用于纯化白蛋白的方法与流程
对相关申请的交叉引用本申请要求2017年3月16日提交的美国临时申请号62/472,007的权益,该美国临时申请以引用的方式整体并入本文。本公开涉及一种用于从血浆中纯化白蛋白的新方法。所述方法包括使血浆与一定量的辛酸钠(nacp)接触,所述量取决于血浆中的总蛋白浓度和nacp与总蛋白的比率;在接近中性的ph值范围内对所述血浆进行巴氏灭菌;以及将白蛋白与非白蛋白相分离。所述方法提供了高收率和纯度的白蛋白溶液。
背景技术:
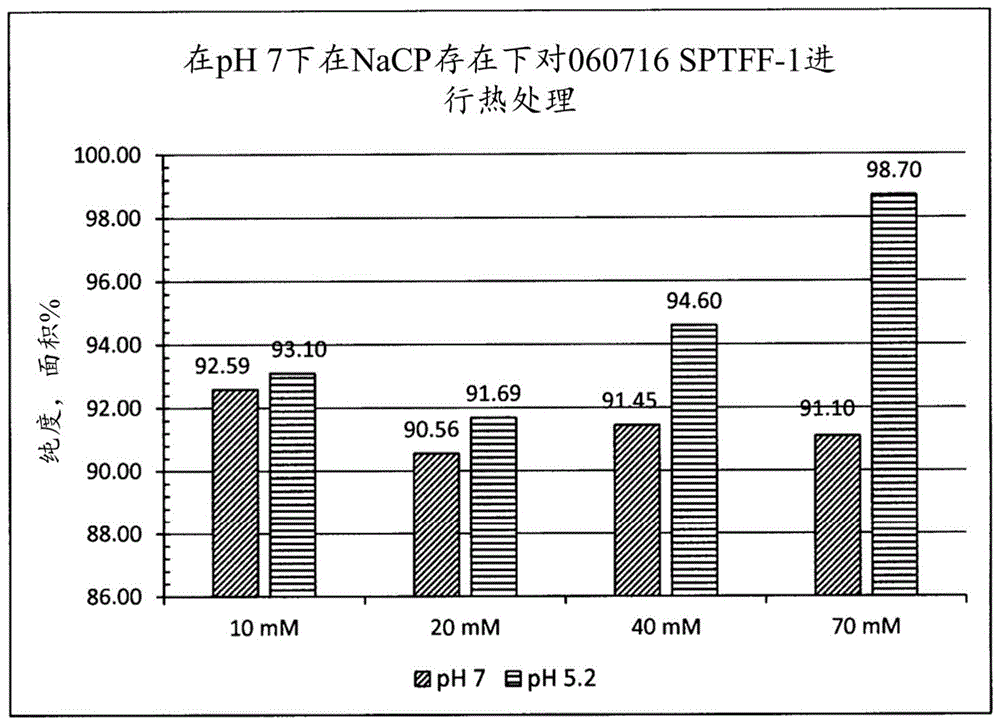
:人类和动物的血液是具有治疗特性的分子的来源。这些分子中有许多是可以在血浆或血清中发现的蛋白质。这些蛋白质已经成为特异性分离的目标,目的在于纯化和标准化用作人类治疗剂的分子。例如,白蛋白、免疫球蛋白g、因子viii和α-1-蛋白酶抑制因子都可以作为分离的治疗产品获得。用于分级分离血浆或血清蛋白的常规上使用的方法之一描述于美国专利号2,390,074中,其公开了一种用于大规模分级分离血浆或血清蛋白的方法,所述方法是通过利用乙醇沉淀并且调节温度、ph值、离子强度和时间以控制某些蛋白质从人类血浆中的沉淀而实现的。所述分级分离方法包括将乙醇逐步添加到血浆原料中以获得几个级分和包含不同富集蛋白质溶液的相应上清液。乙醇沉淀法存在以下缺点:一些蛋白质在乙醇存在下倾向于变性,从而导致待分离的蛋白质的收率降低以及被聚集体污染,在可以获得可接受的治疗产品之前需要去除所述聚集体。此外,沉淀的蛋白质需要再溶解以用于进一步处理,这会产生显著水平的不溶性蛋白质和脂质物质,进而妨碍最终产品的纯化,从而导致收率进一步降低。此外,特别是已经通过各种分级分离方法从血浆中纯化了人血清白蛋白(hsa)。白蛋白是人类血浆中最丰富的蛋白质,占血清蛋白的高达60%。通过遵循药物指南来配制治疗性白蛋白。根据监管指南,所述制剂含有n-乙酰基色氨酸和辛酸盐,继而在60℃±0.5℃进行巴氏灭菌10.5小时±0.5小时以达到病毒灭活的目的。作为稳定剂的这两种试剂的量是基于hsa的量确定的,被设定为每克hsa蛋白0.08mmol±0.016mmol。在巴氏灭菌期间,通过辛酸盐/色氨酸方案的存在来维持hsa的完整性。认为辛酸根离子通过与hsa结合而降低可逆的部分去折叠的速率,从而抑制了导致不可逆沉淀的途径中的一个步骤。faroongsarng和kongprasertkit(2014)观测到在每克hsa0.08mmolnacp存在下,hsa的变性温度从67.23℃升高到72.85℃。白蛋白分离领域中的基本概念和现有技术已经描述于例如美国专利号2,705,230、美国专利号3,992,367、美国专利号4,156,681、美国专利号5,118,794、美国专利号6,022,954和美国专利号6,504,011中。这些文献以引用的方式并入本文。美国专利号6,022,954涉及一种用于从人类或动物生理溶液,如血浆或血浆级分制备纯化的白蛋白的方法。该文献教导了使用阴离子洗涤剂进行脱脂和使用离子交换树脂进行两个色谱分离阶段的方法。脱脂处理由以下步骤组成:在60℃并且在少量作为稳定剂的nacp存在下使来自第一色谱阶段的白蛋白溶液与洗涤剂接触约1小时。巴氏灭菌处理由以下步骤组成:将溶液在超过60℃加热至少10小时。美国专利号5,118,794涉及一种用于在容器中在热处理期间稳定人白蛋白的方法,其包括添加表面活性剂。该文献公开了一种方法,其包括在ph7.0下使用每克白蛋白0.08mmol-0.64mmolnacp的量的少量nacp对溶液进行巴氏灭菌。该文献还公开了在60℃对产品进行最终巴氏灭菌10小时。在美国专利号3,992,367中,白蛋白纯化的方法包括加热步骤,其中溶液由15%至30%的重量,ph值是4.8至5.25的nacp组成。在美国专利号2,705,230中,白蛋白分离包括巴氏灭菌热处理,其在ph8下使用50mm和500mm的nacp进行。美国专利号4,156,681涉及一种用于从血液中提取血清白蛋白的方法,其包括以下步骤:将血浆与血液的固体成分分离;从血浆中分离溶解的非白蛋白成分;以及添加白蛋白稳定剂并且用低级脂族醇处理这样的流体。所述方法包括将少量的nacp添加到大体积的血浆中以进行白蛋白纯化并且在4.5至7.5的ph值下进行热处理。美国专利号6,504,011涉及一种用于纯化重组产生的血清白蛋白的方法,其是通过与阴离子交换吸附剂一起孵育,继而使用疏水性固相并且在水相中使用水溶性脂质阴离子作为解吸剂进行亲和色谱法而实现的。该文献教导了通过色谱法纯化白蛋白而没有巴氏灭菌阶段并且不在洗脱缓冲液中使用nacp来回收白蛋白。先前的报道无助于了解在进行巴氏灭菌以纯化白蛋白期间血浆中的总蛋白浓度与nacp和总蛋白的比率之间的复杂关系。通过本发明公开的方法实现的高收率和纯度提供了使回收的白蛋白的质量和数量达到最大的优势。技术实现要素:本公开描述了一种用于从血浆中纯化白蛋白的改进方法。因此,本公开提供了一种用于从血浆中纯化白蛋白的方法,其包括:(a)使所述血浆与辛酸钠(nacp)接触;其中nacp的量是每克于所述血浆中的总蛋白0.1mmol至5mmol的nacp;(b)将所述血浆在60℃至70℃的温度下加热;以及(c)将白蛋白与非白蛋白相分离。在一个实施方案中,在步骤(a)之前将血浆浓缩到20g/l至150g/l,优选地45g/l至65g/l的总蛋白浓度。在另一个实施方案中,nacp的量是每克总蛋白0.2mmol至3mmol,任选地0.5mmol至2mmol,任选地0.8mmol至1.3mmol的nacp。在另一个实施方案中,所添加的nacp具有20mm至140mm,任选地40mm至100mm,任选地50mm至90mm,任选地60mm至85mm的浓度。在另一个实施方案中,在6.0至8.0,任选地6.5至7.5,任选地6.7至7.3,任选地6.7至6.9的ph值下进行步骤(b)中对血浆的加热。在另一个实施方案中,血浆的电导率小于9ms/cm,任选地小于5ms/cm。在另一个实施方案中,在60℃至70℃,任选地62℃至65℃的温度下进行对血浆的加热,持续0.5小时至24小时,任选地2小时至12小时,任选地3小时至12小时,任选地4小时至6.5小时的时间。在另一个实施方案中,在步骤(c)中将白蛋白与非白蛋白相分离包括使非白蛋白蛋白质和脂质杂质沉淀。在另一个实施方案中,将白蛋白与非白蛋白相分离包括将血浆冷却到低于30℃。在另一个实施方案中,在步骤(c)中过滤血浆,任选地经由在harborlite助滤剂(2%w/v的h900、2%w/v的h1900)存在下使用pallseitzk700p深度过滤器、使用滤盒进行切向流过滤(tff)或进行中空纤维tff,优选地进行中空纤维tff来过滤。在另一个实施方案中,将白蛋白与非白蛋白相分离包括将血浆的ph值调节到4.8至5.4,任选地5.1至5.3。在另一个实施方案中,通过添加酸来进行对血浆的ph值的调节。在另一个实施方案中,所述用于纯化白蛋白的方法可以线性缩放。此外,本公开包括回收的白蛋白溶液,其具有的白蛋白含量为至少90%(w/w)的蛋白质,任选地至少92%(w/w)的蛋白质,任选地至少94%(w/w)的蛋白质,任选地至少96%(w/w)的蛋白质,任选地至少98%(w/w)的蛋白质,任选地至少99%(w/w)的蛋白质。根据以下详细说明,本公开的其它特征和优势将变得显而易见。然而,应当了解的是,虽然详细说明和具体实施例示出了本公开的优选的实施方案,但是所述详细说明和所述具体实施例仅是通过说明的方式给出的,这是因为根据该详细说明,落入本公开的精神和范围内的各种变化方案和改动方案对于本领域技术人员来说将变得显而易见。附图说明现在将关于附图描述本公开,在所述附图中:图1示出了在每一个纯化步骤之后hsa的纯度和回收率的图示。图2示出了受热样品的尺寸排阻色谱图。图3示出了非还原型sds-page凝胶。图4示出了作为巴氏灭菌时间的函数的hsa纯度。图5示出了在每一个巴氏灭菌时间下pas2样品的尺寸排阻色谱图。图6示出了非还原型sds-page凝胶。图7示出了在每一个纯化步骤之后hsa的纯度和回收率的图示。图8示出了在每一个处理步骤之后pas1样品的尺寸排阻色谱图。图9示出了非还原型和还原型sds-page凝胶。图10示出了在每一次处理之后hsa的纯度。图11示出了尺寸排阻色谱图的叠加视图。图12示出了在每一个纯化步骤之后hsa的纯度和回收率的图示。图13示出了在每一个纯化步骤之后样品的尺寸排阻色谱图。图14示出了sds-page凝胶,8%invitrogen凝胶(200v×22分钟)。图15示出了hsa的蛋白质印迹。图16示出了在每一个纯化步骤之后样品的尺寸排阻色谱图。图17示出了样品的尺寸排阻色谱图。图18示出了蛋白质印迹,在非还原条件下的7.5%invitrogen凝胶(200v×22分钟)。图19示出了sds-page凝胶,7.5%invitrogen凝胶(200v×22分钟)。图20示出了根据不同电导率的样品的尺寸排阻色谱图。图21示出了用不同酸调节了ph值的样品的尺寸排阻色谱图。图22示出了根据不同电导率的样品的纯度和回收率图。图23示出了根据用于ph值调节的不同酸的样品的纯度和二聚体形成图。图24示出了还原型sgs-page凝胶。图25示出了根据包括pas3样品的不同样品的样品的纯度、二聚体和聚集体形成图。图26示出了sds-page,7.5%凝胶并且在还原条件下。图27示出了样品的纯度、二聚体和聚集体形成图。图28示出了样品的非还原型和还原型凝胶。图29示出了sechplc叠加视图。图30示出了sechplc叠加视图。图31示出了在sds-page凝胶上回收的hsa的纯度。图32示出了等高线图,图示了在巴氏灭菌期间总蛋白浓度([tp])和nacp与总蛋白的比率对hsa回收率的影响。图33示出了等高线图,图示了在巴氏灭菌期间总蛋白浓度([tp])和nacp与总蛋白的比率对hsa纯度的影响。图34示出了与在巴氏灭菌期间材料中(a)总蛋白浓度([tp])和(b)nacp与总蛋白的比率有关的hsa回收率的标准化效应的帕累托图(paretochart)。图35示出了与在巴氏灭菌期间材料中(a)总蛋白浓度([tp])和(b)nacp与总蛋白的比率有关的hsa纯度的标准化效应的帕累托图。图36示出了hsa回收率和纯度的叠加等高线图,表明了所关注的参数的最佳工作范围;不可行范围以灰色示出。具体实施方式通过在接近中性的ph值下,以取决于血浆中的总蛋白浓度和每克总蛋白的nacp量的浓度使用nacp,继而通过冷却并且降低经过巴氏灭菌的血浆的ph值来分离白蛋白和非白蛋白相以从血浆和部分分级分离的血浆中纯化hsa。所述纯化方法无需使用乙醇或大量的处理步骤即可进行。最终回收的hsa具有高收率和极高的纯度。因此,本公开提供了一种用于从血浆中纯化白蛋白的方法,其包括:(a)使所述血浆与辛酸钠(nacp)接触;其中nacp的量是每克于所述血浆中的总蛋白0.1mmol至5mmol的nacp;(b)将所述血浆在60℃至70℃的温度下加热;以及(c)将白蛋白与非白蛋白相分离。除非另外指明,否则在本部分和其它部分中描述的定义和实施方案意图适用于它们适用的本文所述的本公开的所有实施方案和方面,如本领域技术人员将理解的那样。在理解本公开的范围时,如本文所用的术语“包含”和它的派生词意图是开放式术语,其指定所述特征、要素、组分、组、整数和/或步骤的存在,但是不排除其它未陈述的特征、要素、组分、组、整数和/或步骤的存在。前述内容也适用于具有类似含义的词语,如术语“包括”、“具有”和它们的派生词。如本文所用的术语“由……组成”和它的派生词意图是封闭式术语,其指定所述特征、要素、组分、组、整数和/或步骤的存在,但是排除其它未陈述的特征、要素、组分、组、整数和/或步骤的存在。如本文所用的术语“基本上由……组成”意图指定所述特征、要素、组分、组、整数和/或步骤以及不会实质性影响特征、要素、组分、组、整数和/或步骤的一个或多个基本和新颖特征的那些的存在。除非内容另外明确规定,否则如本文所用的单数形式“a/an(一)”和“所述”包括复数指代对象。在包含“另外的”或“第二”组分的实施方案中,如本文所用的第二组分不同于其它组分或第一组分。“第三”组分不同于其它组分、第一组分和第二组分,并且进一步列举的或“另外的”组分类似地不同。在没有任何相反指示的情况下,在整个本说明书中提到“%”含量时,应当被理解为意指%w/v(重量/体积)。如本文所用的术语“纯化的”和它的派生词意指纯化除去血浆、分级分离的血浆、冷贫血浆、血浆中间体、血浆蛋白溶液或其混合物中存在的其它常见组分。例如,纯化的白蛋白是除去部分分级分离的血浆、冷贫血浆、血浆中间体、血浆蛋白溶液或其混合物中存在的其它蛋白质、核酸、脂质和小代谢物纯化而来。按重量计,纯化的白蛋白是至少60%纯的,任选地至少75%、80%、85%、90%、92%、95%、96%、97%、98%、99%、99.5%、99.9%或甚至100%纯的,而不含血浆、部分分级分离的血浆、冷贫血浆、血浆中间体、血浆蛋白溶液或其混合物中存在的其它蛋白质、核酸、脂质或小代谢物。如本文所用的术语“血浆”和它的派生词包括部分分级分离的血浆、冷贫血浆、血浆中间体、血浆蛋白溶液或其混合物。对于本领域技术人员来说显而易见的是,如何获得部分分级分离的血浆、冷贫血浆、血浆中间体、血浆蛋白溶液或其混合物。例如,部分分级分离的血浆可以通过ek1过滤器(0.45μm-0.65μm)过滤来制备。本公开的方法原则上可以用于纯化任何已知的白蛋白,如源自于人类、非人类灵长类动物、绵羊、山羊、牛科动物、驴、犬科动物、猫科动物、兔、啮齿类动物、仓鼠、豚鼠和禽类的白蛋白。在添加nacp之前可以将血浆中的总蛋白浓缩。可以使用本领域已知的技术进行浓缩,包括添加水或本领域技术人员已知的任何合适的缓冲液。优选地在6.6至7.2的ph值范围,最优选地在6.7至6.9的ph值范围将nacp添加到血浆中。重要的是调节血浆中的总蛋白。特别是,血浆中的总蛋白应当具有20g/l至150g/l的浓度,如至少20g/l、25g/l、30g/l、35g/l、40g/l、45g/l、50g/l、55g/l、60g/l、65g/l或70g/l,并且至多45g/l、50g/l、55g/l、60g/l、65g/l、70g/l、75g/l、80g/l、85g/l、90g/l、95g/l、100g/l、105g/l、110g/l、115g/l、120g/l、125g/l、130g/l、135g/l、140g/l、145g/l或150g/l的浓度。在一个具体的实施方案中,总蛋白具有35g/l至80g/l或45g/l至65g/l的浓度。调节所用的nacp的量是所述方法的一个重要的方面。特别是,nacp的量是每克于血浆中的总蛋白0.1mmol至5mmol的nacp,如至少每克于血浆中的总蛋白0.1mmol、0.2mmol、0.3mmol、0.4mmol、0.5mmol、0.6mmol、0.65mmol、0.66mmol、0.67mmol、0.68mmol、0.69mmol、0.7mmol、0.75mmol、0.8mmol、0.85mmol、0.9mmol、0.95mmol、1mmol、1.1mmol、1.05mmol、1.15mmol、1.2mmol、1.3mmol或1.4mmol的nacp,并且至多每克于血浆中的总蛋白0.9mmol、0.95mmol、1mmol、1.05mmol、1.1mmol、1.15mmol、1.2mmol、1.3mmol、1.4mmol、1.5mmol、1.6mmol、1.8mmol、2mmol、2.5mmol、3mmol、3.5mmol、4mmol或5mmol的nacp。在一个具体的实施方案中,nacp的量是每克于血浆中的总蛋白0.2mmol至3mmol、0.5mmol至2mmol或0.8mmol至1.3mmol的nacp。对于本领域技术人员来说显而易见的是,所述值可以根据重量、摩尔量、包括摩尔浓度的浓度或其组合来转换和表示。在另一个实施方案中,以20mm至140mm的浓度添加nacp,如至少20mm、25mm、30mm、35mm、40mm、45mm、50mm、55mm、60mm、65mm、70mm、80mm或85mm,并且至多65mm、70mm、80mm、85mm、90mm、95mm、100mm、105mm、110mm、115mm、120mm、125mm、130mm、135mm或140mm。在一个具体的实施方案中,nacp具有40mm至100mm、50mm至90mm或60mm至85mm的浓度。在添加nacp之后,对血浆进行热处理或巴氏灭菌。血浆的巴氏灭菌或加热过程是在60℃至70℃的温度下进行的,如至少60℃、61℃、62℃、63℃、64℃、65℃、66℃或67℃,并且至多64℃、65℃、66℃、67℃、68℃、69℃或70℃。在一个具体的实施方案中,血浆的巴氏灭菌或加热过程是在60℃至65℃或62℃至65℃的温度下进行的。对于本领域技术人员来说显而易见的是,如何例如通过使用巴氏灭菌器来调节温度。血浆的巴氏灭菌或加热过程优选地在6.0至8.0的ph值下进行,如至少6.0、6.5、6.6、6.7、6.8、6.9或7.0并且至多6.7、6.7、6.8、6.9、7.0、7.1、7.2、7.3、7.5或8.0。在一个具体的实施方案中,血浆的巴氏灭菌或加热过程在6.5至7.5、6.7至7.3或6.7至6.9的ph值下进行。血浆的电导率也可能是所述方法中的重要因素。在一个实施方案中,电导率小于9ms/cm、8ms/cm、7ms/cm、6ms/cm、5ms/cm、4ms/cm、3ms/cm、2ms/cm或1ms/cm。血浆的电导率可以通过电导率(ec)仪来测量。血浆的巴氏灭菌或加热过程优选地进行0.5小时至24小时,如至少0.5小时、1小时、2小时、3小时、4小时、5小时或6小时,并且至多5小时、6小时、6.5小时、7小时、8小时、9小时、10小时、11小时、12小时、16小时、20小时或24小时。在一个具体的实施方案中,血浆的巴氏灭菌或加热过程进行0.5小时至12小时、2小时至12小时、3小时至12小时或4小时至6.5小时的时间。在一个具体的实施方案中,血浆的巴氏灭菌或加热过程在62℃至65℃的温度下进行4小时至6.5小时的时间。在一个具体的实施方案中,血浆的巴氏灭菌或加热过程在6.7至6.9的ph值下在62℃至65℃的温度下进行至少4小时的时间,其中nacp的量是每克总蛋白0.8mmol至1.3mmol的nacp,其中总蛋白具有45g/l至65g/l的浓度。在步骤(c)中,将白蛋白与血浆中的非白蛋白的蛋白质分离。将白蛋白与非白蛋白相分离包括使非白蛋白的蛋白质和脂质杂质沉淀。在一个具体的实施方案中,将白蛋白与非白蛋白相分离包括将经过巴氏灭菌的血浆冷却到低于30℃。在另一个实施方案中,将白蛋白与非白蛋白相分离包括将血浆的ph值调节到4.8至5.4,如4.8、4.9、5.0、5.1、5.2、5.3或5.4。在一个具体的实施方案中,将白蛋白与非白蛋白相分离包括将ph值调节到4.9至5.3,任选地调节到5.1至5.3。对于本领域技术人员来说将显而易见的是,使用助滤剂进行分离步骤,包括在过滤(即通过过滤将白蛋白与非白蛋白分离)之前将助滤剂,如p1000、p300或其混合物添加到经过巴氏灭菌的血浆中。在一个方面,将白蛋白与非白蛋白分离可以通过深度过滤器、使用滤盒的切向流过滤(tff)或中空纤维tff进行。中空纤维错流过滤器是开放通道装置,其对于与混浊的液体一起使用是理想的并且可以处理高达40%(v/v)的固体浓度。中空纤维过滤器对于粒子/胶体/细胞或粘性的或在浓缩后变粘的液体水平的变化不太敏感。当从过滤器回收产品很重要时(例如疫苗工艺),常常会选择这些过滤器。由于中空纤维过滤器具有畅通且无阻碍的内部流动路径,因此它们对于从过滤器回收产品是理想的。它们可以不同的流动路径几何形状使用(标称纤维直径从0.5mm到1.75mm内径(id),标称纤维长度选项是30cm、60cm或110cm长度)。本领域技术人员将了解的是,中空纤维tff的变化形式可以可选地用于将白蛋白与非白蛋白分离。滤盒最常用于浓缩和渗滤“澄清”低粘度流体。筛网型湍流促进器的使用增强了溶质在膜表面处的去极化,从而增加了样品通量。在相同的工艺条件、孔径和过滤面积下,滤盒可以具有中空纤维过滤器的高达2倍的通量。然而,由于筛网间隔件的“堵塞”/压降,因此滤盒不适用于含有粒子、胶体悬浮液或具有高粘度的溶液。在一个实施方案中,将白蛋白与非白蛋白分离包括通过深度过滤器、使用滤盒的切向流过滤(tff)或中空纤维tff,优选地中空纤维tff进行过滤或澄清。在一个实施方案中,通过深度过滤器、使用滤盒的tff或中空纤维tff将白蛋白与非白蛋白相分离是在4.8至5.4,任选地5.1至5.3的ph值下进行的。在另一个实施方案中,通过过滤或澄清将白蛋白与非白蛋白分离是以每平方米1升/分钟、2升/分钟、3升/分钟、4升/分钟或5升/分钟至6升/分钟、7升/分钟、8升/分钟、9升/分钟或10升/分钟,任选地每平方米1升/分钟至10升/分钟,任选地每平方米2升/分钟至10升/分钟,任选地每平方米3升/分钟至10升/分钟,任选地每平方米8升/分钟至9升/分钟的进料流量进行的。在另一个实施方案中,通过过滤或澄清将白蛋白与非白蛋白分离是以1倍至1.2倍的初始体积减小浓缩率,优选地1.2倍,和3倍至4倍透析体积,优选地4倍透析体积进行的。在一个实施方案中,将白蛋白与非白蛋白分离包括使用中空纤维tff,在4.8至5.4,任选地5.1至5.3的ph值下,以每平方米3升/分钟至10升/分钟,任选地每平方米8升/分钟至9升/分钟的进料流量进行过滤或澄清。在一个具体的实施方案中,将白蛋白与非白蛋白分离包括使用中空纤维tff,在4.8至5.4,任选地5.1至5.3的ph值下,以每平方米3升/分钟至10升/分钟,任选地每平方米8升/分钟至9升/分钟的进料流量,以1倍至1.2倍,任选地1.2倍的初始体积减小浓缩率和3倍至4倍透析体积,任选地4倍透析体积进行过滤或澄清。血浆的ph值的调节可以通过添加酸,如有机酸和/或无机酸来进行。在一个具体的实施方案中,有机酸选自柠檬酸、乙酸和三氟乙酸。在另一个具体的实施方案中,有机酸是乙酸。在另一个实施方案中,无机酸选自盐酸、硫酸和磷酸。可以在harborlite助滤剂(2%w/v的h900、2%w/v的h1900)存在下,通过pallseitzk700p深度过滤器过滤血浆。对于本领域技术人员来说显而易见的是,如何评估所得的白蛋白溶液的纯度。例如,可以进行尺寸排阻色谱-hplc(sec-hplc)或毛细管电泳-sds(ce-sds)分析以评估白蛋白的纯度。所述用于纯化白蛋白的方法从血浆中回收至少40%、50%、60%、70%、75%、80%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%的白蛋白。在另一个实施方案中,所述用于纯化白蛋白的方法可以线性缩放。此外,本公开包括具有至少90%、92%、95%、96%、97%、98%、99%、99.5%或99.9%(w/w)的通过本文公开的方法获得的蛋白质的白蛋白含量的白蛋白溶液。以下非限制性实施例说明了本公开:实施例1材料起始溶液:血浆、部分分级分离的血浆(例如使用科恩分级分离法(cohnfractionation)或膨胀床吸附色谱法去除了igg的血浆)。nacp:辛酸钠,0.6m储备溶液,ph7.5;酸:0.5m-1m储备溶液;p300:p300助滤剂;p1000:p1000助滤剂;naoh:1m储备溶液;水:wfi;ph计:mettlertoledo;深度过滤器:pallk700深度过滤器;和玻璃纤维过滤器:pall(10μm)。在nacp存在下对柱dft+w浓缩物进行巴氏灭菌将柱dft+w浓缩溶液与nacp混合,调节到ph7,然后在60℃加热。将经过加热的溶液冷却到室温,然后使用柠檬酸将ph值调节到5.2。假定总蛋白浓度(060716sptff-2)是约1.1mm。总蛋白浓度是通过使用白蛋白分子量(66,500da)来估计的,这是因为通过sechplc,白蛋白比例是约75面积%,而其它蛋白质比例尚不可清楚地确定,即使杂质大多具有100kda至1,500kda的更高的分子量。将总蛋白浓度(73g/l)除以66,500g/mol,得到1.1mm的值。nacp的测试浓度分别是10mm、20mm、40mm和70mm的nacp。在巴氏灭菌期间稀释了总蛋白和nacp的实际浓度,这是因为用naoh溶液调节了溶液的ph值。在65℃巴氏灭菌4小时之后用柠檬酸将ph值调节到5.2。样品制备汇总于表1中。实验的结果被表示为基于sechplc分析的hsa纯度(表2和表3以及图1和图2)。图2显示在形成脂质体或胶束之后,较高分子量的杂质改变了聚集体的保留时间(13分钟)。在调节ph值之后,脂质的量减少(表4)。还对在65℃巴氏灭菌4小时的样品进行凝胶分析(图3)。表1:在nacp存在下对柱dft+w进行巴氏灭菌的实验设计。表2:nacp/总蛋白比率。表3:hsa的纯度。表4:脂质分析的结果。结论在巴氏灭菌期间nacp的存在从柱dft+w浓缩物中去除了较高分子量的杂质。在对经过巴氏灭菌的样品进行ph值调节之后,脂质浓度降低到低于1/10。增加nacp浓度减少了溶液中的更多脂质。值得注意的是,随着nacp/tp比率增加,hsa的纯度也增加。从70mmnacp(nacp/tp=63.6)获得最好的纯度。在对溶液进行巴氏灭菌之后,纯度从75%增加到91%。将ph值调节到5.2使杂质沉淀并且将纯度提高到超过98.7%。增加nacp量也增加了纯度。实施例2在nacp存在下对柱dft+w浓缩物进行巴氏灭菌——增加的nacp浓度和可变的巴氏灭菌时间使用使在ph值调节之前溶液中nacp的最终浓度是50mm、70mm和90mm三种不同浓度的nacp。然后将溶液调节到ph7,继而在60℃-65℃下进行巴氏灭菌。50mm和90mmnacp条件的巴氏灭菌是持续4小时,然后使用柠檬酸调节ph值。在调节ph值之前在0.5小时、1小时、2小时和4小时将70mmnacp条件等分。假定总蛋白浓度(060716sptff-2)是约1.1mm。对于50mm、70mm和90mm的nacp,nacp/总蛋白的比率分别是45.5、63.6和81.8。样品制备汇总于表5和表6中。实验的结果被表示为基于sechplc分析的hsa纯度(表7以及图4和图5)。表7显示,如果ph值调节停止在更高的ph值,那么可能会发生不完全的沉淀(参见:子编号5:4小时/ph5.4)。图5显示,与ph5.2/4小时巴氏灭菌相比,在更高的ph值(5.4)下,更多的杂质保留。还对样品进行了凝胶分析(图6)。随着nacp的浓度增加,55kda处的条带消失(泳道12)。ph值调节之前和之后的比较显示去除了聚集体和较高分子量的杂质。表5:三种不同的nacp浓度对固定的总蛋白浓度的实验。用柠檬酸调节ph值。表6:nacp/总蛋白比率。表7:巴氏灭菌时间对hsa纯度的影响的结果。结论nacp与总蛋白(tp)的比率显示,当nacp/tp比率增加时,hsa的纯度也增加。从90mmnacp(nacp/tp=81.8)获得最高纯度。回收高纯度hsa的最短巴氏灭菌时间是至少4小时。在巴氏灭菌之后将ph值调节到5.2也增加了纯度。如果ph值调节停止在5.4,那么所得的hsa纯度较低。实施例3nacp与总蛋白的比率——三种nacp浓度对固定的总蛋白浓度使用三种不同浓度的nacp以使在ph值调节之前溶液中nacp的最终浓度是70mm、90mm和110mm。然后将溶液调节到ph7,继而在60℃-65℃下进行巴氏灭菌。在3小时和6小时取等分试样并且使用柠檬酸将ph值调节到5.2。在离心之前,将调节过ph值的样品与p-1000助滤剂(0.7%最终浓度)混合。假定总蛋白浓度(071316sptff-2)是约1.8mm。对于70mm、90mm和110mm的nacp,nacp/总蛋白的比率分别是39、50和61。样品制备汇总于表8和表9中。实验的结果被表示为基于sechplc分析的hsa纯度(表10以及图7和图8)。如表9中所示(还参见图7中的结果),pas1具有70mmnacp,pas2具有90mmnacp并且pas3具有110mmnacp。图9显示,随着nacp的浓度增加,70kda处的条带消失(泳道8和泳道10)。在调节ph值,然后用助滤剂过滤之前与之后之间的比较显示,去除了聚集体和较高分子量的杂质。表8:三种不同的nacp浓度对固定的总蛋白浓度的实验设计。表9:nacp/总蛋白比率。表10:hsa的纯度。结论随着nacp与总蛋白(tp)的比率增加,hsa的纯度增加。从110mmnacp(nacp/tp比率:61)获得最高纯度。在对溶液进行巴氏灭菌之后,hsa纯度从77%-78%增加到94%。通过在巴氏灭菌之后将ph值调节到5.2,hsa纯度被证实超过98%。巴氏灭菌可以快速地在3小时内完成。添加助滤剂也提高了纯度。实施例4在巴氏灭菌期间两种不同的ph值制备含有90mmnacp的两份溶液。然后将溶液调节到ph7和7.3,继而在60℃-65℃下进行巴氏灭菌热处理。在6.5小时之后停止巴氏灭菌,收集样品,然后使用柠檬酸调节到ph5.2。收集一部分调节过ph值的样品,将其余样品离心并且收集上清液,然后调节到7。在每一个阶段之后,即在巴氏灭菌、第一次将ph值调节到5.2和第二次将ph值调节到7之后,评估hsa的纯度。对于这两个样品,nacp/tp比率均是50。样品制备汇总于表11中。实验的结果被表示为基于sechplc分析的hsa纯度(表12以及图10和图11)。考虑到溶液稀释因子,计算了hsa的回收率。样品说明072016pas1在巴氏灭菌期间90mmnacp,ph7072016pas2在巴氏灭菌期间90mmnacp,ph7.3表11:实验设计。样品6.5小时在ph5.2后在ph7后回收率072016pas195.0997.8597.29103072016pas294.0298.1397.21103表12:基于sechplc分析的hsa纯度(面积%)。结论在巴氏灭菌期间更高的ph值产生略微更高的hsa纯度。然而,当将经过离心的溶液的上清液的ph值调节回到7时,纯度下降。hsa的回收率是100%。发现长达6.5小时的巴氏灭菌时间没有造成纯度下降。实施例5三种不同的总蛋白浓度和四种不同的nacp/tp比率如表13中所示制备六种溶液。将起始溶液稀释到一半和四分之一,以使得测试总蛋白浓度是120mg/ml、60mg/ml和30mg/ml。基于总蛋白确定nacp的浓度并且实验设计示于表13中。所述实验被设计用于研究总蛋白浓度和nacp/tp比率对hsa回收率的影响。表13:实验设计。在4小时之后停止巴氏灭菌并且使用柠檬酸将ph值调节到5.2。将调节了ph值的样品离心以进行分析。实验的结果被表示为基于sechplc分析的hsa纯度(表14以及图12和图13)。在图12中,在x轴上,pas#后的数字是nacp/tp比率。pas1是以120mg/ml总蛋白测试的,pas2-pas5是以60mg/ml总蛋白测试的并且pas6是以30mg/ml总蛋白测试的。在图13中,样品在不同的nacp浓度下具有60mg/ml的总蛋白。pas2具有80mmnacp,pas3具有67.5mmnacp,pas4具有55mmnacp并且pas5具有40mmnacp。对样品进行凝胶分析(图14)。通过蛋白质印迹法确认hsa的存在(图15)。考虑到稀释因子,计算了hsa的回收率。表14:基于sechplc分析的hsa纯度(面积%)。结论最好的结果来自60mg/mltp和60至75的nacp/tp比率。当tp浓度是120mg/ml时,纯度和回收率降低。在60mg/mltp下,更高的nacp/tp比率(89)产生不佳的纯度、不佳的回收率和更多的二聚体。更低的nacp/tp比率(44)产生不佳的纯度,但是hsa回收率是100%。在30mg/mltp下,纯度高,但是回收率不佳。这表明不足量的nacp可能无法通过沉淀去除聚集体。此外,过量的nacp可能造成更多的二聚体形成。实施例6两种不同的总蛋白浓度和两种不同的调节ph值的酸如表15中制备四种溶液。将起始溶液稀释到60mg/ml和80mg/ml。基于总蛋白量和72的nacp/tp比率来确定nacp的浓度。所述实验测试了对于hsa回收率,总蛋白浓度、处理体积的影响、在巴氏灭菌后调节ph值的酸类型的影响。表15:实验设计。在4小时之后停止巴氏灭菌并且使用柠檬酸或磷酸将溶液的ph值调节到5.2。将调节过ph值的样品与助滤剂(p-1000)混合。将分析样品离心,并且经由深度过滤器过滤100ml规模样品的本体并且经由玻璃纤维过滤器过滤10ml规模样品的本体。在添加p-1000之后,100ml规模样品变成131ml。将混合物经过预湿的k700(60mm,安装在pendotech过滤容器上,用wfi预湿,膜滞留体积8ml)过滤。在施加10psi的压力之后收集滤液,直到收集到80ml滤液为止,然后对于其余体积,施加35psi的压力。通过16ml的30mm柠檬酸钠(ph5.2)追击过滤器。将10ml规模样品加到预湿的玻璃纤维过滤器(用wfi)上。在加入8ml样品之后进行每一次过滤。不进行追击。深度过滤和玻璃纤维过滤均产生了澄清溶液。实验的结果被表示为基于sechplc分析的hsa纯度(表16以及图16和图17)。pas#-1是在将ph值调节到5.2之前的样品(图16)。图16中的插图是样品的色谱图比较:pas#-2表示将ph值调节到5.2,而pas#-3表示添加p1000。pas2样品来自60mg/mltp和65mmnacp(nacp/tp=72),其已经用柠檬酸处理。pas3样品来自80mg/mltp和87mmnacp(nacp/tp=72),其已经用柠檬酸处理。pas4样品来自80mg/mltp和87mmnacp(nacp/tp=72),其已经用磷酸处理。pas#-3样品已经通过添加p1000,继而离心进行处理(图17)。pas1-3过滤样品已经通过添加p1000,继而过滤进行处理。考虑到溶液稀释因子,计算了hsa的回收率。还通过sds-page凝胶和蛋白质印迹分析了所得溶液以寻找hsa相关蛋白质,如二聚体和低聚物。如在图18的蛋白质印迹中所见,存在从标准品中看不到的条带。凝胶示于图19中。表16:基于sechplc分析的hsa纯度(面积%)。结论在本实施例中,nacp/tp比率固定为72,其介于60与75之间。pas1是pas2的10倍放大,并且该10倍放大显示在纯度和回收率方面没有差异。60mg/mltp(pas1和pas2)和80mg/mltp(pas3和pas4)都能很好地起作用,因此tp浓度范围可以被设定为60mg/mltp-80mg/mltp。有机酸(pas3)和无机酸(pas4)都能起到调节ph值的作用而不会牺牲产品的完整性。添加助滤剂(p1000)对产品完整性没有影响。除了放大样品(由于过滤器的追击不完全)之外,hsa回收率接近100%。实施例7电导率的影响、酸的影响和助滤剂的量如表17中制备溶液。将起始溶液稀释到60mg/ml和80mg/ml。基于总蛋白的量确定nacp的浓度并且将nacp/tp比率调节到72。所述实验测试了对于hsa的滤过率、回收率和纯度,在巴氏灭菌期间盐浓度(电导率)的影响、酸类型的影响以及助滤剂的影响。表17:巴氏灭菌的实验设计。制备样品以测试2ms/cm、5ms/cm、10ms/cm、20ms/cm和50ms/cm的电导率的影响。在不知道电导率的情况下,添加盐溶液以产生电导率。溶液的最终电导率是5ms/cm、9ms/cm、14ms/cm、27ms/cm和47ms/cm(pas1至pas5)。在4小时之后停止巴氏灭菌并且使用柠檬酸将ph值调节到5.2。将调节过ph值的样品与p-1000混合达到1%的最终浓度。将分析样品离心,并且经由深度过滤器过滤本体。从pas6制备5个10ml等分试样。使用盐酸、硫酸、乙酸和三氟乙酸将每一个等分试样的ph值调节到5.2,并且用柠檬酸调节剩余体积(pas6至pas10)。将每一个调节过ph值的等分试样与p1000混合达到1%的最终浓度。将分析样品离心,并且经由深度过滤器过滤本体。从pas10制备4个10ml等分试样。如表18中所述,将每一个等分试样与助滤剂混合。将分析样品离心,并且经由深度过滤器过滤本体。表18:用于测试ph值调节和助滤剂的量的影响的实验设计。为了进行过滤,将溶液加到预湿的k700(用wfi预湿45mm圆盘并且安装在过滤器支架上;有效过滤面积是由35mm得出的9.6cm2)上。将溶液填充在带有压力计的20ml注射器中。实验的结果被表示为基于sechplc分析的hsa纯度(表19以及图20、图21、图22和图23)。图24显示了在不同酸处理之后的蛋白质谱,酸处理过的样品在泳道6至泳道10中。考虑到溶液稀释因子,计算了hsa的回收率。表19:基于sechplc分析的hsa纯度(面积%)。结论在本实施例中使用的nacp/tp比率是72。随着电导率增加,二聚体形成增加并且hsa单体比例减少。无机酸和有机酸都能很好地起作用以使nacp沉淀和杂质的共沉淀。发现酸类型影响分离的hsa的纯度;当酸是强酸时,会发生更多的二聚体形成。发现二聚体形成按照三氟乙酸(tfa)>盐酸>硫酸>柠檬酸>乙酸的顺序。因此,通过乙酸调节ph值引起最少量的二聚体形成。一旦酸沉淀完成,助滤剂的量就既不会增加,也不会降低纯度和二聚体形成。实施例8在nacp存在下对血浆进行巴氏灭菌——从ek1滤液制备在nacp存在下在60℃下对浓缩溶液进行巴氏灭菌之后,从柱dft+w浓缩物中纯化hsa是成功的。在此,我们进行了研究以观察使用上游样品是否可以实现相同的成功。将柱aft+w经过ek1过滤器过滤,这是血浆分级分离的第一柱分级分离步骤。浓缩ek1滤液(082316ilc)。在相同的孵育时间和相同的温度下,对ek1滤液浓缩物与柱dft+w浓缩物并行地进行部分巴氏灭菌。向浓缩的ek1中添加nacp溶液(0.6m)达到104mm的最终浓度,继而将ph值调节到7,然后在64℃下将样品加热4小时。通过sechplc和sds-page凝胶分析样品。ph5.2溶液的上清液显示hsa的纯度是98.7%并且不可检测到较高分子量的蛋白质。用1m乙酸处理巴氏灭菌后的样品以将ph值降低到5.2。通过sec色谱法分析样品并且在叠加视图中绘制(表20和表21以及图25)。在图25中,pas1和pas2来自柱dft+w样品并且pas3来自ek1样品。pas#-1是巴氏灭菌后的样品,pas#-2是ph5.2后的样品,并且pas#-3是添加助滤剂后的样品。标记为“a”的区域指示从其它两个样品中没有观测到的杂质。还进行了sds-page凝胶分析(图26)。表20:巴氏灭菌的实验设计。表21:巴氏灭菌后的样品说明。结论本实施例表明hsa可以从柱a纯化的血浆级分中纯化。因此,从柱cft+w中回收高纯的hsa可能是可行的,这是柱a步骤与柱d步骤之间的中间级分阶段。实施例9在nacp存在下对血浆进行巴氏灭菌——从柱cft+w制备柱cft+w是血浆分级分离的第二柱分级分离步骤。在此,浓缩柱cft+w池(colcft+w)(091916ilc)。在带夹套的玻璃烧杯中,以300ml规模对柱cft+w浓缩物进行部分巴氏灭菌。向浓缩的柱cft+w(71mg/ml)中添加nacp溶液(0.6m)达到74mm的最终浓度,继而将ph值调节到7,然后在64℃下加热4小时。用1m乙酸处理巴氏灭菌后的样品以将ph值降低到5.2,然后降低到5.1。在添加助滤剂(2%p1000和1%p300)之后,经过k700深度过滤器过滤混合物。通过sechplc和sds-page凝胶分析样品。样品说明和sec色谱分析结果的叠加视图列于表22和图27中。sds-page凝胶分析示于图28中。表22:样品说明和分析结果。结论如本实施例中所示,可以从柱c纯化的血浆级分中纯化hsa。巴氏灭菌后的样品的ph值可以低到ph5.1而不会影响样品的纯度。即使在300ml规模下,这种巴氏灭菌方法仍然可以提供>99%纯的hsa。pas1-4a中滤液中的绿色指示该特定样品的进一步下游处理将涉及额外的纯化步骤。实施例10在nacp存在下对血浆进行巴氏灭菌——从冷贫血浆制备冷贫血浆是在fda批准的收集设施处收集的。在相同的孵育时间和相同的温度下,对解冻的血浆与柱cft+w浓缩物并行地进行部分巴氏灭菌。将nacp溶液(0.6m)添加到冷贫血浆中达到80mm的最终浓度,继而将ph值调节到7,然后在64℃下加热4小时。用1m乙酸处理巴氏灭菌后的样品以将ph值降低到5.1。将柱cft+w浓缩物与80mm至120mm(76至114的nacp/tp比率)混合,然后进行巴氏灭菌。通过sechplc分析样品并且在叠加视图中绘制(表23和图29)。如表23中所示,091916ilc和092316ilc来自柱cft+w。ilc的浓度是53mg/ml,并且血浆总蛋白浓度被估计为60mg/ml。添加助滤剂减少了溶液中二聚体的比例(参见图29)。在过多的nacp存在下进行巴氏灭菌引起更多的二聚体形成。用缓冲液和水稀释样品对纯度没有影响。表23:样品说明。结论本实施例表明可以从冷贫血浆中纯化hsa。在过滤之前添加助滤剂可以减少二聚体比例。用缓冲液和水稀释起始材料对纯度没有影响。发现在巴氏灭菌步骤中添加过多的nacp会引起二聚体形成增加。因此,小于95的nacp/tp比率是理想的。实施例11在nacp和n-乙酰色氨酸存在下进行巴氏灭菌期间的ph值评价了在巴氏灭菌期间样品的ph值。还评价了在除了nacp之外还存在n-乙酰色氨酸(nacw)的情况下进行的巴氏灭菌。研究了7、6.8和6.6的ph值。将等量的nacp和nacw添加到柱cft+w浓缩物的巴氏灭菌样品中,如表24中所述。nacp的量添加得较少以使得可以区分ph值和添加nacw的影响。通过sechplc分析样品并且在叠加视图中绘制(表24和表25以及图30)。如图30中所示的所得纯度的总结汇总于表25中。表24:样品说明。092316ilc来自colcft+w。*表示nacp和nacw与总蛋白的比率。样品聚集体的比例has的纯度100716pas1-22.1797.12100716pas2-20.6199.02100716pas3-20.6298.99100716pas4-25.6793.51表25:来自sechplc分析的聚集体的比例和hsa的纯度。结论用于巴氏灭菌的优化的ph值是6.6至6.8。不建议在巴氏灭菌步骤中添加nacw,这是因为即使在ph5.1下也无法完全去除聚集体。实施例12如上述实施例中所示,通过纯化方法使白蛋白的回收率和纯度达到最大,所述纯化方法包括在规定血浆中的总蛋白浓度和每克总蛋白nacp的毫摩尔数的条件下进行巴氏灭菌。在所公开的方法下,在接近中性的ph值下通过过量的辛酸根离子的存在来使白蛋白稳定,并且使杂质选择性地沉淀。在热沉淀期间重要的参数是总蛋白浓度和每克总蛋白nacp的毫摩尔数以及时间、温度、nacp浓度、电导率和ph值。关键的质量属性被定义为收率、纯度和单体百分比。在本实施例中,将部分纯化的人类血浆用nacp处理并且加热到60℃-65℃,持续超过4小时。这引起许多非目标蛋白降解,而hsa保持稳定。当随后将材料调节到ph5.2时,非hsa蛋白质和脂质杂质沉淀并且经由深度过滤从产品流中去除沉淀物。在本实施例中,将部分纯化的人类血浆浓缩到45g/l-65g/l的目标总蛋白浓度并且在接近中性的ph值下将所得的材料用nacp(0.6m的储备溶液,ph7.50)处理到每克总蛋白0.8mmol-1.2mmolnacp的目标量。将材料在60℃-65℃下孵育至少4小时。将材料冷却到室温(<30℃),用1m乙酸储备溶液调节到ph5.2,并且在harborlite助滤剂(2%w/vh900、2%w/vh1900)存在下经由pallseitzk700p深度过滤器过滤。所收集的流过材料是高收率、高纯的白蛋白溶液,其具有低的聚集体比例。实施例13通过过滤或澄清将白蛋白与非白蛋白相分离可以通过深度过滤或使用滤盒的tff并且优选地通过中空纤维tff来进行。在ph5.1至5.3下提高了在使用中空纤维tff时过滤或澄清期间的回收率。优选的孔径、入口压力和透析体积值示于表26a和表26b中。对于中空纤维tff,优选的孔径是0.1μm,进料流量是每平方米8升/分钟-9升/分钟。本领域技术人员将了解的是,可以使用每平方米1升/分钟至每平方米10升/分钟的进料流量将白蛋白与非白蛋白分离。当使用中空纤维tff时初始体积减小浓缩率是1倍至1.2倍,优选地是1.2倍,并且透析体积是3倍至4倍透析体积,优选地是4倍透析体积。如本发明公开的方法所述的巴氏灭菌和过滤/澄清之前和之后杂质的代表性相对浓度示于表27中。图31显示了来自研究hsa20的在巴氏灭菌和使用中空纤维tff过滤/澄清后回收的hsa的纯度。表26a:巴氏灭菌和过滤/澄清的参数。表26b:过滤/澄清的参数。在巴氏灭菌和过滤/澄清之后hsa的回收率和纯度。表27:在巴氏灭菌和随后通过使用滤盒的tff过滤/澄清之前和之后充分表征的基线批次的杂质。本发明公开的方法表明了特别重要的参数是在巴氏灭菌期间血浆中的总蛋白浓度和nacp与总蛋白的比率。这两个参数之间的关系以及方法步骤中的hsa回收率和纯度分别示于图32和图33中。实验分析表明,hsa的回收率与在巴氏灭菌期间血浆中每克总蛋白的nacp的量(即nacp与总蛋白的比率)有关(参见图34)。已经确定hsa纯度显著取决于在巴氏灭菌期间总蛋白浓度以及总蛋白浓度与nacp与总蛋白的比率之间的复杂关系(参见图35)。当将图32和图33中描绘的等高线图趋势合并成叠加的等高线图时,这两个参数(即在巴氏灭菌期间血浆的总蛋白浓度和nacp与血浆中的总蛋白的比率)的最佳工作范围变得显而易见以使hsa回收率和纯度达到最大(参见图36)。在该范围的下半部分内(即在45g/l-65g/l的总蛋白浓度和每克总蛋白0.8mmol-1.2mmolnacp的量下)工作会产生最大的hsa回收率和纯度,同时理想地提高过滤性能。虽然已经参考目前所认为的优选的实施例对本公开进行了描述,但应当了解的是,本公开不限于所公开的实施例。相反,本公开意图涵盖被包括在所附权利要求的精神和范围内的各种改动方案和等同布置。所有出版物、专利和专利申请都以引用的方式整体并入本文,该引用的程度就如同每一篇单独的出版物、专利或专利申请均被具体地和单独地表明以引用的方式整体并入本文一样。参考文献faroongsarngd,kongprasertkitj.2014.theroleofcaprylateligandiononthestabilizationofhumanserumalbumin(辛酸根配体离子对稳定人血清白蛋白的作用),aapspharmscitech.14(2):465-471。美国专利号2,390,074a,12/1945,cohn。美国专利号2,705,230a,3/1955,reid。美国专利号3,992,367a,11/1976,plan等。美国专利号4,156,681a,5/1979,schneider等。美国专利号5,118,794a,6/1992,grangeorge等。美国专利号6,022,954a,2/2000,dernis等。美国专利号6,504,011b1,1/2003vanderlaken等。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1