自身抗体的定量方法与流程
本公开涉及一种自身抗体的定量方法。
背景技术:
在生物体中,免疫耐受性是在生理状态下建立的,从而不会引起对自身成分(诸如自身正常细胞或组织等)的过度反应。然而,如果由于某种原因导致免疫耐受性崩溃,则免疫系统无法将自身成分与非自身成分区分开,并产生自身抗体,该自身抗体是针对自身成分的抗体。自身抗体与导致特定器官病症或全身性病症的自身免疫性疾病有关。因此,在特定疾病中频繁出现的自身抗体被认为在实施自身免疫性疾病的诊断中具有重要意义。还已知自身抗体伴随某些癌症。因此,提出了其临床实用性,诸如将其用作癌症的早期诊断的癌症标志物。
通常,在定量生物样品中包含的测试物时,采用称为高纯度标准物质的试剂。根据一般实践,制备一些含有不同已知量的这种标准物质的标准样品。然后,基于指示从这些标准样品获得的信号强度的测量值与分别包含在其中的标准物质的量之间的关系的校准曲线,根据使用实际生物样品作为测试样本时获得的测量值来定量各个生物样品中包含的测试物的量。
例如,报道了一种方法,其中将从患者样本中纯化的自身抗体用作自身抗体定量中的标准物质(参见参考文献1(j.sheldon等人,“strategiesforbuildingreferencestandardsofautoantibodies”,《免疫学前沿》,第6卷,第194条))。该方法采用生物样品中包含的经纯化自身抗体。然而,自身抗体纯化需要有高技术含量的复杂的技术,因此麻烦且昂贵。此外,为了获得所需量的自身抗体作为标准物质,需要大量的患者样本。包括如上所述的情况在内,在自身抗体的定量中,难以购买/获得高纯度的标准物质,并且也难以准确地定量生物样品中包含的自身抗体。特别地,近年来,需要对多种自身抗体量进行多重同时分析。然而,如上所述,由于难以纯化多种自身抗体并将其作为标准物质提供,因此据信利用参考文献1中公开的经纯化自身抗体的方法不适合用于多重同时分析。
此外,参考文献1还公开了使用患者的血样本身作为标准物质的替代物的方法。参考文献1中公开的该方法的优点在于,其不需要像纯化那样麻烦的技术来利用患者的血样,并且其允许容易且廉价地制备标准物质替代物。然而,由于标准物质替代物中所包含的自身抗体的绝对量是未知的,所以由于不能基于绝对量进行评价,该方法仅包括半定量。此外,如果患者样品的批次改变,则这可能导致测定值变化。因此,为了补偿这种批次间差异,该方法需要包括例如浓度调节的单独操作,以便能够在批次改变时获得相同的信号。这是上述方法的另一个问题。
此外,为了测定自身抗体,还报道了一种测定多种自身抗体的方法,该方法允许使用称为“luminex”(注册商标)的技术对少量样品进行多重分析,其中将与测试物结合的物质分别固定至微珠上,该微珠用多种浓度的两种颜色的荧光染料混合染色(参见参考文献2(v.doseeva等人,“performanceofamultiplexeddualanalyteimmunoassayfortheearlydetectionofnon-smallcelllungcancer”,《转化医学杂志》,13:55,(2015))。鉴于制备多种自身抗体纯化产物作为标准物质的困难,参考文献2所公开的方法中,不产生校准曲线;取而代之的是,基于从实际测定值中减去盲测试值获得的值,影响了作为测试物的自身抗体的测定。因此,该方法提供的优点为不需要这种麻烦的自身抗体纯化技术、校准曲线的制备等,并且可以容易且廉价地进行测定。然而,与参考文献1中公开的使用血样本身作为标准物质替代物的方法一样,由于自身抗体的绝对量未知,上述方法也存在仅是半定量的问题。此外,由于在测定中使用的试剂的滴定度的测定值之间存在离散,因此可以预见,随着测定试剂的批次变化,测定值会发生变化。因此,该方法存在另一个问题,即需要严格控制测定试剂并且难以获得稳定的测定值。
此外,也可以基于对固定在固相上的抗原的竞争性抑制来测定自身抗体。通常,在这种情况下,需要采用高度纯化的抗原作为抗原并将其固定在固相上。相反,据报道,如果捕获抗原的抗体(捕获抗体)被固定在固相表面上,则即使在粗抗原(诸如器官提取物形式的低纯度抗原)的情况下,抗原分子也可以选择性地存在于固相表面上(参见参考文献3(日本专利第2675676号))。这样,参考文献3描述了即使当采用低纯度抗原时也可以测定患者样品中包含的自身抗体。然而,在测定自身抗体的绝对量方面仍有改进的余地。
如上所述,惯例尚未报道在测定生物样品中的自身抗体量方面具有准备性和定量性的任何方法。惯例仅将重点放在准备性和定量性中的任一个上来进行测定。此外,近年来,需要设计一种技术,该技术实现能够同时确定多种自身抗体的量的多重同时分析。
技术实现要素:
因此,需要一种不易受上述缺点影响的自身抗体的定量方法。
根据本发明的一个方面,提供了一种自身抗体定量方法,其包括以下步骤:
使含有作为测试物的所述自身抗体的生物样品与已知量的竞争抗体竞争同抗原发生反应,所述抗原被所述自身抗体特异性识别并与之结合,所述竞争抗体与所述自身抗体竞争与所述抗原结合;
使与所述抗原结合的所述自身抗体与检测抗体反应,所述检测抗体识别所述自身抗体并与之结合,但不识别所述竞争抗体;
测量源自与所述自身抗体结合的所述检测抗体的信号;以及
通过利用所述竞争抗体的量作为自身抗体的指标来计算所述生物样品中包含的所述自身抗体的量,所述竞争抗体的量使得源自不存在所述竞争抗体情况下与所述自身抗体结合的所述检测抗体的信号减少50%。
附图说明
通过参考附图考虑以下详细描述,本公开的前述和附加特性和特征将变得更加明显,其中:
图1为显示与本公开相关的自身抗体定量方法的原理的一种模式的图,其显示了利用固相技术的模式。
图2为显示与本公开有关的自身抗体定量方法中ic50值计算的一种模式的图。
图3为显示实施例3的结果的图,其中考虑了竞争抗体和检测抗体之间的交叉反应性。
图4为显示实施例4的结果的图,其中使用根据本公开的自身抗体定量方法对抗人angptl抗体的量进行测定,其显示了使用兔源抗人igg抗体作为检测抗体的结果。
图5为显示实施例4的结果的图,其中使用根据本公开的自身抗体定量方法对抗人angptl抗体的量进行测定,其显示了使用绵羊源抗人igg抗体作为检测抗体的结果。
图6为显示实施例4的结果的图,其中使用根据本公开的自身抗体定量方法对抗人angptl抗体的量进行测定,其显示了使用山羊源抗人igg抗体作为检测抗体的结果。
具体实施方式
将参照附图解释根据本文公开的实施方式的自身抗体的定量方法。
根据本公开的自身抗体的定量方法被配置为以绝对值的形式测定生物样品中作为测试物的自身抗体的量(浓度)。在测定中,该方法利用与自身抗体竞争结合抗原的抗体(下文有时可称为“竞争抗体”),该抗原被自身抗体特异性识别并与之结合。将各种已知量(浓度)的竞争抗体加入至生物样品中,用于与自身抗体竞争与抗原结合的反应(下文有时可称为“竞争性反应”)。其中,与抗原结合的自身抗体随着加入的竞争抗体的量的增加而减少。其随着竞争抗体的量的减少而增加。该方法基于自身抗体相对于抗原的结合率的降低和所加入的竞争抗体的量来计算生物样品中包含的自身抗体的量。竞争抗体的存在降低了自身抗体和抗原的结合率。通过对比结合率的降低率和竞争抗体的量来计算自身抗体的量。
在根据本公开的自身抗体的定量方法中,作为测试物的自身抗体没有特别限制,但可以为将生物体中的自身组成成分识别为“抗原”(自身抗原)的任何抗体。因此,其可以为对一个特定器官具有特异性的自身抗体,该特定器官的抗原限于这种器官,或者也可以为广泛分布于生物体内的抗原,诸如非器官特异性自身抗体,例如作为自身抗原作用于细胞的核组分的抗核抗体。例如,已知一种自身免疫性疾病,其中由于免疫耐受性的崩溃而产生针对特定身体组成成分的自身抗体,从而导致特定的病理状况。引起特定病理状况的自身抗体可优选用作待定量的测试物。测试物的其它优选但非限制性示例包括自身抗体,该自身抗体对作为抗原的蛋白质起作用,该抗原在特定病理状态(诸如癌症)中特异性表达,从而充当癌症标志物或在特定病理状态(诸如癌症)中过表达的蛋白质等。例如,可以引用在癌细胞中特异性或过度产生的蛋白质的自身抗体。此外,已知在癌症调控基因中发生异常时,会产生癌症,该异常与基因修复、细胞周期的控制相关,因此与编码该癌症调控基因的蛋白质的突变和最终的功能障碍相关。已知在上述方法中,产生了这种突变蛋白的自身抗体。这种自身抗体是测试物的另一优选示例。
自身抗体可以为与自身免疫性疾病有关的自身抗体。作为其示例,可以引用抗核抗体,包括抗dsdna抗体、抗ssdna抗体、抗组蛋白抗体、抗rna抗体、抗rnp抗体、抗sm抗体、抗ss-a抗体、抗ss-b抗体、抗scl-70抗体、抗pcna抗体、抗核糖体抗体、抗线粒体抗体、抗着丝粒抗体、抗igg抗体(诸如类风湿因子)、抗甲状腺球蛋白抗体、抗甲状腺过氧化物酶抗体、抗微粒体抗体、抗乙酰胆碱受体抗体、抗红细胞抗体、抗血小板自身抗体、抗肾小球基底膜抗体、抗胰岛抗体、抗肾上腺皮质细胞抗体、抗胃壁细胞抗体等。但是,自身抗体不限于这些。
此外,自身抗体可以为与癌症有关的自身抗体。例如,其可以为基因突变诱导癌变的蛋白质的肿瘤相关抗原(taa)的自身抗体,诸如在癌细胞中特异性表达的蛋白质、在癌细胞中过表达的蛋白质、抑制癌的蛋白质等。作为其一些非限制性示例,ny-es0-1、c-myc、her2、cea、muc1、psma、survivin、livin、egfr、ca19.9、pai-1、mdm2、细胞周期蛋白b1、imp1、koc、npm1、p53、p16等。此外,自身抗体可以为与维持代谢系统的生物功能、血管生成等相关的蛋白质的自身抗体。例如,angptl的自身抗体,诸如血管生成素样蛋白3(下文中也可简称为“angptl3”)。然而,自身抗体不限于上述抗体。
自身抗体的来源也没有特别限制。作为其示例,可以引用动物,诸如人、非人灵长类动物、兔、大鼠、豚鼠、小鼠、狗、猫、马、牛、猪、绵羊、山羊、家禽,但特别优选人。因此,根据本公开的自身抗体的定量方法优选采用人类来源的生物样品中包含的自身抗体作为测试物。
在根据本公开的自身抗体的定量方法中,含有作为测试物的自身抗体的生物样品没有特别限制,但可以为任何这样的样品,即其可以含有自身抗体作为进行定量的测试物。作为其的一些非限制性示例,可以引用源自生物体的体液,诸如血液、血浆、血清、脑脊髓液、羊水、奶、汗液、尿液、唾液、痰、粪便、组织、来自动物的细胞培养物等。特别优选的示例为人类来源的生物样品,更优选地,从受影响或可能受影响的患者取样的患者样本。如果需要,可以对这种生物样品进行初步处理,诸如分离、纯化、浓缩等。因此,生物样品可以包含从生物体取样的体液,如果需要,加入其它组分,诸如稀释剂、防腐剂、稳定剂、缓冲剂等。
本公开的自身抗体定量方法优选包括以下步骤。
(i)使含有作为测试物的自身抗体的生物样品与已知量的竞争抗体竞争同抗原发生反应,该抗原被自身抗体特异性识别并与之结合,该竞争抗体与自身抗体竞争与抗原结合(与竞争抗体反应的步骤);
(ii)使与抗原结合的自身抗体与检测抗体反应,该检测抗体识别自身抗体并与之结合,但不识别竞争抗体(与检测抗体反应的步骤);
(iii)测量源自与自身抗体结合的检测抗体的信号(测量源自检测抗体的信号的步骤);以及
(iv)通过利用竞争抗体的量作为自身抗体的指标来计算生物样品中包含的自身抗体的量,该竞争抗体的量使得源自不存在竞争抗体情况下与自身抗体结合的检测抗体的信号减少50%(计算自身抗体量的步骤)。
接下来,将详细描述上述各个步骤(i)至(iv)。然而,应当理解,本公开的自身抗体定量方法不限于此,而是在适当或需要时可以进行各种修改。
(i)与竞争抗体反应的步骤:
在本公开的自身抗体定量方法中,在步骤(i)中,含有作为测试物的自身抗体的生物样品与已知量的竞争抗体竞争同抗原发生反应,该抗原被自身抗体特异性识别并与之结合,该竞争抗体与自身抗体竞争与抗原结合。由此,自身抗体和竞争抗体与抗原竞争性结合。
根据作为测试物的自身抗体的种类,可以适当地选择用于本公开的自身抗体定量方法的抗原。可以使用能够与自身抗体特异性结合的任何物质作为测试物以形成抗原-抗体复合物(免疫复合物)。优选地,抗原为含有表位的物质,该表位的结构与作为测试物的自身抗体的可变区或超可变区的互补决定区互补。例如,蛋白质、多肽、肽模拟物、肽核酸、多糖、糖蛋白等可以为抗原。抗原可以为从生物样品中分离和纯化的抗原,或通过基因重组技术或化学合成技术制备的抗原,或甚至可以为市售产品。例如,如果抗原的序列信息是已知的,可以通过将基于这种序列信息合成的dna片段掺入合适的载体中来制备表达载体。然后,使用该表达载体,对合适的宿主(例如微生物细胞(大肠杆菌、酵母)、昆虫、动物)进行转化以表达蛋白质,该蛋白质可用作抗原。此外,多肽可以通过蛋白质的化学裂解或酶解来制备,并且只要保留上述表位,也就可以使用。
抗原的量将根据生物样品中包含的自身抗体的估计量,通过检测抗体测定源自自身抗体的信号的方法学等来适当地设定。优选地,该量可以与生物样品中包含的自身抗体的估计量充分反应。例如,抗原的量可以为1pg至10μg,优选为10pg至1μg。
必要时,可以将抗原固定在不溶性载体(固体载体)上。作为这种固体载体,可以优选使用例如合成聚合物物质(诸如聚苯乙烯、聚乙烯、聚丙烯)、不溶性多糖(诸如琼脂糖、葡聚糖、多糖)或无机物质(诸如玻璃、硅胶、膨润土)。并且,这些载体可以传感器元件、微孔板的形式使用。膜、试管等,或者可以为球、棒、微粒(珠)等形式。
固定至固体载体上可以常规地进行。可以采用任何常规技术,只要其能够使固定化的抗原稳定并维持其功能,并且其不引起生物样品中包含的自身抗体、竞争抗体、后续要加入反应中的检测抗体等与固体载体直接结合(绕过抗原)。作为固定化的一些示例,可以引用物理吸附技术、化学键合技术等。物理吸附技术可以通过使抗原在水性溶剂(诸如水、生理盐水溶液、各种缓冲溶液)中与固体载体接触来实现。作为化学结合技术的一些示例,可以引用通过重氮法、酰基叠氮法、异氰酸酯法、溴化氰法形成共价键的固定化。此外,还可采用使用交联剂(诸如具有两个或多个戊二醛官能团的多官能试剂等)的固定化方法。为了将抗原作为蛋白质稳定地固定化,可以通过对固体载体表面进行化学修饰来引入高反应性的官能团。例如,通过在固体载体的表面上形成3-氨基丙基三乙氧基硅烷(3-aptes)、聚乙烯亚胺(pei)、乙二胺等的薄层,可以引入氨基等官能团。也可以通过具有适当链长的反应性侧链(间隔基)、生物素-亲和素(链霉亲和素)结合、蛋白质(诸如白蛋白、蛋白质a)等进行固定化。此外,也可以使用特异性识别抗原并与之结合的抗体进行固定化,如所谓的夹心法。
在固定化中,为了抑制生物样品中的自身抗体、竞争抗体和后续要加入反应体系中的检测抗体与固体载体直接结合,如果需要,可以对固体载体表面进行处理,例如封闭。
用于与本公开相关的自身抗体的定量方法中的竞争抗体可以为与自身抗体竞争结合抗原的任何物质,该抗原为作为测试物的自身抗体的结合伴侣。这里,术语“竞争”是指在本公开的自身抗体定量方法中,对作为测试物的自身抗体和作为其结合伴侣的抗原之间的抗原-抗体反应提供可检测到的减少的能力。因此,竞争抗体与自身抗体一样识别抗原并与之结合,该抗原被作为测试物的自身抗体特异性识别并结合。优选地,竞争抗体识别与测试物的自身抗体相同或基本相同的表位。由此,竞争抗体抑制自身抗体与相应抗原,特别是抗原表位的结合,使得一个抗原分子的结合导致自身抗体不能与该抗原分子结合,或者相反地,竞争抗原与一个抗原分子的结合导致该竞争抗体不能与抗原分子结合。因此,与抗原结合的自身抗体的量随着加入的竞争抗体的量的增加而减少,或者随着加入的竞争抗体的量的减少而增加。抗原-抗体反应中这种减少的程度可以通过本公开所属领域中已知的任何方法来确定。例如,可以通过比较在对照测试中获得的不存在候选竞争抗体时受到影响的结合活性来实现这种程度的确定。优选地,竞争抗体的表观亲和力水平与作为测试物的自身抗体相同。例如,优选自身抗体的表观平衡解离常数(kd值)显示竞争抗体的kd值的相同数字。此处,kd值表示抗体的亲和力,其为在一定摩尔浓度下的抗原和抗体的混合物产生的结合反应达到平衡时,反应物(抗体(ab)和抗原(ag))与反应产物(抗原-抗体复合物(ag-ab))之间的浓度比,可以计算为kd=[ag]×[ab]/[ag-ab]。平衡状态下的抗体、抗原和抗原-抗体浓度可以通过使用例如平衡透析法、表面等离子体共振法等获得。
优选地,竞争抗体不识别后续步骤中加入的检测抗体或不与之结合。也就是说,其与检测抗体无交叉反应性。进一步优选地,竞争抗体本身彼此不识别或结合,或者也不识别或结合自身抗体。
竞争抗体可以为多克隆抗体或单克隆抗体,只要其具有上述特征即可。并且,其来源也没有特别限制。因此,竞争抗体可以为市售产品,也可以为通过使用作为测试物的自身抗体的靶抗原或这种靶抗原的一部分的组成成分作为免疫原对动物(诸如小鼠、大鼠、兔、山羊、绵羊、豚鼠)进行免疫得到的多克隆抗体。顺便提及,在上文中,要求语言“这种靶抗原的一部分的组成成分”包括测试物的自身抗体识别的表位。特别优选地,可以采用通过对不同于作为测试物的自身抗体来源的动物进行免疫而获得的抗体。此外,可以用例如含有靶抗原组分的单个表位的合成肽对动物进行免疫,并且可以通过抗体产生细胞的细胞融合获得杂交瘤细胞,该抗体产生细胞产生识别该表位的抗体和骨髓瘤细胞。然后,培养这种杂交瘤细胞以产生单克隆抗体,也可优选使用该单克隆抗体。例如,如果靶抗原的序列信息是已知的,可以通过将基于这种序列信息合成的dna片段掺入合适的载体中来制备表达载体。然后,使用该表达载体,对合适的宿主(诸如微生物(大肠杆菌、酵母)、昆虫、动物的细胞)进行转化以表达一种蛋白质,然后该蛋白质可用作对适当动物进行免疫的抗原。特别地,优选地,通过基因工程技术在非人宿主中产生人源重组蛋白,并且用这种重组蛋白作为免疫原对非人动物进行免疫。在免疫中,需要时可以联合使用合适的佐剂。
此外,竞争抗体也可以为保留抗原结合能力的抗体片段,诸如f(ab')2片段、fab片段、fv片段,该片段可以通过用诸如木瓜蛋白酶、胃蛋白酶等的蛋白水解酶处理完整抗体而获得。竞争抗体可以是通过已知的基因工程技术(诸如基因重组、化学合成技术)制备的抗体。在通过基因重组制备竞争抗体的情况下,如果测试物为人自身抗体,则竞争抗体可以为嵌合抗体,其具有被人对应域取代的h链和l链可变区以外的域;或人源化抗体,其中除h链和l链互补决定区以外一级结构被人抗体的相应一级结构取代;或全人源化抗体,其被对应于包括恒定区的人抗体的一级结构取代。
在竞争抗体的使用中,通过向含有作为测试物的自身抗体的生物样品中加入已知量的竞争抗体来制备反应溶液。然后,将该反应溶液与抗原接触,使竞争抗体与生物样品中的自身抗体竞争结合抗原。加入竞争抗体的时间没有特别限制。然而,为了使自身抗体和竞争抗体之间的存在比率反映在竞争反应中,优选在向生物样品中加入竞争抗体之后进行与抗原的反应。
竞争抗体以各种量加入。如果竞争抗体的量大,则自身抗体与抗原结合的比率小。相反,如果竞争抗体的量小,则自身抗体与抗原结合的比率大。竞争抗体的加入量应能确定上述现象。根据竞争抗体和自身抗体对抗原的亲和力、生物样品中包含的自身抗体的估计量、通过检测抗体测定源自自身抗体的信号的方法等适当地设定具体的加入量。例如,竞争抗原的量可以为1pg/ml至1mg/ml,优选为10pg/ml至1μg/ml。
优选地,竞争抗原以竞争抗原溶液的形式加入到生物样品中,该竞争抗原溶液是通过将其溶解或悬浮在适当的水溶液(诸如水、生理盐水溶液、各种缓冲溶液等)中而获得的。缓冲溶液可以为本领域已知的任何缓冲溶液。作为其示例,磷酸盐缓冲溶液、柠檬酸盐缓冲溶液、咪唑缓冲溶液、tris缓冲溶液、hepes缓冲溶液、mops缓冲溶液,但不限于此。
在步骤(i)中与竞争抗体的反应步骤中的操作步骤、反应条件等可以类似于标准免疫测定进行。在抗原固定在固体载体上的情况下,优选在反应后,通过用适当的水溶液(诸如水、生理盐水溶液、各种缓冲溶液等)洗涤除去未与抗原反应的自身抗体和竞争抗体。
(ii)与检测抗体反应的步骤
在本公开的自身抗体检测方法中,在步骤(ii)中,与抗原结合的自身抗体与检测抗体反应,该检测抗体识别自身抗体并与之结合,但不识别竞争抗体。由此,只有与抗原结合的自身抗体与检测抗体结合,而该检测抗体不与和抗原结合的竞争抗体或不与抗原未反应的自身抗体或竞争抗体结合。
用于本公开的自身抗体定量方法的检测抗体可以为任何物质而没有限制,只要其识别作为测试物的自身抗体并与之结合。此外,要求检测抗体不识别或结合竞争抗体并且相对于竞争抗体不具有交叉反应性。进一步优选地,检测抗体本身彼此不识别或结合。
检测抗体可以为多克隆抗体或单克隆抗体,只要其具有上述特征即可。并且,其来源也没有特别限制。因此,与竞争抗体一样,检测抗体可以为市售产品。当采用市售产品时,可根据测试物自身抗体同种型(igg、igm、iga、igd、ige)或同种型的亚类选择检测抗体。根据抗体恒定区的差异所导致的抗原性差异对同种型进行分类。源自动物(诸如人)的生物样品中包含的自身抗体的许多同种型为igg。因此,作为检测抗体,优选选择igg抗体。例如,人igg可分为tour亚型lgg1、lgg2、lgg3、lgg4,而小鼠抗体可分为lgg1、lgg2a、lgg2b、lgg3。
可以类似于竞争抗体制备检测抗体。优选使用通过用作为测试物的自身抗体或自身抗体的组成成分作为免疫原对动物(诸如小鼠、大鼠、兔、山羊、绵羊、豚鼠等)进行免疫而获得的多克隆抗体。此外,可以用例如含有自身抗体组分的单个表位的合成肽对动物进行免疫,并且可以通过抗体产生细胞的细胞融合获得杂交瘤细胞,该抗体产生细胞产生识别该表位的抗体和骨髓瘤细胞。然后,培养这种杂交瘤细胞以产生单克隆抗体,也可优选使用该单克隆抗体。顺便提及,自身抗体的组成成分优选与使用测试物的自身抗体的恒定区(特别是fe片段)作为免疫原一起使用。如果检测抗体识别自身抗体的恒定区,优选竞争抗体具有不同的同种型或亚型。对于免疫,必要时可以使用合适的佐剂。
此外,检测抗体还可以为保留抗原结合能力的抗体片段,诸如f(ab')2片段、fab片段、fv片段,该片段可以通过用诸如木瓜蛋白酶、胃蛋白酶等的蛋白水解酶处理完整抗体而获得。检测抗体可以是通过已知的基因工程技术(诸如基因重组、化学合成技术)制备的抗体。在通过基因重组制备检测抗体的情况下,如果测试物为人自身抗体,则检测抗体可以为嵌合抗体,其具有被人对应域取代的h链和l链可变区以外的域;或人源化抗体,其中除了h链和l链互补决定区以外的一级结构被人抗体的相应一级结构取代;或全人源化抗体,其被对应于包括恒定区的人抗体的一级结构取代。
待加入的检测抗体的量根据生物样品中包含的自身抗体的估计量、通过检测抗体测定源自自身抗体的信号的方法等适当设定。优选地,该量为允许与生物样品中包含的估计量的自身抗体充分反应的量。例如,检测抗原的量可以为0.01至100μg/ml,优选为0.1至10μg/ml的浓度。
优选地,在生物样品和针对抗原的竞争抗体之间发生竞争反应之后,将检测抗原以检测抗原溶液的形式加入到生物样品中,该检测抗原溶液是通过将其在适当的水溶液(诸如水、生理盐水溶液、各种缓冲溶液等)中的溶液或悬浮液加入到反应溶液中而获得的。缓冲溶液可以为本领域已知的任何缓冲溶液。作为其示例,磷酸盐缓冲溶液、柠檬酸盐缓冲溶液、咪唑缓冲溶液、tris缓冲溶液、hepes缓冲溶液、mops缓冲溶液,但不限于此。
在步骤(ii)中与检测抗体的反应步骤中的操作步骤、反应条件等可以类似于标准免疫测定进行。在抗原固定在固体载体上的情况下,优选在反应后,通过用适当的水溶液(诸如水、生理盐水溶液、各种缓冲溶液等)洗涤除去未与抗原反应的检测抗体。
检测抗体直接或间接用适当的标记材料标记,因为这种标记材料是已知的,本领域技术人员可以选择一种以适当使用。只要保持稳定性和功能性,可以采用任何已知的这种材料。作为标记材料的示例,可以引用磁性物质、放射性物质、酶、荧光染料、化学发光材料等。并且,可以使用其中的一种或多种。因此,本公开的自身抗体定量方法可以使用任何已知的抗原-抗体反应测定方法来实现,包括磁性免疫测定、放射性免疫测定(ria、irma)、酶免疫测定(eia、elisa)、化学发光免疫测定(clia)、电化学发光免疫测定(eclia)和荧光酶免疫测定(fleia)等。
如本文所用,磁性材料(物质)是指包括在磁场中被磁化的磁性物质。磁性物质分为铁磁性物质、抗磁性物质、顺磁性物质、超顺磁性物质、亚铁磁性物质等。可以采用任何这种物质,只要其不损害作为测试物的自身抗体和用于测定的一种或多种抗原的特异性亲和力以及任何其它试剂的功能即可。作为其示例,可以引用铁磁性金属(诸如铁、钴、镍、钆)、铁磁性金属的合金(诸如铁-镍、铁-钴等)、含有铁磁性金属的合金、以磁铁矿(fe3o4)、磁赤铁矿(γ-fe2o3)或各种铁氧体为中间体的铁磁金属氧化物。特别地,从化学稳定性和对磁场的反应性的方面来看,优选使用铁氧体。并且,可以有利地使用添加有金属(诸如钴、锰、锌等)的铁氧体的混合物。
磁性物质的形状和尺寸没有特别限制。可以选择任何合适和有利的形状和尺寸。作为形状的示例,可以引用球形、椭圆形、颗粒形、立方体形、柱形、棒形、板形、针形、纤维形、块形等的形状。优选地,该物质形成均匀的形状。此外,磁性物质可以以珠的形式(诸如纳米颗粒、微粒)制备。
磁性颗粒可以仅由这种磁性物质构成,或者可以配置为使得磁性物质分散在整个颗粒或其表面上,或者可以被掺入颗粒内。例如,通过将磁性物质均匀分散在其中而制备的聚合物可以以颗粒的形式制备。或者,通过将磁性材料均匀地分散在聚合物中而制备的芯可以通过涂覆聚合物来制备。聚合物可以为亲水性聚合物或疏水性聚合物,并且可以根据测定模式适当地选择。具体地,可以有利地使用高分子聚合物,诸如聚苯乙烯、硅胶、明胶、聚丙烯酰胺等。此外,可以将聚合物配置为通过向颗粒表面引入官能团(诸如氨基、羧基、甲苯磺酰基、羟基)来表达其功能。顺便提及,优选地,应该进行制备使得每个颗粒的磁化是均匀的。
作为适当的放射性物质的示例,可以引用32p、35s、131i、45ca、3h等。作为酶标记的示例,可以引用过氧化物酶、碱性磷酸酶。作为荧光染料的示例,可以引用异硫氰酸荧光素(fitc)、四甲基罗丹明(tamra)、四甲基罗丹明异硫氰酸酯(trica)、德克萨斯红、花青染料(诸如花青3(cy3)和花青5(cy5))、量子点(诸如qdot(注册商标))。作为化学发光物质的示例,可以引用鲁米那等。此外,还可以有利地使用洋地黄毒苷或生物素。在采用生物素的情况下,可以使用用例如hrp标记的链霉亲和素对用生物素标记的检测抗体进行反应。在这种情况下,通过影响检测抗体上的多个生物素标记,可以放大信号,从而可以提高灵敏度。标记材料不限于上述,可以有利地使用任何已知的物质。
检测抗体的标记方法可以为任何标记方法,只要其能保持检测抗体和标记材料的稳定性和功能,还能保持生物样品中包含的自身抗体、竞争抗体和抗原的反应稳定性。例如,作为用磁性颗粒标记检测抗体的示例,可以引用物理吸附方法和化学结合方法。物理吸附法可以通过将磁性颗粒和检测抗体置于适当的水溶液(诸如水、生理盐水溶液、各种缓冲溶液)中进行。作为化学结合技术的一些示例,可以引用通过重氮法、酰基叠氮法、异氰酸酯法、溴化氰法形成共价键的标记法。此外,还可以采用使用交联剂(诸如具有两个或多个戊二醛官能团的多官能试剂等)的固定化方法。并且,如上所述,引入磁性颗粒表面以表达其功能的官能团(诸如氨基、羧基、甲苯磺酰基、羟基等)可以与检测抗体上的官能团化学键合。此外,磁性颗粒和检测抗体可以通过具有适当链长的反应性侧链(间隔基)或蛋白质(诸如白蛋白、蛋白a等)彼此化学键合。此外,也可以采用具有高亲和力和特异性的生物素-亲和素(链霉亲和素)结合或抗原-抗体反应等。
用标记材料标记检测抗体可以在形成检测抗体和作为测试物的自身抗体的免疫复合物之前或之后进行。因此,可以布置成使用预先用标记材料标记的检测抗体来识别和捕获作为测试物的自身抗体。此外,也可以布置成在检测抗体识别并捕获自身抗体之后用标记材料标记该检测抗体。
(iii)测量源自检测抗体的信号的步骤
在本公开的自身抗体定量方法中,提供步骤(iii),用于测量源自与自身抗体结合的检测抗体的信号。这种源自检测抗体的信号源自于生物样品中包含的自身抗体中与抗原结合的自身抗体。因此,源自检测抗体的信号与结合抗原的自身抗体的比例成正比。
源自检测抗体的信号的强度的测量可以通过任何常规方法进行。在添加标记的情况下,可以根据所使用的标记通过已知的标记检测方法测量强度。例如,在标记为磁性颗粒的情况下,可以通过已知的磁性检测方法,优选地通过磁性传感器来检测。磁性传感器没有特别限制,只要其能够检测来自传感器表面上的磁性颗粒的磁信号即可。例如,可以采用霍尔元件、磁性(磁阻抗:mi)元件、诸如磁阻(磁阻:mr)元件的磁阻元件、巨磁阻元件、隧道磁阻(tmr)元件、超导量子干涉器件(squid)等。测定技术可以为任何一种常规技术,如磁化率测定、磁弛豫测定技术等。优选采用gmr传感器(其为磁阻元件),诸如在s.xwang等人的“biosensorsandbioelectronics,201o,第25卷,第9期,第2051-2057页”中公开的传感器等。例如,可以布置成利用随着磁场的变化而变化的磁性传感器的电阻值来检测磁性粒子的磁化。由于存在外部磁场,传感器上的磁性颗粒被磁化,并且磁化的磁性颗粒引起磁性传感器的电阻率的变化。并且,通过将这种磁性传感器电阻率转换为电信号并检测该信号,可以检测磁性颗粒的存在。顺便提及,磁性传感器本身可以形成为芯片。
在使用磁性传感器测量源自检测抗体的信号的强度的情况下,传感器元件的形状没有特别限制,而是可以为例如平板形、球形、立方体形(诸如立方体)等的形状。例如,其可以形成为平板状的形状,具有形成平平地层压在其上的传感器元件的材料。构成传感器元件的材料不限于以下。尽管不希望以任何方式限于此,但是可以使用硅或二氧化硅、无机化合物(诸如氧化钛)、合成聚合物(诸如丙烯酰胺、聚苯乙烯、聚碳酸酯)形成基底,在该基底上可以堆叠有含有ptmn、nimn、irmn、pdmn、pdptmn、rhmn等作为其主要成分的反铁磁层、含有ta、ru、cr、rh、ir、au、ag、cu、zr、pt、mo、w等作为其主要成分的非磁层、含有nife、co、cofe等作为主要成分的铁磁层、晶种层、绝缘层等,这种材料可以根据电信号的检测方法适当地选择。
磁性传感器优选地包含能够同时测量多个样品的多个传感器元件。每个磁性传感器元件可以精确地设置在基底上的预定位置,诸如以芯片或阵列的形式,能够独立地检测磁信号。以此方式,将传感器配置为可用于同时测量反应溶液以及用于同时测量多个自身抗体的多重同时分析,该反应溶液包含本公开的自身抗体定量方法所需的生物样品,添加有不同已知量的竞争抗体。
(iv)计算自身抗体量的步骤。
在本公开的自身抗体定量方法中,提供步骤(iv),通过利用竞争抗体的量作为自身抗体的指标来计算生物样品中包含的自身抗体的量,该竞争抗体的量使得源自不存在竞争抗体情况下与自身抗体结合的检测抗体的信号减少50%。由于竞争抗体以已知量加入到含有作为测试物的自身抗体的生物样品中,通过与这种已知量的竞争抗体进行对比,计算生物样品中含有的自身抗体的量。
根据加入到生物样品中的竞争抗体量的增加/减少,源自检测抗体的信号的强度发生变化。如果加入到生物样品中的竞争抗体的量大,那么由于竞争抗体和自身抗体在其与抗原的结合中彼此竞争,与抗原结合的竞争抗体的量将增加,而与抗原结合的自身抗体的量将减少。由于检测抗体不识别竞争抗体,而仅识别自身抗体,随着与抗原结合的自身抗体比例的降低,源自检测抗体的信号的强度降低。相反,如果加入到生物样品中的竞争抗体的量小,则与抗原结合的竞争抗体的量将减少,而与抗原结合的自身抗体的量将增加,使得源自检测抗体的信号的强度将增强。因此,随着竞争抗体量的增加,测定的信号强度本身将降低。相反,随着竞争抗体量的降低,测定的信号强度将增强。
在计算自身抗体量的步骤中,获得竞争抗体量,当竞争抗体竞争性抑制抗原与自身抗体的结合时,该竞争抗体量表现出50%的效果降低(这在下文中可称为“ic50”)。优选地,产生由加入到生物样品中的竞争抗体的量与测量的信号强度之间的关系的绘图组成的校准曲线,并且基于这种校准曲线,可以获得ic50。优选地,使用在不存在竞争抗体的情况下测量的为100%的信号强度来计算ic50。
假设作为测试物的自身抗体与竞争抗体对抗原的亲和力相等,则ic50值可以认为是与抗原结合的自身抗体的量。由于生物样品包含的自身抗体中50%的自身抗体与抗原结合,因此可以理解,生物样品整体上包含两倍量的自身抗体。由此,可以将生物样品中包含的自身抗体的量计算为绝对值。
在测量中,如果对生物样品进行了稀释等,生物样品中包含的自身抗体的量可以通过稀释度的倍增校正来获得。此外,在与竞争抗体反应的步骤中使用向生物样品中加入竞争抗体溶液制备的反应溶液的情况下,生物样品中包含的自身抗体的量可以通过反应溶液制备的混合度的倍增校正来获得。其中,反应溶液的混合度可以按照如下获得:
反应溶液的混合度=(反应溶液量(生物样品+竞争抗体溶液))/(生物样品量)。
当作为测试物的自身抗体与竞争抗体对抗原的亲和力不相等时,生物样品中包含的自身抗体的量可以通过亲和度的倍增校正来获得。亲和度例如可以按照如下获得:
亲和度=(自身抗体亲和力(kd值))/(竞争抗体亲和力(kd值))。
(使用固相技术的自身抗体定量方法)
在本公开的自身抗体定量方法中,可以特别优选使用固相技术。接下来,将参照图1和2详细描述使用这种固相技术的自身抗体定量方法的实施方式。
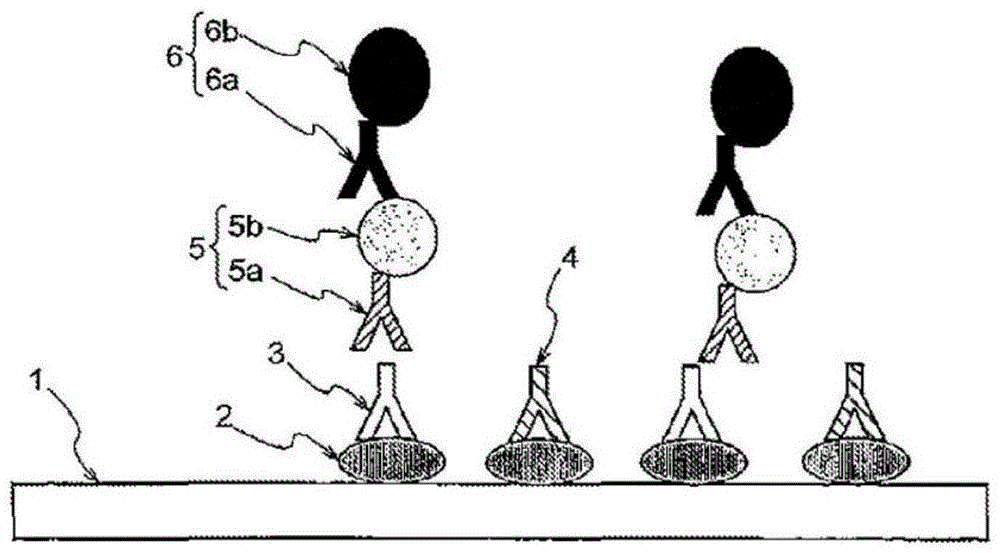
图1显示,采用生物样品中包含的血管生成素样蛋白3(angptl3)的人自身抗体作为测试物3。采用磁性传感器元件作为固体载体1,在其上预先固定angptl3作为抗原2,该抗原2被作为测试物3的自身抗体特异性识别并结合。可以对固体载体1进行表面改性,以将蛋白质稳定地固定在其表面上。向生物样品中加入已知量(浓度)的竞争抗体4并混合,并将该混合物用作反应溶液。采用绵羊源抗人angptl3作为竞争抗体4,并将其以各种量加入到反应溶液中。
接下来,反应溶液与固定有抗原2的固体载体1的反应表面反应。其中,生物样品中作为测试物3的自身抗体和竞争抗体4与抗原2竞争性结合。反应后,用适当的水溶液(诸如水、生理盐水溶液、各种缓冲溶液等)洗涤固体载体1的反应表面,由此可以除去作为测试物3的自身抗体和未与抗原2反应的竞争抗体4。
接下来,固体载体1的反应表面与检测抗体5反应,该检测抗体5识别作为测试物3的自身抗体,但不识别竞争抗体4。检测抗体5仅识别与抗原2结合的作为测试物3的自身抗体并与之结合。在此,使用生物素5b标记的抗人igg抗体5a(兔源抗人igg抗体、绵羊源抗人igg抗体或山羊源抗人igg抗体)作为检测抗体5。反应后,用适当的水溶液(诸如水、生理盐水溶液、各种缓冲溶液等)洗涤固体载体1的反应表面,由此除去未与测试物3反应的检测抗体5。
随后,将捕获检测抗体5的标记材料6加入到固体载体1的反应表面,从而标记检测抗体5并测量标记信号。由此,通过检测抗体5标记结合到抗原2的测试物3,并且可以检测源自结合到抗原2的该测试物3的信号,并且该信号的强度与结合到抗原2的测试物3的量成正比。在此,采用抗生物素抗体6a固定化磁珠6b作为标记材料6,并且通过磁性传感器测量来自该磁珠的磁信号。
接下来,使用根据测量的信号强度和加入的竞争抗体4的量之间的关系获得的ic50值作为指标,计算作为测试物3的自身抗体的量(浓度)。可以如上所述进行自身抗体量的该计算。如图2所示,产生了绘制加入到生物样品中的竞争抗体4的量与测量的信号强度之间的关系的校准曲线,并且基于这种校准曲线,可以容易地定量生物样品中包含的自身抗体的量。
通过将抗原结合到固体载体1上,可以在与抗原2结合的自身抗体和竞争抗体4与未与抗原2反应的自身抗体和竞争抗体4之间进行严格分离,从而进一步增强生物样品中包含的自身抗体的绝对量的可靠性。并且,这种分离也可以通过简单的操作(诸如洗涤上述固体载体)进行。
通过本公开,可以提供容易地定量生物样品中包含的自身抗体的绝对量的方法。对于常规方法,在测定生物样品中包含的自身抗体的量时,重点将放在准备性和定量性中的任一个上,并且难以构造具有以上两者的测定系统。由于难以购买或获得高纯度的自身抗体,特别是人自身抗体的标准物质。因此,如果将重点放在定量性上,则需要使用例如经纯化自身抗体作为标准物质来制备校准曲线。然而,自身抗体的纯化需要复杂和麻烦的操作以及大量成本。特别地,这种方法不适于需要多种不同种类的标准物质的多重同时分析。另一方面,如果将重点放在准备性上,为了测定自身抗体的量,例如,可以使用容易获得的患者样本作为标准物质来产生校准曲线,或者,未产生这种校准曲线,而作为测试物的自身抗体的确定将基于例如通过从实际测定的值减去盲测试值而获得的值。但是,这种方法仅仅是亚定量方法。此外,在作为常规抗体测定方法之一的竞争技术中,基于生物物质中包含的抗体相对于固定在适当底物上的抗原对标记的竞争抗体的“结合”抑制的比率来测定生物样品中包含的抗体的存在和量。然而,在常规方法中,通过与改变已知量的未标记抗体而产生的校准曲线进行对比来测定生物样品中包含的抗体的量。因此,由于难以购买或获得高纯度的自身抗体标准物质,这种方法不能解决上述弊端。
就使用患者样本的生物样品作为标准物质而言,本发明的自身抗体定量方法与常规方法相同。将各种已知量(浓度)的竞争抗体加入到生物样品中,从而引起自身抗体和竞争抗体之间与抗原结合的竞争。然后,通过检测抗体测量源自自身抗体的信号,该检测抗体不与竞争抗体结合,而仅与自身抗体结合。信号强度根据加入的竞争抗体量的变化而变化。然后,使用不存在竞争抗体情况下导致源自自身抗体的信号强度降低50%的竞争抗体的量作为指标,计算生物样品中包含的自身抗体的量(浓度)。特别地,当可以假定自身抗体和竞争抗体对抗原的亲和力相等时,可以认为导致源自自身抗体的信号强度降低50%的竞争抗体的量等于生物样品中包含的自身抗体的一半量。因此,通过本公开,即使使用容易获得的生物样品(诸如患者样本)作为标准物质,也可以定量生物样品中包含的自身抗体的绝对量,并且该方法在其经济方面是优越的,因为其不需要任何复杂的操作或昂贵的试剂等。此外,由于可以将生物样品中包含的自身抗体的量确定为绝对量,因此可以使用生物样品作为标准物质来测定校准曲线浓度,因此也可以为自身抗体定量提供廉价且优异的定量标准物质。可以预期,根据本公开的具有定量性和准备性的自身抗体定量方法可用于近年来对自身抗体的需求不断增加的多重同时分析。此外,利用常规方法,如果对于相同的生物样品使用不同批次的试剂进行测定,则易于发生如上所述的测量值变化的批次间误差,并且这在以商业规模实施的情况下将成为显著问题。另一方面,通过本公开,即使当试剂的这种批次间误差发生时,由于校准曲线浓度可以被确定为绝对值,因此实现了能够稳定地获得高度可靠结果的优点。
实施例
接下来,将详细解释根据本公开的自身抗体定量方法。然而,可以理解,根据本公开的自身抗体定量方法不限于这些实施例。因此,尽管使用gmr传感器测量血管生成素样蛋白(下文中可称为“angptl3”)作为测试物的示例,根据本公开的自身抗体定量方法也可类似地应用于其它自身抗体或其它测量方法。
(实施例1)测定所需的印刷电路板的制备
1.概述
在以下实施例中,通过gmr传感器测量生物样品中自身抗体的量。在该实施例中,将用于测量的gmr传感器的表面进行表面改性以固定蛋白质。
2.程序
制备其上安装有八(8)个gmr传感器的印刷电路板(pcb),并将其用于以下实施例中自身抗体量的测量。八个连续的gmr传感器安装在一条线上,并且其间具有固定间隔。更具体地,八个连续gmr传感器纵向对准彼此平行地设置并且间隔几毫米或厘米的间距,以能够对应于12行×8列布局中的八行中的各个孔。并且,将gmr传感器的抗原固定部分以从pcb突出或具有对应于孔板的八列中的各个孔的突起的方式安装在pcb上,并且gmr传感器的抗原固定部分附接到这些突起的前端部分。
为了将蛋白质固定在gmr传感器表面上,进行以下处理。使用yes(yieldengineeringsystem公司)的等离子体清洁装置(g-1000),在0.1托/室温的环境下进行pcb板的清洁操作300秒。接着,使用yes公司的真空蒸发装置(1224p),在pcb板上,在0.5托/150℃的环境下,将3-氨基丙基三乙氧基硅烷(sigma,440140)气相沉积60分钟。随后,在常压环境150℃下,将板在常压环境/150℃下保持静止16小时。完成这些步骤后,将pcb板恢复至室温并储存在洁净室中直至使用。
(实施例2)将抗原溶液固定在gmr传感器表面上
1.概述
在以下实施例中,在实施例1中的表面改性处理之后的pcb板上的gmr传感器上,将作为测试物的自身抗体的抗原固定。
2.程序
在实施例1的表面改性处理后的pcb板的1个传感器上,使用scienion公司的少量液体施加装置滴加人angptl3抗原(0.05mg/ml:由r&dsystems公司制造)(滴加量:650pl)。滴加后,使抗原反应1小时以固定,并将板在室温下在封闭溶液(1%blockace/4.4%bsa)中浸渍1小时以抑制非特异性键合。浸渍后,将传感器干燥并在4℃下保持过夜。
(实施例3)检索竞争抗体和检测抗体
1.概述
在本实施例中,进行竞争抗体和检测抗体的检索以用于自身抗体的测量。在此,竞争抗体是与作为测试物的自身抗体竞争与相同抗原上的表位结合的抗体。利用自身抗体与竞争抗体在竞争抗原中的这种竞争反应来测定自身抗体。检测抗体是与作为测试物的自身抗体结合的抗体,从而检测生物样品中包含的测试物的存在。
2.程序
作为竞争反应的先决条件,重要的是竞争抗体和检测抗体彼此不反应。为此,在实际进行测量试验之前,确认竞争抗体和检测抗体彼此不反应(两者之间无交叉反应性)。
购买并使用三种抗体作为竞争抗体,即小鼠源抗人angptl3抗体(r&dsystems公司,mab3829)、大鼠源抗人angptl3抗体(r&dsystems公司,mab38291)和绵羊源抗人angptl3抗体(r&dsystems公司,af3929)。更具体地,小鼠源angptl3抗体是通过采用草地贪夜蛾(s.frugiperda)昆虫卵巢细胞系sf21源重组人angptl3(uniprotkb/swiss-protq9y6c1:ser17-glu460)作为免疫原的单克隆小鼠lgg2b克隆#370207获得,并从具有蛋白a和g的杂交瘤细胞的培养悬浮液中纯化。与小鼠源angptl3抗体相似,从小鼠igg2a克隆#370207获得大鼠源angptl3抗体,不同之处在于使用i1e19-glu460作为免疫原。绵羊源抗人angptl3抗体是通过使用与小鼠源angptl3抗体中使用的免疫原相同的免疫原对绵羊进行免疫而获得的多克隆抗体。
购买并使用四种抗体作为检测抗体,即兔源抗人igg抗体/生物素标记(rockland公司,609-4603)、兔源抗人igg抗体/生物素标记(rockland公司,5609-4612)、绵羊源抗人igg抗体/生物素标记(rockland公司,609-6602)和山羊(ziege)源抗人igg抗体/生物素标记(vector公司,ba-3000)。更具体地,兔源抗人igg抗体(rockland公司,609-4603)是通过用人iggf(c)片段对兔进行重复免疫获得的多克隆抗体。兔源抗人igg抗体(rockland公司,609-4612)是使用人iggγ重链作为免疫原的多克隆抗体。绵羊源抗人igg抗体是使用人igg全分子作为免疫原的人igg(h+l)的多克隆抗体,并通过使用人igg结合琼脂糖珠对分离自免疫动物的单特异性抗血清进行免疫亲和层析来制备。山羊源抗人igg抗体也是人igg(h+l)的多克隆抗体。
下面将描述具体的程序。
使用稀释溶液(1%bsa/pbs)将竞争抗体制备为2μg/ml溶液,将检测抗体用稀释溶液(1%bsa/pbs)制备为0.7μg/ml溶液。并且,使用稀释溶液(1%bsa/pbs)将用于检测的抗生物素抗体固定化磁珠(miltenyi公司,150-106-0877)稀释20倍,由此制备其各自的溶液。
将以下溶液各0.5ml加入到12行×8列的96孔板中。然后,将该孔板安装到申请人自行开发的自动反应装置上,并将实施例1和实施例2中制备的pcb板也安装到自动反应装置上。接下来,在搅拌速率和下面确定的反应时间下进行抗原-抗体反应。顺便提及,反应在室温下进行。驱动自动反应装置,使得安装在pct板上的gmr传感器从96孔板的第一排移动到第十二排,并且gmr传感器的抗原固定部分浸渍在依次添加到各排孔中的溶液中。尽管在该实施例中使用了自动反应装置,但是操作也可以手动进行。
施用到各行孔中的溶液、搅拌速率和反应时间总结如下。
第1行和第2行:洗涤液(pbst),搅拌速率1hz,反应时间1分钟。
第3行:空。
第4行:竞争抗体溶液,搅拌速率1hz,反应时间90分钟。
第5、6、7行:洗涤液(pbst),搅拌速率1hz,反应时间1分钟。
第8行:空。
第9行:检测抗体,搅拌速率1hz,反应时间60分钟。
第10、11、12行:洗涤液(pbst),搅拌速率1hz,反应时间1分钟。
在上述反应之后,将pcb板从自动反应装置上卸下,然后安装到由本申请人自行开发的gmr测量装置上。将以下溶液以0.4ml的量加入到2行×8列的孔板中。然后,将该孔板安装到申请人自行研制的自动反应装置上。然后,在以下确定的搅拌速率和反应时间下进行反应和。顺便提及,反应和测定在室温下进行。驱动自动反应装置,使得安装在pct板上的gmr传感器从2行×8列孔板的第一行移动到第二行,并且gmr传感器的抗原固定部分浸渍在依次添加到相应行的孔中的溶液中。通过确定在第二行处的磁珠与传感器表面的结合所导致的电阻值的变化量,这些量被检测为信号。
施加到各行孔中的溶液、搅拌速率和反应时间总结如下。
第1行:洗涤液(pbst),搅拌速率1hz,反应时间3分钟。
第2行:抗生物素抗体固定化磁珠,搅拌速率1hz,反应时间20分钟。
3.结果
结果显示在图3和表1中。根据这些结果,证实了作为竞争抗体的绵羊源抗人angptl3抗体(r&dsystem公司,af3829)和作为检测抗原的兔源抗人igg抗体/生物素标记(rockland公司,609-4612)的组合以及作为竞争抗体的绵羊源抗人angptl3抗体(r&dsystem公司,609-6602)和作为检测抗原的山羊源抗人igg抗体/生物素标记(vector公司,ba-3000)的组合分别无交叉反应性。
[表1]
(实施例4)生物样品中自身抗体量的测量
1.概述由于在实施例3中证实了无交叉反应性的竞争抗体与检测抗体的组合,因此在本实施例中,实际使用这些组合进行患者样本中自身抗体量的测定。
2.程序
使用从患者获得的血浆作为患者样本,并测定这种患者样本中包含的抗人angpl3抗体的量。更具体地,使用稀释溶液(1%bsa/pbs)将患者样本稀释4倍。作为竞争抗体,使用稀释溶液(1%bsa/pbs)将绵羊源抗人angpl3抗体(r&dsystems公司af3829)的浓度制备为6.4ng/ml至100μg/ml。然后,将55μl的如上制备的竞争抗体与495μl的患者样本混合以形成反应溶液,从而提供最终浓度为0.64ng/ml至10μg/ml的竞争抗体样品组。顺便提及,使用加入了稀释溶液(1%bsa/pbs)而非竞争抗体的样品作为未加入竞争抗体的样品(竞争抗体浓度=0的样品)。作为检测抗体,将三种抗体,即兔源抗人igg抗体/生物素标记(rockland公司,609-4612)、绵羊源抗人igg抗体/生物素标记(rockland公司,609-6602)和山羊源抗人igg抗体(vector公司,ba-3000)的浓度用稀释溶液(1%bsa/pbs)制备成0.7μg/ml。
如实施例3,将如此制备的溶液分别以0.5ml的量加入到12行×8列的96孔板中;然后,在自动反应装置中进行反应,并通过gmr测定装置进行分析。
(结果)
结果如图4至6所示。结果表明,无论使用哪种检测抗体,随着竞争抗体浓度的增加,观察到信号降低。从测试结果获得近似公式,并获得50%抑制浓度(ic50)。作为近似公式,从下面的数学公式1获得4参数逻辑曲线,并获得校准曲线。
[数学公式1]
在数学公式1中,在使用兔源抗人igg抗体的情况下,a=12.1,b=-1.15,c=134.0,d=1056,在使用兔源抗人igg抗体的情况下,a=246.81,b=-1.408,c=105.6,d=1548.6,在使用山羊源抗人igg抗体的情况下,a=388,b=-1.68,c=90.1,d=1803.1。
对于ic50值,当使用兔源抗人igg抗体作为竞争抗体时,获得ic50=132.2ng/ml(见图4);当使用绵羊源抗人igg抗体/生物素标记(rockland公司,609-6602)作为竞争抗体时,获得ic50=137.0ng/ml(见图5);当使用山羊源抗人igg抗体/生物素标记(vector公司,ba-3000)作为竞争抗体时,获得ic50=122.8ng/ml(见图6)。
基于以上获得的ic50值,由以下表达式计算抗体浓度。
抗体浓度=ic50×2×反应溶液制备倍增因子×稀释倍增因子
例如,将显示使用兔源抗人igg抗体(rockland公司,609-4612)的情况。获得的ic50为132.3ng/ml,对于50%至100%的校准,该值乘以2(二)。至于反应溶液倍增因子,由于反应溶液通过将55μl的竞争抗体溶液加入到495μl的作为生物样品的患者样本中制备,因此(495+55)/495的倍数受到了影响。并且,由于稀释倍增因子为4,因此乘以4就可以计算出生物样品中包含的自身抗体的浓度。即,其可以计算为1175.1ng/m,因为抗体浓度=132.2×2×550/495×4。
类似地,当使用绵羊源抗人igg抗体/生物素标记和山羊源抗人igg抗体/生物素标记的结果计算自身抗体浓度时,浓度分别计算为1217.4ng/ml和1091.6ng/ml。因此,无论使用哪一种竞争抗体,都可以获得基本相同的自身抗体浓度。因此,可以理解,本公开的自身抗体定量方法具有显著的可靠性和再现性。
这样,在根据本公开的自身抗体定量方法中,在测定生物样品中包含的作为测试物的自身抗体时,通过利用与抗体的竞争反应,可以定量生物样品中包含的自身抗体的绝对量(浓度),该抗体与自身抗体竞争结合由自身抗体特异性识别并结合的抗原。向生物样品中加入各种已知量(浓度)的竞争抗体,通过不与竞争抗体结合但与自身抗体结合的标记检测抗体,测定源自与抗原结合的自身抗体的标记信号强度。在此,由于未检测到竞争抗体,随着竞争抗体量的增加,测量的信号强度降低。在这种情况下,本发明人发现,基于竞争抗体抑制50%信号强度的竞争抗体的量,可以容易地确定生物样品中包含的自身抗体的绝对量。
因此,根据本公开,可以提供自身抗体定量方法,该方法允许容易地确定生物样品中包含的自身抗体的绝对量。对于常规方法,在测定生物样品中含有的自身抗体的量时,重点将放在准备性和定量性中的任一个上,并且难以构造具有以上两者的测定系统。另一方面,根据本公开,即使使用容易获得的生物样品(诸如患者样本)作为标准物质,也可以定量生物样品中包含的自身抗体的绝对量,并且该方法在经济方面是优越的,因为其不需要任何复杂的操作或昂贵的试剂等。并且,由于可以将生物样品中的自身抗体量确定为绝对量,因此可以使用生物样品作为标准物质来定义校准曲线浓度。可以预期,根据本公开的具有如上所述的定量性和准备性的自身抗体定量方法可用于多重同时分析。此外,即使当存在试剂的批次间差异时,由于校准曲线浓度可以形成为绝对量,因此可以稳定地获得高度可靠的结果。
因此,本公开的自身抗体定量方法可用于需要对自身抗体进行定量的各种领域,特别是在诸如诊断、药物开发和生物科学等医学治疗的工业领域。例如,该方法可用于定量自身抗体以诊断自身免疫性疾病或特定疾病(诸如癌症),其特征在于自身抗体的表达,以及为了定量自身抗体而测定用于产生校准曲线的标准物质。
在前述实施方式中,可以设想以下布置。
例如,在上述实施方式中,抗原被固定在固体载体上。
根据本公开,通过使抗原与固体载体结合,可以在与抗原结合的自身抗体和竞争抗体之间以及在未与抗原反应的自身抗体和竞争抗体之间进行严格分离。因此,自身抗体量的测量值的可靠性进一步增强。并且,这种分离也可以通过简单的操作(诸如洗涤固体载体)来进行,从而可以进一步增强准备性。
例如,在上述实施方式中,源自检测抗体的信号为磁信号。
通过本公开,可以通过例如磁性传感器等高灵敏度地检测磁信号,因此能够稳定地定量生物样品中包含的自身抗体,从而获得更加可靠的测定结果。
在前面的说明书中已经描述了本发明的原理、优选实施方式和操作模式。然而,旨在保护的本发明不应被解释为限于上述特定实施方式。此外,本文描述的实施方式应被认为是说明性的而非限制性的。在不脱离本发明的精神的情况下,其他人可以进行变化和改变,并且可以采用等同物。因此,很明显,所有这些落入权利要求所限定的本发明的精神和范围内的变化、改变和等同物都包含在其中。
[参考标记/数字的说明]
1固体载体
2抗原
3测试物(自身抗体)
4竞争抗体
5检测抗体
5a检测抗体分子
5b生物素
6标记材料
6a抗生物素抗体分子
6b磁珠
- 还没有人留言评论。精彩留言会获得点赞!