选择针对癌症患者的治疗的方法与流程
本公开涉及用于治疗患有癌症的患者的预测方法、个性化疗法、试剂盒、可传输形式信息和方法。
背景技术:
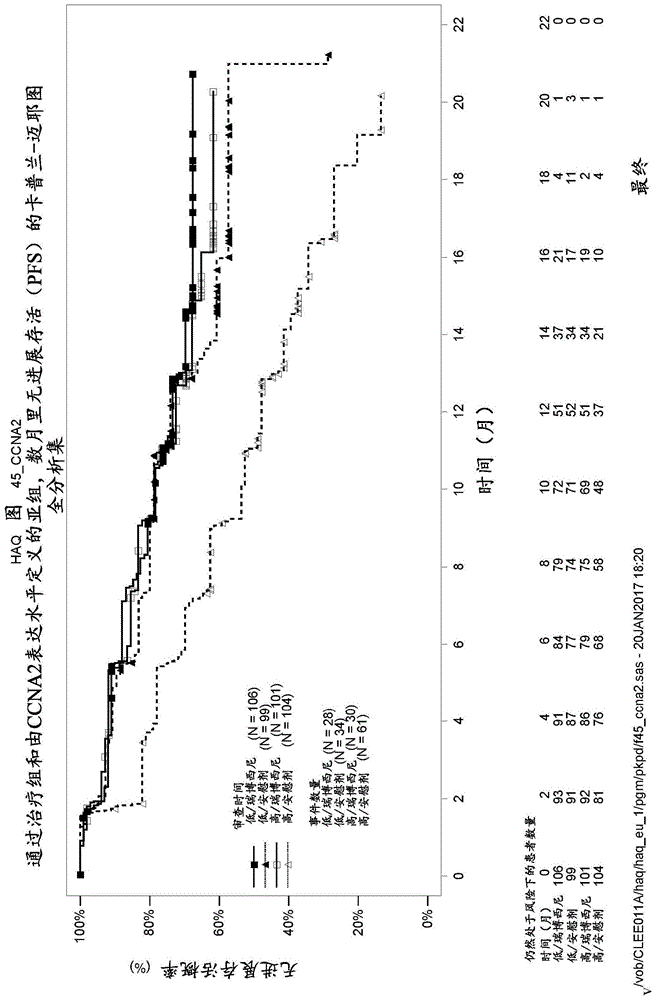
:乳腺癌是在组织学、治疗性应答和患者治疗结果方面有高度多样性的异质性疾病。每年全世界女性中有110万新增乳腺癌病例,并且有40万女性死于这种疾病。尽管在预防女性死于乳腺癌方面取得了进展,但我们仍在一定程度上不了解乳腺癌的生物学,其可以解释为什么某些患者对治疗应答良好,而另一些患者则以不可避免的下坡过程发展复发疾病。人们迫切需要改善的治疗选择以解决这种僵局并有效治疗乳腺癌患者。技术实现要素:本发现基于针对患有癌症(例如乳腺癌)的患者的新颖的预测方法和个性化疗法,这些预测方法和个性化疗法可识别患者的预后,并可用于选择最可能受益于cdk4/6抑制剂和芳香酶抑制剂的组合治疗的患者。具体地,本发明基于以下发现:使用本发明的一种或多种生物标志物,可以预测,与单独用来曲唑(letrozole)治疗的患者相比,那些用瑞博西尼(ribociclib)和来曲唑的组合治疗的乳腺癌患者显示无进展存活(pfs)的机会增加。在一个实施例中,本发明包括选择性地治疗患有癌症(例如乳腺癌,例如转移性乳腺癌)的患者的方法,所述方法包括:a)测定来自所述患者的生物样品中ccna2、ccne1、cdk2、cdk4、cdkn1a、cdkn2b、cdkn2c、e2f1、e2f3和rb1中的一种或多种的表达水平;和b)其后,如果所述患者的ccna2、ccne1、cdk2、cdk4、cdkn1a、cdkn2b、cdkn2c、e2f1、e2f3和rb1中的一种或多种的表达水平相对于对照升高,则向所述患者选择性施用治疗有效量的cdk4/6抑制剂(例如瑞博西尼)和芳香酶抑制剂(例如来曲唑)。在另一方面,本发明包括预测患有癌症的患者将对用cdk4/6抑制剂和芳香酶抑制剂的治疗产生应答的可能性的方法,所述方法包括测定来自所述患者的生物样品中ccna2、ccne1、cdk2、cdk4、cdkn1a、cdkn2b、cdkn2c、e2f1、e2f3和rb1中的一种或多种的表达水平,其中ccna2、ccne1、cdk2、cdk4、cdkn1a、cdkn2b、cdkn2c、e2f1、e2f3和rb1中的一种或多种的表达水平相对于对照的升高表明所述患者对cdk4/6抑制剂(例如瑞博西尼)和芳香酶抑制剂(例如来曲唑)的治疗产生应答的可能性增加。在又另一方面,本发明包括用cdk4/6抑制剂(例如瑞博西尼)和芳香酶抑制剂(例如来曲唑)选择性治疗患有癌症的患者的方法,所述方法包括:a)根据所述患者的ccna2、ccne1、cdk2、cdk4、cdkn1a、cdkn2b、cdkn2c、e2f1、e2f3和rb1中的一种或多种的表达水平相对于对照升高,来选择患者进行用cdk4/6抑制剂和芳香酶抑制剂的治疗;和b)其后,向所述患者施用治疗有效量的cdk4/6抑制剂(例如瑞博西尼)和芳香酶抑制剂(例如来曲唑)。在仍又另一方面,本发明包括用cdk4/6抑制剂(例如瑞博西尼)和芳香酶抑制剂(例如来曲唑)选择性治疗患有癌症的患者的方法,所述方法包括:a)测定来自所述患者的生物样品中ccna2、ccne1、cdk2、cdk4、cdkn1a、cdkn2b、cdkn2c、e2f1、e2f3和rb1中的一种或多种的表达水平;和b)其后,根据所述患者的ccna2、ccne1、cdk2、cdk4、cdkn1a、cdkn2b、cdkn2c、e2f1、e2f3和rb1中的一种或多种的表达水平相对于对照升高,来选择患者进行用cdk4/6抑制剂和芳香酶抑制剂的治疗;和c)其后,向所述患者施用治疗有效量的cdk4/6抑制剂(例如瑞博西尼)和芳香酶抑制剂(例如来曲唑)。在仍又另一方面,本发明包括预测患有癌症的患者将对用cdk4/6抑制剂(例如瑞博西尼)和芳香酶抑制剂(例如来曲唑)的治疗产生应答的可能性的方法,所述方法包括测定来自所述患者的生物样品中ccna2、ccne1、cdk2、cdk4、cdkn1a、cdkn2b、cdkn2c、e2f1、e2f3和rb1中的一种或多种的表达水平,其中:a)ccna2、ccne1、cdk2、cdk4、cdkn1a、cdkn2b、cdkn2c、e2f1、e2f3和rb1中的一种或多种的表达水平升高表明患者将对用cdk4/6抑制剂(例如瑞博西尼)和芳香酶抑制剂(例如来曲唑)的治疗产生应答的可能性增加;和b)ccna2、ccne1、cdk2、cdk4、cdkn1a、cdkn2b、cdkn2c、e2f1、e2f3和rb1中的一种或多种的表达水平没有升高表明可以仅用芳香酶抑制剂(例如来曲唑)来治疗患者。上述方法中使用的生物样品可以是任何肿瘤样品。在上述方法中,测定一种或多种基因的表达水平的步骤可以通过检测基因表达(例如mrna表达)来进行。可以使用选自下组的技术,该组由以下组成:rna印迹分析、聚合酶链反应(pcr)、逆转录聚合酶链反应(rt-pcr)、或基于taqman的测定。在上述方法中,可以确定表1中的一种或多种基因,例如至少两种、三种基因、四种基因、五种基因、六种基因、七种基因、八种基因、九种基因或十种基因的表达水平。在另一方面,本发明包括用于癌症患者的预后的方法,所述方法包括:在从所述受试者获得的生物样品中测量至少一种或多种选自下组的基因的基因表达水平,该组由以下组成:ccna2、ccne1、cdk2、cdk4、cdkn1a、cdkn2b、cdkn2c、e2f1、e2f3和rb1,b)将在步骤a)确定的每个表达水平与对照进行比较,其中将所述表达水平与所述对照进行比较可预测受试者的癌症预后。在一个实施例中,如果在a)中测量的基因的表达高于对照,则确定所述受试者预后较差,例如,无进展存活(pfs)的机会降低。在另一个实施例中,如果在a)中测量的基因的表达等于或低于对照,则确定所述受试者预后良好,例如,无进展存活(pfs)的机会增加。在另一方面,本发明包括选择用于治疗受试者的癌症(例如乳腺癌)的疗法,所述方法包括:(a)在从所述受试者获得的生物样品中测量至少一种或多种选自下组的基因的基因表达水平,该组由以下组成:ccna2、ccne1、cdk2、cdk4、cdkn1a、cdkn2b、cdkn2c、e2f1、e2f3和rb1,以及(b)基于表达水平,选择合适的疗法用于治疗受试者的癌症(例如乳腺癌)。在一个实施例中,如果所述基因中的一种或多种与对照相比表达增加,则表明所述患者应选择cdk4/6抑制剂(例如瑞博西尼)和芳香酶抑制剂(例如来曲唑)的组合疗法。在另一个实施例中,如果基因ccna2、ccne1、cdk2、cdk4、cdkn1a、cdkn2b、cdkn2c、e2f1、e2f3和rb1的表达与对照相比均未增加,则表明所述患者应选择cdk4/6抑制剂(例如瑞博西尼)和芳香酶抑制剂(例如来曲唑)的组合的替代治疗的疗法,例如仅用芳香酶抑制剂(例如来曲唑)治疗。可用于本发明中的芳香酶抑制剂的实例包括来曲唑、阿那曲唑(anastrozole)、或依西美坦(exemestane)。可用于本发明中的cdk4/6抑制剂的实例包括本领域已知的任何cdk4/6抑制剂,包括帕博西尼(palbociclib)、瑞博西尼或玻玛西尼(abemaciclib)。在本发明的一个实施例中,根据上述方法,能以一种剂量单位形式的固定组合或成套试剂盒(kitofparts)的形式施用所述cdk4/6抑制剂(例如瑞博西尼)和芳香酶抑制剂以用于组合施用,其中所述cdk4/6抑制剂和所述芳香酶抑制剂可以同时独立地施用或在允许治疗剂具有治疗效果的时间间隔内分别施用。术语“包含(comprising)”涵盖“包括(including)”以及“组成(consisting)”,例如,“包含”x的组合物可以仅由x组成,或者可以包括另外的一些,例如x+y。关于数值x的术语“约”意指+/-10%,除非上下文另外规定。如本文所用,术语“受试者”和“患者”包括任何人类或非人类动物。术语“非人类动物”包括所有脊椎动物,例如,哺乳动物和非哺乳动物,如非人类灵长类、绵羊、狗、猫、马、牛、鸡、两栖动物、爬行动物等。术语“测定”用于指鉴定、筛选、探测、测试、测量或确定的行为,所述行为可以通过任何常规手段进行。例如,可以通过使用rna印迹来测定样品中特定遗传标记的存在。术语“检测”(等)意指从给定源提取特定信息的行为,其可以是直接的或间接的。在本文公开的预测方法的一些实施例中,在生物样品中检测到给定事物(例如,基因表达水平等)的存在。术语“测定”和“确定”涵盖物质的转化,例如,通过对样品进行物理测试,将生物样品(例如肿瘤样品)从一种状态转化为另一种状态。术语“获得”意指以任何方式(例如通过物理干预(例如活检)或非物理干预(例如经由服务器传输信息))取得,例如获取拥有。如本文所用,术语“组合”定义为呈一个剂量单位形式的固定组合或成套试剂盒以进行组合施用,其中所述cdk4/6抑制剂和所述芳香酶抑制剂可同时独立地施用或在允许治疗剂的时间间隔内分开施用。术语“药物组合物”在本文中被定义为是指含有至少一种待施用于受试者(例如哺乳动物或人)的治疗剂的混合物或溶液,以预防或治疗影响所述哺乳动物的特定疾病或病症。术语“药学上可接受的”在本文中被定义为是指在合理医学判断的范围内适合用于与受试者(例如,哺乳动物或人)的组织相接触而无过度毒性、刺激过敏反应和其他问题并发症,并且与合理的益处/风险比相称的那些化合物、材料、组合物和/或剂型。术语“组合制剂”在本文中被定义为特别指“成套试剂盒”,其意义在于治疗剂(a)和(b)(例如所述cdk4/6抑制剂和所述芳香酶抑制剂)能被单独给药或使用具有不同含量治疗剂(a)和(b)的不同固定组合给药,即同时或在不同时间点使用。成套试剂盒的各部分可随后例如同时地施用,或按时间交错施用,即对于成套试剂盒的任何部分在不同的时间点且以相等或不同的时间间隔施用。组合制剂中待施用的治疗剂(a)与治疗剂(b)的总量的比例可变化,例如以满足待治疗患者亚群的需求或单一患者的需求。如本文所用,术语“组合施用(combinedadministration)”或“组合的施用(administrationofthecombination)”被定义成包括向单个患者施用选定的治疗剂,且意在包括其中试剂不必定通过相同施用途径或同时施用的治疗方案。如本文所用,术语“治疗(treating或treatment)”包括减轻、减少或缓解受试者的至少一种症状或者实现癌症(例如乳腺癌)进展延迟的治疗。例如,治疗可以是减少一种或几种癌症症状,或者完全根除癌症。在本发明的含义内,术语“治疗”还表示阻滞、延迟头颈癌发作(即头颈癌临床表现前的阶段)和/或降低头颈癌发展或恶化的风险。本文所用的术语“预防”意指预防、延迟或治疗(或者适当时,以上全部)受试者中头颈癌的发展或持续或加重。关于化合物(例如,cdk4/6或另一种试剂)的术语“施用”用于指通过任何途径将所述化合物递送至患者。如本文所用,“治疗有效量”是指仅cdk4/6或与芳香酶抑制剂的组合在以单剂量或多剂量向患者(例如人类)施用时有效地治疗、预防、防止发病、治愈、延迟、降低严重程度、减轻障碍或复发性障碍的至少一种症状、或延长患者的存活期超出无此治疗存在时所预期存活期的量。当应用于单独施用的单个活性成分时,所述术语是指单独的该成分。当应用于组合时,所述术语是指产生治疗作用的活性成分(无论连续还是同时组合施用)的组合量。短语“接收数据”用于意指通过任何可用的方式(例如口头地、电子地(例如通过电子邮件、在磁盘或其他媒体上编码)、书写等)获得信息的占有权。如本文所用,关于患者的“选择(selecting)”和“被选择(selected)”用于意指特定患者是基于(由于)具有预定标准的特定患者而从较大的患者组中特别选择的,例如,所述患者具有一种或多种特定基因的表达增加。类似地,“选择性治疗”是指向患有癌症的患者提供治疗,其中所述患者是基于具有预定标准(例如一种或多种基因的表达水平增加)的特定患者从较大的癌症患者组中特别选择的。类似地,“选择性施用”是指向基于(由于)具有预定标准(例如,特定遗传标记或其他生物学标记)的特定患者从较大的患者组中特别选择的患者施用药物。通过选择,选择性地治疗和选择性地施用,其意指基于患者的特定生物学向患者递送个性化疗法,而不是仅基于患有特定疾病的患者来递送标准治疗方案。关于如本文所用的治疗方法,选择不是指具有一种或多种特定基因表达增加的患者的偶然治疗,而是指基于患有癌症(例如乳腺癌)的患者而做出向患者施用cdk4/6抑制剂与芳香酶抑制剂的慎重选择。因此,选择性治疗不同于标准治疗,后者不管其等位基因状态如何向所有患者递送特定药物。如本文所用,“预测”表示本文所述的方法提供信息以使医疗保健提供者能够确定以下可能性:具有一种或多种特定基因的表达升高的个体对cdk4/6抑制剂和芳香酶抑制剂的组合治疗产生应答或对其更有利地产生应答。它并不是指以100%准确度预测应答的能力。相反,技术人员将理解它指的是概率增加。如本文所用,“可能性(likelihood)”和“很可能(likely)”是对事件可能发生的可能性的测量。它可以与“概率”互换使用。可能性是指大于推测但小于确定性的概率。因此,如果合理人使用常识、训练或经验得出结论认为,鉴于当前情形,事件是可能的,则事件是可能的。短语“增加的可能性”是指事件发生的概率增加。例如,本文中的一些方法允许预测患者是否将显示出对用cdk4/6抑制剂和芳香酶抑制剂的治疗产生应答的可能性增加或与患有癌症但不具有一种或多种基因的表达增加的患者相比更好地对用cdk4/6抑制剂和芳香酶抑制剂的治疗产生应答的可能性增加。术语“探针”是指可用于特异性检测另一种物质的任何物质组合物。探针可以是pcr引物,例如与另一引物一起,用于扩增特定的基因序列区域。短语“特异性杂交”用于指严格杂交条件下的杂交。严格条件是本领域技术人员已知的,并且可以在currentprotocolsinmolecularbiology[当代分子生物学实验指南],约翰·威利父子出版社(johnwiley&sons),纽约,(1989),6.3.1-6.3.6中找到。在所述参考文献中描述了水性和非水性方法,并且可以使用任一种。严格杂交条件的一个实例是在约45℃下在6x氯化钠/柠檬酸钠(ssc)中杂交,然后在50℃下在0.2xssc、0.1%sds中至少洗涤一次。严格杂交条件的第二个实例是在约45℃下在6xssc中杂交,然后在55℃下在0.2xssc、0.1%sds中至少洗涤一次。严格杂交条件的另一个实例是在约45℃下在6xssc中杂交,然后在60℃下在0.2xssc、0.1%sds中至少洗涤一次。严格杂交条件的另外的实例是在约45℃下在6xssc中杂交,然后在65℃下在0.2xssc、0.1%sds中至少洗涤一次。高严格条件包括在65℃下在0.5m磷酸钠、7%sds中杂交,然后在65℃下在0.2xssc、1%sds中至少洗涤一次。短语“核酸的区域”用于指示更大核酸序列内的更小序列。例如,基因是染色体的区域,外显子是基因的区域等。术语“能够”用于意指实现给定结果的能力,例如能够检测特定物质的存在的探针意味着所述探针可用于检测所述特定物质。“寡核苷酸”是指核苷酸的短序列,例如2-100个碱基。如本文所用,术语“生物样品”是指来自患者的样品,其可用于鉴定、诊断、预测或监测的目的。如本文所用,术语“预后良好”是指这样的患者,其中所述患者具有以下至少一种:复发风险降低、无进展存活(pfs)的机会增加、存活可能性增加、存活时间增加、或转移风险降低。如本文所用,术语“预后不良”是指这样的患者,其中所述患者具有以下至少一种:复发风险增加、无进展存活(pfs)的机会降低、存活可能性降低、存活时间降低、或转移风险增加。在以下说明书和所附权利要求书中提供了另外的方法、用途和试剂盒。根据以下说明书和所附权利要求书,本公开的其他特征、优点和方面对于本领域技术人员而言将是显而易见的。附图说明图1a-1q显示了通过治疗组和由基因表达水平定义的亚组,针对各种基因的无进展存活(pfs)的卡普兰-迈耶(kaplanmeier)曲线。具体实施方式越来越多的证据表明患者基因图谱能决定患者对治疗性治疗的应答。考虑到多种疗法可用于治疗癌症,影响(例如预后)对特定药物的应答的遗传因素的确定可用于为患者提供个性化的治疗方案。此类个性化的治疗方案提供了能使患者的治疗益处最大化的潜能,同时使与替代治疗方案有关的相关副作用最小化。因此,需要鉴定可用于预测患者的预后以及患者是否可能对特定疗法产生应答的因素。本发明的一种或多种生物标志物包括表1中列出的一种或多种基因。表1中所示的一种或多种基因的表达水平可以包括检测获得自生物样品的核酸产物(例如rna、mrna等)和/或多肽产物(例如表达的蛋白质)。在另一方面,本发明包括表2中列出的基因。表2中所示的一种或多种基因的表达水平可以包括检测获得自生物样品的核酸产物(例如rna、mrna等)和/或多肽产物(例如表达的蛋白质)。通过分析表1中鉴定的一种或多种生物标志物或表2中的生物标志物的表达水平,可以预测癌症患者(例如乳腺癌患者)的预后,并且从而选择最可能对用一种或多种特定药物的治疗产生应答的患者。在一个实施例中,本发明可用于鉴定以下乳腺癌患者,其预后较差并因此将从芳香酶抑制剂(例如来曲唑)和cdk4/6抑制剂(例如瑞博西尼)的组合治疗中受益。cdk4/6抑制剂细胞周期蛋白依赖性激酶-4/6(cdk4/6)抑制剂可以是任何已知的cdk4/6抑制剂或其药学上可接受的盐、溶剂化物、水合物、共晶体、或前药。已鉴定出许多cdk4/6抑制剂,包括特定的吡啶并[2,3-d]嘧啶、2-苯胺基嘧啶、二芳基脲、苯甲酰基-2,4-二氨基噻唑、吲哚并[6,7-a]吡咯并[3,4-c]咔唑和羟吲哚(参见p.s.sharma,r.sharma,r.tyagi,curr.cancerdrugtargets[当代癌症药物靶标]8(2008)53-75)。在一个实施例中,所述cdk4/6抑制剂是帕博西尼(辉瑞公司(pfizer)的商品名第一次批准的)(1)帕博西尼所述商业形式是用于口服施用的胶囊形式的游离碱。在美国专利6,936,612中公开了所述化合物,所述专利通过引用并入本文。ibrance的推荐剂量为125mg胶囊,每天口服一次,持续21天,然后停药7天,以构成一个28天的完整周期。ibrance与下列药物组合可治疗hr阳性、her2阴性的晚期或转移性乳腺癌:--在绝经后女性中作为初始内分泌疗法的芳香酶抑制剂;或者--内分泌治疗后有疾病进展的女性中的氟维司群。在另一个实施例中,所述cdk4/6是瑞博西尼(诺华公司(novartis)的商品名第二次批准的)。(2)瑞博西尼(kisqali)指定与作为初始内分泌疗法的芳香酶抑制剂组合,用于治疗具有激素受体(hr)阳性、人表皮生长因子受体2(her2)阴性晚期或转移性乳腺癌的绝经后女性。kisqali的推荐剂量为口服600mg(三片200mg的薄膜包衣片剂),每天一次,持续21天,然后停药7天,构成一个28天的完整周期。在整个28天的周期中,kisqali与来曲唑2.5mg共同施用,每天一次。呈用于口服施用的片剂形式的kisqali是可商购的。所述商业盐形式是瑞博西尼琥珀酸盐。瑞博西尼被公开为美国专利8,415,355的实例74。瑞博西尼琥珀酸盐形式描述于美国专利9,193,732中,所述专利通过引用并入本文。在又另一个实施例中,所述cdk4/6抑制剂是玻玛西尼(礼来公司(lilly),作为第三次市场准入将很快获得批准)。(3)玻玛西尼(礼来公司(elililly)的ly2835219)芳香酶抑制剂:可以使用任何芳香酶抑制剂。在一个实施例中,所述芳香酶抑制剂是来曲唑(其是一种非甾体抑制剂)。在另一个实施例中,所述芳香酶抑制剂可以是阿那曲唑(anastrazole)(也是非甾体抑制剂)或依西美坦(不可逆类甾体抑制剂)癌症:本发明可用于预后目的和/或可用于选择将从特定治疗中受益的患有癌症的患者。任何癌症都可以根据本发明的方法来筛选,且包括但不限于结肠癌、肺癌、胰腺癌、胃癌(gastriccancer)、前列腺癌和肝细胞癌、基底细胞癌、乳腺癌、骨肉瘤、软组织肉瘤、慢性髓性白血病、急性髓性白血病、血液学癌症、成神经管细胞瘤、横纹肌肉瘤、神经母细胞瘤、胰腺癌、乳腺癌、脑膜瘤、胶质母细胞瘤、星形细胞瘤、黑色素瘤、胃癌(stomachcancer)、食道癌、胆道癌、前列腺癌、小细胞肺癌、非小细胞肺癌、神经胶质细胞癌、多发性骨髓瘤、结肠癌、神经外胚层肿瘤、神经内分泌肿瘤、肥大细胞瘤和基戈林综合征(gorlinsyndrome)。在一个特定实施例中,所述癌症是乳腺癌。在一个实例中,所述癌症是转移性乳腺癌。在另一个实例中,所述乳腺癌是原发性乳腺癌。在另一个实例中,所述乳腺癌来自hr阳性、her2阴性的患者,或hr阳性、her2阴性、绝经后的患者,或hr阳性、her2阴性的患者在一个实施例中,所述患有乳腺癌的患者是hr阳性、her2阴性的。在另一个实施例中,所述患有乳腺癌的患者是hr阳性、her2阴性、绝经后的患者。在又一个实施例中,所述患有乳腺癌的患者是hr阳性、her2阴性、绝经前的患者。样品制备可以使用取自患有增殖性疾病的个体的任合合适的细胞测试样品。一般地,细胞测试样品或组织样品会通过活检或手术切除从癌症受试者获得。细胞、组织或液体的样品可通过针抽吸活检而取出。因此,通过皮肤插入连接到注射器的针并插入目标组织中。所述针通常使用超声或计算机断层扫描(ct)成像引导至目的区域。一旦针插入组织,用注射器创建真空,从而使细胞或液体可经针吸入并收集于注射器中。细胞或组织的样品还可通过切口活检或芯活检而取出。为此,从目的区域取出圆锥形、圆柱形或少量组织。一般使用ct成像、超声或内窥镜来引导此类活检。更具体地,完整癌病变可通过切除活检或手术切除来移出。本发明中,所述测试样品通常是作为手术切除的一部分而移出的细胞样品。例如组织的测试样品也可以存储在例如rnalater(ambion公司;奥斯汀(austin),德克萨斯州(tex.))中,或快速冷冻并存储在-80℃供以后使用。所述活检组织样品还可用固定剂(如甲醛、多聚甲醛或乙酸/乙醇)固定。固定的组织样品可包埋于蜡(石蜡)或塑料树脂中。包埋的组织样品(或冷冻组织样品)可切成薄切片。还可以从固定或蜡包埋的组织样品或冷冻的组织样品中提取rna或蛋白质。一旦细胞样品或组织样品从癌症受试者中移出,则可以使用本领域熟知的且如下文所述的技术对其进行处理以分离rna或蛋白质。从取自癌症患者的活检中提取rna的实例可以包括例如硫氰酸胍裂解,然后进行cscl离心(chirgwin等人,biochemistry[生物化学]18:5294-5299,1979)。可按照从单细胞制备cdna文库的方法中所述,获得来自单细胞的rna(参见例如dulac,curr.top.dev.biol.[发育生物学当前议题]36:245,1998;jena等人,j.immunol.methods[免疫学方法杂志]190:199,1996)。在一个实施例中,可针对如表1和表2所详述的目标序列富集rna群。例如,可通过随机六聚体和引物特异性cdna合成、或多轮基于cdna合成和模板导向体外转录的线性扩增来完成富集(参见例如wang等人,proc.natl.acad.sci.usa[美国国家科学院院刊]86:9717,1989;dulac等人,同上;jena等人,同上)。表达谱可在取自受试者的活检(例如新鲜组织、冷冻组织、在福尔马林(ffpe)或其他固定剂中处理的组织)上进行。患有肿瘤或癌症的受试者通常是哺乳动物受试者,例如灵长类动物。在一个示例性实施例中,所述受试者是人。可以根据本发明的方法筛选任何癌症或肿瘤。生物标志物的表达的检测在一个实例中,所述方法包括确定基因ccna2、ccne1、cdk2、cdk4、cdkn1a、cdkn2b、cdkn2c、e2f1、e2f3和rb1中的一种或多种或基因产物的表达水平。目标基因序列可使用以下试剂来检测,所述试剂可用于特异性检测所述基因的(例如从所述基因转录的rna或由所述基因编码的多肽)的表达水平。可以使用本领域任何已知的方法进行从给定基因转录的mrna序列的分析,包括但不限于rna印迹分析、核酸酶保护测定(npa)、原位杂交、逆转录聚合酶链反应(rt-pcr)、rt-pcrelisa、基于taqman的定量rt-pcr(基于探针的定量rt-pcr)、nanostring和基于sybrgreen的定量rt-pcr。在一个实例中,mrna水平的检测涉及使分离的mrna与寡核苷酸接触,所述寡核苷酸可与由ai应答标志物编码的mrna杂交。核酸探针通常可以是例如全长cdna或其一部分,如长度为至少7个、15个、30个、50个或100个核苷酸并且足以在严格条件下与mrna特异性杂交的寡核苷酸。mrna与探针的杂交表明所述标志物正在被表达。在一种形式中,rna例如通过以下方式固定在固体表面上并与探针接触:使分离的rna运行琼脂糖凝胶,并将mrna从凝胶转移到膜(例如硝化纤维素)上。扩增引物被定义为一对核酸分子,其可以退火成基因的5'或3'区退火(分别为正链和负链,反之亦然),并且在其间含有短区域。通常,扩增引物的长度为约10至30个核苷酸,并且侧翼是长度为约50至200个核苷酸的区域。在适当的条件下并用适当的试剂,这种引物允许扩增包含侧翼为引物的核苷酸序列的核酸分子。pcr产物可以通过任何合适的方法检测,包括但不限于凝胶电泳和用dna特异性染色进行的染色或与标记的探针杂交。在一个实施例中,所述方法包括:提供包含核苷酸序列(例如至少10、15、25或40个核苷酸,以及多至全部或几乎全部编码序列)的核酸探针,所述编码序列与ccna2、ccne1、cdk2、cdk4、cdkn1a、cdkn2b、cdkn2c、e2f1、e2f3和rb1中的一种或多种的核酸序列的部分编码序列互补;从有癌细胞的哺乳动物获得组织样品;使所述核酸探针在严格条件下与从取自癌症患者的活检获得的rna接触(例如,以rna印迹、原位杂交测定、pcr等);以及测定所述探针与rna杂交的量。在rna富集和/或扩增期间或之后,可标记核酸。所述生物标志物ccna2、ccne1、cdk2、cdk4、cdkn1a、cdkn2b、cdkn2c、e2f1、e2f3和rb1也意在包括天然存在的序列,所述天然存在的序列包含等位基因变体和其他家族成员。本发明的生物标志物还包括与列出的由密码子简并得到的那些序列互补的序列,具有足够同源性的序列,以及在严格条件下与本发明的基因杂交的序列。杂交条件是本领域技术人员已知的,且可以在currentprotocolsinmolecularbiology[当代分子生物学实验指南],约翰·威利父子出版社(johnwileyandsons),(1989),6.3.1-6.3.6中找到。高严格杂交条件的优选非限制性实例是在约45摄氏度下在6x氯化钠/柠檬酸钠(ssc)中杂交,然后在50-65摄氏度下在0.2xssc、0.1%sds中洗涤一次或多次。“足够同源”意指,某一生物标志物的氨基酸或核苷酸序列,其含有足够或最少数目的与第二氨基酸或核苷酸序列相同或等同(如有相似侧链的氨基酸残基)的氨基酸残基或核苷酸,使得第一和第二氨基酸或核苷酸序列共享共同的结构域或基序和/或共同的功能活性。例如,共享共同结构域且在结构域的氨基酸序列上具有至少约50%同源性、至少约60%同源性、至少约70%同源性、至少约80%同源性、和至少约90%-95%同源性的氨基酸或核苷酸序列在本文中被定义为足够同源。此外,具有至少约50%同源性、至少约60%-70%同源性、至少约70%-80%同源性、至少约80%-90%同源性、和至少约90%-95%同源性且共享共同功能活性的氨基酸或核苷酸序列在本文中被定义为足够同源。两种序列间的序列比较和百分比同源性测定可使用数学算法完成。用于序列比较的数学算法的一个优选非限制性实例是karlin和altschul(1990)proc.natl.acad.sci.usa[美国国家科学院院刊]87:2264-68的算法,其在karlin和altschul(1993)proc.natl.acad.sci.usa[美国国家科学院院刊]90:5873-77中被改良。将这种算法整合入altschul等人,(1990)j.moi.biol.[分子生物学杂志]215:403-10的nblast和xblast程序(2.0版)中。blast核苷酸搜索可用nblast程序进行,评分=100,字长=12,以获得与本发明的trl核酸分子同源的核苷酸序列。blast蛋白搜索可用xblast程序进行,评分=50,字长=3,以获得与由表1或表2中所列基因编码的蛋白质序列同源的氨基酸序列。为了获得用于比较目的的空位比对,可使用如altschul等人,(1997)nucleicacidsresearch[核酸研究]25(17):3389-3402所述的空位blast(gappedblast)。使用blast和空位blast程序时,可以使用相应程序(例如,xblast和nblast)的默认参数。参见http://www.ncbi.nlm.nih.gov。用于序列比较的数学算法的另一优选非限制性实例是myers和miller,cabios(1989)的align算法。使用align程序来比较氨基酸序列时,可以使用paml20权重残基表,空位长度罚分为12且空位罚分为4。本发明包括在取自患有癌症的受试者的肿瘤活检中测量一种或多种生物标志物ccna2、ccne1、cdk2、cdk4、cdkn1a、cdkn2b、cdkn2c、e2f1、e2f3和rb1的表达。可以分析表达水平并用于产生评分,所述评分可用于区分那些将受益于用cdk4/6抑制剂和芳香酶抑制剂的组合治疗的患有肿瘤的患者与那些受益于其他治疗(例如仅用芳香酶抑制剂治疗)的患者。在一个实施例中,本发明的方法包括测量表1中所列的ccna2、ccne1、cdk2、cdk4、cdkn1a、cdkn2b、cdkn2c、e2f1、e2f3和rb1中的任何一种。在另一个实施例中,本发明的方法包括测量来自表1中的至少两种、至少三种、至少四种、至少五种、至少六种、至少七种或至少八种基因、至少九种或至少10种生物标志物。在一个实例中,测量来自表1中的一种基因(例如ccna2)的表达水平。在另一个实例中,使用要求保护的方法,测量ccne1的表达水平。在又另一个实例中,使用要求保护的方法,测量cdk2的表达水平,等等。在另一个实例中,测量来自表1中的两种基因例如ccna2和ccne1的表达水平。在又另一个实例中,测量来自表1中的三种基因ccna2、ccne1和cdk2的表达水平。在又另一个实例中,测量来自表1中的四种基因ccna2、ccne1、cdk2和cdk4的表达水平。在又另一个实例中,测量来自表1中的五种基因ccna2、ccne1、cdk2、cdk4和cdkn1a的表达水平。在又另一个实例中,测量来自表1中的六种基因ccna2、ccne1、cdk2、cdk4、cdkn1a和cdkn2b的表达水平。在又另一个实例中,测量来自表1中的七种基因ccna2、ccne1、cdk2、cdk4、cdkn1a、cdkn2b和cdkn2c的表达水平。在仍又另一个实例中,测量八种基因ccna2、ccne1、cdk2、cdk4、cdkn1a、cdkn2b、cdkn2c和e2f1的表达水平。在又另一个实例中,测量九种基因ccna2、ccne1、cdk2、cdk4、cdkn1a、cdkn2b、cdkn2c、e2f1和e2f3的表达水平。在又另一个实例中,测量至少10种基因ccna2、ccne1、cdk2、cdk4、cdkn1a、cdkn2b、cdkn2c、e2f1、e2f3和rb1的表达水平。可以测量表1的基因的任何组合,并且相对于对照的表达增加表明应该选择该患者进行cdk4/6抑制剂(例如瑞博西尼)和芳香酶抑制剂(例如来曲唑)的组合治疗。基因名称登录号,unigeneidccna2,ugid:nm_001237ccne1,ugid:nm_001238cdk2,ugid:nm_001798cdk4,ugid:nm_000075cdkn1a,ugid:nm_000389cdkn2b,ugid:nm_004936cdkn2c,ugid:nm_001262e2f1,ugid:nm_005225rb1nm_000321e2f3nm_001949表1本发明的生物标志物还包括表1中所鉴定的基因的任何组合,其表达水平或基因产物作为预测性标志物或生物标志物。在本发明的方法中,测量并分析上述一种或多种基因的表达水平并用于产生评分,所述评分可用于选择那些预后良好的受试者或那些预后不良的受试者,和/或选择更可能受益于cdk4/6抑制剂和芳香酶抑制剂的组合治疗的患者。可替代地,表2中列出的生物标志物可用于选择最可能受益于用cdk4/6抑制剂和芳香酶抑制剂治疗的患者。基因名称登录号,unigeneide2f3nm_001949cdkn2anm_000077表2在本发明的方法中,测量每种生物标志物的表达,且通常在通过单个对照基因的表达水平标准化后将其转换为表达值。然后使用这些表达值产生评分,然后将所述评分与截止值进行比较以选择预后良好或预后不良的受试者,和/或选择更可能受益于用cdk4/6抑制剂和芳香酶抑制剂组合治疗的患者。本发明的生物标志物可使用本领域已知的任何方法(例如反转录酶pcr(rt-pcr))进行测量。所述方法包括使用本领域已知的任何技术来分离mrna,例如通过使用来自商业制造商(例如凯杰公司(qiagen))的纯化试剂盒、缓冲液组和蛋白酶。逆转录步骤通常根据环境和表达谱分析的目标使用特异引物、随机六聚体或寡dt引物引发,然后所得cdna可用作后续pcr反应的模板。然后,可以例如使用可商购的设备进行taqman(r)rt-pcr。rt-pcr技术的最新变化是实时定量pcr,其通过双标记的荧光探针(例如使用taqman(r)探针)测量pcr产物的积累。实时pcr与定量竞争pcr和定量比较pcr都相容,前者中使用各靶序列的内部竞争物进行标准化,后者利用样品中所含的标准化基因或用于rt-pcr的管家基因。更多详述参见例如held等人,genomeresearch[基因组研究]6:986-994(1996)。在另一个实例中,使用包括与基因ccna2、ccne1、cdk2、cdk4、cdkn1a、cdkn2b、cdkn2c、e2f1、e2f3和rb1中的一种或多种对应的一个或多个探针的微阵列。上述方法在阵列表面生成经标记的靶核酸的杂交模式。所得的经标记核酸的杂交模式可通过多种方法可视化或检测,特定检测方式根据靶核酸的特定标记进行选择。代表性检测方式包括闪烁计数、放射自显影、荧光测量、热量测定、光发射测量、光散射等。在另一个实例中,可使用包括与基因ccna2、ccne1、cdk2、cdk4、cdkn1a、cdkn2b、cdkn2c、e2f1、e2f3和rb1中的一种或多种对应的一个或多个探针的低密度阵列(tlda)卡。该方法使用微流体卡,所述微流体卡同时执行实时pcr反应。在一个实例中,检测方法利用可商购的阵列扫描仪(昂飞公司(affymetrix),圣克拉拉(santaclara),加利福尼亚州),例如417.tm.阵列器、418.tm.阵列扫描仪或agilentgenearray.tm.扫描仪。该扫描仪由具有接口和易于使用的软件工具的系统计算机控制。输出可通过多种软件应用来直接导入或直接读取。扫描设备描述于例如美国专利号5,143,854和5,424,186中。如本文所用,用于比较的对照可由本领域技术人员确定。一方面,通过选择某一值作为截止值来确定对照。例如,所述值可以是在例如具有本发明的生物标志物的表达增加的那些测试样品与没有显示出表达增加的那些测试样品之间进行区分的值。在另一个实例中,将本发明的生物标志物的基因表达谱与对照(在取自健康人的样品中存在所述生物标志物的表达)进行比较。检测生物标志物基因产物的表达检测由ccna2、ccne1、cdk2、cdk4、cdkn1a、cdkn2b、cdkn2c、e2f1、e2f3和rb1中的一种或多种编码的蛋白产物的存在可以通过使用本领域已知的任何合适方法完成。例如,可用来检测特定目标蛋白的目标试剂,如使用抗体。用于产生可特异性结合本发明所使用的多肽的多克隆和/或单克隆抗体的方法是本领域技术人员已知的,并且可见于例如dymecki等人(j.biol.chem.[生物化学杂志]267:4815,1992);boersma和vanleeuwen(j.neurosci.methods[神经科学方法杂志]51:317,1994);green等人(cell[细胞]28:477,1982);和arnheiter等人(nature[自然]294:278,1981)。在一个实施例中,可使用免疫测定来定量细胞样品中的蛋白水平。本发明不限于特定测定程序,因此意在包括同类和非同类程序。可根据本发明进行的示例性免疫测定包括荧光偏振免疫测定(fpia)5、荧光免疫测定(fia)、酶免疫测定(eia)、抑制免疫散射浊度测定(nia)、酶联免疫吸附测定(elisa)和放射免疫测定(ria)。指示部分或标记基团可与主题抗体相连,并进行选择以满足对所述方法的多种用途的需求,所述用途通常由测定设备的可用性和相容免疫测定程序决定。用于完成上述各种不同免疫测定的一般技术是本领域普通技术人员已知的。可替代地,也可以使用其他方法,如蛋白质印迹分析,其包括在聚丙烯酰胺凝胶上电泳分离蛋白,并且在对分离的蛋白染色后,通过评价其光密度来定量各蛋白的相对量。可替代地,可使用其他方法,如点印迹测定、facs或免疫组织化学法。通常,针对本发明的生物标志物而生成的抗体可用于可视化目标蛋白的存在,所述目标蛋白可以被标记,例如使用报告分子(例如荧光团、酶、生物素、化学发光分子、生物发光分子、地高辛、抗生物素蛋白、链霉抗生物素蛋白或放射性同位素)。在又另一个实施例中,本发明考虑使用针对本发明的标志物多肽而产生的抗体组。数据分析为利于样品分析操作,可以使用数字计算机来分析通过读取器从装置获得的数据。通常,所述计算机进行适当编程以从所述装置接收和保存数据,以及分析和报告集成数据,例如减去背景、验证对照执行正确、标准化信号、解释荧光数据以确定杂交靶标的量、标准化背景等。具体地,结果可以以可传输的信息形式传播,所述信息可以传达或传输给其他研究人员或医生或遗传咨询师或患者。这种形式可以变化,并且可以是有形的或无形的。测试个体的结果可以以描述性陈述、图解、照片、图表、图像或任何其他视觉形式呈现。例如,pcr产物的凝胶电泳的图像可以用于解释所述结果。有关基因表达水平和蛋白质水平的陈述也可用于表明测试结果。这些陈述和视觉形式可以记录在有形介质上,如纸、计算机可读介质(如软盘、光盘等),或者记录在无形介质上,例如电子邮件形式的电子介质或互联网或内联网上的网站。另外,结果还可以以声音形式记录,并通过任何合适的介质(例如模拟或数字电缆线路、光纤电缆等)经由电话、传真、无线移动电话、网络电话等传输。所有这种形式(有形和无形)都将构成“可传输形式的信息”。因此,可以在世界的任何地方产生关于测试结果的信息和数据并将其传输至不同的位置。例如,当在离岸进行的测定中检测mrna水平时,可以用上述可传输形式产生并计算关于测试结果的信息和数据。可传输形式的测试结果因此可以输入至美国。因此,本公开也涵盖在癌症患者中产生可传输形式的信息的方法,所述信息含有生物标志物的表达水平和/或生物标志物蛋白/活性的水平。这种形式的信息可用于预测癌症患者的应答,以根据该信息选择疗程,以及根据该信息选择性地治疗患者。试剂盒本发明进一步提供用于确定本文所述生物标志物表达水平的试剂盒。所述试剂盒可用于确定谁将从用cdk4/6抑制剂和芳香酶抑制剂的治疗受益。试剂盒可以包含表1中所鉴定基因的探针,可用于测量测试样品的基因表达。在一个实施例中,所述试剂盒包含计算机可读介质,所述介质包括可被载入计算机系统内存并将所测表达值转变成风险评分的表达谱分析软件。试剂盒进一步包含核酸对照、缓冲液和使用说明书。施用cdk4/6可以通过本领域已知的任何常规和可接受的方式以治疗有效量单独或与一种或多种治疗剂例如芳香酶抑制剂(例如来曲唑)的组合施用。治疗有效量可广泛地改变,这取决于疾病的严重程度、受试者的年龄和相对健康状况、所使用化合物的效力和其他因素。本发明的方法可用于选择那些将从用cdk4/6抑制剂和芳香酶抑制剂(例如来曲唑)的组合治疗中受益最大的癌症患者(乳腺癌患者)。所述治疗剂cdk4/6抑制剂和芳香酶抑制剂可以为呈一个剂量单位形式的固定组合或成套试剂盒以组合施用,其中所述cdk4/6抑制剂和所述芳香酶抑制剂可同时独立地施用或在时间间隔内分开施用。本领域技术人员将认识到与本文所述的方法和材料类似或等同的许多方法和材料可以用于本发明的实践中。实际上,本发明决不限于所述的方法和材料。实例实例1:monaleesa-2,一种lee011与来曲唑组合用于治疗激素受体阳性、her2阴性、晚期乳腺癌的绝经后女性的随机双盲、安慰剂对照研究,这些女性先前未接受过针对晚期疾病的治疗。方法图:研究设计–clee011a2301研究研究参与者所述患者人群由hr阳性、her2阴性、晚期乳腺癌的绝经后女性组成,这些女性先前未接受过针对晚期乳腺癌的治疗。主要纳入标准如下:·知情同意的成年绝经后女性(≥18岁)。·患有晚期(局部复发性或转移性)乳腺癌的女性不宜接受治疗疗法。·绝经后状态由以下任一项定义:-既往双侧卵巢切除-年龄≥60-年龄<60岁并且闭经12个月或更长时间(在没有化学疗法、他莫昔芬(tamoxifen)、托瑞米芬(toremifen)或卵巢抑制的情况下),并且促卵泡激素(fsh)和雌二醇在每个局部正常范围的绝经后范围内。·本地实验室对雌激素受体(er)阳性和/或孕激素受体阳性的乳腺癌的组织学和/或细胞学确认。·诊断为her2阴性乳腺癌的患者,其被定义为原位杂交测试阴性或免疫组织化学(ihc)状态为0、1+或2+。如果ihc为2+,则需要通过本地实验室试验进行阴性原位杂交(荧光原位杂交[fish]、染色体原位杂交[cish]或银增强原位杂交[sish])测试。患者具有以下任一项:·可测量的疾病,即,根据recist1.1标准进行的至少一个可测量的病变(如果明确记录了治疗完成后治疗部位的疾病进展,则仅对先前接受过辐照或接受过其他局部区域治疗的肿瘤病变视为可测量)或者·至少一个主要的溶骨性病变(如果有证据表明辐照后所述骨病变的疾病进展,则先前接受过辐照的只有一个主要溶骨性病变的患者是合格的)。·ecog体能状态0或1主要排除标准是:·先前接受过任何cdk4/6抑制剂的患者。·患有炎性乳腺癌的患者。·先前接受过任何针对晚期乳腺癌的全身性抗癌疗法(包括激素疗法和化学疗法)的患者·接受过针对乳腺癌的(新)辅助疗法的患者符合条件。如果先前的新(辅助)疗法包括来曲唑或阿那曲唑,则无病间隔时间从治疗完成到随机分组必须大于12个月。在随机分组之前接受过针对晚期疾病的≤14天的来曲唑或阿那曲唑的患者是被允许的。·在随机分组之前,任何先前的(新)辅助抗癌疗法都必须停止至少5个半衰期或7天(以较长者为准)·目前正在接受其他抗癌治疗的患者。·患有中枢神经系统(cns)转移的患者。·患有活动性心脏病或有心脏功能障碍病史的患者,包括以下任一情况:-入选研究前12个月内有心绞痛、症状性心包炎或心肌梗塞病史-有记录的充血性心力衰竭史(纽约心脏协会功能分类iii-iv)-有记录的心肌病-如通过多门控采集(muga)扫描或超声心动图(echo)确定的左心室射血分数(lvef)<50%-在过去的12个月中有任何心律失常(例如心室心律失常、室上性心律失常、节结性心律失常)或传导异常的病史。-在筛选时,以下任何心脏参数:心动过缓(静止时心率<50)、心动过速(静止时心率>90)、脉率间隔>220msec、qrs间隔>109msec或qtcf>450msec。-收缩压>160或<90mmhg。·当前正在接受以下任何药物并且无法在治疗开始之前的七天内停药的患者:o已知的cyp3a4/5的强诱导剂或抑制剂。o那些有延长qt间期或诱发尖端扭转室性心动过速(torsadesdepointes)的已知风险的药物。o那些具有狭窄的治疗窗并且主要通过cyp3a4/5代谢的药物。o草药制剂/药物。o膳食补充剂(维生素除外)。·在开始药物研究之前,当前正在接受或在≤2周内接受过全身性皮质类固醇的患者,或尚未从此类治疗的副作用中完全康复的患者。注意:允许使用以下皮质类固醇:单剂量局部应用(例如,用于皮疹)、吸入型喷雾剂(例如,用于阻塞性气道疾病)以及滴眼剂或局部注射剂(例如,关节内注射剂)。治疗组a:瑞博西尼(600mg,每天一次,在28天周期的第1-21天)+来曲唑(2.5mg,每天一次,在28天周期的第1-28天)。组b:安慰剂(每天一次,在28天周期的第1-21天)+来曲唑(2.5mg,每天一次,持续性地在28天周期的第1-28天)。可以将瑞博西尼/安慰剂的剂量减少至400mg(第一次减少)和200mg(第二次减少),而研究中并未计划对来曲唑进行剂量调整。患者接受研究治疗,直到疾病进展、不可接受的毒性、死亡或由于任何其他原因终止研究治疗。目标主要目标根据研究者的审查,主要目标是比较用瑞博西尼和来曲唑治疗的患者与用安慰剂和来曲唑治疗的患者的无进展存活期(pfs)。次要目标这项研究的主要次要目标是比较两个治疗组的总体存活期(os)。其他次要目标为:-评估两个治疗组的总体应答率(orr)和临床受益率(cbr)。-评估两个治疗组的东部肿瘤协作组(ecog)体能状态恶化的时间。-评估瑞博西尼与来曲唑的组合的安全性和耐受性。-评估两个治疗组中针对健康相关的生活质量(qol)的患者报告结果(pro)。探索性目标应答时间、应答持续时间、瑞博西尼和来曲唑的暴露、组合疗法与单一疗法对雌二醇抑制的效果、暴露-应答关系、医院资源利用、信号传导途径改变、循环dna、抗性机制。结果/终点通过研究者使用recist1.1版标准对放射学数据进行审查来确定pfs。在最初的18个月中,每8周进行一次肿瘤评估(静脉造影或无静脉造影的ct结合mri、视觉评估、影像学检查),并且此后每12周进行一次肿瘤评估直至疾病进展和治疗结束。pfs被定义为从随机分组之日到首次记录到疾病进展或因任何原因死亡之日的时间。不将非recist进展终止视为pfs事件。如果患者开始其他抗肿瘤治疗或缺少两次或更多次肿瘤评估,则无论后续事件如何,在最后一次充分的肿瘤评估中均会审查pfs。使用盲目性独立审查委员会(birc)来审查放射学(和影像学)数据。在研究开始时,birc由一名放射学读片人和一名肿瘤医师组成,他们将审查所有数据来选择无法完全确认放射学进展的患者。关于患者管理的决定仍由研究者负责。总体存活期(os)是主要的次要终点。总体存活期(os)被定义为从随机分组之日到因任何原因死亡之日的时间。其他次要疗效变量是orr、cbr和ecog体能状态。根据recist1.1,orr被定义为具有确认的cr或pr的最佳总体应答的患者的比例,并且根据recist1.1标准,cbr被定义为具有确认的cr或pr的最佳总体应答或稳定疾病(sd)持续24周或更长时间的患者的比例。用使用欧洲癌症研究与治疗组织(eortc)qlq-c30(3.0版)调查表和疾病特异性乳腺癌模型(eortcqlq-br23,1.0版)以及euroqol5级仪器(eq-5d-5l,4.0版)来评估患者报告结果(pro),以探讨对健康相关的生活质量、功能、疾病症状和治疗相关的副作用的影响。样品量最初计划随机选取500名患者。在一项研究方案修订案(2014年11月25日,第2次修订)中,为了更好地表征瑞博西尼和来曲唑对总体存活期的影响,将所述研究的样品量增加到650。据估计,对照组(安慰剂加来曲唑)中pfs的中位持续时间将为9.0个月,而用测试治疗组(瑞博西尼加来曲唑)进行治疗将使风险率降低33%(对应于中位pfs增加至13.43个月)。如果真实风险率是0.67(在替代假设下),则要求总共302个pfs事件在单侧总显著性水平为2.5%下具有93.5%的效能,才能使用时序检验以及用确定期中分析的疗效边界的haybittle-peto进行的2-看成组序贯设计(2-lookgroupsequentialdesign)来拒绝无效假设(hr=1)。考虑到以37名患者/月的统一速率下的大约16个月的募集期,需要将592名患者以1:1的比例随机分组到两个治疗组。假设约10%的患者会因pfs而失访,则需要对总共650名患者进行随机分组。根据上述假设,估计从研究中第一名患者被随机分组之日开始约20个月会观察到第302个pfs事件。在仅来曲唑组中的中位os被预计为约34个月。假设测试治疗组(瑞博西尼加来曲唑)可使总体存活的风险率降低28%(对应于中位存活期增加至47.2个月)。如果真实风险率是0.72(在替代假设下),则需要观察到总共400例死亡在单侧总显著性水平为2.5%下具有90%的功效,才能使用时序检验和4-看成组序贯设计来拒绝无效假设(hr=1)。随机分组将符合条件的患者使用irt系统以1:1的比例随机分组。将随机分配通过存在肝和/或肺转移(是与否)来进行分层。盲法(遮蔽)双盲研究。统计方法这是一项优势试验,能够检测出(至少)对应于中位pfs为13.43个月(实验组)与9个月(对照组)的差异,其概率为93.5%(hr0.67,单侧总显著性水平为2.5%,时序检验)。这还涉及具有针对优势的期中分析的2-看成组序贯设计。所述期中分析计划将在约211个事件之后执行,要求p<0.0000129以得出优势结论,而最终分析计划在302个事件之后进行,需要p值为0.02499进行显著性统计。假设实验组的中位os为47.2个月,而对照组为34个月(hr为0.72),则需要400个90%效能的事件才能检测出差异(单侧总显著性水平为2.5%,时序检验,4-看成组序贯设计)。计划在76例(期中pfs分析)、120例(最终pfs分析)、300例和400例死亡之后进行四次os分析。研究者和患者将保持对研究治疗不知情,并且将继续随访所有患者以获取os直到进行最终os分析(或者如果在任何期中分析中os达到统计学显著性,则更早)。当仅在主要疗效终点pfs具有统计学显著性时对os进行统计评估的情况下,才使用分级测试策略控制总体i型错误率。所有功效分析均使用全分析集(fas)(其包括所有随机分组的患者)进行。根据意向性治疗原则,根据随机分配的治疗和分层来分析患者数据。功效分析包括在来自fas的患者中观察到的所有数据,无论是在治疗中观察到的还是在研究治疗中断后直至分析截止日观察到的。作为支持性分析,使用来自利用fas的birc评估的数据以及使用与主要分析相同的约定来重复主要pfs分析。计划进行几项敏感性分析以评估主要疗效结果的总体稳健性。这些分析包括使用“符合方案集(perprotocolset)”、未分层的时序检验和不同的检查规则来重复主要功效分析。结果参加流程实例2:样品收集与获取对由临床研究场所提供的福尔马林固定的石蜡包埋的(ffpe)组织肿瘤组织样品进行了生物标记物分析。分析方法总结:通过nanostring技术进行基因表达使用由技术公司(technologies,inc.)提供的反向基因表达测定法,其旨在为遍及所有生物学表达水平的基因表达谱分析提供超灵敏、可重现和高度多样的方法。所述方法允许用称为ncounter报告探针的分子条码来直接检测mrna,而无需使用逆转录或扩增。所述ncountergx人类癌症参考试剂盒(nanostring公司,目录号150091)是具有230个与人类癌症相关的基因和六个内部参考基因的综合集合。这些基因代表了广泛的癌症相关过程。rna提取将包含大于或等于10%肿瘤含量(如通过病理学家对苏木精和曙红(h&e)染色的邻近组织切片进行审查而确定的)的每个样品切成四到八个5±1μm的ffpe切片。使用tissue-tekprisma自动染色仪对切片进行脱蜡,并根据病理学家对h&e染色的组织切片进行审查时指定的肿瘤区域进行宏观解剖。按照制造商的说明,使用针对qiagenrneasyffpe试剂盒的手动旋转方法从组织碎片中提取rna。提取后,使用nanodrop8000分光光度计对rna进行定量。nanostring反应装置根据nanostring方案,使用传统试剂,制备杂交反应用于进行基因表达,使用最小起始rna输入量为50ng,最大体积为10μl。杂交在65℃下进行20±4小时,在这之后纯化样品并使用nanostringgen2准备台和数字分析仪进行分析。nanostring数据分析对于每个样品,都从nanostringgen2数字分析仪获得包含原始计数数据的rcc文件(.rcc),并将其加载到nanostringnsolvertmv1.1上进行数据处理。使用nsolvertmv1.1的阳性对照归一化功能,对所有通过质量控制标准的样品进行ercc阳性对照数据归一化。将根据供应商规格得到的ercc阳性对照归一化值转移到临床数据库中进行进一步分析。所述分析集包括来自clee011a2301/monaleesa-2研究中具有nanostring评估的itt(意向性治疗)患者的410名患者。进行亚组分析以鉴定单个基因的基线rna基因表达是否与瑞博西尼治疗功效相关。根据每个单个基因的中位表达水平,将患者分为高(>中位)和低(<=中位)生物标志物亚组。在每个亚组中估计了两个治疗组的中位无进展存活期(pfs)的卡普兰-迈耶估计值。使用根据irt(交互应答技术)通过肝和/或肺转移而分层的cox比例风险模型来计算每个亚组中瑞博西尼600mg+来曲唑2.5mg与安慰剂+来曲唑2.5mg的风险率以及95%置信区间。使用时序检验来检验治疗和基因表达亚组之间的存活分布差异。评估了直接参与细胞周期进展的以下基因的功效(pfs)和基因表达的相关性。这些基因是:cdkn1a、cdkn2a、cdkn2b、cdkn2c、ccnd1、ccnd2、ccnd3、ccna2、e2f1、e2f3、tfdp1和rb1。如下所示,这些对上述cdk4/6途径相关的生物标志物的探索性分析表明,所有患者均受益于瑞博西尼和来曲唑的组合治疗。仅使用来曲唑的组的pfs随着这些生物标志物中的几种而变化,但是,瑞博西尼和来曲唑的组合始终改善了pfs。表3:通过nanostring技术测量的指定单个基因的pfs与mrna表达水平的关联的亚组分析。mrna的低水平和高水平通过每个基因的中位截止值定义。研究结果表明,相比于仅用来曲唑治疗,当用瑞博西尼和来曲唑组合治疗时,具有特定生物标志物标签(即表1所示的一种或多种生物标志物的增加)的特定患者的无进展存活的机会增加。实例3:用于基因标签产生的方法描述将cox比例风险模型与以下进行拟合:治疗、作为研究分层因素的肝/肺转移、16种基因(包括ccna2、ccnd1、ccnd2、ccnd3、ccne1、cdk2、cdk4、cdk6、cdkn1a、cdkn2a、cdkn2b、cdkn2c、e2f1、e2f3、rb1和tfdp1)的作用、以及通过治疗相互作用的基因。进行了向后模型选择,以选择与无进展存活期(pfs)显著相关的拟合变量。通过向后模型选择来鉴定模型中具有通过治疗相互作用的重要基因的基因组(cdkn2a和e2f3)。计算所有样品的标签评分作为基因表达值的加权总和,其中权重是在cox比例风险模型中通过治疗相互作用的各个基因的回归系数。使用中位标签评分作为截止值,将患者分为高和低亚组。计算每个患者亚组的中位pfs和风险率以及95%置信区间。结果:使用向后模型选择,获得了2基因的标签(cdkn2a和e2f3)。图1q和表4是亚组分析结果,高和低基因标签表达组由作为截止值的中位标签评分定义。瑞博西尼=lee表4当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1