具有高稳定性的可光裂解的核苷酸试剂的制作方法
发明领域
本发明提供了稳定的核苷酸试剂、其制备方法、其使用方法以及包含它们的试剂盒。所述核苷酸试剂可用于许多重组dna技术,尤其是通过聚合酶链反应(pcr)进行的核酸扩增。
发明背景
核酸扩增试剂一般包含温度敏感组分,且因此必须经常在远低于环境温度的温度贮藏和运输。脱氧核苷三磷酸或其核糖核苷三磷酸类似物的情况尤其如此。这些试剂易于通过从末端丧失连续的磷酸基团而降解,从而导致二磷酸核苷和核苷一磷酸的形成,它们都不再作为核酸聚合酶的底物具有活性。通过酯化末端磷酸可以显著提高核苷多磷酸的稳定性。例如,γ-甲基-dntp类似物在足以完全降解正常dntps的热应激条件下是完全稳定的。然而,末端磷酸的酯化可能会对这些核苷酸充当某些聚合酶的有效底物的能力具有负面影响。存在具有既是热稳定的又最初作为底物无活性但容易通过简单步骤活化的核苷三磷酸的需要。
发明概述
本发明提供了用于通过pcr和rt-pcr(逆转录酶-pcr)进行核酸扩增的热稳定核苷酸试剂,其包含具有可光裂解(photocleavable)部分的经修饰的核苷多磷酸。本发明还提供了在扩增反应中使用经修饰的核苷三磷酸检测靶核酸序列在样品中的存在或不存在的方法。
因此,在一个方面,本发明涉及一种检测样品中靶核酸序列的存在或不存在的方法,该方法包括进行扩增步骤,其包括使所述样品与扩增试剂接触以产生扩增产物,如果所述靶核酸序列存在于所述样品中的话,和检测所述扩增产物,其中所述扩增试剂包含具有可光裂解部分并具有以下结构的经修饰的核苷三磷酸:
其中碱基是嘌呤或嘧啶碱基或类似物。在一个实施方案中,在扩增步骤之前,用具有能够裂解可光裂解部分的波长的光照射所述经修饰的核苷多磷酸。在一些实施方案中,所述扩增试剂包含核酸聚合酶、缓冲液、核苷三磷酸、至少一种寡核苷酸引物、可检测地标记的寡核苷酸探针和/或染料中的至少一种。
在另一个方面,本发明涉及一种使用扩增试剂扩增靶核酸序列的方法,其中所述扩增试剂包含具有可光裂解部分并具有以下结构的经修饰的核苷三磷酸:
其中碱基是嘌呤或嘧啶碱基或类似物。在一个实施方案中,在扩增之前,用具有能够裂解可光裂解部分的波长的光照射所述经修饰的核苷三磷酸。在一些实施方案中,所述扩增试剂包含核酸聚合酶、缓冲液、核苷三磷酸、至少一种寡核苷酸引物、可检测地标记的寡核苷酸探针和/或染料中的至少一种。
在另一个方面,本发明涉及一种在扩增反应期间减少或防止核酸的非特异性扩增的方法,其包括提供用于扩增靶核酸的扩增试剂,其中所述扩增试剂包含具有可光裂解部分并具有以下结构的经修饰的核苷三磷酸:
其中碱基是嘌呤或嘧啶碱基或类似物。在一个实施方案中,在扩增之前,用具有能够裂解可光裂解部分的波长的光照射所述经修饰的核苷三磷酸。在一些实施方案中,所述扩增试剂包含核酸聚合酶、缓冲液、核苷三磷酸、至少一种寡核苷酸引物、可检测地标记的寡核苷酸探针和/或染料中的至少一种。
在另一个方面,本发明涉及一种组合物,其包含具有可光裂解部分并具有以下结构的经修饰的核苷三磷酸:
其中碱基是嘌呤或嘧啶碱基或类似物。在一个实施方案中,所述经修饰的核苷三磷酸的特征在于与未经修饰的核苷三磷酸相比具有更大的热稳定性。在一些实施方案中,所述组合物进一步包含至少一种扩增试剂,其选自核酸聚合酶、缓冲液、核苷三磷酸、至少一种寡核苷酸引物、可检测地标记的寡核苷酸探针和/或染料。
在另一个方面,本发明提供了一种试剂盒,其包含根据本公开内容的经修饰的核苷三磷酸,并进一步包含进行扩增反应所必需的试剂。在一些实施方案中,所述试剂包含核酸聚合酶、缓冲液、核苷三磷酸、至少一种寡核苷酸引物、可检测地标记的寡核苷酸探针和/或染料中的至少一种。
在发明详述中和在附图中更详细地描述了本发明的实施方案和优点。
附图简述
图1显示了可光裂解的核苷三磷酸,苯硫基邻硝基苯基丙基dntp的结构和一般概念。
图2显示了已知的可光裂解的(d)ntps的分子结构。
图3是苯硫基邻硝基苯基丙基datp(datp-sph-npp)的制备的示意图。
图4显示了与常规datp相比,苯硫基邻硝基苯基丙基datp(datp-sph-npp)的热稳定性。将样品暴露于65℃达最多到120小时。
图5显示了与dmnpe-atp(一种商购可得的可光裂解的核苷酸)相比,于室温在100mm磷酸盐缓冲液,ph7.0中用led紫外线闪光灯对苯硫基邻硝基苯基丙基datp(datp-sph-npp)的光裂解(photocleavage)。
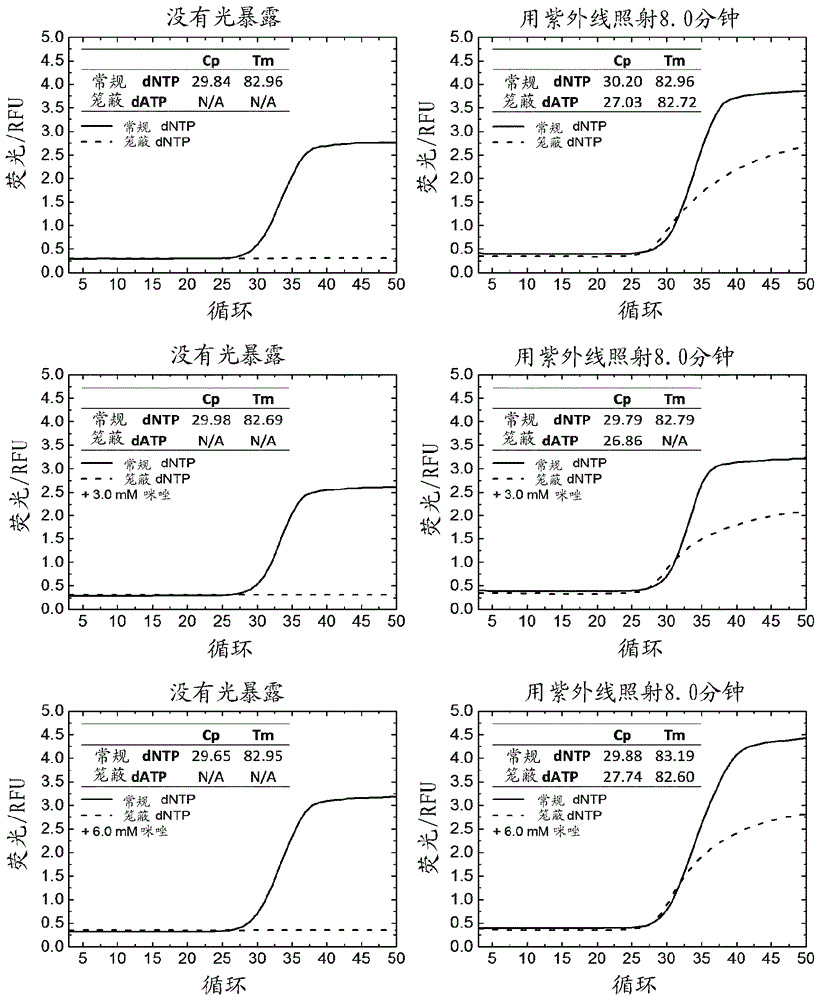
图6显示了在没有(左列的图)和有(右列的图)向紫外线暴露8分钟的情况下用常规dgtp、dctp、dutp和笼蔽datp-sph-npp进行的pcr扩增反应的结果。
发明详述
本发明提供了具有可光裂解部分的热稳定的经修饰的核苷三磷酸、其制备方法、其使用方法以及包含它们的试剂盒。这些热稳定的经修饰的核苷三磷酸可用于许多重组dna技术,尤其是通过聚合酶链反应(pcr)进行的核酸扩增。
定义
除非另外定义,否则在本文中使用的所有技术和科学术语都具有与本发明所属领域的普通技术人员通常理解的相同的意义。尽管基本上与本文描述的那些相似的任何方法和材料都可以用在本发明的实践或试验中,但是仅仅描述了示例性的方法和材料。对本发明来说,下列术语定义如下。
术语“一个(a)”、“一种(an)”和“所述(the)”包括复数对像,除非上下文另外清楚地指出。
术语“环境温度”表示周围的温度,并且当表示控温室内建筑物的温度时与“室温”同义。一般,环境温度表示在15℃至25℃之间的温度范围,尽管稍微更冷的或更暖的温度仍然可以被视为在环境温度的范围内。
在本文中使用的术语“可光裂解部分”在文献中具有几个同义词,并且也可以称为“可光除去的(photoremovable)基团”、“光封闭(photoblocking)基团”、“光触发物(phototriggers)”、“笼蔽化合物”、“光不稳定的基团”和其它类似的术语。采用可光裂解部分的一个优点是通过以高选择性地暂时封闭或掩蔽其功能来控制反应的能力。可以选择可光裂解部分以用某种波长的光从核苷三磷酸裂解,即,去偶,例如在约200nm至约450nm之间,例如在约200nm至约300nm之间,或例如,在约280nm至约315nm之间,或例如,在约300nm至约400nm之间,或例如,在约315nm至约415nm之间的波长。在所述波长的上下文中,术语“约”可以精确地包括所述波长,并且还包括具有所述波长加上或减去1nm、2nm、3nm、4nm或5nm的波长。因此,当向经修饰的核苷三磷酸引入(例如通过照耀或闪光)适当波长的光时,可光裂解部分被裂解,这除去核酸聚合酶加工中的空间或其它干扰。光的引入可以是手动的或自动的。一旦引入光并除去可光裂解部分,恢复的核苷三磷酸就可以在pcr反应期间变成聚合酶的底物。
本文中使用的“重组体”表示已经通过重组方法有意地修饰的氨基酸序列或核苷酸序列。术语“重组核酸”在本文中是指最初在体外一般通过限制性内切核酸酶对核酸的操作形成的核酸,其呈在自然界中通常不存在的形式。因此,呈线性形式的分离的突变dna聚合酶核酸或通过连接通常不连接的dna分子在体外形成的表达载体都被认为是对本公开内容来说的重组体。应当理解,一旦重组核酸被制备并重新引入宿主细胞,它将非重组地复制,即,使用宿主细胞的体内细胞机构而不是体外操作;然而,这样的核酸一旦重组地产生,尽管其后非重组地复制,但仍然被认为是对本公开内容来说的重组体。“重组蛋白”是使用重组技术(即,通过上述重组核酸的表达)制备的蛋白。
当核酸放置成与另一个核酸序列在功能上关联时,所述核酸“可操作地连接”。例如,启动子或增强子与编码序列可操作地连接,如果其影响所述序列的转录的话;或核糖体结合位点与编码序列可操作地连接,如果其被定位以便促进翻译的话。
术语“宿主细胞”表示单细胞的原核生物和真核生物(例如,细菌、酵母和放线菌)以及当在细胞培养物中培养时来自高等植物或动物的单个细胞。
术语“载体”表示一段dna,一般是双链的,其可以已经插入一段外源dna。载体可以是例如质粒起源的。载体含有促进载体在宿主细胞中的自主复制的“复制子”多核苷酸序列。外源dna被定义为异源dna,其是在宿主细胞中天然不存在的dna,其例如,复制载体分子,编码选择性或筛选性标记,或者编码转基因。载体用于将外源的或异源的dna运输进合适的宿主细胞中。一旦在宿主细胞中,载体就可以独立于宿主染色体dna复制或与宿主染色体dna同时复制,并且可以产生载体和它的插入的dna的几个拷贝。另外,载体还可以含有允许插入的dna转录为mrna分子或者以其它方式使插入的dna复制为rna的多个拷贝的必需元件。一些表达载体另外含有在插入的dna附近的序列元件,其增加表达的mrna的半衰期和/或允许所述mrna翻译为蛋白分子。因此,可以迅速地合成由插入的dna编码的mrna和多肽的许多分子。
“扩增试剂”是使得能够扩增核酸的化学或生化组分。这样的试剂包含,但不限于核酸聚合酶、缓冲液、单核苷酸诸如核苷三磷酸、寡核苷酸例如如寡核苷酸引物、盐和它们各自的溶液、检测探针、染料等。
如本领域已知的,“核苷”是碱基-糖组合。核苷的碱基部分通常是杂环碱基。这样的杂环碱基的两个最常见的种类是嘌呤和嘧啶。
“核苷酸”是进一步包含与核苷的糖部分共价连接的磷酸基团的核苷。对于包含呋喃型戊糖基糖的那些核苷,磷酸基团可以连接至所述糖的2'-、3'-或5'-羟基部分。核苷酸是“寡核苷酸”(其可以更一般地表示为“寡聚化合物”)或“多核苷酸”(更一般地表示为“多聚化合物”)的单体单元。前述物质的另一种一般表述是脱氧核糖核酸(dna)和核糖核酸(rna)。
“寡聚化合物”是由“单体单元”组成的化合物,所述“单体单元”可以是单独的核苷酸或单独的非天然化合物(见下文),更具体地是经修饰的核苷酸(或核苷酸类似物)或非核苷酸化合物,或其组合。
“寡核苷酸”和“经修饰的寡核苷酸”(或“寡核苷酸类似物”)是寡聚化合物的亚组。术语“寡核苷酸”表示从多个作为其单体单元的核苷酸形成的组分。磷酸基团通常被称为形成寡核苷酸的核苷间主链。rna和dna的正常键或主链是3'至5'磷酸二酯键。如大体上在本领域中描述的和本领域的专家已知的,可以合成寡核苷酸和经修饰的寡核苷酸(见下文)。用于制备特定序列的寡聚化合物的方法是本领域已知的,并且包括例如合适序列的克隆和限制以及直接化学合成。化学合成方法可以包括例如由narangs.a.等人,methodsinenzymology68(1979)90-98描述的磷酸三酯方法、由browne.l.,等人,methodsinenzymology68(1979)109-151公开的磷酸二酯方法、在beaucage等人,tetrahedronletters22(1981)1859中公开的亚磷酰胺方法、在garegg等人,chem.scr.25(1985)280-282中公开的h-膦酸酯方法以及在us4,458,066中公开的固体支持体方法。
在上述的方法中,寡核苷酸可以经过化学修饰,即引物和/或探针包含经修饰的核苷酸或非核苷酸化合物。然后,探针或引物是经修饰的寡核苷酸。
“经修饰的核苷酸”(或“核苷酸类似物”)与天然核苷酸的不同之处在于某种修饰,但是仍然由碱基、呋喃型戊糖基糖、磷酸部分、碱基样、呋喃型戊糖基糖样和磷酸样部分或其组合组成。例如,可以将标记附着于核苷酸的碱基部分,由此获得经修饰的核苷酸。核苷酸中的天然碱基也可以用例如7-脱氮嘌呤置换,由此也获得经修饰的核苷酸。
属于寡聚化合物的另一个特定亚组的“经修饰的寡核苷酸”(或“寡核苷酸类似物”)具有一个或多个核苷酸和一个或多个经修饰的核苷酸作为单体单元。因而,术语“经修饰的寡核苷酸”(或“寡核苷酸类似物”)表示以与寡核苷酸基本上相似的方式起作用的结构,并且可以在本公开内容的上下文中互换使用。从合成的观点看,例如通过对磷酸主链、核糖单元或核苷酸碱基的适当修饰来化学修饰寡核苷酸,可以制备经修饰的寡核苷酸(或寡核苷酸类似物)(uhlmann和peyman,chem.rev.90(1990)543;vermas.,和ecksteinf.,annu.rev.biochem.67(1998)99-134)。代表性修饰包括用硫代磷酸酯、二硫代磷酸酯、甲基膦酸酯、磷酸三酯或氨基磷酸酯核苷间键代替磷酸二酯核苷间键;用脱氮或氮杂嘌呤和嘧啶代替天然的嘌呤和嘧啶碱基,在第5位或第6位具有取代基的嘧啶碱基;在第2位、第6位或第8位或第7位(如7-脱氮嘌呤)具有改变的取代基的嘌呤碱基;携带烷基-、链烯基-、链炔基或芳基-部分(例如低碳烷基如甲基、乙基、丙基、丁基、叔丁基、戊基、己基、庚基、辛基、壬基、癸基或芳基基团如苯基、苄基、萘基)的碱基;在例如其2'位置具有取代基的糖;或碳环或无环糖类似物。其它修饰是本领域技术人员已知的。这样的经修饰的寡核苷酸(或寡核苷酸类似物)最好被描述为与天然寡核苷酸在功能上可互换,但是在结构上不同。更详细地,示例性的修饰公开在vermas.,和ecksteinf.,annu.rev.biochem.67(1998)99-134或wo02/12263中。另外,可以做出这样的修饰,其中核苷单元经由取代核苷间磷酸或糖磷酸键的基团连接。这样的键包括在vermas.,和ecksteinf.,annu.rev.biochem.67(1998)99-134中公开的那些。当利用磷酸键以外的键来连接核苷单元时,这样的结构也已经被描述为“寡核苷”。
“核酸”以及“靶核酸”是如本领域的熟练专家已知的核苷酸的多聚化合物。“靶核酸”在本文中用于表示样品中应该分析(即应该确定其在样品中的存在、不存在和/或量)的核酸。
术语“引物”在本文中如本领域的熟练专家已知的那样使用,且指能够引发通过模板依赖性dna聚合酶的dna合成的寡聚化合物,主要指寡核苷酸,但也指经修饰的寡核苷酸,即例如引物的3’-端提供游离的3’-oh基团,可以通过确立3'-至5'-磷酸二酯键的模板依赖性dna聚合酶向其附着进一步的核苷酸,由此使用脱氧核苷三磷酸且由此释放焦磷酸盐。
“探针”也表示天然的或经修饰的寡核苷酸。如本领域已知的,探针符合检测分析物或扩增物(amplificate)的目的。在上述的方法的情况下,可以使用探针来检测靶核酸的扩增物。为此目的,探针一般携带标记。
“标记”经常被称作“报道基团”,通常是这样的基团:其使与其结合的核酸,特别是寡核苷酸或经修饰的寡核苷酸,以及任何核酸与样品的剩余部分可区分开(已经附着标记的核酸也可以被称作标记的核酸结合化合物、标记的探针或仅探针)。示例性的标记是荧光标记,其是例如荧光染料如荧光素染料、罗丹明染料、花菁染料和香豆素染料。示例性的荧光染料是fam、hex、ja270、cal635、香豆素343、quasar705、cyan500、cy5.5、lc-red640、lc-red705。
任何引物和/或探针都可以经过化学修饰,即引物和/或探针包含经修饰的核苷酸或非核苷酸化合物。然后,所述探针或引物是经修饰的寡核苷酸。
一种核酸扩增方法是聚合酶链反应(pcr),其尤其公开在美国专利nos.4,683,202、4,683,195、4,800,159和4,965,188中。pcr一般采用两种或更多种结合选择的核酸模板(例如dna或rna)的寡核苷酸引物。对核酸分析有用的引物包括能够在靶核酸的核酸序列内充当核酸合成的起始点的寡核苷酸。引物可以通过常规方法从限制酶切消化纯化,或其可以合成地生产。所述引物可以是单链的以在扩增中实现最大效率,但是所述引物可以是双链的。首先将双链引物变性,即,处理以分离所述链。一种使双链核酸变性的方法是通过加热。“热稳定的聚合酶”是热稳定的聚合酶,即它是这样的酶,其催化与模板互补的引物延伸产物的形成,并且当经受升高的温度达实现双链模板核酸的变性所必需的时间时不会不可逆地变性。通常,合成在每种引物的3’端处起始,并且沿着模板链以5’至3’方向进行。热稳定的聚合酶已经例如分离自黄栖热菌(thermusflavus)、红栖热菌(t.ruber)、嗜热栖热菌(t.thermophilus)、水生栖热菌(t.aquaticus)、乳栖热菌(t.lacteus)、红色栖热菌(t.rubens)、嗜热脂肪芽孢杆菌(bacillusstearothermophilus)和炽热甲烷嗜热菌(methanothermusfervidus)。尽管如此,非热稳定的聚合酶也可以用在pcr测定中,只要补充所述酶即可。
如果模板核酸是双链的,在可以将它用作pcr中的模板之前必须分离两条链。链分离可以通过任意合适的变性方法完成,所述方法包括物理方式、化学方式或酶促方式。一种分离核酸链的方法涉及加热核酸直到它多数变性(例如,大于50%、60%、70%、80%、90%或95%发生变性)。使模板核酸变性所必需的加热条件将取决于例如缓冲液盐浓度以及正在变性的核酸的长度和核苷酸组成,但是取决于反应的特征如温度和核酸长度一般从约90℃一直到约105℃达一段时间。一般将变性执行约5秒至9分钟。为了不使各种聚合酶如例如z05dna聚合酶暴露于这样的高温太久和因而冒着丧失功能性酶的危险,使用短变性步骤可以是优选的。
如果通过加热使双链模板核酸变性,那么允许反应混合物冷却至这样的温度,其促进每条引物与它在靶核酸上的靶序列退火。
用于退火的温度可以是约35℃至约70℃,或约45℃至约65℃,或约50℃至约60℃,或约55℃至约58℃。退火时间可以是约10秒至约1分钟(例如约20秒至约50秒;约30秒至约40秒)。在该背景下,可以有利的是,使用不同的退火温度以便增加各个测定的包容性(inclusivity)。简而言之,这意味着,在相对低的退火温度,引物也可以结合具有单一错配的靶,所以也可以扩增某些序列的变体。如果例如某种生物具有也应该检测的已知或未知的遗传突变,那么这可以是期望的。另一方面,相对高的退火温度具有提供更高特异性的优点,这是因为朝向更高的温度,引物结合不完全匹配的靶序列的可能性持续下降。为了得益于这两种现象,在一些实例中,上述的方法包括在不同温度退火,例如,首先在较低温度,然后在较高温度。如果例如第一温育在55℃发生约5个循环,那么可以(预)扩增不完全匹配的靶序列。这后面可以是例如在58℃的约45个循环,从而贯穿实验的主要部分自始至终提供较高的特异性。这样,不会遗漏潜在重要的遗传突变,同时特异性保持相对高。
然后将反应混合物调节至促进或最优化聚合酶活性的温度,即,足以从退火引物发生延伸以生成与要分析的核酸互补的产物的温度。所述温度应该足以从与核酸模板退火的每条引物合成延伸产物,但是不应当高至使延伸产物从它的互补模板变性的程度(例如,用于延伸的温度通常从约40℃一直到80℃(例如,约50℃至约70℃;约65℃)。延伸时间可以是约10秒至约5分钟,或约15秒至2分钟,或约20秒至约1分钟,或约25秒至约35秒。新合成的链形成可以用在反应的随后步骤中的双链分子。可以如所需要的那样经常重复链分离、退火和延伸的步骤以产生期望的量的与靶核酸对应的扩增产物。在反应中的限制因子是存在于反应中的引物、热稳定的酶和核苷三磷酸的量。可以将所述循环步骤(即,变性、退火和延伸)重复至少一次。对于在检测中的使用,循环步骤的数目将取决于例如样品的特性。如果样品是核酸的复杂混合物,将需要更多的循环步骤来扩增足够用于检测的靶序列。通常,将循环步骤重复至少约20次,但是可以重复多达40、60或甚至100次。
可以进行pcr,其中退火和延伸的步骤在相同步骤中进行(一步pcr),或者如上所述,在分开的步骤中进行(两步pcr)。将退火和延伸一起并因而在相同的物理和化学条件下用合适的酶如例如z05dna聚合酶进行具有以下优点:节省每个循环中用于额外步骤的时间,并且还消除对退火和延伸之间的额外温度调节的需要。因而,一步pcr降低各个测定的总复杂性。
一般而言,总扩增的较短时间可以是优选的,因为达到结果的时间(time-to-result)缩短并导致可能更早的诊断。
要使用的其它核酸扩增方法包括连接酶链反应(lcr;wud.y.和wallacer.b.,genomics4(1989)560-69;和baranyf.,proc.natl.acad.sci.usa88(1991)189-193);聚合酶连接酶链反应(baranyf.,pcrmethodsandapplic.1(1991)5-16);缺口(gap)-lcr(wo90/01069);修复链反应(ep0439182a2);3sr(kwohd.y.等人,proc.natl.acad.sci.usa86(1989)1173-1177;guatellij.c.,等人,proc.natl.acad.sci.usa87(1990)1874-1878;wo92/08808);和nasba(us5,130,238)。进一步地,存在链置换扩增(sda)、转录介导的扩增(tma)和qb-扩增(关于综述,参见例如whelena.c.和persingd.h.,annu.rev.microbiol.50(1996)349-373;abramsonr.d.和myerst.w.,curropinbiotechnol4(1993)41-47)。
术语“cp值”或“交叉点(crossingpoint)”值表示允许输入靶核酸的定量的值。可以根据二阶导数最大值法确定cp值(vanluu-the,等人,“improvedreal-timert-pcrmethodforhigh-throughputmeasurementsusingsecondderivativecalculationanddoublecorrection,”biotechniques,第38卷,第2期,2005年2月,第287-293页)。在二阶导数方法中,cp对应于二阶导数曲线的第一个峰。这个峰对应于对数线性阶段(log-linearphase)的开始。二阶导数方法计算实时荧光强度曲线的二阶导数值,且仅获得一个值。原始cp方法基于强度值的局部地定义的可微分的近似,例如,通过多项式函数。然后计算三阶导数。cp值是三阶导数的最小根。还可以使用拟合点(fitpoint)法确定cp,其中通过在对数线性区域中平行线与阈值线的交叉点确定cp(vanluu-the,等人,biotechniques,第38卷,第2期,2005年2月,第287-293页)。根据二阶导数最大值法计算由roche提供的lightcycler仪器所提供的cp值。
术语“pcr效率”表示循环至循环扩增效率的指标。使用以下方程式计算每种条件的pcr效率:%pcr效率=(10(-斜率)-1)x100,其中斜率通过用y-轴上绘制的对数拷贝数(logcopynumber)和x-轴上绘制的cp的线性回归进行计算。可以使用完美匹配的或错配的引物模板测量pcr效率。
术语“fret”或“荧光共振能量转移”或“förster共振能量转移”表示至少两个生色团,供体生色团和接纳体生色团(被称作猝灭剂)之间的能量转移。当供体被具有适当波长的光辐射激发时,供体一般向接纳体转移能量。接纳体一般将转移的能量以具有不同波长的光辐射的形式再发射。当接纳体是“暗”猝灭剂时,它以除光以外的形式耗散转移的能量。特定的荧光团是充当供体还是接纳体取决于fret对的其它成员的性质。常用的供体-接纳体对包括fam-tamra对。常用的猝灭剂是dabcyl和tamra。常用的暗猝灭剂包括blackholequenchers™(bhq)(biosearchtechnologies,inc.,novato,cal.)、iowablack™(integrateddnatech.,inc.,coralville,iowa)和blackberry™quencher650(bbq-650)(berry&assoc.,dexter,mich.)。
上述的方法可以基于供体荧光部分和接纳体荧光部分之间的荧光共振能量转移(fret)。代表性的供体荧光部分是荧光素,且代表性的对应的接纳体荧光部分包括lc-red640、lc-red705、cy5和cy5.5。一般,检测包括在供体荧光部分吸收的波长激发样品,并显示和/或测量由对应的接纳体荧光部分发射的波长。在根据本公开内容的方法中,检测可以继之以定量fret。例如,在每个循环步骤以后执行检测。例如,实时执行检测。通过使用商购可得的实时pcr设备(例如,lightcycler™或taqman®),可以在具有显著地减少的循环时间的情况下在单个封闭的杯中组合pcr扩增和扩增产物的检测。由于检测与扩增同时发生,实时pcr方法消除了对扩增产物的操作的需要,并减小扩增产物之间交叉污染的危险。实时pcr大大地减少周转时间,并且是临床实验室中的常规pcr技术的有吸引力的替换物。
下述专利申请描述了如在lightcycler®技术中所用的实时pcr:wo97/46707、wo97/46714和wo97/46712。lightcycler®仪器是与利用高质量光学部件的微体积(microvolume)荧光计组合的快速热循环仪。该快速热循环技术使用薄玻璃杯作为反应容器。通过交替加热的空气和环境空气来控制反应室的加热和冷却。由于空气的低质量以及杯的表面积与体积的高比率,可以在热室内实现非常快速的温度交换速率。
taqman®技术利用被两个生色团部分标记的单链杂交探针。当第一荧光部分被合适波长的光激发时,所吸收的能量根据fret原理被转移至第二生色团。以这个形式使用的典型荧光染料是例如,尤其是,fam、hex、cy5、ja270、cyan和cy5.5。第二生色团通常是猝灭剂分子。在pcr反应的退火步骤过程中,标记的杂交探针结合靶核酸(即,扩增产物)并在后来的延伸阶段过程中通过taq或技术人员已知的另一种合适聚合酶如z05聚合酶变体的5’至3’外切核酸酶活性降解。结果,激发的荧光部分和猝灭剂部分变成在空间上彼此分离。因此,在没有猝灭剂的情况下激发第一荧光部分时,可以检测到来自第一荧光部分的荧光发射。
在上述的两种检测形式中,发射的信号的强度可以与原始靶核酸分子的数目有关。
作为fret的替换物,使用双链dna结合染料如荧光dna结合染料(例如,sybrgreeni®或sybrgold®(molecularprobes)),可以检测扩增产物。在与双链核酸相互作用时,这样的荧光dna结合染料在用合适波长的光激发后发射荧光信号。还可以使用双链dna结合染料如核酸嵌入染料。当使用双链dna结合染料时,通常执行解链曲线分析用于证实扩增产物的存在。
也可以使用连同fret一起的分子信标来检测使用本公开内容的实时pcr方法的扩增产物的存在。分子信标技术使用被第一荧光部分和第二荧光部分标记的杂交探针。所述第二荧光部分通常是猝灭剂,且所述荧光标记一般位于探针的每个末端处。分子信标技术使用具有允许二级结构形成(例如发夹)的序列的探针寡核苷酸。作为在探针内的二级结构形成的结果,当探针在溶液中时,两个荧光部分空间接近。在与扩增产物杂交以后,探针的二级结构被破坏,并且荧光部分变得彼此分离,从而使得在用合适波长的光激发后,可以检测第一荧光部分的发射。
因而,使用fret的上述方法在根据本公开内容的方法中,其中所述探针包含允许二级结构形成的核酸序列,其中所述二级结构形成导致所述第一和第二荧光部分之间的空间接近。
只有当荧光部分局部接近,并且当供体荧光部分的发射光谱与接纳体荧光部分的吸收光谱重叠时,有效的fret才发生。
因而,在一个实例中,所述供体和接纳体荧光部分在所述探针上在彼此的不多于5个核苷酸内。在进一步的实例中,所述接纳体荧光部分是猝灭剂。
如上所述,在taqman®形式中,在pcr反应的退火步骤过程中,标记的杂交探针结合靶核酸(即,扩增产物)并在后来的延伸阶段过程中通过taq或技术人员已知的另一种合适聚合酶如z05聚合酶变体的5’-至3’-外切核酸酶活性降解。因而,在一个实例中,在上述的方法中,扩增采用具有5’-至3’-外切核酸酶活性的聚合酶。
进一步有利的是,小心地选择作为上述方法的结果产生的扩增子的长度。通常,相对短的扩增子增加扩增反应的效率。因而,本公开内容的一个方面是上述的方法,其中扩增的片段包含最多到450个碱基、最多到300个碱基、最多到200个碱基或最多到150个碱基。
“序列”是核酸的一级结构,即组成各个核酸的单个核碱基(nucleobase)的特定排列。必须理解,术语“序列”不表示特定类型的核酸如rna或dna,而是适用于这两者以及其它类型的核酸,如例如肽核酸(pna)或其它。如相关领域中众所周知的,在核碱基彼此对应的场合,特别是在尿嘧啶(存在于rna中)和胸腺嘧啶(存在于dna中)的情况下,可以认为这些碱基在rna和dna序列之间是等同的。
临床上有关的核酸经常是dna,其可以源自dna病毒,如例如乙型肝炎病毒(hbv)、巨细胞病毒(cmv)等,或细菌,如例如砂眼衣原体(chlamydiatrachomatis)(ct)、淋病奈瑟氏球菌(neisseriagonorrhoeae)(ng)等。在这样的情况下,为了反映靶核酸性质,使用由dna组成的内部对照核酸可以是有利的。
术语“细胞”、“细胞系”和“细胞培养物”可以互换使用,且所有这样的名称都包括后代。因而,词语“转化体”或“转化的细胞”包括原代转化的细胞和不考虑转移的数目从该细胞衍生出的培养物。由于故意的或非故意的突变,所有后代可能在dna含量上不是精确地相同的。在转化体的定义中包括具有相同功能性的突变后代,如在最初转化的细胞中筛选的。所述细胞可以是原核的或真核的。
术语“控制序列”表示可操作地连接的编码序列在特定宿主生物中的表达所必需的dna序列。适合用于原核生物的控制序列例如包括启动子、任选的操纵基因序列、核糖体结合位点、正反向调控元件(positiveretroregulatoryelement)(参见美国专利no.4,666,848)和可能的其它序列。已知真核细胞利用启动子、多腺苷酸化信号和增强子。
术语“限制性内切核酸酶”和“限制酶”表示在特定核苷酸序列处或附近切割双链dna的酶,一般在起源上是细菌的。
在本文中定义了具有类似侧链的氨基酸残基的家族。这些家族包括具有碱性侧链(例如,赖氨酸、精氨酸、组氨酸)、酸性侧链(例如,天冬氨酸、谷氨酸)、非荷电的极性侧链(例如,天冬酰胺、谷氨酰胺、丝氨酸、苏氨酸、酪氨酸)、非极性侧链(例如,丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、甲硫氨酸、色氨酸、半胱氨酸、甘氨酸)、β-分支侧链(例如,苏氨酸、缬氨酸、异亮氨酸)和芳族侧链(例如,酪氨酸、苯丙氨酸、色氨酸、组氨酸)的氨基酸。
术语“试剂溶液”是含有至少一种试剂的任何溶液,所述试剂是pcr目的所需的或用于pcr目的。大多数典型成分是聚合酶、核苷酸、引物、二价金属离子(诸如镁)、盐、ph缓冲剂、核苷三磷酸(ntps)或脱氧核苷三磷酸(dntps)、一种或多种探针、荧光染料(可以附着至探针)、核酸结合剂以及一种或多种核酸模板。所述试剂还可以是另一种聚合酶反应添加剂,其对聚合酶反应或它的监控具有影响。
术语“主混合物(mastermix)”表示pcr发生所必需的所有或大部分成分或因子的混合物,且在一些情况下,除了样品和扩增子特异性的模板和引物以外的全部。商购可得的主混合物经常是浓缩的溶液。主混合物可以含有多种样品共有的所有试剂,但是它也可以仅为一种样品构建。使用主混合物有助于减小由于移液的体积之间的差异引起的样品之间的移液错误和变动。
术语“热稳定的聚合酶”表示这样的酶,其对热稳定,耐热,并且在经受升高的温度达变性双链核酸所必需的时间后保留足够的活性以实现后来的引物延伸反应。核酸变性所必需的加热条件是本领域众所周知的,并且在美国专利nos.4,965,188和4,889,818中举例说明。如本文中所使用的,热稳定的聚合酶适合用在温度循环反应如pcr中。热稳定的核酸聚合酶的例子包括水生栖热菌(thermusaquaticus)taqdna聚合酶、栖热菌属物种(thermussp.)z05聚合酶、黄栖热菌(thermusflavus)聚合酶、海栖热袍菌(thermotogamaritima)聚合酶如tma-25和tma-30聚合酶、tthdna聚合酶等。
“具有逆转录酶活性的聚合酶”是能够基于rna模板合成dna的核酸聚合酶。一旦rna已经逆转录成单链cdna,它也能复制单链或双链dna。在一个实例中,具有逆转录酶活性的聚合酶是热稳定的。
在dna聚合酶对rna分子的扩增中,第一延伸反应是使用rna模板的逆转录,并产生dna链。使用dna模板的第二延伸反应产生双链dna分子。因而,由dna聚合酶从rna模板合成互补的dna链提供用于扩增的原材料。
热稳定的dna聚合酶可以用于偶联的单酶逆转录/扩增反应中。在该背景下,术语“均质的”表示用于逆转录和扩增rna靶的两步单添加反应。均质的是指,在逆转录(rt)步骤以后,不需要在扩增步骤之前打开反应容器或以其它方式调节反应组分。在非均质的rt/pcr反应中,在逆转录之后和扩增之前,一种或多种反应组分例如扩增试剂被例如调节、添加或稀释,为此必须打开反应容器,或至少必须操纵它的内容物。均质的和非均质的反应都是本发明的公开内容的实例。
逆转录是rt/pcr中的重要步骤。例如,本领域已知,rna模板显示出形成二级结构的倾向,所述二级结构可能阻碍引物结合和/或相应的逆转录酶对cdna链的延伸。因而,就转录效率而论,相对高的rt反应温度是有利的。另一方面,升高温育温度也意味着更高的特异性,即rt引物将不与表现出与预期的一个或多个序列的错配的序列退火。特别地,在多个不同靶rnas的情况下,可能期望也转录和接着扩增和检测具有单个错配的序列,例如在流体样品中可能存在生物的未知的或罕见的亚系或亚种的情况下。
为了从上述两种优点(即二级结构的减少和具有错配的模板的逆转录)获益,可以在不止一种不同的温度进行rt温育。
因此,本公开内容的一个方面是上述的方法,其中所述具有逆转录酶活性的聚合酶的温育在从30℃至75℃或从45℃至70℃或从55℃至65℃的不同温度进行。
作为逆转录的进一步重要的方面,长的rt步骤可以损害在流体样品中可能存在的dna模板。如果流体样品含有rna和dna物类两者,那么因而有利的是保持rt步骤的持续时间尽可能短,但是同时确保合成足够量的cdna用于后来的扩增和任选的扩增物检测。
因而,本公开内容的一个方面是上述的方法,其中所述具有逆转录酶活性的聚合酶的温育的时间段是最多到30分钟、20分钟、15分钟、12.5分钟、10分钟、5分钟或1分钟。
本公开内容的进一步的方面是上述的方法,其中所述具有逆转录酶活性且包含序列变异的聚合酶选自:
a)cs5dna聚合酶
b)cs6dna聚合酶
c)海栖热袍菌(thermotogamaritima)dna聚合酶
d)水生栖热菌(thermusaquaticus)dna聚合酶
e)嗜热栖热菌thermusthermophilus)dna聚合酶
f)黄栖热菌(thermusflavus)dna聚合酶
g)丝状栖热菌(thermusfiliformis)dna聚合酶
h)栖热菌属物种(thermussp.)sps17dna聚合酶
i)栖热菌属物种z05dna聚合酶
j)那不勒斯栖热袍菌(thermotoganeapolitana)dna聚合酶
k)非洲栖热腔菌(termosiphoafricanus)dna聚合酶
l)thermuscaldophilusdna聚合酶
特别适合这些要求的是携带在聚合酶结构域中的序列变异的酶,所述序列变异就更快的延伸速率而论增强它们的逆转录效率。
因此,在上述的方法中,其中所述具有逆转录酶活性的聚合酶是与相应的野生型聚合酶相比具有提高的核酸延伸速率和/或提高的逆转录酶活性的聚合酶变体。
在一个实例中,在上述的方法中,所述具有逆转录酶活性的聚合酶是与相应的野生型聚合酶相比具有提高的逆转录酶活性的聚合酶变体。
在wo2008/046612中公开了携带单序列变异的聚合酶,所述单序列变异使它们是特别有用的。特别地,要使用的聚合酶可以是序列修饰的dna聚合酶,其在聚合酶结构域中至少包含下述基序:
t-g-r-l-s-s-xb7-xb8-p-n-l-q-n;其中xb7是选自s或t的氨基酸,且其中xb8是选自g、t、r、k或l的氨基酸,其中所述聚合酶包含3’-5’外切核酸酶活性,且与野生型dna聚合酶相比具有提高的核酸延伸速率和/或提高的逆转录效率,其中在所述野生型dna聚合酶中,xb8是选自d、e或n的氨基酸。
一个实例是来自栖热菌属物种z05的热稳定的dna聚合酶的变体(例如在us5,455,170中描述),与相应的野生型酶z05相比,所述序列在聚合酶结构域中变异。用于根据本公开内容的方法的一个实例是z05dna聚合酶变体,其中在位置580处的氨基酸选自g、t、r、k和l。
对于使用热稳定的聚合酶的逆转录,mn2+可以是二价阳离子,并且一般作为盐被包括,例如二氯化锰(mncl2)、乙酸锰[mn(oac)2]或硫酸锰(mnso4)。例如,如果在含有50mmn-[2-羟-1,1-二羟甲基乙基]甘氨酸(tricine)缓冲液的反应中包括mncl2,那么mncl2通常以0.5-7.0mm的浓度存在;当利用200µm的各dgtp、datp、dutp和dctp时,通常以2.5-3.5mm存在。
“经修饰的”热稳定的聚合酶表示其中至少一个单体不同于参照序列如所述聚合酶的天然或野生型形式或所述聚合酶的另一种修饰的形式的聚合酶。示例性修饰包括单体插入、缺失和取代。经修饰的聚合酶还包括嵌合聚合酶,其具有衍生自两个或更多个亲本的可鉴定的组分序列(例如,结构或功能结构域等)。在经修饰的聚合酶的定义内还包括包含参照序列的化学修饰的那些。经修饰的热稳定的聚合酶的例子包括g46ee678gcs5dna聚合酶、g46el329ae678gcs5dna聚合酶、g46el329ad640gs671fcs5dna聚合酶、g46el329ad640gs671fe678gcs5dna聚合酶、g46ee678gcs6dna聚合酶、z05dna聚合酶、δz05聚合酶、δz05-gold聚合酶、δz05r聚合酶、e615gtaqdna聚合酶、e678gtma-25聚合酶、e678gtma-30聚合酶等。
术语“热活性的(thermoactive)聚合酶”表示在确保特异性的引发和引物延伸所必需的升高的温度(例如,55-80℃)有活性的酶。
术语“肽”、“多肽”和“蛋白”可互换使用。术语“核酸”和“多核苷酸”可互换使用。除非另外指出,否则从氨基末端至羧基末端书写氨基酸序列。除非另外指出,否则从5'至3'书写单链核酸序列。除非另外指出,否则从5'至3'书写双链核酸序列的上链(topstrand),且从3'至5'书写下链(bottomstrand)。
核酸扩增试剂一般包含温度敏感组分,且因此必须经常在远低于环境温度的温度贮藏和运输。脱氧核苷三磷酸或其核糖核苷类似物的情况尤其如此。这些试剂易于通过从末端丧失连续的磷酸基团而降解,从而导致二磷酸核苷和核苷一磷酸的形成,它们都不再作为聚合酶底物具有活性。
通过酯化末端磷酸可以相当显著地提高核苷多磷酸的稳定性。例如,γ-甲基-dntp类似物在足以完全降解正常dntps的热应激条件下是完全稳定的。然而,末端磷酸的酯化可能会对核苷酸充当某些聚合酶的有效底物的能力具有负面影响。
本公开内容描述了改进的可光裂解的(“笼蔽”)核苷三磷酸(dntps)。在三磷酸的末端磷酸上接入苯硫基邻硝基苯基丙基(sph-npp)稳定dntps免于通过水解的缓慢降解。此外,sph-npp部分阻止酶如聚合酶的加工。用紫外线对这些化合物的照射不可逆地释放出游离的dntps并起始酶促反应(“光启动pcr”,参见图1)。这种策略抑制了起源于酶的残留室温活性的非特异性的pcr产物的形成。与其中由热激活酶的热启动pcr相对比,本文的反应通过光触发的dntp底物的释放来控制。
ghosn,等人,controlofdnahybridizationwithphotocleavableadducts,photochem.photobiol.,2005,81:953-959已经报道了可光裂解基团的附着,其中dna寡核苷酸的磷酸主链与可光裂解基团之间的酯键通过1-(4,5-二甲氧基-2-硝基苯基)-乙基酯(dmnpe)的中间性。更近,kretschy等人,angew.chem.int.ed.,2015,54z:8555-8559首次引入了已知的邻硝基苯基生色团的苯硫基延伸。其中,将苯硫基-2-(2-硝基苯基)-丙氧基羰基(sph-nppoc)用作用于光版印刷微阵列合成的亚磷酰胺上的5'-羟基保护基。sph-nppoc的光解释放出核苷、苯乙烯副产物,并且还会由于碳酸酯接头而释放出一摩尔的co2。与常规的2-(2-硝基苯基)-丙氧基羰基nppoc相比,sph-nppoc基团表现出光脱保护效率的12-倍增加(图2)。
本公开内容的sph-npp-dntps的稳定性尤其适合用于冷冻有限或冷冻不可用的位置。因此,与“常规”dntps相比,本公开内容的可光裂解的dntps可以贮藏更长的时间并且在高得多的温度贮藏。
给出以下实施例来举例说明本公开内容,因为它目前是优选实践的。将理解的是,所述实施例是举例说明的,并且除了如在所附权利要求中所指出的以外,本发明不应视作受到限制。
实施例
缩写:acn:乙腈;cdi:1,1’-羰基二咪唑;dmf:二甲基甲酰胺;dmso:二甲基亚砜;meoh:甲醇;tba:三丁基铵;tea:三甲胺;teaa:乙酸三乙铵;thf:四氢呋喃。
实施例1:苯硫基邻硝基苯基丙基datp(datp-sph-npp)的制备
datp-sph-npp的合成示意地显示在图3上并在这里简要描述。所有步骤在暗处进行。将phsnpp3oh
在ar气氛下溶解在thf(5ml,无水)中并冷却至0-4℃。添加220µltea(无水)和127µlpocl3并将反应搅拌18小时,用水(8ml)猝灭并搅拌1.5小时。将水相用乙酸乙酯萃取3次。将合并的有机相经na2so4干燥。在减压下除去溶剂。将残余物溶解在acn/h2o中并低压冻干以产生作为粘性树脂的200mgphsnpp3mp
将200mg原phsnpp3mp溶解在6mldmf(无水)中,添加cdi并将混合物在干燥条件下搅拌4小时。将过量的cdi用meoh猝灭并搅拌30分钟。添加52mgmgcl2和然后2.2当量的tba-adp溶液,并将反应搅拌3天。以1:1比例添加0.1mteaa缓冲液(ph4.1)。添加diaionhp20树脂,将混合物搅拌30分钟并过滤。将滤过物用水洗涤并将产物用meoh洗脱。然后将溶剂在真空中除去,将剩余的残余物溶解在水中并通过rp18-hplc纯化。将产物级分合并和低压冻干,以51%得率产生phsnpp3atp。
实施例2:使用datp-sph-npp的稳定性研究
制备了水性混合物,其含有300µmdatp-sph-npp、40%dmso和1.0m乙酸钾。作为参考,制备了另一种具有300µmdatp代替datp-sph-npp的混合物。将150µl每种混合物在thermoshaker中于65℃温育。在0、2、18、25和120小时以后,通过uplc-ms(超高效液相层析-质谱分析法)分析每种溶液(20µl)的样品。在260nm的峰面积用于计算原材料和降解产物的百分比。
结果:在所采用的条件下,datp快速地降解为单磷酸和二磷酸,如通过质谱分析法所确认的。datp-sph-npp的比datp显著更热稳定,并且在65℃达120小时未观察到datp-sph-npp的降解产物(图4)。
实施例3:datp-sph-npp的光裂解
在磷酸钠缓冲液(100mm,ph7.0)中制备了datp-sph-npp和atp-dmnpe的两种水性混合物(各300µm)。在没有摇动或搅拌的情况下,在敞口小瓶中同时用来自uv-led灯(ingan,量子阱(quantumwell),λmax=393nm,0.18w/led)的光照射两个样品。在0、1、2、4、8和16分钟后,简短地暂停照射以用于样品取出(20µl)和后来的uplc-ms分析。在260nm的峰面积用于计算原材料和光裂解产物的百分比。通过质谱分析法确认原材料和裂解产物的分子身份。
结果:通过照射datp-sph-npp达5分钟释放了不止>90%的datp,并且在8分钟内完成了完全裂解(图5)。datp-sph-npp的光裂解显著快于商购可得的atp-dmnpe(thermo-fisherscientific)。
实施例4:使用datp-sph-npp的扩增反应
通过合并被称为pcr主混合物(20µl)、缓冲液混合物(20µl)和dntp混合物(10µl)的三种组分来制备具有50µl总体积的实时pcr(taqman®pcr)混合物。所有pcr组分均由depc水制备。pcr主混合物含有n-[2-羟-1,1-二羟甲基乙基]甘氨酸缓冲液(ph8.2)、乙酸钾、甘油、dmso、去污剂、靶dna(400cp)、聚合酶适配体、探针、引物、sybr绿色染料和聚合酶。缓冲液混合物含有乙酸锰(8.3mm)和咪唑(0、3.0或6.0mm)。dntp混合物含有datp(400µm)、dctp(400µm)、dgtp(400µm)和dutp(800µm)。另一种dntp混合物含有datp-sph-npp(400µm)而不是datp。dna靶的终浓度是400cp/反应。
将具有同样组成的taqman®pcrs放在96-孔板的两个独立部分上。每个部分含有具有常规dntps的pcr混合物和含有datp-sph-npp的pcr混合物。一式三份地制备每个pcr。板的一个部分用铝箔覆盖,而另一部分于室温暴露于来自uv-led灯(ingan,量子阱,λmax=393nm,0.18w/led)的光达8.0分钟。后来,移去覆盖物,并用lightcycler480system使板经受pcr扩增循环和后来的dna解链。根据在cy5.5通道中收集的荧光数据进行pcr生长曲线的分析,而解链曲线的分析基于在fam通道(465-510nm)中收集的荧光数据。
结果:带有sph-npp的笼蔽datp阻止了pcr扩增(图6,左列的图;无紫外线暴露)。用紫外线照射8.0分钟和后来的pcr循环导致dna扩增(图6,右列的图)。咪唑的添加不显著影响pcr生长曲线的形状。
- 还没有人留言评论。精彩留言会获得点赞!