表达特异性地识别人间皮素的细胞表面分子、IL-7和CCL19的免疫活性细胞的制作方法
本发明涉及表达特异性地识别人间皮素(humanmesothelin)的细胞表面分子、白细胞介素7(interleukin-7:il-7)和趋化因子(c-c基序)配体19(chemokine(c-cmotif)ligand19:ccl19)的免疫活性细胞;含有该免疫活性细胞的药物组合物;包含编码特异性地识别间皮素的细胞表面分子的核酸、编码il-7的核酸和编码ccl19的核酸的表达载体;一种表达特异性地识别人间皮素的细胞表面分子、il-7和ccl19的免疫活性细胞的制作方法,其特征在于,将编码特异性地识别人间皮素的细胞表面分子的核酸、编码il-7的核酸和编码ccl19的核酸导入到免疫活性细胞中。
背景技术:
恶性肿瘤是在全世界有众多患者的疾病,通常广泛进行化学疗法、放射线疗法或外科疗法。但是,存在产生副作用、丧失部分功能、无法治疗复发或转移等各种问题。因此,为了进一步将患者的生活质量(qol)维持得较高,近年来,正在推进免疫细胞疗法的开发。该免疫细胞疗法是从患者采集免疫活性细胞、按照提高该免疫活性细胞的免疫功能的方式进行处置并扩增后再次移入患者的疗法。具体而言,已知从患者采集t细胞、向该t细胞中导入编码嵌合抗原受体(组成性雄甾烷受体,constitutiveandrostanereceptor;以下也称为“car”)的核酸并扩增后再次移入患者的疗法(参考非专利文献1)。该疗法目前正在全世界进行临床试验,并得到了在白血病、淋巴瘤等造血器官恶性肿瘤等中显示出有效性的结果。
另一方面,本发明人提出了通过同时表达il-7和ccl19来显著抑制实体癌的免疫细胞疗法(参考专利文献1、2)。通过该方法,能够提高内源性的免疫活性细胞的活化和向肿瘤细胞的聚集能力。
另外,已知间皮素在间皮瘤、大肠癌(直肠癌、结肠癌)、胰腺癌、卵巢癌、肺癌、乳腺癌、头颈癌等的癌细胞中表达。以该间皮素作为靶标的car-t细胞已被公开(参考专利文献3、4)。
现有技术文献
专利文献
专利文献1:国际公开第2016/056228号小册子
专利文献2:国际公开第2017/159736号小册子
专利文献3:美国专利申请公开第2014/0301993号说明书
专利文献4:日本特开2017-518053号公报
非专利文献
非专利文献1:中泽洋三信州医志61(4):197~203(2013)
技术实现要素:
发明所要解决的问题
如上所述,开发了使用同时表达il-7和ccl19的car表达t细胞、tcr表达t细胞等的免疫细胞疗法,并进行了显著提高免疫活性细胞的增殖能力、存活能力或宿主的免疫活性细胞的聚集能力,能够适应以往利用免疫细胞疗法未确认到充分的治疗效果的实体癌的技术的开发。另一方面,以在间皮瘤、胰腺癌等的癌细胞中高表达的间皮素作为靶标的car表达免疫活性细胞的开发中,现状是免疫活性细胞在癌局部的聚集不充分、抗肿瘤效果短、肿瘤有可能复发等,在临床结果方面也未得到令人满意的结果。因此,本发明的课题在于提供新的以间皮素作为靶标的免疫活性细胞。
用于解决问题的方法
本发明人研究了目前为止自行开发的表达car、il-7和ccl19的t细胞的进一步的可能性。结果发现,通过选择使用含有特定的氨基酸序列、并含有与人间皮素特异性地结合的单链抗体的car作为特异性地识别人间皮素的细胞表面分子,对表达间皮素的癌细胞具有细胞杀伤活性,并且能够抑制因由表达间皮素的癌细胞形成的肿瘤导致的存活率下降,从而完成了本发明。
即,本发明如下所述。
[1]一种免疫活性细胞,其表达特异性地识别人间皮素(humanmesothelin)的细胞表面分子、白细胞介素7(il-7)和趋化因子(c-c基序)配体19(ccl19)。
[2]如上述[1]所述的免疫活性细胞,其特征在于,其为从生物体中分离出来的免疫活性细胞。
[3]如上述[1]或[2]所述的免疫活性细胞,其特征在于,其含有外源性的编码特异性地识别人间皮素的细胞表面分子的核酸、外源性的编码il-7的核酸和外源性的编码ccl19的核酸。
[4]如上述[3]所述的免疫活性细胞,其特征在于,外源性的编码il-7的核酸和外源性的编码ccl19的核酸为外源性的编码人il-7的核酸和外源性的编码人ccl19的核酸。
[5]如上述[3]或[4]所述的免疫活性细胞,其特征在于,外源性的编码特异性地识别人间皮素的细胞表面分子的核酸、外源性的编码il-7的核酸和外源性的编码ccl19的核酸被整合到基因组中。
[6]如上述[1]~[5]中任一项所述的免疫活性细胞,其特征在于,特异性地识别人间皮素的细胞表面分子为具备单链抗体、跨膜区和诱导免疫活性细胞的活化的信号转导区的嵌合抗原受体(car)。
[7]如上述[6]所述的免疫活性细胞,其中,car中的单链抗体为下述中的任意一者:
(1-1)包含含有由序列号13所示的氨基酸序列构成的重链cdr1、由序列号14所示的氨基酸序列构成的重链cdr2和由序列号15所示的氨基酸序列构成的重链cdr3的重链可变区、以及含有由序列号16所示的氨基酸序列构成的轻链cdr1、由序列号17所示的氨基酸序列构成的轻链cdr2和由序列号18所示的氨基酸序列构成的轻链cdr3的轻链可变区的单链抗体;
(2-1)包含含有由序列号13所示的氨基酸序列构成的重链cdr1、由序列号14所示的氨基酸序列构成的重链cdr2和由序列号15所示的氨基酸序列构成的重链cdr3的重链可变区、以及由序列号19所示的氨基酸序列构成的轻链cdr1、由序列号17所示的氨基酸序列构成的轻链cdr2和由序列号18所示的氨基酸序列构成的轻链cdr3的轻链可变区的单链抗体;
(3-1)包含含有由序列号20所示的氨基酸序列构成的重链cdr1、由序列号21所示的氨基酸序列构成的重链cdr2和由序列号22所示的氨基酸序列构成的重链cdr3的重链可变区、以及由序列号23所示的氨基酸序列构成的轻链cdr1、由序列号24所示的氨基酸序列构成的轻链cdr2和由序列号25所示的氨基酸序列构成的轻链cdr3的轻链可变区的单链抗体。
[8]如上述[6]或[7]所述的免疫活性细胞,其中,car中的单链抗体为下述中的任意一者:
(1-2)包含由与序列号1所示的氨基酸序列具有85%以上的序列一致性的氨基酸序列构成的重链可变区和由与序列号2所示的氨基酸序列具有85%以上的序列一致性的氨基酸序列构成的轻链可变区的单链抗体;
(2-2)包含由与序列号3所示的氨基酸序列具有85%以上的序列一致性的氨基酸序列构成的重链可变区和由与序列号4所示的氨基酸序列具有85%以上的序列一致性的氨基酸序列构成的轻链可变区的单链抗体;
(3-2)包含由与序列号5所示的氨基酸序列具有85%以上的序列一致性的氨基酸序列构成的重链可变区和由与序列号6所示的氨基酸序列具有85%以上的序列一致性的氨基酸序列构成的轻链可变区的单链抗体;
(4-2)包含由与序列号1所示的氨基酸序列具有85%以上的序列一致性的氨基酸序列构成的重链可变区和由与序列号4所示的氨基酸序列具有85%以上的序列一致性的氨基酸序列构成的轻链可变区的单链抗体;
(5-2)包含由与序列号3所示的氨基酸序列具有85%以上的序列一致性的氨基酸序列构成的重链可变区和由与序列号2所示的氨基酸序列具有85%以上的序列一致性的氨基酸序列构成的轻链可变区的单链抗体。
[9]如上述[6]~[8]中任一项所述的免疫活性细胞,其中,car中的单链抗体为下述中的任意一者:
(1-3)包含由序列号1所示的氨基酸序列构成的重链可变区和由序列号2所示的氨基酸序列构成的轻链可变区的单链抗体;
(2-3)包含由序列号3所示的氨基酸序列构成的重链可变区和由序列号4所示的氨基酸序列构成的轻链可变区的单链抗体;
(3-3)包含由序列号5所示的氨基酸序列构成的重链可变区和由序列号6所示的氨基酸序列构成的轻链可变区的单链抗体;
(4-3)包含由序列号1所示的氨基酸序列构成的重链可变区和由序列号4所示的氨基酸序列构成的轻链可变区的单链抗体;
(5-3)包含由序列号3所示的氨基酸序列构成的重链可变区和由序列号2所示的氨基酸序列构成的轻链可变区的单链抗体。
[10]如上述[6]~[9]中任一项所述的免疫活性细胞,其特征在于,car中的跨膜区包含与序列号7所示的氨基酸序列具有85%以上的序列一致性的氨基酸序列。
[11]如上述[6]~[10]中任一项所述的免疫活性细胞,其特征在于,car中的诱导免疫活性细胞的活化的信号转导区包含序列号8、9和10所示的氨基酸序列。
[12]如上述[7]~[11]中任一项所述的免疫活性细胞,其特征在于,重链可变区与轻链可变区借助由2~30个氨基酸的序列构成的肽接头而结合。
[13]如上述[12]所述的免疫活性细胞,其特征在于,肽接头由序列号26或序列号27所示的氨基酸序列构成。
[14]如上述[6]~[13]中任一项所述的免疫活性细胞,其中,car中的单链抗体为下述中的任意一者:
(1-4)依次包含由序列号1所示的氨基酸序列构成的重链可变区、由序列号26所示的氨基酸序列构成的肽接头和由序列号2所示的氨基酸序列构成的轻链可变区的单链抗体;
(2-4)依次包含由序列号3所示的氨基酸序列构成的重链可变区、由序列号26所示的氨基酸序列构成的肽接头和由序列号4所示的氨基酸序列构成的轻链可变区的单链抗体;
(3-4)依次包含由序列号2所示的氨基酸序列构成的轻链可变区、由序列号26所示的氨基酸序列构成的肽接头和由序列号1所示的氨基酸序列构成的重链可变区的单链抗体;
(4-4)依次包含由序列号1所示的氨基酸序列构成的重链可变区、由序列号27所示的氨基酸序列构成的肽接头和由序列号2所示的氨基酸序列构成的轻链可变区的单链抗体;
(5-4)依次包含由序列号2所示的氨基酸序列构成的轻链可变区、由序列号27所示的氨基酸序列构成的肽接头和由序列号1所示的氨基酸序列构成的重链可变区的单链抗体;
(6-4)依次包含由序列号5所示的氨基酸序列构成的重链可变区、由序列号26所示的氨基酸序列构成的肽接头和由序列号6所示的氨基酸序列构成的轻链可变区的单链抗体;
(7-4)依次包含由序列号6所示的氨基酸序列构成的轻链可变区、由序列号26所示的氨基酸序列构成的肽接头和由序列号5所示的氨基酸序列构成的重链可变区的单链抗体;
(8-4)依次包含由序列号5所示的氨基酸序列构成的重链可变区、由序列号27所示的氨基酸序列构成的肽接头和由序列号6所示的氨基酸序列构成的轻链可变区的单链抗体;
(9-4)依次包含由序列号6所示的氨基酸序列构成的轻链可变区、由序列号27所示的氨基酸序列构成的肽接头和由序列号5所示的氨基酸序列构成的重链可变区的单链抗体。
[15]如上述[6]~[14]中任一项所述的免疫活性细胞,其特征在于,car中的诱导免疫活性细胞的活化的信号转导区包含cd28的胞内区的多肽、4-1bb的胞内区的多肽和cd3ζ的胞内区的多肽。
[16]如上述[1]~[15]中任一项所述的免疫活性细胞,其特征在于,免疫活性细胞为t细胞。
[17]如上述[1]~[16]中任一项所述的免疫活性细胞,其特征在于,免疫活性细胞为来源于人的t细胞或从人分离出来的t细胞。
[18]一种药物组合物,其含有上述[1]~[17]中任一项所述的免疫活性细胞和药学上可接受的添加剂。
[19]如上述[18]所述的药物组合物,其用于癌症的治疗。
[20]一种表达载体,其含有编码特异性地识别人间皮素的细胞表面分子的核酸、编码il-7的核酸和编码ccl19的核酸。
[21]一种表达特异性地识别人间皮素的细胞表面分子、il-7和ccl19的免疫活性细胞的制作方法,其特征在于,将编码特异性地识别人间皮素的细胞表面分子的核酸、编码il-7的核酸和编码ccl19的核酸导入到免疫活性细胞中。
发明效果
本发明的免疫活性细胞具有表达人间皮素的癌细胞杀伤活性,能够抑制表达人间皮素的肿瘤形成。另外,本发明的免疫活性细胞还具有抑制癌细胞复发的效果。
附图说明
图1是示出在实施例1中制作的9种抗人间皮素scfv的配置(a)和氨基酸序列(b)的图。
图2是示出在实施例2中对抗人间皮素car-il-7/ccl19表达t细胞中的car的表达进行考察的结果的图。(a)是car、il-7和ccl19非表达t细胞(non-infection,非感染)的结果,(b)~(d)是分别具有vh07(15)vl07(信号肽t)、vh07(15)vl07(信号肽p)、vh36(15)vl36作为scfv区域的抗人间皮素car-il-7/ccl19表达t细胞的结果。
图3是示出在实施例2中对抗人间皮素car-il-7/ccl19表达t细胞中的car的表达进行考察的结果的图。(a)是car、il-7和ccl19非表达t细胞(non-infection,非感染)的结果,(b)~(e)是分别具有vh07(15)vl07、vl07(15)vh07、vh07(25)vl07、vl07(25)vh07作为scfv区域的抗人间皮素car-il-7/ccl19表达t细胞的结果。
图4是在实施例3中利用流式细胞仪对肿瘤细胞株中的间皮素的表达水平进行确认的图。
图5是实施例4中的抗人间皮素car-il-7/ccl19表达t细胞与间皮素阳性肿瘤细胞株或间皮素阴性肿瘤细胞株的共培养试验的说明图。
图6a是示出在实施例4中利用流式细胞术得到的残存的肿瘤细胞株acc-meso-1的测定结果的图。
图6b是示出在实施例4中利用流式细胞术得到的残存的肿瘤细胞株nci-h2052的测定结果的图。
图6c是示出在实施例4中利用流式细胞术得到的残存的肿瘤细胞株a498的测定结果的图。
图7a是示出在实施例4中抗人间皮素car-il-7/ccl19表达t细胞与间皮素阳性肿瘤细胞株acc-meso-1的共培养后的所产生的ifn-γ的测定结果的图。
图7b是示出在实施例4中抗人间皮素car-il-7/ccl19表达t细胞与间皮素阳性肿瘤细胞株nci-h2052的共培养后的所产生的ifn-γ的测定结果的图。
图7c是示出在实施例4中抗人间皮素car-il-7/ccl19表达t细胞与间皮素阴性肿瘤细胞株a498的共培养后的所产生的ifn-γ的测定结果的图。
图8是示出在实施例5中利用流式细胞术得到的残存的白细胞(lymphocytenumber,淋巴细胞数)或pan02肿瘤细胞株的测定结果的图。
图9是示出在实施例5中抗间皮素car-il-7/ccl19表达t细胞与pan02肿瘤细胞株的共培养后的所产生的ifn-γ的测定结果的图。
图10是示出在实施例6中通过对肿瘤模型小鼠给药间皮素car-小鼠il-7/小鼠ccl19表达小鼠t细胞而得到的存活率的结果的图。
图11是示出在实施例6中通过对肿瘤模型小鼠给药间皮素car-小鼠il-7/小鼠ccl19表达小鼠t细胞而得到的肿瘤的体积的测定结果的图。
图12a是示出在实施例7中将给药acc-meso-1-gfp-luc的那天作为第1天,以30秒的曝光时间对第1、3、7、10、14、21、31、38天的小鼠进行拍摄的结果的图。
图12b是示出在实施例7中将给药acc-meso-1-gfp-luc的那天作为第1天,以30秒的曝光时间对第45、59、73、87、101、115、129、143天的小鼠进行拍摄的结果的图。第129天的左起第2号个体死亡,因此省略照片。
图13是示出在实施例7中自给药起的天数与小鼠的存活率的关系的图。
图14是示出在实施例7中自给药起的天数与总荧光量的关系的图。
具体实施方式
本发明的免疫活性细胞只要是表达特异性地识别人间皮素的细胞表面分子、il-7和ccl19的免疫活性细胞即可,优选为含有外源性的编码细胞表面分子的核酸、外源性的编码il-7的核酸和外源性的编码ccl19的核酸的免疫活性细胞,通过该免疫活性细胞,能够抑制由表达人间皮素的癌细胞导致的肿瘤形成。
(人间皮素)
人间皮素为40kda的蛋白质,在正常细胞中几乎不表达,在间皮瘤、胰腺癌等的癌细胞中高表达。人间皮素的序列信息可以通过对公知的文献或ncbi(http://www.ncbi.nlm.nih.gov/guide/)等数据库进行检索而适当地获得。例如,作为人间皮素的氨基酸序列信息,可以列举genbank登录号np_037536.2、aav87530.1、它们的同种型等。
(细胞表面分子)
作为特异性地识别人间皮素的细胞表面分子,可以列举特异性地识别人间皮素的car、特异性地识别来自人间皮素的肽的t细胞受体(tcellreceptor:tcr)、与人间皮素特异性地结合的蛋白质或核酸等通过表达于细胞表面而赋予针对人间皮素的特异性识别能力的分子或因子。需要说明的是,car是使识别癌细胞的细胞表面抗原的单链抗体(singlechainfv:scfv)与诱导t细胞的活化的信号转导区融合而得到的人造嵌合蛋白质。
上述细胞表面分子优选通过信号肽(前导序列)而定位于免疫活性细胞的细胞表面。作为信号肽,可以列举来源于免疫球蛋白重链、免疫球蛋白轻链、cd8、t细胞受体的α、β链、cd3ζ、cd28、cd3ε、cd45、cd4、cd5、cd8、cd9、cd16、cd22、cd33、cd37、cd64、cd80、cd86、cd134、cd137、icos、cd154、gitr的信号肽(前导序列)的多肽。具体而言,可以列举由与序列号11或12所示的氨基酸序列具有85%以上、优选90%以上、更优选95%以上、进一步优选98%以上的序列一致性的氨基酸序列构成且具有与序列号11或12同等的作用的多肽;由在序列号11或12所示的氨基酸序列中缺失、置换、插入和/或添加了一个或几个氨基酸的氨基酸序列构成且具有与序列号11或12所示的氨基酸序列同等的作用的多肽。需要说明的是,在完成了定位的成熟蛋白质中,信号肽被除去。
本说明书中,“缺失、置换、插入和/或添加了一个或几个氨基酸残基的氨基酸序列”包含缺失、置换、插入和/或添加了例如1~30个的范围内、优选1~20个的范围内、更优选1~15个的范围内、进一步优选1~10个的范围内、进一步优选1~5个的范围内、进一步优选1~3个的范围内、进一步优选1~2个的范围内的数目的氨基酸残基的氨基酸序列。这些氨基酸残基的突变处理可以通过化学合成、基因工程方法、诱变等本领域技术人员已知的任意方法来进行。
本说明书中,术语“一致性”是指多肽或多核苷酸序列相似性的程度(该程度通过查询序列与其他优选相同的类型的序列(核酸或蛋白质序列)的匹配来确定)。作为计算和确定“一致性”的优选的计算机程序法,可以列举例如gcgblast(basiclocalalignmentsearchtool,基本局部比对搜索工具)(altschuletal.,j.mol.biol.1990,215:403-410;altschuletal.,nucleicacidsres.1997,25:3389-3402;devereuxetal.,nucleicacidres.1984,12:387)、以及blastn2.0(gishw.,http://blast.wustl.edu,1996-2002)、以及fasta(pearson和lipman,proc.natl.acad.sci.usa1988,85:2444-2448)、以及确定和比对最长重复的一对重叠群的gcggelmerge(wibur和lipman,siamj.appl.math.1984,44:557-567;needleman和wunsch,j.mol.biol.1970,48:443-453)。
(特异性地识别人间皮素的单链抗体)
在细胞表面分子为car的情况下,优选含有特异性地识别人间皮素的单链抗体(scfv)作为特异性地识别人间皮素的分子。该特异性地识别人间皮素的单链抗体中,特异性地识别人间皮素的抗体的重链可变区(vh)和轻链可变区(vl)通过用于连接上述重链可变区和上述轻链可变区的肽接头而结合即可。作为该特异性地识别人间皮素的单链抗体中的重链可变区与轻链可变区的组合,可以列举例如下述的组合。需要说明的是,相对于重链可变区,轻链可变区可以位于上游(n末端侧),也可以位于下游(c末端侧)。
(1-1)含有由序列号13所示的氨基酸序列构成的重链cdr(complementaritydeterminingregion,互补决定区)1、由序列号14所示的氨基酸序列构成的重链cdr2和由序列号15所示的氨基酸序列构成的重链cdr3的重链可变区与含有由序列号16所示的氨基酸序列构成的轻链cdr1、由序列号17所示的氨基酸序列构成的轻链cdr2和由序列号18所示的氨基酸序列构成的轻链cdr3的轻链可变区的组合;
(2-1)含有由序列号13所示的氨基酸序列构成的重链cdr1、由序列号14所示的氨基酸序列构成的重链cdr2和由序列号15所示的氨基酸序列构成的重链cdr3的重链可变区与含有由序列号19所示的氨基酸序列构成的轻链cdr1、由序列号17所示的氨基酸序列构成的轻链cdr2和由序列号18所示的氨基酸序列构成的轻链cdr3的轻链可变区的组合;
(3-1)含有由序列号20所示的氨基酸序列构成的重链cdr1、由序列号21所示的氨基酸序列构成的重链cdr2和由序列号22所示的氨基酸序列构成的重链cdr3的重链可变区与含有由序列号23所示的氨基酸序列构成的轻链cdr1、由序列号24所示的氨基酸序列构成的轻链cdr2和由序列号25所示的氨基酸序列构成的轻链cdr3的轻链可变区的组合。
此外,还可以列举例如具备下述cdr的重链可变区与轻链可变区的组合,该cdr是基于下述文献(美国专利第8357783号、日本特表2017-518053)等中记载的公知的特异性地识别人间皮素的抗体的重链可变区和轻链可变区的氨基酸序列,基于imgt、kabat、chothia、north或contact等编号系统确定出的特异性地识别人间皮素的重链可变区和轻链可变区的cdr。需要说明的是,cdr可以利用下述的abodybuilder网址(http://opig.stats.ox.ac.uk/webapps/sabdab-sabpred/modelling.php)来确定。
另外,作为上述特异性地识别人间皮素的单链抗体中的重链可变区与轻链可变区的组合,还可以列举下述的组合。
(1-2)由与序列号1所示的氨基酸序列具有85%以上、优选90%以上、更优选95%以上、进一步优选98%以上的序列一致性的氨基酸序列构成的重链可变区与由与序列号2所示的氨基酸序列具有85%以上、优选90%以上、更优选95%以上、进一步优选98%以上的序列一致性的氨基酸序列构成的轻链可变区的组合;
(2-2)由与序列号3所示的氨基酸序列具有85%以上、优选90%以上、更优选95%以上、进一步优选98%以上的序列一致性的氨基酸序列构成的重链可变区与由与序列号4所示的氨基酸序列具有85%以上、优选90%以上、更优选95%以上、进一步优选98%以上的序列一致性的氨基酸序列构成的轻链可变区的组合;
(3-2)由与序列号5所示的氨基酸序列具有85%以上、优选90%以上、更优选95%以上、进一步优选98%以上的序列一致性的氨基酸序列构成的重链可变区与由与序列号6所示的氨基酸序列具有85%以上、优选90%以上、更优选95%以上、进一步优选98%以上的序列一致性的氨基酸序列构成的轻链可变区的组合;
(4-2)由与序列号1所示的氨基酸序列具有85%以上、优选90%以上、更优选95%以上、进一步优选98%以上的序列一致性的氨基酸序列构成的重链可变区与由与序列号4所示的氨基酸序列具有85%以上、优选90%以上、更优选95%以上、进一步优选98%以上的序列一致性的氨基酸序列构成的轻链可变区的组合;
(5-2)由与序列号3所示的氨基酸序列具有85%以上、优选90%以上、更优选95%以上、进一步优选98%以上的序列一致性的氨基酸序列构成的重链可变区与由与序列号2所示的氨基酸序列具有85%以上、优选90%以上、更优选95%以上、进一步优选98%以上的序列一致性的氨基酸序列构成的轻链可变区的组合。
此外,也可以是例如下述重链可变区与轻链可变区的组合,该重链可变区是由与下述文献(美国专利第8357783号、日本特表2017-518053)等中记载的公知的特异性地识别人间皮素的抗体的重链可变区具有85%以上、优选90%以上、更优选95%以上、进一步优选98%以上的序列一致性的氨基酸序列构成的重链可变区,该轻链可变区是由与上述公知的特异性地识别人间皮素的抗体的轻链可变区具有85%以上、优选90%以上、更优选95%以上、进一步优选98%以上的序列一致性的氨基酸序列构成的轻链可变区。
此外,作为上述特异性地识别人间皮素的单链抗体中的重链可变区与轻链可变区的组合,还可以列举下述组合。
(1-3)由序列号1所示的氨基酸序列构成的重链可变区与由序列号2所示的氨基酸序列构成的轻链可变区的组合;
(2-3)由序列号3所示的氨基酸序列构成的重链可变区与由序列号4所示的氨基酸序列构成的轻链可变区的组合;
(3-3)由序列号5所示的氨基酸序列构成的重链可变区与由序列号6所示的氨基酸序列构成的轻链可变区的组合;
(4-3)由序列号1所示的氨基酸序列构成的重链可变区与由序列号4所示的氨基酸序列构成的轻链可变区的组合;
(5-3)由序列号3所示的氨基酸序列构成的重链可变区与由序列号2所示的氨基酸序列构成的轻链可变区的组合。
此外,也可以是例如下述文献(美国专利第8357783号、日本特表2017-518053)等中记载的公知的特异性地识别人间皮素的抗体的重链可变区和轻链可变区的组合。
(肽接头)
重链可变区和轻链可变区借助肽接头而结合。该肽接头的长度为2~30、优选为15~25、更优选为15或25。具体而言,可以优选列举由与包含甘氨酸-丝氨酸连续序列的序列号26或27所示的氨基酸序列具有85%以上、优选90%以上、更优选95%以上、进一步优选98%以上的序列一致性的氨基酸序列构成、且具有与序列号26或27同等的作用的多肽;由在序列号26或27所示的氨基酸序列中缺失、置换、插入和/或添加了一个或多个氨基酸的氨基酸序列构成、且具有与序列号26或27所示的氨基酸序列同等的作用的多肽。
作为上述特异性地识别人间皮素的单链抗体中的重链可变区与轻链可变区以及肽接头的组合,还可以列举下述组合。需要说明的是,下述的“依次”是从n末端侧起依次这样的含义。
(1-4)依次包含由序列号1所示的氨基酸序列构成的重链可变区、由序列号26所示的氨基酸序列构成的肽接头和由序列号2所示的氨基酸序列构成的轻链可变区的组合;
(2-4)依次包含由序列号3所示的氨基酸序列构成的重链可变区、由序列号26所示的氨基酸序列构成的肽接头和由序列号4所示的氨基酸序列构成的轻链可变区的组合;
(3-4)依次包含由序列号2所示的氨基酸序列构成的轻链可变区、由序列号26所示的氨基酸序列构成的肽接头和由序列号1所示的氨基酸序列构成的重链可变区的组合;
(4-4)依次包含由序列号1所示的氨基酸序列构成的重链可变区、由序列号27所示的氨基酸序列构成的肽接头和由序列号2所示的氨基酸序列构成的轻链可变区的组合;
(5-4)依次包含由序列号2所示的氨基酸序列构成的轻链可变区、由序列号27所示的氨基酸序列构成的肽接头和由序列号1所示的氨基酸序列构成的重链可变区的组合;
(6-4)依次包含由序列号5所示的氨基酸序列构成的重链可变区、由序列号26所示的氨基酸序列构成的肽接头和由序列号6所示的氨基酸序列构成的轻链可变区的组合;
(7-4)依次包含由序列号6所示的氨基酸序列构成的轻链可变区、由序列号26所示的氨基酸序列构成的肽接头和由序列号5所示的氨基酸序列构成的重链可变区的组合;
(8-4)依次包含由序列号5所示的氨基酸序列构成的重链可变区、由序列号27所示的氨基酸序列构成的肽接头和由序列号6所示的氨基酸序列构成的轻链可变区的组合;
(9-4)依次包含由序列号6所示的氨基酸序列构成的轻链可变区、由序列号27所示的氨基酸序列构成的肽接头和由序列号5所示的氨基酸序列构成的重链可变区的组合。
(il-7、ccl19)
上述il-7是t细胞的存活所必需的细胞因子,由骨髓、胸腺、淋巴器官/组织的基质细胞等非造血细胞产生。另一方面,几乎观察不到t细胞自身的产生能力。
另外,上述ccl19主要由淋巴结的树突状细胞和巨噬细胞产生,具有借助其受体ccr7而引起t细胞、b细胞、成熟的树突状细胞的游走的功能。
il-7和ccl19的来源生物没有特别限定,优选为人。需要说明的是,这些蛋白质的氨基酸序列可以从genbank等公知的序列数据库获得。例如,作为人il-7的氨基酸序列的例子,可以列举以genbank登录号:nm_000880.3(序列号28)登录的序列、或它们的同种型等。另外,作为人ccl19的氨基酸序列的的例子,可以列举以genbank登录号:nm_006274.2(序列号29)登录的序列、或它们的同种型等。需要说明的是,il-7和ccl19可以具有信号肽,但在成熟蛋白质中,信号肽被除去。例如,在序列号28记载的人il-7的氨基酸序列中,1~25位的序列相当于信号肽。另外,例如,在序列号29记载的人ccl19的氨基酸序列中,1~21位的序列相当于信号肽。
另外,il-7和ccl19可以为上述的天然蛋白质的突变体。作为il-7的突变体的例子,可以列举由与序列号28记载的人il-7的氨基酸序列具有85%以上、优选90%以上、更优选95%以上、进一步优选98%以上的序列一致性的氨基酸序列构成、且具有il-7的细胞增殖率或细胞存活率的亢进作用的多肽;由在序列号28记载的人il-7的氨基酸序列中缺失、置换、插入和/或添加了一个或多个氨基酸的氨基酸序列构成、且具有il-7的细胞增殖率或细胞存活率的亢进作用的多肽。作为人ccl19的突变体的例子,可以列举由与序列号29记载的人ccl19的氨基酸序列具有85%以上、优选90%以上、更优选95%以上、进一步优选98%以上的序列一致性的氨基酸序列构成、且具有ccl19的细胞游走作用的多肽;由在序列号29记载的人ccl19的氨基酸序列中缺失、置换、插入和/或添加了一个或多个氨基酸的氨基酸序列构成、且具有ccl19的细胞游走作用的多肽。
(其他免疫功能调节因子)
此外,本发明的免疫活性细胞还可以表达il-15、ccl21、il-2、il-4、il-12、il-13、il-17、il-18、ip-10、干扰素-γ、mip-1α、gm-csf、m-csf、tgf-β、tnf-α等其他免疫功能调节因子,作为上述其他免疫调节因子,优选为il-12以外的免疫功能调节因子。
(跨膜区)
作为本发明中的跨膜区,可以列举来源于cd8、t细胞受体的α、β链、cd3ζ、cd28、cd3ε、cd45、cd4、cd5、cd8、cd9、cd16、cd22、cd33、cd37、cd64、cd80、cd86、cd134、cd137、icos、cd154、gitr的跨膜区的多肽,可以优选列举包含与序列号7所示的人cd8跨膜区的氨基酸序列具有85%以上、优选90%以上、更优选95%以上、进一步优选98%以上的序列一致性的氨基酸序列、且具有与序列号7所示的氨基酸序列同等的作用的多肽;由在序列号7所示的氨基酸序列中缺失、置换、插入和/或添加了一个或多个氨基酸的氨基酸序列构成、且具有与序列号7所示的氨基酸序列同等的作用的多肽。通过该跨膜区,car被固定于t细胞的细胞膜上。
上述跨膜区中可以包含由任意的寡肽或多肽构成、长度为1~100个氨基酸、优选10~70个氨基酸的铰链区。作为铰链区,可以列举人cd8的铰链区。
(免疫活性细胞活化信号转导区)
免疫活性细胞活化信号转导区是在上述细胞表面分子识别间皮素时能够向细胞内进行信号转导的区域,优选包含选自cd28、4-1bb(cd137)、gitr、cd27、ox40、hvem、cd3ζ或fc受体相关γ链(fcreceptor-associatedγchain)的胞内区的多肽中的至少一种或两种以上,更优选包含cd28的胞内区的多肽、4-1bb的胞内区的多肽和cd3ζ的胞内区的多肽这3种多肽。作为cd28的胞内区的氨基酸序列,可以列举包含与序列号8所示的氨基酸序列具有85%以上、优选90%以上、更优选95%以上、进一步优选98%以上的序列一致性的氨基酸序列、且具有与序列号8所示的氨基酸序列同等的作用的多肽;由在序列号8所示的氨基酸序列中缺失、置换、插入和/或添加了一个或多个氨基酸的氨基酸序列构成、且具有与序列号8所示的氨基酸序列同等的作用的多肽。作为4-1bb的胞内区的氨基酸序列,可以列举包含与序列号9所示的氨基酸序列具有85%以上、优选90%以上、更优选95%以上、进一步优选98%以上的序列一致性的氨基酸序列、且具有与序列号9所示的氨基酸序列同等的作用的多肽;由在序列号9所示的氨基酸序列中缺失、置换、插入和/或添加了一个或多个氨基酸的氨基酸序列构成、且具有与序列号9所示的氨基酸序列同等的作用的多肽。作为cd3ζ的胞内区的氨基酸序列,可以列举包含与序列号10所示的氨基酸序列具有85%以上、优选90%以上、更优选95%以上、进一步优选98%以上的序列一致性的氨基酸序列、且具有与序列号10所示的氨基酸序列同等的作用的多肽;由在序列号10所示的氨基酸序列中缺失、置换、插入和/或添加了一个或多个氨基酸的氨基酸序列构成、且具有与序列号10所示的氨基酸序列同等的作用的多肽。需要说明的是,在使用t细胞作为免疫活性细胞时,选择能够向t细胞内进行信号转导的多肽即可,在使用其他免疫活性细胞时,也是选择能够向该免疫活性细胞内进行信号转导的多肽即可。在使用t细胞作为免疫活性细胞的情况下,作为免疫活性细胞活化信号转导区,可以列举包含序列号8、9和10所示的氨基酸序列的多肽,可以优选列举从n末端侧起依次包含序列号8、9和10所示的氨基酸序列的多肽。
(细胞外铰链区、间隔区)
另外,可以在识别间皮素的细胞表面分子与跨膜区之间设置由任意的寡肽或多肽构成的细胞外铰链区。作为细胞外铰链区的长度,可以列举1~100个氨基酸残基、优选10~70个氨基酸残基,作为该细胞外铰链区,可以列举来源于cd8、cd28、cd4等的铰链区、免疫球蛋白的铰链区。
此外,可以在跨膜区与免疫活性细胞活化信号转导区之间设置由任意的寡肽或多肽构成的间隔区。作为间隔区的长度,可以列举1~100个氨基酸残基、优选10~50个氨基酸残基,作为该间隔区,可以列举甘氨酸-丝氨酸连续序列。
(各区域的配置)
上述car中,上述各区域可以从n末端起按照单链抗体、跨膜区、免疫活性细胞活化信号转导区的顺序配置。具体而言,可以列举从n末端侧起按照特异性地识别人间皮素的单链抗体、人cd8的细胞外铰链区、人cd8的跨膜区、人cd28的t细胞活化信号转导区、人4-1bb的t细胞活化信号转导区和人cd3ζ的t细胞活化信号转导区的顺序配置的car。
(由自杀基因表达的蛋白质)
另外,本发明的免疫活性细胞可以表达单纯疱疹病毒的胸苷激酶(hsv-tk)或诱导性胱天蛋白酶9(induciblecaspase9)等具有使自身细胞死亡的功能的蛋白质(由自杀基因表达的蛋白质)。通过使这些基于自杀基因的蛋白质表达,能够直接或者继发地诱导具有细胞毒性的物质,从而具有使自身细胞死亡的功能。因此,例如可以根据癌症的治疗经过,在肿瘤消失的情况下给药活化上述功能的药剂,从而控制生物体内存在的本发明的免疫活性细胞。即,可以根据需要可靠地降低本发明的免疫活性细胞的导致细胞因子释放综合征的风险。
作为活化单纯疱疹病毒的胸苷激酶(hsv-tk)或诱导性胱天蛋白酶9(induciblecaspase9)的功能的药剂,对于前者可以列举更昔洛韦,对于后者可以列举作为二聚体诱导化合物(chemicalinductionofdimerization:cid)的ap1903(cooperlj.,et.al.cytotherapy.2006;8(2):105-17.,jensenm.c.et.al.biolbloodmarrowtransplant.2010sep;16(9):1245-56.,jonesbs.frontpharmacol.2014nov27;5:254.,minagawak.,pharmaceuticals(basel).2015may8;8(2):230-49.,bole-richarde.,frontpharmacol.2015aug25;6:174)。
(免疫活性细胞中的细胞的种类)
作为上述免疫活性细胞中的细胞的种类,只要是参与免疫应答、通过导入编码特异性地识别人间皮素的细胞表面分子的核酸、编码il-7的核酸和编码ccl19的核酸而能够表达特异性地识别人间皮素的细胞表面分子、il-7和ccl19的细胞,则没有特别限制,优选为从生物体中分离出来的免疫活性细胞,可以列举从生物体中分离出来的t细胞、自然杀伤细胞(nk细胞)、b细胞等淋巴细胞系细胞、单核细胞、巨噬细胞、树突状细胞等抗原提呈细胞、中性粒细胞、嗜酸性粒细胞、嗜碱性粒细胞、肥大细胞等粒细胞。具体而言,可以优选列举来源于人、狗、猫、猪、小鼠等哺乳动物的t细胞或从哺乳动物中分离出来的t细胞,优选来源于人的t细胞或从人分离出来的t细胞。需要说明的是,来源于人、狗、猫、猪、小鼠等哺乳动物的t细胞包括将从人、狗、猫、猪、小鼠等哺乳动物中分离(采集)出来的t细胞人为地在生物体外进行培养而得到的t细胞、或者从该t细胞传代培养而得到的t细胞。另外,作为上述分离出来的t细胞,可以是主要包含t细胞的细胞群,除了t细胞以外可以还包含其他细胞,优选以50%以上、优选60%以上、更优选70%以上、进一步优选80%以上、最优选90%的比例包含t细胞。另外,t细胞可以从血液、骨髓液等体液、脾脏、胸腺、淋巴结等组织、或者浸润到原发肿瘤、转移性肿瘤、癌性腹水等癌组织中的免疫细胞中分离包含免疫活性细胞的细胞群而得到。为了提高上述细胞群中包含的t细胞的比例,也可以根据需要通过常规方法进一步对分离出来的上述细胞群进行分离或纯化。此外,作为上述免疫活性细胞中的细胞,也可以利用从es细胞或ips细胞制作的细胞。作为该t细胞,可以列举α/βt细胞、γ/δt细胞、cd8+t细胞、cd4+t细胞、肿瘤浸润t细胞、记忆t细胞、初始t细胞、nkt细胞。需要说明的是,免疫活性细胞的来源与给药对象可以相同也可以不同。此外,在给药对象为人的情况下,作为免疫活性细胞,可以使用从作为给药对象的患者本人采集的自体细胞,也可以使用从他人采集的他体细胞。即,供者与受者可以一致也可以不一致,但优选一致。
(免疫活性细胞的制作方法)
作为本发明的免疫活性细胞的制作方法,可以列举将编码细胞表面分子的核酸、编码il-7的核酸和编码ccl19的核酸导入到免疫活性细胞中来制作的方法,例如可以优选列举利用上述专利文献1或2中记载的方法等将后述的本发明的表达载体导入到免疫活性细胞中来制作的方法。或者,还可以列举:向受精卵中注入表达特异性地识别人间皮素的细胞表面分子、il-7和/或ccl19的载体而制作转基因哺乳动物,从该转基因哺乳动物中纯化得到免疫活性细胞的方法;在从该转基因哺乳动物纯化得到的免疫活性细胞中进一步根据需要导入表达特异性地识别人间皮素的细胞表面分子、il-7和/或ccl19的载体而制作的方法。
作为将编码细胞表面分子的核酸、编码il-7的核酸和编码ccl19的核酸、或后述的本发明的载体导入到免疫活性细胞中的情况下的核酸或载体的导入方法,只要是将核酸或载体导入到免疫活性细胞中的方法即可,可以列举例如电穿孔法(cytotechnology,3,133(1990))、磷酸钙法(日本特开平2-227075号公报)、脂质体转染法(proc.natl.acad.sci.u.s.a.,84,7413(1987))、病毒感染法等方法。作为该病毒感染法,可以列举将要导入的载体和包装质粒转染到gp2-293细胞(宝生物公司制造)、plat-gp细胞(cosmobio公司制造)、pg13细胞(atcccrl-10686)、pa317细胞(atcccrl-9078)等包装细胞中而制作重组病毒,使该重组病毒感染免疫活性细胞细胞的方法(上述专利文献2)。
在使用载体来制作上述“表达特异性地识别人间皮素的细胞表面分子、il-7和ccl19的免疫活性细胞”的情况下,可以通过下述任意一种方法来制作。
(1)将含有编码特异性地识别人间皮素的细胞表面分子的核酸、编码il-7的核酸和编码ccl19的核酸、表达特异性地识别人间皮素的细胞表面分子、il-7和ccl19的载体导入到免疫活性细胞中的方法;
(2)将含有编码特异性地识别人间皮素的细胞表面分子的核酸、表达特异性地识别人间皮素的细胞表面分子的载体、以及含有编码il-7的核酸和编码ccl19的核酸、表达il-7和ccl19的载体这两种载体同时或分阶段地导入到免疫活性细胞中的方法;
(3)将含有编码特异性地识别人间皮素的细胞表面分子的核酸和编码il-7的核酸、表达特异性地识别人间皮素的细胞表面分子和il-7的载体、以及含有编码ccl19的核酸、表达ccl19的载体这两种载体同时或分阶段地导入到免疫活性细胞中的方法;
(4)将含有编码特异性地识别人间皮素的细胞表面分子的核酸和编码ccl19的核酸、表达特异性地识别人间皮素的细胞表面分子和ccl19的载体、以及含有编码il-7的核酸、表达il-7的载体这两种载体同时或分阶段地导入到免疫活性细胞中的方法;
(5)将含有编码特异性地识别人间皮素的细胞表面分子的核酸和编码il-7的核酸、表达特异性地识别人间皮素的细胞表面分子和il-7的载体、以及含有编码特异性地识别人间皮素的细胞表面分子的核酸和编码ccl19的核酸、表达特异性地识别人间皮素的细胞表面分子和ccl19的载体这两种载体同时或分阶段地导入到免疫活性细胞中的方法;
(6)将含有编码特异性地识别人间皮素的细胞表面分子的核酸和编码il-7的核酸、表达特异性地识别人间皮素的细胞表面分子和il-7的载体、以及含有编码il-7的核酸和编码ccl19的核酸、表达il-7和ccl19的载体这两种载体同时或分阶段地导入到免疫活性细胞中的方法;
(7)将含有编码特异性地识别人间皮素的细胞表面分子的核酸和编码ccl19的核酸、表达特异性地识别人间皮素的细胞表面分子和ccl19的载体、以及含有编码il-7的核酸和编码ccl19的核酸、表达il-7和ccl19的载体这两种载体同时或分阶段地导入到免疫活性细胞中的方法;
(8)将含有编码特异性地识别人间皮素的细胞表面分子的核酸、表达特异性地识别人间皮素的细胞表面分子的载体、含有编码il-7的核酸、表达il-7的载体、以及含有编码ccl19的核酸、表达ccl19的载体这三种载体同时或分阶段地导入到免疫活性细胞中的方法。
此外,在使用载体来制作上述“表达特异性地识别人间皮素的细胞表面分子、il-7和ccl19的免疫活性细胞”的情况下,也可以预先制备表达特异性地识别人间皮素的细胞表面分子的免疫活性细胞,使用该表达特异性地识别人间皮素的细胞表面分子的免疫活性细胞,通过下述任意一种方法来制作。
(1)将含有编码il-7的核酸和编码ccl19的核酸、表达il-7和ccl19的载体导入到上述表达特异性地识别人间皮素的细胞表面分子的免疫活性细胞中的方法;
(2)将含有编码il-7的核酸、表达il-7的载体、以及含有编码ccl19的核酸、表达ccl19的载体这两种载体同时或分阶段地导入到上述表达特异性地识别人间皮素的细胞表面分子的免疫活性细胞中的方法。
在使用上述各免疫活性细胞的情况下,也可以使用含有该免疫细胞的、该免疫活性细胞的培养物。另外,编码特异性地识别人间皮素的细胞表面分子的核酸、编码il-7的核酸和编码ccl19的核酸既可以以整合到免疫活性细胞的基因组中的状态来使用,也可以以未整合到基因组中的状态(例如游离的状态)来使用。此外,在使用上述各免疫活性细胞的情况下,可以使用编码特异性地识别人间皮素的细胞表面分子的核酸、编码il-7的核酸和编码ccl19的核酸被整合到免疫活性细胞的基因组中的免疫活性细胞、与编码特异性地识别人间皮素的细胞表面分子的核酸、编码il-7的核酸和编码ccl19的核酸未被整合到基因组中的免疫活性细胞的混合物。
另外,如上所述“表达特异性地识别人间皮素的细胞表面分子、il-7和ccl19的免疫活性细胞”可以通过使用公知的基因编辑技术,将上述编码特异性地识别人间皮素的细胞表面分子、il-7的核酸和编码ccl19的核酸以能够在适当的启动子的调控下进行表达的方式整合到细胞的基因组中来制造。作为公知的基因编辑技术,可以列举使用锌指核酸酶、talen(类转录激活因子效应物核酸酶)、crispr(clusteredregularlyinterspacedshortpalindromicrepeat,成簇的规律间隔的短回文重复序列)-cas系统等内切核酸酶的技术。另外,例如,在使特异性地识别人间皮素的car(抗人间皮素car)表达-免疫活性细胞表达其他外源蛋白质的情况下,也可以同样地使用基因编辑技术,将包含编码其他外源蛋白质的碱基序列的多核苷酸以能够在适当的启动子的调控下进行表达的方式整合到细胞的基因组中。具体而言,可以列举:将与适当的启动子功能性连接的包含编码抗人间皮素car(或其他蛋白质)的碱基序列的多核苷酸整合到细胞基因组的非编码区等中的方法;将包含编码抗人间皮素car(或其他蛋白质)的碱基序列的多核苷酸整合到细胞基因组的内源性启动子的下游的方法等。作为内源性启动子,可以列举例如tcrα、tcrβ的启动子等。
(给药对象)
作为上述给药对象,可以优选列举哺乳动物或哺乳动物细胞,在该哺乳动物中,可以更优选列举人、小鼠、狗、大鼠、豚鼠、兔、鸟、绵羊、猪、牛、马、猫、猴、猩猩,可以特别优选列举人。
(表达载体)
本发明的表达载体只要通过与免疫活性细胞或其前体细胞接触而导入到细胞内,在免疫活性细胞中表达由其编码的规定蛋白质(多肽)而能够制作本发明的免疫活性细胞即可,对于其为何种实施方式没有特别限定。本领域技术人员可以设计并制作能够在免疫活性细胞中表达所期望的蛋白质(多肽)的表达载体。例如,作为本发明的含有编码特异性地识别人间皮素的细胞表面分子的核酸、编码il-7的核酸和编码ccl19的核酸的表达载体,可以列举用于制作上述本发明的免疫活性细胞的下述(a)~(e)中的任意一种表达载体(以下也称为“il-7/ccl19表达-抗人间皮素载体”)。需要说明的是,下述的“两个表达载体”是指两种表达载体的组,“三个表达载体”是指三种表达载体的组。
(a)含有编码特异性地识别人间皮素的细胞表面分子的核酸、编码il-7的核酸和编码ccl19的核酸的表达载体;
(b)下述的(b-1)和(b-2)这两个表达载体:
(b-1)含有编码特异性地识别人间皮素的细胞表面分子的核酸的表达载体;
(b-2)含有编码il-7的核酸和编码ccl19的核酸的表达载体;
(c)下述的(c-1)和(c-2)这两个表达载体:
(c-1)含有编码特异性地识别人间皮素的细胞表面分子的核酸和编码il-7的核酸的表达载体;
(c-2)含有编码ccl19的核酸的表达载体;
(d)下述的(d-1)和(d-2)这两个表达载体:
(d-1)含有编码il-7的核酸的表达载体;
(d-2)含有编码特异性地识别人间皮素的细胞表面分子的核酸和编码ccl19的核酸的表达载体;
(e)下述的(e-1)和(e-2)这两个表达载体:
(e-1)含有编码特异性地识别人间皮素的细胞表面分子的核酸和编码il-7的核酸的表达载体;
(e-2)含有编码特异性地识别人间皮素的细胞表面分子的核酸和编码ccl19的核酸的表达载体;
(f)下述的(f-1)和(f-2)这两个表达载体:
(f-1)含有编码特异性地识别人间皮素的细胞表面分子的核酸和编码il-7的核酸的表达载体;
(f-2)含有编码il-7的核酸和编码ccl19的核酸的表达载体;
(g)下述的(g-1)和(g-2)这两个表达载体:
(g-1)含有编码特异性地识别人间皮素的细胞表面分子的核酸和编码ccl19的核酸的表达载体;
(g-2)含有编码il-7的核酸和编码ccl19的核酸的表达载体;
(h)下述的(h-1)、(h-2)和(h-3)这三个表达载体:
(h-1)含有编码特异性地识别人间皮素的细胞表面分子的核酸的表达载体;
(h-2)含有编码il-7的核酸的表达载体;
(h-3)含有编码ccl19的核酸的表达载体。
此外,上述il-7/ccl19表达-抗人间皮素载体还可以含有编码il-15、ccl21、il-2、il-4、il-12、il-13、il-17、il-18、ip-10、干扰素-γ、mip-1α、gm-csf、m-csf、tgf-β、tnf-α、检查点抑制抗体或其片段等其他免疫功能调节因子的核酸,作为上述编码其他免疫调节因子的核酸,优选为编码il-12以外的免疫功能调节因子的核酸。
(核酸)
本说明书中,“核酸”只要是核苷酸和与该核苷酸具有同等功能的分子聚合而成的分子即可,可以为任意的核酸,可以列举例如作为核糖核苷酸的聚合物的rna、作为脱氧核糖核苷酸的聚合物的dna、核糖核苷酸和脱氧核糖核苷酸混合而成的聚合物、以及包含核苷酸类似物的核苷酸聚合物,此外,也可以是包含核酸衍生物的核苷酸聚合物。另外,核酸可以为单链核酸或双链核酸。另外,双链核酸也包括一条链在严格条件下杂交到另一条链上的双链核酸。
作为上述核苷酸类似物,只要是与rna或dna相比为了提高核酸酶耐性或使其稳定化、为了提高与互补链核酸的亲和性、或者为了提高细胞穿透性、或者为了可见化而对核糖核苷酸、脱氧核糖核苷酸、rna或dna实施修饰而得到的分子,则可以为任意的分子。作为核苷酸类似物,可以是天然存在的分子也可以是非天然的分子,可以列举例如糖部修饰核苷酸类似物、磷酸二酯键修饰核苷酸类似物等。
作为上述糖部修饰核苷酸类似物,只要是对核苷酸的糖的化学结构的一部分或全部附加或取代任意的化学结构物质而得到的核苷酸类似物,则可以为任意的核苷酸类似物,作为其具体例,可以列举被2’-o-甲基核糖取代而得到的核苷酸类似物、被2’-o-丙基核糖取代而得到的核苷酸类似物、被2’-甲氧基乙氧基核糖取代而得到的核苷酸类似物、被2’-o-甲氧基乙基核糖取代而得到的核苷酸类似物、被2’-o-[2-(胍)乙基]核糖取代而得到的核苷酸类似物、被2’-氟核糖取代而得到的核苷酸类似物、通过在糖部导入桥接结构而具有两个环状结构的桥接结构型人造核酸(bridgednucleicacid)(bna),更具体而言,可以列举2’位的氧原子与4’位的碳原子经由亚甲基桥接的锁型人造核酸(lockednucleicacid)(lna)和乙烯桥接结构型人造核酸(ethylenebridgednucleicacid)(ena)[nucleicacidresearch,32,e175(2004)],进一步可以列举肽核酸(pna)[acc.chem.res.,32,624(1999)]、氧肽核酸(opna)[j.am.chem.soc.,123,4653(2001)]和肽核糖核酸(prna)[j.am.chem.soc.,122,6900(2000)]等。
作为上述磷酸二酯键修饰核苷酸类似物,只要是对核苷酸的磷酸二酯键的化学结构的一部分或全部附加或取代任意的化学物质而得到的核苷酸类似物,则可以为任意的核苷酸类似物,作为其具体例,可以列举被取代为硫代磷酸酯键而得到的核苷酸类似物、被取代为n3’-p5’磷酰胺酯键而得到的核苷酸类似物等[细胞工程学,16,1463-1473(1997)][rnai法和反义法、讲谈社(2005)]。
作为上述核酸衍生物,只要是与核酸相比为了提高核酸酶耐性、为了使其稳定化、为了提高与互补链核酸的亲和性、为了提高细胞穿透性、或者为了可见化而在该核酸上附加其他化学物质而得到的分子,则可以为任意的分子,作为其具体例,可以列举5’-多胺附加衍生物、胆固醇附加衍生物、类固醇附加衍生物、胆汁酸附加衍生物、维生素附加衍生物、cy5附加衍生物、cy3附加衍生物、6-fam附加衍生物和生物素附加衍生物等。
(编码特异性地识别人间皮素的细胞表面分子、il-7、ccl19等的核酸)
上述编码特异性地识别人间皮素的细胞表面分子的核酸、编码il-7的核酸和编码ccl19的核酸可以分别列举来源于哺乳动物的核酸,可以优选列举来源于人的核酸。上述各核酸可以根据要导入本发明的表达载体的细胞的种类而适当选择,所述各核酸的序列信息可以通过对公知的文献或ncbi(http://www.ncbi.nlm.nih.gov/guide/)等数据库进行检索而适当获得。
作为编码特异性地识别人间皮素的细胞表面分子的核酸,可以列举编码特异性地识别人间皮素的car的核酸。
作为上述编码特异性地识别人间皮素的car中包含的单链抗体的核酸,具体而言,可以列举下述的(1-1d)~(3-1d)。
(1-1d)编码包含含有由序列号13所示的氨基酸序列构成的重链cdr1、由序列号14所示的氨基酸序列构成的重链cdr2和由序列号15所示的氨基酸序列构成的重链cdr3的重链可变区、以及含有由序列号16所示的氨基酸序列构成的轻链cdr1、由序列号17所示的氨基酸序列构成的轻链cdr2和由序列号18所示的氨基酸序列构成的轻链cdr3的轻链可变区的单链抗体的核酸;
(2-1d)编码包含含有由序列号13所示的氨基酸序列构成的重链cdr1、由序列号14所示的氨基酸序列构成的重链cdr2和由序列号15所示的氨基酸序列构成的重链cdr3的重链可变区、以及含有由序列号19所示的氨基酸序列构成的轻链cdr1、由序列号17所示的氨基酸序列构成的轻链cdr2和由序列号18所示的氨基酸序列构成的轻链cdr3的轻链可变区的单链抗体的核酸;
(3-1d)编码包含含有由序列号20所示的氨基酸序列构成的重链cdr1、由序列号21所示的氨基酸序列构成的重链cdr2和由序列号22所示的氨基酸序列构成的重链cdr3的重链可变区、以及含有由序列号23所示的氨基酸序列构成的轻链cdr1、由序列号24所示的氨基酸序列构成的轻链cdr2和由序列号25所示的氨基酸序列构成的轻链cdr3的轻链可变区的单链抗体的核酸。
作为上述编码特异性地识别人间皮素的car中包含的单链抗体的核酸的其他方式1,具体而言,可以列举下述的(1-2d)~(5-2d)。
(1-2d)编码包含由与序列号1所示的氨基酸序列具有85%以上、优选90%以上、更优选95%以上、进一步优选98%以上的序列一致性的氨基酸序列构成的重链可变区、以及由与序列号2所示的氨基酸序列具有85%以上、优选90%以上、更优选95%以上、进一步优选98%以上的序列一致性的氨基酸序列构成的轻链可变区的单链抗体的核酸;
(2-2d)编码包含由与序列号3所示的氨基酸序列具有85%以上、优选90%以上、更优选95%以上、进一步优选98%以上的序列一致性的氨基酸序列构成的重链可变区、以及由与序列号4所示的氨基酸序列具有85%以上、优选90%以上、更优选95%以上、进一步优选98%以上的序列一致性的氨基酸序列构成的轻链可变区的单链抗体的核酸;
(3-2d)编码包含由与序列号5所示的氨基酸序列具有85%以上、优选90%以上、更优选95%以上、进一步优选98%以上的序列一致性的氨基酸序列构成的重链可变区、以及由与序列号6所示的氨基酸序列具有85%以上、优选90%以上、更优选95%以上、进一步优选98%以上的序列一致性的氨基酸序列构成的轻链可变区的单链抗体的核酸;
(4-2d)编码包含由与序列号1所示的氨基酸序列具有85%以上、优选90%以上、更优选95%以上、进一步优选98%以上的序列一致性的氨基酸序列构成的重链可变区、以及由与序列号4所示的氨基酸序列具有85%以上、优选90%以上、更优选95%以上、进一步优选98%以上的序列一致性的氨基酸序列构成的轻链可变区的单链抗体的核酸;
(5-2d)编码包含由与序列号3所示的氨基酸序列具有85%以上、优选90%以上、更优选95%以上、进一步优选98%以上的序列一致性的氨基酸序列构成的重链可变区、以及由与序列号2所示的氨基酸序列具有85%以上、优选90%以上、更优选95%以上、进一步优选98%以上的序列一致性的氨基酸序列构成的轻链可变区的单链抗体的核酸。
作为上述编码特异性地识别人间皮素的car中包含的单链抗体的核酸的其他方式2,具体而言,可以列举下述的(1-3d)~(5-3d)。
(1-3d)编码包含由序列号1所示的氨基酸序列构成的重链可变区和由序列号2所示的氨基酸序列构成的轻链可变区的单链抗体的核酸;
(2-3d)编码包含由序列号3所示的氨基酸序列构成的重链可变区和由序列号4所示的氨基酸序列构成的轻链可变区的单链抗体的核酸;
(3-3d)编码包含由序列号5所示的氨基酸序列构成的重链可变区和由序列号6所示的氨基酸序列构成的轻链可变区的单链抗体的核酸;
(4-3d)编码包含由序列号1所示的氨基酸序列构成的重链可变区和由序列号4所示的氨基酸序列构成的轻链可变区的单链抗体的核酸;
(5-3d)编码包含由序列号3所示的氨基酸序列构成的重链可变区和由序列号2所示的氨基酸序列构成的轻链可变区的单链抗体的核酸。
上述编码特异性地识别人间皮素的car中包含的单链抗体的核酸的其他方式3,具体而言,可以列举下述的(1-4d)~(9-4d)。
(1-4d)编码依次包含由序列号1所示的氨基酸序列构成的重链可变区、由序列号26所示的氨基酸序列构成的肽接头和由序列号2所示的氨基酸序列构成的轻链可变区的单链抗体的核酸;
(2-4d)编码依次包含由序列号3所示的氨基酸序列构成的重链可变区、由序列号26所示的氨基酸序列构成的肽接头和由序列号4所示的氨基酸序列构成的轻链可变区的单链抗体的核酸;
(3-4d)编码依次包含由序列号2所示的氨基酸序列构成的轻链可变区、由序列号26所示的氨基酸序列构成的肽接头和由序列号1所示的氨基酸序列构成的重链可变区的单链抗体的核酸;
(4-4d)编码依次包含由序列号1所示的氨基酸序列构成的重链可变区、由序列号27所示的氨基酸序列构成的肽接头和由序列号2所示的氨基酸序列构成的轻链可变区的单链抗体的核酸;
(5-4d)编码依次包含由序列号2所示的氨基酸序列构成的轻链可变区、由序列号27所示的氨基酸序列构成的肽接头和由序列号1所示的氨基酸序列构成的重链可变区的单链抗体的核酸;
(6-4d)编码依次包含由序列号5所示的氨基酸序列构成的重链可变区、由序列号26所示的氨基酸序列构成的肽接头和由序列号6所示的氨基酸序列构成的轻链可变区的单链抗体的核酸;
(7-4d)编码依次包含由序列号6所示的氨基酸序列构成的轻链可变区、由序列号26所示的氨基酸序列构成的肽接头和由序列号5所示的氨基酸序列构成的重链可变区的单链抗体的核酸;
(8-4d)编码依次包含由序列号5所示的氨基酸序列构成的重链可变区、由序列号27所示的氨基酸序列构成的肽接头和由序列号6所示的氨基酸序列构成的轻链可变区的单链抗体的核酸;
(9-4d)编码依次包含由序列号6所示的氨基酸序列构成的轻链可变区、由序列号27所示的氨基酸序列构成的肽接头和由序列号5所示的氨基酸序列构成的重链可变区的单链抗体的核酸。
作为编码上述car中包含的跨膜区的多肽的核酸,可以列举编码包含与序列号8所示的氨基酸序列具有85%以上、优选90%以上、更优选95%以上、进一步优选98%以上的序列一致性的氨基酸序列的人cd8跨膜区的多肽的核酸。另外,作为编码上述car中包含的免疫活性细胞活化信号转导区中的cd28、4-1bb和cd3ζ的胞内区的多肽的核酸,可以列举:编码包含与序列号8所示的人cd28的胞内区的氨基酸序列具有85%以上、优选90%以上、更优选95%以上、进一步优选98%以上的序列一致性的氨基酸序列、且具有与序列号8所示的氨基酸序列同等的作用的多肽的核酸;编码包含与序列号9所示的人4-1bb的胞内区的氨基酸序列具有85%以上、优选90%以上、更优选95%以上、进一步优选98%以上的序列一致性的氨基酸序列、且具有与序列号9所示的氨基酸序列同等的作用的多肽的核酸;编码包含与序列号10所示的人cd3ζ的胞内区的氨基酸序列具有85%以上、优选90%以上、更优选95%以上、进一步优选98%以上的序列一致性的氨基酸序列、且具有与序列号10所示的氨基酸序列同等的作用的多肽的核酸;或它们的组合,优选可以列举从上游(5’末端侧)起依次为编码序列号8所示的人cd28的胞内区的多肽的胞内区的多肽的核酸、编码序列号9所示的人4-1bb的胞内区的多肽的核酸、编码序列号10所示的人cd3ζ的胞内区的多肽的核酸。
作为编码il-7的核酸,可以列举编码包含与序列号28所示的氨基酸序列具有85%以上、优选90%以上、更优选95%以上、进一步优选98%以上的序列一致性的氨基酸序列、且具有与序列号28所示的氨基酸序列同等的作用的多肽的核酸,具体而言,可以列举由序列号30所示的碱基序列构成的核酸,只要具有il-7的细胞增殖率或细胞存活率的亢进作用,也可以为与由序列号30所示的碱基序列构成的核酸具有80%以上、优选85%以上、更优选90%以上、进一步优选95%以上、最优选98%以上的序列一致性的核酸。作为编码ccl19的核酸,可以列举编码包含与序列号29所示的氨基酸序列具有85%以上、优选90%以上、更优选95%以上、进一步优选98%以上的序列一致性的氨基酸序列、且具有与序列号29所示的氨基酸序列同等的作用的多肽的核酸,具体而言,可以列举由序列号31所示的碱基序列构成的核酸,只要具有ccl19的细胞的游走作用,也可以使用与由序列号31所示的碱基序列构成的核酸具有80%以上、优选85%以上、更优选90%以上、进一步优选95%以上、最优选98%以上的序列一致性的核酸。
(自杀基因)
另外,本发明的表达载体中可以包含编码自杀基因的核酸。自杀基因是指通过进行表达而直接或者继发地诱导具有细胞毒性的物质、具有使自身细胞死亡的功能的基因。通过使本发明的表达载体包含编码自杀基因的核酸,能够根据癌症的治疗经过,例如在肿瘤消失的情况下给药活化自杀基因的功能的药剂来控制生物体内的免疫活性细胞。另外,不同于其他细胞因子,il-7或ccl19引起作为副作用的细胞因子释放综合征、基因导入细胞的肿瘤化的可能性低。但是,由于导入有本发明的表达载体的免疫活性细胞的功能提高,因此在攻击作为靶标的癌组织时释放的细胞因子等有可能预料之外地影响到周围组织。这种情况下,通过使本发明的表达载体包含编码自杀基因的核酸,能够可靠地降低导致细胞因子释放综合征的风险。
作为自杀基因,可以列举下述文献中记载的编码单纯疱疹病毒的胸苷激酶(hsv-tk)、诱导性胱天蛋白酶9(induciblecaspase9)的基因等,作为活化该基因的功能的药剂,对于前者可以列举更昔洛韦,对于后者可以列举作为二聚体诱导化合物(chemicalinductionofdimerization:cid)的ap1903。
(核酸序列信息的获得和核酸的制作)
本发明的表达载体中包含的上述各核酸可以为天然来源的核酸也可以为人工合成的核酸,可以根据要导入本发明的表达载体的细胞的种类来适当选择,序列信息可以通过对公知的文献或ncbi(http://www.ncbi.nlm.nih.gov/guide/)等数据库进行检索而适当获得。
上述各核酸可以基于编码各核酸的碱基序列的信息,通过进行化学合成的方法、利用pcr进行扩增的方法等公知的技术来制作。需要说明的是,用于编码氨基酸的所选择的密码子可以为了优化目标宿主细胞中的核酸的表达而进行改造。
(各核酸的配置)
本发明的表达载体中的、(a)含有编码特异性地识别人间皮素的细胞表面分子的核酸、编码il-7的核酸和编码ccl19的核酸的表达载体中,任意一种核酸可以配置在任意一种核酸的上游或下游。具体而言,若以含有编码抗人间皮素car的核酸作为编码特异性地识别人间皮素的细胞表面分子的核酸的情况为例,则从上游(5’末端侧)起依次可以为编码抗人间皮素car的核酸、编码il-7的核酸和编码ccl19的核酸,也可以为编码抗人间皮素car的核酸、编码ccl19的核酸和编码il-7的核酸,也可以为编码il-7的核酸、编码ccl19的核酸和编码抗人间皮素car的核酸,也可以为编码il-7的核酸、编码抗间皮素car的核酸和编码ccl19的核酸,也可以为编码ccl19的核酸、编码抗间皮素car的核酸和编码il-7的核酸,也可以为编码ccl19的核酸、编码il-7的核酸和编码抗人间皮素car的核酸。
本发明的载体中的、(b-2)、(f-2)和(g-2)中的含有编码il-7的核酸和编码ccl19的核酸的表达载体中,编码il-7的核酸和编码ccl19的核酸的配置没有特别限制,相对于编码il-7的核酸,编码ccl19的核酸可以配置在上游也可以配置在下游。
本发明的载体中的、(c-1)、(e-1)和(f-1)中的含有编码特异性地识别人间皮素的细胞表面分子的核酸和编码il-7的核酸的表达载体中,编码特异性地识别人间皮素的细胞表面分子的核酸和编码il-7的核酸的配置没有特别限制,相对于编码特异性地识别人间皮素的细胞表面分子的核酸,编码il-7的核酸可以配置在上游也可以配置在下游。
本发明的载体中的、(d-2)、(e-2)和(g-1)中的含有编码特异性地识别人间皮素的细胞表面分子的核酸和编码ccl19的核酸的表达载体中,编码特异性地识别人间皮素的细胞表面分子的核酸和编码ccl19的核酸的配置没有特别限制,相对于编码特异性地识别人间皮素的细胞表面分子的核酸,编码ccl19的核酸可以配置在上游也可以配置在下游。
(转录)
需要说明的是,编码特异性地识别间皮素的细胞表面分子的核酸、编码il-7的核酸和编码ccl19的核酸、编码自杀基因的核酸可以分别由不同的启动子进行转录,也可以使用内部核糖体进入位点(ires:internalribozymeentrysite)或自我剪切型2a肽以一个启动子进行转录。
在使用内部核糖体进入位点(ires)或自我剪切型2a肽以一个启动子对编码il-7的核酸和编码ccl19的核酸进行转录的情况下的上述各核酸之间、或包含上述编码特异性地识别间皮素的细胞表面分子的核酸的情况下的该核酸与编码il-7的核酸和编码ccl19的核酸之间,只要能够表达各核酸,也可以包含任意的核酸,但优选借助编码自我剪切型肽(2a肽)或ires的序列、优选编码2a肽的序列进行连接。通过使用该序列进行连接,能够高效地表达各核酸。
2a肽是来源于病毒的自我剪切型肽,其具有序列号32所示的氨基酸序列中的g-p间(距c末端一个残基的位置)被内质网切断的特征(szymczaketal.,expertopin.biol.ther.5(5):627-638(2005))。因此,借助2a肽整合到其前后的核酸在细胞内相互独立地进行表达。
作为上述2a肽,优选为来源于小核糖核酸病毒、轮状病毒、昆虫病毒、口蹄疫病毒或锥虫病毒的2a肽,更优选为序列号33所示的来源于小核糖核酸病毒的2a肽(f2a)。
(载体的种类)
作为本发明的表达载体中的载体的种类,可以为直链状也可以为环状,可以为质粒等非病毒载体、病毒载体或利用转座子的载体。另外,该载体中可以含有启动子、终止子等调控序列、药剂抗性基因、报告基因等选择标记序列。通过在启动子序列的下游以能够工作的方式配置编码il-7的核酸和编码ccl19的核酸,能够高效地对各核酸进行转录。
作为上述启动子,可以列举逆转录病毒的ltr启动子、sv40早期启动子、巨细胞病毒启动子、单纯疱疹病毒的胸苷激酶启动子等来源于病毒的启动子、磷酸甘油酸激酶(pgk)启动子、xist启动子、β-肌动蛋白启动子、rna聚合酶ii启动子等来源于哺乳类的启动子。另外,也可以使用由四环素诱导的四环素应答型启动子、由干扰素诱导的mx1启动子等。通过在本发明的表达载体中使用上述由特定物质诱导的启动子,在例如将含有本发明的载体的免疫活性细胞作为用于癌症的治疗的药物组合物使用的情况下,能够根据癌症的治疗经过对il-7和ccl19的表达的诱导进行调控。
作为上述病毒载体,可以列举逆转录病毒载体、慢病毒载体、腺病毒载体、腺相关病毒载体,可以优选列举逆转录病毒载体,可以更优选列举pmsgv载体(tamadaketal.,clincancerres18:6436-6445(2002))、pmscv载体(宝生物公司制造)。若使用逆转录病毒载体,则导入基因被整合到宿主细胞的基因组中,因此能够长期且稳定地进行表达。
关于免疫活性细胞中的本发明的表达载体含有的确认,例如在含有编码car的核酸的情况下,可以通过流式细胞术、northern印迹法、southern印迹法、rt-pcr等pcr、elisa、蛋白免疫印迹法考察car的表达,在本发明的表达载体中含有标记基因的情况下,可以通过考察插入到该表达载体中的标记基因的表达来确认。
(药物组合物)
本发明的药物组合物只要含有本发明的免疫活性细胞和药学上可接受的添加剂即可,作为上述添加剂,可以列举生理盐水、缓冲生理盐水、细胞培养用培养基、葡萄糖、注射用水、甘油、乙醇和它们的组合、稳定剂、增溶剂和表面活性剂、缓冲剂和防腐剂、等渗剂、填充剂以及润滑剂。另外,由于上述本发明的药物组合物中的免疫活性细胞中具备诱导免疫活性细胞的活化的信号转导区,因此本发明的药物组合物可以作为用于癌症的治疗的药物组合物。该用于癌症的治疗的药物组合物中,可以包含记载用于癌症的治疗的使用方法等的附属资料、标签、包装等。此外,由于上述本发明的药物组合物中的免疫活性细胞具有抑制肿瘤复发的效果,因此本发明的药物组合物也可以作为用于抑制肿瘤复发的药物组合物。该用于抑制肿瘤复发的药物组合物中可以包含记载用于抑制肿瘤复发的使用方法等的附属资料、标签、包装等。
本发明的药物组合物可以使用本领域技术人员已知的方法给药于需要该药物组合物的被测体,作为给药方法,可以列举向静脉内、肿瘤内、皮内、皮下、肌肉内、腹腔内、动脉内、脊髓内、心脏内、关节内、滑膜腔内、颅内、髓腔内和蛛网膜下腔(脑脊液)中的注射。
本发明的药物组合物可以列举1天4次、3次、2次或1次、每隔1天、每隔2天、每隔3天、每隔4天、每隔5天、1周1次、每隔7天、每隔8天、每隔9天、1周2次、1月1次或1月2次单独一次或分多次进行给药的方法。
作为本发明的药物组合物中的癌症,没有特别限定,优选为在癌组织中表达间皮素的癌种或来源于表达间皮素的癌细胞的癌种,可以列举间皮瘤、大肠癌(结肠癌或直肠癌)、胰腺癌、胸腺癌、胆管癌、肺癌(腺癌、鳞癌、腺鳞癌、未分化癌、大细胞癌、小细胞癌)、皮肤癌、乳腺癌、前列腺癌、膀胱癌、阴道癌、宫颈癌、宫体癌、肝癌、肾癌、胰腺癌、脾癌、气管癌、支气管癌、结肠癌、小肠癌、胃癌、食管癌、胆囊癌、睾丸癌、卵巢癌等癌、骨组织、软骨组织、脂肪组织、肌肉组织、血管组织和造血组织的癌、以及软骨肉瘤、尤文氏肉瘤、恶性血管内皮瘤、恶性神经鞘瘤、骨肉瘤、软组织肉瘤等肉瘤、肝母细胞瘤、髓母细胞瘤、肾母细胞瘤、神经母细胞瘤、胰母细胞瘤、胸膜肺母细胞瘤、视网膜母细胞瘤等母细胞瘤、胚细胞肿瘤。作为给药量,可以给药治疗有效量,例如,在1次给药中,以给药细胞的个数计,可以列举1×104~1×1010个、优选1×105~1×109个、更优选5×106~5×108个。
本发明的药物组合物可以与其他抗癌剂组合使用。作为其他抗癌剂,可以列举环磷酰胺、苯达莫司汀、异环磷酰胺、达卡巴嗪等烷化剂、喷司他丁、氟达拉滨、克拉屈滨、甲氨蝶呤、5-氟尿嘧啶、6-巯基嘌呤、依诺他滨等代谢拮抗药、利妥昔单抗、西妥昔单抗、曲妥单抗等分子靶向药、伊马替尼、吉非替尼、厄洛替尼、阿法替尼、达沙替尼、舒尼替尼、曲美替尼等激酶抑制剂、硼替佐米等蛋白酶体抑制剂、环孢菌素、他克莫司等钙调神经磷酸酶抑制剂、伊达比星、多柔比星、丝裂霉素c等抗癌性抗生素、依立替康、依托泊苷等植物生物碱、顺铂、奥沙利铂、卡铂等铂制剂、他莫昔芬、比卡鲁胺等激素疗法药、干扰素、纳武利尤单抗、帕博利珠单抗等免疫调节药。
作为上述“本发明的药物组合物与其他抗癌剂组合使用”的方法,可以列举:使用其他抗癌剂进行处理,然后使用本发明的药物组合物的方法;同时使用本发明的药物组合物与其他抗癌剂的方法;使用本发明的药物组合物进行处理,然后使用其他抗癌剂的方法。另外,在将本发明的用于癌症的治疗的药物组合物与其他抗癌剂组合使用的情况下,癌症的治疗效果进一步提高,并且各抗癌剂的给药次数或给药量减少,由此能够降低各抗癌剂所产生的副作用。另外,本发明的药物组合物中可以包含上述其他抗癌剂。
(本发明的其他方式)
作为本发明的其他方式1,可以列举:1)一种癌症的治疗方法,其特征在于,将本发明的免疫活性细胞给药于需要癌症的治疗的患者;2)用于作为药物组合物使用的本发明的免疫活性细胞;3)本发明的免疫活性细胞在药物组合物的制备中的应用。
另外,作为本发明的其他方式2,可以列举具备下述任意一种单链抗体、跨膜区和诱导免疫活性细胞的活化的信号转导区的嵌合抗原受体(car),通过使该car在免疫活性细胞中表达,能够通过人间皮素所产生的刺激使免疫活性细胞活化。
(1-1)包含含有由序列号13所示的氨基酸序列构成的重链cdr1、由序列号14所示的氨基酸序列构成的重链cdr2和由序列号15所示的氨基酸序列构成的重链cdr3的重链可变区、以及含有由序列号16所示的氨基酸序列构成的轻链cdr1、由序列号17所示的氨基酸序列构成的轻链cdr2和由序列号18所示的氨基酸序列构成的轻链cdr3的轻链可变区的单链抗体;
(2-1)包含含有由序列号13所示的氨基酸序列构成的重链cdr1、由序列号14所示的氨基酸序列构成的重链cdr2和由序列号15所示的氨基酸序列构成的重链cdr3的重链可变区、以及含有由序列号19所示的氨基酸序列构成的轻链cdr1、由序列号17所示的氨基酸序列构成的轻链cdr2和由序列号18所示的氨基酸序列构成的轻链cdr3的轻链可变区的单链抗体;
(3-1)包含含有由序列号20所示的氨基酸序列构成的重链cdr1、由序列号21所示的氨基酸序列构成的重链cdr2和由序列号22所示的氨基酸序列构成的重链cdr3的重链可变区、以及含有由序列号23所示的氨基酸序列构成的轻链cdr1、由序列号24所示的氨基酸序列构成的轻链cdr2和由序列号25所示的氨基酸序列构成的轻链cdr3的轻链可变区的单链抗体。
此外,作为本发明的其他方式3,可以列举具备本发明的表达载体的、用于制作免疫活性细胞的试剂盒,作为该试剂盒,只要具备本发明的表达载体则没有特别限制,可以包含用于制作本发明的免疫活性细胞的说明书、用于将本发明的表达载体导入到免疫活性细胞中的试剂。
此外,作为本发明的其他方式4,可以列举将同时表达细胞表面分子(优选为具备特异性地识别人间皮素的单链抗体的car)、il-7和ccl19的免疫活性细胞给药于对象的、癌症的复发抑制方法。
以下,通过实施例更具体地对本发明进行说明,但本发明的技术范围并不限定于这些例示。
[实施例1]抗人间皮素car的制作
(抗人间皮素car的scfv序列和dna片段的合成)
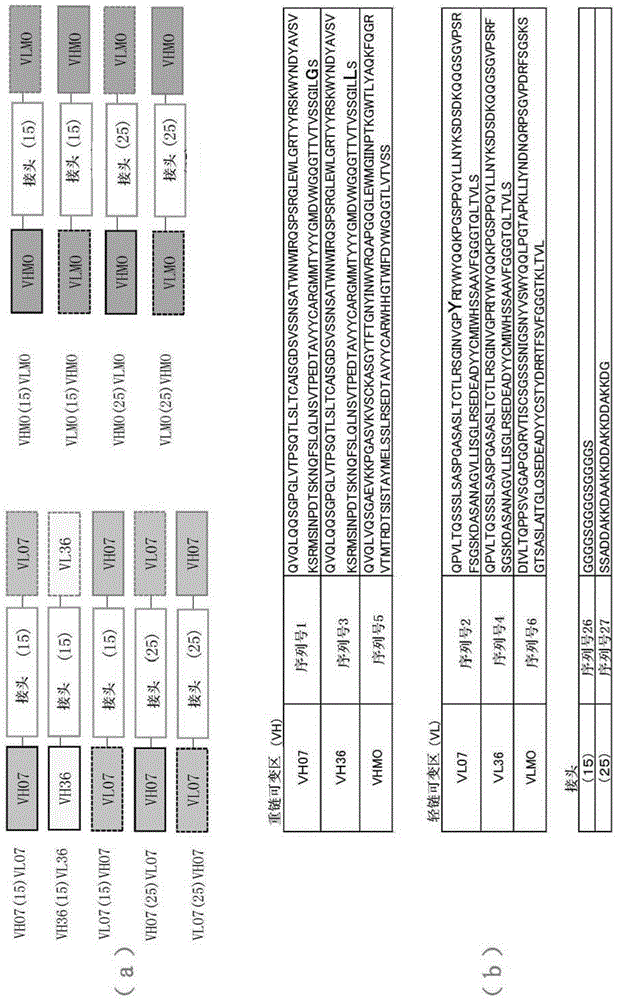
为了对vl和vh的序列、顺序和适当的信号肽的种类进行比较,设计了图1所示的9种抗人间皮素scfv的序列。
vh07(15)vl07由序列号1所示的重链可变区的氨基酸序列、序列号26所示的肽接头的氨基酸序列和序列号2所示的轻链可变区的氨基酸序列构成。
vh36(15)vl36由序列号3所示的重链可变区的氨基酸序列、序列号26所示的肽接头的氨基酸序列和序列号4所示的轻链可变区的氨基酸序列构成。
vl07(15)vh07由序列号2所示的轻链可变区的氨基酸序列、序列号26所示的肽接头的氨基酸序列和序列号1所示的重链可变区的氨基酸序列构成。
vh07(25)vl07由序列号1所示的重链可变区的氨基酸序列、序列号27所示的肽接头的氨基酸序列和序列号2所示的轻链可变区的氨基酸序列构成。
vl07(25)vh07由序列号2所示的轻链可变区的氨基酸序列、序列号27所示的肽接头的氨基酸序列和序列号1所示的重链可变区的氨基酸序列构成。
vhmo(15)vlmo由序列号5所示的重链可变区的氨基酸序列、序列号26所示的肽接头的氨基酸序列和序列号6所示的轻链可变区的氨基酸序列构成。
vlmo(15)vhmo由序列号6所示的轻链可变区的氨基酸序列、序列号26所示的肽接头的氨基酸序列和序列号5所示的重链可变区的氨基酸序列构成。
vhmo(25)vlmo由序列号5所示的重链可变区的氨基酸序列、序列号27所示的肽接头的氨基酸序列和序列号6所示的轻链可变区的氨基酸序列构成。
vlmo(25)vhmo由序列号6所示的轻链可变区的氨基酸序列、序列号27所示的肽接头的氨基酸序列和序列号5所示的重链可变区的氨基酸序列构成。需要说明的是,序列号1与序列号3所示的氨基酸序列的不同点在于,序列号1中的第127位为甘氨酸(g),与此相对,在序列号3所示的氨基酸序列中为亮氨酸(l)。另外,序列号2与序列号4所示的氨基酸序列的不同点在于,序列号2中的第33位的酪氨酸(y)在序列号4所示的氨基酸序列中缺失。
接着,分别合成编码上述各抗人间皮素scfv的氨基酸序列的dna片段。
(表达il-7/ccl19和hsv-tk的抗人间皮素il-7/ccl19car表达载体与不表达il-7/ccl19的常规(conv.)抗人间皮素car表达载体的制作)
在car-t细胞疗法中,有时会由于对靶抗原的强烈的免疫应答而引起细胞因子释放综合征等全身性的副作用。为了应对该问题,制作了导入有来源于疱疹病毒的胸苷激酶基因hsv-tk作为自杀基因的car构建体。将该构建体基因导入至t细胞中,使car表达t细胞表达hsv-tk时,通过添加作为巨细胞病毒治疗药的更昔洛韦,car-t细胞被诱导细胞凋亡而死亡,因此,通过给药更昔洛韦,能够控制体内的car-t细胞。
依照上述专利文献2中记载的方法,首先制作从n末端侧起依次具备抗人间皮素scfv、人cd8跨膜区和人cd28-4-1bb-cd3ζ细胞内信号转导区的第3代car构建体。在该构建体的c末端附加作为2a肽的f2a。进而在其下游附加人il-7-f2a-人ccl19-f2a-hsv-tk。将所得到的依次具备scfv、人cd8跨膜区、人cd28-4-1bb-cd3ζ细胞内信号转导区、人il-7、人ccl19、hsv-tk的构建体插入到pmsgv1逆转录病毒表达载体(tamadaketal.,clincancerres18:6436-6445(2012))中,制作表达抗人间皮素scfv、人cd8跨膜区、人cd28-4-1bb-cd3ζ细胞内信号转导区、人il-7、人ccl19和hsv-tk的pmsgv载体。接着,通过限制酶(ncoi和noti)处理和连接,使用通过上述“抗人间皮素car的scfv序列和dna片段的合成”栏中记载的方法合成的各抗人间皮素scfvdna片段置换上述pmsgv载体内的抗人间皮素scfv区域,制作各“il-7/ccl19表达-抗人间皮素car载体”。需要说明的是,pmsgv1载体在scfv的n末端侧具备来自于免疫球蛋白g的信号肽t(序列号11),但对于将上述scfv区域用vh07(15)vl07dna片段置换的载体,还制作了进一步将上述序列号11所示的信号肽t置换为序列号12所示的信号肽p来作为信号肽的载体。此外,作为无il-7和ccl19的对照,除了使用hsv-tk代替上述人il-7-f2a-人ccl19-f2a-hsv-tk以外,通过与上述同样的方法制作“常规抗人间皮素car载体”。
(导入有il-7/ccl19表达-抗人间皮素car载体或常规抗人间皮素car载体的逆转录病毒的制作)
为了向t细胞进行基因导入,制作逆转录病毒。使用阳离子脂质体lipofectamine3000(lifetechnology公司制造),将上述各il-7/ccl19表达-抗人间皮素car载体或常规抗人间皮素car载体和p-ampho质粒(宝生物公司制造)转染到gp2-293包装细胞株(宝生物公司制造)中,由此制作导入有il-7/ccl19表达-抗人间皮素car载体或常规抗人间皮素car载体的逆转录病毒。转染起48小时后回收含有上述逆转录病毒的上清。
作为上述gp2-293细胞的培养液,使用添加有10%fcs、1%青霉素-链霉素(和光纯药公司制造)的dmem。另外,作为后述实施例中使用的t细胞的培养液,使用包含2.0%人ab型血清(sigma-aldrich公司制造)、1%青霉素-链霉素(和光纯药公司制造)、2.5μg/ml的两性霉素b(百时美施贵宝公司制造)的gt-t551。
(t细胞的转导)
在固相化有用于活化t细胞的抗cd3单克隆抗体(5μg/ml)和retronectin(注册商标:宝生物公司制造、25μg/ml)的板上,将从健康人供者的血液中采集的2×106个外周血单核细胞与il-2(peprotech公司制造)一起在37℃、5%co2温箱中培养3天。在培养开始后第2天,将上述制作的含有导入有il-7/ccl19表达-抗人间皮素car载体或常规抗人间皮素car载体的逆转录病毒的上清以每1孔各500μl添加到预先用25μg/ml的retronectin(宝生物公司制造)包被的表面未处理24孔板中,通过2000g、2小时的离心制作逆转录病毒预装载板。总计制作2张板,离心结束后用1.5%bsa/pbs清洗,在4℃下保存至使用为止。在培养第3天,从上述板中回收活化的细胞,制备成细胞悬浮液(1×105个细胞/ml)。将该细胞悬浮液以每1孔各1ml添加到逆转录病毒预装载板中,在il-2的存在下在37℃、5%co2温箱中培养24小时,进行第一次逆转录病毒感染。次日(培养第4天),将各孔的细胞溶液转移到保存的第2张病毒预装载板中,以500g离心1分钟后,在37℃下培养4小时,进行第二次感染。在37℃下培养4小时后,将各孔的细胞悬浮液1ml转移到新的12孔细胞培养板中,用含有il-2的新培养液(gt-t551)稀释至4倍,在37℃、5%co2温箱中进行培养。从外周血单核细胞的培养开始日起计数培养至第7天为止,得到作为导入有il-7/ccl19表达-抗人间皮素car载体的t细胞的“抗人间皮素car-il-7/ccl19表达t细胞”或作为导入有常规抗人间皮素car载体的t细胞的“抗人间皮素car表达t细胞”。抗人间皮素car-il-7/ccl19表达t细胞中含有外源性的编码抗人间皮素car的核酸、外源性的编码il-7的核酸和外源性的编码ccl19的核酸。抗人间皮素car表达t细胞中含有编码抗人间皮素car的核酸,不含有外源性的编码il-7的核酸和外源性的编码ccl19的核酸。另外,同时,作为car阴性细胞对照,制作利用同样的方法将从同一健康人供者获得的外周血单核细胞活化、但未进行逆转录病毒感染的“car、il-7和ccl19非表达-t细胞”(非基因导入细胞:non-infection)。
在此,如上所述,为了向t细胞中导入编码抗人间皮素car的核酸、编码il-7的核酸和编码ccl19的核酸,使用了逆转录病毒载体。因此,在对导入有上述各核酸的t细胞进行培养而使其增殖的情况下,也存在该t细胞的细胞质内含有逆转录病毒载体的t细胞,但多数情况下,在t细胞中,编码抗人间皮素car的核酸、编码il-7的核酸和编码ccl19的核酸被整合到基因组中。在该t细胞中编码抗人间皮素car的核酸、编码il-7的核酸和编码ccl19的核酸被整合到基因组中的情况下,抗人间皮素car、il-7和ccl19由所导入的外源性的重组构建体进行表达。
[实施例2]利用流式细胞术的car表达测定
(流式细胞术分析)
通过流式细胞术分析进行将间皮素作为抗原来识别的car的表达水平分析。使所制作的抗人间皮素car-il-7/ccl19表达t细胞与重组人间皮素(在c末端包含6-his)(biolegend公司制造)、藻红蛋白(pe)标记抗6-his单克隆抗体(abcam公司制造)和别藻蓝蛋白(apc)标记抗cd8单克隆抗体(affymetrix公司制造)反应来进行染色。流式细胞仪使用ec800(索尼公司制造),数据分析使用flowjo软件(treestar公司制造)。
(结果)
首先,将具有vh07(15)vl07(由信号肽t表达)、vh07(15)vl07(由信号肽p表达)或vh36(15)vl36作为scfv区域的抗人间皮素car-il-7/ccl19表达t细胞的流式细胞术分析结果示于图2。图2中,各图中横轴表示car的表达,纵轴表示cd8的表达。如图2所示,确认到:与car、il-7和ccl19非表达-t细胞(non-infection,非感染)相比,3种抗人间皮素car-il-7/ccl19表达t细胞的car的表达均高。
接着,将具有vh07(15)vl07、vl07(15)vh07、vh07(25)vl07、vl07(25)vh07作为scfv区域的抗人间皮素car-il-7/ccl19表达t细胞的流式细胞术分析结果示于图3。图3中,各图中横轴表示car的表达,纵轴表示cd8的表达。(a)是car、il-7和ccl19非表达-t细胞(non-infection,非感染)的结果,(b)~(e)是具有各scfv区域的抗人间皮素car-il-7/ccl19表达t细胞的结果。另外,图中的数值表示各群的百分比。如图3(b)~(e)所示,在抗人间皮素car-il-7/ccl19表达t细胞中,确认到car的表达。
[实施例3]各肿瘤细胞的间皮素表达
(流式细胞术分析)
为了确认表达间皮素的肿瘤细胞株,对各肿瘤细胞株中的间皮素的表达水平进行了确认。将恶性间皮瘤的细胞株acc-meso-1、y-meso8a、nci-h2052、nci-h226、msto211h、肾癌的细胞株a498用pe标记的市售的间皮素抗体(目录号fab32652p;r&dsystems公司制造)进行染色,通过流式细胞术分析测定各肿瘤细胞中的间皮素的表达。需要说明的是,pe标记抗人间皮素抗体以3μg/样品进行染色。流式细胞仪使用ec800(索尼公司制造),数据分析使用flowjo软件(treestar公司制造)。
(结果)
将结果示于图4。在恶性间皮瘤的细胞株acc-meso-1、y-meso8a、nci-h2052、nci-h226、msto211h中,确认到间皮素的表达。另一方面,在肾癌的细胞株a498中,未确认到间皮素的表达。
[实施例4]细胞杀伤性试验-1
(共培养试验)
将抗人间皮素car-il-7/ccl19表达t细胞(scfv区域为vh07(15)vl07或vh07(25)vl07)作为效应子,与间皮素阳性肿瘤细胞株(acc-meso-1、nci-h2052)或间皮素阴性肿瘤细胞株(a498)一起在培养板上调节至效应子:肿瘤细胞比为1:1、1:3、1:5(1:5仅为ifn-γ的测定分析)后,在37℃温箱中进行共培养。将该共培养的说明示于图5。培养液使用包含10%胎牛血清(fetalcalfserum:fcs)、1%青霉素-链霉素(和光纯药公司制造)、50μm的2-me(gibco公司制造)和25mm的hepes(sigma-aldrich公司制造)的rpmi。通过流式细胞术测定共培养开始2天后残存的肿瘤细胞株,并且使用市售的ifn-γelisa试剂盒(biolegend公司制造)测定培养上清中产生的ifn-γ。将利用流式细胞术得到的共培养开始2天后残存的肿瘤细胞株的测定结果示于图6a~6c,将共培养后的所产生的ifn-γ的测定结果示于图7a~7c。需要说明的是,作为抗人间皮素car-il-7/ccl19表达t细胞的对照,使用car、il-7和ccl19非表达-t细胞(noninfection,非感染)。流式细胞术时,将死细胞用zombieyellow(注册商标;biolegend公司制造)进行染色来区分,将t细胞用pe标记抗cd45单克隆抗体(biolegend公司制造)进行染色。流式细胞仪使用bdlsrfortessax-20(bdbiosciences公司制造),数据分析使用flowjo软件(treestar公司制造)。
(结果)
如图6a~6c所示,在作为对照的car、il-7和ccl19非表达-t细胞(non-infection,非感染)各自与靶肿瘤细胞的共培养中,无论对于哪一种靶肿瘤细胞,都显示出与仅有肿瘤的孔(tumoronly)相同程度地增殖。另一方面,对于抗人间皮素car-il-7/ccl19表达t细胞,在与间皮素阴性靶细胞(a498:图6c)的共培养中,靶肿瘤细胞与仅有肿瘤的孔同样地增殖,但在与间皮素阳性肿瘤细胞(acc-meso-1:图6a、nci-h2052:图6b)的共培养中,与仅有间皮素阳性肿瘤细胞的孔以及与对照细胞的共培养的孔相比,明确观察到肿瘤细胞的数量减少。由此可以确认,抗人间皮素car-il-7/ccl19表达t细胞呈抗原特异性地杀伤了肿瘤细胞。
此外,如图7a~c所示,在使用共培养后的上清的ifn-γ的elisa分析中,也仅在抗人间皮素car-il-7/ccl19表达t细胞与间皮素阳性肿瘤细胞(acc-meso-1:图7a、nci-h2052:图7b)的共培养的上清中确认到显著的ifn-γ的产生。
[实施例5]细胞杀伤性试验-2
(共培养试验)
利用与实施例4同样的方法,将抗人间皮素car-il-7/ccl19表达t细胞(scfv区域为vhmo(15)vlmo、vlmo(15)vhmo、vhmo(25)vlmo或vlmo(25)vhmo)、或“car、il-7和ccl19非表达-t细胞”(非基因导入细胞:non-infection)与作为间皮素阳性肿瘤细胞株的pan02肿瘤细胞株或间皮素阴性肿瘤细胞株一起在培养板上调节至效应子:肿瘤细胞比为1:1、1:3后,在37℃温箱中进行共培养。将利用流式细胞术得到的共培养开始3天后或5天后残存的白细胞或pan02肿瘤细胞株的测定结果示于图8,将共培养后的所产生的ifn-γ的测定结果示于图9。需要说明的是,关于本实施例和后述实施例5的“在肿瘤模型中的治疗效果”中使用的表达抗人间皮素car、il-7和ccl19的t细胞,作为pmsgv1逆转录病毒表达载体,使用按照插入小鼠il-7-f2a-小鼠ccl19-f2a-hsv-tk来代替人il-7-f2a-人ccl19-f2a-hsv-tk、插入小鼠cd8跨膜区和小鼠cd28-4-1bb-cd3ζ细胞内信号转导区来代替人cd8跨膜区和人cd28-4-1bb-cd3ζ细胞内信号转导区的方式制备的pmsgv1逆转录病毒表达载体,作为t细胞,使用来自于脾脏和淋巴细胞的小鼠t细胞,依照实施例1的方法进行制作(以下称为“抗人间皮素car-小鼠il-7/小鼠ccl19表达小鼠t细胞”)。另外,关于本实施例中使用的“car、il-7和ccl19非表达-t细胞”(非基因导入细胞:non-infection),使用来自于脾脏和淋巴细胞的小鼠t细胞作为t细胞。
(结果)
如图8所示,可以确认到,抗人间皮素car-小鼠il-7/小鼠ccl19表达小鼠t细胞杀伤了肿瘤细胞。另外,如图9所示,在使用共培养后的上清的ifn-γ的elisa中,也仅在抗人间皮素car-小鼠il-7/小鼠ccl19表达小鼠t细胞与pan02肿瘤细胞株的共培养的上清中确认到显著的ifn-γ的产生。
[实施例6]在肿瘤模型中的治疗效果
(抗小鼠间皮素car-il-7/ccl19表达t细胞向肿瘤模型小鼠的给药)
对7-10周龄的c57bl/6小鼠(从slc公司购入)皮下接种5×105个pan02胰腺癌细胞株。在接种后第7天向腹腔内给药作为抗癌剂的环磷酰胺(cyclophosphamide:cpa、100mg/kg),在第10天向静脉内给药1×106个上述实施例5中制作的抗人间皮素car-小鼠il-7/小鼠ccl19表达小鼠t细胞(scfv区域为vhmo(15)vlmo、vlmo(15)vhmo、vhmo(25)vlmo或vlmo(25)vhmo))或“抗人间皮素car表达小鼠t细胞”。将vhmo(15)vlmo、vhmo(25)vlmo的小鼠的存活率的结果示于图10,将vhmo(15)vlmo、vlmo(15)vhmo、vhmo(25)vlmo或vlmo(25)vhmo)的肿瘤的体积的结果示于图11。图10中,横轴为皮下接种pan02后的天数(将对小鼠皮下接种pan02的那天作为第0天),纵轴为存活率。另外,图11中,横轴为皮下接种pan02后的天数,纵轴为肿瘤体积(肿瘤的长轴×(肿瘤的短轴)2/2(mm3))。“未处理”表示仅给药cpa的组,“conv.”表示在cpa给药后给药抗人间皮素car表达小鼠t细胞的组,“7×19”表示在cpa给药后给药抗人间皮素car-小鼠il-7/小鼠ccl19表达小鼠t细胞的组。需要说明的是,关于上述“抗人间皮素car表达小鼠t细胞”,在上述实施例1记载的“抗人间皮素car表达t细胞”的制作方法中,作为pmsgv1逆转录病毒表达载体,使用按照插入hsv-tk来代替人il-7-f2a-人ccl19-f2a-hsv-tk、插入小鼠cd8跨膜区和小鼠cd28-4-1bb-cd3ζ细胞内信号转导区来代替人cd8跨膜区和人cd28-4-1bb-cd3ζ细胞内信号转导区的方式制备的pmsgv1逆转录病毒表达载体,作为t细胞,使用来自于脾脏和淋巴细胞的小鼠t细胞,除此以外利用与实施例1同样的方法进行制作。
(结果)
如图10所示,表明:通过给药本发明的抗人间皮素car-il-7/ccl19表达t细胞,存活率显著提高。另外,如图11所示,表明:通过给药本发明的抗人间皮素car-il-7/ccl19表达t细胞,肿瘤的增殖明显得到抑制。由此表明,在肿瘤模型小鼠中,抗人间皮素car-il-7/ccl19表达t细胞显示出优良的抗肿瘤活性。
[实施例7]在肿瘤模型中的治疗效果-2
已表明抗人间皮素car-il-7/ccl19表达t细胞显示出优良的抗肿瘤活性,但为了进一步确认长期的抗肿瘤效果和胰腺癌以外的抗肿瘤效果,对免疫缺陷小鼠给药人恶性胸膜间皮瘤细胞株,使其形成肿瘤,然后考察通过有无给药抗人间皮素car-il-7/ccl19表达t细胞,在143天内有无肿瘤复发。本实施例中使用的“acc-meso-1-gfp-luc株的制作方法”、“t细胞的活化方法”如下所述。
(acc-meso-1-gfp-luc株的制作)
对于由爱知县癌症中心研究所关户好孝先生惠赠的作为间皮素阳性肿瘤细胞株的人恶性间皮瘤细胞株acc-meso-1,使用慢病毒进行绿色荧光蛋白-荧光素酶(gfp-luc)的基因导入。
在第0天将acc-meso-1以1×103个细胞/孔接种到96孔板中。培养基使用添加有10%fbs的rpmi1640(gibco公司制造)。在第1天以moi100添加作为发光细胞制作用慢病毒颗粒的redifectred-fluc-gfp(perkinelmer公司制造),开始转导。此时,为了提高基因导入效率,以终浓度为4μg/ml的方式向培养基中添加溴化己二甲铵(sigma-aldrich公司制造)。在病毒添加24小时后(第2天),除去含有病毒的培养基,进行培养基的更换。继续培养后,利用sh800(sony公司制造)仅分选表达gfp的细胞,得到表达gfp的acc-meso-1、即“acc-meso-1-gfp-luc”。
(抗人间皮素car-il-7-ccl19表达t细胞和抗人间皮素car表达t细胞的制作)
在本实施例7中,使用由实施例1得到的il-7/ccl19表达-抗人间皮素car载体(scfv区域用vh07(15)vl07dna片段置换,信号肽为序列号11所示的信号肽t)或常规抗人间皮素car载体(scfv区域用vh07(15)vl07dna片段置换,信号肽为序列号11所示的信号肽t)。
(t细胞的活化)
在固相化有retronectin25μl/ml(宝生物公司制造)和抗人cd3单克隆抗体5μg/ml(invitrogen公司制造、5μg/ml)的细胞培养用6孔板中,将在第0天从健康人供者采集的2×106个外周血单核细胞与il-2(peprotech公司制造)一起在37℃、5%co2温箱中开始培养。培养液使用在optmizercts(gibco公司制造)中添加l-谷氨酰胺2mm(gibco公司制造)、1%青霉素-链霉素(和光纯药工业公司制造)和两性霉素b2.5μg/ml(百时美施贵宝公司制造)而得到的培养液。培养3天,在第3天在显微镜下确认到t细胞活化而发生形态变化,得到活化t细胞。
(肿瘤的复发观察)
首先,在第0天对8周龄的雌性nsg免疫缺陷小鼠以2×106个细胞/小鼠胸腔内给药上述acc-meso-1-gfp-luc。在第1天使用活体成像系统(invivoimagingsystem:ivis)确认到肿瘤在胸腔内的成活。在第1天将利用实施例1的方法制作后冷冻的抗人间皮素car表达t细胞、抗人间皮素car-il-7-ccl19表达t细胞(scfv区域为vh07(15)vl07)和利用上述方法活化的t细胞解冻。上述抗人间皮素car表达t细胞和上述抗人间皮素car-il-7-ccl19表达t细胞的car表达率分别为49.6%、32.5%,因此,在抗人间皮素car表达t细胞中加入上述活化t细胞,将两者的car表达率合并后,准备给药1×105个细胞的上述抗人间皮素car表达t细胞的组(n=5)、给药1×105个细胞的上述抗人间皮素car-il-7-ccl19表达t细胞的组(n=5)。抗人间皮素car表达t细胞和抗人间皮素car-il-7-ccl19表达t细胞的给药从尾静脉通过静脉内给药来进行。此外,在第3天以后,进行使用ivis的肿瘤荧光强度的测定(发光量:总通量(光子/秒:photons/sec)。将结果示于图12a、图12b。另外,将上述结果中的自给药起的天数与小鼠的存活率的关系作图得到的图示于图13,将自给药起的天数与总荧光量(光子/秒)的关系作图得到的图示于图14。图12a、图12b、图13和图14中,将给药抗人间皮素car-il-7-ccl19表达t细胞的组用“7×19car-t”表示,将给药抗人间皮素car表达t细胞的组用“常规car-t”表示。需要说明的是,在本实施例7中,使用内源性t细胞缺陷的nsg免疫缺陷小鼠作为受者,因此排除了受者的内源性t细胞的影响,对给药的抗人间皮素car-il-7-ccl19表达t细胞自身的效果进行了评价。
如图12a、图12b、图13和图14所示,在第21天,7×19car-t、常规car-t均几乎未观察到肿瘤荧光强度。在7×19car-t中,之后直至第143天也未观察到肿瘤荧光,确认到复发被完全抑制。另一方面,在常规car-t中,从第45天左右起开始观察到肿瘤荧光,在第115天肿瘤荧光强度增高,在第129天1只死亡,在第143天剩余的4只也死亡。因此表明,通过car-il-7-ccl19表达t细胞的给药,不仅对胰腺癌具有细胞杀伤活性,而且对人恶性胸膜间皮瘤等表达人间皮素的癌细胞也具有细胞杀伤活性,并且具有长期的抗肿瘤效果。
本申请以2017年12月24日提交的日本特愿2017-247109号作为基础,其内容全部包含在本说明书中。
序列表
<110>诺伊尔免疫生物科技株式会社(noile-immunebiotech,inc.)
<120>表达特异性地识别人间皮素的细胞表面分子、il-7和ccl19的免疫活性细胞
(immunocompetentcellthatexpressesacellsurfacemoleculespecificallyrecognizinghumanmesothelin,il-7andccl19)
<130>kt-07p
<150>jp2017-247109
<151>2017-12-24
<160>33
<170>patentinversion3.1
<210>1
<211>128
<212>prt
<213>人工
<220>
<223>vh07_aa
<220>
<223>发明人:玉田耕治(tamada,koji);佐古田幸美(sakoda,yukimi);安达圭志(adachi,keishi)
<400>1
glnvalglnleuglnglnserglyproglyleuvalthrprosergln
151015
thrleuserleuthrcysalaileserglyaspservalserserasn
202530
seralathrtrpasntrpileargglnserproserargglyleuglu
354045
trpleuglyargthrtyrtyrargserlystrptyrasnasptyrala
505560
valservallysserargmetserileasnproaspthrserlysasn
65707580
glnpheserleuglnleuasnservalthrprogluaspthralaval
859095
tyrtyrcysalaargglymetmetthrtyrtyrtyrglymetaspval
100105110
trpglyglnglythrthrvalthrvalserserglyileleuglyser
115120125
<210>2
<211>116
<212>prt
<213>人工
<220>
<223>vl07_aa
<400>2
glnprovalleuthrglnserserserleuseralaserproglyala
151015
seralaserleuthrcysthrleuargserglyileasnvalglypro
202530
tyrargiletyrtrptyrglnglnlysproglyserproproglntyr
354045
leuleuasntyrlysseraspserasplysglnglnglyserglyval
505560
proserargpheserglyserlysaspalaseralaasnalaglyval
65707580
leuleuileserglyleuargsergluaspglualaasptyrtyrcys
859095
metiletrphisserseralaalavalpheglyglyglythrglnleu
100105110
thrvalleuser
115
<210>3
<211>128
<212>prt
<213>人工
<220>
<223>vh36_aa
<400>3
glnvalglnleuglnglnserglyproglyleuvalthrprosergln
151015
thrleuserleuthrcysalaileserglyaspservalserserasn
202530
seralathrtrpasntrpileargglnserproserargglyleuglu
354045
trpleuglyargthrtyrtyrargserlystrptyrasnasptyrala
505560
valservallysserargmetserileasnproaspthrserlysasn
65707580
glnpheserleuglnleuasnservalthrprogluaspthralaval
859095
tyrtyrcysalaargglymetmetthrtyrtyrtyrglymetaspval
100105110
trpglyglnglythrthrvalthrvalserserglyileleuleuser
115120125
<210>4
<211>115
<212>prt
<213>人工
<220>
<223>vl36_aa
<400>4
glnprovalleuthrglnserserserleuseralaserproglyala
151015
seralaserleuthrcysthrleuargserglyileasnvalglypro
202530
argiletyrtrptyrglnglnlysproglyserproproglntyrleu
354045
leuasntyrlysseraspserasplysglnglnglyserglyvalpro
505560
serargpheserglyserlysaspalaseralaasnalaglyvalleu
65707580
leuileserglyleuargsergluaspglualaasptyrtyrcysmet
859095
iletrphisserseralaalavalpheglyglyglythrglnleuthr
100105110
valleuser
115
<210>5
<211>119
<212>prt
<213>人工
<220>
<223>vhmo_aa
<400>5
glnvalglnleuvalglnserglyalagluvallyslysproglyala
151015
servallysvalsercyslysalaserglytyrthrphethrglyasn
202530
tyrileasntrpvalargglnalaproglyglnglyleuglutrpmet
354045
glyileileasnprothrlysglytrpthrleutyralaglnlysphe
505560
glnglyargvalthrmetthrargaspthrserileserthralatyr
65707580
metgluleuserserleuargsergluaspthralavaltyrtyrcys
859095
alaargtrphishisglythrtrpilepheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
<210>6
<211>109
<212>prt
<213>人工
<220>
<223>vlmo_aa
<400>6
aspilevalleuthrglnproproservalserglyalaproglygln
151015
argvalthrilesercysserglyserserserasnileglyserasn
202530
tyrvalsertrptyrglnglnleuproglythralaprolysleuleu
354045
iletyrasnaspasnglnargproserglyvalproaspargpheser
505560
glyserlysserglythrseralaserleualailethrglyleugln
65707580
sergluaspglualaasptyrtyrcysserthrtyraspargargthr
859095
pheservalpheglyglyglythrlysleuthrvalleu
100105
<210>7
<211>21
<212>prt
<213>人工
<220>
<223>cd8m_aa
<400>7
iletyriletrpalaproleualaglythrcysglyvalleuleuleu
151015
serleuvalilethr
20
<210>8
<211>41
<212>prt
<213>人工
<220>
<223>cd28_a_aa
<400>8
argserlysargserargleuleuhisserasptyrmetasnmetthr
151015
proargargproglyprothrarglyshistyrglnprotyralapro
202530
proargaspphealaalatyrargser
3540
<210>9
<211>46
<212>prt
<213>人工
<220>
<223>4-1bb_a_aa
<400>9
argpheservalvallysargglyarglyslysleuleutyrilephe
151015
lysglnprophemetargprovalglnthrthrglnglugluaspgly
202530
cyssercysargpheproglugluglugluglyglycysglu
354045
<210>10
<211>113
<212>prt
<213>人工
<220>
<223>cd3z_a_aa
<400>10
leuargvallyspheserargseralaaspalaproalatyrglngln
151015
glyglnasnglnleutyrasngluleuasnleuglyargarggluglu
202530
tyraspvalleuasplysargargglyargaspproglumetglygly
354045
lysproargarglysasnproglngluglyleutyrasngluleugln
505560
lysasplysmetalaglualatyrsergluileglymetlysglyglu
65707580
argargargglylysglyhisaspglyleutyrglnglyleuserthr
859095
alathrlysaspthrtyraspalaleuhismetglnalaleupropro
100105110
arg
<210>11
<211>19
<212>prt
<213>人工
<220>
<223>信号肽t_aa
<400>11
metasptrpthrtrpargileleupheleuvalalaalaalathrgly
151015
alahisser
<210>12
<211>23
<212>prt
<213>人工
<220>
<223>信号肽p_aa
<400>12
metalaleuprovalthralaleuleuleuproleualaleuleuleu
151015
hisalaalaargproglyser
20
<210>13
<211>10
<212>prt
<213>人工
<220>
<223>vh07_cdr1_aa
<400>13
glyaspservalserserasnseralathr
1510
<210>14
<211>9
<212>prt
<213>人工
<220>
<223>vh07_cdr2_aa
<400>14
thrtyrtyrargserlystrptyrasn
15
<210>15
<211>13
<212>prt
<213>人工
<220>
<223>vh07_cdr3_aa
<400>15
alaargglymetmetthrtyrtyrtyrglymetaspval
1510
<210>16
<211>9
<212>prt
<213>人工
<220>
<223>vl07_cdr1_aa
<400>16
serglyileasnvalglyprotyrarg
15
<210>17
<211>7
<212>prt
<213>人工
<220>
<223>vl07_cdr2_aa
<400>17
tyrlysseraspserasplys
15
<210>18
<211>9
<212>prt
<213>人工
<220>
<223>vl07_cdr3_aa
<400>18
metiletrphisserseralaalaval
15
<210>19
<211>8
<212>prt
<213>人工
<220>
<223>vl36_cdr1_aa
<400>19
serglyileasnvalglyproarg
15
<210>20
<211>8
<212>prt
<213>人工
<220>
<223>vhmo_cdr1_aa
<400>20
glytyrthrphethrglyasntyr
15
<210>21
<211>8
<212>prt
<213>人工
<220>
<223>vhmo_cdr2_aa
<400>21
ileasnprothrlysglytrpthr
15
<210>22
<211>12
<212>prt
<213>人工
<220>
<223>vhmo_cdr3_aa
<400>22
alaargtrphishisglythrtrpilepheasptyr
1510
<210>23
<211>8
<212>prt
<213>人工
<220>
<223>vlmo_cdr1_aa
<400>23
serserasnileglyserasntyr
15
<210>24
<211>3
<212>prt
<213>人工
<220>
<223>vlmo_cdr2_aa
<400>24
asnaspasn
1
<210>25
<211>10
<212>prt
<213>人工
<220>
<223>vlmo_cdr3_aa
<400>25
serthrtyraspargargthrpheserval
1510
<210>26
<211>15
<212>prt
<213>人工
<220>
<223>接头15_aa
<400>26
glyglyglyglyserglyglyglyglyserglyglyglyglyser
151015
<210>27
<211>25
<212>prt
<213>人工
<220>
<223>接头25_aa
<400>27
serseralaaspaspalalyslysaspalaalalyslysaspaspala
151015
lyslysaspaspalalyslysaspgly
2025
<210>28
<211>177
<212>prt
<213>智人(homosapiens)
<400>28
metphehisvalserpheargtyrilepheglyleuproproleuile
151015
leuvalleuleuprovalalaserseraspcysaspilegluglylys
202530
aspglylysglntyrgluservalleumetvalserileaspglnleu
354045
leuaspsermetlysgluileglyserasncysleuasnasngluphe
505560
asnphephelysarghisilecysaspalaasnlysgluglymetphe
65707580
leupheargalaalaarglysleuargglnpheleulysmetasnser
859095
thrglyasppheaspleuhisleuleulysvalsergluglythrthr
100105110
ileleuleuasncysthrglyglnvallysglyarglysproalaala
115120125
leuglyglualaglnprothrlysserleuglugluasnlysserleu
130135140
lysgluglnlyslysleuasnaspleucyspheleulysargleuleu
145150155160
glngluilelysthrcystrpasnlysileleumetglythrlysglu
165170175
his
<210>29
<211>98
<212>prt
<213>智人(homosapiens)
<400>29
metalaleuleuleualaleuserleuleuvalleutrpthrserpro
151015
alaprothrleuserglythrasnaspalagluaspcyscysleuser
202530
valthrglnlysproileproglytyrilevalargasnphehistyr
354045
leuleuilelysaspglycysargvalproalavalvalphethrthr
505560
leuargglyargglnleucysalaproproaspglnprotrpvalglu
65707580
argileileglnargleuglnargthrseralalysmetlysargarg
859095
serser
<210>30
<211>531
<212>dna
<213>智人(homosapiens)
<400>30
atgttccatgtttcttttaggtatatctttggacttcctcccctgatccttgttctgttg60
ccagtagcatcatctgattgtgatattgaaggtaaagatggcaaacaatatgagagtgtt120
ctaatggtcagcatcgatcaattattggacagcatgaaagaaattggtagcaattgcctg180
aataatgaatttaacttttttaaaagacatatctgtgatgctaataaggaaggtatgttt240
ttattccgtgctgctcgcaagttgaggcaatttcttaaaatgaatagcactggtgatttt300
gatctccacttattaaaagtttcagaaggcacaacaatactgttgaactgcactggccag360
gttaaaggaagaaaaccagctgccctgggtgaagcccaaccaacaaagagtttggaagaa420
aataaatctttaaaggaacagaaaaaactgaatgacttgtgtttcctaaagagactatta480
caagagataaaaacttgttggaataaaattttgatgggcactaaagaacac531
<210>31
<211>294
<212>dna
<213>智人(homosapiens)
<400>31
atggccctgctactggccctcagcctgctggttctctggacttccccagccccaactctg60
agtggcaccaatgatgctgaagactgctgcctgtctgtgacccagaaacccatccctggg120
tacatcgtgaggaacttccactaccttctcatcaaggatggctgcagggtgcctgctgta180
gtgttcaccacactgaggggccgccagctctgtgcacccccagaccagccctgggtagaa240
cgcatcatccagagactgcagaggacctcagccaagatgaagcgccgcagcagt294
<210>32
<211>8
<212>prt
<213>人工
<220>
<223>2a肽切割区
<220>
<221>misc_feature
<222>(2)..(2)
<223>val或ile
<220>
<221>misc_feature
<222>(4)..(4)
<223>任意氨基酸
<400>32
aspxaagluxaaasnproglypro
15
<210>33
<211>25
<212>prt
<213>人工
<220>
<223>f2a_aa
<400>33
glyserglyvallysglnthrleuasnpheaspleuleulysleuala
151015
glyaspvalgluserasnproglypro
2025
- 还没有人留言评论。精彩留言会获得点赞!