一种在细胞系中条件性敲除必需基因的方法与流程
本发明属于基因工程技术领域,具体涉及一种在细胞系中条件性敲除必需基因的方法。
背景技术:
在细胞中敲除靶基因并观察所得表型是生物学研究中确定一个基因功能最常用的方法。然而,有一些基因是维持细胞存活必不可少的,称为必需基因。直接敲除必需基因,将导致细胞死亡,无法研究敲除后对细胞功能的影响。这类基因只能靠条件性敲除研究。
已有的几种条件性敲除方法总结如下:
1)cre/loxp重组系统是条件性敲除必需基因最常用的方法。该技术需要在靶基因两侧插入一对34bp的loxp位点,在cre重组酶作用下,两个lox位点之间的序列会发生重组删除。所用的cre重组酶一般为mer-cre-mer,加雌激素cre可以发挥重组功能。cre需要整合到基因组上表达。
2)另一种常用的方法是利用tet-on/tet-off调控基因表达。首先构建一个稳定表达转录激活因子tta的细胞系,然后将tre启动子插入到内源基因上游启动子序列中,这样就可以调控内源基因表达。也可以先引入外源基因,再将内源基因敲除,外源基因启动子为tre启动子,受dox调控表达。然而这些方法都需要多个步骤来构建外源基因稳定整合的细胞系,耗时耗力。研究突变对基因功能的影响时,往往需要将突变引入到内源基因上,工作量很大。
技术实现要素:
为了克服现有技术的不足,本发明目的在于提供一种在细胞系中条件性敲除必需基因的方法及研究必需基因突变体功能的方法。本发明方法简单、快速、有效。本发明通过构建同时存在条件下细胞才能存活的一个双质粒系统,把crispr/cas9基因编辑系统、tet-off诱导调控系统和外源基因克隆到这个双质粒系统中,实现必需基因条件性敲除。本发明的技术方案具体介绍如下。
本发明提供一种在细胞系中条件性敲除必需基因的方法,具体步骤如下:
(1)构建双质粒系统,双质粒系统包含ko质粒(敲除质粒)和rescue质粒(营救质粒),ko质粒含有用于敲除内源基因的sgrna和cas9基因,用于调控外源基因表达的tta基因和负责质粒在真核细胞中复制的ebna1和orip元件;rescue质粒含有补偿敲除的必需基因的外源补偿基因,用于筛选转染成功细胞的抗药基因和在ebna1蛋白的作用下可以使质粒在真核细胞中复制的orip元件;将靶向目的基因的sgrna克隆到ko质粒上,将外源补偿基因cdna克隆到rescue质粒上;
(2)将双质粒系统转染到细胞中,在药物筛选下培养若干天,分选单克隆,测序鉴定,即筛选出必需基因纯合敲除的细胞系。
本发明中,步骤(1)中,为了避免rescue质粒上的外源基因被ko质粒上的crispr/cas9靶向破坏,需要在rescue质粒的sgrna靶向序列和pam序列上引入同义突变。
本发明中,rescue质粒中的外源补偿基因表达受dox诱导调控。
本发明中,步骤(1)中,rescue质粒还含有荧光素基因,方便观察转染效率和tet-off调控效果。
本发明中,步骤(1)中,rescue质粒中含有的抗药基因是puromycin抗性基因、zencin抗性基因、blast抗性基因或neomycin抗性基因中任一种。
本发明中,步骤(2)中,细胞选自成纤维细胞,胚胎干细胞,多潜能诱导多能干细胞ips,上皮细胞,成肌细胞,也可以是哺乳动物细胞系包括中国仓鼠卵巢细胞、由sv40转化的猴肾cvi系、人胚肾系293、幼仓鼠肾细胞、小鼠sertoli细胞、猴肾细胞、非洲绿猴肾细胞、人宫颈癌细胞、犬肾细胞、buffalo大鼠肝细胞、人肺细胞、人肝细胞、小鼠乳腺瘤细胞、大鼠肝瘤细胞、hih/3t3细胞、人u2-os骨肉瘤细胞、人a549细胞、人k562细胞、人hek293细胞、人hek293t细胞、人hct116细胞、人mcf-7细胞或tri细胞中任一种。
本发明中,步骤(2)中,将双质粒系统转染到细胞里,通过药物筛选后,含有rescue质粒的细胞才能存活。rescue质粒的复制依赖于ko质粒,所以活下来的细胞含有两个质粒。单独一个质粒无法使细胞长期存活。
本发明中,步骤(2)中,在筛选到的纯合敲除细胞系中加doxcylin可以关闭外源补偿基因表达,用来研究必需基因功能。
本发明进一步提供一种研究必需基因突变体功能的方法,其在上述的步骤(1)和步骤(2)后,还包括构建另一个替换质粒rescue2,再将rescue2质粒转染细胞系,用新的抗生素筛选,recue质粒被替换为rescue2,进而研究突变基因对细胞的影响;其中:替换质粒rescue2包含与rescue不同的抗性标记以及含有突变的外源基因,用于编码带有突变的必需基因。
本发明中用到的双质粒系统具有以下特性:
1)外源补偿基因表达可以补偿内源基因敲除对细胞的影响;
2)外源补偿基因表达受dox诱导调控;
3)双质粒系统能在细胞中长期存在,提高编辑效率;
4)表达的外源基因是可以被替换的。
与现有方法相比,本发明具有如下有益效果:
1.本发明不需要将遗传元件整合到基因组上,操作简单。
2.本发明可外源表达必需基因突变体并研究其功能,不需要在内源基因上
引入突变。
附图说明
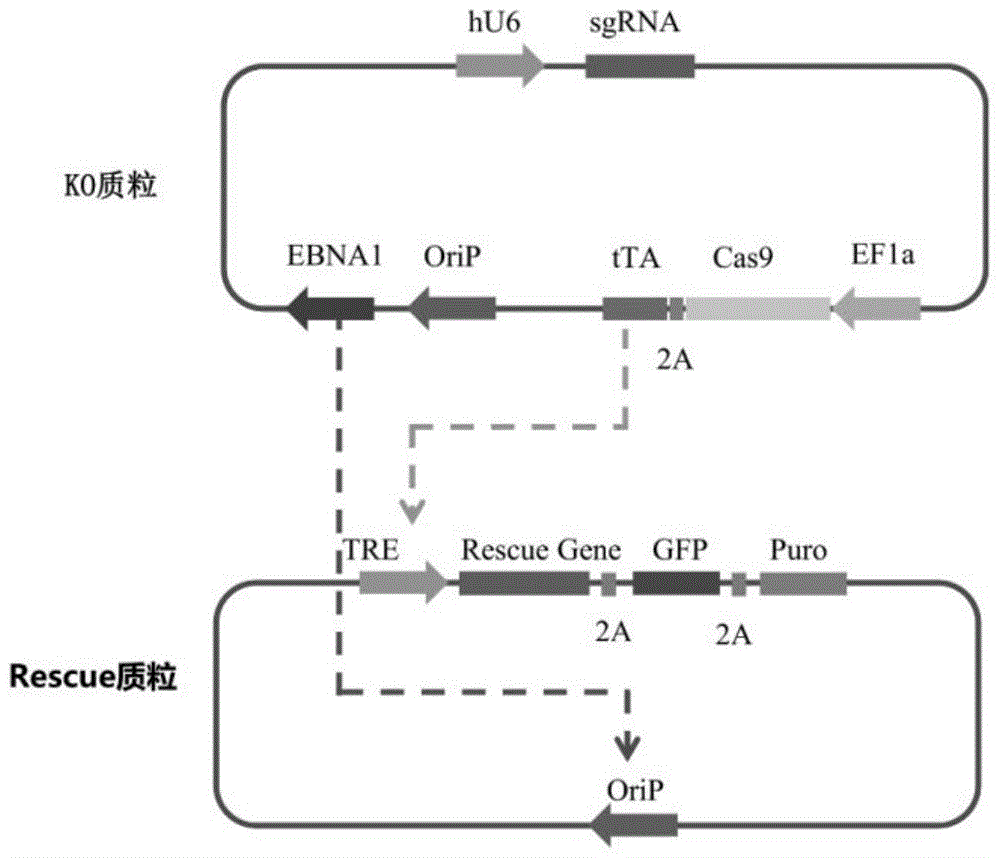
图1为双质粒系统设计示意图。
图2为在hek293t细胞中验证双质粒双质粒系统的功能结果。第一排为白光视野下的细胞图片,第二排为蓝光视野下的细胞图片,图中标尺长度为200um。
图3为利用双质粒系统构建必需基因hdac3条件性敲除细胞系的结果。图3a是基因组和rescue质粒上sgrna靶位点的序列,下划线标记sgrna识别序列,绿色标记pam序列,红色标记突变碱基。图3b是编辑效率统计图,横轴是编辑天数,纵轴是编辑效率。图3c是筛选到的hdac3纯合敲除细胞系加dox处理结果,第一排为白光视野下的细胞图片,第二排为蓝光视野下的细胞图片,图中标尺长度为200um。
图4为利用双质粒系统构建条件性敲除细胞系实验流程图。
图5为利用双质粒系统构建必需基因dnmt1条件性敲除细胞系的结果。图5a是基因组和rescue质粒上sgrna靶位点的序列,下划线标记sgrna识别序列,绿色标记是pam序列红色标记突变碱基。图5b是编辑效率统计图,横轴是编辑天数,纵轴是编辑效率。图5c是筛选到的dnmt1纯合敲除细胞系加dox处理结果,第一排为白光视野下的细胞图片,第二排为蓝光视野下的细胞图片,图中标尺长度为200μm。图5d是加dox处理后,dnmt1蛋白westernblot检测结果。
图6为recue质粒和替换质粒rescue2设计示意图。用rfp-zeocin元件替换rescue质粒上的gfp-puromycin元件,同时将待研究的突变位点引入外源cdna中,构成替换质粒rescue2质粒。
图7为质粒替换的结果。图7a是野生型和突变型的基因序列图示,红色标记突变碱基,下划线标记pmli酶切位点。图7b是pcr产物的pmll酶切凝胶电泳图,用于检测替换效率,其中,m:1000bpmarker;0d,1d和20d分别表示转染a570v-rescue2质粒前,转染1天和转染20天后,提基因组,pcr产物经pmli酶切后的电泳图。
具体实施方式
以下实施例进一步说明本发明的内容,但不应理解为本发明的限制。
若未特别指出,本发明所使用的实验技术手段为本领域技术人员所熟知的常规手段。
实施例中,双质粒系统的设计示意图如图1所示。双质粒系统包含ko质粒和rescue质粒。ko质粒含有hu6启动子转录的sgrna,ef1a启动子转录的核酸内切酶cas9基因和用于诱导型基因表达的tta基因,以及用于质粒在细胞中维持和复制的orip/ebna1元件。cas9和tta基因均由ef1a转录但被p2a元件隔开。rescue质粒含有由启动子tre启动表达的外源补偿基因,gfp荧光标记基因和嘌呤霉素抗性基因,通过p2a连接,还包括用于质粒在细胞中复制的orip元件。
实施例1:在hek293t中验证双质粒系统的功能。具体包括如下步骤:
(1)转染前一天,hek293t细胞传代铺板于12孔板中,等细胞生长密度为60%-70%左右时,进行细胞转染。每组设置3个复孔,三个实验组分别为:单转ko质粒,单转rescue质粒,同时转染两个质粒;
(2)按照lipo2000操作说明进行转染操作,每孔质粒转染量为1ug;
(3)转染24小时给细胞换液加药,使用荧光显微镜观察转染细胞中荧光表达情况以及细胞存活状况;
(4)药筛9天后,细胞每天换液加dox处理,使用荧光显微镜观察转染细胞中荧光表达情况以及细胞存活状况;
实验结果如图2所示,单转ko质粒或者rescue质粒,puro药筛,发现细胞没有表现出绿色荧光,并且在puro药筛3天后细胞全部死亡。而在细胞中共转双质粒系统时,荧光显微镜下观察到绿色荧光,并且荧光比例随puro药筛时间的延长而增大,这说明,puro药筛存活下来的细胞同时含有两个质粒。tet-off系统受dox诱导调控,dox通过和tta竞争性结合,来阻止tre启动子下游基因的表达。转染双质粒的hek293t细胞,加dox处理,绿色荧光几乎全部消失,说明双质粒系统确实受dox诱导调控。
实施例2:在hek293t细胞中利用双质粒系统构建必需基因hdac3条件性敲除细胞系。实验流程如图3所示,具体步骤如下:
(1)构建双质粒系统,靶向hdac3基因的sgrna为:
ggaaggacaccgtcatgacc,合成一对oligo,序列为:
sgrna-hdac3-f:ccgggaaggacaccgtcatgacc
sgrna-hdac3-r:aaccatgacggtgtccttcccgg
oligo退火后连接到ko载体上,得到hdac3-ko载体。hdac3-cdna序列由公司合成,在sgrna靶序列和pam处引入点突变避免被cas9切断(如图3a所示),把hdac3-cdna片段克隆到rescue质粒tre启动子下游的多克隆位点上,得到hdac3-rescue质粒;
(2)使用lipo2000按照操作说明,将两个质粒转染到hek293t细胞中,24小时后换液,用2ug/mlpuro药筛,转染后5天,10天,15天提基因组,pcr扩增,测序,统计编辑效率。pcr扩增引物为:
t7-hdac3-f:gacctccctcctccctgatt
t7-hdac3-r:gaggaggggacacctgagat
(3)药筛10天后,分选单克隆,扩增单克隆细胞,提基因组,pcr扩增内源基因组上的编辑位点,sanger测序,筛选出hdac3基因纯合敲除的细胞系;
(4)筛选出的hdac3纯合敲除的细胞系长起来后,加dox处理,观察细胞绿色荧光表达变化和存活状况;
结果如图3所示随着编辑时间的延长,编辑效率逐渐提高;针对hdac3位点,挑选8个单克隆进行测序分析,发现有7个是纯合敲除,纯合敲除效率达到87.5%。加dox处理3天,gfp荧光消失,11天细胞死亡。表明利用双质粒系统可以很容易获得必需基因纯合敲除细胞系,并且外源补偿基因表达是受dox诱导调控的。
实施例3:在hek293t细胞中利用双质粒系统构建必需基因dnmt1条件性敲除细胞系。具体步骤如下:
(1)构建双质粒系统,靶向dnmt1基因的sgrna为:
gatgtgggaccctgcggccc,合成一对oligo,序列为:
sgrna-dnmt1-f:ccggatgtgggaccctgcggccc
sgrna-dnmt1-r:aacgggccgcagggtcccacatc
oligo退火后连接到ko载体上,得到dnmt1-ko载体。dnmt1-cdna序列由公司合成,在sgrna靶序列和pam处引入点突变避免被cas9切断(如图4a所示),把dnmt1-cdna片段克隆到rescue质粒tre启动子下游的多克隆位点上,得到dnmt1-rescue质粒;
(2)使用lipo2000按照操作说明,将两个质粒转染到hek293t细胞中,24小时后换液,用2ug/mlpuro药筛,转染后5天,10天,15天提基因组,pcr扩增,测序,统计编辑效率。pcr扩增引物为:
t7-dnmt1-f1:ccgtaggctccatctctgaa
t7-dnmt1-r1:acccgtttacctgaggaagg
t7-dnmt1-f2:acctgaaacgacttccaacc
t7-dnmt1-r2:cctccacagacagagggaag
(3)药筛10天后,分选单克隆,扩增单克隆细胞,提基因组,pcr扩增内源基因组上的编辑位点,sanger测序,筛选出dnmt1基因纯合敲除的细胞系;
(4)筛选出的dnmt1纯合敲除的细胞系长起来后,加dox处理,观察细胞绿色荧光表达变化和存活状况;westernblot检测加dox前后dnmt1蛋白表达水平变化;
结果如图4所示随着编辑时间的延长,编辑效率逐渐提高;针对dnmt1位点,挑选12个单克隆进行测序分析,发现有10个是纯合敲除,纯合敲除效率达到83.3%。加dox处理3天,gfp荧光消失,7天细胞死亡。加dox后dnmt1蛋白不能被检测到。表明利用双质粒系统可以很容易获得必需基因纯合敲除细胞系,并且外源补偿基因表达是受dox诱导调控的。
实施例4:在hek293t细胞中验证rescue2质粒替换功能。具体步骤如下:
(1)通过gibson重组的方法将a570v突变引入外源dnmt1-cdna序列中,用
rfp-zeocin元件替换rescue质粒上的gfp-puromycin元件,构成替换质粒a570v-rescue2质粒(图3)。
(2)在实施例1中得到的dnmt1纯合敲除细胞系中,转染a570v-rescue2质粒,使用300~400ug/ml的zeocin药筛;
(3)分别取转染后24小时和20天后的细胞样品,特异性扩增dnmt1-rescue质粒和a570v-rescue2质粒上含有突变位点的序列,a570v-rescue2质粒上含有pmel酶切位点,dnmt1-rescue质粒没有,a570v-rescue2质粒的pcr产物能够被切开,dnmt1-rescue质粒的pcr产物不能被切开(图7)。
通过rflp方法检测a570v-rescue2质粒的替换效率。结果显示,a570v-rescue2替换质粒转染效率是23%,zeocin药筛20天后,替换效率达到93.9%;即在新的抗性筛选下可以实现对于rescue质粒的替换,来研究必需基因突变体的功能。
- 还没有人留言评论。精彩留言会获得点赞!