一种抗EGFR全人源化单克隆抗体的纯化工艺的制作方法
本发明涉及生物医药
技术领域:
,尤其涉及一种抗egfr全人源化单克隆抗体的纯化工艺。
背景技术:
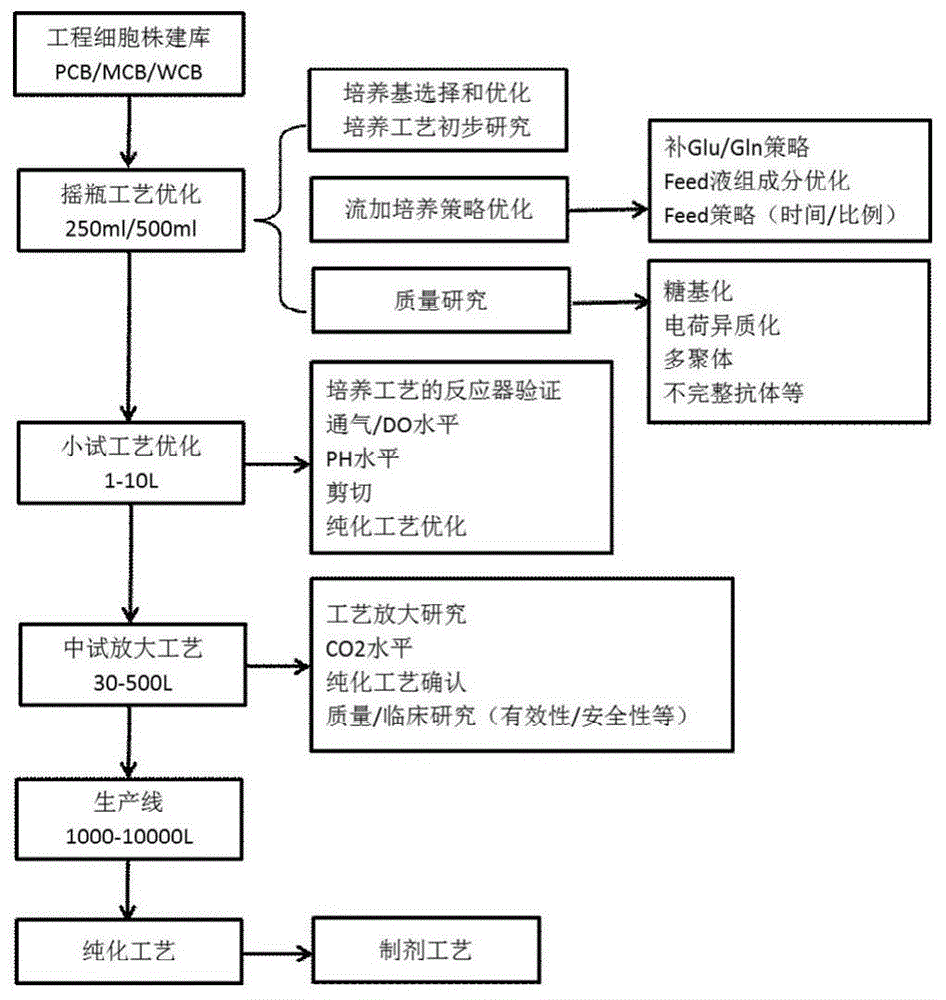
:单克隆抗体(monoclonalantibody,mab)是由单一b细胞克隆产生的具有高度均一、仅针对某一特定抗原表位的抗体,具有特异靶向性,适应症主要集中在肿瘤、自身免疫性疾病、感染性疾病等方面。自1997年全球第一个治疗性单克隆抗体rituxin由fda批准上市以来,短短20年间单克隆抗体迅速在全球的生物医药领域迅猛发展,成为近年来研究热点之一。近年来,国内也涌现出一批研究治疗性单克隆抗体药物的企业和研究机构,其中以表皮生长因子受体(epidermalgrowthfactorreceptor,egfr)为靶标的治疗性抗体尤为关注。egfr是一种跨膜糖蛋白,在实体瘤中呈现高表达。egfr表达阳性的肿瘤具有恶性度高、侵袭力强的特点,且egfr表达水平的高低与预后相关,因而成为当前肿瘤分子靶向治疗的一个重要靶点。以egfr为靶标的单克隆抗体药物,能与内源性配体竞争结合egfr,通过抑制酪氨酸激酶的激活、促进egfr内化等作用产生抗肿瘤效应。目前国内外已有3种抗egfr单克隆抗体上市,与其他化疗药相比,具有靶点明确、疗效显著、毒副作用低等特点,在临床上取得了较好的疗效。最早上市的抗egfr单克隆抗体是2004年被美国fda(thefoodanddrugadministration)批准的西妥昔单抗,是一种重组的抗egfr人鼠嵌合单克隆抗体,用于治疗转移性结肠癌,该产品已于2009年获批进入在国内上市,中文商品名:爱必妥;帕尼单抗是第一个重组抗egfr全人源化单克隆抗体,用于晚期结直肠癌的治疗,其免疫原性较西妥昔单抗等嵌合单抗更低,潜在的临床应用副作用更低。目前帕尼单抗已在欧美、日本等40多个国家批准上市,但国内所需依然依赖进口,进口原研药价格昂贵,限制了多数结直肠癌患者治愈的机会。当前国内已有研究机构和药企联合开发帕尼单抗生物类似药。但生物类似药的研发不同于化学仿制药的研发,相比较而言,生物类似药的研发具有相当的技术门槛。每一生产步骤的微小改变均会对终产物的表达量或活性造成影响;高表达细胞株和细胞培养工艺开发、蛋白纯化工艺和过程控制、抗体药物的质量标准等,都限制着生物类似药研发及产业化。技术实现要素:为解决现有技术存在的局限和缺陷,本发明以原研药帕尼单抗作为参考对照,构建高表达细胞株,研发中试规模培养和纯化工艺,以获取原研药性状、功能相似的重组抗egfr人源化单克隆抗体。本发明提供了一种抗egfr全人源化单克隆抗体的纯化工艺,其特征在于,将vectibix抗体细胞培养液进行以下处理:两级深层过滤澄清、亲和层析、低ph孵育病毒灭活、阴离子交换层析、阳离子交换层析、浓缩透析。优选的,所述两级深层过滤澄清步骤中,首先以100l/m2,600lmh冲洗过滤装置,所述过滤装置为并联两个milliporepodd0hc,2×540cm2后串联milliporepoda1hc,540cm2;再用至少2倍d0hc系统死体积的平衡缓冲液以600lmh平衡过滤装置,直到测定a1hc流出液的ph值与平衡缓冲液一致后开始过滤vectibix抗体细胞培养液,弃去a1hc流出端0.5-0.7倍整个系统死体积滤液后,将流出端串联至除菌过滤器,开始收集滤液,保持进料速度在≤200lmh,保持各级过滤器压力≤15psi;最后样品过滤结束后,用至少2倍整个系统死体积的缓冲液将残留在深层过滤膜中的料液置换出,合并所有滤液,所述平衡缓冲液tris-hac浓度为50mm,nacl浓度为150mm,ph值为7.4。优选的,所述亲和层析步骤中,所用填料为mabselect,层析柱5.0×25cm,cv491ml,对层析系统进行冲洗、消毒和平衡后上样两级深层过滤澄清步骤得到的合并滤液,流速250cm/h,dbc≤35mg/ml填料,保留时间≥5min,淋洗所用平衡液:50mmna-acetate,ph值6.0,淋洗后洗脱,洗脱平衡液:50mmna-acetate,ph值3.5,收集uv280:150-150mau/mm。优选的,所述低ph孵育病毒灭活步骤中,将亲和层析洗脱峰调节ph值至3.5-3.8室温孵育2-4h进行病毒灭活,再中和至ph值5.5-5.8,中和后的产品再经过除菌过滤。优选的,所述阴离子交换层析步骤中,所用填料为superq650m(tosoh),层析柱2.6×22.8cm,cv121ml,低ph孵育病毒灭活步骤得到的产品调ph值至6.9,对层析系统进行消毒和平衡后上样,流速250cm/h,dbc≤189mg/ml填料,保留时间≥5min,开始收集uv280:50mau/mm,淋洗所用平衡液:100mmtris-hac,ph值6.9,结束收集uv280:50mau/mm。优选的,所述阳离子交换层析步骤中,所用填料porosxs,层析柱2.6×25.4cm,cv135ml,对层析系统进行消毒和平衡后上样,流速250cm/h,dbc≤65mg/ml填料,保留时间≥5min,淋洗所用平衡液:50mmna-acetate,ph值5.0,淋洗后洗脱,洗脱平衡液:50mmna-acetate,140mmnacl,ph值5.0,收集uv280:150-150mau/mm。优选的,所述浓缩透析步骤中,进行产品浓缩和换液,渗透压276mosm/kg,进料通量为不超过360lmh,保持进料端压力不超过20psi和跨膜压不超过15psi,通过透析缓冲液调整浓度至19-21mg/ml,再用除菌过滤器进行过滤。本发明还涉及一种用于vectibix抗体药物生产的细胞株构建方法,其特征在于,在中国仓鼠卵巢细胞二氢叶酸还原酶缺陷株cho/dhfr-的细胞完成转染步骤后的pool筛选步骤中,第一阶段利用不含ht的sfm4cho培养基对整合重链基因的细胞株进行筛选,同时利用培养基中的blasticidin筛选出整合有轻链基因的细胞株;第二阶段加入mtx以增加整合进细胞株基因组的轻、重链基因拷贝数以提高表达量。优选的,pool筛选步骤中,第一阶段,培养基中glutamax-i浓度为4mm,blasticidin浓度为10mg/l,每周两次进行传代到细胞活率恢复到85%以上;第二阶段,培养基中glutamax-i浓度为4mm,blasticidin浓度为10mg/l,mtx浓度为500nm,每周两次传代到细胞活率恢复到90%以上。优选的,转染步骤中,通过完全培养基调节中国仓鼠卵巢细胞二氢叶酸还原酶缺陷株cho/dhfr-的细胞密度至10e5cells/ml的细胞密度后,转染体积为10ml后,加入线性化质粒pcho1.0invitrogen20ug、freestyletmmaxreagent16.7ul和optiprotmsfm0.67ml培养,6h后再加入10mlcddg44完全培养基,所述cddg44完全培养基中,glutamax-i浓度为4mm,pluronicf68(pf68)浓度为18ml/l。优选的,pool筛选步骤完成后进行克隆扩增,使用2x103补料培养,2x103补料中fm012浓度为50g/l,每次补料将糖补至终浓度10-12g/l。优选的,补料培养后进行铺板培养,将细胞按300cells/ml的密度计算相应的细胞量加入含有半固体培养基的离心管中混匀后铺板,每孔体积2.5ml,移入到温度36.5℃,6%co2恒温培养箱中静置培养。优选的,铺板培养使用的半固体培养基配制方法为:将90mlclonemediumchodhfr于铺板前24小时从-40℃取出放于2-8℃冰箱,将2mlglutamax-i、1mlclonedetectantihumanfitc、2mlclonexlreagent加入到预备的clonemediumchodhfr中,再加入mtx和blasticidin,使其在终体积100ml时浓度分别为500nm和10mg/l,并且用宿主细胞上清将体积调至到100ml。优选的,构建过程中的细胞培养条件:温度36.5℃,湿度75%至85%,二氧化碳浓度6%,旋转半径2.5cm,转速110至225rmp,体积20至30ml。本发明的有益贡献在于:1、首次克隆筛选出适合大试生产工艺的表达量达2.0g/l-3.0g/l的高效稳定细胞株,产品sec、pi-cief、脱糖分子量、基于细胞的抗体活性均显著提升,糖基化经工艺优化后也有显著改善,为重组抗egfr人源化单克隆抗体在国内实现产业化提供可能。2、自主研发四级步骤纯化工艺,创新性地融合两级深层过滤澄清、亲和层析、低ph孵育病毒灭活、阴离子交换层析、阳离子交换层析、浓缩透析等工艺,纯化过程各反应条件温和,易于产业化,实现纯化收率≥70%,原液纯度≥95%,大大降低产业化成本。创新性地采用低ph孵育法,不但可以在不引入外源性残留物的情况下灭活病原体,还可以在酸性环境里将ngf亚基分开,具有“一个步骤、两个作用”优势。附图说明图1是本发明整体构思逻辑图。图2是实施例一中细胞株构建示意图。图3是实施例一中pool批次补料实验细胞活率曲线图。图4是实施例一中pool批次补料实验细胞密度曲线图。图5是实施例一中待选细胞株批次补料实验活率曲线图。图6是实施例一中待选细胞株批次补料实验密度曲线图。图7是实施例一中待选细胞株批次补料实验表达量柱状图。图8是实施例一中选定细胞株批次补料实验细胞密度曲线图。图9是实施例一中选定细胞株批次补料实验细胞活率曲线图。图10是实施例二中以pcb,mcb,wcb,eopc细胞cdna为模板扩增hc(m:markeriii;lane1:cdna,以抽提的总rna逆转录得到的cdna为pcr扩增的模板;lane2:rna,以未逆转录的原始rna作为扩增的阴性对照;lane3:h2o,以h2o作为pcr扩增的阴性对照)。图11是实施例二中以pcb,mcb,wcb,eopc细胞cdna为模板扩增lc(m:markeriii;lane1:cdna,以抽提的总rna逆转录得到的cdna为pcr扩增的模板;lane2:rna,以未逆转录的原始rna作为扩增的阴性对照;lane3:h2o,以h2o作为pcr扩增的阴性对照)。图12是实施例三中活细胞密度随时间变化曲线图。图13是实施例三中细胞活率随时间变化曲线图。图14是实施例三中葡萄糖浓度随时间变化曲线图。图15是实施例三中乳酸盐浓度随时间变化曲线图。图16是蛋白产量随时间变化曲线图。图17是实施例五中的亲和层析图谱。图18是实施例五中的阴离子交换层析图谱。图19是实施例五中的阳离子交换层析图谱。具体实施方式为使本领域的技术人员更好地理解本发明的技术方案,下面结合实施例对本发明进行详细描述。如图1和2中所示,本发明以原研产品vectibix(panitumumab)帕尼单抗为参比品,开发氨基酸序列与vectibix一致的生物类似药。在前期小试工艺的基础上,摸索和优化200l规模的中试工艺方法和条件,确定关键工艺参数,形成完整的质量控制体系与标准,为重组抗egfr全人源化单克隆抗体的进一步大规模产业化奠定基础。本发明采用自主创新工艺进行重组抗egfr人源化单克隆抗体中试生产工艺开发研究,拟突破高效稳定细胞株构建、细胞培养工艺、纯化工艺三项关键技术;拟通过技术改造和工艺创新,在产品质量达到或超过原研国外该药物质量的同时,大幅降低其制备成本,为更多的结直肠癌患者提供治愈的机会。本发明以下实施例中对照所用标准品均为市售vectibix400mg/20ml(帕尼单抗静脉输入溶液,安进公司)。细胞株构建细胞株构建包括实施例一和二,构建稳定高效的细胞株是重组抗egfr全人源化单克隆抗体实现国内产业化的关键。本实施例拟通过构建重组抗egfr人源化单克隆抗体(vectibix)抗体药物生产的cho/dhfr-工程细胞株,制备50支原始细胞库(pcb,primarycellbank)、100支主细胞库(mcb,mastercellbank)和200支工作细胞库(wcb,workcellbank),以筛选出适合大试生产工艺的高表达vectibix细胞株。通过工艺优化,使表达量达2.0g/l以上,最老细胞表达量不低于70%,易放大生产;产品sec、pi-cief、脱糖分子量、基于细胞的抗体活性以及糖基化均达到原研药水平。实施例一转染实验:实验材料:宿主细胞:dg44(中国仓鼠卵巢细胞二氢叶酸还原酶缺陷株cho/dhfr-,atcc)转染试剂:freestylemaxreagent(invitrogen16447-100)optiprosfm(gibco12309-019)线性化质粒:pcho1.0invitrogendg44完全培养基:cddg44(invitrogen12610-010)含有4mmglutamax-i(invitrogen35050-061)18ml/lpluronicf68(pf68)(invitrogen24040-032)耗材及相关仪器摇瓶corning125mlerlenmeyerflask,货号:431143;摇床inforsht型号:multitronⅱ参数设置:110rpm,36.5℃,6%co2,湿度75%;细胞计数仪beckmancoulter型号:vi-cellxr生物安全柜上海上净型号:bsc-ⅱa2转染实验步骤:1、转染24h前,备用转染的dg44细胞以8e5/ml的密度进行传代,培养基为cddg44完全培养基。2、转染当天,对备用的转染细胞进行计数和活率检测。3、用cddg44完全培养基将细胞密度调节到10e5cells/ml的细胞密度,转染体积为10ml,使用125ml摇瓶。4、将20ug的质粒(pcho1.0invitrogen)和16.7ul的freestyletmmaxreagent分别加入含有0.67ml的optiprotmsfm混合。5、将质粒和转染试剂的混合物在室温下孵育10min后,加入到事先备用转染的细胞中,放入摇床中进行培养。6、6h后加入10mldg44完全培养基继续培养。pool的筛选实验:耗材及相关仪器摇瓶corning125mlerlenmeyerflask,货号:431143摇床inforsht型号:multitronⅱ参数设置:110rpm,36.5℃,6%co2,湿度75%。细胞计数仪beckmancoulter型号:vi-cellxr生物安全柜上海上净型号:bsc-ⅱa2离心机eppendorf型号:centrifuge5810r批次补料实验培养基信息如下表1:表1培养基名称品牌货号sfm4chohyclonesh30518.01glutaminesigmag8540mtxsigmaa6770-1blasticidininvitrogena11139-03pool的筛选实验步骤转染后第一步利用不含ht的sfm4cho培养基对整合重链基因的细胞株进行筛选,同时培养基中含有的blasticidin可筛选出整合有轻链基因的细胞株。第二步加入mtx是为了增加整合进细胞株基因组的轻、重链基因拷贝数,提高表达量。通过两步加压可筛选得到同时整合有轻、重链序列的高表达稳定细胞株。步骤一:基础培养基:sfm4cho并含有:4mmglutamax-i,10mg/lblasticidin传代:细胞在125ml摇瓶中按每周两次进行传代,一直到细胞活率恢复到85%以上。冻存细胞两次,每次2支。步骤二:基础培养基:sfm4cho并含有:4mmglutamax-i,10mg/lblasticidin,500nmmtx传代:细胞在125ml摇瓶中按每周两次传代,一直到细胞活率恢复到90%以上。冻存细胞两次,每次2支。pool批次补料耗材及相关仪器摇瓶corning125mlerlenmeyerflask,货号:431143摇床inforsht型号:multitronⅱ参数设置:110rpm,36.5℃,6%co2,湿度75%。细胞计数仪beckmancoulter型号:vi-cellxr生物安全柜上海上净型号:bsc-ⅱa2批次补料实验培养基信息见下表2:表2培养基名称品牌货号sfm4chohyclonesh30518.01cellboost5(cb5)hyclonesh30865.03fm012sheffield5x004832x103多宁f103-201glutamax-igibco35050-061glucosesigma49139实验方案如下:当细胞活率恢复到90%以上时,在125ml摇瓶中进行批次补料实验。pool名称:jn-xbk(10mg/lblasticidin+500nmmtx)细胞按5e5cells/ml接种培养培养4天,培养基sfm4cho。生长4天后,1:5稀释到fed-batch基础培养基90%sfm4cho+10%cb5中。批次补料实验方案:补料:2x103;50g/lfm012in2x103;每次补料将糖补至终浓度10-12g/l。实验条件如表3:表3批次补料实验结果如附图2和3,pool批次补料实验收获上清后通过hplc-proteina进行titer检测,结果:jn-xbk的第十三天titer为1.67g/l。半固体培养基铺板:设备与耗材:6孔板greinerbio-onecellstar货号:657185细胞计数仪beckmancoulter型号:vi-cellxr二氧化碳静置培养箱thermoscientific型号:heracell240i恒温水浴锅thermo,microprocessorcontrolled280,475524生物安全柜上海上净型号:bsc-ⅱa2培养基及试剂如表4:表4配方组份供应商货号clonemediumchodhfrgenetixk8712clonexlreagentgenetixk8521glutamax-igibco35050-061mtxsigmaa6770-1blasticidininvitrogena11139-03clonedetectanti-humanfitcgenetixk8200半固体培养基配制步骤:将一瓶90mlclonemediumchodhfr于铺板前24小时从-40℃取出放于2-8℃冰箱待用。将2mlglutamax-i、1mlclonedetectantihumanfitc、2mlclonexlreagent加入到预备的clonemediumchodhfr中。将mtx和blasticidin加入到预备的clonemediumchodhfr中,使其在终体积100ml时浓度分别为500nm和10mg/l。用宿主细胞上清将体积调至到100ml。铺板步骤:1.细胞计数,取培养的pooljn-xbk用vicell-xr计数备用。2.取出两份已配制混匀的半固体培养基放入无菌的50ml离心管中,每份10ml。3.将已计数的细胞按300cells/ml的密度计算相应的细胞量加入步骤2的离心管中,混匀。4.用移液管将制备好的待铺板的细胞分别移入到6孔板中,每孔体积2.5ml。5.铺板结束后,将板移入到温度36.5℃,6%co2恒温培养箱中静置培养。实施例二设备与耗材恒温水浴锅julabo型号:tw20生物安全柜上海上净型号:bsc-ⅱa2二氧化碳静置培养箱thermoscientific型号:heracell240i细胞计数仪beckmancoulter型号:vi-cellxr离心机eppendorf型号:centrifuge5810rclonepixgenetix型号:clonepixfl96孔板(greinerbio-onecellstar,货号:655185)24孔板(greinerbio-onecellstar,货号:662102)6孔板(greinerbio-onecellstar,货号:657185)摇床kuhner型号:climo-shakerisf1-xc参数设置:225rpm,36.5℃,6%co2,湿度85%。摇管tpptubespinbioreactor50,货号:87050培养基及试剂如下表5:表5培养基名称品牌货号sfm4adcfhyclonesh3a2156.01glutaminesigmag8540mtxsigmaa6770-1blasticidininvitrogena11139-03cellboost5(cb5)hyclonesh30865.03fm012sheffield5x004832x103a多宁f103-201.aglucosesigma49139br7多宁f008-007克隆挑取观察克隆生长状况,待克隆形成均匀球形,对克隆进行挑取。1.取1块96孔板,每孔加入新鲜培养基sfm4adcf100ul(内含4mmglutamine,1g/lpf68,10mg/lblasticidin和500nmmtx)。2.用clonepix挑取pooljn-xbk克隆移入到96孔板中(sfm4adcf+10mg/lblasticidin+500nmmtx)。3.将96孔板移入到温度36.5℃,6%co2恒温培养箱中静置培养。htrf克隆筛选及扩增培养基:sfm4adcf(内含4mmglutamine,1g/lpf68,10mg/lblasticidin和500nmmtx)1.克隆挑取后第7天,向96孔板中补加新鲜培养基100ul。2.取上清做htrf检测,选取表达量较高的克隆移入到24孔板中,每孔补加新鲜培养基400ul。3.培养3-4天,将24孔板中的克隆移入到6孔板中,每孔补加新鲜培养基2ml。4.移入6孔板后第3-4天,将6孔板中的克隆移入摇管中,每株克隆补加新鲜培养基8ml。5.取两个htrf较高克隆按照上述操作操作铺板挑取亚克隆,并筛选扩增。批次补料克隆筛选细胞进入摇管经传代两次后,按3e5cells/ml接种培养培养4天,培养基sfm4adcf。生长4天后,1:5稀释到fed-batch基础培养基90%sfm4adcf+10%cb5中,在50ml摇管中进行批次补料实验。将pooljn-xbk的亚克隆命名为jk-i,jk-ii,jk-iii。选择的top3克隆分别为jk-i,jk-ii,jk-iii。批次补料实验方案如下表6和7。补料:30g/lfm012in2x103a;br7。每次补料将糖补至终浓度10-12g/l。表6表7批次补料克隆筛选实验结果见图4至5。克隆筛选批次补料实验利用proteina-hplc检测titer结果见图6,其中jk-i产量最高1.82g/l,选定做进一步摇瓶优化和质量分析,并给上游做工艺开发。选定克隆摇瓶优化实验及质量分析选定克隆摇瓶优化实验克隆名称:jk-i细胞按3e5cells/ml接种培养培养4天,培养基sfm4adcf。生长4天后,1:5稀释到自配的fed-batch基础培养基中。在50ml摇管中进行批次补料实验。批次补料实验方案如表8和9:培养基:sfm4adcf+supplements补料:30g/lfm012in2x103a;br7。每次补料将糖补至终浓度10-12g/l。表8表9实验结果见图7和8,选定克隆批次补料实验优化后proteina-hplctiter检测结果:第14天产量2.05g/l。选定克隆质量分析结果及优化批次补料细胞上清通过proteina一步纯化后送样进行质量分析。表10puritysec-hplc通过puritysec-hplc分析检测,检测结果与原研药(vectibix)接近,指标达到要求。表11pi-cief通过pi-cief检测,抗体的等电点与原研药一致,符合要求。glycan优化前:表12优化后:表13糖基化检测报告显示g0f、g1f、g2f与原研药基本一致,符合要求。表14cellbasedassay通过基于细胞的抗体活性检测,此抗体活性与原研药接近,符合要求。表15deglycosylatedmass通过deglycosylatedmass分析,抗体脱糖分子量与理论值一致。本发明通过pool构建,批次补料实验筛选及铺板、克隆挑取、htrf、克隆扩增、克隆批次补料实验,筛选出高表达vectibix的稳定细胞株jk-i。通过工艺优化表达量达2.05g/l,产品sec、pi-cief、脱糖分子量、基于细胞的抗体活性均显著提升。实施例三细胞株稳定性测试细胞株遗传稳定性是后续获得稳定生产工艺和产品质量的基础。通过分子生物学方法对项目中的pcb(primarycellbank),mcb(mastercellbank),wcb(workcellbank)三个细胞库中的细胞进行遗传稳定性的研究,包括重链(hc)和轻链(lc)dna序列稳定性和拷贝数的稳定性。项目拟开展不低于12周的细胞株稳定性研究,包括细胞生长稳定性,产物表达稳定性及分子水平细胞株稳定性评估。通过分子生物学方法对实施例一中的pcb(primarycellbank),mcb(mastercellbank),wcb(workcellbank)三个细胞库中的细胞和中试规模生产终末细胞eopc(endofproductioncell)进行遗传稳定性的研究,包括重链(hc)和轻链(lc)dna序列稳定性和拷贝数的稳定性。拷贝数的稳定性是分别从pcb,mcb,wcb细胞库和中试生产终末细胞(eopc)(细胞数约各1x107个)抽提基因组dna,通过重链或者轻链相对于内参基因b2m(β2-microglobulin)在qpcr中不同扩增结果的比较,来判断pcb,mcb,wcb三个细胞库和中试生产终末细胞中重链和轻链拷贝数的变化情况。重轻链dna序列稳定性的考察是通过获得pcb,mcb,wcb和eopc细胞(细胞总数大约各1x107个),抽提总rna后,以总rna为模板反转录获得其cdna,其中含有重链和轻链的cdna。再以cdna为模板,利用合成的引物对hc、lc分别进行扩增,最后对pcr产物进行测序,检测各细胞库细胞和终末细胞在基因水平上是否发生突变,从而评价该细胞库的稳定性。通过检测表明:实施例一的pcb,mcb,wcb和中试生产的eopc中,重链和轻链拷贝数没有明显变化;cdna水平上扩增出目的产物,pcr产物交由测序公司负责测序,检测其各细胞库细胞和终末细胞在基因水平上是否发生突变。实验仪器7500fastreal-timepcrsystem(appliedbiosystems,model#7500)biosafetycabinet(airtech,model#bsc-1300iia2)实验耗材dneasyblood&tissuekit(250)(qiagen,cat.#69506)taqmanuniversalmastermixiiwith(ab,cat.#4426710)ungrneasymini试剂盒(qiagen,cat.#74104)superscriptiiifirst-strandsynthesis(invitrogen,cat.#no18080-051)systemforrt-pcr试剂盒primestardna聚合酶(takara,cat.#dr044a)实验样品实施例一jk-i-pcb,实施例一jk-i-mcb和实施例一jk-i-wcb各一支解冻复苏之后培养,分别离心1e7细胞沉淀后备用。三级细胞库和eopc的名称,批号及其来源见表16。表16实验样品名称,批号及来源实施例一中pcb,mcb,wcb和eopc细胞中重轻链拷贝数的稳定性检测1、基因组dna抽提从实施例一jk-i的pcb,mcb,wcb三个细胞库细胞和中试生产终末细胞中抽提基因组dna,具体步骤参照dneasyblood&tissuekit使用手册。2、引物和探针设计设计与重链,轻链和内参基因有特异性结合的引物和探针组合,见表17。表173、qpcr反应设置选取50ng/5μl,10ng/5μl和5ng/5μl三个浓度的pcb,mcb,wcb和eopc的gdna做为底物,按照taqmanuniversalmastermixiiwithung的说明配置25μl的反应体系。abi7500fastrealtimesystem选取comparative-ct(δδct)法设置qpcr后运行实验。实施例一pcb,mcb,wcb和eopc细胞中重轻链基因序列的稳定性检测1、细胞库细胞总rna抽提从实施例一jk-i的pcb,mcb,wcb三个细胞库细胞和中试生产终末细胞中抽提各细胞总rna,具体步骤参照rneasyminikit。2、抗体基因第一链cdna合成用oligodt逆转录扩增出cdna片段,实验步骤参照firstscriptiiifirst-strandsynthesissystemforrt-pcrkit的操作流程。3、hc和lc序列的扩增以逆转录获得的cdna为模板,分别扩增抗体的hc和lc片段,所用的引物见表18,扩增所得的pcr产物,交给测序公司,由其进行测序。表18cdna中hc、lc片段的扩增引物及序列pcb,mcb,wcb和eopc中重链和轻链的不同扩增反应实施例一jk-i各细胞库和eopc中重链hc和轻链lc相对内参基因b2m的ct值差异计算总结在下表中。不同浓度样品下计算出的δct的平均值和标准方差也列于下表19中。表19δct(hc-ref)和δct(lc-ref)计算pcb,mcb,wcb和eopc中重链和轻链的基因拷贝数变化把实施例一jk-ipcb中重链hc和轻链lc相对于内参基因b2m的相对拷贝数标准化至1,mcb,wcb和eopc中重链hc和轻链lc相对于pcb的基因拷贝数变化总结在表20中。表20实施例一jk-ipcb,mcb,wcb和eopc中重链轻链基因拷贝数变化hcpcbmcbwcbeopc-δδct0.00-0.23-0.290.022-δδct1.000.850.821.01lcpcbmcbwcbeopc-δδct0.00-0.09-0.090.182-δδct1.000.940.941.14通过comparative-ct(δδct)法分析,mcb中重链hc基因拷贝数相比pcb中降低了15%,wcb中重链hc基因拷贝数相比pcb中降低了18%,eopc中hc的拷贝数相比pcb中升高了1%;mcb中轻链lc的基因拷贝数相比pcb中降低了6%,wcb中重链lc基因拷贝数相比pcb中降低了6%,eopc中lc的拷贝数相比pcb中升高了14%。实施例一mcb,wcb和eopc中重链和轻链的拷贝数变化均在实验允许的误差范围内。实施例一pcb,mcb,wcb和eopc细胞中重轻链基因序列的稳定性检测结果以逆转录获得的cdna为模板,分别扩增抗体的hc(约1395bp)和lc片段(711bp),扩增所得的pcr产物进行琼脂糖凝胶电泳图,电泳结果见图10和图11。运用vectornti软件,将获得的pcb,mcb,wcb和eopc细胞中hc和lc的测序结果与理论序列进行比较,所有测序序列结果与理论序列比较,都100%吻合。利用定量pcr中comparative-ct(δδct)法分析结果显示,实施例一中pcb,mcb,wcb和eopc中的hc和lc的拷贝数相对稳定。通过测序比对分析显示,实施例一中pcb,mcb,wcb和eopc中的hc和lc的cdna在基因水平上均保持相对稳定,hc和lc序列没有出现基因突变、碱基缺失或增加的现象。综上所述,实施例一中pcb,mcb,wcb和eopc的遗传稳定性良好。实施例四细胞培养中试工艺的优化获得单克隆细胞株后,对培养条件进行优化,以达到更高的表达量和合乎规定的产品质量。细胞培养过程中营养物的耗竭和大量代谢副产物的积累往往是限制细胞生长密度、影响培养过程的主要因素,特别是在批次培养过程中,不断消耗的营养成分往往成为影响细胞密度、细胞活力和细胞表达产物产量的限制性因素。本实施例在小试培养工艺的基础上,扩大规模,优化不同的参数控制范围设计产品的质量。研究细胞生长和单克隆抗体生成动力学,设定物理参数(包括温度、气体流量和搅拌速度)、化学参数(包括溶氧和二氧化碳、ph值、渗透压以及氧化还原电位)、代谢物水平(包括培养基基础底料)、氨基酸和废物(副产物)、以及补料供给时间和泡沫控制等对细胞生长和蛋白产量的影响,确定中试细胞培养最佳环境条件。前期已通过2轮反应器实验和3轮摇瓶实验,确定了培养基,验证了全程35℃为最佳培养温度;最佳补料为2×104(含50g/lfm012),补料时间为第4、7、9、11天;同时通过fg01的流加实验,确定在第4、7、9、11天分别流加0.28%,0.4%,0.4%,0.4%。最终确定了细胞培养小试工艺。本实施例放大实验拟采用培养基流加培养法,进行规模为200l反应器规模培养。观察细胞活率、细胞代谢情况、蛋白产量等进行中试工艺优化,考察培养体积及接种密度、反应器参数控制、培养条件、补料策略(第3天、6天、9天、11天)补料浓度及比例对细胞生长和蛋白产量的影响,进行3批产品的检测并与原研产品对比,最终确定关键工艺参数与中试反应器工艺。本报告中细胞培养工艺研究所用的细胞株为实施例一jk-i,为细胞株开发组通过克隆筛选实验确定的细胞株,以下简称“jk-i克隆”。下面主要介绍了3批15l反应器实验,对小试优化后的工艺进行验证。实验数据表明3批中细胞生长和代谢参数基本平行,收获时分别获得了蛋白产量2.35g/l,2.39g/l,2.45g/l;cex检测结果中酸峰均低于13.3%,糖型分布结果中g0f为47-48%。3批15l实验重复结果比较好,从而验证了小试确定工艺的稳定性,可按照此工艺进行3批200l生产。表21专业术语解释表22设备表23耗材表24培养基成分培养基品牌货号2x104多宁生物科技f104-001cb5hyclonesh30865.03sfm4adcfhyclonesh3a2156.01fm012sheffield5x00483l-glutaminesigmag8540碳酸氢钠sigmas5761碳酸钠sigmas7795葡萄糖sigmag7021pf68spectrump1169mtxsigmam9929bs(blasticidinshcl)gibcoa11139-03本实验中涉及的摇床通用参数设置如下表所示,若非通用设置,详见相应部分的描述。表25通用摇床参数设置表摇床参数设置单位co26%温度36.5℃湿度80%摇床转速125rpm流加培养阶段所用到的取样计划如下表所示,若非通用取样计划,详见相应部分的描述。表26取样留样计划表15l反应器工艺验证实验前期实验结果通过2轮反应器实验和3轮摇瓶实验,验证了全程35℃为最佳培养温度;最佳补料为2×104(含50g/lfm012),补料时间为第4、7、9、11天;同时通过fg01的流加实验,确定在第4、7、9、11天分别流加0.28%,0.4%,0.4%,0.4%。最终确定细胞培养工艺。本轮实验在15l反应器规模进行3批工艺稳定性的验证。种子培养信息细胞来源表27克隆信息表传代和扩种培养信息:表28种子传代、扩增培养基信息表表29n-2,n-1代种子扩增信息表摇床参数设置见表25通用摇床参数设置表所示。取样计划n-2代摇瓶每3-4天取样检测活细胞密度、细胞活率和细胞直径,n-1代反应器每天检测活细胞密度、细胞活率和细胞直径和生化参数(ph,po2,pco2,gln,glu,gluc,lac,nh4+,na+,k+,ca2+,osmo)。流加培养培养体积及接种密度表30流加培养基础信息表培养工艺设置表31流加培养阶段反应器参数控制补料流加表表32培养阶段补料流加表补糖策略每天检测葡萄糖含量,当低于3g/l时,流加400g/l的葡萄糖母液至3-5g/l。收获标准培养至第15天或细胞活率低于50%时收获。取样留样计划见表26通用取样留样计划表所示。实验结果细胞生长从活细胞密度数据来看,3批15l随时间变化的趋势基本相同,均在第11天获得最高活细胞密度,分别为27.06×106cells/ml,29.47×106cells/ml,28.02×106cells/ml,至第15天收获时3批活细胞密度基本相同,约为17×106cells/ml。活细胞密度曲线见图12。从细胞活率数据来看,3批实验细胞活率变化趋势基本相同,收获时细胞活率分别为66.8%,59.8%,63.8%。细胞活率曲线见图13。细胞代谢从葡萄糖浓度数据来看,3批15l变化趋势基本相同,第11天后当葡萄糖含量低于3.0g/l时,补加后葡萄糖终浓度在3.0-5.0g/l之间。葡萄糖浓度曲线见图14。从乳酸盐浓度数据来看,3批15l变化趋势基本相同,收获时3批分别为2.22g/l,2.45g/l,2.12g/l。乳酸盐浓度曲线如图15。蛋白产量结果从蛋白产量数据来看,3批蛋白产量基本平行,分别为2.35g/l,2.39g/l,2.45g/l。蛋白产量曲线见图16。蛋白质量结果蛋白质量结果均引自下游蛋白纯化部门三步纯化后的检测数据。从cex检测数据来看,3批15l第15天收获时cex酸峰面积均低于13.3%。cex检测结果见表33。表33蛋白cex检测结果表从糖型分布数据来看,3批15l第15天收获时g0f分别为47.4%,48.2%,47.4%。糖型分布检测结果见表34。表34蛋白糖型分布检测结果表本次实验数据表明,采用小试确定的最终培养工艺,3批15l生产各批次间细胞生长和代谢参数基本相同,最终获得蛋白产量范围为2.35-2.45g/l,cex酸峰均低于13.3%,糖型分布结果中g0f基本为47-48%,进而验证了工艺的稳定性。此工艺可以进行200l生产。经过3批15l工艺实验,验证了工艺的稳定性。确定的反应器工艺如下表,后续将在200l反应器规模进行3批生产。最终确定的反应器工艺如下:表35反应器参数设置表表36反应器补料流加实验方案实施例五纯化工艺分离纯化步骤中的温度、ph、有机溶剂等都会影响目标蛋白的活性。各步骤的先后顺序及过程控制均会对目标蛋白的纯度与活性造成影响。因此,在生物类似药的分离纯化过程中,所采用的分离纯化条件应尽可能地合理、温和、且应尽量减少操作步骤。此外,生物类似药均来自于生物活性物质,因而需对其所携带的潜在危害因子,尤其是对病毒因子,进行严格控制。本发明多次试验探索纯化工艺,拟采用四级步骤进行纯化。下罐后的细胞培养液经过两级深层过滤澄清处理并除菌过滤后上样到proteina亲和层析柱;亲和层析的洗脱峰经过低ph孵育病毒灭活,再中和后进行过滤;样品再经过调ph后上样到阴离子交换层析柱,收集阴离子层析流穿峰;阴离子层析流穿峰经调ph后上样到阳离子交换层析柱,收集阳离子层析洗脱峰,进行浓缩和换液。换液后的样品经过最终除菌过滤得到产品原液。在小试工艺基础上进行3批200l的中试放大,对关键工艺参数进行筛选和优化,确定中试纯化工艺,进行3批产品的检测并与原研产品对比。预期实现纯化收率平均不低于65%,原液纯度不低于95%,proteina,dna,hcp残留等达标,活性合格。表37缩写表缩写定义chpchinesepharmacopoeiauspunitedstatespharmacopoeiagegeneralelectriccompanyeqequilibrationcvcolumnvolumewfiwaterforinjectiondbcdynamicbindingcapacityuf/dfultrafiltration/diafiltrationnwpnormalizedwaterpermeabilitytmptransmembranepressurelvinlowphvirusinactivation&neutralizationsecsizeexclusionchromatographyciefcapillaryisoelectricfocusinghmwhighmolecularweightlmwlowmolecularweighthcphostcellproteinaexanionexchangechromatographycexcationexchangechromatographycecapillaryelectrophoresislmhliterspersquaremeterperhour下游工艺中所使用的化学试剂见表5。除特别说明外,所有试剂均满足中国药典或美国药典或等效的级别。表38:下游工艺所用试剂一、细胞液澄清实施例一或二下罐的胞培养液采用两级深层过滤的方法进行澄清,再经过除菌过滤后上样到亲和层析柱。材料与设备:压力传感器:pendotechpressuremat蠕动泵:longerpump,bt300-2j样品:三批10l细胞培养液平衡缓冲液:50mmtris-hac,150mmnacl,ph7.4深层过滤器:milliporepodd0hc,2×540cm2(一级);milliporepoda1hc,540cm2(二级)除菌滤器:sartopore2300,sartorius操作步骤如下:用wfi分别将深层过滤器a1hc和d0hc冲洗100l/m2,600lmh。将两个d0hc并联再和a1hc串联,用平衡缓冲液平衡深层过滤器(至少2倍d0hc系统死体积),直到测定a1hc流出液的ph与平衡缓冲液一致,600lmh。开始进行样品的过滤,进料速度逐渐增加,弃去a1hc流出端0.5-0.7倍整个系统死体积后,将流出端串联至除菌过滤器,开始收集滤液。继续过滤,并保持进料速度在≤200lmh,监测并保持各级深层过滤器压力为≤15psi。样品过滤结束后,用至少2倍整个系统死体积的缓冲液将残留在深层过滤膜中的料液置换出。排空深层过滤器,合并所有滤液。采用proteina-hplc法测定深层过滤前后的样品的抗体含量,并计算收率。三批10l细胞培养液的深层过滤澄清实验结果见表39:表39*固含量的计算是根据两级离心(1000g,10min+8000g,10min)后固体含量百分比。二、亲和层析经过澄清和除菌过滤后的上清液采用ge公司的proteina亲和层析填料mabselect进行纯化,收集洗脱峰并取样检测。材料与设备填料和层析柱:mabselect,5.0×25cm,cv491ml设备avant,569951,geph计和电导计:sevenexcellence,multi-parameter,595606,mettlertoledo分光光度计:nanodrop2000,520161,thermoscientific样品:三批澄清处理并经除菌过滤后的细胞培养上清液缓冲液(见表40)方法与结果亲和层析方法详见表40。本次实验操作步骤如下:用1mnaoh对系统及管路进行消毒及去热原处理(保持30min以上)。用wfi冲洗系统及管路至中性,并将各缓冲液管路充满相应的缓冲液。将样品过滤并恢复至室温准备上样。将层析柱接入系统,并准备好运行方法。运行层析方法,收集洗脱峰,取样送检,用nanodrop测定蛋白浓度并计算收率。层析方法运行结束,卸下层析柱。用水冲洗系统管路,并用20%乙醇保存。表40:亲和层析方法表41:亲和层析小结三、低ph孵育病毒灭活和中和将亲和层析洗脱峰调节ph至3.5-3.8室温孵育2-4h进行病毒灭活,再中和至ph5.5-5.8,中和后的产品再经过除菌过滤。材料与设备设备ph计和电导计:sevenexcellence,multi-parameter,595606,mettlertoledo分光光度计:nanodrop2000,520161,thermoscientific样品:亲和层析洗脱收集峰滴定液:1mcitricacid(调酸);1mtrisbase(调碱)除菌过滤器:bottletopfilter,expressplus,0.22微米,millipore方法与结果先从洗脱收集液里取样3ml测定ph,并加入1mcitricacid调节ph至3.5-3.8,根据加入的1mcitricacid的量计算加入的百分比。根据此加入百分比,往洗脱收集液里按比例加入1mcitricacid进行调节,边加边搅拌。混匀后再取样3ml进行ph测定以确认。样品于室温放置,并开始计时,2-4h后同样根据3ml样品调节ph至5.5-5.8时tris加入的百分比按比例加入1mtrisbase。混匀后再取样3ml进行ph测定以确认。中和后的样品进行除菌过滤。三批10l的低ph孵育病毒灭活与中和见表42。表42:低ph孵育病毒灭活与中和小结四、阴离子交换层析将低ph病毒灭活与中和后的样品调节ph至6.9后作为阴离子交换层析的上样。收集阴离子层析流穿峰并取样检测。材料与设备填料和层析柱:superq650m(tosoh),2.6×22.8cm,cv121ml设备avant,569951,geph计和电导计:sevenexcellence,multi-parameter,595606,mettlertoledo分光光度计:nanodrop2000,520161,thermoscientific样品:经病毒灭活与中和后的样品在上样前调ph至6.9除菌过滤器:bottletopfilter,expressplus,0.22微米,millipore缓冲液(见表43)方法与结果阴离子交换层析方法详见表43。本次实验操作步骤如下:(实验结果见表44)用1mnaoh对系统及管路进行消毒及去热原处理(保持30min以上)。用wfi冲洗系统及管路至中性,并将各缓冲液管路充满相应的缓冲液。将样品过滤并恢复至室温准备上样。将层析柱接入系统,并准备好运行方法。运行层析方法,收集流穿的蛋白峰并取样检测,用nanodrop测定蛋白浓度并计算收率。层析方法运行结束,卸下层析柱。用水冲洗系统管路,并用20%乙醇保存。表43:阴离子交换层析方法表44:阴离子交换层析小结五、阳离子交换层析将阴离子层析流穿收集峰调ph至5.0作为阳离子交换层析的上样。收集阳离子层析洗脱峰并取样检测。材料与设备填料和层析柱:porosxs,2.6×25.4cm,cv135ml(第1批10l);porosxs,5.0×21.8cm,cv428ml(第3批10l和第4批10l)设备avant,569951,geph计和电导计:sevenexcellence,multi-parameter,595606,mettlertoledo分光光度计:nanodrop2000,520161,thermoscientific样品:阴离子层析流穿峰调ph至5.0(在第三批10l上样时,样品由于未调ph上样导致流穿,将剩下的样品和流穿的样品重新调ph至5.0后再上样)除菌过滤器:bottletopfilter,expressplus,0.22微米,millipore缓冲液(见表45)8.2方法与结果阳离子交换层析方法详见表45。本次实验操作步骤如下:(实验结果见表46)用1mnaoh对系统及管路进行消毒及去热原处理(保持30min以上)。用wfi冲洗系统及管路至中性,并将各缓冲液管路充满相应的缓冲液。将样品过滤并恢复至室温准备上样。将层析柱接入系统,并准备好运行方法。运行层析方法,对收集的洗脱峰取样检测,用nanodrop测定蛋白浓度并计算收率。层析方法运行结束,卸下层析柱。用水冲洗系统管路,并用20%乙醇保存。表45:阳离子交换层析方法表46:阳离子交换层析小结表47:阳离子交换层析产品的glycan-hplc结果和cex-hplc结果*样品为阳离子洗脱峰稀释后再经过纳滤后的滤出液。六、浓缩透析(uf/df)将阳离子交换层析洗脱峰进行浓缩和缓冲液置换。浓缩及换液完成后调整原液蛋白浓度为19-21mg/ml,进行最终除菌过滤。材料与设备设备蠕动泵:longerpump,bt300-2j/yz1515x,bt300-2j/yz2515x压力监测:pendotech,pressurematph计和电导计:sevenexcellence,multi-parameter,595606,mettlertoledo分光光度计:nanodrop2000,520161,thermoscientific样品:阳离子交换层析洗脱收集峰缓冲液uf/df平衡液和透析缓冲液:6.4g三水合醋酸钠/kg溶液,5.8g氯化钠/kg溶液,0.182g冰醋酸/kg溶液,ph5.8,渗透压276mosm/kg。膜消毒液:1mnaoh膜保存液:0.1mnaoh除菌滤器:bottletopfilter,0.22微米,pes,corning超滤膜和夹具:pelliconxlbiomax30,50cm2,catno.pxb030a50,lotno.c2ma64012-030(第1批10l浓缩和换液);pellicon2mini30k,0.1m2,catno.p2b030a01,lotno.c2pa14764-001,夹具milliporezjmp-14-001(第3批10l和第4批10l浓缩和换液)方法与结果浓缩换液步骤详见表48。本次实验ufdf操作步骤如下:(实验结果见表49、表50)用wfi冲洗膜(对于新膜冲洗80l/m2以上,对于使用过的膜冲洗20l/m2以上)。用1mnaoh进行使用前消毒(循环1h)。用wfi冲洗膜至中性并进行nwp测定。在进料通量360lmh、进料端压力1.0bar、回流端压力0.5bar条件下,测定透过端水流速,计算nwp。将管路及膜中的水排空以测定系统死体积。用至少2倍系统死体积的平衡缓冲液平衡膜。测定回流端和透过端流出液的ph和电导率,需要与平衡缓冲液一致。进行样品浓缩和换液,在此过程中,进料通量为不超过360lmh,调节回流端压力,保持进料端压力不超过20psi和跨膜压不超过15psi。换液至少6倍后,如有必要需进行适当的过度浓缩,然后关闭透过液口的阀门,用至少2倍系统死体积的透析缓冲液进行循环5min以上。将膜排空,所有产品回收到产品储罐。用wfi冲洗膜。用1mnaoh进行使用后消毒(循环1h)。用水冲洗膜,并用0.1mnaoh保存膜。对浓缩换液后产品用适量的透析缓冲液调整浓度至19-21mg/ml,再用除菌过滤器进行过滤,计算uf/df收率。表48:uf/df步骤表49:原液检测结果1(uf/df小结)表50:原液检测结果2(uf/df小结)可以理解的是,以上实施方式仅仅是为了说明本发明的原理而采用的示例性实施方式,然而本发明并不局限于此。对于本领域内的普通技术人员而言,在不脱离本发明的精神和实质的情况下,可以做出各种变型和改进,这些变型和改进也视为本发明的保护范围。序列表<110>济宁学院<120>一种抗egfr全人源化单克隆抗体的纯化工艺<130>201910009<160>13<170>siposequencelisting1.0<210>1<211>19<212>dna<213>人工合成(artificial)<400>1tggagtgggagagcaatgg19<210>2<211>20<212>dna<213>人工合成(artificial)<400>2gcatgggaggtgtggtcttg20<210>3<211>15<212>dna<213>人工合成(artificial)<400>3agccggagaacaact15<210>4<211>19<212>dna<213>人工合成(artificial)<400>4caccctgacgctgagcaaa19<210>5<211>21<212>dna<213>人工合成(artificial)<400>5tgacttcgcaggcgtagactt21<210>6<211>17<212>dna<213>人工合成(artificial)<400>6cagactacgagaaacac17<210>7<211>17<212>dna<213>人工合成(artificial)<400>7ttgggcccttggtgctt17<210>8<211>23<212>dna<213>人工合成(artificial)<400>8aaaccgaaagtagatgcttggaa23<210>9<211>21<212>dna<213>人工合成(artificial)<400>9cttccttgttggcccgctgcc21<210>10<211>22<212>dna<213>人工合成(artificial)<400>10cattgacgcaaatgggcggtag22<210>11<211>20<212>dna<213>人工合成(artificial)<400>11atatggtggaaaataacata20<210>12<211>23<212>dna<213>人工合成(artificial)<400>12acgctgttttgacctccatagaa23<210>13<211>22<212>dna<213>人工合成(artificial)<400>13gtcatagcgcgggttccttccg22当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1