一种能提高马抗破伤风免疫球蛋白滴度的免疫方法与流程
本发明涉及基因工程和动物免疫技术领域,具体涉及一种能提高马抗破伤风免疫球蛋白滴度的免疫方法,具体指用重组破伤风毒素重链c片段嵌合体抗原与破伤风类毒素共同免疫马匹可以获得的抗破伤风抗体滴度要比这两种抗原各自免疫马匹产生的相应抗体高的效果。
背景技术:
破伤风毒素(tent)菌分泌的外毒素,破伤风杆菌在自然界广泛存在,在厌氧的环境下,微酸性,一定的营养条件下能生长并分泌tent。当人和动物有深层外伤并感染破伤风杆菌孢子时,破伤风杆菌孢子就能发芽、生长并产生破伤风毒素。tent是一种蛋白,由一条50kd的轻链和一条100kd的重链通过二硫键连接而成。单一轻链或者单一重链都不致病,只有完整的毒素才引起动物神经中毒。毒素进入体内后和细胞表面的受体结合,通过细胞內吞进入胞浆,最终抑制神经传导介质释放。tent轻链本身就足以阻断神经传导介质的释放,但是必须进入细胞,才能在细胞内发挥毒性作用。tent重链涉及毒素与敏感细胞表面的神经节苷脂结合,使得包括tent轻链在内的毒素可以进入细胞。分子量100kd重链在木瓜蛋白酶的酶解作用下产生一条分子量为50kd的多肽,系重链的c端片段(fragmentc),此片段介导了毒素与神经节苷脂的结合,从而使毒素通过细胞内吞进入细胞。用重链的c片段免疫小鼠后,能产生保护性中和抗体,这种小鼠能阻止毒素与神经节苷脂的结合,抑制了tent毒素的细胞內吞,tent毒素无法进入细胞发挥毒性。
在破伤风的被动免疫治疗和预防中,马抗体发挥了无可替代的作用。马抗破伤风抗体是治疗破伤风感染的特效药物,也是预防破伤风感染的常用药物。在我国,应用抗破伤风免疫球蛋白后,大大降低了破伤风的发病率、破伤风病人的治愈率也明显提高。
早在1924年,ramon就用甲醛处理灭活tent得到无毒的破伤风类毒素(ttd)。这种类毒素保留了毒素的免疫原性,免疫动物仍能产生抗体。优质抗原是免疫马匹成功关键的第一步,我们目前使用的是甲醛灭活的tent(甲醛灭活破伤风类毒素(ttd))。甲醛是一种交联剂,广泛用于生化反应中。甲醛可以与蛋白质中的一级氨基基团反应生成羧甲基衍生物,进一步缩合成schiff氏碱。schiff氏碱与赖氨酸、精氨酸、酪氨酸等一些氨基酸残基通过亚甲基交联。这个反应可以发生在蛋白质肽链的内部,形成肽链内的交联,也可以与其它肽链反应,形成肽链与肽链的交联。这种肽链与肽链之间的交联就是所谓的聚合。甲醛灭活破伤风抗原时经常发生大量聚合,聚合后的分子量增大数倍以上,往往将能引起中和抗体的抗原表位屏蔽。此种抗原免疫动物可以产生很高的抗体滴度,但是其中和毒素活性的抗体滴度很低。
本案申请人上海赛伦生物技术股份有限公司利用马匹来生产抗生物毒素抗体,如抗破伤风免疫球蛋白、抗蝮蛇血清、抗眼镜蛇血清、抗银环蛇血清、抗五步蛇血清等。这些血清特异性地治疗和/或预防相应生物毒素中毒的病人。这些抗毒素、抗血清、免疫球蛋白是用马匹血浆制备而来的动物蛋白,用于人体有可能出现对异种蛋白过敏反应等副作用,过敏反应的发生率与制品中的蛋白含量正相关。要减少过敏反应的副作用,就要在保持制品中的抗体效价的同时尽可能的降低制品的蛋白含量。生产高抗破伤风抗体滴度的马血浆是提高制品质量的关键因素之一,我们采用甲醛灭活的精制破伤风类毒素免疫马匹,能获得抗体效价符合药典质量标准的抗破伤风马血浆,与其他同行生产者相似或者文献报道的情况接近,马匹免疫成功率较低,能投入生产的高效价血浆比例仅占60%左右。因此,目前亟待解决破伤风免疫效价低的问题,提高破伤风类毒素免疫滴度成为本领域的迫切需求。
随着现代分子生物学发展,人们逐渐对破伤风类毒素的认识。tent的c端形成一个“r”和“w”口袋形状与神经苷结合,“r”口袋形状主要包括asp1147、arg1226、asn1216、asp1214和tyr1229等位点,而“w”口袋形状主要包括了trp1289、his1271和tyr1290,将这些部位用抗体封锁,可以起到保护作用(参见hanwang,ruiyu,tingfangetal.,(2016)tetanusneurotoxinneutralizingantibodiesscreenedfromahumanimmunescfvantibodyphagedisplaylibrarytoxins8,266;doi:10.3390/toxins8090266)。罗萍等(参见pingluo,liyanqin,xuhumaoetal.,(2012)identificationofanovellinearepitopeintetanustoxinrecognizedbyaprotectivemonoclonalantibody:implicationsforvaccinedesignvaccine30,6449doi:10.1016/j.vaccine.2012.08.002)将破伤风类毒素分段表达然后确定表位,发现在1151-1171有一个线性表位,而tc1(865-975)和tc2(967-1154)段没有明显的线性表位(pingluo,2012)特性。进一步的三级结构研究表明,在863-1100之间有一对二硫键,该区域主要功能是稳定蛋白的构象,有利于破伤风毒素结合神经苷受体(参见geoffreymasuyer,julianconrad,pålstenmark(2017)thestructureofthetetanustoxinrevealsph-mediateddomaindynamics.emboreportsdoi:10.15252/embr.201744198)。发明人在生产实践过程中经常碰到用破伤风类毒素免疫的马匹可以产生很高的絮状反应滴度但是中和破伤风毒素的抗体效价很低。为了解决这一生产难点,我们试验了多种方法,意外发现用破伤风类毒素和重组破伤风毒素重链c片段同时免疫马匹获得预料不到的高效价的中和破伤风毒素抗体,解决了破伤风免疫效价低的问题。
技术实现要素:
本发明要解决的技术问题是提供一种提高马匹免疫获得高效价马破抗体免疫蛋白的方法,解决了破伤风免疫效价低的问题,为了提高破伤风类毒素免疫马匹后产生更高效价的血浆,减少使用马匹的数量,从而降低成本。
为解决上述技术问题,本发明采用如下技术方案:
在本发明的一方面,提供了一种重组破伤风毒素重链c片段,所述重组破伤风毒素重链c片段采用如下制备方法:将经过密码子优化的编码破伤风毒素重链c片段的如seqidno:3所示的核苷酸序列构建入大肠杆菌诱导表达载体中,然后转入大肠杆菌细胞株进行培养后诱导表达,并进行纯化,从而获得所述重组破伤风毒素重链c片段。
所述大肠杆菌细胞可以是任何合适的大肠杆菌细胞。
较佳地,所述大肠杆菌细胞是bl21细胞。
更佳地,所述大肠杆菌细胞是bl21(de3)细胞。
所述的表达载体是大肠杆菌表达载体,载体转录入大肠杆菌细胞后不整合到大肠杆菌的基因内。
所述的大肠杆菌表达载体是适合于大肠杆菌细胞的表达载体。
较佳地,所述的大肠杆菌表达载体为pet系统载体。
更佳地,所述的大肠杆菌表达pet系统载体为pet28a,其筛选所用的抗菌素为卡那霉素。
所述的大肠杆菌细胞株能表达破伤风毒素重链c片段。
所述的大肠杆菌细胞株能用的培养基为lb培养基。
所述的大肠杆菌细胞株能被诱导表达重组破伤风毒素c片段。
较佳地,所述诱导表达在培养液的od600达到0.4-0.8时启动。
更佳地,所述启动诱导时的大肠杆菌培养液od600为0.5-0.7。
更进一步地,所述od600为0.55-0.65。
更进一步地,所述诱导表达通过iptg进行,iptg诱导该融合蛋白在胞内以可溶性形式表达;诱导时间为1-8小时;较佳地,诱导时间为2-6小时;更佳地,诱导时间为3-5小时,所述诱导温度为28℃。
较佳地,所述纯化采用镍离子螯合层析将所述重组破伤风毒素重链c片段以单体形式分离。
重组纯化后可以进一步超滤浓缩然后添加保护剂低温和/或冷冻干燥保存。
在本发明的第二方面,提供一种能提高马抗破伤风免疫球蛋白滴度的免疫方法,包括如下步骤:
a将带有组氨酸标签的破伤风类毒素的重链c端在大肠杆菌中重组表达;
b将所述的重组破伤风毒素重链c片段和破伤风类毒素混合后免疫马匹,以获得高效价抗破伤风免疫球蛋白。
步骤b中,将权利要求1所述的重组破伤风毒素重链c片段、破伤风类毒素加弗氏不完全佐剂充分混匀后的乳化液作为抗原;选用健康雄性马匹,年龄在3-8岁之间,每隔十天注射一次,抗原注射在马匹颈部皮下。
在本发明的第三方面,提供一种能提高马抗破伤风免疫球蛋白滴度的药物或产品,包含了采用上述免疫方法获得的高效价马破抗体免疫蛋白。
本发明的有益效果在于:发明人在生产实践过程中经常碰到用破伤风类毒素免疫的马匹可以产生很高的絮状反应滴度但是中和破伤风毒素的抗体效价很低。为了解决这一生产难点,我们试验了多种方法,意外发现用破伤风类毒素和重组破伤风毒素重链c片段同时免疫马匹获得预料不到的高效价的中和破伤风毒素抗体,解决了破伤风免疫效价低的问题,提高破伤风类毒素免疫马匹后产生更高效价的血浆,减少使用马匹的数量,从而降低成本。本发明的重组破伤风毒素重链c片段的制备方法是将经过密码子优化的编码破伤风毒素重链c片段的核苷酸序列构建入大肠杆菌诱导表达载体中,然后转入大肠杆菌细胞进行培养后诱导表达,并进行纯化,从而获得所述重组破伤风毒素重链c片段,表达量可达约200mg/l;纯度高,经检测,不含可以用sds-page或hplc检测到的大肠杆菌细胞蛋白或其它残留物,通过实验表明获得的重组破伤风毒素重链c片段具有生物学活性,因此本发明的重组破伤风毒素重链c片段可以高表达、高纯度地获得具有生物学活性的重组破伤风毒素重链c片段。进而可以作为抗原与破伤风类毒素共同免疫马匹获得具有高中和破伤风毒素的免疫球蛋白,对提高马抗破伤风免疫球蛋白【f(ab’)2】的产量与质量有明显促进作用。
附图说明
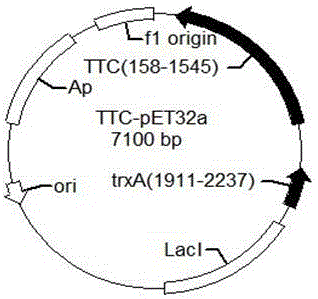
图1是本发明实施例2中破伤风毒素重链c片段在大肠杆菌中表达所用的载体结构图谱(即破伤风重链c片段(ttc)表达质粒结构)。采用t7/lac启动子表达目的蛋白。
图2是本发明实施例3中镍离子螯合层析图谱,图3中,第一峰是上样流穿与洗涤峰,此峰流穿与洗涤的蛋白为大肠杆菌菌体蛋白;第二峰为100mm咪唑洗脱蛋白,此峰为重组破伤风重链c片段;第三峰为0.5n氢氧化钠洗脱峰,其成分主要为大肠杆菌核酸成分。
图3是本发明实施例3中表达破伤风毒素重链c片段的大肠杆菌细胞诱导后的菌体裂解液在还原条件下sds-page结果。图2中从左到右,1为蛋白分子量标准;2为未诱导bl21(de3)菌体裂解上清;3为iptg诱导后的破伤风重链c片段/bl21(de3)菌体裂解液;4.为100mm咪唑洗脱蛋白(纯化获得的破伤风重链c片段蛋白)。
图4是本发明实施例5中免疫印染法图谱(即破伤风重链c片段免疫印染结果示意图),图4中,1代表iptg诱导后的破伤风重链c片段/bl21(de3)菌体裂解液上清;2代表ni柱纯化的破伤风重链c片段蛋白。
具体实施方式
为了能够更清楚地理解本发明的技术内容,特列举以下具体实施例详细说明。然而,具体实施例仅仅是用于举例说明,而不是对本发明的限制。
实施例i:表达序列获取和优化
为了达到使破伤风毒素重链c片段在大肠杆菌细胞内高表达这个目的,通过查文献得到该完整基因的氨基酸序列(即seqidno:1所示的氨基酸序列),其对应的破伤风毒素重链c片段核苷酸序列如seqidno:2所示。我们根据这个氨基酸序列,用大肠杆菌偏好的密码子对相应的核苷酸序列进行优化,设计了核苷酸序列(即seqidno:3所示的序列),具体为:将编码的破伤风类毒素(genbank:p04958)864-1315氨基酸的密码子按大肠杆菌偏好优化、在n-端引入6个组氨酸标签的破伤风毒素重链片段c。seqidno:3所示的序列是根据大肠杆菌密码子偏爱性优化后的破伤风毒素重链c片段的核苷酸序列,5端加框的tggcca为msci酶切位点,3端加框的ctcgag为xhoi酶切位点。
实施例2:表达质粒的构建和表达细胞株筛选
在序列seqidno:3的5’端加上msci酶切位点,3’端加上xhoi酶切位点,用人工合成的方法获得该序列的dna,并插入pet32a载体的msci和xhoi酶切位点之间,重组的质粒命名为ttc--pet32a(结构如图1所示),其理论表达的氨基酸序列即seqidno:4,再将ttc--pet32a用电转方法转入大肠杆菌bl21(de)3细胞。seqidno:4所示的序列是重组表达破伤风毒素重链c片段的氨基酸序列,前1-116为融合蛋白trx,117-121为his标签,122-126为肠激酶酶切位点,127-576为破伤风毒素重链c片段的氨基酸序列。
将转化后的bl21(de)3涂布在含100微克/ml氨苄霉素的lb培养基上,37℃培养过夜,从平板上挑取6个单克隆菌株,加入到含100微克/ml氨苄霉素lb培养基5ml,37℃220rpm震荡培养过夜。次日早上,按1%的接种量转接到5ml含100微克/ml氨苄霉素lb培养基中,37℃220rpm震荡培养2-3小时左右,待培养物的od600为0.6-1之间,记录诱导起始点od600值,并取样1ml,此为诱导前样品。在每个试管中加入1mmiptg再将温度调为28℃、200rpm震荡培养诱导4小时,最后离心收集菌体,用适当体积的水重悬,使各样品的菌浓度一致。进行sds-page检测挑取表达量最高的克隆,命名为ttc--bl21(de)3细胞株。
实施例3:重组破伤风毒素重链c片段纯化
1.挑取ttc--bl21(de)3细胞株接种到50毫升含100微克/ml氨苄霉素的lb培养基中,37℃220rpm震荡培养过夜。
2.四个2000毫升三角烧瓶,每个含500毫升lb培养基,均接种5毫升上述培养过夜的ttc--bl21(de)3细胞液至含lb培养基500ml的锥形瓶,37℃摇床培养至od600=0.6-0.8,加入0.4mm iptg,温度调至30℃,220rpm培养6小时。
3.离心收集菌体,加入ph8.0,20mmtris-hcl,100mmnacl20mm咪唑缓冲液100ml,重悬菌体,然后置冰浴超声破碎10min。
4.超声破碎后的细胞裂解液4℃、12000g离心20min,取上清。
5.取20毫升ni-sepharose6fastflow(ge)装入1.6x10cm层析柱,凝胶先后用5体积纯水、5体积ph8.020mmtris-hcl100mmnacl20mm咪唑缓冲液洗涤。
6.细菌裂解上清用0.45微米微孔滤膜过滤后以2ml/min流速过ni-sepharose层析柱。上样结束后,用10倍柱体积洗涤缓冲液(ph7.020mmtris-hcl 100mmnacl,20mm咪唑)洗涤至od280值低于0.05,然后用洗脱缓冲液(ph7.0含20mmtris-hcl、100mm nacl、250mm咪唑)洗脱,收集洗脱蛋白峰。
7.洗脱至od280值低于0.01,凝胶柱依次用2体积0.5n氢氧化钠,5体积纯化水,5体积20%乙醇清洗,凝胶柱保存在20%乙醇溶液中,2-8℃保存。破伤风重链c片段镍柱层析结果如图2所示,从左向右数,第一峰是上样流穿与洗涤峰,此峰流穿与洗涤的蛋白为大肠杆菌菌体蛋白;第二峰为100mm咪唑洗脱蛋白,此峰为重组破伤风重链c片段;第三峰为0.5n氢氧化钠洗脱峰,其成分主要为大肠杆菌核酸成分。图3为细菌裂解上清(ni-sepharose层析上样液)与100mm咪唑洗脱蛋白的sds-page。从左向右第一列1为蛋白分子量标准,第二列2为未诱导bl21(de3)菌体裂解上清,第三列3为iptg诱导后的破伤风重链c片段/bl21(de3)菌体裂解液;第四列4为100mm咪唑洗脱蛋白(纯化的破伤风重链c片段蛋白)。
实施例4:重组破伤风重链c片段elisa方法鉴定
1、待检样品为含pet32a空质粒转化dl21(de)3菌株培养后菌体裂解液离心后上清(空白样品),含ttc--bl21(de)3细胞培养后菌体裂解液离心后上清(诱导前),含ttc--bl21(de)3细胞iptg诱导后菌体裂解液离心后上清(诱导后),镍柱纯化的重组破伤风重链c-片段,破伤风类毒素。所有样品均用ph7.4,20mm磷酸钠,0.15m氯化钠缓冲液(pbs)稀释至所需检测浓度。
2、用0.05mph9.0碳酸盐包被缓冲液将待检抗原稀释至蛋白质含量为1~10μg/ml。在每个聚苯乙烯板的反应孔中加0.1ml(每个样品加3个孔),4℃过夜。次日,弃去孔内溶液,用洗涤缓冲液(ph7.4,20mm磷酸钠,0.15m氯化钠,0.05%吐温20)在bioten洗板机中洗板3次,最后一次拍板除去残留缓冲液。
3、每孔加0.2ml封闭缓冲液(含5%脱脂奶粉的洗涤缓冲液),室温放置2小时封闭。
4、倾去封闭缓冲液,于各反应孔中加入新鲜1:2000稀释的鼠抗破伤风单克隆抗体(santacruzsc-80506,usa)0.1ml。37℃孵育1小时后,用洗涤缓冲液洗涤3次。
5、加入1:2000稀释的hrp标记的羊抗鼠作为二抗(上海生工)0.1ml,37℃孵育1小时,接着用洗涤缓冲液洗涤3次。
6、于各反应孔中加入新鲜配制的tmb底物溶液0.1ml,37℃放置30分钟后于各反应孔中加入2m硫酸0.05ml终止显色反应。
7、在elisa检测仪上,于450nm处,以空白对照孔调零后测各孔od值,若大于规定的阴性对照od值的2.1倍,即为阳性。
elisa结果见下表1:
表1
如表1所示的elisa结果显示,重组破伤风重链c片段能被鼠抗破伤风单克隆抗体(santacruzsc-80506,usa)识别,该抗体的识别的抗原决定簇(epitope)位于破伤风重链c片段上。
实施例5:重组破伤风重链c片段免疫印染法鉴定
1.ttc--bl21(de)3细胞用iptg诱导前后的破菌上清液与ni-sepharose螯合凝胶纯化的破伤风毒素重链c片段样品用12.5%sds-page电泳进行分离后,用湿法(wetelectrophoretictransfer)转膜方法,将聚丙烯酰胺上的蛋白转到硝酸纤维素膜上。
2.电转完毕后将膜取下并移至含有封闭液(ph7.420mmtris0.15mnacl5%脱脂奶粉)的平皿中,室温下脱色摇床上摇动,封闭2小时。
3.封闭完毕后将硝酸纤维膜转到含将1:2000稀释液鼠抗破伤风单克隆抗体(santacruzsc-80506,usa)的ph7.420mmtris0.15mnacl缓冲液,室温下孵育2h。
4.用ph7.420mmtris0.15mnacl0.5%吐温20缓冲液在室温下摇床上洗3次,每次10min。
5.将1:2000稀释液hrp标记的羊抗鼠(上海生工)加到膜上,室温下孵育2h。
6.用ph7.420mmtris0.15mnacl0.5%吐温20缓冲液在室温下摇床上洗3次,每次10min。
7.用ecl检测试剂盒(上海生工)进行检测,将发光剂和稳定剂按照1;1等体积混合,配置成化学发光检测底物工作液,将底物工作液覆盖全整张膜,室温孵育5分钟。最后将膜放置于bio-rad成像仪中,拍摄成像。
如图4所示,westernblot结果显示,重组破伤风c片段能被鼠抗破伤风单克隆抗体(santacruzsc-80506,usa)识别。图4中,1为iptg诱导后的破伤风重链c片段/bl21(de3)菌体裂解液上清;在分子量65kd左右有一条蛋白条带可以被单克隆抗体识别。2为ni-sepharose金属离子螯合层析柱纯化的破伤风重链c片段蛋白(分子量65kd),亦被该单克隆抗体识别。
实施例6:破伤风类毒素、重组破伤风重链c片段、破伤风类毒素与重组破伤风重链c片段共同免疫马匹
选15匹马,随机分3组,每组各5匹马,第一组使用破伤风类毒素(ttd)免疫;第二组用重组破伤风毒素重链c片段免疫;第三组用ttd与重组破伤风重链c片段共同免疫马匹。免疫用抗原的用量如下表2:
表2
具体免疫方法为:1体积羊毛脂、3体积精制花生油经充分混匀后成为佐剂,用等体积的佐剂加等体积的抗原溶液混合,用超声波细胞破碎仪超声处理至抗原与佐剂充分混匀呈乳胶状。每匹马按照上表的剂量注射,注射部位为马颈部或臀部皮下,分4点注射。共免疫5次,每次间隔10天,第5次免疫注射后第10天采血进行抗血清中和活性试验。
实施例7:小鼠法测定免疫马匹血清的抗破伤风中和抗体滴度
将破伤风抗毒素标准品(购自中国食品药品检定研究院)用等量的稀释液与中性甘油先配成破伤风抗毒素标准品储备液(9iu/ml)。精密吸取破伤风抗毒素标准品储备液(标准抗毒素原液的一次吸取量不应少于0.5ml),用硼酸盐缓冲盐水(ph7.2,50mm硼酸,0.15m氯化钠)稀释,使每ml含0.5iu,当与毒素等量混合后,每0.4ml混合溶液注射量中含0.1iu。
精密称取干燥破伤风毒素(购自中国食品药品检定研究院),用硼酸盐缓冲盐水溶解与中性甘油(经116℃10分钟灭菌)等量混合,制成液体甘油破伤风毒素储备液(使每ml至少含20个实验量)。精密吸取破伤风毒素储备液,用硼酸盐缓冲盐水稀释,使每ml含5个试验量(0.5l+,l+为破伤风毒素使小鼠100%死亡的最低致死剂量),即与抗毒素等量混合后每0.4ml注射量中含1个试验量(0.1l+)。
将待检供试品用硼酸盐缓冲盐水稀释成数个稀释度,使每ml约含0.5iu(即0.5iu)或其上下,即与毒素等量混合后每0.4ml注射量中约含0.1iu或其上下。稀释度之间间隔约为5%。
将破伤风抗毒素标准品及不同稀释度的待检供试品分别加入等量的稀释试验毒素,混合均匀,置水浴箱中于37℃结合1小时,立即注射。
注射时,由高稀释度向低稀释度依次注射,每个稀释度各注射0.4ml于17-19g小鼠腹部或大腿根部皮下,每个稀释度各注射小鼠至少3只。
结果观察,试验小鼠至少应每日上、下午各观察一次,连续5日,并记录发病及死亡情况。结果判定,对照小鼠应于72~120小时之内全部死亡。待检供试品之效价应为与对照小鼠同时死亡或出现破伤风神经毒症状最重者的最高稀释度。
下表3为使用本发明制备的重组破伤风毒素重链c片段免疫的马匹、重组破伤风毒素重链c片段与破伤风类毒素共同免疫的马匹以及破伤风类毒素免疫马匹测得的血清效价:
表3
结果表明当重组破伤风毒素重链c片段与破伤风类毒素共同免疫马匹时,可以获得高效价的中和抗体。中和抗体的滴度(组3)比单独用破伤风类毒素(组1)或重组破伤风重链c片段(组2)免疫高30%以上,产生了协同效应达到了预料不到的技术效果。
综上,本发明的重组破伤风毒素重链c片段的制备方法设计巧妙,从而可以高表达、高纯度地获得具有免疫学活性的重组破伤风毒素重链c片段,进而可以作为抗原与破伤风类毒素共同免疫马匹获得具有高中和破伤风毒素的免疫球蛋白,对提高马抗破伤风免疫球蛋白【f(ab’)2】的产量与质量有明显促进作用。
在此说明书中,本发明已参照其特定的实施例作了描述。但是,很显然仍可以作出各种修改和变换而不背离本发明的精神和范围。因此,说明书和附图应被认为是说明性的而非限制性的。
序列表
<110>上海赛伦生物技术股份有限公司
<120>一种能提高马抗破伤风免疫球蛋白滴度的免疫方法
<130>wh-np-18-100087
<160>4
<170>patentinversion3.5
<210>1
<211>451
<212>prt
<213>人工序列(未知)
<400>1
knldcwvdneedidvilkkstilnldinndiisdisgfnssvitypdaqlvpgingkaih60
lvnnessevivhkamdieyndmfnnftvsfwlrvpkvsashleqygtneysiissmkkhs120
lsigsgwsvslkgnnliwtlkdsagevrqitfrdlpdkfnaylankwvfititndrlssa180
nlyingvlmgsaeitglgairednnitlkldrcnnnnqyvsidkfrifckalnpkeiekl240
ytsylsitflrdfwgnplrydteyylipvassskdvqlknitdymyltnapsytngklni300
yyrrlynglkfiikrytpnneidsfvksgdfiklyvsynnnehivgypkdgnafnnldri360
lrvgynapgiplykkmeavklrdlktysvqlklyddknaslglvgthngqigndpnrdil420
iasnwyfnhlkdkilgcdwyfvptdegwtnd451
<210>2
<211>1353
<212>dna
<213>人工序列(未知)
<400>2
aaaaatctggattgttgggttgataatgaagaagatatagatgttatattaaaaaagagt60
acaattttaaatttagatattaataatgatattatatcagatatatctgggtttaattca120
tctgtaataacatatccagatgctcaattggtgcccggaataaatggcaaagcaatacat180
ttagtaaacaatgaatcttctgaagttatagtgcataaagctatggatattgaatataat240
gatatgtttaataattttaccgttagcttttggttgagggttcctaaagtatctgctagt300
catttagaacaatatggcacaaatgagtattcaataattagctctatgaaaaaacatagt360
ctatcaataggatctggttggagtgtatcacttaaaggtaataacttaatatggacttta420
aaagattccgcgggagaagttagacaaataacttttagggatttacctgataaatttaat480
gcttatttagcaaataaatgggtttttataactattactaatgatagattatcttctgct540
aatttgtatataaatggagtacttatgggaagtgcagaaattactggtttaggagctatt600
agagaggataataatataacattaaaactagatagatgtaataataataatcaatacgtt660
tctattgataaatttaggatattttgcaaagcattaaatccaaaagagattgaaaaatta720
tacacaagttatttatctataacctttttaagagacttctggggaaaccctttacgatat780
gatacagaatattatttaataccagtagcttctagttctaaagatgttcaattgaaaaat840
ataacagattatatgtatttgacaaatgcgccatcgtatactaacggaaaattgaatata900
tattatagaaggttatataatggactaaaatttattataaaaagatatacacctaataat960
gaaatagattcttttgttaaatcaggtgattttattaaattatatgtatcatataacaat1020
aatgagcacattgtaggttatccgaaagatggaaatgcctttaataatcttgatagaatt1080
ctaagagtaggttataatgccccaggtatccctctttataaaaaaatggaagcagtaaaa1140
ttgcgtgatttaaaaacctattctgtacaacttaaattatatgatgataaaaatgcatct1200
ttaggactagtaggtacccataatggtcaaataggcaacgatccaaatagggatatatta1260
attgcaagcaactggtactttaatcatttaaaagataaaattttaggatgtgattggtac1320
tttgtacctacagatgaaggatggacaaatgat1353
<210>3
<211>1399
<212>dna
<213>人工序列(未知)
<400>3
tggccatcatcaccaccaccacgacgacgacgacaagaagaacttggattgttgggtgga60
taacgaagaagatatcgatgtgattttgaagaagagcaccatcttgaacttggatatcaa120
caacgatatcatcagcgatatcagcggcttcaacagctctgtgattacctatccggatgc180
gcaattggtgccgggcatcaacggcaaagcgattcatttggtgaacaatgaatctagcga240
agtgattgtgcataaagcgatggatatcgaatacaacgatatgttcaataactttaccgt300
gagcttctggttgcgtgtgccgaaagtgagcgcgagccatttggaacaatatgataccaa360
cgagtatagcatcattagctctatgaagaagtatagcttgagcattggcagcggctggag420
cgtgagcttgaaaggcaataacttgatttggaccttgaaagatagcgcgggcgaagtgcg480
tcaaatcaccttccgtgatttgtctgataagttcaacgcgtacttggcgaacaagtgggt540
gttcattaccattaccaacgatcgtttgtctagtgcgaacttgtatatcaacggcgtgtt600
gatgggctctgcggaaatcaccggcttgggcgcgatccgtgaggataacaacatcacctt660
gaagttggatcgttgtaacaataacaatcaatatgttagtatcgataagtttcgcatctt720
ctgtaaagcgttgaacccgaaagagatcgaaaagttgtataccagttacttgagtatcac780
cttcttgcgcgatttctggggcaacccgttgcgctacgataccgaatactacttgatccc840
ggttgcgtatagttccaaagatgttcagttgaagaacatcaccgattacatgtatttgac900
gaacgcgccgagttacacgaacggcaagttgaacatctactatcgccgcctttactcagg960
ccttaagttcatcatcaaacgctacacgccgaacaatgaaatcgactcattcgttcgctc1020
aggcgactttatcaaactttacgtttcatacaacaataacgagcatatcgttggttaccc1080
gaaagacggtaacgccttcaacaatcttgaccgcatccttcgcgttggttacaacgcccc1140
aggtatcccactttacaagaagatggaagccgttaagcttcgcgaccttaagacgtactc1200
cgtccaacttaagctttacgatgacaaagatgcctctttaggtcttgtcggtacgcataa1260
cggtcagatcggtaacgacccaaaccgggacatcttgatagcatcgaactggtacttcaa1320
tcacctgaaagacaagactttgacttgcgactggtactttgtacctacagacgaagggtg1380
gacaaatgactaactcgag1399
<210>4
<211>576
<212>prt
<213>人工序列(未知)
<400>4
msdkiihltddsfdtdvlkadgailvdfwaewcgpckmiapildeiadeyqgkltvakln60
idqnpgtapkygirgiptlllfkngevaatkvgalskgqlkefldanlagsgsghmhhhh120
hddddkknldcwvdneedidvilkkstilnldinndiisdisgfnssvitypdaqlvpgi180
ngkaihlvnnessevivhkamdieyndmfnnftvsfwlrvpkvsashleqydtneysiis240
smkkyslsigsgwsvslkgnnliwtlkdsagevrqitfrdlsdkfnaylankwvfititn300
drlssanlyingvlmgsaeitglgairednnitlkldrcnnnnqyvsidkfrifckalnp360
keiekltsylsitflrdfwgnplrydteyylipvaysskdvqlknitdymyltnapsytn420
gklniyyrrlysglkfiikrytpnneidsfvrsgdfiklyvsynnnehivgypkdgnafn480
nldrilrvgynapgiplykkmeavklrdlktysvqlklyddkdaslglvgthngqigndp540
nrdiliasnwyfnhlkdktltcdwyfvptdegwtnd576
- 还没有人留言评论。精彩留言会获得点赞!