一种柑橘黄龙病菌荧光定量分析的内参基因及其应用的制作方法
本发明属于分子植物病理学技术领域。更具体地,涉及一种柑橘黄龙病菌荧光定量分析的内参基因及其应用。
背景技术:
柑橘黄龙病(citrushuanglongbing,hlb)是柑橘生产上最具毁灭性的病害之一,严重制约了我国柑橘产业的发展。目前普遍认为柑橘黄龙病由一种限于韧皮部筛管细胞的革兰氏阴性细菌引起。该细菌属于α-变形菌纲(proteobacteriacea)的候选韧皮部杆菌属(candidatusliberibacterspp.);根据热敏性和地区可分为耐热型亚洲种(candidatusliberibacterasiaticus,clas)、在巴西发生的美洲种(candidatusliberibacteramericanus,clam)和在南非发生的非洲种(candidatusliberibacterafricanus,claf),可感染几乎所有柑橘属植物,且表现出不同的症状。
研究表明,黄龙病菌体内与转录调节、运输系统、代谢途径、分泌系统和抗逆性相关的基因在昆虫寄主与植物寄主中的表达存在差异。黄龙病菌基因在不同植物寄主上的表达存在差异,故不同寄主植物感染黄龙病后的发病进程和病害症状也存在差异。
通过实时荧光定量pcr(real-timequantitativepcr,rt-qpcr)方法对mrna表达量进行相对定量是基因表达研究的常用方法,该方法通过荧光强度的积累实时反应pcr进程,对起始模板进行定量分析。由于用于rna提取的细胞起始数不同、样品间rna提取效率不同、目的基因扩增效率不同等因素,选择合适的内参基因进行相对定量分析十分重要。早期研究选择的内参基因多为管家基因,并人为假设管家基因在每个样品中表达量相同。然而,由于受内外环境的影响,在细胞中真正恒定表达的基因并不存在,所以需要根据试验对象和试验条件筛选内参基因。一些传统的内参基因如18srrna、β-actin、gapdh常被用于数据标准化,目前已有报导,利用16srrna作为参照基因分析柑橘黄龙病菌在甜橙(citrussinensis)与柑橘木虱(diaphorinacitri)寄主上的基因表达差异。研究表明,不同宿主环境对植物病原菌的基因调控有显著影响,不同植物寄主中柑橘黄龙病菌存在不同的基因调控行为。同时rt-qpcr最低标准(minimuminformationforpublicationofquantitativereal-timepcrexperiments,miqe)表明没有适用于所有实验条件的内参基因。
因此,目前需找到一种更可靠、适应性更广、表达稳定的内参基因,并以此提出更准确的检测方法。
技术实现要素:
本发明要解决的技术问题是克服现有技术缺少一种合适的柑橘黄龙病rt-qpcr检测用内参基因的缺陷和不足,提供一种柑橘黄龙病菌荧光定量内参基因的引物及其应用。
本发明的第一个目的是提供一个柑橘黄龙病菌rt-qpcr分析的内参基因组合。
本发明的第二个目的是提供所述内参基因组合在柑橘黄龙病菌rt-qpcr分析,或制备柑橘黄龙病菌rt-qpcr分析试剂盒中的应用。
本发明的第三个目的是提供基因gyra的扩增引物。
本发明的第四个目的是提供基因ftsz的扩增引物。
本发明的第五个目的是提供基因gyra的扩增引物和/或基因ftsz的扩增引物在柑橘黄龙病菌rt-qpcr分析,或制备柑橘黄龙病菌rt-qpcr分析试剂盒中的应用。
本发明的第六个目的是提供一种柑橘黄龙病菌的rt-qpcr分析方法。
本发明的第七个目的是提供一个柑橘黄龙病菌rt-qpcr分析的试剂盒。
本发明的第八个目的是提供任一所述试剂盒在检测寄主体内柑橘黄龙病菌的应用。
本发明上述目的通过以下技术方案实现:
本发明同时考虑到了柑橘黄龙病菌感染不同寄主和感染寄主后不同时期这两个因素对基因表达的影响,选择柑橘黄龙病菌侵染不同植物寄主以及侵染后不同时期的植株叶片作为试验材料,通过spss、genorm、normfinder及reffinder软件对14个候选内参基因的表达水平ct值进行稳定性评价,筛选该试验条件下合适的内参基因。目前常用的稳定性评价软件包括genorm、normfinder及bestkeeper。其中bestkeeper实质为比较标准差,且一次性最多评价10个基因,因而本试验采用spss软件标准差比较方法代替。本研究中,以上3种软件的分析结果存在一定差异,因此基于reffinder综合排序结果进行内参基因选择,避免单个软件分析的片面性。同时排除genorm软件大于m值的基因以及normfinder和标准差排序相差过大的基因,使得筛选结果更可靠。进一步验证表明,gyra和ftsz内参基因组合应用于目标基因标准化具有可靠性。
一个柑橘黄龙病菌rt-qpcr分析的内参基因组合,包括基因gyra和ftsz,其核苷酸序列分别如seqidno.9和seqidno.10所示。
优选地,所述内参基因组合检测的对象包括十月橘、柚、年橘和柠檬。
优选地,所述内参基因组合检测对象为感染柑橘黄龙病菌后3~18个月。
所述内参基因组合在柑橘黄龙病菌rt-qpcr分析,或制备柑橘黄龙病菌rt-qpcr分析试剂盒中的应用,也在本发明保护范围之内。
基因gyra的扩增引物,其核苷酸序列如seqidno.2~3所示。
seqidno.2:5’-cacgaaaagcaacaaaagcc-3’;
seqidno.3:5’-agcgtcaatatggttgctttga-3’。
其扩增产物核苷酸序列如seqidno.1所示,
5’-cacgaaaagcaacaaaagccttgagtattcctatgagggtaaaacgctcaggtttatatccattcaaagcaaccatattgacgct-3’;
基因ftsz的扩增引物,其核苷酸序列如seqidno.5~6所示。
seqidno.5:5’-cttccaccggtaattttgggg-3’;
seqidno.6:5’-agatagctctctgacaacgca-3’。
其扩增产物核苷酸序列如seqidno.4所示,
5’-cttccaccggtaattttggggaagaaagattcaaaaattttgcgttttttaaagattcatgcgttgtcagagagctatct-3’。
基因gyra的扩增引物和/或基因ftsz的扩增引物在柑橘黄龙病菌rt-qpcr分析,或制备柑橘黄龙病菌rt-qpcr分析试剂盒中的应用,也在本发明保护范围之内。
优选地,所述基因gyra的扩增引物核苷酸序列如seqidno.2~3所示。
优选地,所述基因ftsz的扩增引物核苷酸序列如seqidno.5~6所示。
一种柑橘黄龙病菌的rt-qpcr分析方法,所述内参基因组合作为内参基因设计引物进行检测。
优选地,所述基因gyra的扩增引物核苷酸序列如seqidno.2~3所示。
优选地,所述基因ftsz的扩增引物核苷酸序列如seqidno.5~6所示。
一个柑橘黄龙病菌rt-qpcr分析的试剂盒,含有所述内参基因组合的扩增引物。
优选地,含有核苷酸序列如seqidno.2~3所示和/或核苷酸序列如seqidno.5~6所示扩增引物。
优选地,含有核苷酸序列如seqidno.2~3所示和核苷酸序列如seqidno.5~6所示扩增引物。
优选地,所述荧光定量试剂盒还包括rt-qpcr反应试剂。
更优选地,所述pcr反应试剂为sybrgreenqpcrmastermix。
优选地,所述试剂盒的反应体系为:10μlsybrgreenqpcrmastermix,所述引物各0.5μl,cdna模板1μl,加ddh2o补足余量,总体积为20μl。
优选地,所述特异性引物浓度为20μmol/l。
优选地,所述试剂盒的反应程序为:95℃2min;95℃10s,60℃30s,72℃30s,40个循环。
一个柑橘黄龙病菌rt-qpcr分析的试剂盒,包括内参基因gyra和ftsz的扩增引物、sybrgreenqpcrmastermix和ddh2o;其中,内参基因gyra的扩增引物的核苷酸序列如seqidno.2~3所示;内参基因ftsz的扩增引物的核苷酸序列如seqidno.5~6所示,引物浓度为20μmol/l。
其使用方法包括以下步骤:
(1)提取待测样品总rna;
(2)合成cdna第一链;
(3)以步骤(2)合成的cdna为模板进行荧光定量pcr,以基因gyra和ftsz作为内参基因;
(4)结果检测:
基于两个内参基因gyra和ftsz各ct值,通过excel软件计算相对表达量(q),具体计算公式为:q=2-△△ct(△△ct=(待测组目的基因平均ct值-待测组内参基因平均ct值)-(对照组目的基因平均ct值-对照组内参基因平均ct值)),其中内参基因ct值为gyra与ftsz的平均ct值。
此外,以上任一所述试剂盒在柑橘黄龙病菌rt-qpcr分析的中应用,也在本发明保护范围之内。
基因gyra、ftsz和/或任一扩增引物在检测柑橘黄龙病或制备柑橘黄龙病检测试剂盒中的应用,也属于本发明的保护范围。
一种柑橘黄龙病检测试剂盒,含有基因gyra和/或ftsz扩增引物。
优选地,含有核苷酸序列如seqidno.2~3所示和/或核苷酸序列如seqidno.5~6所示扩增引物。
优选地,含有核苷酸序列如seqidno.2~3所示和核苷酸序列如seqidno.5~6所示扩增引物。
优选地,所述荧光定量试剂盒还包括rt-qpcr反应试剂。
更优选地,所述pcr反应试剂为sybrgreenqpcrmastermix。
优选地,所述试剂盒的反应体系为:10μlsybrgreenqpcrmastermix,所述引物各0.5μl,cdna模板1μl,加ddh2o补足余量,总体积为20μl。
优选地,所述特异性引物浓度为20μmol/l。
优选地,所述试剂盒的反应程序为:95℃2min;95℃10s,60℃30s,72℃30s,40个循环。
其使用方法包括以下步骤:
(1)提取待测样品总rna;
(2)合成cdna第一链;
(3)以步骤(2)合成的cdna为模板进行荧光定量pcr,以基因gyra和ftsz作为内参基因;
(4)结果检测:
荧光定量试剂盒的pcr体系为:10μlsybrgreenqpcrmastermix,所述特异性引物各0.5μl,cdna模板1μl,加ddh2o补足余量,总体积为20μl。
荧光定量试剂盒的pcr程序为:95℃2min;95℃10s,60℃30s,72℃30s,40个循环。
检测结果ct<32的样品则确定为clas阳性,ct>36为clas阴性样品,ct为任一基因的ct值,或两个基因ct值的平均值。
本发明具有以下有益效果:
本发明首次筛选出适用于柑橘黄龙病菌感染不同寄主、感染寄主后不同时期时基因表达分析的内参基因组合gyra和ftsz,进一步提供了其特异性引物,为柑橘黄龙病菌基因的准确定量检测提供可靠保证。本发明筛选出的内参基因组合gyra和ftsz具有以下优势:
(1)可靠性高:本发明通过对14个候选内参基因的表达水平ct值进行稳定性评价,表明gyra和ftsz内参基因组合应用于目标基因检测具有很好的可靠性。
(2)稳定性好:本发明的gyra和ftsz在柑橘黄龙病菌感染4种不同植物寄主和感染寄主后不同时期时稳定表达,是柑橘黄龙病菌感染4种不同植物寄主和感染寄主后不同时期的荧光定量分析的最优双内参基因组合,其应用优于常用单内参基因(16srrna)的标准化效果。
(3)适用性广:本发明gyra和ftsz内参基因组合可以检测柑橘黄龙病菌感染不同寄主和感染寄主后不同时期的基因表达分析,其适用性广。
因此,利用此内参基因组合构建的对柑橘黄龙病菌的检测方法及检测试剂盒相比单个或传统的内参基因具有巨大的优势,值得大面积推广和应用。
附图说明
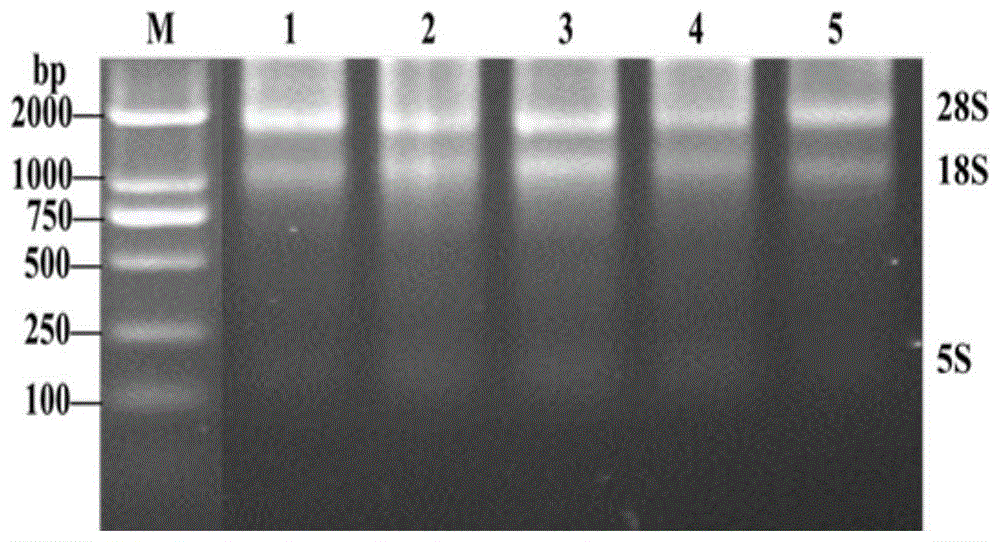
图1为总rna提取物的琼脂糖凝胶电泳图。
图2为候选内参基因的rt-qpcr熔解曲线图;a:gyra(tm:79.00);b:reca(tm:78.00);c:rpob1(tm:79.67);d:rpod(tm:80.00);e:rpoo(tm:82.00);f:gap(tm:78.00);g:ftsa(tm:80.50);h:ftsw(tm:78.00);i:ftsz(tm:76.50);j:zape(tm:77.00);k:secy(tm:80.00);l:seca(tm:79.83);m:gmk1(tm:83.00);n:gmk2(tm:77.50);横坐标:temperature(℃);纵坐标:-d(rfu)/dt。
图3为候选内参基因rt-qpcr产物的琼脂糖凝胶电泳;1:gyra;2:reca;3:rpob1;4:rpod;5:rpoo;6:gap;7:ftszz;8:zape;9:ftsw;10:ftsa;11:secy;12:seca;13:gmk1;14:gmk2。
图4为14个候选内参基因在柑橘黄龙病菌感染不同寄主和感染寄主后不同时期样品的ct值平均值的条形图。
图5为14个候选内参基因在柑橘黄龙病菌感染不同寄主和感染寄主后不同时期的表达稳定性排序(m值,genorm)。
图6为14个候选内参基因在柑橘黄龙病菌感染不同寄主和感染寄主后不同时期的表达稳定性排序(稳定因子,normfinder)。
图7为n14个候选内参基因在柑橘黄龙病菌感染不同寄主和感染寄主后不同时期的表达稳定性排序(标准差,spss)。
图8为genorm确定用于准确定量分析最优的内参基因数目。
图9为14个候选内参基因在柑橘黄龙病菌感染不同寄主和感染寄主后不同时期的表达稳定性排序(综合排序,reffinder)。
图10为柑橘黄龙病菌las△5313基因转录水平分析;y-6:病芽嫁接6个月的柚;n-6:病芽嫁接6个月的年橘;s-6:病芽嫁接6个月的砂糖橘;y-12:病芽嫁接12个月的柚。
图11为内参基因的检测结果对比;3m:病芽嫁接3个月的植株;6m:病芽嫁接6个月的植株;9m:病芽嫁接9个月的植株;12m:病芽嫁接12个月的植株;18m:病芽嫁接18个月的植株。
具体实施方式
以下结合说明书附图和具体实施例来进一步说明本发明,但实施例并不对本发明做任何形式的限定。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。
除非特别说明,以下实施例所用试剂和材料均为市购。
实施例1内参基因的筛选
一、实验方法
1、检测样本的制备
用黄龙病病芽嫁接技术将黄龙病接种到不同种的植株上:十月橘(citrusreticulatablancocv.shiyueju)、柚(citrusmaxima)、年橘(citrusreticulatablancocv.nianju)和柠檬(citruslimon(l.)burm.f.),每个种3个生物学重复,材料于网室内自然条件下培养。在嫁接后3~18个月随机采集典型症状叶片以及健康植株叶片,每个样品均采自不同植株。每个叶片剪取一部分液氮冻存后,-80℃保存备用,另一部分4℃保存备用。
2、dna提取及rt-qpcr检测
参照omega植物dna提取试剂盒(omegabio-tek,hpplantdnamidikitd2086)说明书提取植物组织dna。用1%的琼脂糖凝胶电泳验证所提取dna的质量。每份dna样品中clas含量的检测采用基于16srdna序列引物hlbas/hlbr的rt-qpcr方法,基于阳性对照及阴性对照的ct值,检测结果ct<32则确定为clas阳性样品。
其中,16srrna的扩增引物,其核苷酸序列如seqidno.7~8所示。
seqidno.7:5’-tcgagcgcgtatgcaatacg-3’;
seqidno.8:5’-ctacctttttctacgggataacgc-3’。
检测体系为:
sybrgreenqpcrmastermix10μl,10μm正向引物0.5μl,10μm反向引物0.5μl,dna模板1μl,ddh2o8μl。
检测程序为:
95℃预变性2min;95℃变性10s,60℃退火延伸30s,72℃延伸30s,40个循环,并在每个72℃步骤结束时捕获荧光信号。
3、叶组织总rna提取
(1)分别取每个样品的叶中脉80mg~100mg,在液氮中研磨成粉末,参照omega植物组织总rna提取试剂盒(omegabio-tek,plantrnakitr6827)提取各样品植物组织总rna;
(2)总rna质量检测:1.0%琼脂糖凝胶电泳,tbe×5缓冲液,130v,35min;经nanodropone微量紫外-可见光分光光度计(thermoscientific)测定浓度和纯度,a260/280值介于2.0~2.1为合格样品;
(3)cdna第一链的合成:按照cdna第一链合成试剂盒(transgenbiotech,transscriptone-stepgdnaremovalandcdnasynthesissupermix)的操作说明将步骤1.1.3提取的总rna(合格样品)反转录合成第一链cdna并去除dna污染,-20℃保存,用于rt-qpcr模板;具体包括以下步骤:
(i)冰上准备反应混合液:依次加入1μlanchoredoligo(dt)18primer、1μlrandomprimer,加总rna模板与rnasewater补齐至8μl(总rna浓度均一化至25ng/μl);
(ii)65℃孵育5min,冰浴2min;
(iii)稍离心;将离心管放在冰上,依次加入10μl2×tsreactionmix、1μlrt/rienzymemix、1μlgdnaremover;
(iv)轻轻混匀,离心;
(v)25℃温浴10min,42℃温浴15min,85℃加入5s,放置于冰上冷却,-20℃保存备用;
(4)内参基因的筛选
以上一步反转录合成的cdna为模板,选择gyra、reca、rpob1、rpod、rpoo、gap、ftsa、ftsw、ftsz、zape、secy、seca、gmk1和gmk2作为候选内参基因,设计引物进行rt-qpcr反应。上述14个候选内参基因是基于报道中统计的内参基因转录产物以及发明人实验室发表的广东黄龙病菌a4菌株序列,通过检索转录产物确定的。
候选内参基因的引物序列及相关参数见表1。
表1:
荧光定量pcr体系为:10μlsybrgreenqpcrmastermix,20μmol/l的正向引物和反向引物各0.5μl,cdna模板1μl,加ddh2o至20μl。
荧光定量pcr程序为:95℃2min,95℃10s、60℃30s,72℃30s进行40个循环。
实时荧光定量pcr结果的ct值表示每个反应管内的荧光信号达到设定阈值所需循环数,ct值越低,起始拷贝数越多,表达丰度越高,反之亦然。故同一基因在不同样品间ct值的变化表明了转录水平上基因的表达差异。将cdna依照顺序稀释6个梯度,作为rt-qpcr的模板。依次用设计的候选内参基因引物进行扩增,采用bio-radcfxmanager2.1软件绘制各基因的标准曲线,从而得到引物的斜率(k),扩增效率(e),决定系数(r2)等系数。
由于所提取的rna为携带病原核酸的植物组织总rna,且每个样品中黄龙病菌rna的含量不同。因此对黄龙病菌rna含量进行相对定量时需采用参照基因16srdna校正表达量数据。基于候选内参基因在clas不同侵染时期和不同植物寄主下的循环阈值(ct),通过excel软件计算相对表达量(q),具体计算公式为:q=(1+e)△ct(△ct=某内参基因在样品中最低ct值-某内参基因在各样品中ct值),最低ct值样品的相对表达量即为1。
各基因的转录水平分析选用statisticalproductandservicesolutions(spss)软件。候选内参基因的表达稳定性分析采用spss、genorm、normfinder及reffinder软件,参照说明书步骤进行。其中导入genorm、normfinder的数据均为各样品q值,导入spss、reffinder的数据为各样品ct值。基于软件分析结果综合评价各候选内参基因,筛选合适的内参基因。
二、实验结果
(1)rna质量检测
经检测,提取的总rna浓度为99.0~320.2ng/μl,各样品a260/a280比值在2.07~2.12,纯度较好。随机选取5个rna样品经1%琼脂糖凝胶电泳,结果显示rna完整性较好,28s、18s和5s亚基条带清晰,无dna和其他杂质污染现象,可用于后续实验(图1)。
(2)扩增特异性
由于clas不能纯培养,所提取的核酸背景复杂,包含寄主植物及内生菌的核酸。为确定候选内参基因引物的特异性,采用rt-qpcr方法验证这些引物对不同品种clas阴性样品及阳性样品的cdna的扩增效果。以clas阴性样品和阳性样品cdna为模板的rt-qpcr扩增结果显示,有16个基因在clas阴性样品无扩增片段,特异性良好(表2)。而基于基因rpoa、rpob2、rho、cdp1、cdp2、secg、adk设计的引物扩增出clas外的基因片段,特异性较差,其原因与基因序列不特异、rt-qpcr退火温度与时间设置等有关。
表2:
rt-qpcr结果显示,除yajc、gmk3外,14个候选内参基因的熔解曲线都显示单一信号峰(图2),说明各基因引物能进行特异性扩增。且各基因的rt-qpcr产物经1%琼脂糖凝胶电泳进行检测,结果显示条带单一且与预期片段大小一致,无非特异性扩增和引物二聚体现象,故引物具有较好特异性(图3)。16srdna引物特异性已验证。
(3)扩增效率
梯度稀释cdna模板验证各内参基因的扩增效率,标准曲线相关参数及扩增效率如表3所示。结果显示各基因线性决定系数(r2)的变化范围0.954~0.999,扩增效率范围为85.7%~115.8%,可进行后续rt-qpcr实验。
表3:
(3)候选内参基因的转录水平分析
实时荧光定量pcr结果的ct值表示每个反应管内的荧光信号达到设定阈值所需循环数。根据每个基因在所有样品中的ct值平均值(图4),利用spss进行dmrt(duncan’smultiplerangetest)法多重比较。结果显示,各基因的ct值范围从17.00至22.35,16rrna的表达丰度显著高于候选内参基因(p=0.027<0.05)。此外,候选内参基因中gmk2表达量最低,reca表达量最高,而14个候选内参基因表达水平没有显著差异(p=0.078>0.05),ct值范围在17.22-26.79;gmk2表现出相对高的转录水平,其ct平均值为20.15;reca平均表达水平最低,ct平均值为21.94。
(4)内参基因的稳定性分析
为确定候选内参基因的表达稳定性,采用spss、genorm、normfinder及reffinder对rt-qpcr数据进行分析并综合评价。
利用genorm软件分析候选内参基因在不同样品中的表达稳定性(m),m值越小,稳定性越高,以m=0.5为取舍值。根据genorm软件分析结果,对14个内参基因稳定性进行计算并排序(图5)。不同候选内参基因表达稳定性从高到低排列顺序为gyra(0.349)=ftsz(0.349)>zape(0.395)>rpod(0.431)>seca(0.483)>rpob1(0.523)>gap(0.558)>reca(0.586)>ftsa(0.624)>secy(0.658)>ftsw(0.682)>gmk2(0.698)>rpoo(0.720)>gmk1(0.789)。normfinder软件的分析结果与genorm的分析结果相似,以稳定因子(stabilityvalue)表示表达稳定性,但normfinder软件无取舍值。将stabilityvalue的值从高到低排序并转换为折线图(图6)。利用spss统计各内参基因对所有样品扩增值的标准差(standarddeviation),标准差越低则表达稳定性越强,结果如图7所示。
根据genorm软件计算的内参基因之间的配对变异值vn/n+1,分析出研究基因表达引入的内参基因的最适数目(n)。若vn/n+1值小于0.15,则不必引入第n+1个内参基因。结果如图8所示,配对变异值均小于0.15,故选择2对及以上内参基因均可行。
综合以上分析结果对内参基因进行综合排名。各候选内参基因的综合排名如图9所示:ftsz在reffinder和其他3种软件稳定排序中均为第1或第2位,可作为最佳的内参基因。而rpob1在reffinder中虽排第2位,但genorm中的m值大于0.5,故舍弃。第3位的gyra在所有排序均在前5,可作为内参基因。故而根据genorm的配对变异值选择2对内参基因:ftsz、gyra。
其中内参基因gyra的特异性引物的正向引物为5’-cacgaaaagcaacaaaagcc-3’(如seqidno.2所示),反向引物为5’-agcgtcaatatggttgctttga-3’(如seqidno.3所示),该引物对扩增的内参基因gyra的扩增产物的核苷酸序列如seqidno.1所示;内参基因ftsz的特异性引物的正向引物为5’-cttccaccggtaattttgggg-3’(如seqidno.5所示),反向引物为5’-agatagctctctgacaacgca-3’(如seqidno.6所示),该引物对扩增的内参基因ftsz的扩增产物的核苷酸序列如seqidno.4所示。
实施例2一个柑橘黄龙病菌rt-qpcr分析的试剂盒
一、组成
包括内参基因gyra和ftsz的扩增引物、sybrgreenqpcrmastermix和ddh2o;其中,内参基因gyra的扩增引物的核苷酸序列如seqidno.2~3所示;内参基因ftsz的扩增引物的核苷酸序列如seqidno.5~6所示,引物浓度为20μmol/l。
二、使用方法
1、植物组织总rna提取:分别取每个样品的叶中脉80mg~100mg,在液氮中研磨成粉末,参照omega植物组织总rna提取试剂盒(omegabio-tek,plantrnakitr6827)提取各样品植物组织总rna。
2、总rna质量检测:1.0%琼脂糖凝胶电泳,tbe×5缓冲液,130v,35min;经nanodropone微量紫外-可见光分光光度计(thermoscientific)测定浓度和纯度,a260/280值介于2.0~2.1为合格样品。
3、cdna第一链的合成:按照cdna第一链合成试剂盒(transgenbiotech,transscriptone-stepgdnaremovalandcdnasynthesissupermix)的操作说明将步骤2.2提取的总rna(合格样品)反转录合成第一链cdna并去除dna污染,-20℃保存,用于rt-qpcr模板。
4、荧光定量pcr
以上一步反转录合成的cdna为模板,荧光定量试剂盒的pcr体系为:10μlsybrgreenqpcrmastermix,所述特异性引物各0.5μl,cdna模板1μl,加ddh2o补足余量,总体积为20μl。
荧光定量试剂盒的pcr程序为:95℃2min;95℃10s,60℃30s,72℃30s,40个循环。
3、检测步骤
基于两个内参基因gyra和ftsz各ct值,通过excel软件计算相对表达量(q),具体计算公式为:q=2-△△ct(△△ct=(待测组目的基因平均ct值-待测组内参基因平均ct值)-(对照组目的基因平均ct值-对照组内参基因平均ct值)),其中内参基因ct值为gyra与ftsz的平均ct值。
实施例3荧光定量试剂盒的应用及其特异性检测
为进一步证明内参基因的可靠性,以16srrna以及gyra+ftsz组合分别作为内参基因,分析柑橘黄龙病菌重要致病基因las△5313在感染黄龙病的植株叶片中的表达模式。
一、实验方法
1、样品准备:以病芽嫁接6个月的柚子、年橘、砂糖橘植株、病芽嫁接12个月的柚子植株为样品,参照实施例2提取总rna并合成cdna第一链。
2、特异性检测:参照实施例2的荧光定量pcr与检测步骤。
二、实验结果
结果如图10所示,结果表明16srrna作为内参与gyra+ftsz作为内参所得的las△5313的表达模式相同,同个侵染时期clas在寄主中las△5313的表达水平高于在柚寄主中的表达水平,但无显著差异(a:p=0.039<0.05;b:p=0.005<0.05);clas在柚寄主侵染后期las△5313的表达水平显著高于侵染前期(a:p=0.139>0.05;b:p=0.142>0.05)。对比16srrna作为内参与gyra+ftsz作为内参的表达结果,可看出以gyra+ftsz作为内参样品相对表达量的标准差较小,且表达差异体现更显著。
实施例4利用内参基因的rt-qpcr检测
为证明内参基因的可靠性,以16srrna、gyra、ftsz分别作为内参基因,利用rt-qpcr检测不同感染时期的柑橘黄龙病植株。
一、实验方法
1、样品制备:以病芽嫁接后3、6、9、12、18个月的植株作为样品,参照实施例1提取dna。
2、rt-qpcr检测
参照omega植物dna提取试剂盒(omegabio-tek,hpplantdnamidikitd2086)说明书提取植物组织dna。用1%的琼脂糖凝胶电泳验证所提取dna的质量。每份dna样品中clas检测分别以16srrna、gyra、ftsz作为内参基因,进行检测结果对比。
检测体系及程序参照实施例1。
二、实验结果
如图11所示,gyra与ftsz的检测结果与16srrna的检测结果相近,可用于检测柑橘黄龙病样品。
实施例5一种特异检测柑橘黄龙病菌的荧光定量试剂盒
一、组成
包括内参基因gyra和ftsz的扩增引物、sybrgreenqpcrmastermix和ddh2o;其中,内参基因gyra的扩增引物的核苷酸序列如seqidno.2~3所示;内参基因ftsz的扩增引物的核苷酸序列如seqidno.5~6所示,引物浓度为20μmol/l。
二、使用方法
(1)提取待测样品总rna;
(2)合成cdna第一链;
(3)以步骤(2)合成的cdna为模板进行荧光定量pcr,以基因gyra和ftsz作为内参基因;
(4)结果检测:
荧光定量试剂盒的pcr体系为:10μlsybrgreenqpcrmastermix,所述特异性引物各0.5μl,cdna模板1μl,加ddh2o补足余量,总体积为20μl。
荧光定量试剂盒的pcr程序为:95℃2min;95℃10s,60℃30s,72℃30s,40个循环。
检测结果ct<32的样品则确定为clas阳性,ct>36为clas阴性样品,ct为任一基因的ct值,或两个基因ct值的平均值。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
序列表
<110>华南农业大学
<120>一种柑橘黄龙病菌荧光定量分析的内参基因及其应用
<160>10
<170>siposequencelisting1.0
<210>1
<211>85
<212>dna
<213>人工序列(artificialsequence)
<400>1
cacgaaaagcaacaaaagccttgagtattcctatgagggtaaaacgctcaggtttatatc60
cattcaaagcaaccatattgacgct85
<210>2
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>2
cacgaaaagcaacaaaagcc20
<210>3
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>3
agcgtcaatatggttgctttga22
<210>4
<211>80
<212>dna
<213>人工序列(artificialsequence)
<400>4
cttccaccggtaattttggggaagaaagattcaaaaattttgcgttttttaaagattcat60
gcgttgtcagagagctatct80
<210>5
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>5
cttccaccggtaattttgggg21
<210>6
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>6
agatagctctctgacaacgca21
<210>7
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>7
tcgagcgcgtatgcaatacg20
<210>8
<211>24
<212>dna
<213>人工序列(artificialsequence)
<400>8
ctacctttttctacgggataacgc24
<210>9
<211>2733
<212>dna
<213>人工序列(artificialsequence)
<400>9
ttattctgttgactccgcttcatcaactatctcagattctctaatgcgttctactgatac60
taccctttcatctttcgcagtagaaaaaataacaacccctttggtagcacggctagcaat120
tctaatctcattgactggtactcgaataagagttcctttatccgaaacaaggatgatttg180
atcattatcgttaactggaaataccgctaccaatgctcctatttcatttatttttgacac240
atcagttgcacgaataccttttccgctacgattagaaatacgaaaatcataagaagatgt300
tctcttcccgaatcctttttctgatacagttaagataaattgctcttttaattttaattc360
ttgacaacgctcttccgaaatattgccctcaacagaagaatcatttttaagagaagtaat420
ttcttccgtatcacctgaaataagacgacgttgggcggacatatgtttcatataacaaat480
tcgttcatcataatccgcatctgcatgaagaacaattgccatagaaataacttgatcacc540
tttagcaagtgatatgcccctaactccgacagaattacgtcccgcaaatactcgtatagc600
agaaatcggaaagcggacacattgtccaagtttagtagtcaacaatatatcattttcttg660
tgtacaggtttcaacggaaagaatctcatctcttgaatctaatttcatcgcaatcttacc720
actacgattgatttgaataaaatcagaaagtttattacgccgtacattgccatgcttagt780
agcaaatacgacatataagttattccaactcgattcatcctctggaaaaggcataatcgt840
tgtgatacgctcaccttgatttaaagagaggatattaatcaatgctttcccgcgcgcttg900
aggtgatccaataggtaaacgccataccttttctttatacacaaatcctaaagaagagaa960
aaaaagaacggaagtatgtgtgctcacgataaatagatccgtaacgaaatcttcgtcacg1020
catcaccacaccggatcgccccttaccaccacgacgctgcgcccgatagacagaaagtgg1080
tactcgtttgacatatccgagatgcgaaaccgtcacgaccatgtcttctcgcacaatgca1140
atcttcgtcttccatatctaataaaccctctacaattcgtgtccgacgaggagtatcaag1200
ttcatctttaaccgatagcagttcctgcttgataatacccagcagacgagatcgcgacga1260
caaaatgtctaagcactccttaatctctatgccaagactatttaactcattacgaatatc1320
gtctcgacccaatcccgtcaaccgcgctaagcgaagctctagaatagcacgcgtctgtac1380
ttctgataagtacatcgttccatcactacctatagtataacttgaatcatcaatcagatc1440
aattaaatctttaatatcagaagcgttccaacttctctgcataagctctcgccgagcagt1500
ttctggattaggtgaaaaacgaataatacgaacaacttcgtctaaattagccacagcaat1560
agccaaacctaccaaaacatgagctctatcacgtgctttattcaaaagatattttgttct1620
tcttacaaccacttcctcacgaaaagcaacaaaagccttgagtattcctatgagggtaaa1680
acgctcaggtttatatccattcaaagcaaccatattgacgctaaataaactttgtaaaga1740
agtataacgatataattggttgagaataacatccgcagaagcacctcgcttcaactcaat1800
gaccactcgataaccttgacgatccgattcatctcgcagatctgctatatcaactatccg1860
cttttctctaactaattcagcaatcttttcaagcattgccgctttattaacctgatatgg1920
aatctcagtaacgacaatttgctcccgatcgcctgatgttttttctatgtgactgacccc1980
tcgtattacaatagatccccgacccgttgcataagcatttttaatgccagtacgtcctaa2040
gatcaccgctcctgttggaaaatctggaccacgaataatctccatcaaggcatccagatc2100
aatatcaggattatcaattacggccacacaaccatcaaccacttctcccaaattatgagt2160
cgggatattggtagccatgccaacggcaataccgccaccaccattgaccagcacattggg2220
atatctagcacaaagcacaacaggttcttgaaaagagccatcatagttagggcggaaatc2280
aacagtatctttaccaagatcatctagcagaaaatgcgctgctttctgcaaacgacattc2340
agtatacctttctgctgccggaggatctccatcgactgatccaaaatttccttgtccttc2400
aattaacaacaaacgcaaagaccagtcctgtgccatacgcgccaatgcgtcataaatggc2460
agcattaccatgtgggtggtatttacccatcacctctccggaaatacgtgcgcacttcac2520
atattttttattccattctacgcccatctgcatcataccaaaaagtatacgacgatgaac2580
aggttttaacccatctcgcaaatcagggatagcacggcctaaaatgacattaattgcata2640
agtaagataagaattttgcatttcatctgttattgaaacagaagttatgcccttctcctc2700
ttcttcatcactagatataatatgctcggtcaa2733
<210>10
<211>1509
<212>dna
<213>人工序列(artificialsequence)
<400>10
tcaatgcgattgacgacgcaaaaaagcaggtatctctaatttatcttcctcacacttaac60
agttggctttgattgtacacaaaaatcatcaatgctctcttcagagatagaagggtttct120
ttctctcaaataagaaaccgtagattcacttttcatatgaacggaatcttcttctgaagc180
aatattttcatgcaaaccaaaagagtgtgcaatacgtttaattaatgccatcaccccacg240
ctcttcgacagagtcactatgtctttgccgagatatgagacgatgtggagcagaagattc300
tggaacaacatcttcctctaaaaacaattcttgattttgatctcctaccaaagaattttc360
ttggttatttaaatcttcttgattgtcggtgcagtgagcattttcagcgattacactatg420
atgcataacatgagaatcttccaccggtaattttggggaagaaagattcaaaaattttgc480
gttttttaaagattcatgcgttgtcagagagctatctcgattatcatcaccatctctatg540
caaacgattctctattcccgtcgcaacaacagatacacgaatcacaccttcaagcgcttc600
atcaaaagtagcaccaagaataatattggcttcggaatcaacctcttcacgaatacgcgt660
tgcagcttcgtcaacttcaaacaatgtaaggtcacttccccctgtaattgaaatcaataa720
tccttgcgatcccttcattgacgcttcatcaagcaatggattagcaacagctgcttcggc780
tgcttggataccacgtccatgaccagaagcttctcctgttcccatcatagcacgtcccat840
attgcgcatgacggaacgaacgtctgcaaaatcaagattaatcaatccctctttaatcat900
caaatcagtaatgcaagaaacacccgaataaagcacttgatctgccatagaaaaagcatc960
ggcaaacgttgttttatcatttgcaatccggaatagattttgattaggaatcacaatcaa1020
tgtatcaactgtttcttgcaatgcttctatcccagattctgctacacgcatacgccgaga1080
accttcaaaatgaaaaggtttagtgaccacaccaacagttaaaacccctttattccgcgc1140
tatttttgcaataatcggggctgctcccgttcccgtaccgcctcccatgcctgcggtgac1200
aaaacacatatgtgttttatctaacatctcagtaatttcatcaatgcattcttctgcagc1260
agcacgaccaacttctggatgagatcctgctcccaaaccttcggttattccagatcctag1320
ttgaataatctgcttagctttagacatcatcaatgcttgagcatcagtattggctacaac1380
aaaattgacaccctgaagacctgaggaaaccatgttgttgacggcgtttccacctccacc1440
tcctacaccaaagacggtaatcctaggctttaattcagttatatccatattagcgttttt1500
ccctaccat1509
- 还没有人留言评论。精彩留言会获得点赞!