一种用于宏基因组测序的建库方法、试剂盒和测序方法与流程
本发明涉及测序领域,具体而言,涉及一种用于宏基因组测序的建库方法、试剂盒和测序方法。
背景技术:
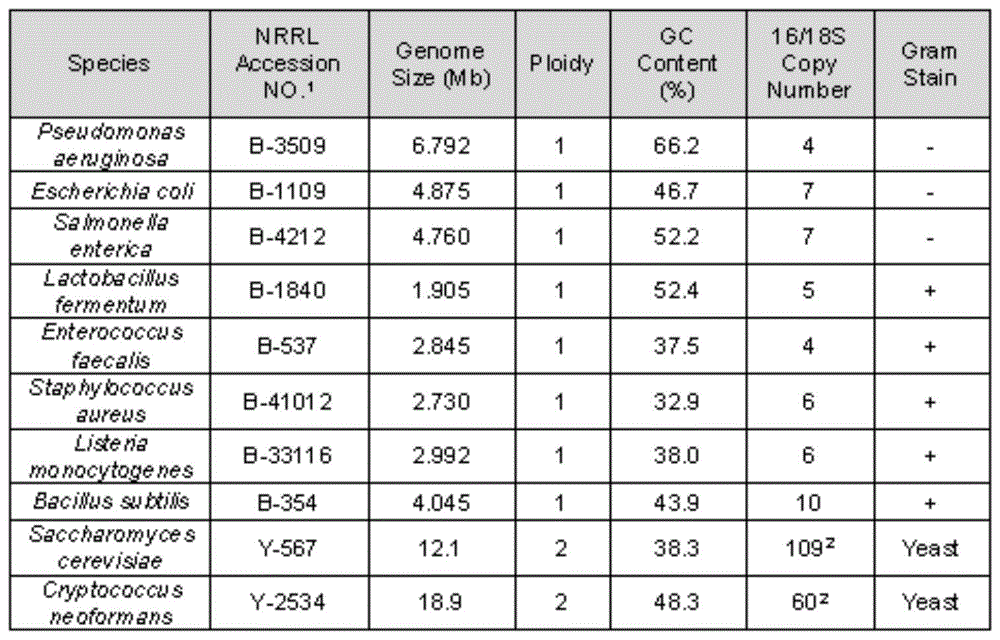
:宏基因组测序鉴定相较于传统的培养鉴定方法,具有鉴定周期短、对操作及鉴定人员的技术水平要求低等优势。宏基因组测序克服了很多不能培养的微生物的鉴定弊端,被越来越多地应用于微生物鉴定中,特别是不明原因病原微生物的鉴定。目前主流的宏基因组测序方法主要是高通量测序方法,包括二代测序和三代测序。其中三代测序如纳米孔测序以其包括超长序列读长、实时数据产生和生信分析和设备小巧便携等卓越的特征,是目前比较快捷方便的宏基因组研究方法。在宏基因组的研究领域,对于一些珍贵的样本,往往提取获得的核酸量非常有限。另外,如果在样本处理过程中使用了去宿主流程,提取得到的核酸量也非常低。因此,在很多情况下,为满足测序上机的要求,通过pcr扩增来提高样本总量,是一个必不可少的选择。目前英国牛津纳米孔公司提供的官方试剂盒中满足快速建库需求、提供多样本混合测序功能的试剂盒只有快速条码试剂盒(sqk-rbk004)和快速pcr条码试剂盒(sqk-rpb004)。快速条码试剂盒(sqk-rbk004)官方对于起始dna量的限制是400ng,对于珍贵的临床样本而言,常常无法满足。快速pcr条码试剂盒(sqk-rpb004)的建库起始量要求是1-5ng,首先在片段化步骤:3μl建库核酸+1μlfrm溶液,接下来,加入pcr体系(无核酸酶水20μl;rlb引物1μl;longamptaq2xmastermix25μl)进行pcr扩增,循环数设置为14个循环,延伸时间6mins。后面进行混库,纯化,加接头就可上机测序了。按照该流程,部分样本可基本满足建库要求,但是还是有一些样本量低,或者经过去宿主步骤处理的样本核酸量<1ng,无法满足上机要求。前人有对快速pcr条码试剂盒(sqk-rpb004)进行修改。比如英国的grady教授在其修改流程中,提取后的核酸先经过1.2xampurexpbead纯化,15μl洗脱;然后用7.5μl的洗脱液和2.5μl的frm试剂混合做片段化处理;在接下来的pcr反应中,他们将循环数改为25个循环,延伸时间缩短为4分钟。修改后的流程使得部分样本可建库成功,但还是有一些经过去宿主流程的样本pcr失败,并且增加pcr循环数,进一步加重扩增偏向性,导致对于一些gc含量高的细菌的鉴定出现严重问题,菌种丰度比例严重失衡。现有技术中仍亟需一种更为高效便捷适宜于微量临床样本的宏基因组测序的建库方法。有鉴于此,特提出本发明。技术实现要素:本发明提供一种用于宏基因组测序的建库方法、试剂盒和测序方法,本发明对pcr扩增条件进行优化,可降低建库dna模板的起始量,提高建库成功率,降低pcr扩增偏向性,克服现有建库方法对dna模板的起始量要求高,以及容易出现扩增偏向性,导致菌种丰度严重失衡的技术问题。为了实现本发明的上述目的,特采用以下技术方案:一种用于宏基因组测序的建库方法,所述建库方法包括以下步骤:dna模板片段化和pcr扩增,其中所述pcr扩增的引物用量为1.5~2.5μl/50μl体系,循环数为18~22个。在一些具体的实施方式中,所述pcr扩增的引物用量为1.5μl/50μl体系、2μl/50μl体系或2.5μl/50μl体系。在一些具体的实施方式中,所述pcr扩增的循环数为18、19、20、21、或22,优选为18-20个,更有选为20个。在一些具体的实施方式中,所述pcr扩增的引物用量为2μl/50μl体系,循环数为20个。在一些具体的实施方式中,所述pcr扩增的引物为快速条码引物(rlb)。在一些具体的实施方式中,所述pcr扩增的条件还包括使用gc无偏向性的dna聚合酶;优选地,所述gc无偏向性的dna聚合酶在gc含量>65%的dna样本中仍能稳定扩增的dna聚合酶,例如,invitrogenplatinumsuperfipcrmastermix。在一些具体的实施方式中,所述pcr扩增的条件还包括:退火温度50~60℃,优选为52-56℃,更有选为52℃。在一些具体的实施方式中,在所述dna模板的片段化步骤中,片段化试剂的使用量为2~3μl/10μl体系;优选地,所述片段化试剂的使用量为2.5μl/10μl体系。在一些具体的实施方式中,所述dna模板在建库之前和/或pcr扩增之后,使用磁珠纯化所述dna模板。在一些具体的实施方式中,所述dna模板的建库起始量为1ng以下,可选地,所述dna模板的建库起始量为0.25ng。在一些具体的实施方式中,所述dna模板包括高gc含量的dna片段,优选地,所述高gc含量是指gc含量在60%以上,可选的,65%以上。在一些具体的实施方式中,所述建库方法用于第三代测序,优选用于基于纳米孔的测序平台。在一些具体的实施方式中,所述建库方法使用快速pcr条码试剂盒,优选地,所述快速pcr条码试剂盒为sqk-rpb004,前述片段化试剂为frm混合物,所述引物为快速条形码引物(rlb引物);更优选地,使用前述gc无偏向性的dna聚合酶替换所述试剂盒中的dna聚合酶。在一些具体的实施方式中,所述建库方法用于临床样本。本发明还涉及一种用于前述建库方法的试剂盒,所述试剂盒包括dna片段化试剂、pcr扩增引物和dna聚合酶,其中,所述dna聚合酶为无gc偏向性的dna聚合酶;优选地,所述pcr扩增引物为快速条形码引物(rlb引物);优选地,所述无gc偏向性的dna聚合酶在gc含量>65%的dna样本中仍能稳定扩增。示例性的,所述试剂盒是将sqk-rpb004中的dna聚合酶替换为gc无偏向性的dna聚合酶,优选地,所述gc无偏向性的dna聚合酶在gc含量>65%的dna样本中仍能稳定扩增的dna聚合酶,例如,invitrogentmplatinumtmsuperfitmpcrmastermix。本发明还涉及一种宏基因组测序方法,所述方法包括执行前述的建库方法,还包括将建库产物用于直接测序。与现有技术相比,本发明的有益效果为:(1)本发明通过循环数、退火温度、引物投入量,采用gc无偏向性的dna聚合酶,优化测序的建库条件,可降低建库起始量,提高建库成功率,为去宿主样本及珍贵的临床样本测序检测提供可能性。(2)本发明通过统合条件优化,降低了pcr扩增偏向性,更加真实地反映样本中的微生物比例,使其更适宜于微生物组的精准检测。(3)与前人方法对比,本发明所述方法与临床培养金标准检测更吻合。附图说明为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。图1为实施例所述zymo标准品的菌株信息。具体实施方式下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限制本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购买获得的常规产品。本发明所用试剂和耗材:核酸纯化试剂:agencourtampurexpbeads(货号:a63881);无酶无菌水:thermofisher,nuclease-freewater(notdepc-treated)(货号:am9937);qubit荧光定量仪dna检测试剂盒:qubit1xdsdnahsassaykit(货号:q33231);建库pcr扩增酶:invitrogentmplatinumtmsuperfitmpcrmastermix(货号:12358010);建库pcr扩增酶:taqdnapolymerase(货号:m0323l)核酸标准品zymobiomicstmmicrobialcommunitydnastandard(catalognos.d6305)。英国牛津纳米孔公司的快速pcr条码试剂盒(sqk-rpb004):frm(片段化混合物):1管;rlb(快速条形码引物):01-12a,共12管;rap(快速接头):1管;sqb(测序缓冲液):1管;sqt(测序膜固定物):1管;lb(测序上样珠):1管。一、下述实施例采用的建库和测序流程如下所示:1、建库前的核酸纯化取核酸样本加水补齐至100μl,加入平衡至室温的1.2×ampurexpbeads,室温旋转混匀孵育5min,瞬离放磁力架上去上清;新鲜配制的70%酒精洗2次beads;加入17μl水,室温旋转混匀孵育2min,瞬离放磁力架上至澄清;小心吸取16μl上清至1.5ml低吸附的离心管中,取1μlqubit检测。2、sqk-rpb004建库和纳米孔测序(1)dna模板的片段化:每例样本加入相应比例的模板dna和frm片段化混合物,轻轻混匀离心,反应条件:30℃1min,80℃1min(作为模板)。(2)pcr扩增:配制pcrmix50μl体系,pcr反应,结束后检测产物浓度。(3)混库:不同样本产物混合,等量取样,混合成一管,混库总质量不小于1200ng。(4)纯化:加入0.6×ampurebeads,室温旋转混匀孵育5min,瞬离放磁力架上去上清;200μl新鲜配制的70%酒精洗2次beads;加入12μl10mmtris-hcl(50mmnacl)ph8.0洗脱液,室温旋转混匀孵育2min,瞬离放磁力架上至澄清;小心吸取11μl上清至1.5ml低吸附的离心管中。(5)检测:取纯化后上清1μl用qubit检测,合格标准为dna浓度不低于50ng/μl。(6)加接头:向检测合格的剩余10μl上清液中加入1μlrap,室温反应5min,备用。(7)按照标准纳米孔测序上机流程上机测序。二、下述实施例使用zymoresearch公司生产的dna核酸标准品zymobiomicstmmicrobialcommunitydnastandard(catalognos.d6305)作为验证的输入,该核酸标准品由比例精确定量、临床上及其常见的8种细菌和2种真菌组成,总体gc含量分布广(15%-85%),适合作为研究微生物组的标准品,该核酸标准品的具体菌株信息参见图1。实施例1sqk-rpb004试剂盒的官方建库方法以zymo标准品为样本,按照sqk-rpb004试剂盒提供的官方流程建库,其中,样本dna的起始量分别为1ng和0.25ng(3μl),frm片断化混合物1μl,rlb快速条形码引物为1μl,退火温度分别为56℃和51℃(参见表1)。按照官方流程完成14个循环后,pcr产物的核酸浓度均<1ng/μl(表2),远无法满足上机要求(按照官方说明书在混库阶段总核酸量至少需要100ng,而考虑到纯化损失,在混库阶段单样本的混入量不应少于200ng,即以50μl体系计算,浓度应不小于4ng/μl)。表1.zymo标准品的sqk-rpb004官方流程尝试pcr条件表2.zymo标准品的sqk-rpb004官方流程pcr产物结果实施例2grady建库方法1、按照grady方法进行建库,其中将7.5μldna模板与2.5μlfrm片段化混合物混合,增加循环数至25个循环,缩短延伸时间至4mins。仍以1ng和0.25ngdna模板作为起始量,rlb快速条形码引物用量为1μl,分别尝试56℃和51℃(具体pcr条件参见表3)。建库结果表明,25个循环结束后,pcr产物的核酸量满足上机要求(见表4)。表3.zymo标准品的sqk-rpb004grady流程尝试pcr条件表4.zymo标准品的sqk-rpb004grady流程25个循环pcr产物结果2、按照官方流程混库上机,依据标准流程进行生物信息学分析。然而,测序结果(参见表5)不能满足预期,与标准品的官方比例相差大,对于gc含量较高的菌,如铜绿假单胞菌(pseudomonasaeruginosa)的检测严重失真,检测丰度2.25%远低于理论丰度值12%。表5.zymo标准品的sqk-rpb004grady流程测序结果3、为减小pcr扩增的gc偏向性,本发明尝试将循环数减小,控制在20个循环数,各条件下的pcr产物浓度见表6。表6所示结果表明,当rlb快速条形码引物为1μl条件下,20个循环,无法满足建库需求。表6.zymo标准品的sqk-rpb004grady流程20个循环pcr产物结果实施例3建库体系优化(rlb引物和pcr反应循环数)在实施例2的基础上,针对rlb快速条形码引物和扩增循环数对pcr体系进行优化,以期提高建库成功率:将rlb引物的掺入量提高至2μl,减少pcr扩增循环数至14和20,考察是否能达到建库需求(具体pcr条件参见表7)。结果表明,当循环数为14时,pcr产物的核酸量无法上机(见表8)。而当循环数为20时,pcr产物的核酸量满足上机要求(见表9)。因此,对比rlb快速条形码引物1μl用量的结果,2μlrlb引物(20个循环)为优化后的扩增条件。表7.zymo标准品的sqk-rpb004grady流程改进尝试pcr条件表8.zymo标准品的sqk-rpb004grady流程改进尝试14个循环pcr产物结果表9.zymo标准品的sqk-rpb004grady流程改进尝试20个循环pcr产物结果实施例4建库体系优化(dna聚合酶种类和退火温度)在实施例3的基础上,进一步优化dna聚合酶的种类:在建库体系中选用invitrogentmplatinumtmsuperfitmpcrmastermix酶进行pcr扩增,该酶gc无偏向性的dna聚合酶,即使在gc含量>65%的靶标也能稳定扩增。根据优化后的dna聚合酶,摸索具体的pcr条件,确定不同的退火温度和不同的循环数的扩增效果(参见表10-11)。根据表10-11的结果,最终确定最佳条件为退火温度52-56℃,优选52℃;延伸时间4分钟,18-20个循环,优选20个循环。表10.zymo标准品的sqk-rpb004gc稳定扩增酶条件摸索表11.zymo标准品的sqk-rpb004gc稳定扩增酶不同条件下的pcr扩增结果通过上机测序验证前述最佳条件是否能更真实地反映微生物的丰度比例,具体结果参见表12。对比表12和表5可知,相对于grady流程,本实施例最后优化所得流程取得了更接近于真实比例的测序效果,对于宏基因组测序,尤其是人源临床样本中的病原体检测意义重大。表12.zymo标准品的sqk-rpb004本发明流程测序结果实施例5临床样本验证在上述基于标准品研究的基础上,测试本发明实施例4最优建库流程对于临床样本的测序建库表现:同时用sqk-rpb004原始流程,grady流程和本发明实施例4的最优流程,对于一例痰液和一例肺泡灌洗液(临床培养结果见表13)进行宏基因组测序检测。结果发现用sqk-rpb004原始流程,14个循环结束后pcr产物总量太低,无法完成建库;grady流程和本发明流程的检出结果见表14。对于143号脑脊液样本,本发明对于铜绿假单胞菌给出了更接近于培养结果(所述临床培养结果来源于微生物培养和质谱鉴定)的丰度比例,并且菌种覆盖度也更好;而对于grady流程无法给出鉴定结果的12号痰液样本,本发明流程,成功汇报了与培养结果一致的测序鉴定结果。表13.临床样本摸索培养结果样本编号样本类型培养结果培养菌种培养定量/半定量143肺泡灌洗液阳性+铜绿假单胞菌,鲍曼不动杆菌>10^5cfu/ml12痰液阳性+肺炎克雷伯菌,铜绿假单胞菌++++表14.临床样本摸索测序结果实施例6批量临床样本验证进一步测试本发明对更大临床样本量的表现情况,本发明针对随机收取的临床培养阳性的细菌性感染肺泡灌洗液样本20例,按照上述方法进行宏基因组建库和测序鉴定,以临床培养结果作为金标准对照(所述临床培养结果来源于微生物培养和质谱鉴定)。下表15是详细鉴定结果与培养金标准的比对结果。结果表明,20例肺泡灌洗液样本中有14例成功检出了培养病原体。其中3例未检出的纹带棒状杆菌,进一步通过后续生物信息学优化发现,该未检出是因为采用的比对数据库中不包含纹带棒状杆菌,因此不属于本发明建库流程所导致的阴性结果。可见,本发明建库流程的阳性检出率为85%(17/20例)。表15.本发明流程病原体检出结果与培养金标准详细比对表作为对比,本实施例还随机收取了另一批临床培养阳性的肺泡灌洗液样本23例,按照grady流程进行宏基因组建库和测序鉴定,以临床培养结果作为对照(所述临床培养结果来源于微生物培养和质谱鉴定)。下表16是详细鉴定结果与培养金标准的比对结果。表16.grady流程病原体检出结果与培养金标准详细比对表最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,但本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1