一种利用RNaseH检测(CAG)n重复序列的方法与流程
本发明涉及一种利用rnaseh检测(cag)n重复序列的方法,属于分子生物学技术领域。
背景技术:
亨廷顿舞蹈症等神经性疾病是一种以影响运动功能为主的神经退行性疾病。其病理改变主要是纹状体中等大小多棘神经元的退行性病变,尤以纹状体投射性γ-氨基丁酸神经元的死亡最为严重。该突变基因位于人第4号染色体上,在外显子起始密码子atg下游第17个密码子处有一段三核苷酸cag的重复序列,亨廷顿舞蹈症即由该基因中cag重复序列的异常扩展突变引起的,而且该重复的序列也被视为该疾病检测的生物标志物。
现有检测cag序列的重复状况的方法,有采用的是通过纳米金-dna传感器或是石墨烯氧化物-dna传感器,这两种方法操作简单,检测时间较短。但这两种方法存在多种缺陷,比如目标dna因不能重复利用,所带出的荧光基团较少不易被检测出,并且造成了检测精度不佳、过度浪费等问题。
技术实现要素:
本发明克服现有技术中存在的不足,提供一种利用核糖核酸内切酶rnaseh的特异性,借助氧化石墨烯-rna传感器,检测导致亨廷顿舞蹈症的(cag)n重复序列的方法。
为解决上述技术问题,本发明提供了如下技术方案:
本发明的第一个目的是提供一种检测(cag)n重复序列的方法,所述方法利用核糖核酸内切酶rnaseh检测导致亨廷顿舞蹈症的(cag)n重复序列,其包括如下步骤:
(1)待测(cag)n样品与适配体结合:将待测(cag)n样品与荧光素标记的互补rna适配体溶液混匀;
(2)核糖核酸内切酶rnaseh的酶切反应:向步骤(1)的混合溶液中加入核糖核酸内切酶rnaseh溶液,以及buffer溶液混匀、孵育;
(3)荧光检测:向经过步骤(2)酶切反应的混合溶液中加入氧化石墨烯,混匀、孵育,得到待检测溶液,用荧光分光光度计检测荧光强度,获得(cag)n浓度与荧光强度的线性回归方程,作为(cag)n定量分析的标准曲线。
在本发明的一种实施方式中,所述n=6~15,且n为整数。
在本发明的一种实施方式中,所述(cag)n重复序列的n=10。
在本发明的一种实施方式中,所述(cag)n的dna的核苷酸序列为5’-cagcagcagcagcagcagcagcagcag-3’,所述rna适配体的核苷酸序列为5’-fam-gucgucgucgucgucgucgucgucgucguc-3’。
在本发明的一种实施方式中,所述荧光素标记的rna适配体溶液的浓度为2.0×10-7mol/l,所述荧光素标记的互补rna适配体溶液是将所述荧光素标记的核酸适配体溶液于1.9~2.1×10-2mol/ltris中。
在本发明的一种实施方式中,所述荧光素包括5-羧基荧光素。
在本发明的一种实施方式中,将(cag)10与适配体的混合溶液中加入限制性核酸内切酶rnaseh溶液,所述限制性核酸内切酶rnaseh的用量为每1mol适配体加入3.75×105u,溶解于buffer,并经过36~37℃孵育50~60min。
在本发明的一种实施方式中,向经过酶切反应的溶液稀释并加入氧化石墨烯,混匀、孵育,所述氧化石墨烯的用量为每1mol适配体加入1.1~1.2×104g,温度为室温20~25℃,反应时间≥2min。
在本发明的一种实施方式中,所述反应时间为10min。
在本发明的一种实施方式中,所述检测方法具体为:
(1)用depc水将氧化石墨烯稀释至100μg/ml,混匀。
(2)用depc水溶解被荧光标记的适配体r1(适配体序列为5’-fam-gucgucgucgucgucgucgucgucgucguc-3’),配制成20×10-6mol/l的溶液,混匀。
(3)用depc水溶解(cag)n重复序列d1(序列为5’-cagcagcagcagcagcagcagcagcag-3’),配制成100×10-6mol/l的溶液,混匀。
(4)在含有200×10-9mol/lfam-r1的tris-hcl缓冲溶液中加入不同浓度≤2.5×10-9mol/l的d1,混匀。
(5)在混合溶液中加入0.075u的rnaseh混匀,37℃孵育60min。
(6)在混合溶液中加入24μg/ml的氧化石墨烯,混匀,室温孵育10min。
(7)使用日立f-7000荧光分光光度计,激发波长为480nm,激发狭缝为5nm,发射狭缝为2.5nm,扫描速度1200nm/min,检测520nm的荧光强度。
,本发明的第二个目的是提供一种适用上述检测方法的检测试剂盒。
在本发明的一种实施方式中,所述试剂盒含有dna试剂、氧化石墨烯、经荧光标记的rna适配体、rnaseh酶;所述经荧光标记的rna适配体是5-羧基荧光素标记的rna;所述rna的核苷酸序列如seqidno.2所示;所述dna的核苷酸序列如seqidno.1所示;所述dna试剂、氧化石墨烯分别溶解在depc水中。
在本发明的一种实施方式中,所述经荧光素标记的rna是在rna的5’端连接5-羧基荧光素。
本发明还要求保护所述试剂盒或所述方法在生物、医学检测领域中的应用。
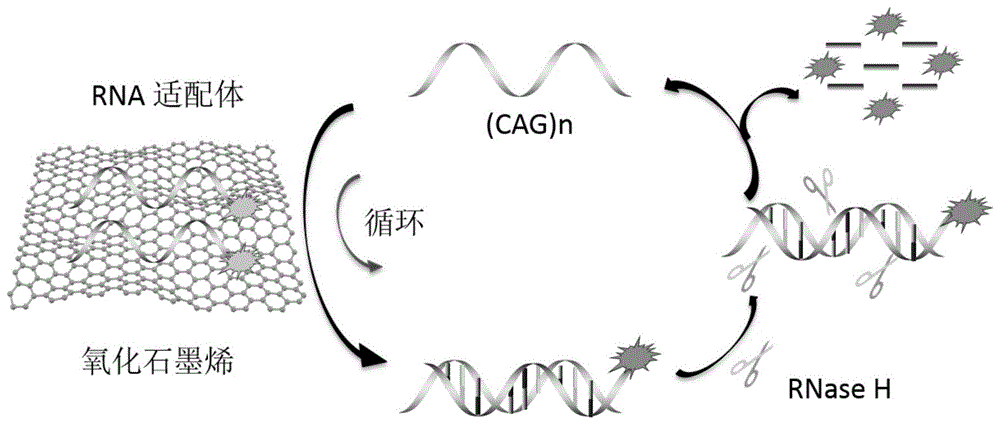
本发明的有益效果:本发明通过含有30个碱基的重复cag序列与rna探针的碱基互补配对,使rna探针从氧化石墨烯上释放出来而恢复荧光,再通过核糖核酸内切酶rnaseh水解该探针rna,特异性地水解杂交到dna链上的rna磷酸二酯键(该酶不能消化单链或双链dna),使目标dna脱离rna探针,恢复单链,恢复的单链在氧化石墨烯上释放下一条探针rna,达到重复多次利用目标dna而不浪费的目的。经过多次循环,只需少量的目标dna即可使荧光信号不断放大,从而提高检测方法的灵敏度。该过程中,原本经氧化石墨烯吸附的荧光素标记的rna适配体荧光淬灭,加入(cag)n后与rna适配体通过碱基互补形成双链结构,从而从氧化石墨烯表面脱离,导致荧光恢复。在rnaseh对rna进行特异性酶切的作用下,切割后的小片段不再被氧化石墨烯吸附,而从双链体中释放出的(cag)n则可重复进行循环,提高(cag)n的利用率,增强检测灵敏度。本发明的方法操作简单、检测快速且灵敏度高,对(cag)n序列的检出限达1.12×10-10mol/l,本发明检测(cag)n序列具有非常高的特异性。
附图说明
图1为本发明工作原理示意图;其中,fam-rna适配体为连接荧光素的rna;(cag)n为检测的目标dna。。
图2为工作原理可行性分析图。
图3为氧化石墨烯浓度对适配体荧光淬灭能力的检测图。
图4为适配体荧光淬灭时间的检测图。
图5为适配体荧光恢复时间的检测图。
图6为氧化石墨烯—rna生物传感器对不同浓度(cag)n重复序列的检测结果图;其中,(a)为线性回归方程图,(b)为荧光光谱图。
图7为不同rnaseh用量对荧光强度的影响检测图。
图8为基于rnaseh的氧化石墨烯—rna生物传感器对不同浓度(cag)n重复序列的检测结果图;其中,(a)为线性回归方程图,(b)为荧光光谱图。
图9为本发明对(cag)n重复序列检测的特异性实验结果图。
具体实施方式
为使本发明的上述目的、特征和优点能够更加明显易懂,下面结合具体实施例对本发明的具体实施方式做详细的说明。
在下面的描述中阐述了很多具体细节以便于充分理解本发明,但是本发明还可以采用其他不同于在此描述的其它方式来实施,本领域技术人员可以在不违背本发明内涵的情况下做类似推广,因此本发明不受下面公开的具体实施例的限制。
其次,此处所称的“一个实施例”或“实施例”是指可包含于本发明至少一个实现方式中的特定特征、结构或特性。在本说明书中不同地方出现的“在一个实施例中”并非均指同一个实施例,也不是单独的或选择性的与其他实施例互相排斥的实施例。
在不做特别说明的情况下,说明书中的浓度为物质在体系中的终浓度。
实施例1:
工作原理可行性分析:
(1)用depc水将氧化石墨烯稀释至100μg/ml,混匀,备用。
(2)用depc水溶解被荧光标记的适配体r1(序列为5’-fam-gucgucgucgucgucgucgucgucgucguc-3’),配制成20×10-6mol/l的溶液,混匀,备用。
(3)用depc水溶解(cag)n(序列为5’-cagcagcagcagcagcagcagcagcag-3’),配制成100×10-6mol/l的溶液,混匀,备用。
(4)用depc水稀释步骤(2)制备的荧光标记的适配体r1溶液至200×10-9mol/l,混匀,成为管①。
(5)在管①中加入终浓度24μg/ml步骤(1)制备的氧化石墨烯溶液,混匀,室温孵育10min,成为管②。
(6)在管②中加入终浓度25×10-9mol/l步骤(3)制备的(cag)n,混匀,室温孵育30min,成为管③。
(7)在管①中加入终浓度25×10-9mol/l的步骤(3)制备的(cag)n和0.075u的rnaseh,混匀,37℃孵育60min,再加入24μg/ml的氧化石墨烯溶液,混匀,室温孵育10min,成为管④。
(8)在紫外灯下观察管①、管②、管③、管④的荧光强度。
结果显示,可见管①为被荧光素标记的适配体原始荧光强度;管②为适配体的荧光被氧化石墨烯淬灭后的荧光强度,荧光几乎完全被淬灭;管③为加入(cag)n后与被荧光素标记的适配体形成双链,从氧化石墨烯表面脱落,荧光较管②有一定程度的恢复;管④在管③的基础上加入了rnaseh,实现了(cag)n的多次循环,荧光强度较管①几乎相同,荧光基本完全恢复。此实例证明检测方法原理可行。
实施例2:
氧化石墨烯浓度对适配体rna荧光淬灭的能力:
1.用depc水将氧化石墨烯稀释至100μg/ml,混匀。
2.用depc水溶解被荧光标记的适配体r1(序列为5’-fam-gucgucgucgucgucgucgucgucgucguc-3’),配制成20×10-6mol/l的溶液,混匀。
3.分别将不同终浓度的氧化石墨烯溶液(0,2,4,6,8,10,12,14,16,18,20,24,28,32μg/ml)加入到tris-hcl缓冲溶液中的20×10-6mol/lfam-r1中,混匀,室温孵育30min。
4.使用日立f-7000荧光分光光度计。激发波长为480nm,激发狭缝为5nm,发射狭缝为2.5nm,扫描速度1200nm/min,检测520nm的荧光强度。结果显示,随着氧化石墨烯浓度增大,荧光强度不断降低,在24μg/ml之后荧光猝灭能力基本持平,荧光强度保持较低水平。
tris-hcl缓冲溶液配方(按终浓度计):2×10-2mol/ltris,1×10-1mol/lnacl,1×10-2mol/lmgcl2,ph值为7.2。
实施例3:
考察适配体荧光淬灭时间的影响,具体步骤如下:
1.用depc水将氧化石墨烯稀释至100μg/ml,混匀。
2.用depc水溶解被荧光标记的适配体r1(序列为5’-fam-gucgucgucgucgucgucgucgucgucguc-3’),配制成20×10-6mol/l的溶液,混匀。
3.用depc水溶解(cag)n(序列为5’-cagcagcagcagcagcagcagcagcag-3’),配制成100×10-6mol/l的溶液,混匀。
4.在含有200×10-9mol/lfam-r1的tris-hcl缓冲溶液中加入24μg/ml的氧化石墨烯溶液,混匀,室温分别孵育0,2,5,8,10,12,15,20,25,30min。
5.使用日立f-7000荧光分光光度计。激发波长为480nm,激发狭缝为5nm,发射狭缝为2.5nm,扫描速度1200nm/min,检测520nm的荧光强度。结果如图4所示,孵育2min后荧光发生淬灭,且随着时间延长保持稳定,之后的实施例终以10min为适配体荧光淬灭稳定时间。
实施例4:
比较适配体荧光恢复时间对荧光效果的影响,具体步骤如下:
1.用depc水将氧化石墨烯稀释至100μg/ml,混匀。
2.用depc水溶解被荧光标记的适配体r1(序列为5’-fam-gucgucgucgucgucgucgucgucgucguc-3’),配制成20×10-6mol/l的溶液,混匀。
3.用depc水溶解(cag)n(序列为5’-cagcagcagcagcagcagcagcagcag-3’),配制成100×10-6mol/l的溶液,混匀。
4.在含有200×10-9mol/lfam-r1的tris-hcl缓冲溶液中加入24μg/ml的氧化石墨烯溶液,混匀,室温孵育10min。
5.在混合溶液中加入25×10-9mol/l的(cag)n,混匀,室温分别孵育0,2,5,8,10,12,15,20,25,30,35,40,45min。
6.使用日立f-7000荧光分光光度计。激发波长为480nm,激发狭缝为5nm,发射狭缝为2.5nm,扫描速度1200nm/min,检测520nm的荧光强度。结果如图5所示,加入(cag)n后,荧光强度在孵育15min后可达800左右,且随着时间延长保持稳定,在之后的实施例终,选择30min为适配体荧光恢复稳定时间。
实施例5:
氧化石墨烯对(cag)n序列的检测,具体步骤如下:
1.用depc水将氧化石墨烯稀释至100μg/ml,混匀。
2.用depc水溶解被荧光标记的适配体r1(序列为5’-fam-gucgucgucgucgucgucgucgucgucguc-3’),配制成20×10-6mol/l的溶液,混匀。
3.用depc水溶解(cag)n(序列为5’-cagcagcagcagcagcagcagcagcag-3’),配制成100×10-6mol/l的溶液,混匀。
4.在含有200×10-9mol/lfam-r1的tris-hcl缓冲溶液中加入24μg/ml的氧化石墨烯溶液,混匀,室温孵育10min。
5.在混合溶液中加入不同浓度(0×10-9,20×10-9,40×10-9,60×10-9,80×10-9,100×10-9,120×10-9,140×10-9,160×10-9,180×10-9,200×10-9,300×10-9,400×10-9,600×10-9,800×10-9,1000×10-9mol/l)的(cag)n,混匀,室温孵育30min。
6.使用日立f-7000荧光分光光度计。激发波长为480nm,激发狭缝为5nm,发射狭缝为2.5nm,扫描速度1200nm/min,检测520nm的荧光强度。
结果如图6(a)所示,建立荧光强度与(cag)n浓度的标准曲线,在dna浓度为0~300×10-9mol/l时,具有良好的线性范围,线性方程为荧光强度=1.46167×[(cag)n]×10-9mol/l+283.60528,建立的标准曲线r2为0.98。如图6(b)所示,为加入不同浓度(cag)n时的荧光光谱图。本发明方法操作简单、检测快速,对(cag)n的检出限达1.97×10-9mol/l。
实施例6:
比较不同rnaseh用量对荧光强度的影响,具体步骤如下:
1.用depc水将氧化石墨烯稀释至100μg/ml,混匀。
2.用depc水溶解被荧光标记的适配体r1(序列为5’-fam-gucgucgucgucgucgucgucgucgucguc-3’),配制成20×10-6mol/l的溶液,混匀。
3.用depc水溶解(cag)n(序列为5’-cagcagcagcagcagcagcagcagcag-3’),配制成100×10-6mol/l的溶液,混匀。
4.在含有200×10-9mol/lfam-r1的tris-hcl缓冲溶液中加入25×10-9mol/l的d1,混匀。
5.在混合溶液中分别加入不同浓度的rnaseh(0,0.0125,0.025,0.075,0.1,0.125u)混匀,37℃孵育60min。
6.在混合溶液中加入24μg/ml的氧化石墨烯,混匀,室温孵育10min。
7.使用日立f-7000荧光分光光度计。激发波长为480nm,激发狭缝为5nm,发射狭缝为2.5nm,扫描速度1200nm/min,检测520nm的荧光强度。
结果如图7所示,rnaseh添加量达0.075u时,荧光强度达1000以上,且随着酶用量的加大,荧光增长趋势渐弱。
实施例7:
基于rnaseh酶,氧化石墨烯对(cag)n序列的检测。
具体步骤如下:
1.用depc水将氧化石墨烯稀释至100μg/ml,混匀。
2.用depc水溶解被荧光标记的适配体r1(适配体序列为5’-fam-gucgucgucgucgucgucgucgucgucguc-3’),配制成20×10-6mol/l的溶液,混匀。
3.用depc水溶解(cag)n重复序列d1(序列为5’-cagcagcagcagcagcagcagcagcag-3’),配制成100×10-6mol/l的溶液,混匀。
4.在含有200×10-9mol/lfam-r1的tris-hcl缓冲溶液中加入不同浓度(0×10-9,1×10-9,2×10-9,3×10-9,4×10-9,5×10-9,7.5×10-9,10×10-9,20×10-9,25×10-9mol/l)的d1,混匀。
5.在混合溶液中加入0.075u的rnaseh混匀,37℃孵育60min。
6.在混合溶液中加入24μg/ml的氧化石墨烯,混匀,室温孵育10min。
7.使用日立f-7000荧光分光光度计。激发波长为480nm,激发狭缝为5nm,发射狭缝为2.5nm,扫描速度1200nm/min,检测520nm的荧光强度。
结果如图8(a)所示,建立荧光强度与(cag)n浓度的标准曲线,在dna浓度为0~25×10-9mol/l时,具有良好的线性范围,线性方程为荧光强度=59.44558×[(cag)n]×10-9mol/l+613.47907,建立的标准曲线r2为0.99。如图8(b)所示,为加入不同浓度(cag)n时的荧光光谱图。本发明方法操作简单、检测快速且灵敏度高,对(cag)n的检出限达1.12×10-10mol/l。
实施例8:
本发明对(cag)n重复序列检测的特异性进行考察,具体步骤如下:
1.用depc水将氧化石墨烯稀释至100μg/ml,混匀。
2.用depc水溶解被荧光标记的适配体r1(序列为5’-fam-gucgucgucgucgucgucgucgucgucguc-3’),配制成20×10-6mol/l的溶液,混匀。
3.用depc水配制浓度为1×10-6mol/l的半错配序列(t1,序列为:5'-cagtcatagccttcgcttaggcatactcag-3'),随机序列1(t2,序列为:5'-actggaccttcaggttgaaccttattaact-3'),随机序列2(t3,序列为:5'-tggtgcctctgaatcagtgtataagctcgt-3'),随机序列3(t4,序列为:5'-gctagtagttccggtctggatagtatctac-3'),(cag)n(序列为5’-cagcagcagcagcagcagcagcagcag-3’)。
4.在含有200×10-9mol/lfam-r1的tris-hcl缓冲溶液中加入7.5×10-9mol/l的t1,t2,t3,t4,(cag)10,混匀。
5.在混合溶液中加入0.075u的rnaseh混匀,37℃孵育60min。
6.在混合溶液中加入24μg/ml的氧化石墨烯,混匀,室温孵育10min。
7.使用日立f-7000荧光分光光度计。激发波长为480nm,激发狭缝为5nm,发射狭缝为2.5nm,扫描速度1200nm/min,检测520nm的荧光强度。
结果如图9所示,f为加入不同dna序列酶切后所测得的荧光恢复强度,f0为被荧光素的适配体r1被氧化石墨烯淬灭后的荧光强度。空白组即被荧光素的适配体r1被氧化石墨烯淬灭后的荧光强度,t1,t2,t3,t4的f/f0比值为1.3~1.5,与空白组(f/f0比值为1)差异不大,而加入(cag)10组f/f0比值为4.7,证实本发明可以实现(cag)n与其他碱基错配序列的区分,具有很高的特异性。
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
sequencelisting
<110>江南大学
<120>一种利用rnaseh检测(cag)n重复序列的方法
<160>5
<170>patentinversion3.3
<210>1
<211>27
<212>dna
<213>人工序列
<400>1
cagcagcagcagcagcagcagcagcag27
<210>2
<211>30
<212>rna
<213>人工序列
<400>2
gucgucgucgucgucgucgucgucgucguc30
<210>3
<211>30
<212>dna
<213>人工序列
<400>3
cagtcatagccttcgcttaggcatactcag30
<210>4
<211>30
<212>dna
<213>人工序列
<400>4
actggaccttcaggttgaaccttattaact30
<210>5
<211>30
<212>dna
<213>人工序列
<400>5
tggtgcctctgaatcagtgtataagctcgt30
- 还没有人留言评论。精彩留言会获得点赞!