一种光反应驱动的聚轮烷状二维超分子纳米组装体系及其制备方法及应用与流程
本发明属于周期性的超分子纳米组装体领域,特别是一种光反应驱动的聚轮烷状二维超分子纳米组装体系。
背景技术:
二维材料,由于其具有良好的分散性、较大的比表面积以及丰富的可接触的活性位点,受到了材料化学、纳米科学、生物制药以及超分子化学等领域的广泛关注。尤其是近些年来,功能性二维材料被广泛的应用于污水处理、气体分离、药物传递和超分子诊疗等方面。目前,利用有机小分子作为组装基元通过各种非共价作用力,如氢键作用、π-π堆积、金属配位作用以及动态共价键实现自组装从而构筑二维材料的策略被普遍运用。参见:(1)mali,k.s.;adisoejoso,j.;ghijsens,e.;decat,i.;defeyter,s.exploringthecomplexityofsupramolecularinteractionsforpatterningattheliquid–solidinterface.acc.chem.res.2012,45,1309–1320;(2)liu,s.;zhang,j.;dong,r.;gordiichuk,p.;zhang,t.;zhuang,x.;mai,y.;liu,f.;herrmann,a.;feng,x.two-dimensionalmesoscale-orderedconductingpolymers.angew.chem.int.ed.2016,55,12516–12521;(3)goronzy,d.p.;ebrahimi,m.;rosei,f.;arramel;fang,y.;defeyter,s.;tait,s.l.;wang,c.;beton,p.h.;wee,a.t.s.;weiss,p.s.;perepichka,d.f.supramolecularassembliesonsurfaces:nanopatterning,functionality,andreactivity.acsnano2018,12,7445–7481。事实上,有机二维材料的发展相比于无机二维材料仍然处于初级阶段,如何巧妙地运用超分子自组装策略有效地构筑功能性的有机二维材料仍然是当前的研究热点。虽然近些年来利用大环化合物实现的超分子二维材料的构筑取得了一定的发展,但是目前的结构主要是基于超分子准轮烷来实现的。这样的结构本身稳定性欠佳,容易受到外界环境的影响,如高温或者存在竞争分子时,其结构不能有效保持,这在一定程度上限制了该类二维材料的进一步发展与应用。因此,利用大环化合物的主客体相互作用,实现稳定的超分子二维材料的构筑仍然是一个挑战。
技术实现要素:
本发明的目的是针对上述存在的问题,利用葫芦[8]脲(cb[8])、烯基吡啶盐修饰的三苯胺(tpa-sp)通过主客体相互作用在水溶液中构筑了一种单层分布的二维超分子纳米结构。在本体系中,客体分子的边臂结构以2:1的方式“头对尾”地包结在葫芦[8]脲的空腔中,进一步在可见光的驱动下,边臂结构中的烯基双键发生光二聚反应,从而实现了超分子聚准轮烷到更加稳定的聚轮烷的结构的转化。而且这种周期性聚轮烷的结构可以捕获富勒烯(c60),得到的复合材料在光动力治疗方面表现了优良的效果。
本发明的技术方案:
一种光反应驱动的聚轮烷状二维超分子纳米组装体系,该二维超分子纳米组装体系为超分子复合材料
一种光反应驱动的聚轮烷状二维超分子纳米组装体系的制备方法,包括以下步骤:
步骤1、烯基吡啶盐修饰的三苯胺tpa-sp的制备;
步骤2、葫芦[8]脲-烯基吡啶盐修饰的三苯胺的二维周期性聚准轮烷状超分子组装体
步骤3、将上述聚准轮烷状超分子组装体利用可见光照射,制备得到葫芦[8]脲-烯基吡啶盐修饰的三苯胺的二维周期性聚轮烷状超分子组装体
步骤4、步骤3所得的二维周期性聚轮烷状超分子组装体中对富勒烯(c60)进行负载捕获,得到超分子复合材料
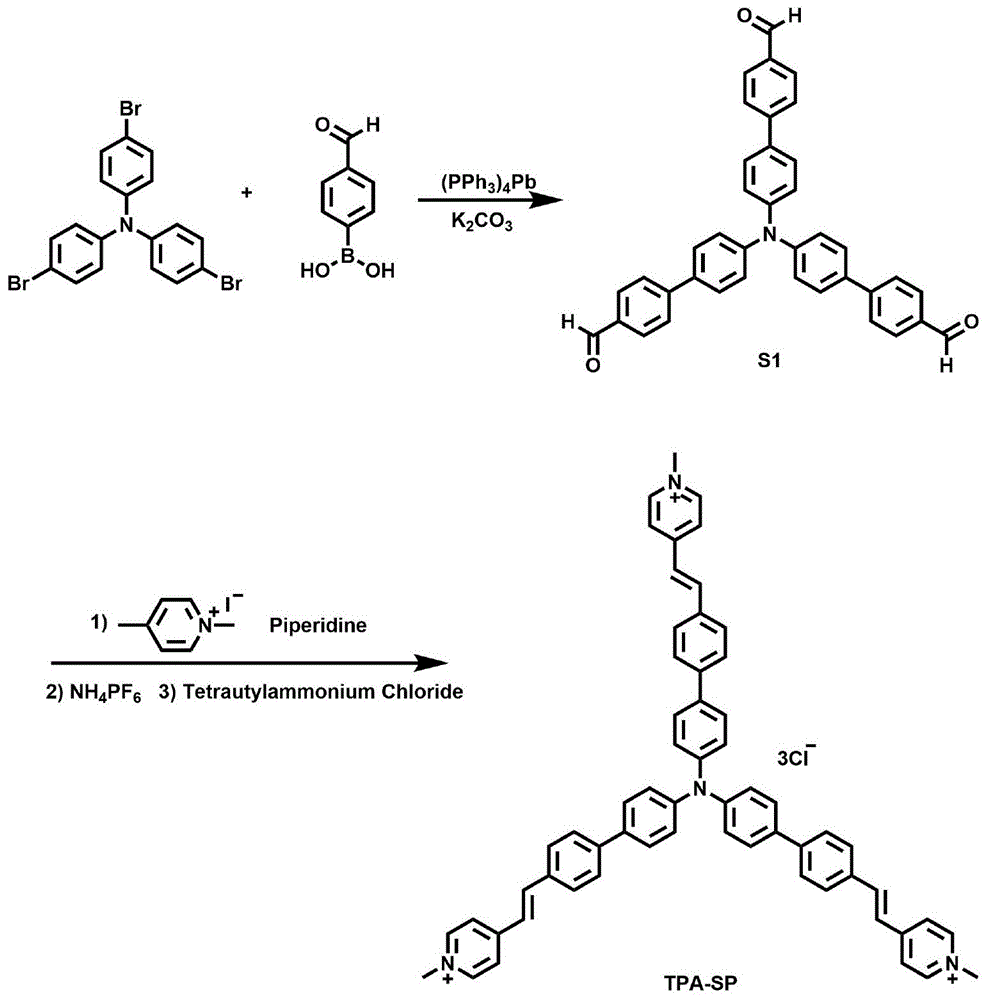
其中烯基吡啶盐修饰的三苯胺通过简单的三步合成制备得到,该客体分子的设计主要有以下两个方面的考虑:1)三苯胺的结构是螺旋桨式的,三个苯环不在同一个平面上,这样的结构在一定程度上会防止客体分子自身的堆积;2)三苯胺周围共价修饰的烯基吡啶盐赋予了客体分子良好的水溶性,而且可以与主体分子葫芦[8]脲形成2:1的络合作用,进一步,烯基双键可以在光照条件下发生光二聚反应,实现二维聚准轮烷向准轮烷结构的转化。
进一步的,其中步骤1中的烯基吡啶盐修饰的三苯胺tpa-sp的制备方法如下:
1)在n2保护下,将三(4-溴苯)胺和4-甲酰基苯硼酸溶解于1,4-二氧六环中,随后加入碳酸钾的水溶液;加入三(4-溴苯)胺、4-甲酰基苯硼酸、1,4-二氧六环、碳酸钾的用量为4.82g:5.99g:150ml:11.05g;随后对该体系进行除氧操作,在n2保护下,加入577.70mg四三苯基膦钯作为催化剂;该反应体系加热90℃搅拌回流48h,反应结束后,冷却到室温;随后用二氯甲烷对反应液进行萃取,收集有机相,旋干用二氯甲烷对粗产物进行柱层析,得到黄色的固体化合物;
2)在n2保护下,将得到的上述固体化合物和1,4-二甲基吡啶碘化物溶于甲醇溶液中,加入几滴六氢哌啶作为催化剂;加入的上述固体化合物、1,4-二甲基吡啶碘化物、甲醇的用量比为1.67g:2.54g:50ml,加热至60℃,反应12小时;待反应完成后,冷却到室温,抽滤并收集沉淀。将所得的红色沉淀用甲醇重结晶几次,真空干燥;
3)将上述的所得的红色沉淀溶于少量水中,向其中加入六氟磷酸铵的饱和水溶液,室温搅拌4个小时,反应出现大量的暗红色沉淀,抽滤并收集沉淀,用大量的水进行洗涤,真空干燥;之后将所得到的暗红色沉淀再次溶解于无水乙腈中,向其中加入四丁基氯化铵的饱和乙腈溶液,室温搅拌4个小时,反应出现大量的红色沉淀,抽滤并收集沉淀,并用大量的无水乙腈洗涤,真空干燥;其中上述步骤的红色沉淀、六氟磷酸铵、四丁基氯化铵的用量比为1.67g:1.46g:2.50g。
进一步的,其中步骤2中葫芦[8]脲-烯基吡啶盐修饰的三苯胺的二维周期性聚准轮烷状超分子组装体
葫芦[8]脲-烯基吡啶盐修饰的三苯胺的二维周期性聚准轮烷状超分子组装体是以葫芦[8]脲为主体分子,以烯基吡啶盐修饰的三苯胺为客体分子,通过主-客体相互作用构筑的;将烯基吡啶盐修饰的三苯胺溶解于水中,之后将相应量的葫芦[8]脲固体加入到所得到的客体溶液中,加热超声至葫芦[8]脲固体完全溶解;如上所述二维周期性聚准轮烷状超分子组装体中烯基吡啶盐修饰的三苯胺的溶度为0.2mm,葫芦[8]脲的浓度为0.3mm。
进一步的,其中步骤3中将聚准轮烷状超分子组装体利用可见光照射,制备得到葫芦[8]脲-烯基吡啶盐修饰的三苯胺的二维周期性聚轮烷状超分子组装体
将步骤2制备的葫芦[8]脲-烯基吡啶盐修饰的三苯胺的二维周期性聚准轮烷状超分子组装体
进一步的,其中步骤4中利用所制备的二维周期性聚轮烷状超分子组装体
将过量的富勒烯(c60)加入到步骤3所得的二维周期性聚轮烷状超分子组装体
一种光反应驱动的聚轮烷状二维超分子纳米组装体系的应用,本发明所制备的超分子复合材料
首先利用琼脂糖凝胶电泳实验考察了不同浓度的超分子复合材料
1)琼脂糖凝胶电泳实验:1%的琼脂糖凝胶由250mg琼脂糖加热溶于25ml的1×tae缓冲溶液(4.0×10-2mol/ltris,2.0×10-2mol/l冰乙酸和2×10-3mol/ledta),冷却至室温后制得。包含不同浓度比的pbr322dna和组装体的溶液与加样缓冲液(北京鼎国)等体积混合后,吸取5μl混合液,注入凝胶进样孔中,电压60v、电流120ma条件下电泳40分钟,随后将凝胶放入溴化乙锭溶液中染色30min,用wd-9413b凝胶成像系统(北京六一仪器厂)观察并记录图像。
2)细胞毒性实验:将a549细胞以5×104cellsml-19(100μl每孔)的密度均匀铺在96孔板里。37℃,5%co2的条件下培养24h之后加入5μl含各种浓度的超分子组装体的溶液继续培养12h。然后对细胞进行白光照射10分钟,再继续培养12h。然后每孔加入碘化丙啶(pi,5μg/ml)进行5分钟的染色,然后通过激光共聚焦显微镜对各实验组数据进行收集,所有数据以平均值±标准偏差的形式呈现。
本发明的优点是:
烯基吡啶盐修饰的三苯胺和葫芦[8]脲首先通过主-客体相互作用自组装形成二维周期性聚准轮烷状超分子组装体;在可见光照的条件下,客体分子中的烯基结构会发生光二聚反应,使得原来的聚准轮烷状超分子组装体转化为更加稳定的二维周期性聚轮烷状超分子组装体;由于所得的聚轮烷状超分子组装体具有良好的稳定性和水溶性,可以作为富勒烯(c60)的捕获剂,进一步构筑功能性的超分子复合体系,并在光动力治疗方面表现了良好的效果,在生物医药方面具有比较广阔的应用前景。
附图说明
图1为烯基吡啶盐修饰的三苯胺tpa-sp合成方法示意图。
图2为烯基吡啶盐修饰的三苯胺tpa-sp的核磁氢谱谱图。
图3为烯基吡啶盐修饰的三苯胺tpa-sp的核磁碳谱谱图。
图4为葫芦[8]脲对烯基吡啶盐修饰的三苯胺的核磁滴定图。
图5为控制主客体总浓度为0.02mm时,葫芦[8]脲与烯基吡啶盐修饰的三苯胺的键合比测定图。
图6为控制烯基吡啶盐修饰的三苯胺浓度为0.003mm葫芦[8]脲与烯基吡啶盐修饰的三苯胺的键合常数测定图。
图7为葫芦[8]脲-烯基吡啶盐修饰的三苯胺的二维周期性聚准轮烷状超分子组装体
图8为葫芦[8]脲-烯基吡啶盐修饰的三苯胺的二维周期性聚准轮烷状超分子组装体
图9为葫芦[8]脲-烯基吡啶盐修饰的三苯胺的二维周期性聚准轮烷状超分子组装体
图10为葫芦[8]脲-烯基吡啶盐修饰的三苯胺的二维周期性聚准轮烷状超分子组装体
图11为葫芦[8]脲-烯基吡啶盐修饰的三苯胺的二维周期性聚准轮烷状超分子组装体
图12为溶液ph=2.2时,控制主客体总浓度为0.02mm时,葫芦[8]脲与烯基吡啶盐修饰的三苯胺的键合比测定图。
图13为溶液ph=2.2时,控制烯基吡啶盐修饰的三苯胺浓度为0.003mm葫芦[8]脲与烯基吡啶盐修饰的三苯胺的键合常数测定图。
图14为溶液ph=2.2时,葫芦[8]脲-烯基吡啶盐修饰的三苯胺的二维周期性聚准轮烷状超分子组装体
图15为葫芦[8]脲-烯基吡啶盐修饰的三苯胺的二维周期性聚轮烷状超分子组装体
图16为葫芦[8]脲-烯基吡啶盐修饰的三苯胺的二维周期性聚轮烷状超分子组装体
图17为葫芦[8]脲-烯基吡啶盐修饰的三苯胺的二维周期性聚轮烷状超分子组装体
图18为葫芦[8]脲-烯基吡啶盐修饰的三苯胺的二维周期性聚轮烷状超分子组装体
图19为葫芦[8]脲-烯基吡啶盐修饰的三苯胺的二维周期性聚轮烷状超分子组装体捕获富勒烯(c60)制备超分子复合材料
图20为超分子复合材料
图21为葫芦[8]脲-烯基吡啶盐修饰的三苯胺的二维周期性聚轮烷状超分子组装体捕获富勒烯(c60)前后的氮气吸附-脱附曲线。
图22为葫芦[8]脲-烯基吡啶盐修饰的三苯胺的二维周期性聚轮烷状超分子组装体捕获富勒烯(c60)前后的tga。
图23为超分子复合材料
具体实施方式
实施例:
一种光反应驱动的葫芦[8]脲-三苯胺衍生物的聚轮烷状二维超分子纳米组装体系,其构筑单元以葫芦[8]脲为主体,以三苯胺衍生物为客体。构筑单元的化学结构式如下:
本发明提供的光反应驱动的葫芦[8]脲-三苯胺衍生物的聚轮烷状二维超分子纳米组装体系的制备方法,包括以下步骤:
步骤1、烯基吡啶盐修饰的三苯胺tpa-sp的制备;
步骤2、葫芦[8]脲-烯基吡啶盐修饰的三苯胺的二维周期性聚准轮烷状超分子组装体
步骤3、将上述聚准轮烷状超分子组装体利用可见光照射,制备得到葫芦[8]脲-烯基吡啶盐修饰的三苯胺的二维周期性聚轮烷状超分子组装体
步骤4、步骤3所得的二维周期性聚轮烷状超分子组装体中对富勒烯(c60)进行负载捕获;
步骤5、将上述所得的超分子复合材料
参加附图1,以上制备方法中,步骤1的烯基吡啶盐修饰的三苯胺tpa-sp的制备,具体步骤如下:
1)在n2保护下,将三(4-溴苯)胺和4-甲酰基苯硼酸溶解于1,4-二氧六环中,随后加入碳酸钾的水溶液。加入三(4-溴苯)胺、4-甲酰基苯硼酸、1,4-二氧六环、碳酸钾的用量为4.82g:5.99g:150ml:11.05g。随后对该体系进行除氧操作,在n2保护下,加入577.70mg四三苯基膦钯作为催化剂。该反应体系加热90℃搅拌回流48h,反应结束后,冷却到室温。随后用二氯甲烷对反应液进行萃取,收集有机相,旋干用二氯甲烷对粗产物进行柱层析,得到黄色的固体化合物;
2)在n2保护下,将得到的上述固体化合物和1,4-二甲基吡啶碘化物溶于甲醇溶液中,加入几滴六氢哌啶作为催化剂。加入的上述固体化合物、1,4-二甲基吡啶碘化物、甲醇的用量比为1.67g:2.54g:50ml,加热至60℃,反应12小时。待反应完成后,冷却到室温,抽滤并收集沉淀。将所得的红色沉淀用甲醇重结晶几次,真空干燥;
3)将上述的所得的红色沉淀溶于少量水中,向其中加入六氟磷酸铵的饱和水溶液,室温搅拌4个小时,反应出现大量的暗红色沉淀,抽滤并收集沉淀,用大量的水进行洗涤,真空干燥。之后将所得到的暗红色沉淀再次溶解于无水乙腈中,向其中加入四丁基氯化铵的饱和乙腈溶液,室温搅拌4个小时,反应出现大量的红色沉淀,抽滤并收集沉淀,并用大量的无水乙腈洗涤,真空干燥。其中上述步骤的红色沉淀、六氟磷酸铵、四丁基氯化铵的用量比为1.67g:1.46g:2.50g。
图2为烯基吡啶盐修饰的三苯胺的核磁氢谱谱图。图中表明:烯基吡啶盐修饰的三苯胺的结构正确。
图3为烯基吡啶盐修饰的三苯胺的碳谱谱图。图中表明:烯基吡啶盐修饰的三苯胺的结构正确。
本发明制备方法的步骤2中,葫芦[8]脲-烯基吡啶盐修饰的三苯胺的二维周期性聚准轮烷状超分子组装体
葫芦[8]脲-烯基吡啶盐修饰的三苯胺的二维周期性聚准轮烷状超分子组装体是以葫芦[8]脲为主体分子,以烯基吡啶盐修饰的三苯胺为客体分子,通过主-客体相互作用构筑的。将烯基吡啶盐修饰的三苯胺溶解于水中,之后将相应量的葫芦[8]脲固体加入到所得到的客体溶液中,加热超声至葫芦[8]脲固体完全溶解。如上所述二维周期性聚准轮烷状超分子组装体中烯基吡啶盐修饰的三苯胺的溶度为0.2mm,葫芦[8]脲的浓度为0.3mm。
图4为葫芦[8]脲对烯基吡啶盐修饰的三苯胺的核磁滴定图。图中表明:葫芦[8]脲对烯基吡啶盐修饰的三苯胺具有良好的键合作用。
图5为控制主客体总浓度为0.02mm时,葫芦[8]脲与烯基吡啶盐修饰的三苯胺的键合比测定图。图中表明:葫芦[8]脲对烯基吡啶盐修饰的三苯胺的job’splot曲线的最低点对应的横坐标为0.4,即葫芦[8]脲对烯基吡啶盐修饰的三苯胺的键合比为3:2。
图6为控制烯基吡啶盐修饰的三苯胺浓度为0.003mm葫芦[8]脲与烯基吡啶盐修饰的三苯胺的键合常数测定图。图中表明:葫芦[8]脲对烯基吡啶盐修饰的三苯胺的键合常数为k1=7.33×103m-1,k2=3.94×107m-1,即葫芦[8]脲与烯基吡啶盐修饰的三苯胺形成的主客体络合物是十分稳定的。
图7为葫芦[8]脲-烯基吡啶盐修饰的三苯胺的二维周期性聚准轮烷状超分子组装体
图8为葫芦[8]脲-烯基吡啶盐修饰的三苯胺的二维周期性聚准轮烷状超分子组装体
图9为葫芦[8]脲-烯基吡啶盐修饰的三苯胺的二维周期性聚准轮烷状超分子组装体
图10为葫芦[8]脲-烯基吡啶盐修饰的三苯胺的二维周期性聚准轮烷状超分子组装体
图11为葫芦[8]脲-烯基吡啶盐修饰的三苯胺的二维周期性聚准轮烷状超分子组装体
本发明制备方法的步骤3中,聚准轮烷状超分子组装体在可见光照射的条件下发生光二聚反应,从而得到葫芦[8]脲-烯基吡啶盐修饰的三苯胺的二维周期性聚轮烷状超分子组装体
将步骤2制备的葫芦[8]脲-烯基吡啶盐修饰的三苯胺的二维周期性聚准轮烷状超分子组装体
图12为溶液ph=2.2时,控制主客体总浓度为0.02mm时,葫芦[8]脲与烯基吡啶盐修饰的三苯胺的键合比测定图。图中表明:在溶液ph=2.2时,葫芦[8]脲对烯基吡啶盐修饰的三苯胺的job’splot曲线的最低点对应的横坐标为0.4,即葫芦[8]脲对烯基吡啶盐修饰的三苯胺的键合比为3:2。
图13为溶液ph=2.2时,控制烯基吡啶盐修饰的三苯胺浓度为0.003mm葫芦[8]脲与烯基吡啶盐修饰的三苯胺的键合常数测定图。图中表明:在溶液ph=2.2时,葫芦[8]脲对烯基吡啶盐修饰的三苯胺的键合常数为k1=4.93×103m-1,k2=2.92×107m-1,即葫芦[8]脲与烯基吡啶盐修饰的三苯胺形成的主客体络合物是十分稳定的。
图14为溶液ph=2.2时,葫芦[8]脲-烯基吡啶盐修饰的三苯胺的二维周期性聚准轮烷状超分子组装体
图15为葫芦[8]脲-烯基吡啶盐修饰的三苯胺的二维周期性聚轮烷状超分子组装体
图16为葫芦[8]脲-烯基吡啶盐修饰的三苯胺的二维周期性聚轮烷状超分子组装体
图17为葫芦[8]脲-烯基吡啶盐修饰的三苯胺的二维周期性聚轮烷状超分子组装体
图18为葫芦[8]脲-烯基吡啶盐修饰的三苯胺的二维周期性聚轮烷状超分子组装体
本发明制备方法的步骤4中,利用所制备的二维周期性聚轮烷状超分子组装体对富勒烯(c60)进行负载捕获的具体方法是:
将过量的富勒烯(c60)加入到步骤3所得的二维周期性聚轮烷状超分子组装体的溶液中,超声半个小时,之后高速离心除去未被负载的富勒烯(c60)。
图19为葫芦[8]脲-烯基吡啶盐修饰的三苯胺的二维周期性聚轮烷状超分子组装体
图20为超分子复合材料
图21为葫芦[8]脲-烯基吡啶盐修饰的三苯胺的二维周期性聚轮烷状超分子组装体捕获富勒烯(c60)前后的氮气吸附-脱附曲线。图中表明:bet数值由原来的35m2g–1降低到7m2g–1说明二维周期性聚轮烷状超分子组装体
图22为葫芦[8]脲-烯基吡啶盐修饰的三苯胺的二维周期性聚轮烷状超分子组装体捕获富勒烯(c60)前后的tga。图中表明:二维周期性聚轮烷状超分子组装体
本发明制备方法的步骤5中,将所制备的超分子复合材料
首先利用琼脂糖凝胶电泳实验考察了不同浓度的超分子复合材料
1)琼脂糖凝胶电泳实验:1%的琼脂糖凝胶由250mg琼脂糖加热溶于25ml的1×tae缓冲溶液(4.0×10-2mol/ltris,2.0×10-2mol/l冰乙酸和2×10-3mol/ledta),冷却至室温后制得。包含不同浓度比的pbr322dna和组装体的溶液与加样缓冲液(北京鼎国)等体积混合后,吸取5μl混合液,注入凝胶进样孔中,电压60v、电流120ma条件下电泳40分钟,随后将凝胶放入溴化乙锭溶液中染色30min,用wd-9413b凝胶成像系统(北京六一仪器厂)观察并记录图像。
2)细胞毒性实验:将a549细胞以5×104cellsml-19(100μl每孔)的密度均匀铺在96孔板里。37℃,5%co2的条件下培养24h之后加入5μl含各种浓度的超分子组装体的溶液继续培养12h。然后对细胞进行白光照射10分钟,再继续培养12h。然后每孔加入碘化丙啶(pi,5μg/ml)进行5分钟的染色,然后通过激光共聚焦显微镜对各实验组数据进行收集,所有数据以平均值±标准偏差的形式呈现。
图23为超分子复合材料
- 还没有人留言评论。精彩留言会获得点赞!