一种正电子显像剂18F-FPGalNAc及其制备方法和应用与流程
本发明涉及一种正电子显像剂18f-fpgalnac及其制备方法和应用。
背景技术:
恶性肿瘤会威胁人类生命和健康,所以早期的诊断和治疗至关重要。解剖成像(超声、ct和mri等)可以从大小、形态、密度等解剖形态的变化来评价肿瘤,进而可以提供器官或组织准确的解剖信息,是目前临床最常用的检查方法。然而,恶性肿瘤的形成是一个复杂的过程,先发生原癌基因、抑癌基因、直接/间接控制细胞增殖的基因等的突变,然后出现分子水平的改变和功能异常,最后才发生形态学改变。因此,只有从细胞和分子水平诊断肿瘤才是真正的早期诊断,而解剖成像无法实现分子水平诊断,且特异性不高,对于疾病早期诊断能够提供的信息有限。
分子影像可以在分子水平上实现实时、无创、动态的在体成像,可以在出现解剖形态改变之前发现疾病,有希望真正实现肿瘤的早期诊断和个体化治疗。分子探针是分子成像的关键,是通过将特殊分子引入组织体内与特定分子(靶分子)特异性结合产生信号,再在体外采用磁共振(mri)、正电子发射计算机断层显像(pet)、ct和单光子发射计算机断层显像(spect)、超声以及光学设备等进行成像。近几年,pet显像倍受关注。
目前,临床上应用最广泛的pet显像剂是18f-脱氧葡萄糖(18f-fdg),主要是用于原发肿瘤良恶性的鉴别、恶性肿瘤的分期、寻找肿瘤的原发灶、放化疗后肿瘤组织的坏死与残余肿瘤的鉴别、肿瘤复发的诊断、对肿瘤患者的预后评估、监控单独化疗或联合治疗后的效果等。然而,18f-fdg为非肿瘤特异性示踪剂,除正常组织生理性摄取外,有些良性病变,如炎症、活动性结核、结节病、炎性假瘤、放疗/手术后反应等均可以表现为18f-fdg高摄取,导致假阳性结果,而有些恶性肿瘤,如支气管肺泡癌、肾透明细胞癌、高分化肝细胞癌、部分体积小且发展较缓慢的癌症却表现为假阴性。
pet受体显像是利用正电子放射性核素标记的相应配体与肿瘤中高表达的、与靶组织高亲和力的特异受体相结合的原理,显示肿瘤受体空间分布、密度、亲和力的显像技术,具有亲和力高、特异性强、穿透能力强、放射性标记配体到达靶点和血液清除速度快、能在较短时间内获得肿瘤与正常组织高对比度的图像、几乎没有人体免疫反应发生等优点,且具有无创性,能够在活体状态下进行细胞分子水平研究,是目前分子影像的重要发展方向之一。
去唾液酸糖蛋白受体(asgpr),又名肝凝集素,是20世纪六七十年代发现的一种受体。asgpr是一种跨膜蛋白,主要存在于肝脏窦状隙和基底外侧的细胞表面,目前已知asgpr的天然配体有半乳糖、乳糖、n-乙酰半乳糖胺、去唾液酸胎球蛋白、去唾液酸血清类粘蛋白等。研究发现,asgpr在多种肿瘤中都有表达,如mcf-7、a549、hct116、mda-mb-231等,这为asgpr作为pet显像受体的靶点提供了可靠的依据。
cn109369755a公开了一种靶向asgpr的正电子显像剂18f-gal-1,18f-gal-1能够特异性靶向asgpr表达高的hepg2、a549、mda-mb-231、mcf-7等肿瘤,但18f-gal-1中的半乳糖基团(gal)与asgpr结合的亲和性一般,且18f-gal-1对于肺癌a549肿瘤的摄取较小(靶/非靶比值低),特异性不高,这是目前研究asgpr对于肿瘤摄取的过程中急需解决的问题。
技术实现要素:
本发明的目的在于提供一种正电子显像剂18f-fpgalnac及其制备方法和应用。
本发明所采取的技术方案是:
一种正电子显像剂18f-fpgalnac,结构式为:
上述正电子显像剂18f-fpgalnac的制备方法,包括以下步骤:
1)将4-戊炔-1-醇分散在溶剂中,加入三乙胺和4-二甲氨基吡啶,混合均匀,再加入对甲苯磺酰氯,充分反应,对反应液进行萃取,再对萃取物进行除水、减压蒸馏和柱层析分离,得到
2)将
3)将
4)将
5)将
6)将
优选的,上述正电子显像剂18f-fpgalnac的制备方法,包括以下步骤:
1)将4-戊炔-1-醇分散在溶剂中,加入三乙胺和4-二甲氨基吡啶,混合均匀,再将反应混合物置于冰浴中,滴加对甲苯磺酰氯,滴加完后常温反应10~20h,对反应液进行萃取,再对萃取物进行除水、减压蒸馏和柱层析分离,得到
2)将
3)将
4)将
5)将
6)将
优选的,步骤1)所述4-戊炔-1-醇、三乙胺、4-二甲氨基吡啶、对甲苯磺酰氯的摩尔比为1:(3~7):(0.04~0.09):(1.2~1.8)。
优选的,步骤1)所述溶剂为二氯甲烷。
优选的,步骤2)所述溶剂为乙腈。
优选的,步骤3)所述溶剂为吡啶。
优选的,步骤4)所述
优选的,步骤4)所述溶剂为二氯甲烷。
优选的,步骤5)所述
优选的,步骤5)所述溶剂为甲醇。
优选的,步骤5)中通过强酸型阳离子树脂调节反应液的ph值。
优选的,步骤6)所述溶剂为水、乙腈中的至少一种。
进一步优选的,步骤6)所述溶剂由水和乙腈按照质量比1:1组成。
本发明的有益效果是:本发明的正电子显像剂18f-fpgalnac中含有n-乙酰半乳糖胺基团(galnac),其与asgpr结合的亲和性要比半乳糖基团(gal)高很多,能够特异性靶向asgpr表达高的hepg2、a549、mda-mb-231、mcf-7、hct116等肿瘤,显像效果好。
1)本发明的正电子显像剂18f-fpgalnac中的n-乙酰半乳糖胺基团(galnac)与asgpr结合的亲和性要比半乳糖基团(gal)高约50倍,特异性更强;
2)本发明的正电子显像剂18f-fpgalnac对hepg2、a549、mda-mb-231、mcf-7、hct116等肿瘤的显像效果均十分优异,尤其是对肺癌a549肿瘤和结肠癌hct116肿瘤模型的显像效果要显著优于正电子显像剂18f-gal-1;
3)本发明的正电子显像剂18f-fpgalnac的产率显著提高,要高于正电子显像剂18f-gal-1;
4)本发明的正电子显像剂18f-fpgalnac在昆明鼠肝硬化的疾病诊断方面也有一定的作用。
附图说明
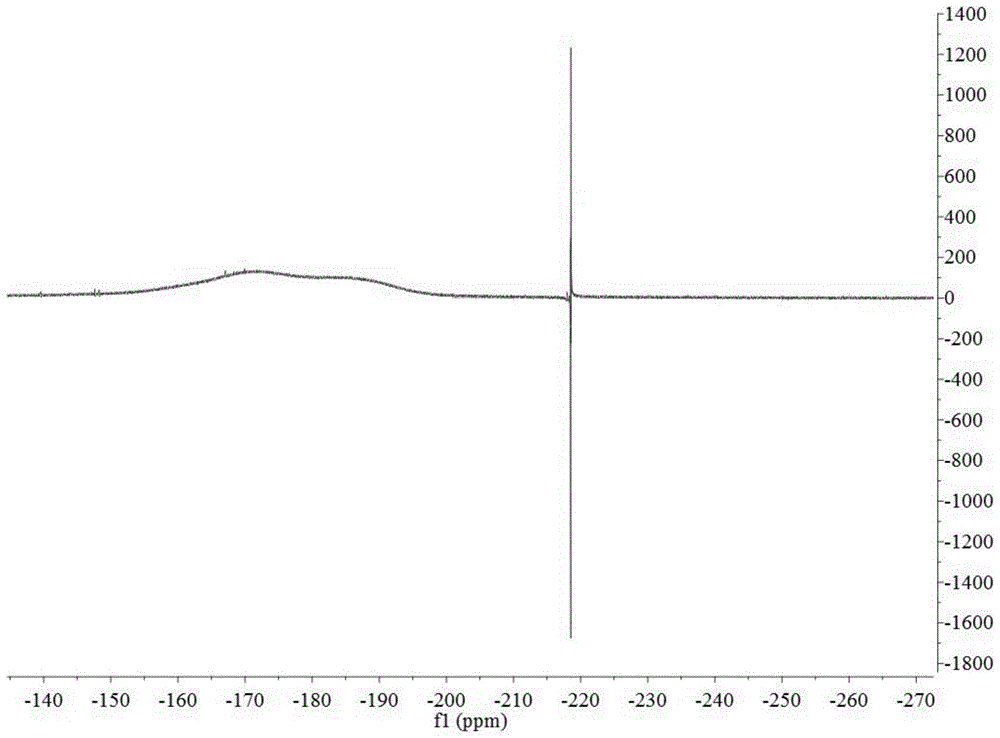
图1为18f-fpgalnac的核磁氟谱。
图2为18f-fpgalnac的核磁氢谱。
图3为18f-fpgalnac的质谱(正离子模式)。
图4为18f-fpgalnac的质谱(负离子模式)。
图5为18f-fpgalnac在小鼠结肠癌hct116肿瘤模型中的pet-ct显像结果(箭头所指为肿瘤)。
图6为18f-fdg在小鼠结肠癌hct116肿瘤模型中的pet-ct显像结果(箭头所指为肿瘤)。
图7为18f-fpgalnac在小鼠肺癌a549肿瘤模型中的pet-ct显像结果(箭头所指为肿瘤)。
图8为18f-gal-1在小鼠肺癌a549肿瘤模型中的pet-ct显像结果(箭头所指为肿瘤)。
图9为18f-fpgalnac在肝纤维化小鼠模型中的pet-ct显像结果(从左至右依次为15min、30min、60min、90min和120min)。
图10为18f-fpgalnac在正常小鼠模型中的pet-ct显像结果(从左至右依次为15min、30min、60min、90min和120min)。
图11为18f-fpgalnac在肝纤维化小鼠模型主要脏器内的生物分布曲线。
图12为18f-fpgalnac在正常小鼠模型主要脏器内的生物分布曲线。
具体实施方式
下面结合具体实施例对本发明作进一步的解释和说明。
实施例1:
一种正电子显像剂18f-fpgalnac的制备方法,包括以下步骤:
1)将4-戊炔-1-醇(2.52g,30mmol)分散在80ml二氯甲烷中,再加入三乙胺(10.12g,100mmol)、4-二甲氨基吡啶(0.16g,1.32mmol)和对甲苯磺酰氯(6.86g,36mmol),常温反应14h,加入氯化铵(5.35g,0.1mol)中和三乙胺,再用乙酸乙酯进行萃取,再对萃取物进行无水硫酸钠除水、减压蒸馏和柱层析分离,得到浅黄色液体
2)将
3)将
4)将
5)将
6)将
18f-fpgalnac的核磁氟谱如图1所示,核磁氢谱如图2所示(位移2.5是氘代dmso的溶剂峰),质谱(正离子模式)如图3所示,质谱(负离子模式)如图4所示。
由图1可知:化学位移-218.55ppm,与氟乙基的理论位置-218ppm接近。
图2的解谱分析如下:1hnmr(600mhz,dmso)δ7.90(m,1h),7.74(d,j=9.4hz,1h),5.56(d,j=9.9hz,1h),4.5(m,1h),4.41(ddt,j=23.3,19.7,8.0hz,2h),3.78(d,j=2.7hz,1h),3.68(ddd,j=20.2,12.0,5.3hz,2h),3.53(m,2h),2.7(t,2h),1.95(m,2h),1.61(m,3h)。
由图3可知:正离子模式[m+1h]得到333.12,m=332.12,理论计算值为332.15,理论值与实际值相符合。
由图4可知:负离子模式[m-1h]得到331.10,m=332.10,理论计算值为332.15,理论值与实际值相符合。
综合图1~4的结果可知:合成的确实是
18f-fpgalnac的合成路线如下:
实施例2:
一种正电子显像剂18f-fpgalnac的制备方法,包括以下步骤:
1)将4-戊炔-1-醇(2.52g,30mmol)分散在100ml二氯甲烷中,再加入三乙胺(10.12g,100mmol)、4-二甲氨基吡啶(0.16g,1.32mmol)和对甲苯磺酰氯(6.86g,36mmol),常温反应10h,加入氯化铵(5.35g,0.1mol)中和三乙胺,用乙酸乙酯进行萃取,再对萃取物进行无水硫酸钠除水、减压蒸馏和柱层析分离,得到浅黄色液体
2)将
3)将
4)将
5)将
6)将
实施例3:
一种正电子显像剂18f-fpgalnac的制备方法,包括以下步骤:
1)将4-戊炔-1-醇(2.52g,30mmol)分散在100ml二氯甲烷中,再加入三乙胺(10.12g,100mmol)、4-二甲氨基吡啶(0.16g,1.32mmol)和对甲苯磺酰氯(6.86g,36mmol),常温反应20h,加入氯化铵(5.35g,0.1mol)中和三乙胺,用乙酸乙酯进行萃取,再对萃取物进行无水硫酸钠除水、减压蒸馏和柱层析分离,得到浅黄色液体
2)将
3)将
4)将
5)将
6)将
测试例:
pet-ct显像测试:
测试方法:将正电子显像剂通过尾静脉注入荷瘤鼠体内,代谢1h,再用7%的水合氯醛将小鼠麻醉后固定在扫描床架上,采集荷瘤鼠的pet-ct图像,并通过数据重建得到正电子显像剂在荷瘤鼠体内的分布图。
18f-fpgalnac在小鼠结肠癌hct116肿瘤模型中的pet-ct显像结果如图5所示。
18f-fdg在小鼠结肠癌hct116肿瘤模型中的pet-ct显像结果如图6所示。
18f-fpgalnac在小鼠肺癌a549肿瘤模型中的pet-ct显像结果如图7所示。
18f-gal-1在小鼠肺癌a549肿瘤模型中的pet-ct显像结果如图8所示。
18f-fpgalnac在小鼠肝纤维化模型中的pet-ct显像结果如图9所示(从左至右依次为15min、30min、60min、90min和120min)。
18f-fpgalnac在正常小鼠中的pet-ct显像结果如图10所示(从左至右依次为15min、30min、60min、90min和120min)。
18f-fpgalnac在小鼠肝纤维化模型主要脏器内的生物分布曲线如图11所示。
18f-fpgalnac在正常小鼠主要脏器内的生物分布曲线如图12所示。
由图5和图6可知:18f-fpgalnac在hct116肿瘤中的显像十分明显,而18f-fdg在hct116肿瘤中显像不明显;通过对肿瘤和肌肉的感兴趣区进行勾画,由软件计算出相应区域的标准摄取值(standardizeduptakevalue),得到18f-fpgalnac在hct116肿瘤中60min时的标准摄取值达到2.9%id/g,肿瘤/肌肉为3.7,能够很容易诊断肿瘤,而18f-fdg在hct116肿瘤中60min时的标准摄取值和肌肉相当,无法诊断肿瘤。因此,18f-fpgalnac能够弥补显像剂18f-fdg对于hct116肠癌疾病的诊断不足。
由图7和图8可知:18f-fpgalnac在a549肿瘤中的显像十分明显,而18f-gal-1在a549肿瘤中显像不明显;通过对肿瘤和肌肉的感兴趣区进行勾画,由软件计算出相应区域的标准摄取值(standardizeduptakevalue),得到18f-fpgalnac在a549肿瘤中60min时的标准摄取值达到1.2%id/g,肿瘤/肌肉为3.2,能够很容易诊断肿瘤,而18f-gal-1在a549肿瘤中60min时的标准摄取值和肌肉相当,无法诊断肿瘤。因此,18f-fpgalnac能够弥补显像剂18f-gal-1对于a549肺癌疾病的诊断不足。
由图9和图10可知:18f-fpgalnac对于整个小鼠的肝脏显像十分清晰,30min便能清晰成像,且可以一直持续到120min,很适合肝脏成像;肝纤维化小鼠的肝脏对于18f-fpgalnac的摄取比正常小鼠低,且有明显的不均匀摄取。
由图11和图12可知:在肝纤维化小鼠的肾脏代谢过程中,肾脏对18f-fpgalnac的摄取15min便达到最大值,而在正常小鼠的肾脏代谢过程中,35min才达到最大值,可见在小鼠肝脏代谢系统受损的情况下,18f-fpgalnac在其体内的药代动力学情况也会随之改变,且肝脏受损会导致肾脏的代谢负荷增加,肾脏代谢达到最大值的时间提前。所以,18f-fpgalnac可以用于评价肝脏的整体功能,且可以结合三维模拟软件评价剩余肝脏的功能,为肝切除提供帮助。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!