一种L-丝氨酸的制备方法与流程
本发明涉及l-丝氨酸制备技术领域,特别涉及一种l-丝氨酸的制备方法。
背景技术:
l-丝氨酸处于机体多条代谢途径之中,在机体内发挥重要的生理功能。同时,l-丝氨酸作为一种原料,在化工、制药、食品、化妆品和生物农药等行业有着广泛的应用,因此其需求量日益增大,是市场上价格最昂贵的氨基酸之一。
丝氨酸羟甲基转移酶(shmt)是体外酶促法制备l-丝氨酸的关键酶,它是以5-磷酸吡哆醛(plp)为辅酶的吡哆醛酶,能在四氢叶酸(thf)存在的条件下催化甲醛与甘氨酸缩合生成l-丝氨酸。
在现有通过酶促转化法制备l-丝氨酸的工艺中,一般需要在酶促反应工艺完成后对酶促反应体系中的细胞碎片沉淀分离,所得液体经717阴离子树脂柱洗脱,将产物l-丝氨酸与甘氨酸分离。但是,在717阴离子过柱时,虽然产物得到了纯化,同时shmt及辅酶因子也在分离过程中丢失,未能重复利用。而在制备l-丝氨酸的成本中,酶、辅酶及thf是成本组成的重要部分,因此,如果能将这些成分的重复利用,能大大降低l-丝氨酸的生产成本。
技术实现要素:
本发明的主要目的是提出一种l-丝氨酸的制备方法,旨在降低通过酶促转化反应制备l-丝氨酸的生产成本。
为实现上述目的,本发明提出一种l-丝氨酸的制备方法,包括以下步骤:
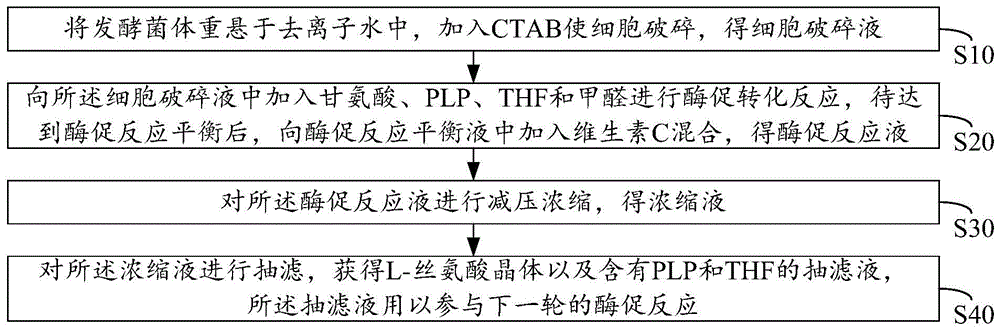
将发酵菌体重悬于去离子水中,加入ctab使细胞破碎,得细胞破碎液;
向所述细胞破碎液中加入甘氨酸、plp、thf和甲醛进行酶促转化反应,待达到酶促反应平衡后,向酶促反应平衡液中加入维生素c混合,得酶促反应液;
对所述酶促反应液进行减压浓缩,得浓缩液;
对所述浓缩液进行抽滤,获得l-丝氨酸晶体以及含有plp和thf的抽滤液,所述抽滤液用以参与下一轮的酶促反应。
可选地,将发酵菌体重悬于去离子水中,加入ctab使细胞破碎,得细胞破碎液的步骤,包括:
将发酵菌体重悬于去离子水中,得菌悬液;
向所述菌悬液中加入ctab破碎细胞,待细胞破碎后用陶瓷膜过滤去除菌体,并收集滤液,得细胞破碎液。
可选地,将发酵菌体重悬于去离子水中,得菌悬液的步骤中:
所述菌悬液中发酵菌体的浓度为0.07~0.09kg/l。
可选地,向所述菌悬液中加入ctab破碎细胞,待细胞破碎后用陶瓷膜过滤去除菌体,并收集滤液,得细胞破碎液的步骤中:
所述ctab在所述菌悬液中的质量浓度为0.05~0.2%。
可选地,向所述细胞破碎液中加入甘氨酸、plp、thf和甲醛进行酶促转化反应,待达到酶促反应平衡后,向酶促反应平衡液中加入维生素c混合,得酶促反应液的步骤中:
所述维生素c在所述酶促反应平衡液中的添加浓度为0.15~0.35g/l。
可选地,向所述细胞破碎液中加入甘氨酸、plp、thf和甲醛进行酶促转化反应,待达到酶促反应平衡后,向酶促反应平衡液中加入维生素c混合,得酶促反应液的步骤中:
所述酶促反应体系中,所述甘氨酸、5-磷酸吡哆醛、四氢叶酸和甲醛的浓度对应为2~2.8mol/l、0.2~0.4mmol/l、3~5mmol/l和8~13mmol/l,且所述酶促反应体系的ph值为6.0~8.0。
可选地,向所述细胞破碎液中加入甘氨酸、plp、thf和甲醛进行酶促转化反应,待达到酶促反应平衡后,向酶促反应平衡液中加入维生素c混合,得酶促反应液的步骤中:
所述酶促转化反应过程中的搅拌速率为100~150rpm,反应温度为35~40℃,反应时间为18~24h。
可选地,对所述酶促反应液进行减压浓缩,得浓缩液的步骤,包括:
对所述酶促反应液进行减压浓缩,至浓缩后的体积为原体积的1/6~1/7为止,得浓缩液。
可选地,对所述酶促反应液进行减压浓缩,至浓缩后的体积为原体积的1/6~1/7为止,得浓缩液的步骤中:
所述减压浓缩时的压力为-0.09~-0.08mpa,温度为37~40℃。
可选地,对所述浓缩液进行抽滤,获得l-丝氨酸晶体以及含有plp和thf的抽滤液,所述抽滤液用以参与下一轮的酶促反应的步骤中:
进行所述抽滤时的抽滤压力为-0.05~-0.04mpa,抽滤时间为6~8h,且过滤膜为陶瓷膜。
本发明提供的技术方案中,通过向酶促反应平衡体系中加入一定量的维生素c,使得整个酶促体系保持还原性的微环境,有利于plp和thf保持活性;然后将添加有维生素c的酶促反应液进行减压浓缩后抽滤,分离出l-丝氨酸产物的同时,经过抽滤所得的滤液中含有plp和thf,且均保持较高的活性,能够实现重复利用,可再次作为反应原料投入到酶促反应体系参与下一轮的酶促转化反应,如此,通过酶促转化反应中的酶及辅助因子的重复利用,大大降低了酶促转化制取l-丝氨酸的生产成本,且l-丝氨酸的得率也能保持在85%以上。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅为本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
图1为本发明提供的l-丝氨酸的制备方法的一实施例的流程示意图。
本发明目的的实现、功能特点及优点将结合实施例,参照附图做进一步说明。
具体实施方式
为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
在现有通过酶促转化法制备l-丝氨酸的工艺中,一般需要在酶促反应工艺完成后对酶促反应体系中的细胞碎片沉淀分离,所得液体经717阴离子树脂柱洗脱,将产物l-丝氨酸与甘氨酸分离。但是,在717阴离子过柱时,虽然产物得到了纯化,同时shmt及辅酶因子也在分离过程中丢失,未能重复利用。而在制备l-丝氨酸的成本中,酶、辅酶及thf是成本组成的重要部分,因此,如果能将这些成分的重复利用,能大大降低l-丝氨酸的生产成本。
鉴于此,本发明提出一种l-丝氨酸的制备方法,通过向酶促反应平衡体系中加入维生素c的方式,有利于plp和thf保持活性,从而实现plp和thf的重复利用,图1所示为本发明提供的l-丝氨酸的制备方法的一实施例。请参阅图1,在本实施例中,所述l-丝氨酸的制备方法包括以下步骤:
步骤s10、将发酵菌体重悬于去离子水中,加入ctab使细胞破碎,得细胞破碎液;
ctab是指十六烷基三甲基溴化铵,可溶解细胞膜,常用作化学法破碎细胞的化学试剂,在采用ctab破碎细胞时,具体操作步骤包括:
步骤s11、将发酵菌体重悬于去离子水中,得菌悬液;
步骤s12、向所述菌悬液中加入ctab破碎细胞,待细胞破碎后用陶瓷膜过滤去除菌体,并收集滤液,得细胞破碎液。
先将发酵菌体重悬于适量的去离子水中形成菌悬液,然后再向所述菌悬液中加入一定量的ctab破碎细胞,在此过程中可以通过适当搅拌或振荡的方式来促进细胞破碎,待细胞破碎后,选用陶瓷膜对细胞液进行过滤,去除菌体并收集滤液,即得细胞破碎液。其中,在配制所述菌悬液时,优选为所述发酵菌体与去离子水的添加比例为(28~35)kg:400l,也即,所述菌悬液中发酵菌体的浓度为0.07~0.09kg/l,在此比例下,所述发酵菌体能够均匀分散在去离子水中,且在经过细胞破碎处理后,细胞碎片也能均匀分散不团聚,形成浓度适中的细胞破碎液。进一步地,在选用ctab破碎细胞时,其添加量要适宜,既要能够实现有效破碎细胞,又要避免添加量过多导致影响后续酶促反应过程中酶的活性,在本实施例中,所述ctab的添加量优选为在所述菌悬液中的最终质量浓度为0.05~0.2%,即可将按照上述浓度比例配制的菌悬液中的细胞有效破碎,且能尽量减少对酶活性的影响。
步骤s20、向所述细胞破碎液中加入甘氨酸、plp、thf和甲醛进行酶促转化反应,待达到酶促反应平衡后,向酶促反应平衡液中加入维生素c混合,得酶促反应液;
通过向所述酶促反应平衡体系中加入维生素c,使整个酶促体系保持在还原性的微环境中,从而有利于plp和thf保持活性,较佳地,在本实施例中,所述维生素c在所述酶促反应平衡液中的添加浓度为0.15~0.35g/l。
在本实施例中,所述酶促反应体系中各组分的配制比例为:所述甘氨酸、5-磷酸吡哆醛、四氢叶酸和甲醛的浓度对应为2~2.8mol/l、0.2~0.4mmol/l、3~5mmol/l和8~13mmol/l,且所述酶促反应体系的ph值为6.0~8.0。进一步地,所述酶促反应的温度条件为35~40℃,在此温度条件下反应至酶促反应平衡,大约需要18~24h,酶促转化完全,得到生成有l-丝氨酸的酶促反应平衡液;较佳地,在所述酶促反应过程中还可以通过例如机械搅拌、磁力搅拌等方式使反应物充分接触进而促进反应的进行,在本实施例中优选为机械搅拌,且搅拌速率设置为100~150rpm。
步骤s30、对所述酶促反应液进行减压浓缩,得浓缩液;
相比于通过酶促转化法制备l-丝氨酸的工艺中,通过717阴离子树脂柱从酶促反应液中分离出l-丝氨酸产物的方法,本发明中采用对所述酶促反应液进行减压浓缩后抽滤的方式,对酶促反应液中生成的l-丝氨酸进行分离,能有效避免plp和thf在产物分离过程中造成的损失。
具体地,在本实施例中,对所述酶促反应液进行减压浓缩时,优选为将所述酶促反应液减压浓缩至浓缩后的体积为原体积的1/6~1/7为止,得浓缩液。较佳地,为了进一步保证plp和thf的活性,本实施例中所述的减压浓缩优选为在37~40℃的低温条件下进行,且减压浓缩时的压力为-0.09~-0.08mpa,如此,在经过所述减压浓缩处理后的浓缩液中,plp和thf仍然能够保持较高的活性,有利于plp和thf的重复利用。
步骤s40、对所述浓缩液进行抽滤,获得l-丝氨酸晶体以及含有plp和thf的抽滤液,所述抽滤液用以参与下一轮的酶促反应。
在通过减压浓缩制得所述浓缩液后,再通过抽滤的方式分离出其中的l-丝氨酸产物,工艺简便易行,且分离效率较高。在本实施例中,进行所述抽滤时的抽滤压力为-0.05~-0.04mpa,抽滤时间为6~8h,且过滤膜为陶瓷膜,抽滤完毕后分别收集滤出晶体和抽滤液,所述滤出晶体即为l-丝氨酸产物,得率约为90%,可通过干燥等处理获得l-丝氨酸,所述抽滤液中含有plp和thf,且均保持较高的活性,可直接将所述抽滤液作为酶促反应的反应物添加到酶促反应体系中,参与下一轮的酶促转化反应。
本发明提供的技术方案中,通过向酶促反应平衡体系中加入一定量的维生素c,使得整个酶促体系保持还原性的微环境,有利于plp和thf保持活性;然后将添加有维生素c的酶促反应液进行低温减压浓缩后抽滤,分离出l-丝氨酸产物的同时,经过抽滤所得的滤液中含有plp和thf,且依然保持较高的活性,能够实现重复利用,可再次作为反应原料投入到酶促反应体系参与下一轮的酶促转化反应,如此,通过酶促转化反应中的酶及辅助因子的重复利用,大大降低了酶促转化制取l-丝氨酸的生产成本,成本节约45%以上,且相比于现有技术使用树脂柱分离l-丝氨酸产物的方式而言,有效缩短了生产周期,l-丝氨酸的得率也能保持在85%以上。
所述抽滤液在重复利用时,可利用2~4次,且在重复利用2~3次的过程中,由于所述抽滤液中不仅含有plp和thf,还含有菌体的破碎细胞,因此此时可以直接将上述实施例中得到的抽滤液转入到酶促转化反应釜中,然后按照上述设定的浓度向抽滤液中加入甘氨酸和甲醛,不需要添加菌体、plp和thf,调节ph值为6.0~8.0,在同样的反应条件下进行酶促转化反应至酶促反应平衡,再次减压浓缩并抽滤,对应获得l-丝氨酸产物和抽滤液,实现抽滤液重复利用1次;同样地,此时所得抽滤液可直接再次转入到酶促转化反应釜中,补充甘氨酸和甲醛后进行酶促转化反应,至酶促反应平衡后经过减压浓缩和抽滤处理后,再次获得l-丝氨酸和抽滤液,实现抽滤液重复利用2次;此时所得抽滤液可直接再一次转入到酶促转化反应釜中,补充甘氨酸和甲醛后进行酶促转化反应,至酶促反应平衡后经过减压浓缩和抽滤处理后,再次获得l-丝氨酸和抽滤液,实现抽滤液重复利用3次。在进行第4次重复利用时,除向酶促反应体系中添加甘氨酸和甲醛外,还需要适量补充plp、thf和菌体,具体可按照第一次酶促反应体系投加量的30%补充细胞破碎液,按照第一次酶促反应体系投加量的60%补充plp和thf,在同样的反应条件下进行酶促转化反应至酶促反应平衡,并再次减压浓缩、抽滤,此时得到的抽滤液不载重复利用,而是使用717树脂柱分离出l-丝氨酸产物,其中使用717树脂柱过柱分离l-丝氨酸的具体操作步骤可参考现有技术,在此不做赘述。
以下结合具体实施例和附图对本发明的技术方案作进一步详细说明,应当理解,以下实施例仅仅用以解释本发明,并不用于限定本发明。
实施例1
(1)将30kg发酵菌体重悬于去离子水中,使总体积为400l,然后加入ctab至终浓度为0.1%,待细胞破碎后用陶瓷过滤去除菌体,得细胞破碎液;
(2)将细胞破碎液转入酶促反应釜中,并加入甘氨酸、plp、thf和甲醛配制成600l的酶促反应体系,其中甘氨酸、plp、thf和甲醛的浓度对应为2.4mol/l、0.3mmol/l、4mmol/l和10mmol/l,且调节所述酶促反应体系的ph值为7.0,在搅拌速率120rpm、反应温度37℃的条件下反应20h,至酶促反应平衡,得酶促反应平衡液;
(3)向酶促反应平衡液中加入0.15kg的维生素c混匀,得酶促反应液;
(4)将酶促反应液在温度38℃、压力-0.09mpa的条件下,减压浓缩至原体积的1/6,得浓缩液;
(5)将浓缩液在0.04mpa原料条件下抽滤7h,分别收集滤出晶体和抽滤液,得到的滤出晶体即为l-丝氨酸晶体。
测得l-丝氨酸的得率为87.4%,纯度99.5%。
实施例2
(1)将28kg发酵菌体重悬于去离子水中,使总体积为400l,然后加入ctab至终浓度为0.05%,待细胞破碎后用陶瓷过滤去除菌体,得细胞破碎液;
(2)将细胞破碎液转入酶促反应釜中,并加入甘氨酸、plp、thf和甲醛配制成600l的酶促反应体系,其中甘氨酸、plp、thf和甲醛的浓度对应为2mol/l、0.2mmol/l、3mmol/l和8mmol/l,且调节所述酶促反应体系的ph值为6.0,在搅拌速率150rpm、反应温度35℃的条件下反应24h,至酶促反应平衡,得酶促反应平衡液;
(3)向酶促反应平衡液中加入0.1kg的维生素c混匀,得酶促反应液;
(4)将酶促反应液在温度37℃、压力-0.08mpa的条件下,减压浓缩至原体积的1/7,得浓缩液;
(5)将浓缩液在-0.05mpa原料条件下抽滤6h,分别收集滤出晶体和抽滤液,得到的滤出晶体即为l-丝氨酸晶体。
测得l-丝氨酸的得率为87.4%,纯度99.5%。
实施例3
(1)将35kg发酵菌体重悬于去离子水中,使总体积为400l,然后加入ctab至终浓度为0.2%,待细胞破碎后用陶瓷过滤去除菌体,得细胞破碎液;
(3)将细胞破碎液转入酶促反应釜中,并加入甘氨酸、plp、thf和甲醛配制成600l的酶促反应体系,其中甘氨酸、plp、thf和甲醛的浓度对应为2.8mol/l、0.4mmol/l、5mmol/l和13mmol/l,且调节所述酶促反应体系的ph值为8.0,在搅拌速率150rpm、反应温度40℃的条件下反应18h,至酶促反应平衡,得酶促反应平衡液;
(3)向酶促反应平衡液中加入0.2kg的维生素c混匀,得酶促反应液;
(4)将酶促反应液在温度40℃、压力-0.09mpa的条件下,减压浓缩至原体积的1/6,得浓缩液;
(5)将浓缩液在-0.05mpa原料条件下抽滤8h,分别收集滤出晶体和抽滤液,得到的滤出晶体即为l-丝氨酸晶体。
测得l-丝氨酸的得率为87.4%,纯度99.5%。
实施例4
(1)将实施例1中步骤(5)得到的抽滤液转入酶促反应釜中,并加入甘氨酸和甲醛配制成600l的酶促反应体系(不需要添加细胞破碎液、plp和thf),其中甘氨酸和甲醛的浓度对应为2.4mol/l和10mmol/l,且调节所述酶促反应体系的ph值为7.0,在搅拌速率120rpm、反应温度37℃的条件下反应20h,至酶促反应平衡,得酶促反应平衡液;
(2)向酶促反应平衡液中加入0.15kg的维生素c混匀,得酶促反应液;
(3)将酶促反应液在温度38℃、压力-0.09mpa的条件下,减压浓缩至原体积的1/6,得浓缩液;
(4)将浓缩液在0.04mpa原料条件下抽滤7h,分别收集滤出晶体和抽滤液,得到的滤出晶体即为l-丝氨酸晶体。
测得l-丝氨酸的得率为86.9%,纯度99.2%。
实施例5
(1)将实施例4中步骤(4)得到的抽滤液转入酶促反应釜中,并加入甘氨酸和甲醛配制成600l的酶促反应体系(不需要添加细胞破碎液、plp和thf),其中甘氨酸和甲醛的浓度对应为2.4mol/l和10mmol/l,且调节所述酶促反应体系的ph值为7.0,在搅拌速率120rpm、反应温度37℃的条件下反应20h,至酶促反应平衡,得酶促反应平衡液;
(2)向酶促反应平衡液中加入0.15kg的维生素c混匀,得酶促反应液;
(3)将酶促反应液在温度38℃、压力-0.09mpa的条件下,减压浓缩至原体积的1/6,得浓缩液;
(4)将浓缩液在0.04mpa原料条件下抽滤7h,分别收集滤出晶体和抽滤液,得到的滤出晶体即为l-丝氨酸晶体。
测得l-丝氨酸的得率为86.6%,纯度99.2%。
实施例6
(1)将实施例5中步骤(4)得到的抽滤液转入酶促反应釜中,并加入甘氨酸和甲醛配制成600l的酶促反应体系(不需要添加细胞破碎液、plp和thf),其中甘氨酸和甲醛的浓度对应为2.4mol/l和10mmol/l,且调节所述酶促反应体系的ph值为7.0,在搅拌速率120rpm、反应温度37℃的条件下反应20h,至酶促反应平衡,得酶促反应平衡液;
(2)向酶促反应平衡液中加入0.15kg的维生素c混匀,得酶促反应液;
(3)将酶促反应液在温度38℃、压力-0.09mpa的条件下,减压浓缩至原体积的1/6,得浓缩液;
(4)将浓缩液在0.04mpa原料条件下抽滤7h,分别收集滤出晶体和抽滤液,得到的滤出晶体即为l-丝氨酸晶体。
测得l-丝氨酸的得率为86.4%,纯度99.2%。
实施例7
(1)将实施例6中步骤(4)得到的抽滤液转入酶促反应釜中,并加入细胞破碎液、甘氨酸、plp、thf和甲醛配制成600l的酶促反应体系,其中甘氨酸和甲醛的浓度对应为2.4mol/l和10mmol/l,细胞破碎液的添加量为实施例1中的30%,plp和thf的添加量为实施例1中的60%,调节所述酶促反应体系的ph值为7.0,在搅拌速率120rpm、反应温度37℃的条件下反应20h,至酶促反应平衡,得酶促反应平衡液;
(2)向酶促反应平衡液中加入0.15kg的维生素c混匀,得酶促反应液;
(3)将酶促反应液在温度38℃、压力-0.09mpa的条件下,减压浓缩至原体积的1/6,得浓缩液;
(4)将浓缩液在0.04mpa原料条件下抽滤7h,分别收集滤出晶体和抽滤液,得到的滤出晶体即为l-丝氨酸晶体,此时获得的抽滤液不再作为酶促反应的反应原料重复利用,而是使用717树枝状上柱分离,收集含有l-丝氨酸的分离液。
测得l-丝氨酸的得率为86.1%,纯度99.0%。
对比例1
(1)将30kg发酵菌体重悬于去离子水中,使总体积为400l,然后加入ctab至终浓度为0.1%,待细胞破碎后用陶瓷过滤去除菌体,得细胞破碎液;
(2)将细胞破碎液转入酶促反应釜中,并加入甘氨酸、plp、thf和甲醛配制成600l的酶促反应体系,其中甘氨酸、plp、thf和甲醛的浓度对应为2.4mol/l、0.3mmol/l、4mmol/l和10mmol/l,且调节所述酶促反应体系的ph值为7.0,在搅拌速率120rpm、反应温度37℃的条件下反应20h,至酶促反应平衡,得酶促反应平衡液;
(3)将酶促反应平衡液使用717树脂柱过柱分离12h,收集含有有l-丝氨酸的分离液,得l-丝氨酸产物。
测得l-丝氨酸的得率为89%,纯度99.3%。
相比于对比例1中采用717树脂柱过柱分离出酶促反应产物中的l-丝氨酸的方法,本发明实施例中提供的l-丝氨酸的制备方法,在保证l-丝氨酸得率和纯度没有出现明显下降的同时,实现了酶促反应原料中plp和thf的重复利用,有利于降低l-丝氨酸的生产成本,且使用回收再利用的plp和thf通过酶促反应制取l-丝氨酸时,基本不会影响l-丝氨酸的得率和纯度。
以上仅为本发明的优选实施例,并非因此限制本发明的专利范围,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包括在本发明的专利保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!