一种传统固态食醋定向风味调控发酵技术及其应用的制作方法
技术领域:
本发明属于食品发酵技术领域,尤其涉及一种传统固态发酵食醋定向风味调控发酵技术及其应用。
背景技术:
我国传统食醋主要以粮食及其副产品为原辅料,采用自然发酵的工艺生产。传统食醋发酵过程中存在着复杂的微生物群落,它们能够产生丰富的代谢产物,如有机酸、还原糖、氨基酸、酯类、醇类、酚类、芳香类、醛类等物质。这些物质赋予了食醋独特的口感和风味。有机酸是食醋酸味的主要来源,对食醋的风味品质起到重要的作用。以醋酸为主的挥发酸构成了食醋的香气中心,使醋具有爽口、刺激性酸味,乳酸等不挥发酸的存在能够调和酸味,使食醋酸味柔和,回味绵长。食醋中的糖类、氨基酸、酯类等风味物质在恰当的比例下,能赋予食醋独特的风味。食醋发酵过程中风味成分的分析研究,不仅有助于进一步阐明食醋酿造机理,并为进一步改善产品提供参考。
我国传统食醋风味物质的生成与其中微生物的代谢作用密切相关,微生物通过直接或间接(产生相关酶系)的代谢方式,将原料中的营养物质不断降解为小分子物质。食醋发酵过程中主要包括醋酸菌、乳酸菌、芽孢菌等细菌以及霉菌、酵母菌等真菌。食醋固态发酵过程微生物群落的演替消长直接影响到风味物质的生成和消耗。但是现阶段传统食醋固态发酵工艺一般依靠经验进行控制,使得产品质量不稳定,生产难以有效控制和定向改变。主要原因在于对发酵过程微生物的组成及其功能认识不够深入,缺乏理性的发酵工程控制技术。
本发明以山西老陈醋传统发酵工艺为分析对象,山西老陈醋发酵阶段分为酒精发酵和醋酸发酵,其中酒精发酵13天,醋酸发酵9天,共计22天。本发明对发酵过程微生物功能这一核心问题进行分析,解析发酵过程中主要微生物的功能,针对性地选择功能性微生物。在此基础上,根据风味物质与微生物之间的pearson相关性模型确定强化功能微生物,根据风味物质与微生物之间的典范对应相关性模型确定强化微生物的强化时间,通过风味物质与功能微生物间的线性回归模型确定强化微生物的添加量,定向调控发酵过程风味物质的生成,从而提高发酵效率,改善产品品质。
技术实现要素:
本发明的目的在于解决上述现有传统食醋固态酿造技术的不足,提供一种定向调控发酵的技术。本发明所提供的定向调控技术是通过微生物组成分析、风味物质分析、相关性分析和回归分析等方法,建立风味物质与发酵过程主要微生物之间的直接联系,以此指导优良菌种的定向选育及应用,建立传统食醋定向风味调控发酵技术,以定向、定量的改变食醋中风味物质的含量。该技术用于传统食醋固态发酵,可改善产品风味、提高发酵效率和提高原料利用率。
本发明技术方案如下:
一种食醋定向风味调控发酵技术,包括:
(1)分析测定食醋酒精发酵和醋酸发酵等阶段风味物质的组成和含量;
(2)对发酵食醋酒精发酵和醋酸发酵等阶段中的细菌和真菌群落的组成和演替进行分析,分析不同发酵阶段起主要作用的功能微生物;
(3)建立步骤(1)风味物质与步骤(2)微生物之间pearson相关性模型、典范对应相关性模型和回归模型;
(4)根据步骤(3)的分析结果以特定的培养基筛选特定风味物质相对应的特定微生物菌株,并制成微生物强化菌剂;
(5)强化微生物发酵工艺:根据pearson相关性分析、典范对应相关性分析和线性回归方程的分析结果,在食醋发酵的不同时期定量的加入对应的步骤(4)中的微生物,以定向提高风味物质的含量,提高发酵效率。
进一步地,步骤(1)所述的风味物质包括但不限于酚类、酯类、乙酸、乳酸、氨基酸、还原糖等物质;
进一步地,步骤(2)所述分析的方法包括但不限于宏基因组学高通量测序等分子生态学技术,结合主成分分析(principalcomponentanalysis,pca)等统计学分析方法;
进一步地,步骤(3)中通过pearson相关性分析确定强化用微生物,通过典范对应相关性分析确定强化微生物的强化时间,通过风味物质与强化微生物间的回归方程确定强化微生物的强化量;
进一步地,步骤(4)筛选微生物所采用的培养基是以大曲、酒醪、醋醅为主成分作为主要功能微生物的筛选培养基,分别将大曲、酒醪、醋醅彻底粉碎后加10倍质量的去离子水常温下浸泡4h,取浸提液灭菌,三者浸提液比例为1:4:5,调节还原糖、乙醇、乙酸、乳酸浓度分别为为1-1.5g/100ml、5-5.5g/100ml、0.1-0.5g/100ml和2-2.5g/100ml,固体形态培养基加2.5%琼脂,作为霉菌、酵母、芽孢、醋酸菌、乳酸菌等主要功能微生物筛选培养基;
进一步地,步骤(4)所述生物强化菌剂的制备方法为:将筛选得到的微生物以0.5%-10%的接种量接入上述培养基中,在微生物的最适生长环境下培养,其中,霉菌、酵母、芽孢、醋酸菌、乳酸菌的最适生长温度分别为20-30℃、20-30℃、30-37℃、30-35℃和35-45℃。离心收集微生物菌体,将以50-60g/l乳糖和100-120g/l麦芽糊精制成的保护剂与微生物菌体质量(离心收集的微生物菌体,g)以15:1的比例均匀混合,然后利用喷雾冷冻干燥制得菌剂。
有益效果:
(1)微生物强化技术在传统食醋发酵领域的应用还处于起步阶段,本发明对食醋发酵过程中主要酿造微生物的功能进行理性分析,根据食醋品质改良需求,针对性地制定强化方案。通过pearson相关性分析、典范对应相关性分析、回归分析等确定发酵过程的强化微生物、强化时间和强化量,是一项理性的强化发酵技术。
(2)在优良功能微生物的筛选过程中,本发明使用以大曲、酒醪、醋醅为基础的特定筛选培养基,还原所筛选功能微生物的功能微生物生长环境,克服了传统组成培养基或半组成培养基不适合所筛选功能微生物生长的缺点。
(3)传统食醋采用固态发酵技术进行生产,仅通过表观指标进行调控。本分明在理性分析发酵过程风味物质与微生物的直接联系,通过微生物强化发酵定向的调控食醋风味物质,改善食醋风味。
(4)理性的调控发明技术能够有效解决产品质量不稳定,生产难以有效控制和定向改变等传统食醋面临的难题,对提高发酵效率和原料利用率有重要意义。
附图说明:
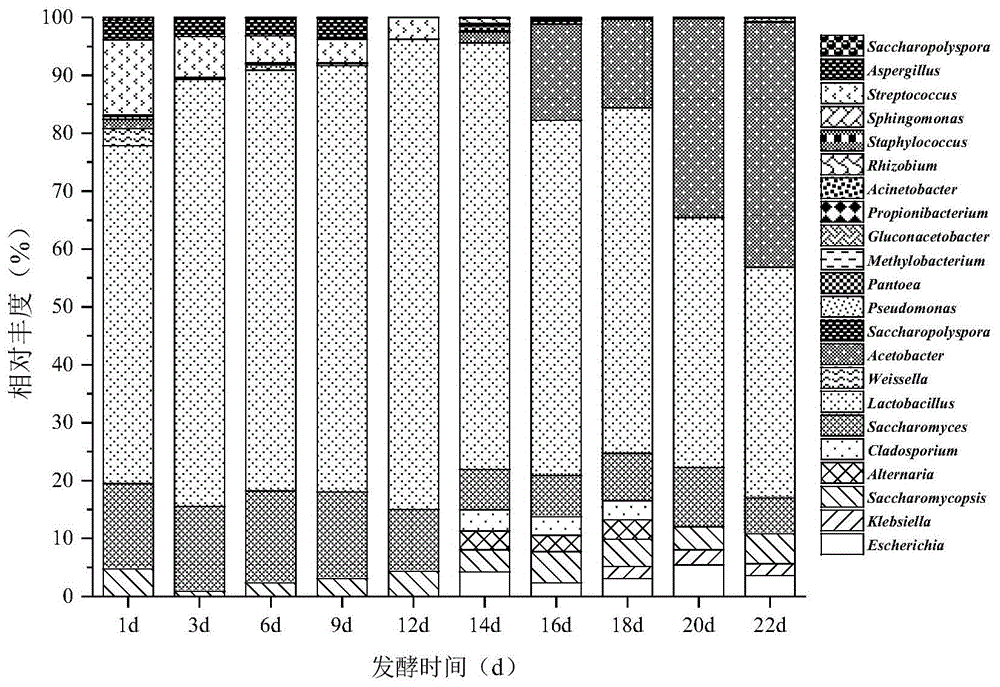
图1食醋发酵过程中微生物相对丰度变化;
图2食醋发酵过程中酚类物质含量;
图3食醋发酵过程中酚类物质与功能微生物间pearson相关性分析;
图4食醋发酵过程中酚类物质与功能微生物间典范对应相关性分析;
图5食醋发酵过程中酯类物质含量变化;
图6食醋发酵过程中酯类物质与功能微生物间pearson相关性分析;
图7食醋发酵过程中酯类物质与功能微生物间典范对应相关性分析;
图8食醋发酵过程中乙酸含量变化;
图9食醋发酵过程中乙酸与功能微生物间pearson相关性分析;
图10食醋发酵过程中乙酸与主要功能微生物间典范对应相关性分析;
图11食醋发酵过程中乳酸含量变化;
图12食醋发酵过程中乳酸与功能微生物间pearson相关性分析;
图13食醋发酵过程中乳酸与功能微生物间典范对应相关性分析;
图14食醋发酵过程中酯类、酚类含量变化;
图15食醋发酵过程中酯类、酚类物质与功能微生物间pearson相关性分析;
图16食醋发酵过程中酯类、酚类物质与功能微生物间典范对应相关性分析;
图17食醋发酵过程中乙酸、乳酸含量变化;
图18食醋发酵过程中乙酸、乳酸与功能微生物间pearson相关性分析;
图19食醋发酵过程中乙酸、乳素与功能微生物间典范对应相关性分析;
具体实施方式:
下面通过具体的实施方案叙述本发明。除非特别说明,本发明中所用的技术手段均为本领域技术人员所公知的方法。另外,实施方案应理解为说明性的,而非限制本发明的范围,本发明的实质和范围仅由权利要求书所限定。对于本领域技术人员而言,在不背离本发明实质和范围的前提下,对这些实施方案中的物料成分和用量进行的各种改变或改动也属于本发明的保护范围。
实施例中涉及到的百分号“%”,若未特别说明,固体指质量百分比,溶液的百分比指100ml中含有溶质的克数,液体之间的百分比,是指在25℃时溶液的体积比例。
本发明所述的食醋定向风味调控技术具体实时路线如下:
(1)食醋发酵过程主要风味物质的检测
采用高效液相色谱(highperformanceliquidchromatography,hplc)、顶空固相微萃取气相-质谱联用技术(headspacesolidphasemicroextractionbygas-massspectrometry,hs-spme-gc-ms)以及气质联用(gaschromatographymassspectrometry,gc-ms)等方法分析传统食醋酒精发酵和醋酸发酵等阶段挥发性风味物质和不挥发性风味物质的组成和含量。
(2)传统食醋发酵过程微生物的检测
采用宏基因组学高通量测序等分子生态学技术,结合主成分分析(principalcomponentanalysis,pca)等统计学分析方法对传统固态发酵食醋酒精发酵和醋酸发酵等阶段中的细菌和真菌群落的组成和演替进行分析,分析不同发酵阶段起主要作用的功能微生物。
(3)建立风味物质与微生物之间pearson相关性模型、典范对应相关性模型和回归模型。通过pearson相关性分析、典范对应相关性分析(canonicalcorrespondenceanalysis,cca)的方法分析传统食醋发酵过程中主要风味物质变化和微生物群落演替的直接关系,建立风味物质与发酵过程中主要微生物之间的相关系数模型和典范对应相关性模型,以确定酿造过程中的强化微生物和其强化节点。以主要功能微生物为自变量,风味物质为因变量建立线性回归模型,确定酿造过程中主要功能微生物的强化量。
(4)优良功能微生物的筛选和发酵菌剂的制备
根据风味物质与功能微生物发酵过程模型,合理设计微生物筛选条件,以特定的筛选培养基为基础,从大曲、酒醪、醋醅等样品中纯化获得食醋酿造微生物功能菌株。将微生物活化培养后加入由50-60g/l乳糖和100-120g/l麦芽糊精制成的保护剂,采用喷雾冷冻干燥法制备菌剂。
(5)微生物强化发酵工艺
根据pearson相关性分析、典范对应相关性分析和线性回归方程的分析结果,将从食醋酿造过程获得的功能微生物菌株制作成菌剂,在食醋发酵的不同时期定量的加入到传统食醋发酵过程,以定向的提高风味物质的含量,提高发酵效率。
在本发明的一些实施例中,食醋发酵过程风味物质的检测采用如下方法:
①主要理化指标和有机酸的检测:取5g样品(大曲、酒醪、醋醅等),加去离子水45ml,浸提、过滤、离心取上清液,再经0.22μm水系膜过滤后,进行hplc分析检测有机酸。hplc检测条件如下:色谱柱:aminexhpx-87h离子交换柱;流动相:0.005mmol/lh2so4;流速:0.6ml/min;进样量:20μl;紫外检测器波长:215nm;柱温:30℃。总酸、氨基酸态氮和还原糖等参照国标gb19461-2004中规定的方法进行测定。
②挥发性风味物质检测:取2g样品加水、nacl和2-辛醇(内标)按gc-ms分析方法分析:250℃解吸5min后,运行仪器,升温程序为:35℃维持1min后,以1℃/min速率升温至70℃后,维持2min;再以5℃/min速率升温至230min,维持2min;之后以15℃/min速率升温至280℃,维持1min。其他参数:进样口温度为250℃,隔垫吹扫流量为3ml/min,模式为不分流,氦载气流速为1ml/min,色谱柱为agilenthp-5毛细管柱。ms扫描范围为30-600。质谱检测(detector)温度为220℃,电离方式ei,电子能量70ev,捕获方式为全扫描(fullscan,从40到500m/z)。
③不挥发性风味物质检测:将样品用不同的方法进行衍生化,再由gc-ms法进行进样分析。采用的衍生化的方法主要包括通用衍生化,有机酸衍生化,糖及糖的衍生化。gc-ms分析方法为:采用agilenthp-5毛细管柱(30m×250μm×0.25μm),氦载气流速0.8ml/min,进样口温度250℃,分流比10:1,柱温起始温度50℃维持2min,以4℃/min速率增加至150℃,维持5min,之后以2℃/min速率升温至220℃并维持3min,然后以3℃/min速率升温至280℃并保持4min,质谱检测(detector)温度为220℃,电离方式ei,电子能量70ev。进样量为1μl。定性定量方法:检测出的物质根据质谱、保留指数,通过nist谱库和人工解谱的方法进行定性(匹配度大于80%),风味组成的相对含量以内标峰面积为准,所有物质的含量换算成相对含量。
在本发明的一些实施例中,食醋发酵过程微生物的检测可以采用如下方法:
取2g样品(大曲、酒醪、醋醅等)置于无菌研钵中,采用液氮研磨、溶菌酶处理、氯仿-异戊醇抽提、乙醇洗涤、rnaase酶消化等步骤提取基因组dna,送至公司进行宏基因组高通量测序,得到传统食醋发酵过程微生物组成。
本发明通过风味物质与功能微生物之间pearson相关性模型、典范对应相关性模型和线性回归模型的建立,以确定食醋发酵强化微生物、强化时间和强化量;
通过pearson相关性分析确定强化用微生物,通过典范对应相关性分析确定强化微生物的强化时间,通过风味物质与强化微生物间的回归方程确定强化微生物的强化量。以双尾检验作为显著性的检验方法,进行传统食醋发酵过程风味物质和主要功能微生物之间的pearson相关性分析,分析相应风味物质与主要功能微生物种群的相关性大小,选择与风味物质相关性最大的功能微生物作为强化菌株(确定强化菌株)。建立传统食醋发酵过程中风味物质含量变化与主要功能微生物群落演替之间的典范对应相关性模型,分析风味物质与强化微生物间的典范对应相关性,选择与强化微生物相关性最大样品的发酵时间作为该微生物的强化时间(确定强化时间)。以强化功能微生物为自变量、风味物质为因变量建立食醋发酵的线性回归方程,根据将目标提高量代入回归方程确定强化微生物的强化量(确定强化量)。确定食醋发酵过程中强化微生物、强化时间及强化量,并以此指导功能微生物的筛选和传统食醋发酵工艺的优化;
其中,确定强化菌株组成、添加时间及强化量的详细过程如下:
以双尾检验作为显著性的检验方法,进行传统食醋发酵过程风味物质和主要功能微生物之间的pearson相关性分析,分析相应风味物质与主要功能微生物种群的相关性大小,选择与风味物质相关性最大的功能微生物作为强化菌株(确定强化菌株)。建立传统食醋发酵过程中风味物质含量变化与主要功能微生物群落演替之间的典范对应相关性模型,分析风味物质与强化微生物间的典范对应相关性,选择与强化微生物相关性最大样品的发酵时间作为该微生物的强化时间(确定强化时间)。以强化功能微生物为自变量、风味物质为因变量建立食醋发酵的线性回归方程,根据将目标提高量代入回归方程确定强化微生物的强化量(确定强化量)。
在本发明的一些实施例中,功能微生物的筛选方法如下:
以大曲、酒醪、醋醅为主成分作为主要功能微生物的筛选培养基。分别将食醋生产过程中的大曲、酒醪、醋醅彻底粉碎后加10倍质量的去离子水常温下浸泡4h,取浸提液灭菌,三者浸提液比例为1:4:5,调整还原糖、乙醇、乙酸、乳酸浓度为分别为为1-1.5g/100ml、5-5.5g/100ml、0.1-0.5g/100ml和2-2.5g/100ml,固体形态培养基加2.5%琼脂。作为霉菌、酵母、芽孢、醋酸菌、乳酸菌等主要功能微生物筛选培养基。以大曲、酒醪、醋醅等作为筛选样品,筛选样品中霉菌、酵母、芽孢、醋酸菌、乳酸菌等微生物,挑选生长较快,菌落较大,分布密度较广但菌落形态不同的50-60株菌落,纯化后保存。对上述筛选获得的纯培养微生物进行测序,同一属的微生物进行发酵和耐受性(如耐酸、耐醇、耐温等)比较,选择发酵和耐受性能较好的微生物作为同属的优势微生物。若本步骤未获得优势微生物,则按照功能性微生物筛选方法进行重复筛选和鉴定。
在本发明的一些实施例中,食醋发酵过程的优化过程如下:
根据传统食醋发酵过程风味物质与微生物群落的pearson相关性分析模型、典范对应相关性模型和线性回归方程的分析结果,优化传统食醋的发酵过程,将从大曲、酒醪、醋醅等样品中筛选出的特定功能微生物菌株制作成菌剂,在传统食醋的不同发酵阶段定量的加入到传统食醋发酵过程,达到定向调控某风味物质含量、提高发酵效率的目的。
以下将通过具体实施例并结合附图对本发明做进一步地解释说明,通过对传统固态食醋样品进行分析,并采用本发明所述方法进行定向风味调控发酵:
实施例1:定向调控食醋中酚类含量
(1)食醋发酵过程中酚类含量的测定:
采用gc-ms的方法测定食醋发酵过程中酚类物质含量。具体测定条件和方法如前所述挥发性风味物质的检测。酚类物质含量变化如图2所示,酚类物质在食醋酒精发酵过程中呈逐渐下降的趋势,在醋酸发酵阶段呈现先上升后迅速下降的趋势。
(2)食醋发酵过程中主要微生物的测定:
采用宏基因组学高通量测序等分子生态学技术结合主成分分析等统计学分析方法,对食醋醋酸发酵阶段中的细菌和真菌群落的组成和演替进行分析。具体测定条件和方法如前述。对传统食醋发酵阶段微生物的组成和变化规律进行分析,结果如图1所示。乳酸菌和酿酒酵母菌是食醋酒精发酵过程最主要的微生物,醋酸菌和乳酸菌是食醋醋酸发酵过程的最主要微生物。酒精发酵阶段,酿酒酵母菌相对丰度基本保持不变,乳酸菌相对丰度则有略微的上升,随着醇度的升高,微生物多样性也迅速降低。醋酸发酵阶段,乳酸菌的相对丰度逐渐降低,醋酸菌的相对丰度则逐渐升高,随着酸度的增加,微生物多样性下降。虽然有些微生物在食醋发酵过程中的相对丰度较低,但是其对某些风味物质的影响作用是不可替代的。
(3)酚类物质与主要功能微生物间pearson相关性分析:
以双尾检验作为显著性的检验方法,对酚类物质与功能微生物之间的pearson相关性进行分析。结果如图3所,根据pearson相关性分析结果,与酚类物质含量相关性最大的微生物为streptococcus,相关性系数为0.957。选取相关性系数最高的streptococcus对酚类物质进行强化发酵。
(4)酚类与主要功能微生物间典范对应相关性分析:
用canoco5对酚类物质与强化微生物进行典范对应相关性分析,分析结果如图4所示。
根据酚类物质与主要功能微生物间的典范对应相关性分析,在酚类物质的变化过程中,streptococcus与食醋发酵第6天的样品有最大的相关性,因此确定在食醋发酵的第6天添加streptococcus菌剂。
(5)酚类物质线性回归方程的建立:
以强化微生物菌体cfu/g的log值为自变量,酚类物质含量为因变量建立食醋发酵过程中酚类物质的线性回归方程。
酚类(g/100g醋醅)=1.25*streptococcus–3.52
根据酚类物质streptococcus的回归方程,如果酚类物质要提高1g/100g醋醅,则需要在食醋发酵的第6天强化streptococcus至103.616cfu/g醋醅。
(6)优良功能微生物的筛选:
利用大曲、酒醪、醋醅筛选培养基(分别将大曲、酒醪、醋醅彻底粉碎后加10倍质量的去离子水常温下浸泡4h,取浸提液灭菌,三者浸提液比例为1:4:5,调整还原糖、乙醇、乙酸、乳酸浓度为分别为为1-1.5g/100ml、5-5.5g/100ml、0.1-0.5g/100ml和2-2.5g/100ml),以大曲、酒醪、醋醅等为筛选样品,筛选样品中streptococcus,挑选生长较快,菌落较大,分布密度较广但菌落形态不同的50-60株菌落,纯化后保存。对上述筛选获得的纯培养微生物进行测序,同一属的微生物进行发酵和耐受性能比较,选择发酵和耐受性能较好的微生物作为同属微生物的优势微生物。若本步骤未获得优势微生物,则按照功能性微生物筛选方法进行重复筛选和鉴定。
菌剂的制备方法为:将筛选得到的streptococcus微生物以1%的接种量接入上述筛选培养基中,在30℃,200rpm培养24h,离心收集微生物菌体,将以50g/l乳糖和100g/l麦芽糊精制成的保护剂与微生物菌体质量以15:1的比例均匀混合,然后利用喷雾冷冻干燥制得菌剂。
(7)功能微生物强化发酵:
streptococcus发酵菌剂应用于传统食醋酿造过程中对酚类物质进行强化,具体实验方案如下:在食醋发酵第6天进行菌剂的添加,实验设置添加菌剂的实验组,未添加菌剂的对照组。强化组每个发酵缸需要强化streptococcus至103.616cfu/g醋醅,发酵菌剂复水活化后添加,并搅拌均匀。发酵结束后强化结果如表1所示。
表1:微生物强化发酵试验中酚类物质强化结果
由表1可看出实验组和对照组相比酚类物质含量变化明显,说明在食醋发酵第6天添加streptococcus菌剂对食醋产品中酚类物质风味有较大的影响。酚类物质含量从2.15g/100g醋醅提高到3.17g/100g醋醅,提高了1.02g/100g醋醅,与预期提高量1g/100g醋醅相差2%,达到了预期目的。
实施例2:定向调控食醋中数据酯类含量
(1)食醋发酵过程中酯类含量的测定:
采用gc-ms的方法测定食醋发酵过程中酯类物质含量。具体测定条件和方法如前所述挥发性风味物质的检测。发酵过程中酯类含量变化如图5所示,酯类物质发酵过程中呈先上升后下降的趋势。
(2)食醋发酵过程中主要微生物的测定:
采用宏基因组学高通量测序等分子生态学技术结合主成分分析等统计学分析方法,对食醋醋酸发酵阶段中的细菌和真菌群落的组成和演替进行分析。具体测定条件和方法同上。对传统食醋发酵阶段微生物的组成和变化规律进行分析,结果如图1所示,乳酸菌和酿酒酵母菌是食醋酒精发酵过程最主要的微生物,醋酸菌和乳酸菌是食醋醋酸发酵过程的最主要微生物。酒精发酵阶段,酿酒酵母菌相对丰度基本保持不变,乳酸菌相对丰度则有略微的上升,随着醇度的升高,微生物多样性也迅速降低。醋酸发酵阶段,乳酸菌的相对丰度逐渐降低,醋酸菌的相对丰度则逐渐升高,随着酸度的增加,微生物多样性下降。虽然有些微生物在食醋发酵过程中的相对丰度较低,但是其对某些风味物质的影响作用是不可替代的。
(3)酯类物质与主要功能微生物间pearson相关性分析:
以双尾检验作为显著性的检验方法,对酯类物质与功能微生物之间的pearson相关性进行分析。结果如图6所示。根据pearson相关性分析结果,与酯类物质相关性最大的微生物为cladosporium,相关性系数为0.970。选取相关性系数最高的cladosporium对酯类进行强化发酵。
(4)酯类物质与主要功能微生物间典范对应相关性分析:
用canoco5对酯类物质与强化微生物进行典范对应相关性分析,分析结果如图7所示。
根据酯类物质与主要功能微生物间的典范对应相关性分析,在酯类物质的变化过程中,cladosporium与食醋发酵第16天的样品有最大的相关性,因此确定在食醋发酵的第16天添加cladosporium菌剂。
(5)酯类物质线性回归方程的建立:
以强化微生物菌体cfu/g的log值为自变量,酯类物质含量为因变量建立食醋发酵过程中酯类物质的线性回归方程。
酯类(g/100g醋醅)=2.75*cladosporium–9.07
根据酯类物质与cladosporium的相关性方程,如果酯类物质要提高3g/100g醋醅,每个发酵缸(上口径40cm、下口径25cm、高50cm)约有50kg醋醅,则需在食醋发酵的第16天强化cladosporium至104.39cfu/g醋醅。
(6)优良功能微生物的筛选:
利用大曲、酒醪、醋醅筛选培养基(同实施例1),以大曲、酒醪、醋醅等为筛选样品,筛选样品中cladosporium,挑选生长较快,菌落较大,分布密度较广但菌落形态不同的50-60株菌落,纯化后保存。对上述筛选获得的纯培养微生物进行测序,同一属的微生物进行发酵和耐受性能比较,选择发酵和耐受性能较好的微生物作为同属微生物的优势微生物。若本步骤未获得优势微生物,则按照功能性微生物筛选方法进行重复筛选和鉴定。
菌剂的制备方法为:将筛选得到的cladosporium微生物以1%的接种量接入上述筛选培养基中,在25℃、220rpm培养72h,离心收集微生物菌体,将以60g/l乳糖和90g/l麦芽糊精制成的保护剂与微生物菌体质量以15:1的比例均匀混合,然后利用喷雾冷冻干燥制得菌剂。
(7)功能微生物强化发酵:
cladosporium发酵菌剂应用于传统食醋酿造过程中对酯类物质进行强化,具体实验方案如下:在食醋发酵第16天进行菌剂的添加,实验设置添加菌剂的强化组,未添加菌剂的对照组。强化组每个发酵缸需要强化cladosporium至104.39cfu/g醋醅,发酵菌剂复水活化后添加,并搅拌均匀。强化结果如表2所示。
表2:微生物强化发酵试验中酯类物质强化结果
由表2可看出实验组和对照组相比酯类物质含量变化明显,说明在食醋发酵第16天添加cladosporium菌剂对食醋产品中酯类物质风味有较大的影响。酯类物质含量从12.19g/100g醋醅提高到15.21g/100g醋醅,提高了3.02g/100g醋醅,与预期提高量3g/100g醋醅相差0.7%,达到了预期目的。
实施例3:定向调控食醋中乙酸含量
(1)食醋发酵过程中乙酸含量的测定:
采用hplc的方法测定食醋发酵过程中乙酸含量。具体测定条件和方法如前所述风味物质的检测。乙酸含量变化如图8所示,乙酸含量在发酵过程呈增加的趋势,尤其是在醋酸发酵阶段,乙酸含量迅速升高。
(2)食醋发酵过程中主要微生物的测定:
采用宏基因组学高通量测序等分子生态学技术结合主成分分析等统计学分析方法,对食醋醋酸发酵阶段中的细菌和真菌群落的组成和演替进行分析。具体测定条件和方法同上。对传统食醋发酵阶段微生物的组成和变化规律进行分析,结果如图1所示。乳酸菌和酿酒酵母菌是食醋酒精发酵过程最主要的微生物,醋酸菌和乳酸菌是食醋醋酸发酵过程的最主要微生物。酒精发酵阶段,酿酒酵母菌相对丰度基本保持不变,乳酸菌相对丰度则有略微的上升,随着醇度的升高,微生物多样性也迅速降低。醋酸发酵阶段,乳酸菌的相对丰度逐渐降低,醋酸菌的相对丰度则逐渐升高,随着酸度的增加,微生物多样性下降。虽然有些微生物在食醋发酵过程中的相对丰度较低,但是其对某些风味物质的影响作用是不可替代的。
(3)乙酸与主要功能微生物间pearson相关性分析:
以双尾检验作为显著性的检验方法,对乙酸与功能微生物之间的pearson相关性进行分析。结果如图9所示,根据pearson相关性分析结果,与乙酸相关性最大的微生物为acetobacter,相关性系数为0.974。选取相关性系数最高的acetobacter对乙酸进行强化发酵。
(4)乙酸与主要功能微生物间典范对应相关性分析:
用canoco5对乙酸与强化微生物进行典范对应相关性分析,分析结果如图10所示。
根据乙酸与主要功能微生物间的典范对应相关性分析,在乙酸的变化过程中,acetobacter与食醋发酵第18天的样品有最大的相关性,因此确定在食醋发酵的第18天添加acetobacter菌剂。
(5)乙酸线性回归方程的建立:
以强化微生物菌体cfu/g的log值为自变量,乙酸含量为因变量建立食醋发酵过程中乙酸物质的线性回归方程。
乙酸(g/100g醋醅)=1.13*acetobacter–2.31
根据乙酸与acetobacter的相关性方程,如果乙酸要提高3g/100g醋醅,则需在食醋发酵的第18天强化acetobacter至104.699cfu/g醋醅。
(6)优良功能微生物的筛选:
利用大曲、酒醪、醋醅筛选培养基(同实施例1),以大曲、酒醪、醋醅等为筛选样品,筛选样品中acetobacter,挑选生长较快,菌落较大,分布密度较广但菌落形态不同的50-60株菌落,纯化后保存。对上述筛选获得的纯培养微生物进行测序,同一属的微生物进行发酵和耐受性能比较,选择发酵和耐受性能较好的微生物作为同属微生物的优势微生物。若本步骤未获得优势微生物,则按照功能性微生物筛选方法进行重复筛选和鉴定。
菌剂的制备方法为:将筛选得到的acetobacter微生物以2%的接种量接入上述筛选培养基中,在30℃、180rpm培养24h,离心收集微生物菌体,将以55g/l乳糖和100g/l麦芽糊精制成的保护剂与微生物菌体质量以15:1的比例均匀混合,然后利用喷雾冷冻干燥制得菌剂。
(7)功能微生物强化发酵:
acetobacter发酵菌剂应用于传统食醋酿造过程中对乙酸进行强化,具体实验方案如下:在食醋发酵第18天进行菌剂的添加,实验设置添加菌剂的强化组,未添加菌剂的对照组。强化组每个发酵缸强化acetobacter至104.699cfu/g醋醅,发酵菌剂复水活化后添加,并搅拌均匀。强化结果如表3所示。
表3:微生物强化发酵试验中乙酸强化结果
由表3可看出实验组和对照组相比乙酸含量变化明显,说明在食醋发酵第18天添加acetobacter菌剂对食醋产品中乙酸有较大的影响。乙酸含量从3.85g/100g醋醅提高到6.72g/100g醋醅,提高了2.87g/100g醋醅,与预期提高量3g/100g醋醅相差4.3%,达到了预期目的。
实施例4:定向调控食醋中乳酸含量
(1)食醋发酵过程中乳酸含量的测定:
采用hplc的方法测定食醋发酵过程中乳酸含量。具体测定条件和方法如前所述风味物质的检测。乳酸含量变化如图11所示,乳酸含量在酒精发酵阶段逐渐上升,进入醋酸发酵阶段后乳酸含量略微上升后呈下降趋势。
(2)食醋发酵过程中主要微生物的测定:
采用宏基因组学高通量测序等分子生态学技术结合主成分分析等统计学分析方法,对食醋醋酸发酵阶段中的细菌和真菌群落的组成和演替进行分析。具体测定条件和方法同上。对传统食醋发酵阶段微生物的组成和变化规律进行分析,结果如图1所示。乳酸菌和酿酒酵母菌是食醋酒精发酵过程最主要的微生物,醋酸菌和乳酸菌是食醋醋酸发酵过程的最主要微生物。酒精发酵阶段,酿酒酵母菌相对丰度基本保持不变,乳酸菌相对丰度则有略微的上升,随着醇度的升高,微生物多样性也迅速降低。醋酸发酵阶段,乳酸菌的相对丰度逐渐降低,醋酸菌的相对丰度则逐渐升高,随着酸度的增加,微生物多样性下降。虽然有些微生物在食醋发酵过程中的相对丰度较低,但是其对某些风味物质的影响作用是不可替代的。
(3)乳酸与主要功能微生物间pearson相关性分析:
以双尾检验作为显著性的检验方法,对乳酸与功能微生物之间的pearson相关性进行分析。结果如图12所示,根据pearson相关性分析结果,与乳酸相关性最的微生物为lactobacillus,相关性系数为0.910。选取相关性系数最高的lactobacillus对乳酸进行强化发酵。
(4)乳酸与主要功能微生物间典范对应相关性分析:
用canoco5对乳酸与强化微生物进行典范对应相关性分析,分析结果如图13所示。
根据乳酸与主要功能微生物间的典范对应相关性分析,在乳酸的变化过程中,lactobacillus与食醋发酵第12天的样品有最大的相关性,因此确定在食醋发酵的第12天添加lactobacillus菌剂。
(5)乳酸线性回归方程的建立:
以强化微生物菌体cfu/g数的log值为自变量,乳酸含量为因变量建立食醋发酵过程中乳酸物质的线性回归方程。
乳酸(g/100g醋醅)=0.86*lactobacillus–2.41
根据乳酸与lactobacillus的相关性方程,如果乳酸要提高2g/100g醋醅,每个发酵缸(上口径40cm、下口径25cm、高50cm)约有50kg醋醅,则需在食醋发酵的第12天强化lactobacillus至105.128cfu/g醋醅。
(6)优良功能微生物的筛选:
利用大曲、酒醪、醋醅筛选培养基(同实施例1),以大曲、酒醪、醋醅等为筛选样品,筛选样品中lactobacillus,挑选生长较快,菌落较大,分布密度较广但菌落形态不同的50-60株菌落,纯化后保存。对上述筛选获得的纯培养微生物进行测序,同一属的微生物进行发酵和耐受性能比较,选择发酵和耐受性能较好的微生物作为同属微生物的优势微生物。若本步骤未获得优势微生物,则按照功能性微生物筛选方法进行重复筛选和鉴定。
菌剂的制备方法为:将筛选得到的lactobacillus微生物以1%的接种量接入上述筛选培养基中,在37℃、静置培养20h,离心收集微生物菌体,将以50g/l乳糖和100g/l麦芽糊精制成的保护剂与微生物菌体质量以15:1的比例均匀混合,然后利用喷雾冷冻干燥制得菌剂。
(7)功能微生物强化发酵:
lactobacillus发酵菌剂应用于传统食醋酿造过程中对乳酸进行强化,具体实验方案如下:在食醋发酵第12天进行菌剂的添加,实验设置添加菌剂的强化组,未添加菌剂的对照组。强化组每个发酵缸强化lactobacillus至105.128cfu/g醋醅,发酵菌剂复水活化后添加,并搅拌均匀。强化结果如表4所示。
表4:微生物强化发酵试验中乳酸强化结果
由表4可看出实验组和对照组相比乳酸含量变化明显,说明在食醋发酵第12天添加lactobacillus菌剂对食醋产品中乳酸有较大的影响。乳酸含量从1.04g/100g醋醅提高到3.00g/100g醋醅,提高了1.96g/100g醋醅,与预期提高量2g/100g醋醅相差2%,达到了预期目的。
实施例5:同时定向调控食醋中酯类和酚类含量
(1)食醋发酵过程中酯类、酚类含量的测定;
采用gc-ms的方法测定食醋发酵过程中酚类和酯类物质含量。具体测定条件和方法如前所述挥发风味物质的检测。酚类和酯类含量变化如图14所示,酚类物质在食醋酒精发酵过程中呈逐渐下降的趋势,在醋酸发酵阶段呈现先上升后迅速下降的趋势。酯类物质发酵过程中呈先上升后下降的趋势。
(2)食醋发酵过程中主要微生物的测定:
采用宏基因组学高通量测序等分子生态学技术结合主成分分析等统计学分析方法,对食醋醋酸发酵阶段中的细菌和真菌群落的组成和演替进行分析。具体测定条件和方法同上。对传统食醋发酵阶段微生物的组成和变化规律进行分析,结果如图1所示。乳酸菌和酿酒酵母菌是食醋酒精发酵过程最主要的微生物,醋酸菌和乳酸菌是食醋醋酸发酵过程的最主要微生物。酒精发酵阶段,酿酒酵母菌相对丰度基本保持不变,乳酸菌相对丰度则有略微的上升,随着醇度的升高,微生物多样性也迅速降低。醋酸发酵阶段,乳酸菌的相对丰度逐渐降低,醋酸菌的相对丰度则逐渐升高,随着酸度的增加,微生物多样性下降。虽然有些微生物在食醋发酵过程中的相对丰度较低,但是其对某些风味物质的影响作用是不可替代的。
(3)酯类、酚类与主要功能微生物间pearson相关性分析:
以双尾检验作为显著性的检验方法,对酚类、酯类物质与功能微生物之间的pearson相关性进行分析。结果如图15所示。根据pearson相关性分析结果,与酯类、酚类物质相关性最的微生物分别为cladosporium、streptococcus,相关性系数分别为0.970和0.957。选取相关性系数最高的cladosporium、streptococcus对酯类和酚类进行强化发酵。
(4)酯类、酚类与主要功能微生物间典范对应相关性分析:
用canoco5对酯类、酚类与强化微生物进行典范对应相关性分析,分析结果如图16所示。
根据酯类、酚类与主要功能微生物间的典范对应相关性分析,在酯类、酚类物质的变化过程中,cladosporium与食醋发酵第16天、streptococcus与食醋发酵第6天的样品有最大的相关性,因此确定在食醋发酵的第6天添加streptococcus菌剂、食醋发酵第16天添加cladosporium菌剂。
(5)酯类、酚类线性回归方程的建立:
以强化微生物菌体cfu/g数的log值为自变量,酯类、酚类物质含量为因变量分别建立食醋发酵过程中酯类物质和酚类的线性回归方程。
酯类(g/100g醋醅)=2.75*cladosporium–9.07
酚类(g/100g醋醅)=1.25*streptococcus–3.52
根据酚类物质与streptococcus的回归方程和酯类物质与cladosporium的相关性方程,如果酚类物质要提高1g/100g醋醅,酯类物质要提高3g/100g醋醅,每个发酵缸则需在食醋发酵的第6天强化streptococcu至103.616cfu/g醋醅,在食醋发酵的第16天强化cladosporiums至104.39cfu/g醋醅。
(6)优良功能微生物的筛选:
利用大曲、酒醪、醋醅筛选培养基(同实施例1),以大曲、酒醪、醋醅等为筛选样品,筛选样品中streptococcus和cladosporium,挑选生长较快,菌落较大,分布密度较广但菌落形态不同的50-60株菌落,纯化后保存。对上述筛选获得的纯培养微生物进行测序,同一属的微生物进行发酵和耐受性能比较,选择发酵和耐受性能较好的微生物作为同属微生物的优势微生物。若本步骤未获得优势微生物,则按照功能性微生物筛选方法进行重复筛选和鉴定。
streptococcus菌剂的制备方法同实施例1;cladosporium菌剂的制备方法同实施例2;
(7)功能微生物强化发酵:
streptococcus和cladosporium发酵菌剂应用于传统食醋酿造过程中对酯类物质和酚类物质进行强化,具体实验方案如下:在食醋发酵的第6天添加streptococcus菌剂、食醋发酵第16天添加cladosporium菌剂。实验设置添加菌剂的强化组,未添加菌剂的对照组。强化组每个发酵缸强化streptococcu至103.616cfu/g醋醅,强化cladosporiums至104.39cfu/g醋醅,发酵菌剂复水活化后添加,并搅拌均匀。强化结果如表5所示。
表5:微生物强化发酵试验中酯类、酚类物质强化结果
由表5可看出实验组和对照组相比酯类、酚类物质含量变化明显,说明在食醋发酵的第6天添加streptococcus菌剂、食醋发酵第16天添加cladosporium菌剂对食醋产品中酯类和酚类物质风味有较大的影响。酯类物质含量从8.19g/100g醋醅提高到11.12g/100g醋醅,提高了2.9g/100g醋醅,与预期提高量3g/100g醋醅相差3.3%。酚类物质含量从1.65g/100g醋醅提高到2.59g/100g醋醅,提高了0.94g/100g醋醅,与预期提高量1g/100g醋醅相差6%,达到了预期目的。
实施例6:同时定向调控食醋中乙酸和乳酸含量
(1)食醋发酵过程中乙酸、乳酸含量的测定:
采用hplc的方法测定食醋发酵过程中乙酸和乳酸的含量。具体测定条件和方法如前所述风味物质的检测。乙酸、乳酸物质含量变化如图17所示。乙酸含量在发酵过程呈增加的趋势,尤其是在醋酸发酵阶段,乙酸含量迅速升高。乳酸含量在酒精发酵阶段逐渐上升,进入醋酸发酵阶段后乳酸含量略微上升后呈下降趋势。
(2)食醋发酵过程中主要微生物的测定:
采用宏基因组学高通量测序等分子生态学技术结合主成分分析等统计学分析方法,对食醋醋酸发酵阶段中的细菌和真菌群落的组成和演替进行分析。具体测定条件和方法同上。对传统食醋发酵阶段微生物的组成和变化规律进行分析,结果如图1所示。乳酸菌和酿酒酵母菌是食醋酒精发酵过程最主要的微生物,醋酸菌和乳酸菌是食醋醋酸发酵过程的最主要微生物。酒精发酵阶段,酿酒酵母菌相对丰度基本保持不变,乳酸菌相对丰度则有略微的上升,随着醇度的升高,微生物多样性也迅速降低。醋酸发酵阶段,乳酸菌的相对丰度逐渐降低,醋酸菌的相对丰度则逐渐升高,随着酸度的增加,微生物多样性下降。虽然有些微生物在食醋发酵过程中的相对丰度较低,但是其对某些风味物质的影响作用是不可替代的。
(3)乙酸、乳酸与主要功能微生物间pearson相关性分析:
以双尾检验作为显著性的检验方法,对乙酸、乳酸物质与功能微生物之间的pearson相关性进行分析。结果如图18所示。根据pearson相关性分析结果,与乙酸、乳酸物质相关性最大的微生物分别为acetobacter、lactobacillus,相关性系数分别为0.974和0.910。选取相关性系数最高的acetobacter、lactobacillus对乙酸和乳酸进行强化发酵。
(4)乙酸、乳酸与主要功能微生物间典范对应相关性分析:
用canoco5对乙酸、乳酸与强化微生物进行典范对应相关性分析,分析结果如图19所示。根据乙酸、乳酸与主要功能微生物间的典范对应相关性分析,在乙酸、乳酸物质的变化过程中,lactobacillus与食醋发酵第14天、acetobacter与食醋发酵第16天的样品有最大的相关性,因此确定在食醋发酵的第14天添加lactobacillus菌剂、食醋发酵第16天添加acetobacter菌剂。
(5)乙酸、乳酸线性回归方程的建立:
以强化微生物菌体cfu/g数的log值为自变量,乙酸、乳酸物质含量为因变量分别建立食醋发酵过程中乙酸和乳酸的线性回归方程。
乙酸(g/100g醋醅)=1.13*acetobacter–2.31
乳酸(g/100g醋醅)=0.86*lactobacillus–2.41
根据乙酸与acetobacter的相关性方程和乳酸与lactobacillus的相关性方程,如果乙酸要提高3g/100g醋醅,乳酸要提高2g/100g醋醅,每个发酵缸(上口径40cm、下口径25cm、高50cm)约有50kg醋醅,则需在在食醋发酵的第14天强化lactobacillus至105.128cfu/g醋醅,食醋发酵的第16天强化acetobacter至104.699cfu/g醋醅。
(6)优良功能微生物的筛选:
利用大曲、酒醪、醋醅筛选培养基(同实施例1),以大曲、酒醪、醋醅等为筛选样品,筛选样品中acetobacter、lactobacillus,挑选生长较快,菌落较大,分布密度较广但菌落形态不同的50-60株菌落,纯化后保存。对上述筛选获得的纯培养微生物进行测序,同一属的微生物进行发酵和耐受性能比较,选择发酵和耐受性能较好的微生物作为同属微生物的优势微生物。若本步骤未获得优势微生物,则按照功能性微生物筛选方法进行重复筛选和鉴定。
acetobacter、lactobacillus菌剂的制备分别如实施例3和4;
(7)功能微生物强化发酵:
lactobacillus和acetobacter发酵菌剂应用于传统食醋酿造过程中对乙酸、乳酸进行强化,具体实验方案如下:在食醋发酵的第14天添加lactobacillus菌剂、食醋发酵第16天添加acetobacter菌剂。实验设置添加菌剂的强化组,未添加菌剂的对照组。强化组每个发酵缸强化lactobacillus至105.128cfu/g醋醅,强化acetobacter至104.699cfu/g醋醅,发酵菌剂复水活化后添加,并搅拌均匀。强化结果如表9-1所示。
表6:微生物强化发酵试验中乙酸、乳酸强化结果
由表6可看出实验组和对照组相比乙酸、乳酸含量变化明显,说明在食醋发酵的第14天添加lactobacillus菌剂、食醋发酵第16天添加acetobacter菌剂对食醋产品中乙酸和乳酸物质风味有较大的影响。乙酸含量从3.85g/100g醋醅提高到6.90g/100g醋醅,提高了3.05g/100g醋醅,与预期提高量3g/100g醋醅相差1.6%。乳酸物质含量从1.04g/100g醋醅提高到3.08g/100g醋醅,提高了2.04g/100g醋醅,与预期提高量2g/100g醋醅相差2%,达到了预期目的。
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本专利构思的前提下,上述各实施方式还可以做出若干变形、组合和改进,这些都属于本专利的保护范围。因此,本专利的保护范围应以权利要求为准。
- 还没有人留言评论。精彩留言会获得点赞!