壳聚糖硒降低F-2毒素致猪子宫内膜上皮细胞CASP3基因表达升高的应用的制作方法
本发明属于生物技术领域,涉及细胞工程技术,尤其是一种壳聚糖硒在抑制f-2毒素所致猪子宫内膜上皮细胞casp3(caspase-3)基因表达升高方面的应用。
背景技术:
f-2毒素,也称玉米赤霉烯酮,是由禾谷镰刀菌产生,是二羟基苯酸内酯化合物,与雌二醇结构相似,具有雌激素样活性,是世界上污染农作物范围最为广泛真菌毒素之一。国内外大量研究证明,f-2毒素具有生殖毒性、细胞毒性、免疫毒性以及致癌作用。长期饲喂f-2毒素污染的饲料会导致畜禽生长性能下降、免疫功能低下和繁殖机能障碍。
研究表明,f-2毒素对猪空肠上皮细胞、鸡脾淋巴细胞、大鼠睾丸间质细胞、小鼠子宫内膜基质细胞、猪卵巢颗粒细胞、大鼠子宫内膜细胞、猪子宫内膜细胞等均具有细胞毒性,可以抑制细胞增殖,导致细胞的凋亡。细胞凋亡的过程大致可分为以下几个阶段:接受凋亡信号→凋亡调控分子间的相互作用→蛋白水解酶的活化(caspase)→进入连续反应过程。caspase全称为含半胱氨酸的天冬氨酸蛋白水解酶,与真核细胞凋亡密切相关,并参与细胞的生长、分化与凋亡调节。caspase分为两类,一类是起始者(initiators),另一类是执行者(executioners)。起始caspase在外来蛋白信号的作用下被切割激活,激活的起始caspase对执行者caspase进行切割并使之激活,被激活的执行者caspase通过对caspase靶蛋白的水解,导致程序性细胞死亡。caspase-3是细胞凋亡过程中最主要的终末剪切酶,也是ctl细胞杀伤机制的重要组成部分。caspase-3基因和蛋白表达升高时细胞凋亡增多,caspase-3基因和蛋白表达降低时细胞凋亡减少,因此caspase-3基因和蛋白表达量的高低在一定程度上可反映毒素对细胞毒性作用的强弱。研究表明,f-2毒素可导致鸡脾淋巴细胞、人肝癌hepg2细胞;猪卵巢颗粒细胞、大鼠睾丸支持细胞以及猪子宫内膜细胞caspase-3基因和蛋白表达水平显著提高,并以此来体现其对相应细胞的毒性作用。
硒是动物和人所必需的微量元素。硒的抗氧化、提高机体免疫力和抗病力,调节机体代谢,影响动物和人的繁育机能,抗肿瘤,延缓衰老,拮抗有毒元素等多种生物学功能已为人们所共知。壳聚糖是从低等的生物菌类、藻类的细胞、节支动物虾蟹昆虫的外壳中提取的天然高分子聚合物,具有抗衰老、抗氧化、抗癌、抗风湿、抗病毒、抗肿瘤、增强机体免疫活性、诱导细胞分化等作用。壳聚糖硒是硒与壳聚糖的有机化合物,能同时发挥有机硒和壳聚糖的抵抗氧化,保护细胞膜,抑制过氧化物,提高机体抵抗氧化损伤的作用;在生产实践中,壳聚糖硒还能不同程度提高畜禽的生产性能、免疫力、抗氧化能力,降低重金属对机体的蓄积毒性,也可抵抗肿瘤、诱导细胞凋亡、降血糖和血脂。
目前,国内外未见到壳聚糖硒抑制f-2毒素所致猪子宫内膜上皮细胞caspase-3基因表达升高方面的专利或报道。
技术实现要素:
本发明目的在于克服现有技术中的不足之处,提供一种壳聚糖硒在抑制f-2毒素所致猪子宫内膜上皮细胞caspase-3基因表达升高方面的应用,为壳聚糖硒在预防和治疗猪f-2毒素中毒方面的应用提供体外研究模型和理论支持。
本发明解决其技术问题所采用的技术方案是:
一种壳聚糖硒在抑制f-2毒素所致猪子宫内膜上皮细胞caspase-3基因表达升高方面的应用。
而且,对于猪子宫内膜上皮细胞,当f-2毒素浓度为20-40μg/ml时,使用硒在培养液中的终浓度为1.0-3.0μmol/l的壳聚糖硒,能够抑制f-2毒素所致猪子宫内膜上皮细胞caspase-3基因表达升高。
一种壳聚糖硒在抑制f-2毒素所致猪子宫内膜上皮细胞caspase-3基因表达升高的方法,步骤如下:
对于猪子宫内膜上皮细胞,当f-2毒素浓度为20-40μg/ml时,加入壳聚糖硒,硒在培养液中的终浓度为1.0-3.0μmol/l,培养6-24h后,培养结束,能够抑制f-2毒素所致猪子宫内膜上皮细胞caspase-3基因表达升高。
一种壳聚糖硒在抑制f-2毒素所致猪子宫内膜上皮细胞caspase-3基因表达升高的验证方法,步骤如下:
⑴将纯化后的猪子宫内膜上皮细胞接种于六孔板,调整细胞浓度为4×105个/孔;试验分为对照组、f-2毒素攻毒组和壳聚糖硒组;细胞接种5-7d后,待细胞汇合80-90%,更换培养液:对照组和f-2毒素攻毒组更换为普通培养液,壳聚糖硒组更换含壳聚糖硒的培养液,硒浓度为1.0-3.0μmol/l;继续培养12-24h后取出六孔板,在f-2毒素攻毒组和壳聚糖硒组加入f-2毒素,使其浓度为20-40μg/ml,继续培养6-24h后,培养结束;
⑵采用qpcr法测定caspase-3基因表达量的改变:
提取细胞总rna,常规反转录rna为cdna,常规设计合成猪子宫内膜上皮细胞的内参基因和caspase-3基因的引物、确定反应体系和反应条件,在定量pcr仪上对caspase-3基因表达量进行测定,以此体现减弱f-2毒素对体外培养的猪子宫内膜上皮细胞的毒性作用。
而且,所述步骤⑵的具体步骤如下:
⑴细胞总rna提取
取出培养板,弃培养液并清洗3次,收集子宫内膜上皮细胞,使用培养细胞/细菌总rna提取试剂盒提取总rna,使用超微量分光光度计检测rna浓度和纯度,od260/od280值应在1.8和2.0之间,置于-80℃冰箱保存备用;
⑵反转录成cdna
样品反转录如下:
样品rna反转录体系如下:
反应条件:65℃10min,取出置于冰上;
样品rna反转录体系如下:
反应条件:37℃60min,85℃5min;反转录结束后将上述cdna置于-20℃冰箱保存;
⑶引物设计
猪子宫内膜上皮细胞的β-actin和caspase-3基因的引物,具体如下:
⑷qpcr反应
反应体系及反应条件如下:
qpcr反应体系如下:
qpcr扩增程序如下:
⑸猪子宫内膜上皮细胞caspase-3基因mrna表达量的测定。
本发明取得的优点和积极效果为:
1、本发明提出了壳聚糖硒在抑制f-2毒素所致猪子宫内膜上皮细胞caspase-3基因表达升高方面的应用。实验结果显示:对于子宫内膜上皮细胞,使用1.0-3.0μmol/l的壳聚糖硒(在培养液中的终浓度,以硒计),在f-2毒素浓度为20-40μg/ml,可抑制f-2毒素所致猪子宫内膜上皮细胞caspase-3基因表达升高,以此达到减弱f-2毒素对体外培养的猪子宫内膜上皮细胞的毒性作用,为壳聚糖硒在预防和治疗猪f-2毒素中毒方面的应用提供体外研究模型和理论支持。
2、本发明主要解决了如何应用壳聚糖硒抑制f-2毒素所致猪子宫内膜上皮细胞caspase-3基因表达量改变的方法及应用;重点考察了壳聚糖硒作为能够抑制细胞凋亡的物质在减弱f-2毒素对猪子宫内膜上皮细胞毒性作用方面的作用效果,特别是抑制f-2毒素所致猪子宫内膜上皮细胞caspase-3基因表达量升高方面的作用效果;主要的难点在于,确定壳聚糖硒对f-2毒素所致猪子宫内膜上皮细胞毒性作用(特别是对caspase-3基因表达量改变)具有最佳保护效果的时间以及最佳应用浓度;为此先后考察了f-2毒素对猪子宫内膜上皮细胞生长的影响、攻毒的毒素剂量、攻毒时间等条件、壳聚糖硒的应用剂量和应用时间等条件;最后确定的方案是:猪子宫内膜上皮细胞培养5-7d,处于生长对数期时,应用含有壳聚糖硒的培养液(在培养液中的终浓度1.0-3.0μmol/l,以硒计)对细胞进行保护;继续培养12-24h,待壳聚糖硒充分发挥作用后,加入20-40μg/ml的f-2毒素进行攻毒,攻毒进行6-24h,在此条件下,壳聚糖硒抑制f-2毒素所致猪子宫内膜上皮细胞caspase-3蛋白表达量升高具有最佳的作用效果。
附图说明
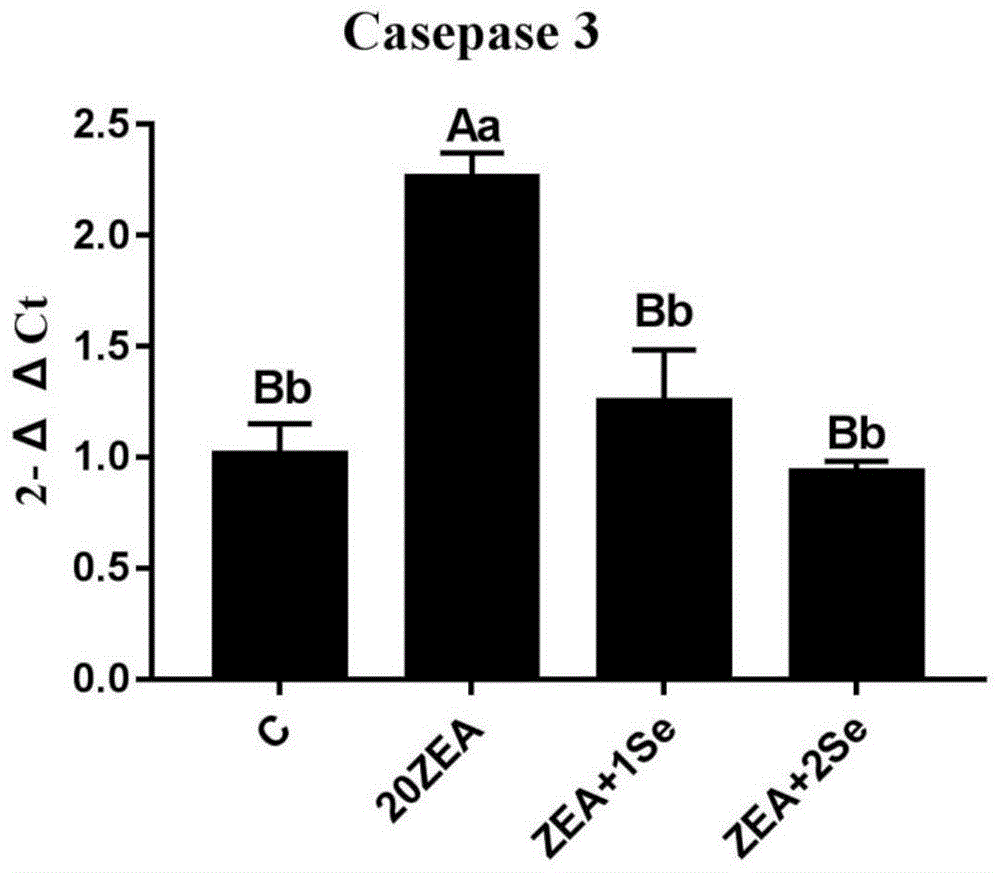
图1为本发明中壳聚糖硒对f-2毒素(20μg/ml)导致的子宫内膜上皮细胞caspase-3基因表达的影响图;
注:标注不同大写(或小写)字母表示差异显著p<0.01(或p<0.05),下同;
图2为本发明中壳聚糖硒对f-2毒素(30μg/ml)导致的子宫内膜上皮细胞caspase-3基因表达的影响;
图3为本发明中壳聚糖硒对f-2毒素(40μg/ml)导致的子宫内膜上皮细胞caspase-3基因表达的影响图。
具体实施方式
下面详细叙述本发明的实施例,需要说明的是,本实施例是叙述性的,不是限定性的,不能以此限定本发明的保护范围。
本发明中所使用的原料,如无特殊说明,均为常规的市售产品;本发明中所使用的方法,如无特殊说明,均为本领域的常规方法。
较优地,本发明中dmem/f12细胞培养液购买于gibco公司,f-2毒素购买于上海源叶生物科技有限公司。壳聚糖硒购由天津农学院临床兽医学实验室参照文献(孔涛,曲韵笙,朱连勤,等.壳聚糖硒的合成及其理化性质[j].安徽农业科学,2007,35(1):21)的方法进行制备,制备原料买于壳聚糖购买于忆隆生物科技有限公司,亚硒酸钠购自天津市化学试剂究所;制备的壳聚糖硒中硒含量为2.73g/kg。
一种壳聚糖硒在抑制f-2毒素所致猪子宫内膜上皮细胞caspase-3基因表达升高方面的应用。
较优地,对于猪子宫内膜上皮细胞,当f-2毒素浓度为20-40μg/ml时,使用硒在培养液中的终浓度为1.0-3.0μmol/l的壳聚糖硒,能够抑制f-2毒素所致猪子宫内膜上皮细胞caspase-3基因表达升高。
一种壳聚糖硒在抑制f-2毒素所致猪子宫内膜上皮细胞caspase-3基因表达升高的方法,步骤如下:
对于猪子宫内膜上皮细胞,当f-2毒素浓度为20-40μg/ml时,加入壳聚糖硒,硒在培养液中的终浓度为1.0-3.0μmol/l,培养6-24h后,培养结束,能够抑制f-2毒素所致猪子宫内膜上皮细胞caspase-3基因表达升高。
一种壳聚糖硒在抑制f-2毒素所致猪子宫内膜上皮细胞caspase-3基因表达升高的验证方法,步骤如下:
⑴将纯化后的猪子宫内膜上皮细胞接种于六孔板,调整细胞浓度为4×105个/孔;试验分为对照组、f-2毒素攻毒组和壳聚糖硒组;细胞接种5-7d后,待细胞汇合80-90%,更换培养液:对照组和f-2毒素攻毒组更换为普通培养液,壳聚糖硒组更换含壳聚糖硒的培养液,硒浓度为1.0-3.0μmol/l;继续培养12-24h后取出六孔板,在f-2毒素攻毒组和壳聚糖硒组加入f-2毒素,使其浓度为20-40μg/ml,继续培养6-24h后,培养结束;
⑵采用qpcr法测定caspase-3基因表达量的改变:
提取细胞总rna,常规反转录rna为cdna,常规设计合成猪子宫内膜上皮细胞的内参基因和caspase-3基因的引物、确定反应体系和反应条件,在定量pcr仪上对caspase-3基因表达量进行测定,以此体现减弱f-2毒素对体外培养的猪子宫内膜上皮细胞的毒性作用。
较优地,所述步骤⑵的具体步骤如下:
⑴细胞总rna提取
取出培养板,弃培养液并清洗3次,收集子宫内膜上皮细胞,使用培养细胞/细菌总rna提取试剂盒提取总rna,使用超微量分光光度计检测rna浓度和纯度,od260/od280值应在1.8和2.0之间,置于-80℃冰箱保存备用;
⑵反转录成cdna
样品反转录如下:
样品rna反转录体系如下:
反应条件:65℃10min,取出置于冰上;
样品rna反转录体系如下:
反应条件:37℃60min,85℃5min;反转录结束后将上述cdna置于-20℃冰箱保存;
⑶引物设计
猪子宫内膜上皮细胞的β-actin和caspase-3基因的引物,具体如下:
⑷qpcr反应
反应体系及反应条件如下:
qpcr反应体系如下:
qpcr扩增程序如下:
⑸猪子宫内膜上皮细胞caspase-3基因mrna表达量的测定。
具体地,本发明中相关的验证实施例如下:
实施例1
一种壳聚糖硒在抑制f-2毒素所致猪子宫内膜上皮细胞caspase-3基因表达升高的验证方法,步骤如下:
1.1猪子宫内膜细胞的分离与纯化
(1)子宫内膜细胞的分离
猪屠宰后,立即将子宫两端结扎,无菌取下整个子宫,剥离脂肪组织,用含有200iu双抗预冷的生理盐水冲洗后置于含双抗的生理盐水溶液中,尽快送至实验室。用止血钳夹住子宫两端,超净工作台内取出子宫,浸泡于酒精约60s,取出后pbs冲洗;纵向剪开子宫(接近子宫角部位),含双抗pbs冲洗3-4次,无血迹,剪取子宫内膜至1mm3左右的粒状,按0.5cm左右间隔均匀置于细胞培养板内,组织块贴附于细胞培养板后,加少量细胞培养液,co2培养箱培养24h后补加足够的培养液。48h待细胞迁出后,弃掉组织块,收集细胞悬液,低速离心弃上清,重悬,静置10min,移取悬液离心弃上清,收集底部细胞,加培养液制成细胞悬液。
(2)细胞活性测定
利用台盼蓝拒染的方法检测分离细胞的活性,取少量细胞悬液与台盼蓝混匀(台盼蓝终浓度0.04%),静置染色3min。显微镜下观察细胞染色状况(死亡细胞为蓝色,正常细胞拒染)。计算细胞的活性。
细胞活性=活细胞数/(活细胞数+死细胞数)*100%。细胞活性大于90%时可继续进行后续试验。
(3)猪子宫内膜细胞原代培养
1×105个细胞/ml接种于细胞培养板,置于co2培养箱,24h后换液,以后根据细胞的生长状况更换培养液,定期观察细胞贴壁情况及生长状况。
(4)猪子宫内膜上皮细胞的纯化
上皮细胞较基质细胞的贴壁能力强,利用差速消化法纯化子宫内膜皮细胞。细胞长至单层用胰蛋白酶(0.25%)消化,当基质细胞开始收缩变圆时,立即加入细胞培养液终止消化,移液枪轻轻吹打使基质细胞脱落,而上皮细胞依然贴壁,弃去培养液,清洗培养板2次,加入适量的细胞培养液继续培养,若仍有基质细胞混合生长,重复上述纯化过程得到纯净子宫内膜上皮细胞。
1.2猪子宫内膜上皮细胞培养与分组处理
子宫内膜上皮细胞接种于6孔板,调整细胞浓度至4×105个/孔,加样布板前要缓慢多次吹打。试验分为4组,即对照c组、f-2毒素攻毒组(f-2毒素20μg/ml)、壳聚糖硒(1.0μmol/lse+f-2毒素20μg/ml)和壳聚糖硒2组(2.0μmol/lse+f-2毒素20μg/ml),每组6个重复。细胞接种5d后,弃掉培养液并清洗2次,更换培养液:对照组和f-2毒素攻毒组更换普通培养液;壳聚糖硒1和2组更换含有1.0μmol/l和2.0μmol/l(以硒计)的壳聚糖硒培养液。继续培养12h后取出细胞培养板,壳聚糖硒1组、壳聚糖硒2组和f-2毒素组均加入f-2毒素,使其浓度为为20μg/ml,继续培养24h后,培养结束。
1.3细胞总rna提取
取出培养板,弃培养液并清洗3次,收集子宫内膜上皮细胞,使用培养细胞/细菌总rna提取试剂盒(rnapreppurecell/bacteriakitrnapreppure)提取总rna,购自天根生化科技有限公司。使用超微量分光光度计检测rna浓度和纯度,od260/od280值应在1.8和2.0之间。置于-80℃冰箱保存备用。
1.4反转录成cdna
样品反转录见1-1,1-2。
表1-1样品rna反转录体系
反应条件:65℃10min,取出置于冰上。
表1-2样品rna反转录体系
反应条件:37℃60min,85℃5min。反转录结束后将上述cdna置于-20℃冰箱保存。
1.5引物设计
猪子宫内膜上皮细胞的β-actin和caspase-3基因的引物,由primer3设计,苏州金唯智生物科技有限公司合成,见表1-3。
表1-3β-actin和caspase3引物序列
1.6qpcr反应
反应体系及反应条件见表1-4、1-5。
表1-4qpcr反应体系
表1-5qpcr扩增程序
1.7猪子宫内膜上皮细胞caspase-3基因mrna表达量的测定
猪子宫内膜上皮细胞caspase-3基因mrna表达量的测定结果见图1。
结果表明:20μg/ml的f-2毒素可极显著的升高猪子宫内膜上皮细胞中caspase-3基因的表达量(p<0.01),而1.0μmol/l(以硒计)的壳聚糖硒和2.0μmol/l(以硒计)的壳聚糖硒能够极显著的降低f-2毒素所致的猪子宫内膜上皮细胞中caspase-3基因表达量的升高,与对照组无显著差异(p<0.01)。
实施例2
一种壳聚糖硒在抑制f-2毒素所致猪子宫内膜上皮细胞caspase-3基因表达升高的验证方法,步骤如下:
1.1猪子宫内膜细胞的分离与纯化
(1)子宫内膜细胞的分离
猪屠宰后,立即将子宫两端结扎,无菌取下整个子宫,剥离脂肪组织,用含有200iu双抗预冷的生理盐水冲洗后置于含双抗的生理盐水溶液中,尽快送至实验室。用止血钳夹住子宫两端,超净工作台内取出子宫,浸泡于酒精约60s,取出后pbs冲洗;纵向剪开子宫(接近子宫角部位),含双抗pbs冲洗3-4次,无血迹,剪取子宫内膜至1mm3左右的粒状,按0.5cm左右间隔均匀置于细胞培养板内,组织块贴附于细胞培养板后,加少量细胞培养液,co2培养箱培养24h后补加足够的培养液。48h待细胞迁出后,弃掉组织块,收集细胞悬液,低速离心弃上清,重悬,静置10min,移取悬液离心弃上清,收集底部细胞,加培养液制成细胞悬液。
(2)细胞活性测定
利用台盼蓝拒染的方法检测分离细胞的活性,取少量细胞悬液与台盼蓝混匀(台盼蓝终浓度0.04%),静置染色3min。显微镜下观察细胞染色状况(死亡细胞为蓝色,正常细胞拒染)。计算细胞的活性。
细胞活性=活细胞数/(活细胞数+死细胞数)*100%。细胞活性大于90%时可继续进行后续试验。
(3)猪子宫内膜细胞原代培养
1×105个细胞/ml接种于细胞培养板,置于co2培养箱,24h后换液,以后根据细胞的生长状况更换培养液,定期观察细胞贴壁情况及生长状况。
(4)猪子宫内膜上皮细胞的纯化
上皮细胞较基质细胞的贴壁能力强,利用差速消化法纯化子宫内膜皮细胞。细胞长至单层用胰蛋白酶(0.25%)消化,当基质细胞开始收缩变圆时,立即加入细胞培养液终止消化,移液枪轻轻吹打使基质细胞脱落,而上皮细胞依然贴壁,弃去培养液,清洗培养板2次,加入适量的细胞培养液继续培养,若仍有基质细胞混合生长,重复上述纯化过程得到纯净子宫内膜上皮细胞。
1.2猪子宫内膜上皮细胞培养与分组处理
子宫内膜上皮细胞接种于6孔板,调整细胞浓度至4×105个/孔,加样布板前要缓慢多次吹打。试验分为4组,即对照c组、f-2毒素攻毒组(f-2毒素30μg/ml)、壳聚糖硒1组(1.25μmol/lse+f-2毒素30μg/ml)和壳聚糖硒2组(2.5μmol/lse+f-2毒素30μg/ml),每组6个重复。细胞接种5d后,弃掉培养液并清洗2次,更换培养液:对照组和f-2毒素攻毒组更换普通培养液;壳聚糖硒1和2组更换含有1.25μmol/l和2.5μmol/l(以硒计)的壳聚糖硒培养液。继续培养18h后取出细胞培养板,壳聚糖硒1组、壳聚糖硒2组和f-2毒素组均加入f-2毒素,使其浓度为为30μg/ml,继续培养12h后,培养结束。
1.3细胞总rna提取
取出培养板,弃培养液并清洗3次,收集子宫内膜上皮细胞,使用培养细胞/细菌总rna提取试剂盒(rnapreppurecell/bacteriakitrnapreppure)提取总rna,购自天根生化科技有限公司。使用超微量分光光度计检测rna浓度和纯度,od260/od280值应在1.8和2.0之间。置于-80℃冰箱保存备用。
1.4反转录成cdna
样品反转录见1-1,1-2。
表1-1样品rna反转录体系
反应条件:65℃10min,取出置于冰上。
表1-2样品rna反转录体系
反应条件:37℃60min,85℃5min。反转录结束后将上述cdna置于-20℃冰箱保存。
1.5引物设计
猪子宫内膜上皮细胞的β-actin和caspase-3基因的引物,由primer3设计,苏州金唯智生物科技有限公司合成,见表1-3。
表1-3β-actin和caspase-3引物序列
1.6qpcr反应
反应体系及反应条件见表1-4、1-5。
表1-4qpcr反应体系
表1-5qpcr扩增程序
1.7猪子宫内膜上皮细胞caspase-3基因mrna表达量的测定
猪子宫内膜上皮细胞caspase-3基因mrna表达量的测定结果见图2。
结果表明:30μg/ml的f-2毒素可极显著的升高猪子宫内膜上皮细胞中caspase-3基因的表达量(p<0.01),而1.25μmol/l(以硒计)的壳聚糖硒和2.5μmol/l(以硒计)的壳聚糖硒能够极显著的降低f-2毒素所致的猪子宫内膜上皮细胞中caspase-3基因表达量的升高(p<0.01),与对照组无显著差异。
实施例3
一种壳聚糖硒在抑制f-2毒素所致猪子宫内膜上皮细胞caspase-3基因表达升高的验证方法,步骤如下:
1.1猪子宫内膜细胞的分离与纯化
(1)子宫内膜细胞的分离
猪屠宰后,立即将子宫两端结扎,无菌取下整个子宫,剥离脂肪组织,用含有200iu双抗预冷的生理盐水冲洗后置于含双抗的生理盐水溶液中,尽快送至实验室。用止血钳夹住子宫两端,超净工作台内取出子宫,浸泡于酒精约60s,取出后pbs冲洗;纵向剪开子宫(接近子宫角部位),含双抗pbs冲洗3-4次,无血迹,剪取子宫内膜至1mm3左右的粒状,按0.5cm左右间隔均匀置于细胞培养板内,组织块贴附于细胞培养板后,加少量细胞培养液,co2培养箱培养24h后补加足够的培养液。48h待细胞迁出后,弃掉组织块,收集细胞悬液,低速离心弃上清,重悬,静置10min,移取悬液离心弃上清,收集底部细胞,加培养液制成细胞悬液。
(2)细胞活性测定
利用台盼蓝拒染的方法检测分离细胞的活性,取少量细胞悬液与台盼蓝混匀(台盼蓝终浓度0.04%),静置染色3min。显微镜下观察细胞染色状况(死亡细胞为蓝色,正常细胞拒染)。计算细胞的活性。
细胞活性=活细胞数/(活细胞数+死细胞数)*100%。细胞活性大于90%时可继续进行后续试验。
(3)猪子宫内膜细胞原代培养
1×105个细胞/ml接种于细胞培养板,置于co2培养箱,24h后换液,以后根据细胞的生长状况更换培养液,定期观察细胞贴壁情况及生长状况。
(4)猪子宫内膜上皮细胞的纯化
上皮细胞较基质细胞的贴壁能力强,利用差速消化法纯化子宫内膜皮细胞。细胞长至单层用胰蛋白酶(0.25%)消化,当基质细胞开始收缩变圆时,立即加入细胞培养液终止消化,移液枪轻轻吹打使基质细胞脱落,而上皮细胞依然贴壁,弃去培养液,清洗培养板2次,加入适量的细胞培养液继续培养,若仍有基质细胞混合生长,重复上述纯化过程得到纯净子宫内膜上皮细胞。
1.2猪子宫内膜上皮细胞培养与分组处理
子宫内膜上皮细胞接种于6孔板,调整细胞浓度至4×105个/孔,加样布板前要缓慢多次吹打。试验分为4组,即对照c组、f-2毒素攻毒组(f-2毒素40μg/ml)、壳聚糖硒1组(1.5μmol/lse+f-2毒素40μg/ml)和壳聚糖硒2组(3μmol/lse+f-2毒素40μg/ml),每组6个重复。细胞接种5d后,弃掉培养液并清洗2次,更换培养液:对照组和f-2毒素攻毒组更换普通培养液;壳聚糖硒1和2组更换含有1.5μmol/l和3μmol/l(以硒计)的壳聚糖硒培养液。继续培养24h后取出细胞培养板,壳聚糖硒1组、壳聚糖硒2组和f-2毒素组均加入f-2毒素,使其浓度为为40μg/ml,继续培养6h后,培养结束。
1.3细胞总rna提取
取出培养板,弃培养液并清洗3次,收集子宫内膜上皮细胞,使用培养细胞/细菌总rna提取试剂盒(rnapreppurecell/bacteriakitrnapreppure)提取总rna,购自天根生化科技有限公司。使用超微量分光光度计检测rna浓度和纯度,od260/od280值应在1.8和2.0之间。置于-80℃冰箱保存备用。
1.4反转录成cdna
样品反转录见1-1,1-2。
表1-1样品rna反转录体系
反应条件:65℃10min,取出置于冰上。
表1-2样品rna反转录体系
反应条件:37℃60min,85℃5min。反转录结束后将上述cdna置于-20℃冰箱保存。
1.5引物设计
猪子宫内膜上皮细胞的β-actin和caspase-3基因的引物,由primer3设计,苏州金唯智生物科技有限公司合成,见表1-3。
表1-3β-actin和caspase3引物序列
1.6qpcr反应
反应体系及反应条件见表1-4、1-5
表1-4qpcr反应体系
表1-5qpcr扩增程序
1.7猪子宫内膜上皮细胞caspase-3基因mrna表达量的测定
猪子宫内膜上皮细胞caspase-3基因mrna表达量的测定结果见图3。
结果显示:40μg/ml的f-2毒素可极显著的升高猪子宫内膜上皮细胞中caspase-3基因的表达量(p<0.01),1.5μmol/l(以硒计)的壳聚糖硒能够降低caspase-3基因的表达量,与f-2攻毒组相比无显著差异(p>0.05);3μmol/l(以硒计)的壳聚糖硒能够极显著的降低f-2毒素所致的猪子宫内膜上皮细胞中caspase-3基因表达量的升高(p<0.01),与对照组无显著差异。
尽管为说明目的公开了本发明的实施例,但是本领域的技术人员可以理解:在不脱离本发明及所附权利要求的精神和范围内,各种替换、变化和修改都是可能的,因此,本发明的范围不局限于实施例和附图所公开的内容。
序列表
<110>天津农学院
<120>壳聚糖硒降低f-2毒素致猪子宫内膜上皮细胞casp3基因表达升高的应用
<160>4
<170>siposequencelisting1.0
<210>1
<211>20
<212>dna
<213>caspase-3引物forward(unknown)
<400>1
acagcacctggttactattc20
<210>2
<211>18
<212>dna
<213>caspase-3引物reverse(unknown)
<400>2
cagttctttcgtgagcat18
<210>3
<211>22
<212>dna
<213>β-actin引物forward(unknown)
<400>3
ccaaggccaaccgtgagaagat22
<210>4
<211>22
<212>dna
<213>β-actin引物reverse(unknown)
<400>4
ccacgttccgtgaggatcttca22
- 还没有人留言评论。精彩留言会获得点赞!