一种基于丙酮酸激酶检测样品中微生物的方法及试剂盒与流程
本发明涉及一种检测样品中微生物的方法及试剂盒,具体是一种基于丙酮酸激酶检测样品中微生物的方法及试剂盒。
技术背景
酶分析是通过测量酶消耗的底物或通过酶催化生产的产物来测定酶的催化活性。典型的酶分析方法包括比色分析法和使用化学发光底物的化学发光测定法。其中比色分析法应用比较广泛,一般常见的比色分析法包括mtt分析法、xgal测定法、等。mtt分析法是一种使用四唑染料为底物的氧化还原的分析方法;xgal测定法为使用x-gal(5-溴-4-氯-3-吲哚基-β-d-半乳糖苷)为底物,来测定β-半乳糖苷酶的活性;荧光测定法是通过测定荧光值以计算相应物质的含量或活性的方法,例如使用4-甲基伞形酮-β-d-半乳糖苷来测定β-半乳糖苷酶的活性。这些分析方法也有一些变化,例如酶耦合分析和荧光猝灭分析或荧光能量转移分析。
酶分析被广泛用于鉴定微生物,即靶微生物的存在可以通过检测某些酶活性的存在来确定。通过特定酶检测的酶分析应用非常多,如疾病诊断,环境监测和发现药物等。自二十世纪六十年代中期起,人们就开始使用atp(三磷酸腺苷作为微生物数量的指标。由于,几乎所有生物均利用atp作为化学能源,而atp可以通过atp驱动的荧光素酶或荧光素来测定,即这种由酶反应产生的光可以用光度检测仪测定,并与存在的atp数量相关,由此来确定样品中微生物的数量。该法主要的优点在于快速灵敏。这种分析方法的检测能力可以检出低至10-12molatp,简单样品几分钟就可以分析完,就算是复杂的样品一般也只要半小时。然而,该方法存在一个重大的缺点,atp容易被细胞新陈代谢消耗掉,其含量高度变化,因此单单通过检测atp的含量,其与相关细胞数的联系不够密切,很多情况下灵敏度不够。因此,仍然需要一种既保持了快速的优点,又易于操作并且更加灵敏的检测方法,以检测样品中微生物或其内容物的方法。
经研究发现,只要把分析的目标由atp换成产生它的酶,就可大幅度提高该基于atp方法的速度和灵敏度。丙酮酸激酶是很多生物体用来将腺苷二磷酸(adp)转变成腺苷三磷酸(atp)的酶,此酶的靶底物优选是adp。且丙酮酸激酶与糖酵解途径有关。它将磷酸烯醇丙酮酸(pep)分子的高能磷酸基团转移给adp生成一分子的atp和一分子的丙酮酸,该反应需要mg2+的参与,且该反应是不可逆的。因此,丙酮酸激酶的活性是通过它自身的底物pep和糖酵解的中间产物果糖1,6-二磷酸来调节的,这两种物质均能提高丙酮酸激酶的活性。而atp、乙酰-coa和丙氨酸都是该酶的别构抑制剂,可以调节反应。有鉴于此,本发明提出与种基于丙酮酸激酶检测样品中是否存在靶微生物的方法,并提供一种试剂盒以便快速实现该检测过程。
技术实现要素:
本发明针对前述的现有atp检测方法存在的问题,目的在于提供一种既快速,又易于操作并且更加灵敏的检测样品中微生物或其内容物的方法。为达到上述目的,本发明提供一种基于丙酮酸激酶检测样品中微生物的方法及试剂盒。具体技术方案如下:
首先本发明提供一种基于丙酮酸激酶检测样品中微生物的方法,包括步骤如下:
s1:裂解处理:采用合适的裂解处理方法,将样品中靶微生物裂解,使其细胞内的物质释放出来,以便于与试剂充分接触。
s2:加入试剂:向经步骤s1裂解处理后的样品中加入含有能通过丙酮酸激酶转化成atp必需组分的第一试剂,和含有用于检测atp的荧光素/荧光素酶系统的第二试剂,制成转化混合液。第一试剂中所述通过丙酮酸激酶转化成atp的必需组分包括pep和adp等,但不包括丙酮酸激酶本身。
s3:温育转化:步骤s2中所述的转化混合液置于室温下(15~30℃)温育数分钟,使加入的adp通过样品靶微生物裂解释放出来的丙酮酸激酶转化成atp,并使该atp被第一试剂中的荧光素/荧光素酶系统所标记。
s4:测定分析:使用光度计测量步骤s3中所转化的atp发出的光信号,记录相对光单位,确定atp的量;并将测定的atp的量与丙酮酸激酶的量联系起来,进而判断样品中是否有靶微生物的存在和/测定样品中靶微生物的数量。
作为优选的技术方案的,前述的基于丙酮酸激酶检测样品中微生物的方法,还包括样品准备工作,在将靶微生物裂解前,采用合适的方法对样品进行处理,以去除样品中干扰测定结果的因素。所述去除干扰的方法包括过滤法或使用体细胞特异性溶解试剂去除样品中的干扰物质,优选将这两种方法结合使用。
作为优选的技术方案的,步骤s1中,所述裂解处理为使用能够裂解靶微生物的裂解缓冲液处理样品;所述裂解缓冲液包括市售的阳离子洗涤剂和专用试剂。
作为优选的技术方案的,步骤s2中,所述第一试剂中的adp选用纯度>99.5%的市售高纯度adp,且该adp在使用前需进一步纯化,以去除其中的atp污染物;所述进一步纯化的方法包括使用柱色谱法或使用atp特异性降解酶,或将该两种方法结合使用。
作为优选的技术方案的,样品中adp的理想的浓度在0.001mm到10mm之间。优选超过0.005mm,更优选超过0.01mm,最优选超过0.05mm。特别优选的adp的量是0.1mm。实际操作中的adp和mg2+的上限可以通过使用已知数量的细菌实验确定。
作为优选的技术方案的,步骤s2中,所述第一试剂中还含有能调节丙酮酸激酶的果糖1,6-二磷酸,以及反应所必须的镁离子,以保证adp是在镁离子充足的条件下进行的;此外,第一试剂中还含有丙酮酸激酶别构抑制剂乙酰-coa,用于调节反应。所述第二试剂,其组分包括荧光素酶、d-荧光素、mgcl2、牛血清蛋白以及缓冲液;所述缓冲液ph值为5.5~8.5;理想的ph值为6~8之间,优选的ph值在7.5左右。合适的缓冲液包括tris和磷酸盐缓冲液,也可以使用这种缓冲液来收集和/或稀释样品,以便于实施本发明。
作为优选的技术方案的,所述第一试剂、第二试剂可以预先混合好,再与处理过的样品混合,直接一步完成经温育转化反应和标记atp,然后进行测定分析。
作为优选的技术方案的,前述的基于丙酮酸激酶检测样品中微生物的方法,还包括区分靶微生物细胞与真菌孢子的步骤,区分靶细胞和那些如真菌孢子的细胞,该步骤通过使用仅能裂解真菌孢子和动物体细胞的非离子型洗涤剂作为对照组,或在品中靶微生物裂解前加入仅能裂解真菌孢子和动物体细胞的非离子型洗涤剂实现。
本发明还提供一种基于丙酮酸激酶检测样品中微生物的试剂盒,该试剂盒包含前述的基于丙酮酸激酶的样品中微生物检测方法所需的第一试剂、第二试剂和裂解缓冲液,所述第一试剂含有通过丙酮酸激酶转成atp所必需的adp、pep和mg2+,所述第二试剂含有检测atp的荧光素/荧光素酶系统,且所述第一试剂和第二试剂作为一种母液试剂提供。
作为优选的技术方案的,所述母液试剂的组分具体包括:异吡唑200mg、bsa100mg、荧光素2mg、dtt100mg、乙酰-coa100mg、mgcl220mg、cacl220mg、荧光素酶2mg、庆大霉素10mg、pep20mg、果糖1,6-二磷酸2mg、adp5mg,以及用于配制体系的去离子水。
作为进一步优选的技术方案的,所述的裂解缓冲液和母液试剂可先混合,再一次性全部加入到样品中,温育后直接进行测定分析。
本发明的有益效果是:
与现有的基于atp检测样品中微生物方法相比,本发明本方法不仅具有atp检测法快速、灵敏的优点,而且本发明方法检测结果更加准确。atp检测法中,由于atp被细胞新陈代谢消耗atp含量高度变化,导致检测结果与相关细胞数联系不够密切。而本发明方法通过将检测的atp量与与样品中靶微生物或相关细胞数联系更紧密的丙酮酸激酶量联系起来,该结果更加可靠,从而弥补了现有基于atp方法的重大缺陷。另外,本发明提供的试剂盒可以快速有效地完成检测,操作比现有的基于atp的方法更加快捷灵敏准确,具有优良的使用价值。
附图说明
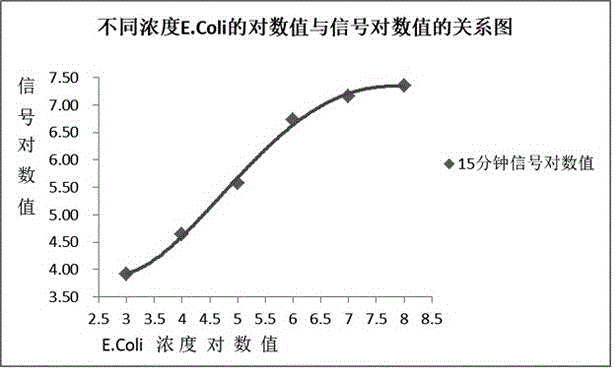
图1为本发明检测大肠杆菌光测试校准曲线图。
具体实施方式
为使本发明的目的、技术方案和优点更加清楚,下面将结合实施例对本发明的技术方案进行清楚、完整地描述。
实施例1
本实施例是一种基于丙酮酸激酶检测样品中微生物的简单方法。本方法主要是通过测量样品中丙酮酸激酶将adp(腺苷二磷酸)转化成atp(三磷酸腺苷)的能力来估测样品中丙酮酸激酶的量,并将该丙酮酸激酶的量与样品中微生物的存在及数量联系起来。该方法还可以用来检测样品中其它细胞内物质的数量。本方法是通过向样品中加入pep和adp实现通过丙酮酸激酶将adp转化成atp,这种转化能力是通过检测转化生成的atp的量来确定的。而生成的atp的量的检测是通过荧光素/荧光素酶系统完成。具体的步骤如下:
s1:裂解处理:采用合适的裂解处理方法,将样品中靶微生物裂解,使其细胞内的物质释放出来,以便于与试剂充分接触。
s2:加入试剂:向经步骤s1裂解处理后的样品中加入含有能通过丙酮酸激酶转化成atp必需组分的第一试剂,和含有用于检测atp的荧光素/荧光素酶系统的第二试剂,制成转化混合液。第一试剂中所述通过丙酮酸激酶转化成atp的必需组分包括pep和adp等,但不包括丙酮酸激酶本身。
s3:温育转化:步骤s2中所述的转化混合液置于室温下(15~30℃),温育数分钟(一般不超过15分钟),使加入的adp通过样品靶微生物裂解释放出来的丙酮酸激酶转化成atp,并使该atp被第一试剂中的荧光素/荧光素酶系统所标记。
s4:测定分析:使用光度计测量步骤s3中所转化的atp发出的光信号,记录相对光单位,确定atp的量;并将测定的atp的量与丙酮酸激酶的量联系起来,进而判断样品中是否有靶微生物的存在和/测定样品中靶微生物的数量。
本实施例中,检测atp使用的荧光素/荧光素酶系统可以提供一种光度学上可测的atp量的指示信号,以确定样品中转化得到的atp量。该用于测定atp的荧光素/荧光素酶制剂和方法是本领域技术人员熟知的,而且可以购买得到。检测atp的一个典型的荧光素/荧光素酶系统配方应包含0.1至10毫克/升的荧光素酶,10到1000微摩尔的d-荧光素,以及其他试剂,例如mgcl2,牛血清蛋白,以及ph为7的缓冲液。以便于实施本发明,合适的缓冲液包括tris和磷酸盐缓冲液。所述缓冲液ph值为5.5~8.5,理想的ph值为6~8之间,优选的ph值在7.5左右。也可以使用这种缓冲液来收集和/或稀释样品。
本领域技术人员应当知晓adp转化为atp需要镁离子的存在。由于所有的细胞某种程度上都存在镁离子,所以加入镁离子并不是必须的,但是加入镁离子可以很明显地优化转化率并且能使反应条件标准化。因此,在不加入镁离子的情况下,样品产生的信号只是和有充足镁离子情况下产生的信号大致相同,所以本实施例中步骤s2中,所述第一试剂中还含有能调节丙酮酸激酶的果糖1,6-二磷酸,以及反应所必须的镁离子,以保证adp是在镁离子充足的条件下进行的,以便于最大程度将adp转化为atp。另外,由于丙酮酸激酶具有别构酶的特性,其自身的底物pep和糖酵解的中间产物果糖1,6-二磷酸均能提高丙酮酸激酶的活性,且adp是别构激活剂,这会导致反应太快,不利于检测。虽然atp是丙酮酸激酶的别构抑制剂,但新生成的atp被荧光素/荧光素酶系统标记而消耗掉,难以平衡整个反应;因此,本实施例所述的第一试剂中还加入了丙酮酸激酶的另一别构抑制剂乙酰-coa,以调节整个反应的速度,使其不至于太快。
同任何放大检测一样,本实施例所述检测方法的灵敏度受试剂纯度的限制。在本实施例中,主要的污染物是adp中的atp和荧光素酶制剂中的丙酮酸激酶。作为用于检测微生物的灵敏度要求高的检测,特别是在靶微生物可能具有潜在危害需要在低量情况下检测时,各种检测用的试剂、反应物以及底物都应有尽可能高的纯度。
为了解决第一个问题,即adp中存在atp污染物的问题,优选的做法是将市售的纯度>99.5%的高纯度adp经进一步纯化后再使用。这是合乎需要的,因为即使很少量的atp污染物也足以导致很高的atp背景含量。adp纯化的方法有很多,例如柱色谱法,可以用二乙基氨基乙基纤维素柱和0.02mm的盐酸洗脱法,由于atp从柱上洗脱下来的速度比adp慢得多,由此基本上可以将两者分离开。也可以用其它的色谱方法,只要介质和洗脱剂组合也可以达到相似的效果。例如,液相色谱法使用的nucleosil柱(technicol,stockportcheshireuk)。采用nucleosil3型柱和nucleosil5型柱,可结合ph值为6的由0.06mm的kh2po4、甲醇、和5mm的四丁基硫酸氢铵组成的洗脱剂,可以将adp和atp分离开。其中,洗脱剂中kh2po4与甲醇的体积比为77:23。洗脱后,将adp/atp高比率的部分物质保留备用。分离纯化后的adp需通过丙酮酸激酶及荧光素/荧光素酶系统测定adp的水平,并在无丙酮酸激酶的条件下测定污染物atp的水平来估测adp的纯度。
从adp中去除atp污染物的另一种方法是使用特异性降解atp的酶,如荧光素酶或三磷酸腺苷双磷酸酶。也可用这些酶进一步纯化已经色谱法纯化过的adp,或者经酶纯化的adp再进一步用柱色谱法纯化。使用三磷酸腺苷双磷酸酶时应注意其也是一种atp降解酶,它对atp的活性更高,但由于adp大量存在,因此不会造成很大的问题。与样品混合的adp量理想的浓度在0.001mm与10mm之间。其下限优选超过0.005mm,更优选超过0.01mm,最优选超过0.05mm。在本实施例中加入的adp的量是0.1mm。样品中的adp和mg2+的上限,可以在不需要过度工作或创造性的条件下,通过使用已知数量的细菌的实验很容易确定。
荧光素酶制剂中的丙酮酸激酶的去除方法是加入一定量adp,利用adp在丙酮酸激酶的作用下转化为atp的反应,以消耗掉残余的丙酮酸激酶,而反应产物atp又会被特异性降解atp的酶,如荧光素酶降解掉,最终获得无丙酮酸激酶活性的荧光素酶试剂。
另外,对于高灵敏度的检测来说,样品的准备也是至关重要的。在本实施例中,样品的准备包括使其达到目标浓度和干扰去除步骤,然后再进入裂解处理步骤(步骤s1)。对于干扰的去除,免疫磁微粒法被广泛应用,该方法也被证明是快速有效的。然而,该方法需要开发物种-特异性抗体或凝集素/糖类,工作量相当大且繁琐。本实施例使用另一种更简单和更快的方法:过滤(包括离心机和真空过滤)。例如去除样品中的体细胞干扰,可以先通过滤膜规格尺寸大于目标微生物细胞但小于体细胞但的过滤器去除,再使用小于目标微生物细胞的过滤器将目标微生物富集在滤膜上用于检测。当然如果,没有干扰因素存在,或不需要去除干扰,可直接采用小于目标微生物细胞的过滤器将目标微生物富集在滤膜上直接用于检测。
此外,为使与靶微生物有关的所有丙酮酸激酶都能接触到加入的pep、adp和荧光素酶/荧光素检测试剂,有必要将微生物裂解以使其细胞内的物质释放出来或使其暴露于试剂中,也就是本实施例中步骤s1所述的裂解处理。该步骤可以通过使用机械手段如超声波发生器实现,也可以通过渗透压打击联合冷休克或溶菌酶这样的试剂使用实现。本实施例使用一种更方便的方法,即通过使用裂解缓冲液来实现这种裂解。
在本实施中,或在向疑有靶微生物的样品中加入adp及荧光素酶/荧光素试剂之前,使用裂解缓冲液将它们裂解,使其细胞内容物可接触到相关试剂。合适的裂解缓冲液可自市售获得,其一般称为“提取剂”。典型的提取剂包括一般的阳离子洗涤剂,如bzk(氯化苯甲烃铵)和ctab(溴化十六烷基三甲基铵);和专用试剂,如enzymatics*atp释放试剂、biotrace*xm提取剂(可得自biotrace,bridgenduk)和lumac*nrm(核苷酸释放试剂,可得自lumacbv,holland)。当使用bzk或ctab时,裂解缓冲液中的bzk或ctab含量为0.01%~1%,例如0.2%,也可选用本领域技术人员可想到的其它浓度。
此外,在一些情况下,样品中可能还存在真菌孢子,或者没有进行去除干扰处理时样品中可能还存在多细胞动物的“体”细胞,这些细胞内也含有干扰物atp,容易导致检测结果有误。如果想区分开靶微生物细胞和真菌孢子或真核细胞时,可以通过如下两种方法实现:
第一种方法是对照检测法,即将样品分成两组,其中一组作为对照组,另外一组作为实验组,去除干扰后分别进行单独的检测。其中,对照组使用仅能裂解这孢子和多细胞动物的“体”细胞的非离子型洗涤剂(如triton*tx-100)处理,实验组用上面详述过的裂解缓冲液裂解所有细胞;然后分别进行转化,检测转化生成的atp,并收集光信号;在通过实验组数据减去对照组的数据获得样品中靶微生物信息。
第二种方法是双次测定法,即将atp分解酶(如三磷酸腺苷双磷酸酶)加到裂解/转化/测定两次测定循环之间,提前将样品中真菌孢子或者体细胞中的atp干扰去除。具体做法是,在样品中先加入仅能裂解这孢子和多细胞动物的“体”细胞的非离子型洗涤剂将孢子和体细胞裂解,然后加入上述的第一试剂转化,然后测定atp的量;之后加入atp分解酶将这些atp全部分解,然后再加入上面详述过的裂解缓冲液裂解所有细胞,再次温育转化测定atp的量。这样孢子和多细胞动物的“体”细胞被先裂解,且其释放出的atp将被atp酶分解,因而降低来自这些孢子和多细胞动物的“体”细胞的atp干扰,确保第二次循环时的atp是新生成的。
另外,对于本实施例所述的基于丙酮酸激酶检测样品中微生物的方法,为了简化该检测,还可以将含有pep、adp的转化试剂(第一试剂)和含有用于测定atp量的荧光素酶/荧光素系统的第二试剂预先混合好,在与处理后的样品混合,同时完成转化和标记反应。或者直接将裂解缓冲液和、第一试剂、第二试剂全部混合在一起,直接一步完成裂解、转化和标记反应。在这种情况下,最好调整裂解缓冲液ph值,以保证丙酮酸激酶和atp标记酶的活性,利于将adp转化为atp,并使atp上的光信号持续发射。合适的ph值可以通过使用常规实验,例如利用含有已知数目细菌的样品实验来决定ph值。由于可以在任何适于丙酮酸激酶反应的ph值的缓冲液里混合样品、pep、adp和镁离子,所以裂解缓冲液的ph值可以调节为5.5~8.5之间,理想的ph值为6~8之间,最好的ph值在7.5左右。其次,在第一试剂与第二试剂混合使用时,裂解缓冲液应该选用最少化抑制测试的丙酮酸激酶活性的种类。比较合适的缓冲液包括tris和磷酸盐缓冲液。这种缓冲液也可以被使用来收集或稀释样品,以便于实施本发明。另外,由于萃取剂的效果在荧光素酶/荧光素系统是很重要的,而阳离子洗涤剂可引起萤光素酶的逐渐失活,因此在第一试剂与第二试剂混合使用时还需要控制阳离子洗涤剂对萤光素酶的影响。已知阴离子洗涤剂和非离子洗涤剂可抑制阳离子洗涤剂导致的萤光素酶失活该反应。为了达到将第一试剂与第二试剂混合使用的目的,经多次实验发现使用0.15%阳离子洗涤剂与0.25%的叔二胺表面活性剂的混合物作为裂解缓冲液是令人满意的,当然本领域的技术人员也可以筛选其它最佳丙酮酸激酶和萤光素酶活性的裂解缓冲液的组合。
实施例2
本实施例是提供一种基于丙酮酸激酶检测样品中微生物的试剂盒。该试剂盒单独含有用于将靶细胞裂解的裂解缓冲液。通常情况下,只需要使用阳离子洗涤剂作为裂解缓冲液用于检测微生物,该裂解缓冲液最好为实施例1中所述的0.15%阳离子洗涤剂与0.25%的叔二胺表面活性剂的混合物。当然,如果样品中存在真菌孢子或真核细胞例如体细胞时,则需要进一步地使用非离子洗涤剂来处理区分开靶微生物细胞和真菌孢子或真核细胞,处理的方法如实施例1中所述的对照检测法和双次测定法,此处不再赘述,所用的非离子洗涤剂也,优选在本试剂盒的提供的范围内,也可以另外准备。
另外,本实施例所述的试剂盒还含有实施实施例1所述检测方法所必需的第一试剂和第二试剂,且第一试剂和第二试剂优选混合在一起,并采用母液形式提供。该母液的组分优选的包括纯度高于99.95%的adp试剂和实质上无丙酮酸激酶活性的荧光素酶试剂,特别优选的包括纯度高于99.99%的pep和adp试剂,镁离子和荧光素酶/荧光素,以及实质上无丙酮酸激酶活性的bsa(牛血清白蛋白)。本实施例试剂盒母液的具体配方如下表(表1)所示:
表1.基于丙酮酸激酶检测样品中微生物的试剂盒中母液配方
注:异吡唑的作用主要是防止真菌污染。
在配制时,将上述配方中的各试剂完全溶解在100ml去离子水中混合后获得母液初液,将该母液初液的ph调节至7.0~8.0,优选调节至7.2~7.4;然后加水使其最终体积为150ml,即获得母液。配制好的母液需贮置于2~8℃温度下过夜,以使荧光素酶消耗掉母液中可能存在的游离的atp污染物,减少污染物背景。然后再将该母液分到小瓶中,优选每瓶0.2ml,然后冻干并储存于-20℃下,备用。
实施例3
本实施例是采用实施例2所述的基于丙酮酸激酶检测样品中微生物的试剂盒结合实施例1所述的基于丙酮酸激酶检测样品中微生物的方法检测样品中的大肠杆菌。具体操作步骤如下:
s1:裂解处理:将10μl含有大肠杆菌的样品和40μl裂解缓冲液(该裂解缓冲液可以为ph=7.5的0.1%苯扎氯铵)加入10×55m的试管中,混合,获得待检测的样品;将该待检测的样品置于室温下孵育2分钟,使大肠杆菌细胞裂解,获得大肠杆菌裂解液,备用。
s2:加入试剂:取实施例2中所述的母液200μl加入到步骤s1中获得的大肠杆菌裂解液中,混合,获得转化混合液。
s3:温育转化:将步骤s2获得转化混合液置于室温条件下(本实施例室温约为20℃)孵育5分钟,使adp完全转化成atp,并使atp完全被母液中含有的荧光素所标记。
s4:测定分析:使用光度计测量步骤s3温育转化后的试管内atp的光信号,光读数记录相对光单位光读数(rlu),确定atp的量;并将atp的量与丙酮酸激酶的量联系起来,进而判断样品中大肠杆菌的存在和数量。
本实施例中,光读数(rlu)和信号的对数值见表2和表3。
表2.检测样品中大肠杆菌的光读数(rlu)数值表
表3.检测样品中大肠杆菌的光读数(rlu)和信号的对数表
对于本实施例,使用光度计测量时,如果样本有很强的光信号则表明样品中存在大肠杆菌。样品中的大肠杆菌越多则光信号越高。另外,本实验可以进一步优化,即将裂解试剂和母液在加入样品之前就混合在一起,再加入含有大肠杆菌的样品中,实现裂解、转化、标记一步完成。
另外,为了方便使用本发明的方法测定未知样品中的微生物的数量,还可以绘制可提供已知微生物数量与光度计读数相关的校准曲线,如图1所示。使用同样的方法测定含有未知数量微生物的读书,并使用校准曲线的发光量来估算大致的微生物的量。
本领域技术人员应知晓特定微生物,例如细菌,中丙酮酸激酶的量,可能与其它微生物中丙酮酸激酶的量不同。例如,由于它们的尺寸,酵母可能包含比细菌更多的丙酮酸激酶。因此,对于特定的微生物,可能需要特定的校准曲线,并且对于同一微生物的不同状态,例如,对于虚弱的,ph值应激或氧应激的微生物,可能也需要使用不同的校准曲线。本方法与现有基于atp的方法相比,最重要的优点在于与高度变化的被细胞新陈代谢消耗的atp含量相比,丙酮酸激酶与相关细胞数更紧密地相连。
对于本领域技术人员而言,显然本发明不限于上述示范性实施例的细节,而且在不背离本发明的精神或基本特征的情况下,能够以其他的具体形式实现本发明。因此,无论从哪一点来看,均应将实施例看作是示范性的,而且是非限制性的。此外,应当理解,虽然本说明书按照实施方式加以描述,但并非只包含一个的技术方案,说明书的这种叙述方式仅仅是为清楚起见,本领域技术人员应当将说明书作为一个整体,实施例中的技术方案也可以经适当组合,形成本领域技术人员可以理解的其他实施方式。
- 还没有人留言评论。精彩留言会获得点赞!