一种具有谷胱甘肽响应性的纳米载药体系及其制备方法和应用与流程
本发明属于生物医用材料技术领域。更具体地,涉及一种具有谷胱甘肽响应性的纳米载药体系及其制备方法和应用。
背景技术:
近年来,恶性肿瘤成为威胁人们身心健康的重大疾病,并呈明显上升趋势,对人类健康造成极大的影响。化疗是肿瘤学中最常用的治疗方法之一,化疗效果的好坏在很大程度上取决于是否有足够的浓度化疗药物到达整个肿瘤部位。常规的抗癌药物制剂由于其水溶性差和选择性差,常导致不令人满意的治疗效果和严重的毒副作用,如在全身循环中被快速清除并且对癌细胞和健康细胞具有相似的细胞毒性。
多西紫杉醇(dtx)便是众多化疗制剂的一种,是一种在临床上应用较广的细胞周期非特异性一线抗肿瘤化疗药物,用于治疗各种癌症,如乳腺癌、头颈癌、胃癌、前列腺癌和非小细胞肺癌等。dtx是一种抗有丝分裂化疗剂,通过促进微管稳定化,导致g2/m期细胞周期停滞,并进一步导致癌细胞凋亡。但多西紫杉醇治疗肿瘤的同时会导致多种不良反应,包括过敏反应,骨髓抑制,皮肤反应,液体潴留,周围神经病变,脱发,心脏疾病和疲倦等副作用。dtx需要特定的溶剂系统,例如乙醇和吐温80的溶液,但这种溶剂体系会导致过敏、肿瘤组织摄取不佳、以及身体副作用等。因此,寻求一种方法来增加dtx的体内循环时间、在保证对肿瘤细胞杀伤作用的同时降低药物对正常细胞的毒性成为关键瓶颈。
纳米递送系统依赖于实体瘤的高通透性和滞留效应(epr)来改善药代动力学特征和靶位点积累,有望彻底改变肿瘤的诊断和治疗。在医用高分子迅速发展的当下,在提高医用高分子生物相容性的基础上实现其多重功能性是生物材料追求的目标。近年来,文献中报道了许多不同的天然聚合物材料,尤其是氨基酸,过去几十年见证了基于氨基酸的纳米载体的蓬勃发展,由于其合成聚合物的优越性,如结构的可调性和良好的生物相容性,以及各种活性基团,如巯基(-sh)、氨基(-nh2)和羧基(-cooh),为开发靶向纳米药物递送系统提供了较大的机会。目前,急需开发一个生物相容好、多功能性和可生物降解的氨基酸聚合物纳米载体库,来降低疾病风险,改善人类健康。
近年来,基于氨基酸已经合成了许多聚酯酰胺共聚物(二嵌段或多嵌段共聚),但它们都是基于一种氨基酸与二醇、二酸(或二元酰氯)反应形成共聚物,很难制备出具有多功能性的聚合物纳米载体。如申请号为cn201310284253.1的中国发明专利,公开了一种聚酯酰胺与聚乙二醇嵌段共聚物及其制备方法。通过将具有氨基酸单元结构的聚酯酰胺与分子链末端带有氨基的聚乙二醇进行缩合反应,得到具有两亲性特性的三嵌段或多嵌段共聚物。该类嵌段共聚物具有良好的生物相容性和生物可降解性,适用于制备包载油溶性药物的纳米颗粒。然而该共聚物递药体系虽然改善了肿瘤药物的水溶性,但是存在不能将包载的抗肿瘤药物快速释放至肿瘤细胞的缺陷,在血液长循环过程中稳定性较差,并且在循环过程中不能高效进入肿瘤细胞。
技术实现要素:
本发明要解决的技术问题是针对上述抗肿瘤药物递送中的问题,提供一种适用于抗肿瘤药物递送的具有谷胱甘肽响应性的纳米载药体系。本发明从机体内大量存在的含二硫键的胱氨酸、脂肪二酸及脂肪二醇出发,合成基于胱氨酸和苯丙氨酸的新型生物相容性高、生物可降解、且具有氧化还原响应性的功能性高分子,实现以dtx为代表的疏水性抗肿瘤药物的高效传递、以及其在肿瘤细胞内的定位可控释放。该纳米载药体系具有很好的生物安全性、生物可降解性和长循环稳定性,具备高效肿瘤靶向和高效抑制肿瘤细胞生长的特点,可有效解决纳米药物载体的溶解性差、靶向性差、响应性不好、释放速度慢和体循环稳定性较差的问题。
本发明的第一个目的是提供一种具有谷胱甘肽响应性的聚酯酰胺聚合物(pea)的制备方法。
本发明的第二个目的是提供上述聚酯酰胺聚合物(pea)在作为或制备抗肿瘤药物载体中的应用。
本发明的第三个目的是提供一种谷胱甘肽响应型药物输送载体的制备方法。
本发明的第四个目的是提供一种基于上述聚酯酰胺聚合物的、具有谷胱甘肽响应性的纳米载药体系。
本发明的第五个目的是提供一种用于抗肿瘤药物递送的纳米递药体系的制备方法。
本发明上述目的通过以下技术方案实现:
一种具有谷胱甘肽响应性的聚酯酰胺聚合物pea的制备方法,包括以下步骤:
s1.将苯丙氨酸或其盐、二元醇和对甲苯磺酸于溶剂中,在回流条件下反应,得到接枝聚合物phe-6;
s2.将胱氨酸或半胱氨酸或其衍生物与上述聚合物phe-6溶于氯仿后,加入三乙胺,冰水浴条件下搅拌15~120min,得到混合溶液;用氯仿稀释后的等摩尔的二元酰氯滴加至上述混合溶液中,酰胺反应10~120min,得到具有谷胱甘肽响应性的聚酯酰胺聚合物pea。
本发明从机体内大量存在的含二硫键的胱氨酸、脂肪二酸及脂肪二醇出发,合成基于胱氨酸和苯丙氨酸的新型生物相容性高、生物可降解、且具有氧化还原响应性的功能性高分子聚酯酰胺聚合物pea,同时改善了药物的溶解性,极大的提高了疏水药物的可利用性,还可以大大提高纳米粒在血液中的循环时间,从而提高肿瘤部位的药物聚积。另外,肿瘤组织具有不同于正常组织的微环境,与正常细胞相比,谷胱甘肽(gsh)在肿瘤细胞内的浓度约为2~20mm,是正常细胞的500到1000倍。本发明利用半胱氨酸的硫醇基团(-sh)和胱氨酸的二硫键赋予聚酯酰胺聚合物pea新的gsh响应特性,肿瘤细胞质中高浓度的gsh迅速裂解二硫键,可使包载肿瘤药物的聚酯酰胺聚合物pea纳米颗粒迅速崩解,从而引发药物的快速释放至肿瘤细胞,并且随后可高效诱导肿瘤细胞凋亡。同时,本发明将具有较好疏水性的l-苯丙氨酸片段聚合到聚合物pea,使聚合物pea载体将肿瘤药物分子直接导入癌瘤区,大大增强了靶向性。这样既可以抑制癌瘤生长,又可以降低药物的毒副作用。
在本发明较佳的实施例中,所述聚合物pea的聚合度是2~60,分子量范围在2000~51000。聚合物pea的聚合度和分子量会影响gsh响应特性的强弱及其自组装成纳米粒子时的粒径大小等。当聚合物pea的聚合度是2~60,分子量范围在2000~51000时,gsh响应特性最强且其自组装成纳米粒子时粒径均一、尺寸合适,能充分发挥载药纳米粒的epr效应及gsh响应性,大大增强抗肿瘤效果8。
在本发明较佳的实施例中,s2所述聚合物phe-6与胱氨酸的摩尔比为9:1~1:9;优选为1~6:1,如1:1、2:1、3:1、4:1、5:1、6:1等。当反应原料为半胱氨酸时,聚合物phe-6与半胱氨酸盐的摩尔比是上述聚合物phe-6与胱氨酸的摩尔比的2倍。聚合物phe-6与胱氨酸的摩尔比会显著影响合成的聚合物pea的产率、稳定性及gsh响应特性,实验发现聚合物phe-6与胱氨酸盐的摩尔比为9:1~1:9,优选为1~6:1时,聚合物pea的产率较高、稳定性高,且具有显著的gsh响应特性,在肿瘤细胞质中高浓度的gsh条件下可迅速裂解二硫键,从而使聚合物pea载药纳米粒迅速崩解释药。
本发明中,半胱氨酸选自l-半胱氨酸、d-半胱氨酸或l,d-半胱氨酸。另外,反应原料除可以选择胱氨酸、半胱氨酸外,也可以选择其他胱氨酸衍生物、半胱氨酸衍生物等。其中,半胱氨酸衍生物为半胱氨酸、高半胱氨酸、甲基半胱氨酸、半胱氨酸盐酸盐、半胱氨酸硫酸盐中的一种或多种。胱氨酸盐可选自盐酸盐或硫酸盐。本发明中,反应原料苯丙氨酸也可以选择其他苯丙氨酸盐,如苯丙氨酸盐酸盐、苯丙氨酸锂、苯丙氨酸钠、苯丙氨酸钾或苯丙氨酸铷等。
在本发明较佳的实施例中,s2所述二元酰氯用氯仿稀释大于或等于10倍,以防止加入高浓度二元酰氯,会剧烈反应产生较多黑褐色的副产物,致使产物产率和纯度较低,纳米粒稳定性较差。
在本发明较佳的实施例中,s1所述苯丙氨酸、二元醇和对甲苯磺酸的摩尔比为2~4:1:1~3,优选为2~3:1:2~3;更优选为2.2:1:2.6。
在本发明较佳的实施例中,所述二元醇选自1,4-丁二醇、1,6-己二醇、1,8-辛二醇或1,10-癸二醇中的一种或几种;所述二元酰氯选自己二酰氯、乙二酰氯、丁二酰氯或辛二酰氯中的一种或几种。
在本发明较佳的实施例中,s1得到phe-6后,将其倒入沸水中搅拌溶解,以除去未反应的溶剂,之后将产物置于0~10℃条件下沉淀,滤去未反应单体,重复3~4次,50~100℃真空干燥12~24h,得到白色粉末状接枝聚合物(phe-6),在保证不减少聚合物得率的同时,进一步提高聚合物phe-6的纯度和稳定性。
在本发明较佳的实施例中,s2得到聚酯酰胺pea后,将其滴加至沸水浴中搅拌以除去氯仿和未反应的二元酰氯,重复3~4次后,50~100℃真空干燥12~24h,在保证不减少聚合物得率的同时,进一步提高聚酯酰胺pea的纯度和稳定性。
在本发明较佳的实施例中,s1所述回流条件为:120~140℃磁力搅拌回流24~36h。聚合物pea在制备过程需严格控制反应条件,回流温度和回流时间显著影响获得的聚合材料的性能效果,如果回流温度过高或时间过久,材料内部的功能键生成速率加快,会造成其分子量分布变宽,从而得到的产品稳定性能会下降;而回流温度过低或时间过短,造成其内部不能形成足够且有效的功能结构,进而影响其递药及释药性能。
在本发明较佳的实施例中,s1所述溶剂选自甲苯和/或苯中的一种或几种。该反应需在无水条件下进行,水的存在会与二酰氯反应,使产率降低。
在本发明较佳的实施例中,s2二元酰氯的加入量是聚合物phe-6与胱氨酸盐摩尔量之和。如果二元酰氯的加入量过高,则会产生较多副产物,致使产物产率和纯度较低,纳米粒稳定性较差。
在本发明较佳的实施例中,s2所述冰水浴条件为:0~4℃。该反应需在冰水浴中进行,温度过高会使反应过于剧烈而产生较多副产物。
本发明还涉及了上述方法制得的聚酯酰胺聚合物pea在作为或制备中抗肿瘤药物纳米递送载体中的应用。
本发明还涉及了一种谷胱甘肽响应型药物输送载体的制备方法,包括以下步骤:
将上述方法制得的聚合物pea溶于有机溶剂中,得到pea溶液;再在搅拌条件下,将pea溶液滴加至含有稳定剂的水溶液中,使其自组装成纳米粒;其中,pea溶液的浓度为10~50mg/ml;或者,将上述方法制得的聚合物pea与稳定剂均溶解于有机溶剂中,将得到的混合溶液滴加至水中自组装成纳米粒,即可。
在本发明较佳的实施例中,所述稳定剂的质量为聚合物pea质量的0~75%,优选为15%~30%。
在其中一些实施例中,所述稳定剂为dspe-peg,优选为dspe-peg2000。
本发明还涉及了一种具有谷胱甘肽响应性的纳米载药体系,包括上述方法制得的聚合物pea、以及抗肿瘤药物。
本发明还涉及了所述具有谷胱甘肽响应性的纳米载药体系的制备方法,包括以下步骤:
将抗肿瘤药物、上述方法制得的聚合物pea分别溶于有机溶剂中,分别配成浓度为5~60mg/ml的溶液;再在搅拌条件下,将pea和抗肿瘤药物溶液分别滴加至含有稳定剂的水溶液中,使其自组装成载药纳米粒;或者,上述方法制得的聚合物pea、抗肿瘤药物以及稳定剂均溶解于有机溶剂中,聚合物pea与抗肿瘤药物的质量比为1:0.05~0.50,将得到的混合溶液滴加至水中自组装成载药纳米粒。
该纳米递药体系所需原料易得,制备工艺纯熟,易于操作,不需要昂贵的仪器,且制备的纳米复合物尺寸适中、生物相容性好,不仅实现了疏水药物的可控载药,改善了药物的溶解性,极大的提高了疏水药物的可利用性,还可以大大提高纳米粒在血液中的循环时间,从而提高肿瘤部位的药物聚积,提高治疗效果。
在其中一些实施例中,所述聚合物pea与抗肿瘤药物的质量比为1:0.08~0.25,优选为1:0.3。聚合物pea和抗肿瘤药物的质量比过大,则载药量较低,所成纳米粒粒子数较少,过小则包封率较小,造成药物的浪费,并且所得纳米粒不稳定,易沉淀。
在本发明较佳的实施例中,所述有机溶剂选自二甲基亚砜(dmso)、n,n-二甲基甲酰胺(dmf)或四氢呋喃(thf)中的一种或多种;优选为二甲基亚砜(dmso)。
在本发明较佳的实施例中,所述稳定剂的质量为聚合物pea和抗肿瘤药物总质量的15%~30%。
在本发明较佳的实施例中,所述抗肿瘤药物和聚合物pea的浓度优选为20~50mg/ml。
在本发明中,所述载药纳米粒的粒径为60~200nm。本发明载药纳米粒的粒径在200nm以下,拥有较高的比表面积,载药量高,是优良的载药体系,可增强药物的疗效;而且该载药纳米粒能够利用epr效应增强药物在肿瘤部位的靶向性。
在本发明较佳的实施例中,将上述所得载药纳米粒溶液置于截留分子量(mwco=100kd)的超滤管中,3000~8000rpm超滤15~25min后,用超纯水洗涤后再超滤,重复2~3次,以除去未包封的dtx并使有机溶剂含量在千分之一以下,得到纯化后的载药纳米粒。
在本发明中,对所载的抗肿瘤药物没有特殊限制,所载的药物包括亲水性药物和疏水性药物。其中,所述亲水性药物包括但不限于盐酸阿霉素、盐酸吉西他滨、盐酸伊立替康、氟尿嘧啶或香菇多糖等药物。所述疏水性药物包括但不限于紫杉醇(ptx)、多西紫杉醇、甲氨蝶呤、喜树碱、阿霉素、姜黄素等药物。
不同的聚合物结构对于载药和递送性能有不同程度的影响。本发明所制备的纳米递药体系中,充分将肿瘤细胞微环境、聚合物的结构、功能域和亲疏水性等因素考虑在内,通过控制制备条件来调整聚酯酰胺载体材料的物理化学性质,结合肿瘤细胞特殊微环境,制备出粒径合适、亲水性适宜、具有高谷胱甘肽响应性的、生物可降解聚酯酰胺高分子载体(聚酯酰胺聚合物pea),再与疏水性抗癌药物复合形成纳米结构,可以实现抗癌药物的高效负载和可控释放,表现出良好的生物安全性,体内循环稳定性好,同时由于本发明载药纳米颗粒具有谷胱甘肽(gsh)响应性,其在肿瘤细胞高浓度谷胱甘肽(gsh)存在下,二硫键迅速断裂,可导致聚合物纳米粒的快速崩解和包载药物的迅速释放,增强了肿瘤细胞对于抗癌药物的利用,使得正常细胞在不同程度上对其相对摄取率较小,其从而在增强肿瘤细胞杀伤作用的同时,达到降低化疗药物对正常组织毒性的目的。
与现有技术相比,本发明具有以下有益效果:
本发明材料来源于生物相容性好的氨基酸,安全性有保障;制备方法简单,聚酯酰胺聚合物pea抗肿瘤递药体系改善了药物的溶解性,极大的提高了疏水药物的可利用性,还可以大大提高纳米粒在血液中的循环时间,从而提高肿瘤部位的药物聚积,并且载药量高,谷胱甘肽响应性高,绿色安全,易于实现;降低了化疗药物对正常组织的毒性,拓宽了其在抗肿瘤方面的应用范围。
附图说明
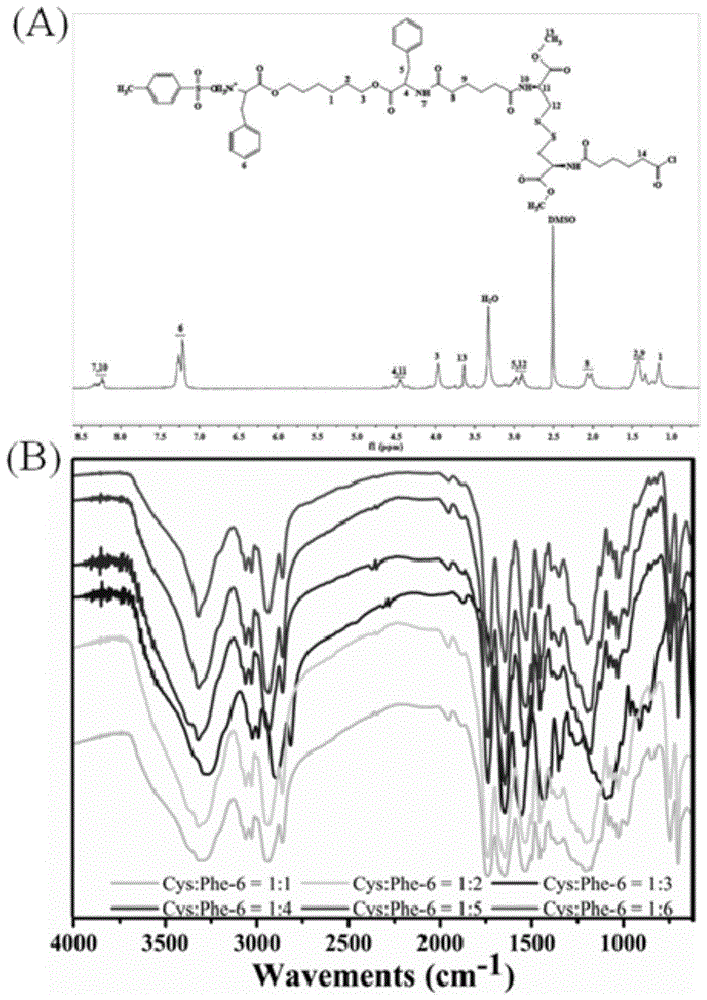
图1为实施例1制备的聚合物pea的表征:其中a为聚合物pea核磁氢谱解析;b为聚合物pea红外光谱解析图。
图2为实施例2制备的pea纳米粒(谷胱甘肽响应型药物输送载体)的物理性质表征:纳米载体粒经分布及透射电镜图。
图3为实施例2制备的pea纳米粒(谷胱甘肽响应型药物输送载体)的生物相容性表征;其中(a)为材料对细胞的毒性实验;(b)为溶血实验。
图4为实施例2和3制备的pea纳米粒和载药纳米粒的pea@dtx的氧化还原响应性表征;其中(a)为利用循环伏安法测定载体的氧化还原电位变化;(b)为纳米药物载体在不同条件下的释放曲线。
图5为实施例3制备得到的载药纳米粒的pea@dtx作用于ct26细胞的凋亡结果图。
图6为实施例3制备得到的载药纳米粒pea@dtx对ct26肿瘤小鼠的抑瘤效果。
具体实施方式
以下结合说明书附图和具体实施例(以胱氨酸为代表)来进一步说明本发明,但实施例并不对本发明做任何形式的限定。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。
除非特别说明,以下实施例所用试剂和材料均为市购。
实施例1一种具有谷胱甘肽响应性的聚酯酰胺聚合物pea的制备
1、一种具有谷胱甘肽响应性的聚酯酰胺聚合物pea的制备方法,包括以下步骤:
(1)称取54.5g苯丙氨酸、17.7g1,6-己二醇和68.49g对甲苯磺酸混溶于500ml含甲苯的烧瓶中,140℃磁力搅拌回流24h,其中苯丙氨酸与1,6-己二醇和对甲苯磺酸的摩尔比为:2.2:1:2.6;
(2)将反应所得固体产物倒入沸水中磁力搅拌使其溶解,以除去未反应的苯溶剂,之后将产物置于4℃冰箱以沉淀出产物,滤去未反应苯丙氨酸单体及对甲苯磺酸,重复3次,真空干燥1d,得到白色粉末状接枝聚合物(phe-6);
(3)将所得接枝聚合物(phe-6)与胱氨酸(cys)溶于氯仿之后,加入一定量的三乙胺,冰水浴条件下快速搅拌30min使其充分混合,该条件下将用氯仿稀释后的等摩尔的己二酰氯缓慢滴加至上述溶液反应15min;其中,cys与phe-6的摩尔比分别为1:1、1:2、1:3、1:4、1:5、1:6、1:9、9:1、8:1、7:1、6:1、5:1、4:1、3:1、2:1;且己二酰氯的加入量是phe-6与cys摩尔量之和;
(4)将反应所得聚酯酰胺粗产物缓慢滴加至沸水浴,快速搅拌以除去氯仿和未反应的己二酰氯,重复3次,真空干燥1d,即可得到一系列具有谷胱甘肽响应性的聚酯酰胺聚合物pea。
2、结果
本实施例利用400m超导核磁共振波谱仪(ascendtm400)和布鲁克红外光谱仪(vertex70)表征实施例1制备的聚合物pea的结构。
如图1所示,图1的(a)图中1.5and2.0ppm处的峰对应己二酰氯上面的氢的峰;3.0and3.65ppm则是胱氨酸二甲酯二盐酸盐上的氢的峰,而7.2ppm处的峰则对应于苯环上的氢,核磁氢谱表明该聚合物则有这三种单体构成。进一步的结构信息则由红外表征,见图1的(b)图(图中谨以cys:phe-6=1:1、1:2、1:3、1:4、1:5和1:6为代表进行表征,图中未显示cys:phe-6=1:9、9:1、8:1、7:1、6:1、5:1、4:1、3:1、2:1的结果),将合成的聚合物(cys:phe-6=1:1、1:2、1:3、1:4、1:5和1:6)进行红外测试,3317-3454cm-1左右为聚合物酰胺键中n-h的伸缩振动,3317cm-1是聚合物酰胺中的仲胺峰;3000-3100cm-1,1455cm-1以及700cm-1为phe-6中苯环的特征吸收峰;而1735cm-1和1200cm-1分别为酯键上c=o和c-o-c伸缩振动;1648cm-1和1535cm-1分别为酰胺ⅰ和酰胺ⅱ吸收带其具有相同的吸收峰,说明合成的为同一种物质。以上结果表明聚合物pea被成功合成。
另外,当cys与phe-6的摩尔比为1~9:1~9时,所得聚合物pea结构稳定,综合性能较好;其中,当cys与phe-6的摩尔比为1:1~6时,制备得到的聚合物pea结构稳定、其生物相容性更好,能包载不同亲疏水性的药物,所制备的聚酯酰胺具有粒径小、稳定性高的特征;并且聚合物pea具有高gsh快速还原响应性,在作为肿瘤药物传递载体方面具有良好应用前景。
本实施例聚酯酰胺聚合物pea的聚合度为2~60;分子量为2000~51000。
本实施例聚酯酰胺聚合物pea在制备过程需严格控制反应条件,聚合物(phe-6)与胱氨酸(cys)溶于氯仿之后,加入一定量的三乙胺,磁力搅拌一定时间使其充分混匀,不溶物需过滤除去。二元酰氯加入前需用氯仿稀释至少10倍后缓慢滴加至上述溶液,以防止高浓度二元酰氯加入会剧烈反应产生较多副产物(黑褐色),致使产物产率和纯度较低,纳米粒稳定性较差。反应需在冰水浴中进行,温度过高会使反应过于剧烈而产生较多副产物。此外,反应需在无水条件下进行,水的存在会与二元酰氯反应,使产率降低。
实施例2一种具有谷胱甘肽响应性的聚酯酰胺聚合物pea纳米粒(即谷胱甘肽响应型药物输送载体)的制备
1、其制备过程包括以下步骤:
(1)将实施例1制备得到的不同的聚酯酰胺聚合物pea溶于dmso中,配成50mg/ml的溶液;另外,以dspe-peg2000为表面稳定剂,将dspe-peg2000溶于水中,配成浓度为0.5mg/ml的溶液,备用;
(2)将上述pea油相在1000rpm转速下缓慢滴加至含有dspe-peg2000的水溶液中,该复合物在水溶液中通过纳米沉淀法自组装形成纳米体系,其中dspe-peg2000的质量为pea质量的30%;
(3)将所得纳米粒溶液置于截留分子量(mwco=100kd)的超滤管中,3000rpm超滤2次,每次15min,使dmso含量在千分之一以下,最后得到pea纳米粒。
2、结果
(1)利用纳米粒经仪和透射电镜进行表征,结果如图2所示,所制得的纳米粒子粒径100nm,呈类圆形,大小相对均一。
(2)此外,如图3所示,对该纳米粒子进行细毒性实验和溶血实验,表明该纳米粒子具有较好的生物相容性,所制备的纳米粒用作药物载体具有较好的应用前景。图3表明所制备的纳米粒子具有较好的生物相容性,能够用于动物体内。
(3)图4中(a)图利用循环伏安法测定载体的氧化还原电位变化,其氧化还原电位随着胱氨酸比例增加而增加,由此说明胱氨酸的引入可引起载体氧化还原电位的变化,从而说明该反应保留了胱氨酸的活性。从侧面说明该纳米粒子具有氧化还原响应性,制备过程并未影响胱氨酸的活性。
实施例3一种具有谷胱甘肽响应性的聚酯酰胺聚合物pea纳米粒(即谷胱甘肽响应型药物输送载体)的制备
其他条件与实施例2相同,将聚酯酰胺聚合物pea溶解于n,n-二甲基甲酰胺(dmf)中,并控制聚酯酰胺聚合物pea的浓度分别为5mg/ml、10mg/ml、60mg/ml,最后得到的聚酯酰胺聚合物pea纳米粒具有gsh响应性,在高浓度gsh条件下(肿瘤部位)可快速释放药物。
实施例4一种具有谷胱甘肽响应性的聚合物纳米载药体系的制备
1、其制备过程包括以下步骤:
(1)将dtx、实施例1制备得到的不同的聚酯酰胺聚合物pea分别溶于dmso中,配成相同浓度的溶液(50mg/ml);以dspe-peg2000为表面稳定剂,将dspe-peg2000溶于水中,配成浓度为0.5mg/ml的溶液,备用;
(2)将等浓度两种溶液,按照聚合物pea与抗肿瘤药物的质量比为1:0.05、1:0.08、1:0.25、1:0.50不同比例混合后,在1000rpm转速下缓慢滴加至含有dspe-peg2000的水溶液中,该复合物在水溶液中通过纳米沉淀法自组装形成纳米体系,其中dspe-peg2000质量为pea质量的30%;
(3)将所得纳米粒溶液置于截留分子量(mwco=100kd)的超滤管中,3000rpm超滤2次,每次15min,以除去未包封的dtx并使dmso含量在千分之一以下,最后得到pea@dtxnps载药纳米粒。
2、结果
(1)图4中(b)图为纳米药物载体释放曲线,如图4中(b)图所示,随着gsh浓度的升高,药物释放变快,药物累计释放量增大。说明本发明的载药纳米粒子具有明显的gsh响应性,在高浓度gsh条件下(肿瘤部位)快速释放药物,这有利于其发挥抗肿瘤作用,同时降低毒副作用。
(2)在聚酯酰胺聚合物pea和其他条件相同的条件下,以聚酯酰胺聚合物pea与dtx的质量比为单变量,考察发现随着聚合物材料和dtx质量比对纳米粒稳定性、载药量有显著影响,当dtx含量逐渐增加时,载药量先是增加后逐渐降低且纳米粒稳定性下降,聚合物和dtx质量比为1:0.3时较好。本发明所制备的纳米载药体系具有载药量高、肿瘤微环境响应性以及能够通过epr效应聚集在肿瘤部位并进入肿瘤细胞诱导其凋亡的能力;能够明显降低化疗药物的毒副作用并提高抗肿瘤效果。
实施例5一种具有谷胱甘肽响应性的聚合物纳米载药体系的制备
其制备过程包括以下步骤:
(1)将盐酸阿霉素、实施例1制备得到的聚酯酰胺聚合物pea(cys与phe-6的摩尔比分别为1:1)、表面稳定剂dspe-peg2000均溶于dmso中,得到混合溶液;控制聚合物pea与抗肿瘤药物的质量比为1:0.25;其中dspe-peg2000质量为pea质量的15%;
(2)在1000rpm转速下,将上述混合溶液缓慢滴加至水中自组装成载药纳米粒;
(3)将所得纳米粒溶液置于截留分子量(mwco=100kd)的超滤管中,3000rpm超滤2次,每次15min,以除去未包封的dtx并使dmso含量在千分之一以下,最后得到负载有盐酸阿霉素的载药纳米粒。
实施例6载药纳米粒pea@dtx的抗肿瘤效果评价
(1)对实施例4制备得到的纳米载药体系对小鼠结肠癌(ct26)细胞进行细胞作用评价,图5为载药纳米粒的pea@dtx诱导ct26细胞凋亡的图,与游离dtx相比,载药纳米粒pea@dtx诱导ct26细胞调亡的能力更强。
(2)对实施例4制备得到的纳米载药体系进行体内抗肿瘤作用评价。体内抑瘤效果如图6所示载药纳米粒子具有更好的抑瘤效果,本发明制备的纳米载药体系在肿瘤治疗领域有一定的应用潜力。
上述结果说明,本发明基于具有谷胱甘肽响应性的胱氨酸和具有生理活性的疏水性苯丙氨酸与二醇和酰氯反应制备具有不同化学结构且具有两亲性特性嵌段共聚物。该共聚物兼有gsh响应性和较好的疏水性,在提高载药量和延长血液循环时间的同时,可将抗癌药物分子直接导入癌瘤区且在癌症部位能够快速释放药物,达到快速抑制癌瘤生长,又可以降低药物毒副作用的目的。
上述实施例中,所述抗肿瘤药物除可以选择多西紫杉醇、盐酸阿霉素外,也可以选择喜树碱、盐酸吉西他滨、盐酸伊立替康、氟尿嘧啶或香菇多糖、姜黄素等抗肿瘤药物,亦得到相同的结果。实际应用中,可根据具体的癌症类型选择相应的抗肿瘤药物与聚合物pea按照本发明的方法合成纳米递药体系,增强抗肿瘤药物的治疗效果的有效性、可控性和安全性。
申请人声明,以上具体实施方式为便于理解本发明而说明的较佳实施例,但本发明并不局限于上述实施例,即不意味着本发明必须依赖上述实施例才能实施。所属技术领域的技术人员应该明了,对本发明的任何改进,对本发明所选用原料的等效替换及辅助成分的添加、具体方式的选择等,均落在本发明的保护范围和公开范围之内。
- 还没有人留言评论。精彩留言会获得点赞!