一种新型GDSL家族脂类水解酶EII-3及其编码基因与应用的制作方法
本发明属于基因工程领域,具体涉及一种海洋细菌来源新型耐金属离子gdsl家族水解酶、其编码基因及其应用。
背景技术:
sgnh家族水解酶是一类在4个保守序列区中含有4个严格保守的催化残基丝氨酸、甘氨酸、天冬酰胺和组氨酸的水解酶。sgnh家族水解酶广泛存在于真核和原核生物中,具有脂肪酶、蛋白酶、硫酯酶、芳香酯酶、溶血磷脂酶、碳水化合物酯酶、酰基转移酶等多种活性,是具有广泛底物谱的一类水解酶,可参与细菌毒力和植物生长发育、形态发生以及防御等多种生理功能。广泛底物谱和功能多样性使该家族水解酶具有广泛的潜在应用价值,成为国内外研究热点。
目前已报道的sgnh家族水解酶多来源于真核生物,细菌来源的该家族水解酶较少,功能也不明确。海洋是一个巨大的微生物资源宝库,海洋来源的水解酶通常具有与海洋环境相关的优良性质,例如温度稳定性、耐盐性、耐碱性、耐低温、以及优异的手性选择性等等,因此,从海洋微生物中筛选出独具特性的水解酶就成了开发新型工业酶制剂的一个重要方向。
gdsl酯酶和脂肪酶是一类具有广泛底物特异性和区域特异性的水解酶。它们对医药、食品、生物化学以及重要酯类化合物的水解和合成具有潜在的应用价值。这一家族的脂类水解酶的活性中心为一段gly-asp-ser-leu氨基酸序列,不同于其他家族的gly-xaa-ser-xaa-gly序列,其活性位点比其他脂类水解酶更靠近肽链的n端。研究表明,gdsl水解酶有一个灵活的活性位点,随着不同底物的存在和结合,构象发生变化,这与koshland提出的诱导拟合机制非常相似。
目前已报道的gdsl家族水解酶多来源于真核生物,细菌来源的该家族水解酶较少,功能也不明确。海洋是一个巨大的微生物资源宝库,海洋来源的水解酶通常具有与海洋环境相关的优良性质,例如温度稳定性、耐盐性、耐碱性、耐低温、以及优异的手性选择性等等,因此,从海洋微生物中筛选出独具特性的水解酶就成了开发新型工业酶制剂的一个重要方向。
本发明从一种海洋细菌中筛选到一种新型gdsl家族水解酶基因,并对该基因进行了重组表达,重组酶具有耐金属离子及有机溶剂、ph范围广等特点,可用于精细化工、制药、洗涤、废水处理和环境修复等工业领域。
技术实现要素:
本发明的目的是提供一种新的海洋细菌来源水解酶、其编码基因及其制备方法,该水解酶可用于含金属离子及有机溶剂的条件下酯类降解及其他酯类化合物的生物催化和转化。
本发明涉及具有水解酶活性的分离的多肽,其选自下组:
(a)多肽,其与seqidno:2的多肽所示序列一致;或
(b)多肽,其为seqidno:2所示多肽的远离催化中心位置进行各种取代、添加和/或缺失一个或几个氨基酸得到的突变体,该突变体具有与seqidno:2所示的蛋白序列至少90%以上的同源性及至少90%以上的酶活性,所述的催化中心为seqidno:2所示的56-59、207和210氨基酸位置。
本发明所述的具有水解酶活性的多肽,其来源于韩国潮滩表层的细菌altererythrobactergangjinensis。该菌株购买于日本微生物菌种保藏中心。
本发明针对分离自韩国潮滩表层的细菌altererythrobactergangjinensisjcm17802t,基于其全基因组序列,筛选获得水解酶基因eⅱ-3,其核苷酸序列如seqidno.1所示。基因eⅱ-3大小为705bp,碱基组成为147a(20.85%)、173t(24.54%)、177c(25.11%)和208g(29.50%),编码蛋白大小为234个氨基酸残基,其氨基酸序列如seqidno.2所示。将该水解酶eⅱ-3氨基酸序列在genbank数据库中进行同源搜索,与之氨基酸序列一致性最高的是海洋细菌altererythrobacterluteolus来源的酯酶,一致性为86%(其在genbank数据库中的注册号为amz80132.1)。氨基酸序列分析结果表明,活性位点丝氨酸附近序列为具有甘氨酸-天冬氨酸-丝氨酸-亮氨酸组成的保守区(氨基酸位置为56至59),58位丝氨酸与207位天冬氨酸和210位组氨酸共同构成丝氨酸水解酶催化三联体。其氨基酸序列特征符合gdsl水解酶家族特征。综上所述,eⅱ-3应为gdsl水解酶家族中的一名新成员。
在不影响eⅱ-3蛋白活性前提下,可对seqidno:2所示的远离催化中心氨基酸位置(优选远离56-59、207和210氨基酸位置)的氨基酸序列进行各种取代、添加和/或缺失一个或几个氨基酸获得具有eⅱ-3活性的衍生蛋白质。根据本领域技术的公知常识,蛋白质的生物学活性是与其功能结构域密切相关的。一般来说,只有发生在功能结构域的位点突变可能对蛋白质的二维和三维结构产生影响,从而影响其生物学活性。而对于发生在远离功能结构域(优选156-59、207和210氨基酸位置)的氨基酸位点,由于这一区域不参与蛋白功能构象,氨基酸的个别点突变不会对蛋白质的生物学活性产生实质性影响,从而能够基本保留原蛋白质的生物学功能。优选的水解酶eⅱ-3突变体具有至少与seqidno:2所示的氨基酸序列90%以上的同源性,更优选具有至少95%以上的同源性,最优选具有至少99%以上的同源性。所述的突变体能够基本保留水解酶eⅱ-3的生物学功能,优选该突变体具有与seqidno:2所示氨基酸序列的水解酶至少90%以上的酶活性,更优选具有至少95%以上的酶活性,最优选至少99%以上的酶活性。更优选的,所述的突变体具有与seqidno:2所示的氨基酸序列至少95%以上的同源性及至少95%以上的水解酶活性。最优选的,所述的突变体具有与seqidno:2所示的氨基酸序列至少99%以上的同源性及至少99%以上的水解酶活性,且该水解酶eii-3来源于韩国潮滩表层的细菌altererythrobactergangjinensis
本发明涉及seqidno:2的成熟多肽或其同源序列的包含取代、缺失和/或插入一个或多个氨基酸的人工变体,突变位置优选小于5个,更优选小于3个,最优选仅为1个位置氨基酸的突变。保守取代的实例是在以下组之内:碱性氨基酸组(精氨酸、赖氨酸和组氨酸)、酸性氨基酸组(谷氨酸和天冬氨酸)、极性氨基酸组(谷氨酰胺和天冬酰胺)、疏水氨基酸组(亮氨酸、异亮氨酸和缬氨酸)、芳族氨基酸组(苯丙氨酸、色氨酸和酪氨酸)和小氨基酸组(甘氨酸、丙氨酸、丝氨酸、苏氨酸和甲硫氨酸)。通常不改变比活性的氨基酸取代是本领域已知的,并且由例如η.neurath和r.l.hill,1979于theproteins,academicpress,newyork中描述。最普遍发生的交换是ala/ser、val/ile、asp/glu、thr/ser、ala/gly、ala/thr、ser/asn、ala/val、ser/gly、tyr/phe、ala/pro、lys/arg、asp/asn、leu/ile、leu/val、ala/glu和asp/gly等。
可使用已知的诱变、重组和/或改组方法,然后进行相关的筛选过程,如由reidhaar-olson和sauer,1988,science,241:53-57;bowie和sauer,1989,proc.natl.acad.sci.usa86:2152-2156;wo95/17413或者wo95/22625所公开的那些,进行一个或多个氨基酸取代、缺失和/或插入并加以测试。其他可使用的方法包括易错pcr、噬菌体展示(例如lowman等,1991,biochemistry30:10832-10837;美国专利号5,223,409;wo92/06204)和区域定向诱变(region-directedmutagenesis)(derbyshire等,1986,gene46:145和1988,dna7:127)。
本发明还涉及分离的多核苷酸,其包含编码本发明水解酶eⅱ-3的核苷酸序列,或由编码本发明具有水解酶eⅱ-3活性的突变体的核苷酸序列组成。
本发明涉及编码具有水解酶eⅱ-3活性多肽的分离的多核苷酸,其选自下组:
(a)多核苷酸,其与seqidno:1的核苷酸所示序列一致;或
(b)多核苷酸,其为编码seqidno:1所示的核苷酸序列中除166-177、619-621和628-630位核苷酸外的其他核苷酸进行替换、添加和/或缺失一个或几个核苷酸得到的突变体基因,该多核苷酸具有与seqidno:1所示的核苷酸序列至少90%以上的同源性。
本发明提供了编码水解酶eⅱ-3的基因eⅱ-3,其与seqidno.1所示的核苷酸序列一致;基因eⅱ-3大小为705bp,碱基组成为147a(20.85%)、173t(24.54%)、177c(25.11%)和208g(29.50%),编码蛋白大小为234个氨基酸残基,其氨基酸序列如seqidno.2所示。本发明还提供对seqidno.1所示的核苷酸序列中除166-177、619-621和628-630位核苷酸外的其他核苷酸进行替换、添加和/或缺失一个或几个核苷酸从而获得编码能基本保留eⅱ-3蛋白生物学活性的突变体基因。优选的水解酶eⅱ-3突变体基因具有至少与seqidno:1所示的核苷酸序列90%以上的同源性,更优选具有至少95%以上的同源性,最优选具有至少99%以上的同源性,且该水解酶eii-3来源于韩国潮滩表层的细菌altererythrobactergangjinensis。
本发明还涉及包含本发明的分离的多核苷酸的核酸构建体,可以用许多方式操作编码本发明水解酶的分离的多核苷酸以提供水解酶的表达。所述分离的多核苷酸与一个或多个调控序列可操作地连接,所述调控序列在合适的宿主细胞中在与该调控序列相容的条件下指导编码序列的表达。调控序列可以是适当的启动子序列,其是由用于表达编码本发明多肽的多核苷酸的宿主细胞识别的核苷酸序列。启动子序列含有介导多肽的表达的转录调控序列。启动子可以是在所选的宿主细胞中显示转录活性的任何核苷酸序列,包括突变的、截短的和杂合的启动子,并且可以从编码与宿主细胞同源或异源的胞外或胞内多肽的基因获得。
利用基因克隆技术,可将克隆到的水解酶eⅱ-3基因连接到合适的载体上,并转化或转染到原核生物或真核生物宿主表达制备重组水解酶eⅱ-3。合适的原核生物宿主包括各种细菌如e.coli等,合适的真核生物宿主包括酵母(如甲醇酵母)及哺乳动物细胞(如中国仓鼠卵巢细胞)等,优选采用原核表达系统e.coli。
合适的载体为本领域技术人员所熟知的各种可商业化购买的原核或真核表达载体,原核表达载体如pet系列载体,pqe系列载体;酵母表达载体ppicz-α-a,phil-d2,ppic9,phil-s1(invitrogencorp.sandiego.california.usa);动物细胞表达载体psvk3、pmsg(amershampharmaciabiotechinc.usa)等。
本发明还涉及重组宿主细胞,其包含本发明的分离的多核苷酸,可有利地用于水解酶eⅱ-3的重组生产中。将包含本发明的多核苷酸的载体导入宿主细胞,宿主细胞的选择在很大程度上依赖于编码多肽的基因及其来源。宿主细胞可以是在本发明的水解酶eⅱ-3的重组产生中有用的任何细胞,例如,原核或真核细胞。利用基因克隆技术,可将克隆到的水解酶eⅱ-3基因连接到合适的载体上,并转化或转染到原核生物或真核生物宿主表达制备重组水解酶eⅱ-3。合适的原核生物宿主包括各种细菌如e.coli等,可通过如下原生质体转化或或电穿孔法将载体转化到原核细胞中。合适的真核生物宿主包括酵母(如甲醇酵母)及哺乳动物细胞(如中国仓鼠卵巢细胞)等。本发明优选采用原核表达系统e.coli表达生产水解酶eⅱ-3。一个优选的例子是将本发明筛选到的水解酶基因eⅱ-3连接到大肠杆菌表达载体psmt3上,并转化到大肠杆菌bl21(de3)中,经诱导表达出高活性的重组酶。
本发明还涉及用于制备本发明所述水解酶eⅱ-3的方法,其包括:
(a)在有助于产生水解酶eⅱ-3的条件下培养重组宿主细胞,其中所述宿主细胞包含seqidno:1所示核苷酸或对seqidno.1所示的核苷酸序列中除166-177、619-621和628-630位核苷酸外具有至少一个突变位点的核苷酸;
(b)回收所述多肽。
在本发明的产生方法中,使用本领域已知的方法在适合于产生所述水解酶eⅱ-3的营养培养基中培养细胞。例如,可以通过在合适培养基中和允许表达和/或分离所述水解酶eⅱ-3的条件下进行的摇瓶培养,和实验室或工业发酵罐中的小规模或大规模发酵(包括连续、分批、补料分批或固态发酵)来培养细胞。使用本领域已知的方法在合适的营养培养基中进行培养,所述营养培养基包含碳源和氮源和无机盐。合适的培养基能够从商业供应商获得或可以根据公开的组成制备。如果多肽分泌到营养培养基中,该多肽能够从所述培养基中直接回收。如果多肽不分泌,则其能够从细胞裂解物回收。
所得水解酶eⅱ-3可以使用本领域已知的方法回收。例如,可以通过常规方法从营养培养基中回收,所述常规方法包括但不限于离心、过滤、提取、喷雾干燥、蒸发或沉淀。可以通过多种本领域已知的方法纯化,所述方法包括但不限于层析(例如,离子交换、亲和、疏水、层析聚焦和大小排阻)或差示溶解度(例如硫酸铵沉淀)等方法。
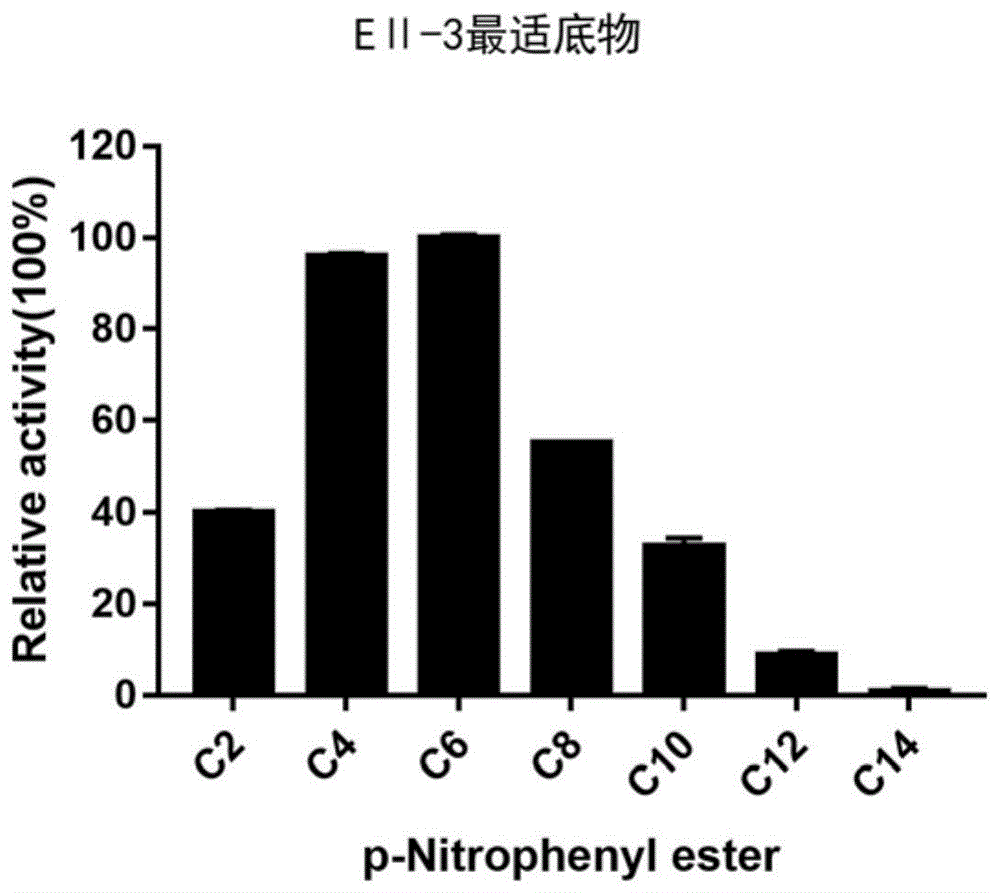
本发明还提供了水解酶eⅱ-3或能表达水解酶eⅱ-3的宿主菌在工业上的应用,例如可用于催化酯类水解。通过酯酶活力测定表明,水解酶eⅱ-3具有酯酶活性。eⅱ-3或上述能表达eⅱ-3的宿主菌可用于水解c2-c8短碳链脂肪酸酯,同时对c10-c14的长碳链脂肪酸酯也具有一定降解作用。优选的短链脂肪酸脂为具有c2-c8短碳链的对硝基苯酚酯,例如对硝基苯酚乙酸酯、对硝基苯酚丁酸酯、对硝基苯酚己酸酯和对硝基苯酚辛酸酯等,其中底物为对硝基苯酚己酸酯(c6)时催化活性最高,酶活为6.39u/mg。
eⅱ-3催化水解温度范围为10~50℃,优选为40℃;所述水解的ph值为3.0~10.0,优选为7.0。二价金属离子ca2+、mg2+和sr2+以及甲醇、dmso、甘油可增强其活性;在mn2+、ba2+以及乙醇存在下可保留75%以上活性。
本发明从韩国潮滩表层细菌altererythrobactergangjinensisjcm17802t中筛选获得新型耐金属离子及有机溶剂水解酶基因,发现了该基因编码蛋白具有优良的酶学特性,可应用于催化解酯和酶法合成酯产品生产过程中。获得的水解酶基因可克隆到合适的宿主中实现异源表达,实现工业化生产耐金属离子耐有机溶剂水解酶,为后续的工业应用提供成本低廉的耐金属离子耐有机溶剂水解酶起始材料。该酶的生产可在洗涤剂、废水处理、精细化工、制药和环境修复等含各种金属离子及有机溶剂生产工艺中显示出重要的经济和社会价值。
附图说明
图1为水解酶eⅱ-3的底物特异性图。c2:对硝基苯酚乙酸酯;c4:对硝基苯酚丁酸酯、c6:对硝基苯酚己酸酯;c8:对硝基苯酚辛酸酯;c10:对硝基苯酚癸酸酯;c12:对硝基苯酚十二酸酯;c14:对硝基苯酚十四酸酯;c16:对硝基苯酚十六酸酯;定义底物为c6时测定值为100%。
图2为水解酶eⅱ-3最适反应ph图。
图3为水解酶eⅱ-3最适反应温度图。
图4为二价阳离子对水解酶eⅱ-3活性影响图。
图5为有机溶剂对水解酶eⅱ-3活性影响图。
具体实施方式
实施例1水解酶基因eⅱ-3的获取
基于分离自韩国潮滩表层细菌altererythrobactergangjinensisjcm17802t全基因组、开放阅读框预测及基因注释结果,筛选脂类水解酶相关基因。通过blastp(http://blast.ncbi.nlm.nih.gov/)比对序列与数据库中已知水解酶基因序列的同源性。经数据库比对分析获得eⅱ-3基因,大小为705bp,碱基组成为147a(20.85%)、173t(24.54%)、177c(25.11%)和208g(29.50%),氨基酸残基其核苷酸序列如seqidno:1所示。编码蛋白大小为234氨基酸残基,其氨基酸序列如下所示(其三字母氨基酸序列如seqidno.2所示):
将该eⅱ-3蛋白序列在genbank中进行同源搜索,与之氨基酸序列一致性最高的是海洋细菌altererythrobacterluteolus来源的酯酶,一致性为86%,其在genbank数据库中的注册号为amz80132.1。
系统发育分析表明,水解酶eⅱ-3属于酯酶第ii家族,亦属gdsl水解酶家族。氨基酸序列分析结果显示,活性位点丝氨酸附近序列为具有甘氨酸-天冬氨酸-丝氨酸-亮氨酸组成的保守区(氨基酸位置为56至59),58位丝氨酸与207位天冬氨酸和210位组氨酸共同构成丝氨酸水解酶催化中心。其氨基酸序列特征符合gdsl水解酶家族特征。
综上所述,eⅱ-3应为酯酶家族和gdsl水解酶家族中的一名新成员。
实施例2基因eⅱ-3的重组表达质粒和重组菌株的构建
将本发明获得的基因eⅱ-3克隆到表达载体上,构建重组表达菌株。基于ncbiorffinder的orf分析获得的基因开放阅读框序列,设计扩增全基因的上游引物eⅱ-3f(5’-cgcggatccatgcaactatgtcgtttgtcgattg-3’,bamhi)和下游引物eⅱ-3r(5’-ccgctcgagctactctgcctcgggcaaagcgccc-3’,xhoi),pcr扩增确认基因全长序列。采用酶切克隆的方法构建表达质粒,即用bamhi和xhoi双酶切pcr产物,纯化后的片段与经bamhi和xhoi双酶切的质粒psmt3连接,采用cacl2转化法转化至e.colidh5α中,卡那霉素抗性筛选阳性克隆。采用质粒抽提试剂盒(omega,美国)提取阳性克隆的质粒,经bamhi和xhoi双酶切鉴定,获得700bp左右的dna片段,经测序鉴定为基因eⅱ-3。将重组表达质粒转化到e.colirosetta(de3)表达菌株中,构建表达重组菌株。
实施例3利用重组表达菌株表达重组基因eⅱ-3
将构建好的3ml重组表达菌株转接到100ml含有50μg/ml卡那霉素和34μg/ml氯霉素的lb液体培养基中,37℃振荡培养至od600达到0.6,加入终浓度为0.5mm的iptg进行诱导表达,转入20℃以150r/min振荡培养16h。低温离心收集菌体,重悬于nta-10溶液(500mm氯化钠,10mm咪唑,20mmtris盐酸,ph8.0)中,在冰上进行超声波破碎处理。低温离心收集上清,采用nta-ni2+亲和柱层析纯化表达蛋白。所表达的重组蛋白含有n端的6×histag,可亲和吸附到层吸柱上,经过不同浓度的咪唑溶液梯度洗脱,收集洗脱液。经sds-page检测目的蛋白在洗脱液中的分布情况。利用ulp1酶在透析袋中切除重组蛋白n端的类泛素sumo,并采用nta-ni2+亲和柱层析去除sumo蛋白,收集样品进行sds-page检测。得到电泳纯的重组蛋白eⅱ-3,分子量约25kda(图1)。用brandford法测定蛋白质浓度。
实施例4重组基因eⅱ-3的活性检测
利用对硝基苯酚丁酸酯法测定纯化的重组水解酶eⅱ-3活性。具体操作:1ml反应体系中包括1mm对硝基苯酚丁酸酯,100mm磷酸盐缓冲液(ph7.0)和526.2ng纯酶蛋白,采用紫外可见光分光光度计(beckmandu800型,美国)于40℃条件下连续测定吸光值a4052min,使用失活的酶液作为对照用于调零。一个酶活力单位定义为每分钟从对硝基苯酚酯催化产生lμmol对硝基苯酚的所需要的酶量。测得的酯酶活性为6.39u/mg。
实施例5水解酶eⅱ-3底物特异性分析
水解酶eⅱ-3的底物特异性分析采用体系(1ml):100mm磷酸盐缓冲液(ph7.5),1mm底物,加入526.2ng纯酶蛋白,在40℃下连续测定吸光值a4052min。测定采用的底物为:对硝基苯酚乙酸酯(c2),对硝基苯酚丁酸酯(c4),对硝基苯酚己酸酯(c6),对硝基苯酚辛酸酯(c8),对硝基苯酚癸酸酯(c10),对硝基苯酚十二酸酯(c12),对硝基苯酚十四酸酯(c14),对硝基苯酚十六酸酯(c16)。经测定表明,eⅱ-3对酰基碳链较短的对硝基苯酚酯(c4、c6和c8)具有较高催化活性,其中底物为对硝基苯酚己酸酯(c6)时催化活性最高,对酰基碳链较长的对硝基苯酚酯(c10、c12和c14)也具有一定的催化活性(图1)。结果表明,水解酶eⅱ-3对酰基碳链较短脂类物质具有较好催化活性,对于短链脂类的水解活力优于长链脂类。
实施例6水解酶eⅱ-3最适反应条件分析
水解酶eⅱ-3最适反应ph在3.0~10.5范围内测定。具体操作为:在不同ph缓冲液中加入1mm对硝基苯酚丁酸酯和526.2ng纯酶蛋白,在40℃下连续测定吸光值a3482min。测定使用的缓冲液为:100mm柠檬酸-柠檬酸钠缓冲液(ph3.0~6.0),100mm磷酸二氢钾-磷酸氢二钾(ph6.0~7.5),100mmtris盐酸缓冲液(ph7.5~9.0)和100mm2-环己胺基乙磺酸-氢氧化钠缓冲液(ph9.0~10.5)。测定结果表明,eⅱ-3最适反应ph为7.0,在ph3.0~9.5范围内具有活性(图2)。
水解酶eⅱ-3最适反应温度在10~50℃范围内测定。具体操作为:1ml反应体系中,加入1mm对硝基苯酚丁酸酯,100mm磷酸盐缓冲液(ph7.5)和526.2ng纯酶蛋白,分别在10、15、20、25、30、35、40、45和50℃条件下连续测定吸光值a4052min。测定结果表明eⅱ-3的反应温度范围为10~50℃,最适反应温度为40℃(图3)。
实施例7水解酶eⅱ-3酶学稳定性分析
二价阳离子对水解酶eⅱ-3活性影响的测定具体操作为:在反应体系中分别加入10mmba2+、ca2+、cd2+、co2+、cu2+、mg2+、mn2+、ni2+、sr2+、zn2+和乙二胺四乙酸(edta),测定酶活性。测酶活体系为:1ml反应体系中,加入1mm对硝基苯酚丁酸酯,100mmtris-hcl缓冲液(ph7.5)和526.2ng纯酶蛋白,于40℃下连续测定吸光值a4052min。测定结果表明,edta、mg2+、ca2+和sr2+可增强其活性,ba2+和mn2+存在下对酶活影响不大(保留80%以上活性),而cd2+、cu2+、ni2+和zn2+离子存在下,eⅱ-3的活性会被显著抑制(图4)。
有机溶剂对水解酶eⅱ-3活性影响的测定具体操作为:在反应体系中分别加入5%(v/v)有机溶剂:丙酮(acetone)、乙腈(acetonitrile)、乙醇(ethanol)、二甲基甲酰胺(dmf)、二甲基亚砜(dmso)、甘油(glycerol)、异丙醇(isopropanol)和甲醇(methanol),测定酶的活性。测活体系为:1ml反应体系中,加入1mm对硝基苯酚丁酸酯,100mmtris-hcl缓冲液(ph7.5)和526.2ng纯酶蛋白,于40℃下连续测定吸光值a4052min。测定结果表明,eⅱ-3对绝大多数有机溶剂耐受,甲醇、dmso和甘油可增强其活性(图5)。
序列表
<110>自然资源部第二海洋研究所
<120>一种新型gdsl家族脂类水解酶eii-3及其编码基因与应用
<160>2
<170>siposequencelisting1.0
<210>1
<211>705
<212>dna
<213>altererythrobactergangjinensis
<400>1
atgcaactatgtcgtttgtcgattgttcccgcctttctgttgagcttggcgctcgccgct60
tgcggaaccgagccacctgcgagcaaaaccgtcggagcagaaaatgttggcgcaattgca120
gccgaacagcctgttatggggccagagcggcgcattcttgctttcggtgacagtttgttt180
gctggatataatgtcgcgcaggaggatagctaccccgccaaattggagggcgcattgcga240
gcgcagggtatcaacgctcgggtcactaatgcgggtgtctcgggtgacactaccgccgcg300
gggttgcaacgtctgaccttcacactcgatgcgcaggaagaacgacctgatctgtttatc360
cttgagctggggggcaatgatttgctgcggggcatccagcccaatcagactcggtcgaat420
atcgaagcgatgctgaacgaattgaagaagcgcgacattccggtgctgttgatgggaatg480
cgtgcgccgcccaattttgcgcaatttcaggctgattttgataatctttatccagaactt540
gctgcgaaatatggctctgggttggtcccgttcttcttggattcgatctacaccaagccg600
gaattaatccagcccgaccgtattcatcccaccgaagtgggtattgaaacgctggttggc660
gccactgttgatgcggtgaagggcgctttgcccgaggcagagtag705
<210>2
<211>234
<212>prt
<213>altererythrobactergangjinensis
<400>2
metglnleucysargleuserilevalproalapheleuleuserleu
151015
alaleualaalacysglythrgluproproalaserlysthrvalgly
202530
alagluasnvalglyalailealaalagluglnprovalmetglypro
354045
gluargargileleualapheglyaspserleuphealaglytyrasn
505560
valalaglngluaspsertyrproalalysleugluglyalaleuarg
65707580
alaglnglyileasnalaargvalthrasnalaglyvalserglyasp
859095
thrthralaalaglyleuglnargleuthrphethrleuaspalagln
100105110
glugluargproaspleupheileleugluleuglyglyasnaspleu
115120125
leuargglyileglnproasnglnthrargserasnileglualamet
130135140
leuasngluleulyslysargaspileprovalleuleumetglymet
145150155160
argalaproproasnphealaglnpheglnalaasppheaspasnleu
165170175
tyrprogluleualaalalystyrglyserglyleuvalprophephe
180185190
leuaspseriletyrthrlysprogluleuileglnproaspargile
195200205
hisprothrgluvalglyilegluthrleuvalglyalathrvalasp
210215220
alavallysglyalaleuproglualaglu
225230
- 还没有人留言评论。精彩留言会获得点赞!