一种用于生产L-草铵膦的酶组合和L-草铵膦生产方法与流程
本发明涉及酶工程技术领域,具体涉及一种用于生产l-草铵膦的酶组合和l-草铵膦生产方法。
背景技术:
草铵膦,也称草丁膦,英文名为:phosphinothricin(简称ppt),化学名为2-氨基-4-[羟基(甲基)膦酰基]-丁酸。草铵膦是一种广谱灭生性除草剂。
目前,世界三大除草剂分别为草甘膦、百草枯和草铵膦。草甘膦的长期大量使用,一是造成大量杂草产生抗性,使草甘膦趋于失效;二是造成严重水土流失和土壤板结;百草枯由于其剧毒性,已被列入《鹿特丹公约》,全球越来越多国家禁用或限用。草铵膦由于其环境相容度高、几乎没有动物毒性等优点,是草甘膦和百草枯的最佳替代者。更重要的是,随着转基因技术的发展,抗草铵膦作物的种类和种植面积会进一步增多,草铵膦将具备更广阔的的市场前景。
制备光学纯l-草铵膦的方法主要有三种:化学不对称合成法、手性拆分法以及生物催化法。生物催化法具有立体选择性严格、反应条件温和、收率高及产物易分离纯化等优点,是生产l-草铵膦的潜在优势方法。生物催化的不对称合成可以针对分子的手性中心,直接合成单一的光学异构体。这类反应的代表就是酶催化的转氨基反应或酶催化的还原胺化反应,均以2-羰基-4-[羟基(甲基)膦酰基]-丁酸(ppo)为原料,合成l-2-氨基-4-[羟基(甲基)膦酰基]-丁酸(即l-草铵膦),涉及到的酶分别为转氨酶和谷氨酸脱氢酶。
专利cn1349561a筛选得到了能够特异性地催化2-羰基-4-(羟基甲基膦酰基)丁酸的草酰乙酸转氨酶,直接利用l-天冬氨酸为氨基供体。但此工艺效率低下,当底物ppo的浓度为552mmol/l、在几乎完全消耗大约700mmol/l的原料l-天冬氨酸的情况下,只生成251.9mmol/l的产物l-ppt,与此同时生成了大约234.5mmol/l的杂质丙氨酸,原料ppo的转化率只有52%。因此,转氨酶工艺虽然具有酶活高、立体选择性高等优点。但也存在两大缺陷,其一是转氨酶催化的反应为可逆反应,原料ppo不能完全转化为l-ppt,在高达4倍量谷氨酸存在的条件下转化率也只有90%;其二是要使可逆反应向生成l-ppt的方向进行、获得高的转化率,需要3-4倍当量以上的手性氨基酸作为氨基供体,过量的氨基供体残余给l-草铵膦的分离精制带来了很大的麻烦。
专利cn106978453a通过筛选得到了酶活较高的谷氨酸脱氢酶,在额外的辅酶再生体系配合反应下,制备了l-草铵膦,反应液中原料ppo的浓度达到了100mm,转化率高达100%。专利cn110184246a通过基因工程改造、获得了一种酶活更高的谷氨酸脱氢酶突变体,在葡萄糖脱氢酶的配合下制备l-草铵膦,原料ppo转化率>99%,l-草铵膦浓度最高达到445mm(80.6g/l),产品ee值>99%。谷氨酸脱氢酶可以直接利用无机氨作为氨基供体、还原胺化原料ppo制备l-草铵膦,无需手性氨基酸作为氨基供体;但谷氨酸脱氢酶催化的反应需要消耗等当量的辅酶,由于辅酶价格昂贵,因此,还需要额外辅酶再生体系。采用以葡萄糖脱氢酶为辅酶再生酶、以葡萄糖为辅酶再生底物的辅酶再生系统。此辅酶再生系统的副产物为葡萄糖酸,而葡萄糖酸与产品l-草铵膦都是溶解度极高的物质,难以将二者予以分离,导致产品后处理工艺复杂、精制成本高。
分离l-草铵膦和葡萄糖酸的方法可以采用有机溶剂沉淀的方法,如专利cn109651433a所公开的方法:将含葡萄糖酸的l-草铵膦反应液减压浓缩后,得到浓缩液i;浓缩液i经降温、搅拌、结晶,过滤,得到滤液i和葡萄糖酸铵;向滤液i中加入无机酸,减压浓缩后,得到浓缩液ii;向浓缩液ii中加入有机溶剂,持续搅拌,过滤,烘干滤饼后,得到l-草铵膦,产品收率60~70%。也可以采用离子交换树脂进行分离,如专利cn109485673a所公开的方法:取含l-草铵膦和葡萄糖酸的l-草铵膦粗液,调节粗液的ph值至1~4,得到进料液;将进料液加入至装有强酸型阳离子交换树脂的交换柱中,进行色谱分离,收集含葡萄糖酸的流出液;在交换柱底部检测到l-草铵膦的浓度达到进料液中l-草铵膦浓度的5~10%时,停止加入进料液;然后,先用去离子水洗涤树脂,再用碱液作洗脱剂解吸l-草铵膦,收集洗脱液,得到l-草铵膦溶液,l-草铵膦的产品收率在90%左右,但离子交换树脂存在操作复杂、产生废水量大等缺点。
综上所述,生物催化法虽然是生产l-草铵膦的潜在优势方法,但还存在以下一些问题亟待解决:(1)产品浓度不高,目前还没有相关报导生物催化不对称合成工艺中产品l-草铵膦的浓度能超过500mm;(2)反应液中存在各种各样的、难以分离的杂质。这些问题都是生物催化法生产l-草铵膦的瓶颈问题,阻碍了生物法制备l-草铵膦的大规模应用。
技术实现要素:
针对现有技术中合成l-草铵膦浓度不高,杂质难以分离的问题,本发明提供一条完整的l-草铵膦生产工艺,提供多个辅酶再生底物和辅酶再生酶在l-草铵膦合成中的应用,解决辅酶再生系统的副产物与产品l-草铵膦分离的问题,提高l-草铵膦生产效率。
一种用于生产l-草铵膦的酶组合,包括谷氨酸脱氢酶和辅酶再生酶,其特征在于,所述辅酶再生酶为醇脱氢酶、甲酸脱氢酶或亚磷酸脱氢酶。
优选的,所述谷氨酸脱氢酶的氨基酸序列如seqidno.1所示;谷氨酸脱氢酶为该突变体,催化活力较高。
优选的,所述醇脱氢酶的氨基酸序列如seqidno.2所示,所述甲酸脱氢酶的氨基酸序列如seqidno.3所示,所述亚磷酸脱氢酶的氨基酸序列如seqidno.4所示。
一种l-草铵膦的生产方法,包括以下步骤:以2-羰基-4-[羟基(甲基)膦酰基]-丁酸(ppo)作为原料,添加nh4+、辅酶nadp+/nadph和辅酶再生底物,然后使用所述酶组合进行催化,其中,谷氨酸脱氢酶用于将ppo催化反应为l-草铵膦,辅酶再生酶用于将nadp+还原为nadph。
nh4+可以来源于(nh4)2so4。ppo作为原料生产l-草铵膦过程中在谷氨酸脱氢酶作用下利用nadph辅酶提供还原力,产生nadp+,同时,辅酶再生底物在辅酶再生酶作用下消耗氧化型辅酶nadp+,产生还原型辅酶nadph,形成辅酶再生系统。添加辅酶nadp+时,辅酶再生酶催化辅酶再生底物,添加辅酶nadph时,谷氨酸脱氢酶催化ppo,优选的,首先加入nadp+启动催化反应;酶组合中谷氨酸脱氢酶和辅酶再生酶来源于同一宿主细胞的细胞悬液或破胞粗酶液,或者谷氨酸脱氢酶单表达菌株和辅酶再生酶单表达菌株的细胞悬液混合液或破胞粗酶液混合液。
作为优选,以醇脱氢酶为辅酶再生酶时,需要同时流加异丙醇作为辅酶再生底物,反应后的副产物为丙酮,可以在反应过程中或反应结束后,通过减压蒸馏的方式加以去除;以甲酸脱氢酶作为辅酶再生酶时,需要同时流加甲酸作为辅酶再生底物,反应后的副产物为二氧化碳和水,无需额外的副产物分离工艺;以亚磷酸脱氢酶作为辅酶再生酶时,需要同时流加亚磷酸作为辅酶再生底物,反应后的副产物为磷酸,可以在反应过程中或反应结束后,通过添加ca2+形成磷酸钙沉淀的方式加以去除。
优选的,将谷氨酸脱氢酶基因(公开专利cn110184246a中的谷氨酸脱氢酶突变株(ppgludh-t121n/l123y))和醇脱氢酶基因(ncbi登录号wp_077844196.1)、甲酸脱氢酶基因(genebank号aab36206.1)或亚磷酸脱氢酶基因(ncbi登录号wp_063540370.1)构建于同一个表达质粒上,导入宿主细胞,构建基因工程菌,更为优选的,表达质粒为prsfduet、pet-24a(+)、pet-28a(+)或pet-30a(+),宿主细胞为大肠杆菌e.colibl21(de3)。
优选的,基因工程菌发酵时采用补料分批发酵方法,在基础培养基被消耗完全后,通过向发酵液补加补料培养基来使基因工程菌细胞密度得以继续增加,待发酵液中基因工程菌的细胞浓度达到od600=20~40时,向发酵液中加入异丙基硫代半乳糖苷(iptg)诱导基因工程菌产酶,直至发酵结束,细胞浓度达到od600=200~300;通过将补料分批发酵提高单位体积细胞密度,尤其是发酵过程中培养基的组成,不仅提高了双酶共表达基因工程菌的细胞密度(od600=200~300),而且一次发酵还可以得到两种酶。其中,谷氨酸脱氢酶对原料ppo的催化活力最高超过1200u/ml的发酵液。
优选的,催化反应体系中加入基因工程菌,催化反应过程中连续流加原料ppo,控制反应体系中原料的浓度≤100mm;生物催化的反应往往都发生在中性或弱碱性条件下,这是因为作为生物催化剂的酶,只有在中性或弱碱性条件下才能保持稳定、并实现其催化功能。过程中之所以控制ppo的浓度≤100mm,是因为ppo在中性或碱性条件下不稳定、容易自发降解,而且其浓度越高、自降解速率越快。通过采用高活力的生物催化剂,并且连续流加原料ppo、控制反应体系中ppo浓度在比较低的水平,是实现生物催化制备高浓度l-草铵膦的有效途径。
优选的,催化反应过程中通过流加氨水控制反应ph值为7.0~9.0;控制反应温度为20~50℃,最终ppo的添加浓度为500mm~1000mm;辅酶nadp+的添加浓度为0.001mm~0.5mm;辅酶再生底物的添加浓度为500mm~1200mm;l-草铵膦时采用连续流加底物的方式,避免了原料的自降解,使得产品l-草铵膦的浓度超过1000mm,原料转化率达100%,产品得率大于98%;显著提高了产品浓度和生产强度,充分利用了酶的催化活性,降低了酶的使用成本;节能减排效果显著。
本发明具有的有益效果:
本发明提供的用于生产l-草铵膦的酶组合和l-草铵膦生产方法,所产生的副产物极易去除,无需复杂的分离工艺或根本不需要额外的分离工艺,简化了产品的后处理工艺;产品l-草铵膦的浓度超过1000mm,原料转化率达100%,产品得率大于98%,总收率大于95%,显著提高了产品浓度和生产强度,充分利用了酶的催化活性,降低了l-草铵膦的生产成本,是一种绿色、环保、低碳的工艺路线,适合大规模工业化生产应用。
附图说明
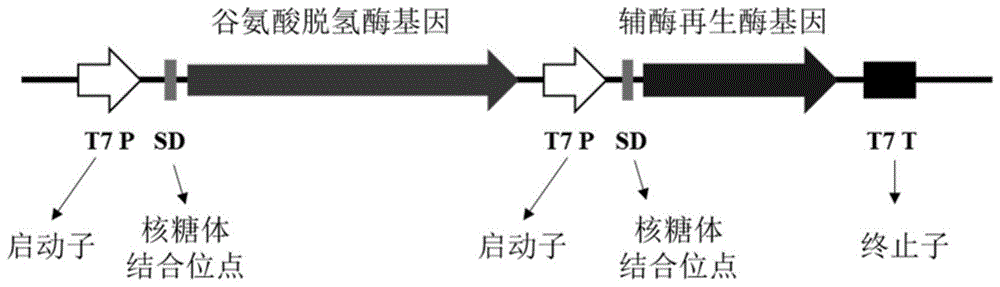
图1谷氨酸脱氢酶基因和辅酶再生酶基因在表达质粒上的连接顺序。
图2为实施例2的催化反应过程曲线。
图3为共表达菌株与单表达、双菌双酶体系的催化效率对比。
具体实施方式
本发明中的实验方法如无特别说明均为常规方法,基因克隆操作具体可参见j.萨姆布鲁克等编的《分子克隆实验指南》。
上游基因工程所用试剂:本发明实施例中使用的限制性内切酶和dna连接酶均购自takara,宝生物工程(大连)有限公司;基因组提取试剂盒、质粒提取试剂盒、dna回收纯化试剂盒购自axygen杭州有限公司;e.colidh5α、e.colibl21(de3)、质粒prsfduet、pet-24a(+)、pet-28a(+)以及pet-30a(+)等购自novagen公司;dnamarker、fastpfudna聚合酶、低分子量标准蛋白、琼脂糖电泳试剂购自北京全式金生物技术有限公司;引物合成与序列测序工作由生工生物工程(上海)股份有限公司完成。以上试剂使用方法参考商品说明书。
下游催化工艺所用试剂:2-羰基-4-(羟基甲基膦酰基)丁酸(简称ppo)为实验室合成;d,l-草铵膦购自sigma-aldrich公司;其他常用试剂购自国药集团化学试剂有限公司。
下列实施例的催化反应通过高效液相色谱(hplc)监测反应的进行,并对各个反应物和产物进行分析。hplc分析方法为色谱柱:aq-c18;柱温:40℃;流速:1ml/min;检测波长:uv205nm;流动相:50mm(nh4)2hpo4,加入1%的10%四丁基氢氧化铵水溶液,用50%磷酸调ph至3.6,加入8%乙腈。(使用高效液相色谱检测产物时,检测的是处于离子状态的l-草铵膦,而最后实际制备的产品在有铵根离子存在的情况下为l-草铵膦铵盐。)
通过手性hplc分析方法检查草铵膦的两个构型含量,手性hplc分析方法为:
色谱柱:
衍生化试剂:分别称取0.03g邻苯二甲醛与0.1n-乙酰-l-半胱氨酸,用400μl乙醇助溶,再加入4ml0.2mol/硼酸缓冲液(ph9.8),振荡使其充分溶解,4℃冰箱保存备用(不超过4天)。
衍生化反应与测定:取100μl样品加入150μl衍生化试剂,混匀后至于25℃保温5min,进样20μl进行分析。
实施例1:菌种构建与酶活测定
1、菌种构建
(1)表达谷氨酸脱氢酶的基因工程菌的构建
选取催化活力较高的谷氨酸脱氢酶作为本发明方法制备l-草铵膦的催化剂,其氨基酸序列如seqidno.1所示。将此谷氨酸脱氢酶的碱基序列(公开专利cn110184246a中的谷氨酸脱氢酶突变株(ppgludh-t121n/l123y))克隆到相关的表达质粒上,表达质粒包括:prsfduet、pet-24a(+)、pet-28a(+)以及pet-30a(+)中的一种,插入酶切位点为bamhⅰ和hindⅲ;重组质粒经测序验证无误后转入表达宿主大肠杆菌e.colibl21(de3)中,构建相应的表达谷氨酸脱氢酶的基因工程菌,如e.colibl21(de3)/pet-24a(+)–gludh。
(2)表达辅酶再生酶的基因工程菌的构建
将优选的三种辅酶再生酶的醇脱氢酶基因(ncbi登录号wp_077844196.1)、甲酸脱氢酶基因(genebank号aab36206.1)和亚磷酸脱氢酶基因(ncbi登录号wp_063540370.1)序列,送生工生物工程(上海)股份有限公司进行全基因合成,并克隆到相关的表达质粒上。重组质粒经测序验证无误后转入表达宿主大肠杆菌e.colibl21(de3)中,构建用于辅酶再生酶表达以及后续的共表达基因工程菌株,如e.colibl21(de3)/pet-24a(+)-adh。
(3)共表达谷氨酸脱氢酶突变体和辅酶再生酶的基因工程菌的构建
通过全质粒pcr的方式得到质粒上的谷氨酸脱氢酶突变体基因和辅酶再生酶基因的线性片段。通过重组反应,将两个线性片段重新连接成表达质粒,新的质粒携带有谷氨酸脱氢酶突变体基因和辅酶再生酶基因,两段基因以及其他表达元件的连接顺序如图1所示。再将重组质粒分别转入表达宿主e.colibl21(de3)中,得到基因工程菌e.colibl21(de3)/prsfduet-gludh-adh,e.colibl21(de3)/pet-24a(+)-gludh-adh,e.colibl21(de3)/pet-28a(+)-gludh-adh,e.colibl21(de3)/pet-30a(+)-gludh-adh,测序验证后无误即用作共表达所述两种酶的基因工程菌。
2、酶活测定
(1)谷氨酸脱氢酶的酶活测定
谷氨酸脱氢酶酶活标准检测体系:适量的酶液、100mm底物ppo、10mmnadph、500mmnh4+((nh4)2so4),总体系为400μl,反应介质为ph7.5,0.1m磷酸盐缓冲液。35℃反应10min,反应结束后加入40μl5mnaoh终止反应。样品中生成的l-草铵膦浓度通过柱前衍生化hplc进行定量。酶活单位(u)的定义:在标准的反应条件下,每分钟生成1μmoll-草铵膦所需要的酶量。
(2)醇脱氢酶、甲酸脱氢酶和亚磷酸脱氢酶的酶活测定
醇脱氢酶底物、甲酸脱氢酶底物和亚磷酸脱氢酶底物分别为0.1m磷酸盐缓冲液配置的异丙醇溶液、甲酸铵溶液和亚磷酸氢二铵溶液。
取相应底物溶液950μl,加入10mmnadp+溶液25μl,置于金属浴震荡器中,35℃保温10min;加入25μl对应酶液,迅速取出用手震荡、到入比色皿中,迅速放入分光光度计内,以时间为横坐标(单位min)、
吸光值为纵坐标测定吸光值随时间的变化率,根据事先测定的nadph摩尔吸光系数,即可计算酶活。
实施例2:采用基因工程菌e.colibl21(de3)/prsfduet-gludh-adh生产l-草铵膦
(1)菌种活化:采用接种环取菌种管内的-80℃甘油管保藏的共表达谷氨酸脱氢酶和醇脱氢酶的基因工程菌e.colibl21(de3)/prsfduet-gludh-adh菌种在lb-kan-琼脂固体培养基表面(平皿或茄子瓶)上划线,平皿倒置于37℃恒温培养箱,培养12小时;
(2)种子培养:将活化后的菌种再接种到40ml的一级种子培养基中,37℃下振荡培养12h,得到一级种子液;然后,将一级种子液移入400ml二级种子培养基中,35℃下振荡培养4h,得到二级种子液;
其中,一级种子培养基为lb培养基,10g/l蛋白胨,5g/l酵母抽提物,10g/l氯化钠,5m氢氧化钠溶液调节ph值至7.0,121℃灭菌20min,接种前加入卡那霉素浓度为50μg/ml。二级种子培养基为:12g/l蛋白胨,24g/l酵母抽提物,16.43g/lk2hpo4·3h2o,2.31g/lkh2po4,5.04g/l甘油,121℃灭菌20min,接种前加入卡那霉素浓度为50μg/ml。
(3)补料分批发酵:
先配制5l基础培养基置于发酵罐中,初始ph=6.41,121℃灭菌20min,降温到35℃,ph变为6.29,用氨水将ph调到6.8,将440ml二级种子液接入发酵罐,进行发酵,控制发酵温度35℃,通过通气与搅拌控制溶氧维持在5~30%之间,用氨水控制发酵液ph=7.0。另配3l补料培养基,115℃灭菌30min,冷却到室温后,待用。待基础培养基营养物质耗尽(表现为溶氧急剧上升),开始补料。发酵6h后,测得发酵液的od600=28.1,将发酵液温度降至28℃,加入诱导剂iptg0.3mm,继续发酵到48h,期间溶氧维持在20~30%;补料速率为0.05l/h。
发酵结束后,得到od600=286,测得谷氨酸脱氢酶酶活为920u/ml的发酵液,醇脱氢酶酶活为1063u/ml。
(4)将发酵液进行4000rpm离心30min,弃上清,得到基因工程菌菌泥。在1.0l三口烧瓶罐中注入0.20l纯水,加入菌泥80g,调ph=8.0,补水定容到0.30l,烧瓶置于水浴中、控制水浴温度为35℃,开启搅拌。将100g纯度98%的固体ppo粉末和50ml异丙醇配置成500ml底物流加液,连续加入反应。加入nadp+0.03g启动反应,用氨水控制反应液ph=8.0±0.1,定时取样,测定体系中的ppo和l-草铵膦的浓度。反应12h后,得到反应液970ml,其中,未检测到原料ppo,原料转化率达100%,检测到产品l-草铵膦(分子量181)的浓度为547mm,产品得率98.3%。反应过程曲线如图2所示。
(5)反应结束后,将反应液煮沸,12000rpm离心30min,除去蛋白沉淀物,得到上清液约900ml,减压浓缩去除反应液中的水、丙酮以及未反应的异丙醇,得到产品l-草铵膦铵盐(分子量198)约103.9g,产品总收率96.4%。
实施例3:采用基因工程菌e.colibl21(de3)/pet-24a(+)-gludh-adh生产l-草铵膦
(1)工程菌的发酵和菌泥的获取与实施例2相同。发酵结束后,得到od600=296,测得谷氨酸脱氢酶酶活为1269u/ml的发酵液,醇脱氢酶酶活为947u/ml。
(2)在10.0l反应釜中注入2.5l纯水,加入菌泥1.5kg,补水定容到4.0l,开启搅拌,用氨水调ph=7.5,用循环冷却水控制反应温度为40℃。将2.0kg纯度95%的固体ppo粉末和500ml异丙醇配置成5.0l底物流加液,连续加入反应。加入nadp+0.5g启动反应,用氨水控制反应液ph=7.5±0.1,定时取样,测定体系中的ppo和l-草铵膦的浓度。反应15h后,得到反应液9.5l,其中,未检测到原料ppo,原料转化率达100%,检测到产品l-草铵膦(分子量181)的浓度为1092mm,产品得率98.1%。
(5)反应结束后,将反应进行膜分离、除去蛋白等大分子物质,得到清液约20l(l-草铵膦浓度为518mm),减压浓缩去除反应液中的水、丙酮以及未反应的异丙醇,得到产品l-草铵膦铵盐(分子量198)约1.99kg,产品总收率95.2%。
实施例4采用基因工程菌e.colibl21(de3)/pet-28a(+)-gludh-fdh生产l-草铵膦
(1)菌种活化:采用接种环取菌种管内的-80℃甘油管保藏的共表达谷氨酸脱氢酶和甲酸脱氢酶的基因工程菌e.colibl21(de3)/
pet-28a(+)-gludh-fdh菌种在lb-kan-琼脂固体培养基表面(平皿或茄子瓶)上划线,平皿倒置于37℃恒温培养箱,培养12h;
(2)种子培养:将活化后的菌种再接种到50ml的一级种子培养基中,35℃下振荡培养16h,得到一级种子液;然后,将一级种子液移入500ml二级种子培养基中,37℃下振荡培养4h,得到二级种子液;
其中,一级种子培养基为lb培养基,10g/l蛋白胨,5g/l酵母抽提物,10g/l氯化钠,5m氢氧化钠溶液调节ph值至7.0,121℃灭菌20min,接种前加入卡那霉素浓度为50μg/ml。二级种子培养基为:12g/l蛋白胨,24g/l酵母抽提物,16.43g/lk2hpo4·3h2o,2.31g/lkh2po4,5.04g/l甘油,121℃灭菌20min,接种前加入卡那霉素浓度为50μg/ml。
(3)补料分批发酵:
先配制5l基础培养基置于发酵罐中,初始ph=6.56,121℃灭菌20min,降温到37℃,ph变为6.34,用氨水将ph调到7.2,将550ml二级种子液接入发酵罐,进行发酵,控制发酵温度35℃,通过通气与搅拌控制溶氧维持在5~30%之间,用氨水控制发酵液ph=7.5。另配3l补料培养基,115℃灭菌30min,冷却到室温后,待用。待基础培养基营养物质耗尽(表现为溶氧急剧上升),开始补料。发酵8h后,测得发酵液的od600=38.3,将发酵液温度降至25℃,加入诱导剂iptg0.5mm,继续发酵到48h,期间溶氧维持在30%;补料速率为0.06l/h。
发酵结束后,得到od600=241,测得谷氨酸脱氢酶酶活为1051u/ml的发酵液,甲酸脱氢酶酶活为163u/ml。
(4)将发酵液进行4000rpm离心30min,弃上清,得到基因工程菌菌泥。在1.0l三口烧瓶罐中注入0.20l纯水,加入菌泥150g,调ph=7.0,补水定容到0.40l,烧瓶置于水浴中、控制水浴温度为45℃,开启搅拌。将150g纯度98%的固体ppo粉末和质量分数80%的甲酸溶液50g配置成500ml底物流加液,连续加入反应。加入nadp+0.01g启动反应,用氨水控制反应液ph=7.0±0.1,定时取样,测定体系中的ppo和l-草铵膦的浓度。反应24h后,得到反应液920ml,其中,未检测到原料ppo,原料转化率达100%,检测到产品l-草铵膦(分子量181)的浓度为879.7mm,产品得率99.1%。反应过程曲线如图2所示。
(5)反应结束后,将反应液煮沸,12000rpm离心30min,除去蛋白沉淀物,得到上清液约880ml,减压浓缩去除反应液中的水,得到产品l-草铵膦铵盐(分子量198)约156.6g,产品总收率96.7%。
实施例5采用基因工程菌e.colibl21(de3)/pet-30a(+)-gludh-ptdh生产l-草铵膦
(1)菌种活化:采用接种环取菌种管内的-80℃甘油管保藏的共表达谷氨酸脱氢酶和亚磷酸脱氢酶的基因工程菌e.colibl21(de3)/pet-30a(+)-gludh-ptdh菌种在lb-kan-琼脂固体培养基表面(平皿或茄子瓶)上划线,平皿倒置于37℃恒温培养箱,培养12h;
(2)种子培养:将活化后的菌种再接种到50ml的一级种子培养基中,37℃下振荡培养14h,得到一级种子液;然后,将一级种子液移入500ml二级种子培养基中,37℃下振荡培养4h,得到二级种子液;
其中,一级种子培养基为lb培养基,10g/l蛋白胨,5g/l酵母抽提物,10g/l氯化钠,5m氢氧化钠溶液调节ph值至7.0,121℃灭菌20min,接种前加入卡那霉素浓度为50μg/ml。二级种子培养基为:12g/l蛋白胨,24g/l酵母抽提物,16.43g/lk2hpo4·3h2o,2.31g/lkh2po4,5.04g/l甘油,121℃灭菌20min,接种前加入卡那霉素浓度为50μg/ml。
(3)补料分批发酵:
先配制5l基础培养基置于发酵罐中,初始ph=6.26,121℃灭菌20min,降温到37℃,ph变为6.14,用氨水将ph调到7.0,将550ml二级种子液接入发酵罐,进行发酵,控制发酵温度35℃,通过通气与搅拌控制溶氧维持在5~30%之间,用氨水控制发酵液ph=7.0。另配3l补料培养基,115℃灭菌30min,冷却到室温后,待用。待基础培养基营养物质耗尽(表现为溶氧急剧上升),开始补料。发酵7h后,测得发酵液的od600=30.5,将发酵液温度降至28℃,加入诱导剂iptg0.7mm,继续发酵到48h,期间溶氧维持在30%;补料速率为0.07l/h。
发酵结束后,得到od600=215,测得谷氨酸脱氢酶酶活为711u/ml的发酵液,亚磷酸脱氢酶酶活为112u/ml。
(4)将发酵液进行4000rpm离心30min,弃上清,得到基因工程菌菌泥。在1.0l三口烧瓶罐中注入0.20l纯水,加入菌泥200g,调ph=9.0,补水定容到0.40l,烧瓶置于水浴中、控制水浴温度为50℃,开启搅拌。将150g纯度98%的固体ppo粉末配置成400ml底物流加液,连续加入反应。加入nadp+0.01g启动反应,分三批加入固体亚磷酸氢二铵132g。用氨水控制反应液ph=9.0±0.1,定时取样,测定体系中的ppo和l-草铵膦的浓度。反应30h后,得到反应液960ml,其中,未检测到原料ppo,原料转化率达100%,检测到产品l-草铵膦(分子量181)的浓度为843.9mm,产品得率99.2%。
(5)反应结束后,将反应液煮沸,12000rpm离心30min,除去蛋白沉淀物,得到上清液约920ml,加入无水氯化钙111g,析出沉淀后过滤,滤液进行减压浓缩去除其中的水,得到产品l-草铵膦铵盐(分子量198)约154.9g,产品总收率95.8%。
实施例6采用两个单表达菌株生产l-草铵膦
(1)选取实施例1中单表达谷氨酸脱氢酶的菌株e.colibl21(de3)/pet-24a(+)-gludh,以及单表达醇脱氢酶的菌株e.colibl21(de3)/pet-24a(+)-adh来生产l-草铵膦,工程菌的发酵和菌泥的获取与实施例2相同。
在相同菌体浓度下,测定了共表达谷氨酸脱氢酶和醇脱氢酶的菌株(e.colibl21(de3)/pet-24a(+)-gludh-adh与双菌双酶体系催化转化250mm原料ppo的反应进程。为使双菌双酶体系获得最佳的催化效果,将该体系中的醇脱氢酶与谷氨酸脱氢酶酶活添加比例设置为2:1。如图3所示,在以破胞粗酶液进行反应时,共表达菌株能够在2h达到99%以上的转化率,而双菌双酶体系则需要4h才能达到99%以上的转化率,表明共表达菌株的催化效率高于双菌双酶体系。在以全细胞进行催化反应时,共表达菌株测得的反应进程与以破胞粗酶液进行反应时基本一致,同样能够在2h获得99%以上的转化率,而双菌双酶体系的催化效率则显著降低,5h时转化率仅为58.8%。这是因为,对于双菌双酶全细胞催化体系,谷氨酸脱氢酶与醇脱氢酶分处于两个细胞内,辅酶需要在两个细胞之间穿梭才能实现循环,严重影响辅酶再生的效率。相对而言,共表达菌株的辅酶循环在同一细胞内进行,细胞壁/细胞膜的存在对辅酶再生效率影响较小,因此共表达菌株全细胞催化能够保持与破胞粗酶液一致的催化效率。综上所述,共表达菌株对比双菌双酶,具有催化效率更高、可进行全细胞催化等显著优势。
对比例1一次性投加原料的反应生产l-草铵膦
(1)工程菌的发酵和菌泥的获取与实施例2相同。
(2)将200g纯度95%的固体ppo粉末加水溶解,用氨水中和到ph=7.0,配置成约900ml水溶液,一次性加入到1.0l反应釜中,开启搅拌,加入菌泥100g,加入nadp+0.05g,启动反应,5批加入50ml异丙醇,用循环冷却水控制反应温度为40℃,用氨水控制反应液ph=7.5±0.1,定时取样,测定体系中的ppo和l-草铵膦的浓度。反应36h后,得到反应液995ml,其中,检测到原料ppo浓度91.8mm,检测到产品l-草铵膦(分子量181)的浓度为213.5mm,产品得率20.0%。
序列表
<110>浙江大学
<120>一种用于生产l-草铵膦的酶组合和l-草铵膦生产方法
<160>4
<170>siposequencelisting1.0
<210>1
<211>449
<212>prt
<213>人工序列(artificialsequence)
<400>1
metserthrmetilegluservalaspasnpheleualaargleulys
151015
glnargaspproglyglnprogluphehisglnalavalglugluval
202530
leuargthrleutrppropheleuglualaasnprohistyrleugln
354045
serglyileleugluargmetvalgluprogluargalavalleuphe
505560
argvalsertrpvalaspaspglnglylysvalglnvalasnarggly
65707580
tyrargileglnmetserseralaileglyprotyrlysglyglyleu
859095
argphehisproservalasnleuservalleulyspheleualaphe
100105110
gluglnvalphelysasnserleuasnsertyrprometglyglygly
115120125
lysglyglyserasppheaspprolysglylysseraspalagluval
130135140
metargphecysglnalaphemetsergluleutyrarghisilegly
145150155160
alaaspcysaspvalproalaglyaspileglyvalglyalaargglu
165170175
ileglyphemetpheglyglntyrlysargleualaasnglnphethr
180185190
servalleuthrglylysglymetthrtyrglyglyserleuilearg
195200205
proglualathrglytyrglycysvaltyrphealagluglumetleu
210215220
lysargglnasplysargileaspglyargargvalalavalsergly
225230235240
serglyasnvalalaglntyralaalaarglysvalmetaspleugly
245250255
glylysvalileserleuseraspsergluglythrleutyralaglu
260265270
alaglyleuthraspalaglntrpaspalaleumetgluleulysasn
275280285
vallysargglyargilesergluleualaglyglnpheglyleuglu
290295300
phearglysglyglnthrprotrpserleuprocysaspilealaleu
305310315320
procysalathrglnasngluleuglyalagluaspalaargthrleu
325330335
leuargasnglycysilecysvalalagluglyalaasnmetprothr
340345350
thrleuglualavalaspilepheleuaspalaglyileleutyrala
355360365
proglylysalaserasnalaglyglyvalalavalserglyleuglu
370375380
metserglnasnalametargleuleutrpthralaglygluvalasp
385390395400
serlysleuhisasnilemetglnserilehishisalacysvalhis
405410415
tyrglygluglualaaspglyargileasntyrvallysglyalaasn
420425430
ilealaglyphevallysvalalaaspalametleualaglnglyval
435440445
val
<210>2
<211>351
<212>prt
<213>拜氏梭菌(clostridiumbeijerinckii)
<400>2
metlysglyphealametleuglyileasnlysleuglytrpileglu
151015
lysgluargprovalalaglysertyraspalailevalargproleu
202530
alavalserprocysthrseraspilehisthrvalphegluglyala
354045
leuglyasparglysasnmetileleuglyhisglualavalglyglu
505560
valvalgluvalglysergluvallysaspphelysproglyasparg
65707580
valilevalprocysthrthrproasptrpargserleugluvalgln
859095
alaglypheglnglnhisserasnglymetleualaglytrplysphe
100105110
serasnphelysaspglyvalpheglyglutyrphehisvalasnasp
115120125
alaaspmetasnleualaileleuprolysaspmetproleugluasn
130135140
alavalmetilethraspmetmetthrthrglyphehisglyalaglu
145150155160
leualaaspileglnmetglyserservalvalvalileglyilegly
165170175
alavalglyleumetglyilealaglyalalysleuargglyalagly
180185190
argileileglyvalglyserargproilecysvalglualaalalys
195200205
phetyrglyalathraspileleuasntyrlysasnglyhisileval
210215220
aspglnvalmetlysleuthrasnglylysglyvalaspargvalile
225230235240
metalaglyglyglysergluthrleuserglnalavalsermetval
245250255
lysproglyglyileileserasnileasntyrhisglyserglyasp
260265270
alaleuleuileproargvalglutrpglycysglymetalahislys
275280285
thrilelysglyglyleucysproglyglyargleuargalaglumet
290295300
leuargaspmetvalvaltyrasnargvalaspleuserlysleuval
305310315320
thrhisvaltyrhisglypheasphisilegluglualaleuleuleu
325330335
metlysasplysprolysaspleuilelysalavalvalileleu
340345350
<210>3
<211>401
<212>prt
<213>微卡分歧杆菌(mycolicibacteriumvaccae)
<400>3
metalalysvalleucysvalleutyraspaspprovalaspglytyr
151015
prolysthrtyralaargaspaspleuprolysileasphistyrpro
202530
glyglyglnileleuprothrprolysalaileaspphethrprogly
354045
glnleuleuglyservalserglygluleuglyleuargglutyrleu
505560
gluserasnglyhisthrleuvalvalthrserasplysaspglypro
65707580
aspservalphegluarggluleuvalaspalaaspvalvalileser
859095
glnprophetrpproalatyrleuthrprogluargilealalysala
100105110
lysasnleulysleualaleuthralaglyileglyserasphisval
115120125
aspleuglnseralaileaspargasnvalthrvalalagluvalthr
130135140
tyrserasnserileservalalagluhisvalvalmetmetileleu
145150155160
serleuvalargasntyrleuproserhisglutrpalaarglysgly
165170175
glytrpasnilealaaspcysvalserhisalatyraspleugluala
180185190
methisvalglythrvalalaalaglyargileglyleualavalleu
195200205
argargleualapropheaspvalhisleuhistyrthrglnarghis
210215220
argleuprogluservalglulysgluleuasnleuthrtrphisala
225230235240
thrarggluaspmettyrprovalcysaspvalvalthrleuasnval
245250255
proleuhisprogluthrgluhismetileasnaspgluthrleulys
260265270
leuphelysargglyalatyrilevalasnthralaargglylysleu
275280285
cysaspargaspalavalalaargalaleugluserglyargleuala
290295300
glytyralaglyaspvaltrppheproglnproalaprolysasphis
305310315320
protrpargthrmetprotyrasnglymetthrprohisilesergly
325330335
thrthrleuthralaglnalaargtyralaalaglythrarggluile
340345350
leuglucysphephegluglyargproileargaspglutyrleuile
355360365
valglnglyglyalaleualaglythrglyalahissertyrserlys
370375380
glyasnalathrglyglysergluglualaalalysphelyslysala
385390395400
val
<210>4
<211>336
<212>prt
<213>施氏假单胞菌(pseudomonasstutzeri)
<400>4
metleuprolysleuvalilethrhisargvalhisaspgluileleu
151015
glnleuleualaprohiscysgluleumetthrasnglnthraspser
202530
thrleuthrargglugluileleuargargcysargaspalaglnala
354045
metmetalaphemetproaspargvalaspalaasppheleuglnala
505560
cysprogluleuargvalvalglycysalaleulysglypheaspasn
65707580
pheaspvalaspalacysthralaargglyvaltrpleuthrpheval
859095
proaspleuleuthrvalprothralagluleualaileglyleuala
100105110
valglyleuglyarghisleuargalaalaaspalaphevalargser
115120125
glyglupheglnglytrpglnproglnphetyrglythrglyleuasp
130135140
asnalathrvalglyileleuglymetglyalaileglyleualamet
145150155160
alaaspargleuglnglytrpglyalathrleuglntyrhisgluala
165170175
lysalaleuaspthrglnthrgluglnargleuglyleuargglnval
180185190
alacyssergluleuphealaserserasppheileleuleualaleu
195200205
proleuasnalaaspthrglnhisleuvalasnalagluleuleuala
210215220
leuvalargproglyalaleuleuvalasnprocysargglyserval
225230235240
valaspglualaalavalleualaalaleugluargglyglnleugly
245250255
glytyralaalaaspvalpheglumetgluasptrpalaargalaasp
260265270
argproargleuileaspproalaleuleualahisproasnthrleu
275280285
phethrprohisileglyseralavalargalavalargleugluile
290295300
gluargcysalaalaglnserileileglnalaleualaglyalaarg
305310315320
proileasnalaalaasnargleuproglnalagluproalaalacys
325330335
- 还没有人留言评论。精彩留言会获得点赞!