作为靶向前列腺特异性膜抗原的治疗性放射性药物的177Lu-DOTA-HYNIC-iPSMA的制作方法
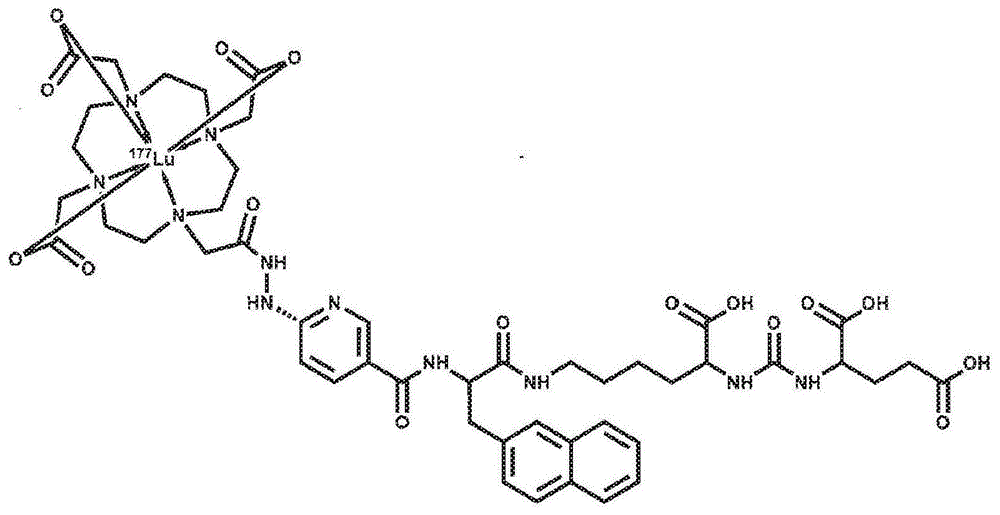
本发明涉及一种新型的作为前列腺特异性膜抗原抑制剂(ipsma)的镥-177治疗性放射性药物,其中与杂环性质的肼基烟酰胺(hynic)分子结合的1,4,7,10-四氮杂环十二烷-n,n',n”,n””-四乙酸(dota)产生使构象异构体和分子内氢键的数量最小化的刚性化学结构,从而产生分子中活性位点(lys(nal)-nh-co-nh-glu)的空间取向,其有助于psma蛋白的生物识别。新型放射性药物177lu-dota-hynic-ipsma在体内以高亲和力在过表达蛋白psma的肿瘤中累积,从而充当放射治疗剂。
背景技术:
前列腺癌(pc)是全球男性中第二大最常见的癌症[jemala,etal.cancerstatistics,2010.cacancerjclin.2010,60:277-300]。在局部性pc患者中,五年生存率接近100%,而在转移患者中,五年生存率是31%[weiq,etal.globalanalysisofdifferentiallyexpressedgenesinandrogen-independentprostatecancer.prostatecancerprostaticdis.2007,10:167-174]。最初,几乎所有转移患者对抗雄激素治疗反应良好。但是,pc患者的主要死亡原因是发展为雄激素非依赖性。
酶,谷氨酸羧肽酶ii,也称为前列腺特异性膜抗原(psma),在前列腺中的上皮细胞中表达,在95%的晚期前列腺癌中过表达。psma表达水平与pc的雄激素非依赖性、转移和发展直接相关[santonim.,etal.targetingprostate-specificmembraneantigenforpersonalizedtherapiesinprostatecancer:morphologicandmolecularbackgroundsandfuturepromises.jbiolregulhomeostagents.2014,28:555–563]。因此,psma是使用特异性放射性药物对转移性前列腺癌进行基于图像的检测和放射治疗的合适分子靶标。
psma基因包含19个外显子,代表大约60kb的基因组dna。该基因编码具有短细胞质片段(19个氨基酸)、疏水性跨膜结构域(24个氨基酸)和大胞外结构域(707个氨基酸)的ii型跨膜蛋白。psma在酶的活性中心含有zn,因此认为序列glu-nh-co-nh-lys(β-萘基丙氨酸)=glu-nh-co-nh-lys(nal)是其活性的有效抑制剂[benesová,m,etal.,preclinicalevaluationofatailor-madedota-conjugatedpsmainhibitorwithoptimizedlinkermoietyforimagingandendoradiotherapyofprostatecancer.jnuclmed,56,2015:914-920]。在特定的化学相互作用中,glu-nh-co-nh-lys片段的三个羧基与psma的活性位点处的肽侧链静电相互作用,尿素氧与锌配位,并且nal中的芳族结构相互作用以确保与酶中的活性疏水位点偶联。最近的临床研究示出使用由两种不同的lu-177标记的psma抑制剂衍生物,即177lu-psma-617和177lu-psma-i&t,导致pc患者的前列腺抗原(psa)水平显着降低50-70%而没有严重的副作用,从而显着提高了患者的生存率[ahmadzadehfarh.,etal.earlysideeffectsandfirstresultsofradioligandtherapywith177lu-dkfz-617psmaofcastrate-resistantmetastaticprostatecancer:atwo-centrestudy.ejnmmires.2015.5:36;kratochwilcetal.[177lu]lutetium-labelledpsmaligand-inducedremissioninapatientwithmetastaticprostatecancer.eurjnuclmedmolimaging,42,2015:987-988;weineisenm.etal.,68ga-and177lu-labeledpsmai&t:optimizationofapsma-targetedtheranosticconceptandfirstproof-of-concepthumanstudies.jnuclmed2015;56:1169-1176;baum,r.p.,etal.lutetium-177psmaradioligandtherapyofmetastaticcastration-resistantprostatecancer:safetyandefficacy.jnuclmed,2016,57:1006-1013;kratochwil,c,etal.psma-targetedradionuclidetherapyofmetastaticcastration-resistantprostatecancerwithlu-177labeledpsma-617.jnuclmed,2016,57:1170-1176;rahbar,ketal.responsetoandtolerabilityofasingledoseof177lu-psma-617inpatientswithmetastaticcastration-resistantprostatecancer:amulticenterretrospectiveanalysis.jnuclmed,2016,57:1334-1338;rahbar,ketal.germanmulticenterstudyinvestigating177lu-psma-617radioligandtherapyinadvancedprostatecancerpatients.jnuclmed,2017,58:85-90]。psma蛋白是多功能的,因为其可以充当在上皮细胞的信号转导和细胞迁移中起作用的内化受体、营养吸收酶或肽酶[rajasekarana.etal.isprostate-specificmembraneantigenamultifunctionalprotein?americanjournalofphysiology-cellphysiology.2005,288:c975-c981]。这样,抑制psma的放射性药物也可以用于除pc以外的其他肿瘤,例如用于转移性的乳腺癌、骨肉瘤、神经胶质瘤和分化型甲状腺癌等[lafougére,etal.invivovisualizationofprostate-specificmembraneantigeninglioblastoma.eurjnuclmedandmolimaging,2015,42:170-171;verburgfa,etal.firstevidenceofpsmaexpressionindifferentiatedthyroidcancerusing[68ga]psma-hbed-ccpet/cteurjnuclmedandmolimaging,2015,42:1622-1623;zengcetal.prostate-specificmembraneantigen:anewpotentialprognosticmarkerofosteosarcoma.medicaloncology,2012,29:2234-2239;sathekgemelal,68ga-psmaimagingofmetastaticbreastcancer.eurjnuclmedandmolimaging,2015,42:1482-1483]。
但是,在任何放射治疗之前,必须通过核成像评估肿瘤或其转移中放射性药物的摄取,以确定治疗是否对患者有用并确定提供辐射到肿瘤的消融剂量所需给予的活性,换句话说,应用个性化的和治疗诊断性的药物。为此,必须使用抑制psma的诊断性放射性药物来通过正电子发射断层扫描(pet)或单光子发射计算机断层扫描(spect)获得分子图像,其中68ga-psma-11(pet)由于其高度的灵敏性和特异性而被广泛应用于这方面的临床实践[edermetal.novelpreclinicalandradiopharmaceuticalaspectsof[68ga]ga-psma-hbed-cc:anewpettracerforimagingofprostatecancer.pharmaceuticals,2014,7:779-796;edermetal.68ga-complexlipophilicityandthetargetingpropertyofaurea-basedpsmainhibitorforpetimaging.bioconjugatechem,2012,23:688-697;weineisenetal.68ga-and177lu-labeledpsmai&t:optimizationofapsma-targetedtheranosticconceptandfirstproof-of-concepthumanstudies."jnuclmed,2015,56:1169-1176;afshar-oromieh,a.,etal.comparisonofpet/ctandpet/mrihybridsystemsusing68ga-labeledpsmaligandforthediagnosisofrecurrentprostatecancer:initialexperience.eurjnuclmedandmolecularimaging41.5(2014);887-897]。
但是,在国内和国际上,spect研究占核医学中所有研究的70%以上,因为它们的成本较低,并且设备和放射性核素的可用性更高,因为在医院或其附近不需要回旋加速器。用于spect成像的最广泛使用的放射性核素是99mtc,最近报道99mtcedda/hynic-ipsma是含有肼基烟酰胺(hynic)作为增强与psma中的疏水位点偶联的分子的脂溶性的关键化学基团的前列腺特异性膜抗原(ipsma)的放射性药物抑制剂,其与作为放射性金属99mtc的螯合剂的hynic的常规应用结合,其中乙二氨基乙酸(edda)用于完成放射性金属的配位球体。放射性药物99mtc-edda/hynic/ipsma使用核医学中的spect分子成像技术以高体内亲和力检测前列腺癌细胞中过表达的psma蛋白[ferro-floresg.,etal.clinicaltranslationofapsmainhibitorfor99mtc-basedspect.nuclmedbici,2017,48:36-44;santos-cuevasetal,99mtc-edda/hynic-ipsma:biokineticsandradiationdosimetryinhealthysubjectsandtumorimaginginpatientswithprostatecancer.nuclmedbiol,2017,52:1-6;lawali.o.,etal.diagnosticsensitivityoftc-99mhynicpsmaspect/ctinprostatecarcinoma:acomparativeanalysiswithga-68psmapet/ct,theprostate,2017,1-8;ferro-floresg.,etal.99mtc-edda/hynic-ipsmaasaradiopharmaceuticaifordetectingtheoverexpressionofprostate-specificmembraneantigen,wo2017222362,pct/mx2017/000068]。
为了研发可以被lu-177标记的配体hynic-ipsma的治疗诊断学对,本文中我们提出将dota分子与hynic结合,从而生成使构象异构体和分子内氢键最小化的刚性化学结构,从而产生有利于psma蛋白的生物学识别的分子中的活性位点(lys(nal)-nh-co-nh-glu)的空间取向。
具体实施方式
出于本发明的目的,呈现了新型的镥-177放射性药物,其可以抑制前列腺特异性膜抗原(ipsma),并含有结合到杂环性质的肼基烟酰胺(hynic)分子的1,4,7,10-四氮杂环十二烷-n,n',n”,n””-四乙酸(dota),从而产生刚性化学结构,其使构象异构体和分子内氢键的数量最小化,从而产生有利于psma蛋白生物学识别的分子中的活性位点(lys(nal)-nh-co-nh-glu)的空间取向。新型放射性药物177lu-dota-hynic-ipsma在体内以高亲和力在过表达蛋白psma的肿瘤中累积,从而充当放射治疗剂。申请专利的放射性药物(177lu-dota-hynic-ipsma)的结构如图1所示。
众所周知,由于其杂环性质,吡啶具有偶极矩和低于苯的共振能量(吡啶为117kj·mol–1,苯为150kj·mol–1)以及与苯和环己烷中c-c键的139pm值相比较短的cn键(137pm)[elschenbroichc.organometallchemie,6thed.,2008,isbn3-8351-0167-6],设计和合成衍生物177lu-dota-hynic–ipsma以得到相对于衍生物177lu-psma-617和177lu-psma-i&t使构象异构体和分子内氢键的数量最小化的hynic区域中的低反应性和刚性的化学结构。下表1给出了不同psma抑制剂的分子性质和最佳结构几何形状的比较结果。考虑到化合价、键类型,电荷和杂化,构建了配体psma-617、dota-hynic-ipsma和psma-i&t。使用cacheworksystempro软件套件得到与结构的最佳几何形状相关的最小能量(使用增强型mm3得到)和最低能量构象异构体(conflex程序)。使用量子力学方法与带有mopac(分子轨道)的
表1.当配位至lu-177时在临床研究中显示肿瘤摄取和放射性治疗效果的三种psma蛋白抑制配体的的分子性质
此外,在申请专利的放射性药物的结构中,hynic不用作与放射性金属螯合的分子,而在其他放射性药物中,hynic仅用作用于由99mtc标记的双功能剂[decristoforocetal.,99mtc-edda/hynic-toc:anew99mtc-labelledradiopharmaceuticalforimagingsomatostatinreceptor-positivetumours;firstclinicalresultsandintra-patientcomparisonwith111in-labelledoctreotidederivatives;2000,jnuclmed27;1318-25;ferro-floresgetal.preparationandevaluationof99mtc-edda/hynlc-[lys3]-bombesinforimagingofgrpreceptor-positivetumours.nuclmedcomm,2006,27:371-376;gonzález-vázquezaetal.dosimetryandbiokineticsof99mtc-edda/hynic-tyr3-octreotidepreparedfromlyophilizedkits.applredisot,2006,64:792-79;ortiz-arzatezetal.kitpreparationandbiokineticsinwomenof99mtc-edda/hynic-e-[c(rgdfk)]2forbreastcancerimaging.nuclmedcommon,2014,35:423-32;medina-garciavelal.afreeze-driedkitformulationforthepreparationoflys27(99mtc-edda/hynic)-exendin(9-39)/99mtc-edda/hynic-tyr3-octreotidetodetectbenignandmalignantinsulinomas.nuclmedbiol,2015,42:911-916]。
用于制备本发明放射性药物的方法
最初使用谷氨酸的二叔丁酯合成分子,所述酯在三乙胺(tea)存在下与羰二咪唑(cdi)反应形成酰基咪唑衍生物,其用三氟甲磺酸甲酯(meotf)活化以与(s)-叔丁基-2-氨基-6-(苄氧羰基氨基)己酸酯(cbz-lys-ot-bu)反应,随后通过氢解作用将cbz脱保护,从而得到衍生物glu-尿素-lys,其在固相(mbha树脂)中与氨基酸fmoc-β-萘基丙氨酸(hbtu/hobt)反应,然后在二异丙基乙胺(dipea)和二甲基甲酰胺(dmf)存在下与6-boc-肼基吡啶-3-甲酸(boc-hynic)反应,然后加入tfa。重复该后面的添加步骤以引入dota-tris(t-bu酯)。最后,将化合物用tfa脱保护,通过hplc纯化,并冻干。最终产物是glu-nh-co-nh-lys(β-萘基丙氨酸)-hynic-dota(dota-hynic-ipsma),其显示期望的质谱图,如图2所示。冻干的白色固体的反相hplc分析示出该化合物的化学纯度为98.8%。
将dota-hynic-ipsma(0.6mg)制成含有50mg甘露醇和100mg抗坏血酸的冻干药物形式。在含有无菌和无热原的镥177氯化物(177lucl3)的1.1ml乙酸钠1m缓冲溶液ph5.0中重构和在95℃下在干浴中温育30分钟后,所述制剂得到申请专利的化合物177lu-dota-hynic-ipsma的澄清的水性溶液,通过反相hplc确定的放射化学纯度大于98%,其放射色谱图如图3所示。
放射性药物保持稳定,标记大于7天后的放射化学纯度大于98%。在人血清中的体外稳定性测试示出6.5±1.8%的血清蛋白结合率和高放射化学稳定性(>98%)。由对psma蛋白(lncap)阳性的癌细胞中的饱和研究确定的177lu-dota-hynic-ipsma的亲和力显示6.33±2.69nm的kd和5.89±0.47nm的最大结合位点数(bmax)。
当在balb-c实验室小鼠中以40mg/kg的剂量给予时,化合物没有毒性或副作用。在患有lncap诱导的肿瘤的裸鼠中对177lu-dota-hynic-ipsma进行的生物分布测定显示所述肿瘤中的摄取为给予的活性的9.74±1.13%每克组织(%id/g),主要通过肾脏消除途径。
为了确定放射性药物的生物动力学和剂量,在177lu-dota-hynic-ipsma(185mbq)给药后20分钟和6、24、48和120h采集了五名健康受试者的全身图像。图像序列用于推断每个器官中的时间-活性曲线,以调整生物动力学模型并计算在源区域中发生的崩解的总数(n)。将n的值用于olinda/exm代码中来计算内部辐射剂量。健康志愿者的图像示出快速清除,快速成分的半衰期为1.1h(t1/2α=ln2/0.614),第一慢成分的半衰期为9.2h(t1/2β=ln2/0.075),第二慢成分的半衰期为79.6h(t1/2γ=ln2/0.008)。摄取和排泄主要是肾脏,肝脏摄取较低,甲状旁腺、唾液和泪腺中摄取较高。脾脏、肝脏、肾脏和唾液腺的平均摄取剂量分别为0.23、0.28、0.88和1.17mgy/mbq。
为了评估放射治疗的潜力,每8-10周对11例患者(平均年龄:66岁;范围:45-86)给予177lu-dota-hynic-ipsma(3.7或7.4gbq)的一个至四个周期的治疗。使用68ga-psma-11pet/ct(在临床实践和用于转移性前列腺癌病变的特异性检测的高分辨率技术中证明具有亲和力的放射性药物)的图像和确定治疗前后的血清前列腺特异性抗原(psa)水平评估应答。通过成像确定,约60%的患者表现出转移灶和原发性肿瘤中psa降低和转移灶的数量和大小和/或放射性药物的摄取强度降低了70%。
图4示出了健康志愿者在不同时间获得的放射性药物177lu-dota-hynic-ipsma的spect图像。图5示出了接受68ga-psma-11(pet,1h)和177lu-dota-hynic-ipsma(spect,24h)的患有晚期转移性前列腺癌的同一患者的pet和spect图像,表明这两种放射性药物检测与psma过表达相关的前列腺癌肿瘤和转移,从而证实放射性药物177lu-dota-hynic-ipsma检测体内前列腺癌细胞中过表达的psma的能力。最后,图6示出在用177lu-dota-hynic-ipsma治疗的第三周期后,转移性前列腺癌患者的图像。对68ga-psma-11(pet)进行的基于影像学的随访表明,每次给予177lu-dota-hynic-ipsma后,前列腺癌转移性病变部位(箭头所示)的大小和数量均减少直到完全消除。所述图像证实了177lu-dota-hynic-ipsma在过表达psma的肿瘤病变中的放射治疗潜力,并且是其主要证据。
总之,获得177lu-dota-hynic-ipsma,具有以下特征:
·放射化学纯度大于98%。
·放射性药物在体内检测过表达前列腺特异性膜抗原的肿瘤的能力,其与结合到dota分子的hynic的存在诱导的分子的活性位点(lys(nal)-nh-co-nh-glu)的有利空间取向有关。
·由于与结合到dota分子并用镥-177标记的hynic的存在诱导的分子的活性位点(lys(nal)-nh-co-nh-glu)的有利空间取向有关的分子识别,如血清psa水平显着降低以及在用177lu-dota-hynic-ipsma治疗的前列腺癌患者中观察到的转移病灶的数量和大小减少所显示,放射性药物177lu-dota-hynic-ipsma表现出放射治疗性质。
- 还没有人留言评论。精彩留言会获得点赞!