原位基因测序方法与流程
原位基因测序方法
交叉引用
[0001]
本专利申请案主张于2018年4月9日提交的编号为62/655,052的美国临时专利申请案、于2018年6月20日提交的编号为62/687,490的美国临时专利申请案以及于2019年2月20日提交的编号为62/808,159的美国临时专利申请案的优先权;上述专利中的内容以引用方式全文并入本文中。介绍
[0002]
在生物组织中,功能的多样性源自于形态的多样性,部分源自于细胞特异性基因表达的复杂性,这决定了各组织的独特三维分子解剖结构和细胞特性。现已出现用于测绘具有亚细胞分辨率的基因表达空间图谱的原位转录组分析工具,这种工具可能适用于探究这些组织结构-功能关系,包括多重原位rna杂交和原位rna测序。现有的原位测序方法在致密、复杂的组织环境中面临着实现酶促反应的挑战,且目前的测序效率低下,但是这种组织内测序法有着巨大的潜在价值;与基于杂交的多重分析/读数(其利用多个多核苷酸探针对基因同一性、测序进行编码)相比,这种组织内测序法可以在单核苷酸分辨率下进行操作,因此本质上其提供的信息量大幅增加。但是,由于实现在组织(例如,哺乳动物大脑)中的通量所必需的灵敏度、保真度和可扩展性方面的基础性限制,现有的测序方法不适用于3d完整组织。例如,哺乳动物大脑由各种复杂的细胞类型组成,其多样性对于取决于差异基因表达和电路特异性解剖结构的功能至关重要。在细胞分辨率下保留3d定位解剖结构的同时,获取高内涵基因表达信息较为困难,这限制了对大脑结构和功能的全面了解。本发明解决了上述问题并提供了相应的优势。
技术实现要素:
[0003]
本发明提供用于对完整组织内细胞中的靶核酸进行原位基因测序的设备、方法和系统。本发明还提供筛选候选试剂以确定所述候选试剂能否调控完整组织内细胞中核酸的基因表达的方法。
[0004]
本发明提供一种用于对完整组织内细胞中的靶核酸进行原位基因测序的方法,所述方法包含:(a)在允许发生特异性杂交的条件下,使固定透化完整组织与至少一对寡核苷酸引物接触,其中所述引物对包含第一寡核苷酸和第二寡核苷酸;其中所述第一寡核苷酸和所述第二寡核苷酸各自包含第一互补性区域、第二互补性区域和第三互补性区域;其中所述第二寡核苷酸进一步包含条形码序列;其中所述第一寡核苷酸的第一互补性区域与所述靶核酸的第一部分互补,其中所述第一寡核苷酸的第二互补性区域与所述第二寡核苷酸的第一互补性区域互补,其中所述第一寡核苷酸的第三互补性区域与所述第二寡核苷酸的第三互补性区域互补,其中所述第二寡核苷酸的第二互补性区域与所述靶核酸的第二部分互补,而且其中所述第一寡核苷酸的第一互补性区域与所述第二寡核苷酸的第二互补性区域相邻;(b)加入连接酶以连接所述第二寡核苷酸,并生成封闭的核酸环;(c)在核酸分子存在的情况下进行滚环扩增,其中所述操作包含采用所述第二寡核苷酸作为模板,以及采用所述第一寡核苷酸作为促使聚合酶形成一个或更多个扩增子的引物;(d)在水凝胶亚单元
存在的情况下包埋所述一个或更多个扩增子,以形成一个或更多个水凝胶包埋的扩增子;(e)在允许连接的条件下,使具有条形码序列的所述一个或更多个水凝胶包埋的扩增子与一对引物接触,其中所述引物对包含第三寡核苷酸和第四寡核苷酸,其中仅在第三寡核苷酸和第四寡核苷酸与同一扩增子连接时,方实现连接;(f)重复步骤(e);以及(g)对所述一个或更多个水凝胶包埋的扩增子进行成像,以确定完整组织内细胞中靶核酸的原位基因测序。在一些情况下,所述引物对在接触所述样品之前加热变性。在一些情况下,所述细胞存在于细胞群中。在一些情况下,所述细胞群包括多种细胞类型。
[0005]
本发明还提供一种筛选候选试剂以确定所述候选试剂能否调控完整组织内细胞中核酸的基因表达的方法,所述方法包含:(a)在允许发生特异性杂交的条件下,使固定透化完整组织与至少一对寡核苷酸引物接触,其中所述引物对包含第一寡核苷酸和第二寡核苷酸;其中所述第一寡核苷酸和所述第二寡核苷酸各自包含第一互补性区域、第二互补性区域和第三互补性区域;其中所述第二寡核苷酸进一步包含条形码序列;其中所述第一寡核苷酸的第一互补性区域与所述靶核酸的第一部分互补,其中所述第一寡核苷酸的第二互补性区域与所述第二寡核苷酸的第一互补性区域互补,其中所述第一寡核苷酸的第三互补性区域与所述第二寡核苷酸的第三互补性区域互补,其中所述第二寡核苷酸的第二互补性区域与所述靶核酸的第二部分互补,而且其中所述第一寡核苷酸的第一互补性区域与所述第二寡核苷酸的第二互补性区域相邻;(b)加入连接酶以连接所述第二寡核苷酸,并生成封闭的核酸环;(c)在核酸分子存在的情况下进行滚环扩增,其中所述操作包含采用所述第二寡核苷酸作为模板,以及采用所述第一寡核苷酸作为促使聚合酶形成一个或更多个扩增子的引物;(d)在水凝胶亚单元存在的情况下包埋所述一个或更多个扩增子,以形成一个或更多个水凝胶包埋的扩增子;(e)在允许连接的条件下,使具有条形码序列的所述一个或更多个水凝胶包埋的扩增子与一对引物接触,其中所述引物对包含第三寡核苷酸和第四寡核苷酸,其中仅在第三寡核苷酸和第四寡核苷酸与同一扩增子连接时,方实现连接;(f)重复步骤(e);(g)对所述一个或更多个水凝胶包埋的扩增子进行成像,以确定完整组织内细胞中靶核酸的原位基因测序;以及(h)检测所述靶核酸的基因表达水平,其中在所述至少一种候选试剂存在的情况下所述靶核酸的表达水平相对于在所述至少一种候选试剂不存在的情况下所述靶核酸的表达水平所发生的变化表明,所述至少一种候选试剂调控完整组织内细胞中核酸的基因表达。在一些情况下,所述引物对在接触所述样品之前加热变性。在一些情况下,所述细胞存在于细胞群中。在一些情况下,所述细胞群包括多种细胞类型。
[0006]
本发明还提供按照本文所述的方法使用的设备。在一些实施例中,提供了用于自动实施本文所述的方法的流体系统,从而允许连续操作。在一些实施例中,所述系统包括流体设备、被配置成实施本文所述的方法的处理器。
附图说明
[0007]
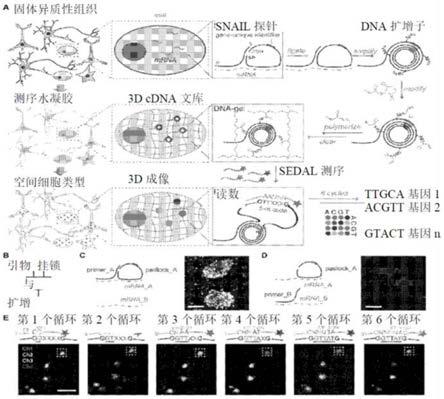
图1a-1e描述了本文所述的空间分辨转录物扩增子读数图测绘(starmap)方法的示意图,该方法包括在3d组织环境内对空间转录组学进行原位rna测序。
[0008]
图2a-2i描述了用于实现高质量rna成像和小鼠大脑实例化的基于分子内连接的核酸特异性扩增(snail)探针。
[0009]
图3a-3h描述了在starmap中用于减少背景噪点和固定扩增子的水凝胶组织化学
方法(htc)。
[0010]
图4a-4l描述了动态退火和连接法测序(sedal)方面,其中sedal是starmap的低背景噪点纠错原位测序组成部分。
[0011]
图5a-5n描述了采用本文所述的方法对初级视皮层中的细胞类型进行分类的情况。
[0012]
图6a-6c描述了用于starmap的数据处理流水线。
[0013]
图7a-7d描述了适用于抑制性和兴奋性亚聚类star图谱测绘的基因表达信息。
[0014]
图8a-8c描述了非神经元细胞类型的亚聚类。
[0015]
图9a-9g描述了采用本文所述的方法实现细胞聚类再现性时缺乏批处理效应的情况。
[0016]
图10a-10d描述了采用本文所述的方法检测和量化活性调节基因(arg)的细胞类型特异性调节的行为经验。
[0017]
图11a-11c描述了采用本文所述的方法获得的黑暗处理样品、光照处理样品以及arg的表达信息。
[0018]
图12描述了适用于薄组织切片和厚组织切片的starmap的实验流程图。
[0019]
图13a-13i描述了视皮层中细胞类型的三维结构。
[0020]
图14a-14b描述了连续sedal读数和多个标记基因的表达。
[0021]
图15a-15c描述了小鼠初级视皮层中短程抑制性聚类的2d最近邻分析和交叉方法验证。
[0022]
图16a-16e描述了starmap的可扩展性。
[0023]
图17描述了在starmap中识别出的神经元类型与已发布的单细胞rna测序结果的相关性。
[0024]
图18a-18f描述了采用本文所述的方法对内侧前额叶皮层(mpfc)的细胞类型亚聚类进行的基因表达分析。
[0025]
图19a-19c描述了采用本文所述的方法对mpfc的细胞聚类和空间组织进行的再现性测定。
[0026]
图20a-20c描述了采用本文所述的方法在6-轮测序中对小鼠海马细胞培养物中的1020个基因进行的分析。
[0027]
图21a-21c描述了采用本文所述的方法对小鼠初级视皮层中的1020个基因进行的基因表达分析。
[0028]
图22a-22d描述了采用本文所述的方法对小鼠初级视觉层中1020个基因的测量值进行的再现性测定和交叉方法比较。
[0029]
图23a-23d描述了适用于薄组织切片和厚组织切片的starmap的实验流程图和成本估算。
[0030]
图24a-24b描述了用于实施本文所述的方法的示例性流体系统的平面布局图。实施方式
[0031]
本发明提供用于对完整组织内细胞中的靶核酸进行原位基因测序的设备、方法和系统。本发明还提供筛选候选试剂以确定所述候选试剂能否调控完整组织内细胞中核酸的基因表达的方法。
[0032]
在一些实施例中,所揭示的用于大脑和其他器官中3d完整组织rna测序的方法(被称为空间分辨转录物扩增子读数图测绘(starmap))包括整合经改进的连接法测序流程、特异性信号扩增和水凝胶组织化学方法(图1a)。在某些方面,starmap可以通过对小鼠视皮层切片内所有细胞中的160个不同基因进行测序,测绘细胞分辨率表达图谱。在某些方面,starmap可以识别皮质层内不同的解剖学和分子分辨细胞类型(包括中间神经元和神经胶质亚型),并对活性调节基因进行定量表达,这种表达随视觉刺激、空间位置和分子定义的细胞类型而变化。在某些方面,starmap可以对立方毫米级体积中的30,000多个细胞进行量化,表明兴奋性神经元亚型的梯度分布与抑制性神经元的3d聚类模式形成了鲜明对比。
[0033]
在一些实施例中,原位合成水凝胶与细胞内递送界面(与天然生物分子偶联)整合,这可以使组织(由其组成细胞内部开始)转变成适于进行高分辨率体积成像和分析(与适用于蛋白、核酸和其他靶标的多种分子表型分析兼容)的新状态。例如,合成水凝胶已用于适应酶促反应(包括dna测序),且在本领域中是众所周知的,包括但不限于wo2014/025392中所揭示的技术,该专利中的内容以引用方式并入本文。在一些实施例中,可以将生物组织转化为与rna衍生的互补dna(cdna)的产生、保留和功能性表达兼容的水凝胶包埋形式。在这些方面,可以在所述组织水凝胶制剂中进行3d原位测序,从而利用光学透明性的关键伴随特性,减少背景噪点,提高扩散速率,提高机械稳定性。
[0034]
术语“肽”、“多肽”和“蛋白”在本文中可互换使用,是指任何长度的聚合形式的氨基酸,其可以包括编码和非编码的氨基酸、经化学或生物化学修饰或衍生的氨基酸以及具有经修饰的肽骨架的多肽。术语“多肽”包括融合蛋白,包括但不限于具有异源氨基酸序列的融合蛋白;具有异源和同源前导序列、含或不含n末端甲硫氨酸残基的融合蛋白;免疫标记蛋白等。术语“多肽”包括符合以下要求的多肽,即包括脂肪酸部分、脂质部分、糖部分和碳水化合物部分中的一种或更多种。术语“多肽”包括翻译后修饰的多肽。
[0035]
本文中使用的术语“靶核酸”是指存在于单细胞中的任何多核苷酸核酸分子(例如,dna分子、rna分子、经修饰的核酸等)。在一些实施例中,所述靶核酸是编码rna(例如,mrna)。在一些实施例中,所述靶核酸是非编码rna(例如,trna、rrna、微小rna(mirna)、成熟mirna、未成熟mirna等)。在一些实施例中,所述靶核酸是细胞环境中rna分子(例如,mrna、mrna前体等)的剪接变体。因此,合适的靶核酸可以是未剪接的rna(例如,mrna前体、mrna)、部分剪接的rna或完全剪接的rna等。目的靶核酸在细胞群中可以有不同程度的表达,即具有不同的丰度,其中本发明的方法允许分析和比较个体细胞中核酸(包括但不限于rna转录物)的表达水平。靶核酸也可以是dna分子,例如,变性基因组dna、病毒dna、质粒dna等。例如,所述方法可用于检测拷贝数变异,例如,癌细胞群中的拷贝数变异,其中靶核酸以不同的丰度存在于所述细胞群内的细胞以及受病毒感染的细胞的基因组中,以便确定病毒载量和动力学特征等。
[0036]
术语“寡核苷酸”、“多核苷酸”和“核酸分子”在本文中可互换使用,是指任何长度的聚合形式的核苷酸,即核糖核苷酸或脱氧核糖核苷酸。因此,该术语包括但不限于单链、双链或多链dna或rna;基因组dna、cdna、dna-rna杂交体;或包括嘌呤和嘧啶碱基或其他天然、经化学或生物化学修饰、非天然或衍生的核苷酸碱基的聚合物。所述多核苷酸的骨架可包括糖和磷酸基团(通常见于rna或dna中),或经修饰或取代的糖或磷酸基团。或者,所述多核苷酸的骨架可包括由合成亚单元组成的聚合物(例如,亚磷酰胺和/或硫代磷酸酯),因此
可以是寡脱氧核苷氨基磷酸酯或混合的氨基磷酸酯-磷酸二酯低聚物。peyrottes等人(1996),核酸研究,24:1841-1848;chaturvedi等人(1996),核酸研究,24:2318-2323。所述多核苷酸可以包括一种或更多种l型核苷。多核苷酸可以包括经修饰的核苷酸,例如,甲基化核苷酸和核苷酸类似物、尿嘧啶、其他糖类、连接基团(例如氟核糖和硫代酯)以及核苷酸分支。核苷酸的序列可以被非核苷酸组分中断。可以修饰多核苷酸,以包括n3'-p5'(np)氨基磷酸酯、吗啉代磷酰二胺(mf)、锁核酸(lna)、2'-o-甲氧基乙基(moe)或2'-氟代阿拉伯糖核酸(fana),其可以增强所述多核苷酸对核酸酶降解的抗性(请参阅,例如,faria等人(2001),自然生物科技,19:40-44;toulme(2001),自然生物科技,19:17-18)。多核苷酸可在聚合后进一步修饰,例如通过与标记组分共轭。此定义中包括的其他类型的修饰是加帽,一个或更多个天然存在的核苷酸用类似物置换,以及多核苷酸附接到蛋白、金属离子、标记组分、其他多核苷酸或固体载体上的方式的引入。免疫调节核酸分子可以各种制剂形式提供,例如,与脂质体缔合、微胶囊化等,详情如本文所述。扩增中采用的多核苷酸通常是单链多核苷酸,以最大程度地提高扩增效率,但也可以是双链多核苷酸。
--
如果是双链多核苷酸,则在用于制备延伸产物之前,可以先处理所述多核苷酸,以使其双链分开。-此变性步骤通常受高温影响,但也可以利用碱进行相关操作,然后进行中和。
[0037]“受试者”或“个体”或“患者”均是指任何需要接受治疗的受试者。人类受试者特别引入关注。其他受试者可能包括非人灵长类动物、牛、绵羊、山羊、狗、猫、鸟(例如,鸡或其他家禽)、豚鼠、兔、大鼠、小鼠、马等。值得注意的是已出现或易出现脑损伤的受试者。
[0038]
在进一步描述本发明之前,应当理解,本发明不限于所描述的特定实施例,因为在实际实施中一定会存在差异。还应当理解,本专利中使用的术语仅用于描述特定实施例,而无意限制本发明构思,本发明的范围将仅由所附权利要求书限定。
[0039]
在提供数值范围的情况下,应当理解,该范围的上限和下限之间的每个中间值以及在该范围内的任何其他规定值或中间值都包含在本发明的范围内。除非上下文另有明确规定,否则每个中间值应低至下限单位的十分之一。这些较小范围的上限和下限可独立地包括在较小范围内,并且也包括在本发明内,需遵守所述范围内任何特别排除的限值的要求。在所述范围包括一个或两个限值的条件下,排除了那些所包括限值中的任一个或两个的范围也包括在本发明内。
[0040]
除非另有定义,否则本专利所用的所有技术和科学术语的含义与本发明所属领域的普通技术人员通常理解的含义相同。尽管与本文所描述的方法和材料类似或等同的方法和材料也可用于本发明的实施或测试中,但下文描述了首选的方法和材料。本专利提及的所有出版物均以引用方式并入本文,以公开和描述与所引用出版物有关的方法和/或材料。
[0041]
必须注意的是,如本专利和所附权利要求书中所使用的,单数形式的“一”、“一个”和“所述/该”包括复数指代对象,除非上下文另有明确说明。因此,举例而言,“一个细胞”的指代对象包括多个此类细胞,而“所述寡核苷酸”指的是一种或更多种寡核苷酸及所属领域技术人员已知的等效物,等等。还应注意,可以起草权利要求以排除任何可选要素。因此,该陈述旨在作为使用诸如“单独”、“仅”等与陈述权利要求要素有关的专用术语或使用“否定”限制的前置基础。
[0042]
应当理解,为清楚起见,在单独实施例的上下文中描述的本发明的某些特征也可以在单个实施例中以组合形式呈现。相反,为简洁起见,在单个实施例的上下文中描述的本
发明的各种特征也可以单独或以任何合适的子组合形式呈现。与本发明有关的实施例的所有组合都明确地被本发明涵盖,且在本文中公开,如同每种组合都被单独、明确地公开一般。此外,各种实施例及其构成部分的所有子组合也明确地被本发明涵盖,且在本文中公开,如同每种子组合都被单独、明确地公开一般。
[0043]
本专利所讨论的出版物仅供在本专利的申请日之前披露。本文中无任何内容可以解释为承认由于之前的发明使得本发明无权早于此类出版物。此外,所提供的出版日期可能与实际出版日期不同,可能需要单独确认。方法
[0044]
本文所揭示的方法包括基于图像的原位核酸(dna和/或rna)测序技术,该技术可以通过经改进的连接法测序流程、特异性信号扩增、将生物组织转变为透明测序芯片的水凝胶组织化学方法以及相关数据分析流水线(统称为“空间分辨转录物扩增子读数图测绘(starmap)”),以在亚细胞和细胞水平下进行空间分辨的高度多重化基因检测。在一些实施例中,starmap定义了用于3d原位转录组分析的平台,其通过经改进的cdna文库制备、测序和水凝胶组织化学方法来实现。
[0045]
如上所述,本文所揭示的方法包括一种用于对完整组织内细胞中的靶核酸进行原位基因测序的方法,所述方法包括:(a)在允许发生特异性杂交的条件下,使固定透化完整组织与至少一对寡核苷酸引物接触,其中所述引物对包括第一寡核苷酸和第二寡核苷酸;其中所述第一寡核苷酸和所述第二寡核苷酸各自包括第一互补性区域、第二互补性区域和第三互补性区域;其中所述第二寡核苷酸进一步包括条形码序列;其中所述第一寡核苷酸的第一互补性区域与所述靶核酸的第一部分互补,其中所述第一寡核苷酸的第二互补性区域与所述第二寡核苷酸的第一互补性区域互补,其中所述第一寡核苷酸的第三互补性区域与所述第二寡核苷酸的第三互补性区域互补,其中所述第二寡核苷酸的第二互补性区域与所述靶核酸的第二部分互补,而且其中所述第一寡核苷酸的第一互补性区域与所述第二寡核苷酸的第二互补性区域相邻;(b)加入连接酶以连接所述第二寡核苷酸,并生成封闭的核酸环;(c)在核酸分子存在的情况下进行滚环扩增,其中所述操作包括采用所述第二寡核苷酸作为模板,以及采用所述第一寡核苷酸作为促使聚合酶形成一个或更多个扩增子的引物;(d)在水凝胶亚单元存在的情况下包埋所述一个或更多个扩增子,以形成一个或更多个水凝胶包埋的扩增子;(e)在允许连接的条件下,使具有条形码序列的所述一个或更多个水凝胶包埋的扩增子与一对引物接触,其中所述引物对包括第三寡核苷酸和第四寡核苷酸,其中仅在第三寡核苷酸和第四寡核苷酸与同一扩增子连接时,方实现连接;(f)重复步骤(e);以及(g)对所述一个或更多个水凝胶包埋的扩增子进行成像,以确定完整组织内细胞中靶核酸的原位基因测序。
[0046]
本文所揭示的方法还提供了一种筛选候选试剂以确定所述候选试剂能否调控完整组织内细胞中核酸的基因表达的方法,所述方法包括:(a)在允许发生特异性杂交的条件下,使固定透化完整组织与至少一对寡核苷酸引物接触,其中所述引物对包括第一寡核苷酸和第二寡核苷酸;其中所述第一寡核苷酸和所述第二寡核苷酸各自包括第一互补性区域、第二互补性区域和第三互补性区域;其中所述第二寡核苷酸进一步包括条形码序列;其中所述第一寡核苷酸的第一互补性区域与所述靶核酸的第一部分互补,其中所述第一寡核苷酸的第二互补性区域与所述第二寡核苷酸的第一互补性区域互补,其中所述第一寡核苷
酸的第三互补性区域与所述第二寡核苷酸的第三互补性区域互补,其中所述第二寡核苷酸的第二互补性区域与所述靶核酸的第二部分互补,而且其中所述第一寡核苷酸的第一互补性区域与所述第二寡核苷酸的第二互补性区域相邻;(b)加入连接酶以连接所述第二寡核苷酸,并生成封闭的核酸环;(c)在核酸分子存在的情况下进行滚环扩增,其中所述操作包括采用所述第二寡核苷酸作为模板,以及采用所述第一寡核苷酸作为促使聚合酶形成一个或更多个扩增子的引物;(d)在水凝胶亚单元存在的情况下包埋所述一个或更多个扩增子,以形成一个或更多个水凝胶包埋的扩增子;(e)在允许连接的条件下,使具有条形码序列的所述一个或更多个水凝胶包埋的扩增子与一对引物接触,其中所述引物对包括第三寡核苷酸和第四寡核苷酸,其中仅在第三寡核苷酸和第四寡核苷酸与同一扩增子连接时,方实现连接;(f)重复步骤(e);(g)对所述一个或更多个水凝胶包埋的扩增子进行成像,以确定完整组织内细胞中靶核酸的原位基因测序;以及(h)检测所述靶核酸的基因表达水平,其中在所述至少一种候选试剂存在的情况下所述靶核酸的表达水平相对于在所述至少一种候选试剂不存在的情况下所述靶核酸的表达水平所发生的变化表明,所述至少一种候选试剂调控完整组织内细胞中核酸的基因表达。
[0047]
在某些方面,与现有的基因表达分析工具相比,本文所揭示的方法能够缩短处理时间,提高多重性(至多1000个基因),提升效率,提高灵敏度,降低错误率,同时增加空间分辨的细胞类型。在这些方面,所述改进的水凝胶组织化学方法可以将生物组织转变为具有与原位测序相容的水凝胶印迹的核酸,这是一种适用于错误率有所降低的原位测序的经改进的连接法测序流程(sedal)。在一些其他方面,本文所揭示的方法包括具有单细胞和/或单分子灵敏度的用于生物医学研究和临床诊断(例如,癌症、细菌感染、病毒感染等)的空间测序(例如,试剂、芯片或服务)。基于分子内连接的核酸特异性扩增(snail)
[0048]
在一些实施例中,starmap的一个组成部分包括一种利用细胞rna原位生成cdna文库的有效方法,这种方法可以称之为snail,即,基于分子内连接的核酸特异性扩增。在某些实施例中,本发明的方法包括在允许发生特异性杂交的条件下,使固定透化完整组织与至少一对寡核苷酸引物接触,其中所述引物对包括第一寡核苷酸和第二寡核苷酸。
[0049]
更普遍地讲,所述存在于组织内目的细胞中的核酸可用作复合物组装体的支架,所述复合物包括一对引物,这对引物在本文中被称为第一寡核苷酸和第二寡核苷酸。在一些实施例中,接触所述固定透化完整组织包括使所述引物对与同一靶核酸杂交。在一些实施例中,所述靶核酸是rna。在这些实施例中,所述靶核酸可以是mrna。在其他实施例中,所述靶核酸是dna。
[0050]
本文中使用的术语“杂化”和“杂交”是指在核苷酸序列之间形成复合物,所述核苷酸序列适当互补以经由watson-crick碱基配对形成复合物。在引物与靶标(模板)“杂交”的情况下,此等复合物(或杂交体)足够稳定,能够发挥诸如促使dna聚合酶引发dna合成所需的引发作用。应当理解,在提供稳定的杂交体方面,所述杂交序列无需具有完美互补性。在许多情况下,会形成稳定的杂交体,其中错配的碱基比例低于约10%,且会忽略由四个或更多个核苷酸组成的环。因此,本文中使用的术语“互补的”是指在测定条件(通常同源性约为90%或更高)下与其“补体”形成稳定双链体的寡核苷酸。snail寡核苷酸引物
[0051]
在本发明的方法中,所述snail寡核苷酸引物至少包括第一寡核苷酸和第二寡核苷酸;其中所述第一寡核苷酸和所述第二寡核苷酸各自包括第一互补性区域、第二互补性区域和第三互补性区域;其中所述第二寡核苷酸进一步包括条形码序列;其中所述第一寡核苷酸的第一互补性区域与所述靶核酸的第一部分互补,其中所述第一寡核苷酸的第二互补性区域与所述第二寡核苷酸的第一互补性区域互补,其中所述第一寡核苷酸的第三互补性区域与所述第二寡核苷酸的第三互补性区域互补,其中所述第二寡核苷酸的第二互补性区域与所述靶核酸的第二部分互补,而且其中所述第一寡核苷酸的第一互补性区域与所述第二寡核苷酸的第二互补性区域相邻。在替代实施例中,所述第二寡核苷酸是封闭的环状分子,且省略了连接步骤。
[0052]
本发明提供方法,其中接触所述固定透化完整组织包括使对不同靶核酸具有特异性的多种寡核苷酸引物杂交。在一些实施例中,所述方法包括多个与靶核苷酸序列杂交的第一寡核苷酸,包括但不限于5个或更多个第一寡核苷酸,例如,8个或更多、10个或更多、12个或更多、15个或更多、18个或更多、20个或更多、25个或更多、30个或更多、35个或更多。在一些实施例中,本发明的方法包括多个第一寡核苷酸,包括但不限于15个或更多个第一寡核苷酸,例如,20个或更多、30个或更多、40个或更多、50个或更多、60个或更多、70个或更多以及至多80个不同的第一寡核苷酸,其与15个或更多,例如,20个或更多、30个或更多、40个或更多、50个或更多、60个或更多、70个或更多以及至多80个不同的靶核苷酸序列杂交。在一些实施例中,所述方法包括多个第二寡核苷酸,包括但不限于5个或更多个第二寡核苷酸,例如,8个或更多、10个或更多、12个或更多、15个或更多、18个或更多、20个或更多、25个或更多、30个或更多、35个或更多。在一些实施例中,本发明的方法包括多个第二寡核苷酸,包括但不限于15个或更多个第二寡核苷酸,例如,20个或更多、30个或更多、40个或更多、50个或更多、60个或更多、70个或更多以及至多80个不同的第一寡核苷酸,其与15个或更多,例如,20个或更多、30个或更多、40个或更多、50个或更多、60个或更多、70个或更多以及至多80个不同的靶核苷酸序列杂交。可以在反应中使用多个寡核苷酸对,其中一个或更多个寡核苷酸对与每个靶核酸特异性结合。例如,可以将两个引物对用于一个靶核酸,以提高灵敏度,减少变异性。同样关注的是,检测细胞中多个不同的靶核酸,例如,检测至多2个、至多3个、至多4个、至多5个、至多6个、至多7个、至多8个、至多9个、至多10个、至多12个、至多15个、至多18个、至多20个、至多25个、至多30个、至多40个或更多个不同的靶核酸。所述引物通常在使用前变性,这通常通过加热至至少约50℃、至少约60℃、至少约70℃、至少约80℃以及至多约99℃、至多约95℃、至多约90℃的温度来实现。
[0053]
在一些实施例中,所述引物在接触所述样品之前加热变性。在某些方面,选定寡核苷酸的所述解链温度(t
m
)以最大限度地减少寡核苷酸在溶液中的连接。核酸的“解链温度”或“tm”是指所述核酸的螺旋结构的一半由于加热或碱基对之间的氢键以其他方式发生解离(例如,通过酸或碱处理等实现)而丢失时的温度。核酸分子的t
m
取决于其长度以及其碱基组成。富含gc碱基对的核酸分子的t
m
高于具有大量at碱基对的核酸分子的解链温度。在所述温度降至t
m
以下时,核酸已分离的互补链会自发地重新缔合或退火,以形成双链核酸。最高的核酸杂交速率发生于t
m
以下约25摄氏度下。可以用以下关系式来估算t
m
:t
m
=69.3+0.41(gc)%(marmur等人(1962),分子生物学杂志,5:109-118)。
[0054]
在某些实施例中,所述多个第二寡核苷酸包括挂锁探针。在一些实施例中,所述探
针包括可被测定和量化的可检测标记。术语“标记”和“可检测标记”是指能够检测的分子,包括但不限于放射性同位素、荧光剂、化学发光剂、酶、酶底物、酶辅因子、酶抑制剂、发色团、染料、金属离子、金属溶胶、配体(例如,生物素或半抗原)等。术语“荧光剂”是指能够在可检测范围内显示出荧光的物质或其部分。可与本发明结合使用的标记的具体示例包括但不限于藻红蛋白、alexa染料、荧光素、ypet、cypet、cascade blue、别藻蓝蛋白、cy3、cy5、cy7、罗丹明、丹磺酰基、伞形酮、texas red、鲁米诺、吖啶酯、生物素、绿色荧光蛋白(gfp)、增强型绿色荧光蛋白(egfp)、黄色荧光蛋白(yfp)、增强型黄色荧光蛋白(eyfp)、蓝色荧光蛋白(bfp)、红色荧光蛋白(rfp)、萤火虫荧光素酶、海肾荧光素酶、nadph、β-半乳糖苷酶、辣根过氧化物酶、葡萄糖氧化酶、碱性磷酸酶、氯霉素乙酰转移酶和脲酶。
[0055]
在一些实施例中,所述一个或更多个第一寡核苷酸和第二寡核苷酸与所述靶核酸的不同区域或靶位点结合。在一个靶位点对中,每个靶位点是不同的,且所述靶位点是所述靶核酸上的相邻位点(例如,与另一位点的间距通常不超过15个核苷酸距离,例如,不超过10、8、6、4或2个核苷酸距离),并且可以是连续位点。靶位点通常以相同朝向存在于所述靶核酸的同一链上。此外,还会相对于所述细胞中存在的其他核酸选择靶位点,以提供独特的结合位点。每个靶位点的长度通常为约19至约25个核苷酸,例如,约19至23个核苷酸、约19至21个核苷酸或约19至20个核苷酸。选择所述第一和第二寡核苷酸对,使得所述寡核苷酸对中的每个寡核苷酸具有相似的解链温度,以便与其同源靶位点结合,例如,所述t
m
可以不低于约50℃、不低于约52℃、不低于约55℃、不低于约58℃、不低于约62℃、不低于约65℃、不低于约70℃或不低于约72℃。通常选择的所述靶位点的gc含量不超过约20%、不超过约30%、不超过约40%、不超过约50%、不超过约60%、不超过约70%。
[0056]
在一些实施例中,所述第一寡核苷酸包括第一、第二和第三互补性区域。所述第一寡核苷酸的靶位点可以指第一互补性区域。如上所述,所述第一寡核苷酸的第一互补性区域的长度可以为19-25个核甘酸。在某些方面,所述第一寡核苷酸的第二互补性区域的长度为3-10个核苷酸,包括,例如,4-8个核苷酸或4-7个核苷酸。在一些方面,所述第一寡核苷酸的第二互补性区域的长度为6个核甘酸。在一些实施例中,所述第一寡核苷酸的第三互补性区域的长度同样为6个核苷酸。在这些实施例中,所述第一寡核苷酸的第三互补性区域的长度为3-10个核苷酸,包括,例如,4-8个核苷酸或4-7个核苷酸。
[0057]
在一些实施例中,第二第一寡核苷酸包括第一、第二和第三互补性区域。所述第二寡核苷酸的靶位点可以指第二互补性区域。如上所述,所述第二寡核苷酸的第二互补性区域的长度可以为19-25个核甘酸。在某些方面,所述第一寡核苷酸的第一互补性区域的长度为3-10个核苷酸,包括,例如,4-8个核苷酸或4-7个核苷酸。在一些方面,所述第一寡核苷酸的第一互补性区域的长度为6个核甘酸。在一些方面,所述第二寡核苷酸的第一互补性区域包括所述第二寡核苷酸的5'末端。在一些实施例中,所述第二寡核苷酸的第三互补性区域的长度同样为6个核苷酸。在这些实施例中,所述第二寡核苷酸的第三互补性区域的长度为3-10个核苷酸,包括,例如,4-8个核苷酸或4-7个核苷酸。在进一步实施例中,所述第二寡核苷酸的第三互补性区域包括所述第二寡核苷酸的3'末端。在一些实施例中,所述第二寡核苷酸的第一互补性区域与所述第二寡核苷酸的第三互补性区域相邻。
[0058]
在一些方面,所述第二寡核苷酸包括条形码序列,其中所述第二寡核苷酸的条形码序列提供用于识别所述靶核酸的条形码信息。术语“条形码”是指用于识别单个细胞或细
胞亚群的核酸序列。条形码序列可在扩增过程中与目的靶核酸连接,并用于将扩增子追溯至所述靶核酸所源自的细胞。条形码序列可在用寡核苷酸进行扩增的过程中添加至目的靶核酸上,所述寡核苷酸含有一个包括条形码序列的区域以及一个与所述靶核酸互补的区域,从而使所述条形码序列掺入所述最终扩增的靶核酸产物(即,扩增子)中。组织
[0059]
如本文所述,所揭示的方法包括完整组织的原位测序技术,这通过在允许发生特异性杂交的条件下,至少使固定透化完整组织与至少一对寡核苷酸引物接触实现。适于与本文所述的方法结合使用的组织试样通常包括从活体或死亡受试者身上收集的任何类型的组织试样,例如,活检试样和尸检试样,其中包括但不限于上皮组织、肌肉组织、结缔组织和神经组织。可以采用本文所述的方法收集和处理组织试样,并在处理后立即对所述试样进行显微镜分析,或者对其进行保存并在日后(例如,储存较长一段时间后)进行显微镜分析。在一些实施例中,本文所述的方法可用于保存组织试样,使其保持稳定、可获取且完好无缺的状态,以供日后分析使用。在一些实施例中,本文所述的方法可用于分析先前保存或储存的组织试样。在一些实施例中,所述完整组织包括脑组织,例如视皮层切片。在一些实施例中,所述完整组织是厚度为5-20μm的薄切片,包括但不限于,例如,5-18μm、5-15μm或5-10μm。在其他实施例中,所述完整组织是厚度为50-200μm的厚切片,包括但不限于,例如,50-150μm、50-100μm或50-80μm。
[0060]
本发明的方面包括固定完整组织。本文中使用的术语“固定处理”或“固定”是指保存生物材料(例如,组织、细胞、细胞器官、分子等)以免腐烂和/或降解的过程。固定可以依照任何合适的方案来完成。固定可以包括使所述样品与固定试剂(即,含有至少一种固定剂的试剂)接触。可以使样品与固定试剂接触较长一段时间,接触时长具体取决于温度、样品的性质以及固定剂。例如,可以使样品与固定试剂接触24小时或更短、18小时或更短、12小时或更短、8小时或更短、6小时或更短、4小时或更短、2小时或更短、60分钟或更短、45分钟或更短、30分钟或更短、25分钟或更短、20分钟或更短、15分钟或更短、10分钟或更短、5分钟或更短或2分钟或更短。
[0061]
可以使样品与固定试剂接触一段时间,所述时间范围为5分钟至24小时,例如,10分钟至20小时、10分钟至18小时、10分钟至12小时、10分钟至8小时、10分钟至6小时、10分钟至4小时、10分钟至2小时、15分钟至20小时、15分钟至18小时、15分钟至12小时、15分钟至8小时、15分钟至6小时、15分钟至4小时、15分钟至2小时、15分钟至1.5小时、15分钟至1小时、10分钟至30分钟、15分钟至30分钟、30分钟至2小时、45分钟至1.5小时或55分钟至70分钟。
[0062]
可以在各种温度下使样品与固定试剂接触,具体取决于所述方案和所用试剂。例如,在一些情况下,可以在-22℃至55℃的温度范围内使样品与固定试剂接触,其中特定目的温度范围包括但不限于50至54℃、40至44℃、35至39℃、28至32℃、20至26℃、0至6℃和-18至-22℃。在一些情况下,可以在-20℃、4℃、室温(22-25℃)、30℃、37℃、42℃或52℃的温度下使样品与固定试剂接触。
[0063]
可以使用任何合适的固定试剂。常见的固定试剂包括交联固定剂、沉淀固定剂、氧化固定剂、汞剂等。交联固定剂通过共价键以化学方式连接两个或更多个分子,且可以使用各种交联试剂。合适的交联固定剂的示例包括但不限于醛类(例如,甲醛,也通常被称为“多聚甲醛”和“福尔马林”;戊二醛等)、亚氨酸酯,nhs(n-羟基琥珀酰亚胺)酯等。合适的沉淀固
定剂的示例包括但不限于醇类(例如,甲醇、乙醇等)、丙酮、乙酸等。在一些实施例中,所述固定剂是甲醛(即,多聚甲醛或福尔马林)。固定试剂中甲醛的合适的最终浓度为0.1-10%、1-8%、1-4%、1-2%、3-5%或3.5-4.5%,包括约1.6%,维持10分钟。在一些实施例中,所述样品被固定在最终浓度为4%的甲醛中(用浓度更高的储备溶液稀释而成,例如,38%、37%、36%、20%、18%、16%、14%、10%、8%、6%等)。在一些实施例中,所述样品被固定在最终浓度为10%的甲醛中。在一些实施例中,所述样品被固定在最终浓度为1%的甲醛中。在一些实施例中,所述固定剂是戊二醛。固定试剂中戊二醛的合适浓度为0.1至1%。固定试剂可以含有任何组合中一种以上的固定剂。例如,在一些实施例中,所述样品与含有甲醛和戊二醛的固定试剂接触。
[0064]
本文中使用的术语“透性化”或“透化”是指使样品中的细胞(细胞膜等)对于实验试剂(例如,核酸探针、抗体、化学底物等)而言可渗透的过程。可以使用用于透性化的任何合适的方法和/或试剂。合适的透性化试剂包括去污剂(例如,皂苷、triton x-100、tween-20等)、有机固定剂(例如,丙酮、甲醇、乙醇等)、酶等。可以使用各种浓度的去污剂。例如,可使用0.001%-1%去污剂、0.05%-0.5%去污剂或0.1%-0.3%去污剂实现透性化(例如,0.1%皂苷、0.2%tween-20、0.1-0.3%triton x-100等)。在一些实施例中,使用甲醇(置于冰上)进行透化,至少持续10分钟。
[0065]
在一些实施例中,使用相同的溶液作为固定试剂和透性化试剂。例如,在一些实施例中,所述固定试剂含有0.1%-10%甲醛和0.001%-1%皂苷。在一些实施例中,所述固定试剂含有1%甲醛和0.3%皂苷。
[0066]
可以使样品与透性化试剂接触较长一段时间,接触时长具体取决于温度、样品的性质以及透性化试剂。例如,可以使样品与透性化试剂接触24小时或更长、24小时或更短、18小时或更短、12小时或更短、8小时或更短、6小时或更短、4小时或更短、2小时或更短、60分钟或更短、45分钟或更短、30分钟或更短、25分钟或更短、20分钟或更短、15分钟或更短、10分钟或更短、5分钟或更短或2分钟或更短。可以在各种温度下使样品与透性化试剂接触,具体取决于所述方案和所用试剂。例如,在一些情况下,可以在-82℃至55℃的温度范围内使样品与透性化试剂接触,其中特定目的温度范围包括但不限于:50至54℃、40至44℃、35至39℃、28至32℃、20至26℃、0至6℃、-18至-22℃和-78至-82℃。在一些情况下,可以在-80℃、-20℃、4℃、室温(22-25℃)、30℃、37℃、42℃或52℃的温度下使样品与透性化试剂接触。
[0067]
在一些实施例中,样品与酶促透性化试剂接触。酶促透性化试剂通过部分降解细胞外基质或表面蛋白(其阻碍测定试剂透过样品)来使样品透化。固定后,在靶标检测前的任何时间都可以与酶促透性化试剂接触。在一些情况下,所述酶促透性化试剂是蛋白酶k,一种可商购的酶。在这些情况下,所述样品先与蛋白酶k接触,然后再与固定后试剂接触。可以在一定温度范围内,在根据经验确定的适用于每种正在研究的细胞类型或组织类型的酶浓度范围内,进行一段时间的蛋白酶k处理(即,与蛋白酶k接触;通常也被称为“蛋白酶k消化”)。例如,可以使样品与蛋白酶k接触30分钟或更短、25分钟或更短、20分钟或更短、15分钟或更短、10分钟或更短、5分钟或更短或2分钟或更短。可以使样品与浓度为1μg/ml或更低、2μg/ml或更低、4μg/ml或更低、8μg/ml或更低、10μg/ml或更低、20μg/ml或更低、30μg/ml或更低、50μg/ml或更低或100μg/ml或更低的蛋白酶k接触。可以在2℃至55℃的温度范围内
使样品与蛋白酶k接触,其中特定目的温度范围包括但不限于:50至54℃、40至44℃、35至39℃、28至32℃、20至26℃和0至6℃。在一些情况下,可以在4℃、室温(22-25℃)、30℃、37℃、42℃或52℃的温度下使样品与蛋白酶k接触。在一些实施例中,样品不与酶促透性化试剂接触。在一些实施例中,样品不与蛋白酶k接触。完整组织与至少一种固定试剂和一种透性化试剂接触,从而得到固定透化组织。连接酶
[0068]
在一些实施例中,本文所揭示的方法包括加入连接酶以连接所述第二寡核苷酸,并生成封闭的核酸环。在一些实施例中,所述加入连接酶包括加入dna连接酶。在替代实施例中,所述第二寡核苷酸以封闭的核酸环的形式提供,且省略加入连接酶的步骤。在某些实施例中,连接酶是有助于对靶核酸分子进行测序的酶。
[0069]
本文中使用的术语“连接酶”是指通常用于使多核苷酸连接在一起或使单个多核苷酸的末端连接的酶。连接酶包括atp依赖性双链多核苷酸连接酶、nad-i依赖性双链dna或rna连接酶以及单链多核苷酸连接酶,例如,ec 6.5.1.1(atp依赖性连接酶)、ec 6.5.1.2(nad+依赖性连接酶)、ec 6.5.1.3(rna连接酶)中所述的任一连接酶。连接酶的具体示例包括细菌连接酶,例如,大肠杆菌dna连接酶和taq dna连接酶、热稳定dna连接酶(technologies corp.(威斯康星州麦迪逊市),隶属于旗下)和噬菌体连接酶,例如,t3 dna连接酶、t4 dna连接酶和t7 dna连接酶及其突变体。滚环扩增
[0070]
在一些实施例中,本发明的方法包括在核酸分子存在的情况下进行滚环扩增的步骤,其中所述操作包括采用所述第二寡核苷酸作为模板,以及采用所述第一寡核苷酸作为促使聚合酶形成一个或更多个扩增子的引物。在这些实施例中,单链环状多核苷酸模板通过连接所述第二核苷酸而形成,所述环状多核苷酸包括与所述第一寡核苷酸互补的区域。在合适的dntp前体和其他辅因子存在的情况下加入dna聚合酶后,所述第一寡核苷酸通过复制多个模板拷贝来延长。与检测探针结合后,可以轻易检测到所述扩增产物。
[0071]
在一些实施例中,仅当第一寡核苷酸和第二寡核苷酸与同一靶核酸分子杂交时,才能将所述第二寡核苷酸环化并进行滚环扩增,以生成含有多个cdna拷贝的cdna纳米微球(即,扩增子)。术语“扩增子”是指pcr反应或其他核酸扩增过程的扩增核酸产物。在一些实施例中,将经胺修饰的核苷酸掺入滚环扩增反应物中。
[0072]
滚环扩增技术在本领域中是众所周知的(请参阅,例如,baner等人,核酸研究,26:5073-5078,1998;lizardi等人,自然遗传学,19:226,1998;schweitzer等人,美国国家科学院院刊,97:101 13-1 19,2000;faruqi等人,bmc基因组学,2:4,2000;nallur等人,核酸研究,29:el 18,2001;dean等人,基因组研究,1 1:1095-1099,2001;schweitzer等人,自然生物科技,20:359-365,2002;第6,054,274、6,291,187、6,323,009、6,344,329和6,368,801号美国专利)。在一些实施例中,所述聚合酶是phi29 dna聚合酶。
[0073]
在某些方面,所述核酸分子包括经胺修饰的核苷酸。在这些实施例中,所述经胺修饰的核苷酸包括丙烯酸n-羟基琥珀酰亚胺部分修饰。其他经胺修饰的核苷酸的示例包括但不限于5-氨基烯丙基-dutp部分修饰、5-炔丙基氨基-dctp部分修饰、n6-6-氨基己基-datp部分修饰或7-脱氮-7-炔丙基氨基-datp部分修饰。组织水凝胶环境中的扩增子包埋
[0074]
在一些实施例中,本文所揭示的方法包括在水凝胶亚单元存在的情况下包埋一个或更多个扩增子,以形成一个或更多个水凝胶包埋的扩增子。本文所述的水凝胶组织化学方法包括使核酸与原位合成水凝胶共价连接,以便进行组织透明化、酶扩散和多重循环测序,而现有的水凝胶组织化学方法则无法实现上述操作。在一些实施例中,为了使扩增子包埋入组织水凝胶环境中,将经胺修饰的核苷酸掺入滚环扩增反应物中,然后用丙烯酰胺部分(同时使用丙烯酸n-羟基琥珀酰亚胺酯)使其官能化,并使其与丙烯酰胺单体共聚以形成水凝胶。
[0075]
本文中使用的术语“水凝胶”或“水凝胶网络”是指由不溶于水的聚合物链形成的网络,有时以胶态凝胶形式存在,分散介质为水。换言之,水凝胶是一类可吸收大量水分而不会溶解的聚合材料。水凝胶的含水量可以超过99%,而且水凝胶可以包括天然或合成聚合物或其组合。此外,由于其含水量高,水凝胶的柔韧性与天然组织非常相似。合适水凝胶的详情请见已发布的第20100055733号美国专利申请案,该专利明确以引用方式并入本文中。本文中使用的术语“水凝胶亚单元”或“水凝胶前体”是指可以交联或“聚合”以形成三维(3d)水凝胶网络的亲水性单体、预聚物或聚合物。在不受任何科学理论束缚的情况下,据称,所述生物试样在水凝胶亚单元存在的情况下进行的所述固定使得所述试样的组分与所述水凝胶亚单元交联,从而将分子组分固定在适当位置,同时保留所述组织结构和细胞形态。
[0076]
在一些实施例中,所述包埋包括使所述一个或更多个扩增子与丙烯酰胺共聚。本文中使用的术语“共聚物”是指含有一种以上的亚单元的聚合物。该术语涵盖包括两种、三种、四种、五种或六种亚单元的聚合物。
[0077]
在某些方面,所述包埋包括使所述一个或更多个水凝胶包埋的扩增子透明化,其中所述靶核酸基本上留存于所述一个或更多个水凝胶包埋的扩增子中。在这些实施例中,所述透明化包括基本上去除所述一个或更多个水凝胶包埋的扩增子中的多种细胞组分。在一些其他实施例中,所述透明化包括基本上去除所述一个或更多个水凝胶包埋的扩增子中的脂质。本文中使用的术语“基本上”是指透明化之前样品中存在的初始量减少约70%或更多,例如,减少75%或更多、80%或更多、85%或更多、90%或更多、95%或更多、99%或更多以及100%。
[0078]
在一些实施例中,使所述水凝胶包埋的扩增子透明化包括对所述试样进行电泳处理。在一些实施例中,使用包括离子表面活性剂的缓冲溶液对所述扩增子进行电泳处理。在一些实施例中,所述离子表面活性剂是十二烷基硫酸钠(sds)。在一些实施例中,使用约10至约60伏的电压对所述试样进行电泳处理。在一些实施例中,对所述试样进行一段时间的电泳处理,所述时间范围为约15分钟至约10天。在一些实施例中,所述方法进一步涉及将所述透明化试样置于折射率与所述透明化组织的折射率相匹配的封固剂中孵育。在一些实施例中,所述封固剂使得所述试样的透光率有所增加。在一些实施例中,所述封固剂包括甘油。动态退火和连接法测序纠错(sedal)
[0079]
本文所揭示的方法包括在允许连接的条件下,使具有条形码序列的所述一个或更多个水凝胶包埋的扩增子与一对引物接触的步骤,其中所述引物对包括第三寡核苷酸和第四寡核苷酸,其中仅在第三寡核苷酸和第四寡核苷酸与同一扩增子连接时,方实现连接。在
一些实施例中,sedal专为starmap设计。在这些实施例中,本文所述的经改进的连接法测序方法包括在室温下进行操作,以在低背景噪点和错误率降低的情况下维持最佳组织形态。在此等其他实施例中,接触所述一个或更多个水凝胶包埋的扩增子包括消除测序过程中的错误积累。
[0080]
在一些实施例中,接触所述一个或更多个水凝胶包埋的扩增子发生两次或更多次,包括但不限于,例如,三次或更多次、四次或更多次、五次或更多次、六次或更多次或七次或更多次。在某些实施例中,对于薄组织试样,接触所述一个或更多个水凝胶包埋的扩增子发生四次或更多次。在其他实施例中,对于厚组织试样,接触所述一个或更多个水凝胶包埋的扩增子发生六次或更多次。在一些实施例中,可以使一个或更多个扩增子与一对引物接触24小时或更长、24小时或更短、18小时或更短、12小时或更短、8小时或更短、6小时或更短、4小时或更短、2小时或更短、60分钟或更短、45分钟或更短、30分钟或更短、25分钟或更短、20分钟或更短、15分钟或更短、10分钟或更短、5分钟或更短或2分钟或更短。
[0081]
采用标的方法制备的试样可以通过多种不同显微技术中的任一种进行分析,例如,光学显微技术(例如,明场、倾斜照明、暗场、相衬、微分干涉对比、干涉反射、落射荧光、共聚焦等显微技术)、激光显微技术、电子显微技术和扫描探针显微技术。在一些方面,非暂时性计算机可读介质先将通过显微技术获得的多轮原位测序的原始图像转换为已解码的基因身份和空间位置,然后分析每个细胞的基因表达组成。sedal寡核苷酸引物
[0082]
在一些实施例中,本文所揭示的方法包括第三寡核苷酸和第四寡核苷酸。在某些方面,所述第三寡核苷酸被配置成解码碱基,而所述第四寡核苷酸被配置成将已解码的碱基转化为信号。在一些方面,所述信号是荧光信号。在示例性方面,在允许连接的条件下,使具有条形码序列的所述一个或更多个水凝胶包埋的扩增子与一对引物接触,涉及使所述第三寡核苷酸和所述第四寡核苷酸各自连接来形成稳定产物,以便仅在完美匹配的情况下进行成像操作。在某些方面,连接酶的所述错配敏感度用于确定所述靶核酸分子的基础序列。
[0083]
就双链体而言,术语“完美匹配”是指构成双链体的多核苷酸和/或寡核苷酸链彼此结合形成双链结构,使得每条链中的每个核苷酸都与另一条链中的一个核苷酸进行watson-crick碱基配对。术语“双链体”包括但不限于可以使用的核苷类似物的配对,例如,脱氧肌苷、具有2-氨基嘌呤碱基的核苷、肽核酸(pna)等。两个寡核苷酸之间的双链体中的“错配”是指所述双链体中的一对核苷酸未能实现watson-crick键合。
[0084]
在一些实施例中,所述方法包括多个与靶核苷酸序列杂交的第三寡核苷酸,包括但不限于5个或更多个第三寡核苷酸,例如,8个或更多、10个或更多、12个或更多、15个或更多、18个或更多、20个或更多、25个或更多、30个或更多、35个或更多。在一些实施例中,本发明的方法包括多个第三寡核苷酸,包括但不限于15个或更多个第三寡核苷酸,例如,20个或更多、30个或更多、40个或更多、50个或更多、60个或更多、70个或更多以及至多80个不同的第一寡核苷酸,其与15个或更多,例如,20个或更多、30个或更多、40个或更多、50个或更多、60个或更多、70个或更多以及至多80个不同的靶核苷酸序列杂交。在一些实施例中,所述方法包括多个第四寡核苷酸,包括但不限于5个或更多个第四寡核苷酸,例如,8个或更多、10个或更多、12个或更多、15个或更多、18个或更多、20个或更多、25个或更多、30个或更多、35个或更多。在一些实施例中,本发明的方法包括多个第四寡核苷酸,包括但不限于15个或更
多个第四寡核苷酸,例如,20个或更多、30个或更多、40个或更多、50个或更多、60个或更多、70个或更多以及至多80个不同的第一寡核苷酸,其与15个或更多,例如,20个或更多、30个或更多、40个或更多、50个或更多、60个或更多、70个或更多以及至多80个不同的靶核苷酸序列杂交。可以在反应中使用多个寡核苷酸对,其中一个或更多个寡核苷酸对与每个靶核酸特异性结合。例如,可以将两个引物对用于一个靶核酸,以提高灵敏度,减少变异性。同样关注的是,检测细胞中多个不同的靶核酸,例如,检测至多2个、至多3个、至多4个、至多5个、至多6个、至多7个、至多8个、至多9个、至多10个、至多12个、至多15个、至多18个、至多20个、至多25个、至多30个、至多40个或更多个不同的靶核酸。
[0085]
在某些实施例中,sedal涉及活性因碱基错配受阻的连接酶、第三寡核苷酸和第四寡核苷酸。本文中使用的术语“受阻”是指连接酶的活性降低约20%或更多,例如,降低25%或更多、50%或更多、75%或更多、90%或更多、95%或更多、99%或更多以及100%。在一些实施例中,所述第三寡核苷酸的长度为5-15个核苷酸,包括但不限于5-13个核苷酸、5-10个核苷酸或5-8个核苷酸。在一些实施例中,所述第三寡核苷酸的t
m
为室温(22-25℃)。在一些实施例中,所述第三寡核苷酸是简并寡核苷酸或其部分。在一些实施例中,所述第四寡核苷酸的长度为5-15个核苷酸,包括但不限于5-13个核苷酸、5-10个核苷酸或5-8个核苷酸。在一些实施例中,所述第四寡核苷酸的t
m
为室温(22-25℃)。在对应于碱基读数的每个sedal循环后,可以剥离所述第四寡核苷酸,从而消除测序过程中的错误累积。在这些实施例中,用甲酰胺剥离所述第四寡核苷酸。
[0086]
在一些实施例中,sedal涉及第三寡核苷酸和第四寡核苷酸的洗涤,以去除未结合的寡核苷酸,而后揭示用于成像的荧光产物。在某些示例性实施例中,可检测标记可用于检测本文所述的一个或更多个核苷酸和/或寡核苷酸。在某些实施例中,可检测标记可用于检测所述一个或更多个扩增子。可检测标记的示例包括各种放射性部分、酶类、辅基、荧光标记、发光标记、生物发光标记、金属颗粒、蛋白-蛋白结合对、蛋白-抗体结合对等。荧光蛋白的示例包括但不限于黄色荧光蛋白(yfp)、绿色荧光蛋白(gfp)、青色荧光蛋白(cfp)、伞形酮、荧光素、异硫氰酸荧光素、罗丹明、二氯三嗪氨基荧光素、丹磺酰氯、藻红蛋白等。生物发光标记的示例包括但不限于萤光素酶(例如,细菌、萤火虫、叩头虫等)、萤光素、水母发光蛋白等。具有视觉上可检测到的信号的酶体系的示例包括但不限于半乳糖苷酶、葡糖醛酸苷酶、磷酸酶、过氧化物酶、胆碱酯酶等。可识别标记还包括放射性化合物,例如,
125
i、
35
s、
14
c或
3
h。可识别标记可从各种来源处购得。
[0087]
荧光标记及其与核苷酸和/或寡核苷酸的附接在许多综述中都有详细描述,包括:haugland,荧光探针和研究用化学品手册,第九版(molecular probes,inc.,尤金,2002年);keller和manak,dna探针,第二版(stockton press,纽约,1993年);eckstein,编者,寡核苷酸和类似物:一种实践方法(irlpress,牛津,1991年);以及wetmur,生物化学和分子生物学评论,26:227-259(1991)。适用于本发明的特定方法请见以下参考样本:第4,757,141、5,151,507和5,091,519号美国专利。在一方面,一种或多种荧光染料被用作已标记靶序列的标记,例如,如第5,188,934号美国专利(4,7-二氯荧光素染料);第5,366,860号美国专利(光谱上可分辨的罗丹明染料);第5,847,162号美国专利(4,7-二氯罗丹明染料);第4,318,846号美国专利(醚取代的荧光素染料);第5,800,996号美国专利(能量转移染料);lee等人;第5,066,580号美国专利(黄嘌呤染料);第5,688,648号美国专利(能量转移染料)等中
所述。标记也可以用量子点进行,具体如以下专利和专利出版物中所述:第6,322,901、6,576,291、6,423,551、6,251,303、6,319,426、6,426,513、6,444,143、5,990,479、6,207,392、2002/0045045和2003/0017264号美国专利。本文中使用的术语“荧光标记”包括通过一个或更多个分子的荧光吸收和/或发射特性传递信息的信号传导部分。所述荧光特性包括荧光强度、荧光寿命、发射光谱特性、能量转移等。
[0088]
易于掺入核苷酸和/或寡核苷酸序列中的市售荧光核苷酸类似物包括但不限于cy3-dctp、cy3-dutp、cy5-dctp、cy5-dutp(amersham biosciences,新泽西州皮斯卡塔韦)、荧光素-12-dutp、四甲基罗丹明-6-dutp、texas red
tm-5-dutp、cascade blue
tm-7-dutp、bodipy tmfl-14-dutp、bodipy tmr-14-dutp、bodipy tmtr-14-dutp、rhodamine green
tm-5-dutp、oregon greenr
tm
488-5-dutp、texas red
tm-12-dutp、bodipy
tm 630/650-14-dutp、bodipy
tm 650/665-14-dutp、alexa fluor
tm 488-5-dutp、alexa fluor
tm 532-5-dutp、alexa fluor
tm 568-5-dutp、alexa fluor
tm 594-5-dutp、alexa fluor
tm 546-14-dutp、荧光素-12-utp、四甲基罗丹明-6-utp、texas red
tm-5-utp、mcherry、cascade blue
tm-7-utp、bodipy
tm fl-14-utp、bodipy tmr-14-utp、bodipy
tm tr-14-utp、rhodamine green
tm-5-utp、alexa fluor
tm 488-5-utp、lexafluor
tm 546-14-utp(molecular probes,inc.eugene,俄勒冈州)等。用于具有其他荧光团的核苷酸的定制合成的方案在本领域中是众所周知的(请参阅,henegariu等人(2000),自然生物科技,18:345)。
[0089]
可用于合成后附接的其它荧光团包括但不限于alexa fluor
tm 350、alexa fluor
tm 532、alexa fluor
tm 546、alexa fluor
tm 568、alexa fluor
tm 594、alexa fluor
tm 647、bodipy 493/503、bodipy fl、bodipy r6g、bodipy 530/550、bodipy tmr、bodipy 558/568、bodipy 558/568、bodipy 564/570、bodipy 576/589、bodipy 581/591、bodipy 630/650、bodipy 650/665、cascade blue、cascade yellow、丹磺酰基、丽丝胺罗丹明b、marina blue、oregon green 488、oregon green 514、pacific blue、罗丹明6g、rhodamine green、rhodamine red、四甲基罗丹明、texas red(可从molecular probes,inc.(俄勒冈州尤金)处获取)、cy2、cy3.5、cy5.5、cy7(amersham biosciences,新泽西州皮斯卡塔韦)等。还可以使用fret串联荧光团,包括但不限于percp-cy5.5、pe-cy5、pe-cy5.5、pe-cy7、pe-texas red、apc-cy7、pe-alexa染料(610、647、680)、apc-alexa染料等。
[0090]
金属银或金颗粒可用于增强来自荧光标记的核苷酸和/或寡核苷酸序列的信号(lakowicz等人(2003),生物技术,34:62)。
[0091]
生物素或其衍生物也可用作核苷酸和/或寡核苷酸序列上的标记,且随后与可检测地标记的亲和素/链霉亲和素衍生物(例如,藻红蛋白共轭的链霉亲和素)或可检测地标记的抗生物素抗体结合。地高辛配基可以作为标记掺入,随后与可检测地标记的抗地高辛配基抗体(例如,荧光素化抗地高辛配基)结合。可将氨基烯丙基-dutp残基掺入寡核苷酸序列中,随后使其与n-羟基琥珀酰亚胺(nhs)衍生的荧光染料偶联。通常情况下,可将共轭对的任何成员掺入检测寡核苷酸中,前提是可以结合可检测地标记的共轭伴侣以进行检测。本文中使用的术语“抗体”是指任何种类的抗体分子或其任何亚片段,例如,fab。
[0092]
寡核苷酸序列的其他合适标记可以包括荧光素(fam)、地高辛配基、二硝基苯酚(dnp)、丹磺酰基、生物素、溴脱氧尿苷(brdu)、六聚组氨酸(6
×
his)、磷氨基酸(例如,p-tyr、p-ser、p-thr)等。在一实施例中,以下半抗原/抗体对用于检测中,其中每种抗体都用
可检测标记衍生:生物素/α-生物素、地高辛配基/α-地高辛配基、二硝基苯酚(dnp)/α-dnp、5-羧基荧光素(fam)/α-fam。
[0093]
在某些示例性实施例中,核苷酸和/或寡核苷酸序列可被间接标记,尤其是用半抗原标记,然后使其与捕获剂结合,例如,如第5,344,757、5,702,888、5,354,657、5,198,537和4,849,336号美国专利、第wo 91/17160号pct出版物等所述。有许多不同的半抗原-捕获剂对可供使用。示例性半抗原包括但不限于生物素、去生物素和其他衍生物、二硝基苯酚、丹磺酰基、荧光素、cy5、地高辛配基等。对于生物素,捕获剂可以是亲和素、链霉亲和素或抗体。抗体可用作其他半抗原的捕获剂(许多染料-抗体对均可商购,例如,molecular probes,俄勒冈州尤金)。细胞
[0094]
本文所揭示的方法包括一种用于对完整组织内细胞中的靶核酸进行原位基因测序的方法。在某些实施例中,所述细胞存在于细胞群中。在某些其他实施例中,所述细胞群包括多种细胞类型,包括但不限于兴奋性神经元、抑制性神经元和非神经元细胞。用于本发明的测定法的细胞可以是生物体、源自生物体的单一细胞类型,也可以是各细胞类型的混合物。本发明包括天然存在的细胞和细胞群、基因改造的细胞系、衍生自转基因动物的细胞等。几乎可以囊括所有细胞类型和大小。合适的细胞包括细菌、真菌、植物和动物细胞。在本发明的一实施例中,所述细胞是哺乳动物细胞,例如,复杂细胞群,例如天然存在的组织,例如,血液、肝脏、胰腺、神经组织、骨髓、皮肤等。一些组织可能被解离以制成单分散悬浮液。或者,所述细胞可以是经培养的细胞群,例如,源自复杂细胞群的培养物、源自单一细胞类型的培养物,其中所述细胞已分化为多个谱系,或者其中所述细胞对刺激做出不同反应等。
[0095]
本发明中使用的细胞类型包括干祖细胞(例如,胚胎干细胞、造血干细胞、间充质干细胞、神经嵴细胞等)、内皮细胞、肌肉细胞、心肌细胞、平滑肌细胞和骨骼肌细胞、间充质细胞、上皮细胞;造血细胞,例如,淋巴细胞,包括t细胞,例如th1 t细胞、th2 t细胞、tho t细胞、细胞毒性t细胞;b细胞、前b细胞等;单核细胞;树突细胞;嗜中性粒细胞;巨噬细胞;自然杀伤细胞;肥大细胞等;脂肪细胞,与特定器官有关的细胞,例如胸腺、内分泌腺、胰腺、脑,例如神经元、神经胶质细胞、星形胶质细胞、树突细胞等,以及其基因修饰细胞。造血细胞可能与炎性过程、自身免疫疾病等有关,内皮细胞、平滑肌细胞、心肌细胞等可能与心血管疾病有关;几乎所有类型的细胞都可能与瘤形成有关,例如肉瘤、癌和淋巴瘤;与肝细胞有关的肝病;与肾细胞有关的肾病;等等。
[0096]
所述细胞也可以是不同类型的转化细胞或赘生性细胞,源自不同细胞来源的癌、源自不同细胞类型的淋巴瘤等。美国国家菌种保藏中心(american type culture collection,atcc)(弗吉尼亚州马纳萨斯)已收集并提供了来自150多种不同物种的4,000多种细胞系,950多种癌细胞系,其中包括700种人癌细胞系。美国国家癌症研究所(national cancer institute,nci)已汇编了有关一大批人肿瘤细胞系的临床、生化和分子数据,这些数据可从atcc或nci获取(phelps等人(1996),细胞生物化学杂志增刊,24:32-91)。本发明包括自发衍生的不同细胞系,或针对单个细胞系所需的生长或应答特性而选择的细胞系;而且可能包括衍生自相似肿瘤类型但源自不同患者或部位的多个细胞系。
[0097]
细胞可以是非粘附细胞(例如,血细胞,包括单核细胞、t细胞、b细胞;肿瘤细胞等)或粘附细胞(例如,上皮细胞、内皮细胞、神经细胞等)。为了获得粘附细胞的表达谱,使所述
粘附细胞与其所粘附的基质和其他细胞分离,同时保持其识别和结合探针分子的能力。
[0098]
所述细胞可以利用诸如抽取、灌洗、清洗、外科解剖等方法,通过本领域已知的各种技术从个体的各种组织(例如,血液、骨髓)、实体组织(例如,实体瘤)、腹水中获取。细胞可以从固定或未固定、新鲜或冷冻、完整或已解离的样品中获得。可以采用已知技术以机械方式或酶促方式解离组织。成像
[0099]
本文所揭示的方法包括采用多种不同类型的显微技术中的任一种对所述一个或更多个水凝胶包埋的扩增子进行成像,例如,共聚焦显微技术、双光子显微技术、光场显微技术、完整组织膨胀显微技术和/或经clarity
tm
优化的单层光显微技术(colm)。
[0100]
所有光学显微技术中最简单的一种是明场显微技术。样品由透射的白光照射,即,从下方照射,从上方观察。这种显微技术的局限性包括大多数生物样品的对比度较低以及由于聚焦材料失焦造成的表观分辨率较低。这种技术的显著优势是操作简单,所需的样品制备工作最少。
[0101]
采用倾斜照明显微技术时,从侧面照射试样。这使得图像具有三维外观,且可以突出显示其他不可见的特征。基于此方法的最新技术是霍夫曼调制对比显微技术,这是倒置显微镜上用于细胞培养物的系统。虽然倾斜照明受到与明场显微技术相同的局限性(大多数生物样品的对比度较低;由于聚焦对象失焦造成的表观分辨率较低)影响,但它可能会突出显示其他不可见的结构。
[0102]
暗场显微技术是一种用于改善未染色透明样品对比度的技术。暗场照明采用精心对准的光源,以最大限度地减少进入图像平面的直接透射(未散射)光的光量,同时仅收集样品散射的光。暗场可以显著改善图像对比度(尤其是透明物体),而无需进行任何设备设置或样品制备。但是,采用这种技术时,许多生物样品的最终图像的光强度较低,且表观分辨率仍然较低。
[0103]
相衬是一种光学显微照明技术,可将穿过透明试样的光的相移转换为图像中的亮度变化。换言之,相衬是将折射率差异表现为对比度差异。相移本身对于人眼而言是不可见的,但是当其表现为亮度变化时,会变得可见。
[0104]
采用微分干涉对比(dic)显微技术时,光密度差异将表现为凸现差异。该系统由聚光器中的特殊棱镜(nomarski棱镜、wollaston棱镜)组成,所述棱镜将光分成寻常光束和非寻常光束。所述两束光束之间的空间差异较小(小于物镜的最大分辨率)。所述光束穿过试样后,在物镜中通过类似棱镜使其重新聚合。在均质试样中,所述两束光束之间无任何差异,也不会产生对比度。但是,在折射边界附近(例如,细胞质内的细胞核),所述寻常光束和非寻常光束之间的差异会使得所述图像中产生浮雕效果。微分干涉对比需要偏振光源以发挥效用;光路中必须安装的两面偏振滤光镜,一面安装在聚光器下方(偏振镜),另一面安装在物镜上方(检偏镜)。
[0105]
另一种干涉显微技术是干涉反射显微技术(也被称为反射干涉对比或ric)。这种显微技术的用途如下:当两种具有不同折射率的物质之间存在界面时,利用具有窄范围波长的待反射偏振光,检测细胞对玻璃表面的粘附性。每当将细胞粘附于玻璃表面时,来自玻璃的反射光和来自所粘附细胞的反射光都会产生干扰。如果玻璃上未粘附细胞,则不会产生干扰。
[0106]
荧光显微镜是一种光学显微镜,其利用荧光和磷光而非反射和吸收,或除反射和吸收外还利用荧光和磷光,以研究有机或无机物质的特性。采用荧光显微技术时,用激发样品产生荧光的波长的光照射样品。然后,通过显微镜物镜对波长通常长于光照波长的荧光进行成像。该项技术可以使用两片滤波片;确保光照接近单色且波长适当的照明(或激发)滤光片,以及确保任何激发光源发出的光都无法到达检测器的第二发射(或阻挡)滤光片。或者,这些功能都可以通过单个二向色滤光片来实现。“荧光显微镜”是指任何利用荧光生成图像的显微镜,无论是诸如落射荧光显微镜之类的较为简单的装置,还是诸如共聚焦显微镜之类的较为复杂的设计,这种显微镜都可以利用光学切片来获得具有更高分辨率的荧光图像。
[0107]
共聚焦显微镜在检测器前方的光学共轭平面中使用点照明和针孔,以消除失焦信号。由于只能检测到极为接近焦平面的荧光产生的光,因此图像的光学分辨率(尤其是沿样品深度方向)远胜过宽视野显微镜的分辨率。但是,由于许多来自样品荧光的光被针孔阻挡,因此这种分辨率的提高是以降低信号强度为代价——经常需要长时间曝光。由于一次仅照射样品中的一个点,因此2d或3d成像需要在试样中的规则光栅(即,平行扫描线的矩形图案)上进行扫描。焦平面可达到的厚度主要取决于所用光的波长除以物镜的数值孔径所得的值,也取决于试样的光学特性。薄光学切片可能使这些类型的显微镜在3d成像和样品表面轮廓分析方面表现得尤为出色。colm是另一种对大型澄清样品进行快速3d成像的显微技术。colm会对大型免疫组化染色组织发出询问,允许提高采集速度,从而提高所生成数据的质量。
[0108]
采用单平面照明显微技术(spim)(也被称为单层光显微技术)时,仅照射检测物镜焦平面中的荧光团。所述单层光是在一个方向上实现准直并在另一个方向上实现聚焦的光束。由于无荧光团在检测器焦平面外被激发,因此所述方法还提供了固有的光学切片。此外,与常规显微技术相比,单层光法能够减少光漂白,降低光毒性,且通常能够对各试样进行更多次扫描。通过旋转试样,该项技术几乎可以利用从不同角度获得的多个视图对任何平面进行成像。但是,对于各个角度,只有试样相对较薄的部分才具有高分辨率成像,而随着厚度增加,图像也越来越模糊。
[0109]
超分辨率显微技术是一种光学显微技术。由于光的衍射,常规光学显微技术的分辨率受到相应限制,具体如ernst abbe于1873年发表的文章所示。点扩散函数的fwhm(半峰全宽)值是可达到分辨率的一个适当近似值,具有高数值孔径且适用于可见光的精密宽视野显微镜的分辨率通常可以达到约250nm。超分辨率技术允许以高于衍射极限的分辨率捕获图像。该项技术可分为两大类:“实际”超分辨率技术,其可捕获隐失波中含有的信息;“功能性”超分辨率技术,其利用实验技术以及对成像对象的已知限制来重构超分辨率图像。
[0110]
激光显微技术采用在各种显微技术中使用的激光照明源。例如,专注于生物学应用的激光显微技术采用在多种技术中使用的超短脉冲激光器或飞秒激光器,这些技术包括非线性显微技术、饱和显微技术和多光子荧光显微技术,例如双光子激发显微技术(一种荧光成像技术,可以对较厚的活组织进行成像,例如,厚度为一毫米)。
[0111]
采用电子显微技术(em)时,电子束用于照射试样并产生放大图像。电子显微镜的分辨能力高于光动力光学显微镜,因为电子的波长比可见光(光子)短约100,000倍。电子显微镜的分辨率可达到50pm以上,放大倍数最高可达到约10,000,000倍,而普通非共聚焦光
学显微镜受到衍射限制,其分辨率约为200nm,有效放大倍数低于2000倍。电子显微镜利用静电和电磁“透镜”来控制电子束并将其聚焦以形成图像。这些透镜类似于光学显微镜的玻璃透镜但也存在不同之处,后者通过将光聚焦在试样上或使光穿过试样来形成放大图像。电子显微镜用于观察各种生物和无机试样,包括微生物、细胞、大分子、活检样品、金属和晶体。在工业上,电子显微镜通常用于质量控制和故障分析。电子显微技术的示例包括透射电子显微技术(tem)、扫描电子显微技术(sem)、反射电子显微技术(rem)、扫描透射电子显微技术(stem)和低电压电子显微技术(lvem)。
[0112]
扫描探针显微技术(spm)是一种显微技术,其利用扫描试样的物理探针形成表面图像。表面图像可以通过在试样的光栅扫描区域以机械方式逐行移动探针,并记录探针-表面的相互作用随位置的变化情况获得。spm的示例包括原子力显微技术(atm)、弹道电子发射显微技术(beem)、化学力显微技术(cfm)、导电原子力显微技术(c-afm)、电化学扫描隧道显微技术(ecstm)、静电力显微技术(efm)、流体力显微技术(fluidfm)、力调制显微技术(fmm)、特征定向扫描探针显微技术(fospm)、开尔文探针力显微技术(kpfm)、磁力显微技术(mfm)、磁共振力显微技术(mrfm)、近场扫描光学显微技术(nsom)(或扫描近场光学显微技术(snom))、压电响应力显微技术(pfm)、光子扫描隧道显微技术(pstm)、光热显微分光术/显微技术(ptms)、扫描电容显微技术(scm)、扫描电化学显微技术(secm)、扫描门控显微技术(sgm)、扫描霍尔探针显微技术(shpm)、扫描离子电导显微技术(sicm)、自旋极化扫描隧道显微技术(spsm)、扫描扩展电阻显微技术(ssrm)、扫描热显微技术(sthm)、扫描隧道显微技术(stm)、扫描隧道电位法(stp)、扫描电压显微技术(svm)和同步加速器x射线扫描隧道显微技术(sxstm)。
[0113]
完整组织膨胀显微技术(exm)可以对横向分辨率约为70nm的厚保存试样进行成像。采用exm时,可以通过在成像前使生物样品物理膨胀来规避光学衍射极限,从而使亚衍射极限结构达到常规衍射极限显微镜可观察的尺寸范围。exm可以在衍射极限显微镜的体素速率下对生物试样进行成像,但需采用超分辨率显微镜的体素大小。膨胀样品是透明的,且与水的折射率匹配,因为膨胀材料的含水量>99%。膨胀显微技术在本领域中是众所周知的,例如,如以下出版物所述:gao等人,问答:膨胀显微技术,bmc生物学,2017;15:50。筛选方法
[0114]
本文所揭示的方法还提供了一种筛选候选试剂以确定所述候选试剂能否调控完整组织内细胞中核酸的基因表达的方法,所述方法包括:(a)在允许发生特异性杂交的条件下,使固定透化完整组织与至少一对寡核苷酸引物接触,其中所述引物对包括第一寡核苷酸和第二寡核苷酸;其中所述第一寡核苷酸和所述第二寡核苷酸各自包括第一互补性区域、第二互补性区域和第三互补性区域;其中所述第二寡核苷酸进一步包括条形码序列;其中所述第一寡核苷酸的第一互补性区域与所述靶核酸的第一部分互补,其中所述第一寡核苷酸的第二互补性区域与所述第二寡核苷酸的第一互补性区域互补,其中所述第一寡核苷酸的第三互补性区域与所述第二寡核苷酸的第三互补性区域互补,其中所述第二寡核苷酸的第二互补性区域与所述靶核酸的第二部分互补,而且其中所述第一寡核苷酸的第一互补性区域与所述第二寡核苷酸的第二互补性区域相邻;(b)加入连接酶以连接所述第二寡核苷酸,并生成封闭的核酸环;(c)在核酸分子存在的情况下进行滚环扩增,其中所述操作包括采用所述第二寡核苷酸作为模板,以及采用所述第一寡核苷酸作为促使聚合酶形成一个
或更多个扩增子的引物;(d)在水凝胶亚单元存在的情况下包埋所述一个或更多个扩增子,以形成一个或更多个水凝胶包埋的扩增子;(e)在允许连接的条件下,使具有条形码序列的所述一个或更多个水凝胶包埋的扩增子与一对引物接触,其中所述引物对包括第三寡核苷酸和第四寡核苷酸,其中仅在第三寡核苷酸和第四寡核苷酸与同一扩增子连接时,方实现连接;(f)重复步骤(e);(g)对所述一个或更多个水凝胶包埋的扩增子进行成像,以确定完整组织内细胞中靶核酸的原位基因测序;以及(h)检测所述靶核酸的基因表达水平,其中在所述至少一种候选试剂存在的情况下所述靶核酸的表达水平相对于在所述至少一种候选试剂不存在的情况下所述靶核酸的表达水平所发生的变化表明,所述至少一种候选试剂调控完整组织内细胞中核酸的基因表达。所述筛选方法包括本文提供的starmap步骤。
[0115]
在一些方面,所述检测包括实施流式细胞术;测序;探针结合和电化学检测;ph值改变;与dna标签结合的酶诱导的催化作用;量子纠缠;拉曼光谱技术;太赫兹波技术;和/或扫描电子显微技术。在某些方面,所述流式细胞术为大量细胞计数法或荧光激活流式细胞术。在一些其他方面,所述检测包括实施本文所述的显微技术、扫描质谱分析技术或其他成像技术。在这些方面,所述检测包括确定信号,例如,荧光信号。
[0116]
本文中使用的术语“测试试剂”、“候选试剂”和语法上等同的表达可互换使用,是指任何在受试者分析中待测定其活性的分子(例如,蛋白(此处包括蛋白、多肽和肽)、小(即,尺寸为5-1000da、100-750da、200-500da或小于500da)分子、有机或无机分子、多糖、多核苷酸等)。
[0117]
通过上述方法可以筛选出各种不同的候选试剂。候选试剂涵盖多种化学物质分类,例如,分子量超过50道尔顿(例如,至少约50da、至少约100da、至少约150da、至少约200da、至少约250da或至少约500da)以及分子量低于约20,000道尔顿、低于约10,000道尔顿、低于约5,000道尔顿或低于约2,500道尔顿的小尺寸有机化合物。例如,在一些实施例中,合适的候选试剂是分子量范围为约500da至约20,000da的有机化合物,例如,约500da至约1000da、约1,000da至约2,000da、约2,000da至约2,500da、约2,500da至约5,000da、约5,000da至约10,000da或约10,000da至约20,000da。
[0118]
候选试剂可以包括与蛋白进行结构相互作用(例如,氢键结合)所必需的官能团,且可以包括至少一个氨基、羰基、羟基或羧基,或者至少两个官能化学基团。候选试剂可以包括被一个或更多个上述官能团取代的环状碳或杂环结构和/或芳族或多芳族结构。候选试剂还可以源自于包括肽、糖类、脂肪酸、类固醇、嘌呤、嘧啶、衍生物、结构类似物或其组合的生物分子。
[0119]
候选试剂可从各种来源处获得,包括合成或天然化合物文库。例如,许多手段可用于各种有机化合物和生物分子的随机和定向合成,包括随机寡核苷酸和寡肽的表达。或者,可获得或轻易产生呈细菌、真菌、植物和动物提取物形式的天然化合物文库。此外,天然或合成产生的文库和化合物可通过常规化学、物理和生化手段轻易地加以修饰,且可用于产生组合文库。已知药剂可以进行直接或随机的化学修饰(例如,酰化、烷化、酯化、酰胺化等),以生成结构类似物。此外,筛选可以针对已知的药理学活性化合物及其化学类似物,或针对具有未知特性的新试剂进行,例如通过合理的药物设计产生的试剂。
[0120]
在一实施例中,候选调节剂是合成化合物。许多技术可用于各种有机化合物和生物分子的随机和定向合成,包括随机寡核苷酸的表达。请参阅,例如,wo 94/24314,其通过
引用方式明确并入本文,其中探讨了生成新化合物的方法,包括随机化学方法和酶促方法。
[0121]
在另一实施例中,所述候选试剂作为可获得或轻易产生的呈细菌、真菌、植物和动物提取物形式的天然化合物文库提供。此外,天然或合成产生的文库和化合物可通过常规化学、物理和生化手段轻易地加以修饰。已知药剂可以进行直接或随机的化学修饰(包括酶修饰),以生成结构类似物。
[0122]
在一实施例中,候选试剂包括蛋白(包括抗体、抗体片段(即,含有抗原结合区的片段、单链抗体等)、核酸和化学部分。在一实施例中,所述候选试剂是天然存在的蛋白或天然存在的蛋白的片段。因此,例如,可以测试含有蛋白的细胞提取物,或测试蛋白细胞提取物的随机或定向消化物。可以采用这种方式制备原核和真核蛋白文库以供筛选。其他实施例包括细菌、真菌、病毒和哺乳动物蛋白(例如,人蛋白)文库。
[0123]
在一实施例中,候选试剂是有机部分。在此实施例中,如wo 94/243 14中通常所述,候选试剂是由一系列可以进行化学修饰的底物合成的。本文所述的“化学修饰”包括传统的化学反应和酶促反应。这些底物通常包括但不限于烷基基团(包括烷烃、烯烃、炔烃和杂烷基)、芳基基团(包括芳烃和杂芳基)、醇类、醚类、胺类、醛类、酮类、酸类、酯类、酰胺类、环状化合物、杂环化合物(包括嘌呤、嘧啶、苯二氮卓类、β-内酰胺、四环素、头孢菌素和碳水化合物)、类固醇(包括雌激素、雄激素、可的松、蜕皮素等)、生物碱(包括麦角、长春花、箭毒、吡咯烷和丝裂霉素)、有机金属化合物、含有杂原子的化合物、氨基酸和核苷。可以使部分发生化学(包括酶促)反应以形成新的底物或候选试剂,然后可以运用本发明对其进行测试。设备和系统
[0124]
本发明还包括用于实施标的方法各方面的设备。所述标的设备可以包括,例如,成像室、电泳装置、流动室、显微镜、针、管、泵。
[0125]
本发明还提供了用于实施标的方法的系统。系统可以包括本文所述的模块中的一个或更多个。例如,电源、制冷单元、废弃物处理、加热单元、泵等。系统还可以包括本文所述的任何试剂,例如,成像缓冲液、清洗缓冲液、剥离缓冲液、nissl和dapi溶液。根据某些实施例的系统还可以包括显微镜和/或相关成像设备,例如,相机组件、数字成像组件和/或图像捕获设备、被配置成根据一项或更多项用户输入来采集图像的计算机处理器等。
[0126]
如上所述,本文所述的系统包括具有成像室和泵的流体设备;以及处理器单元,其被配置成实施对本文所述的完整组织内细胞中的靶核酸进行原位基因测序的方法。在一些实施例中,所述系统能够实现starmap的自动化,该过程在本文中被描述为包括但不限于:使探针与包埋入凝胶中的dna重复杂交;将荧光标记的寡核苷酸与这些探针连接;洗去过量的探针;成像;以及剥离探针以便进行下一轮测序。在一些实施例中,所述系统可以连续操作。在一些实施例中,所述系统包括成像室,所述成像室用于使原位dna测序过程中涉及的测序化学物质流经样品。在一些实施例中,流体和泵系统对递送至样品的测序化学物质加以控制。
[0127]
可以通过使用一个或更多个端口,以及可选地使用管道、泵、阀门或任何其他合适的流体处理和/或流体操作设备(例如,可移动地附接或永久地附接至设备的一个或更多个组件的管道)来添加/取出/再循环/更换缓冲液。例如,具有第一端和第二端的第一管道可以附接至第一端口,而具有第一端和第二端的第二管道可以附接至第二端口,其中所述第
一管道的第一端附接至所述第一端口,而所述第一管道的第二端可操作地连接至容器,例如,冷却单元、加热单元、过滤单元、废弃物容器等;以及所述第二管道的第一端附接至所述第二端口,而所述第二管道的第二端可操作地连接至容器,例如,冷却单元、置于冰上的烧杯、过滤单元、废弃物容器等。
[0128]
在一些实施例中,所述系统包括载有指令的非暂时性计算机可读存储介质,所述指令由所述处理器单元执行时,会使所述处理器单元控制化学物质的输送并令该过程与显微镜相关操作同步。在一些实施例中,所述非暂时性计算机可读存储介质包括指令,所述指令由所述处理器单元执行时,会使所述处理器单元测量光信号。效用
[0129]
本发明的设备、方法和系统在本领域中有许多用途,例如,用于生物医学研究和/或临床诊断。例如,在生物医学研究中,应用包括但不限于用于基础生物学或药物筛选的空间分辨基因表达分析。在临床诊断中,应用包括但不限于检测患者样品的基因标记,例如,疾病、免疫应答、细菌或病毒dna/rna。本文所述方法的优势的示例包括效率,其中,从原始样品中获取最终数据仅需3或4天,数据提供速度远快于现有微阵列或测序技术的相应速度;高度多重性(至多1000个基因);单细胞和单分子敏感性;保留组织形态;和/或高信噪比和低错误率。
[0130]
在某些方面,starmap可用于研究小鼠视皮层中分子定义的细胞类型和活性调节基因表达,且可扩展至更大的3d组织块,使以前无法查看的皮质神经元的短程和长程空间组织在体积上可视化。在一些实施例中,本文所揭示的方法可用于对dna共轭的抗体进行成像,以用于高度多重蛋白检测。
[0131]
本发明的设备、方法和系统也可以泛型化,用以研究各种组织中的许多异质细胞群。在不受任何科学理论束缚的情况下,对大脑进行starmap分析面临着特殊挑战。例如,在不同细胞类型中观察到的多态活性调节基因(arg)表达可能既取决于细胞的本征生物学特性(例如,信号转导通路组分表达),又取决于非本征特性(例如,将外部感官信息传递至不同细胞(此处是指视皮层中的细胞)的神经回路解剖结构)。在这些情况下,以starmap为例的原位转录组分析可以有效地将基于成像的分子信息与解剖和活动信息联系起来,从而明确脑功能和功能障碍。
[0132]
本文所揭示的设备、方法和系统能够在维持细胞和组织的三维结构的同时去除细胞组分(例如,通常提供结构支撑但阻碍亚细胞蛋白和分子可视化的脂质),因为样品与物理上支撑组织超微结构的水凝胶交联。这种去除使生物试样的内部对于光和/或大分子而言基本上是可渗透的,以便对试样内部(例如,细胞和亚细胞结构)进行显微镜观察,而无需制作颇为费时的破坏性组织切片。这一过程相较于本领域中通常采用的过程更加快速,因为通常分步执行的透明化和透性化可以在去除细胞组分的单个步骤中一同执行。此外,可以对试样进行反复染色、不染色,也可以用其他试剂对试样进行重新染色,以便进行全面分析。用可聚合丙烯酰胺部分进一步官能化,使得扩增子能够在聚丙烯酰胺网络内的多个位点处实现共价锚定。
[0133]
在一示例中,标的设备、方法和系统可用于评估、诊断或监测疾病。本文中使用的“诊断”通常包括预测受试者对疾病或病症的易感性;确定受试者当前是否受疾病或病症影响;确定受疾病或病症影响的受试者的预后(例如,确定癌变情况、癌症分期、患者死于所述
癌症的可能性);预测受试者对疾病或病症治疗的反应(例如,对诸如异基因造血干细胞移植、化疗、放疗、抗体疗法、小分子复合疗法等表现出积极反应、消极反应、根本无反应);以及治疗测定(例如,监测受试者的身体状况以提供有关治疗效果或疗效的信息)。例如,可以用癌变组织制备活检切片并对此进行显微镜分析,确定癌症类型、癌症发展程度以及癌症是否对治疗干预产生反应等。
[0134]
本发明的设备、方法和系统还提供了一种用于筛选候选治疗剂以了解其对组织或疾病的效力的实用技术。例如,可以使一例受试者(例如,小鼠、大鼠、狗、灵长类动物、人等)暴露于候选试剂,然后通过标的方法制备器官或其活检切片,并针对一个或更多个细胞或组织参数对所制备的试样进行显微镜分析。参数是细胞或组织的可量化组分,尤其是可以在高通量系统中准确测量的组分。参数可以是任何细胞组分或细胞产物,包括细胞表面决定因素、受体、蛋白或其构象或翻译后修饰、脂质、碳水化合物、有机或无机分子、核酸(例如,mrna、dna等)或源自此类细胞组分的部分或其组合。虽然大多数参数会提供定量读数,但在一些情况下,半定量或定性结果是可接受的。读数可以包括单个确定的值,或者可以包括平均值、中值或方差等。从特征上来说,可以针对源自多次同一测定的各参数获取一系列参数读数值。相应值预计会发生变化,并且采用标准统计方法和用于提供单个值的常用统计方法来获取测试参数组中各参数的值范围。因此,例如,一种这样的方法可以包括检测细胞活性、组织血管形成、是否存在免疫细胞浸润、改变疾病进展的效力等。在一些实施例中,所述筛选包括将已分析参数与来自对照或参比样品(例如,源自未暴露于候选试剂的受试者、以类似方式制备的样品)的参数进行比较。用于筛选的目的候选试剂包括涵盖多种化学物质分类的已知和未知化合物,主要是有机分子,其可能包括有机金属分子、无机分子、基因序列等。用于筛选的目的候选试剂还包括核酸,例如,编码sirna、shrna、反义分子或mirna的核酸,或编码多肽的核酸。本发明的一个重要方面是评估候选药物,包括毒性测试等。采用标的方法对组织样品进行的评估可以包括,例如,基因、转录组、基因组、蛋白质组和/或代谢组分析。
[0135]
本发明的设备、方法和系统还可用于在亚细胞分辨率下使基因编码标记在整个组织中的分布可视化,例如,染色体畸变(倒位、重复、易位等),基因杂合性丧失,存在指示有患病倾向或身体健康、可能对治疗产生反应、血统等的等位基因。这种检测可用于,例如,诸如如上所述的疾病诊断和监测、个性化医疗和亲子关系研究。
[0136]
可以汇编分析信息数据库。这些数据库可以包括来自已知细胞类型的结果、来自在特定条件下处理过的细胞的分析的参考信息等。可以生成数据矩阵,其中所述数据矩阵中的每个点对应于源自一个细胞的一个读数,其中每个细胞的数据可以包括源自多个标记的读数。读数可以是与测量相关的平均值、中值、方差或其他统计学或数学导出的值。通过直接比较相应的参考读出,可以进一步细化输出读数信息。在相同条件下针对各项输出获得的绝对值将显示出活生物体所固有的变异性,还可以反映出个体细胞变异性以及个体之间固有的变异性。本发明的非限制性方面的示例
[0137]
上述本发明标的物(包括实施例)可单独使用或与一项或多项内容或实施例合并使用。在不限制前述内容的情况下,下文提供了本专利1-89项的某些非限制性内容。在阅读本发明后,以下内容对所属领域的技术人员来说是显而易见的,每个单独编号的内容可单
独使用,也可与之前或之后任一单独编号内容组合使用。这旨在为各项内容的所有此类组合提供支持,并且不仅限于以下明确提供的内容的组合:1.一种用于对完整组织内细胞中的靶核酸进行原位基因测序的方法,所述方法包含:(a)在允许发生特异性杂交的条件下,使固定透化完整组织与至少一对寡核苷酸引物接触,其中所述引物对包含第一寡核苷酸和第二寡核苷酸;其中所述第一寡核苷酸和所述第二寡核苷酸各自包含第一互补性区域、第二互补性区域和第三互补性区域;其中所述第二寡核苷酸进一步包含条形码序列;其中所述第一寡核苷酸的第一互补性区域与所述靶核酸的第一部分互补,其中所述第一寡核苷酸的第二互补性区域与所述第二寡核苷酸的第一互补性区域互补,其中所述第一寡核苷酸的第三互补性区域与所述第二寡核苷酸的第三互补性区域互补,其中所述第二寡核苷酸的第二互补性区域与所述靶核酸的第二部分互补,而且其中所述第一寡核苷酸的第一互补性区域与所述第二寡核苷酸的第二互补性区域相邻;(b)加入连接酶以连接所述第二寡核苷酸,并生成封闭的核酸环;(c)在核酸分子存在的情况下进行滚环扩增,其中所述操作包含采用所述第二寡核苷酸作为模板,以及采用所述第一寡核苷酸作为促使聚合酶形成一个或更多个扩增子的引物;(d)在水凝胶亚单元存在的情况下包埋所述一个或更多个扩增子,以形成一个或更多个水凝胶包埋的扩增子;(e)在允许连接的条件下,使具有条形码序列的所述一个或更多个水凝胶包埋的扩增子与一对引物接触,其中所述引物对包含第三寡核苷酸和第四寡核苷酸,其中仅在第三寡核苷酸和第四寡核苷酸与同一扩增子连接时,方实现连接;(f)重复步骤(e);以及(g)对所述一个或更多个水凝胶包埋的扩增子进行成像,以确定完整组织内细胞中靶核酸的原位基因测序。2.根据方面1所述的方法,其中所述引物对在接触所述样品之前加热变性。3.根据方面1或2所述的方法,其中所述细胞存在于细胞群中。4.根据方面3所述的方法,其中所述细胞群包含多种细胞类型。5.根据方面1-4中任一项所述的方法,其中接触所述固定透化完整组织包含使所述引物对与同一靶核酸杂交。6.根据方面1-5中任一项所述的方法,其中所述靶核酸是rna。7.根据方面6所述的方法,其中所述rna是mrna。8.根据方面1-5中任一项所述的方法,其中所述靶核酸是dna。9.根据方面1-8中任一项所述的方法,其中所述第二寡核苷酸包含挂锁探针。10.根据方面1-9中任一项所述的方法,其中所述第一寡核苷酸的第一互补性区域的长度为19-25个核甘酸。11.根据方面1-10中任一项所述的方法,其中所述第一寡核苷酸的第二互补性区域的长度为6个核甘酸。12.根据方面1-11中任一项所述的方法,其中所述第一寡核苷酸的第三互补性区域的
长度为6个核甘酸。13.根据方面1-12中任一项所述的方法,其中所述第二寡核苷酸的第一互补性区域的长度为6个核甘酸。14.根据方面1-13中任一项所述的方法,其中所述第二寡核苷酸的第二互补性区域的长度为19-25个核甘酸。15.根据方面1-14中任一项所述的方法,其中所述第二寡核苷酸的第三互补性区域的长度为6个核甘酸。16.根据方面1-15中任一项所述的方法,其中所述第二寡核苷酸的第一互补性区域包含所述第二寡核苷酸的5'末端。17.根据方面1-16中任一项所述的方法,其中所述第二寡核苷酸的第三互补性区域包含所述第二寡核苷酸的3'末端。18.根据方面1-17中任一项所述的方法,其中所述第二寡核苷酸的第一互补性区域与所述第二寡核苷酸的第三互补性区域相邻。19.根据方面1-18中任一项所述的方法,其中所述第二寡核苷酸的条形码序列提供用于识别所述靶核酸的条形码信息。20.根据方面1-19中任一项所述的方法,其中接触所述固定透化完整组织包含使对不同靶核酸具有特异性的多种寡核苷酸引物杂交。21.根据方面1所述的方法,其中所述第二寡核苷酸以封闭的核酸环形式提供,且省略加入连接酶的步骤。22.根据方面1-21中任一项所述的方法,其中选定寡核苷酸的所述解链温度(t
m
)以最大限度地减少寡核苷酸在溶液中的连接。23.根据方面1-22中任一项所述的方法,其中加入连接酶包含加入dna连接酶。24.根据方面1-23中任一项所述的方法,其中所述核酸分子包含经胺修饰的核苷酸。25.根据方面24所述的方法,其中所述经胺修饰的核苷酸包含丙烯酸n-羟基琥珀酰亚胺部分修饰。26.根据方面1-25中任一项所述的方法,其中所述包埋包含使所述一个或更多个扩增子与丙烯酰胺共聚合。27.根据方面1-26中任一项所述的方法,其中所述包埋包含使所述一个或更多个水凝胶包埋的扩增子透明化,其中所述靶核酸基本上留存于所述一个或更多个水凝胶包埋的扩增子中。28.根据方面27所述的方法,其中所述透明化包含基本上去除所述一个或更多个水凝胶包埋的扩增子中的多种细胞组分。29.根据方面27或28所述的方法,其中所述透明化包含基本上去除所述一个或更多个水凝胶包埋的扩增子中的脂质。30.根据方面1-29中任一项所述的方法,其中所述第三寡核苷酸被配置成解码碱基。31.根据方面1-30中任一项所述的方法,其中所述第四寡核苷酸被配置成将已解码碱基转换成信号。32.根据方面31所述的方法,其中所述信号为荧光信号。33.根据方面1-32中任一项所述的方法,其中接触所述一个或更多个水凝胶包埋的扩
增子包含消除测序过程中的错误积累。34.根据方面1-33中任一项所述的方法,其中所述成像包含利用共聚焦显微技术、双光子显微技术、光场显微技术、完整组织膨胀显微技术和/或经clarity
tm
优化的单层光显微技术(colm)对所述一个或更多个水凝胶包埋的扩增子进行成像。35.根据方面1-34中任一项所述的方法,其中所述完整组织为薄切片。36.根据方面35所述的方法,其中所述完整组织的厚度为5-20μm。37.根据方面35或36所述的方法,其中接触所述一个或更多个水凝胶包埋的扩增子发生四次或更多次。38.根据方面35或36所述的方法,其中接触所述一个或更多个水凝胶包埋的扩增子发生五次或更多次。39.根据方面1-34中任一项所述的方法,其中所述完整组织为厚切片。40.根据方面39所述的方法,其中所述完整组织的厚度为50-200μm。41.根据方面39或40所述的方法,其中接触所述一个或更多个水凝胶包埋的扩增子发生六次或更多次。42.根据方面39或40所述的方法,其中接触所述一个或更多个水凝胶包埋的扩增子发生七次或更多次。43.一种筛选候选试剂以确定所述候选试剂能否调控完整组织内细胞中核酸的基因表达的方法,所述方法包含:(a)在允许发生特异性杂交的条件下,使固定透化完整组织与至少一对寡核苷酸引物接触,其中所述引物对包含第一寡核苷酸和第二寡核苷酸;其中所述第一寡核苷酸和所述第二寡核苷酸各自包含第一互补性区域、第二互补性区域和第三互补性区域;其中所述第二寡核苷酸进一步包含条形码序列;其中所述第一寡核苷酸的第一互补性区域与所述靶核酸的第一部分互补,其中所述第一寡核苷酸的第二互补性区域与所述第二寡核苷酸的第一互补性区域互补,其中所述第一寡核苷酸的第三互补性区域与所述第二寡核苷酸的第三互补性区域互补,其中所述第二寡核苷酸的第二互补性区域与所述靶核酸的第二部分互补,而且其中所述第一寡核苷酸的第一互补性区域与所述第二寡核苷酸的第二互补性区域相邻;(b)加入连接酶以连接所述第二寡核苷酸,并生成封闭的核酸环;(c)在核酸分子存在的情况下进行滚环扩增,其中所述操作包含采用所述第二寡核苷酸作为模板,以及采用所述第一寡核苷酸作为促使聚合酶形成一个或更多个扩增子的引物;(d)在水凝胶亚单元存在的情况下包埋所述一个或更多个扩增子,以形成一个或更多个水凝胶包埋的扩增子;(e)在允许连接的条件下,使具有条形码序列的所述一个或更多个水凝胶包埋的扩增子与一对引物接触,其中所述引物对包含第三寡核苷酸和第四寡核苷酸,其中仅在第三寡核苷酸和第四寡核苷酸与同一扩增子连接时,方实现连接;(f)重复步骤(e);(g)对所述一个或更多个水凝胶包埋的扩增子进行成像,以确定完整组织内细胞中靶
核酸的原位基因测序;以及(h)检测所述靶核酸的基因表达水平,其中在所述至少一种候选试剂存在的情况下所述靶核酸的表达水平相对于在所述至少一种候选试剂不存在的情况下所述靶核酸的表达水平所发生的变化表明,所述至少一种候选试剂调控完整组织内细胞中核酸的基因表达。44.根据方面43所述的方法,其中所述引物对在接触所述样品之前加热变性。45.根据方面43或44所述的方法,其中所述细胞存在于细胞群中。46.根据方面45所述的方法,其中所述细胞群包含多种细胞类型。47.根据方面43-46中任一项所述的方法,其中接触所述固定透化完整组织包含使所述引物对与同一靶核酸杂交。48.根据方面43-47中任一项所述的方法,其中所述靶核酸是rna。49.根据方面48所述的方法,其中所述rna是mrna。50.根据方面43-47中任一项所述的方法,其中所述靶核酸是dna。51.根据方面43-50中任一项所述的方法,其中所述第二寡核苷酸包含挂锁探针。52.根据方面43-51中任一项所述的方法,其中所述第一寡核苷酸的第一互补性区域的长度为19-25个核甘酸。53.根据方面43-52中任一项所述的方法,其中所述第一寡核苷酸的第二互补性区域的长度为6个核甘酸。54.根据方面43-53中任一项所述的方法,其中所述第一寡核苷酸的第三互补性区域的长度为6个核甘酸。55.根据方面43-54中任一项所述的方法,其中所述第二寡核苷酸的第一互补性区域的长度为6个核甘酸。56.根据方面43-55中任一项所述的方法,其中所述第二寡核苷酸的第二互补性区域的长度为19-25个核甘酸。57.根据方面43-56中任一项所述的方法,其中所述第二寡核苷酸的第三互补性区域的长度为6个核甘酸。58.根据方面43-57中任一项所述的方法,其中所述第二寡核苷酸的第一互补性区域包含所述第二寡核苷酸的5'末端。59.根据方面43-58中任一项所述的方法,其中所述第二寡核苷酸的第三互补性区域包含所述第二寡核苷酸的3'末端。60.根据方面43-59中任一项所述的方法,其中所述第二寡核苷酸的第一互补性区域与所述第二寡核苷酸的第三互补性区域相邻。61.根据方面43-60中任一项所述的方法,其中所述第二寡核苷酸的条形码序列提供用于识别所述靶核酸的条形码信息。62.根据方面43-61中任一项所述的方法,其中接触所述固定透化完整组织包含使对不同靶核酸具有特异性的多种寡核苷酸引物杂交。63.根据方面43所述的方法,其中所述第二寡核苷酸以封闭的核酸环形式提供,且省略加入连接酶的步骤。64.根据方面43-63中任一项所述的方法,其中选定寡核苷酸的所述解链温度(t
m
)以最大限度地减少寡核苷酸在溶液中的连接。
65.根据方面43-64中任一项所述的方法,其中加入连接酶包含加入dna连接酶。66.根据方面43-65中任一项所述的方法,其中所述核酸分子包含经胺修饰的核苷酸。67.根据方面66所述的方法,其中所述经胺修饰的核苷酸包含丙烯酸n-羟基琥珀酰亚胺部分修饰。68.根据方面43-67中任一项所述的方法,其中所述包埋包含使所述一个或更多个扩增子与丙烯酰胺共聚合。69.根据方面43-68中任一项所述的方法,其中所述包埋包含使所述一个或更多个水凝胶包埋的扩增子透明化,其中所述靶核酸基本上留存于所述一个或更多个水凝胶包埋的扩增子中。70.根据方面69所述的方法,其中所述透明化包含基本上去除所述一个或更多个水凝胶包埋的扩增子中的多种细胞组分。71.根据方面69或70所述的方法,其中所述透明化包含基本上去除所述一个或更多个水凝胶包埋的扩增子中的脂质。72.根据方面43-71中任一项所述的方法,其中所述第三寡核苷酸被配置成解码碱基。73.根据方面43-72中任一项所述的方法,其中所述第四寡核苷酸被配置成将已解码碱基转换成信号。74.根据方面73所述的方法,其中所述信号为荧光信号。75.根据方面43-74中任一项所述的方法,其中接触所述一个或更多个水凝胶包埋的扩增子包含消除测序过程中的错误积累。76.根据方面43-75中任一项所述的方法,其中所述成像包含利用共聚焦显微技术、双光子显微技术、光场显微技术、完整组织膨胀显微技术和/或经clarity
tm
优化的单层光显微技术(colm)对所述一个或更多个水凝胶包埋的扩增子进行成像。77.根据方面43-76中任一项所述的方法,其中所述完整组织为薄切片。78.根据方面77所述的方法,其中所述完整组织的厚度为5-20μm。79.根据方面77或78所述的方法,其中接触所述一个或更多个水凝胶包埋的扩增子发生四次或更多次。80.根据方面77或78所述的方法,其中接触所述一个或更多个水凝胶包埋的扩增子发生五次或更多次。81.根据方面43-76中任一项所述的方法,其中所述完整组织为厚切片。82.根据方面81所述的方法,其中所述完整组织的厚度为50-200μm。83.根据方面81或82所述的方法,其中接触所述一个或更多个水凝胶包埋的扩增子发生六次或更多次。84.根据方面81或82所述的方法,其中接触所述一个或更多个水凝胶包埋的扩增子发生七次或更多次。85.根据方面43-84中任一项所述的方法,其中所述检测包含实施流式细胞术;测序;探针结合和电化学检测;ph值改变;与dna标签结合的酶诱导的催化作用;量子纠缠;拉曼光谱技术;太赫兹波技术;和/或扫描电子显微技术。86.根据方面85所述,其中所述流式细胞术为大量细胞计数法或荧光激活流式细胞术。87.根据方面43-86中任一项所述的方法,其中所述检测包含实施显微技术、扫描质谱
分析技术或其他成像技术。88.根据方面43-87中任一项所述的方法,其中所述检测包含测定信号。89.根据方面88所述的方法,其中所述信号为荧光信号。90.一种系统,其包含:包含成像室和泵的流体设备;以及被配置成实施方面1-42中任一项的处理器单元。示例
[0138]
提出以下示例是为了向本领域普通技术人员完整地公开并叙述构建及使用本发明的方法,并且无意限制发明人所认为其发明的范围,也无意表示以下实验是全部或唯一进行的实验。已经努力确保所使用数字(例如数量、温度等)的准确性,但是应该考虑到一些实验误差和偏差。除非另有说明,否则份数为重量份数,分子量为重均分子量,温度为摄氏度,压力指大气压或接近大气压。可使用标准缩写,例如,bp:碱基对;kb:千碱基;pl:皮升;s或sec:秒;min:分钟;h或hr:小时;aa:氨基酸;kb:千碱基;bp:碱基对;nt:核苷酸;i.m.:肌内;i.p.:腹膜内;s.c.:皮下注射;等等。材料和方法
[0139]
除非另有说明,否则以下材料和方法通常适用于本专利所述示例中的结果。小鼠
[0140]
所有动物程序均遵循斯坦福大学实验室动物护理小组(administrative panel on laboratory animal care,aplac)批准的动物护理准则以及美国国立卫生研究院(national institutes of health)发布的准则。将c57/bl6雄性小鼠(6-10周龄)用于实验。对于黑暗/照明处理实验,先按标准光照周期饲养小鼠,然后将其置于始终黑暗无光的环境中5天。在黑暗环境饲养结束后,处死小鼠或在处死前对其进行光暴露1小时。对于可卡因实验,在处死前1小时给小鼠注射生理盐水或15mg/kg可卡因。对于薄切片,用异氟烷麻醉动物并迅速断头。取出脑组织,置于o.c.t中,于液氮中冷冻,然后用低温恒温器(leica cm1900;详细信息请见下文薄组织切片部分)切片。对于大体积样品,用buprenex(100mg/ml,腹膜内)麻醉动物,经心脏灌注冷pbs,然后再灌注4%pfa(详细信息请见下文大体积样品部分)。thy1-yfp小鼠为b6.cg-tg(thy1-yfp)hjrs/j。小白蛋白转基因小鼠通过parv-ires-cre(jax编号:8069)和ai14(jax编号:7908)小鼠杂交而产生。化学物质和酶类
[0141]
化学物质和酶类按名称列出(供应商,目录号):gel slick溶液(lonza,50640)。plusone亲和硅烷(ge healthcare,17-1330-01)。聚-l-赖氨酸溶液,0.1%w/v(sigma,p8920)。超纯蒸馏水(invitrogen,10977-015)。玻璃底12孔和24孔板(mattek,p12g-1.5-14-f和p24g-1.5-13-f)。2号微型盖玻片,直径12mm(electron microscope sciences,72226-01)。o.c.t.化合物(fisher,23-730-571)。16%pfa,em级(electron microscope sciences,15710-s)。hplc用甲醇(sigma-aldrich,34860-1l-r)。pbs,7.4(gibco,对于1
×
,为10010-023;对于10
×
,为70011-044)。tween-20,10%溶液(calbiochem,655206)。triton-x-100,10%溶液(sigma-aldrich,93443)。ominipur甲酰胺(calbiochem,75-12-7)。20
×
ssc缓冲液(sigma-aldrich,s6639)。氧钒核糖核苷复合物(new england biolabs,s1402s)。经剪切的鲑鱼精dna(invitrogen,am9680)。superase
·
in(invitrogen,am2696)。
t4 dna连接酶,5weiss u/μl(thermo scientific,el0011)。phi29 dna聚合酶(thermo scientific,ep0094)。10mm dntp混合物(invitrogen,100004893)。bsa,分子生物学等级(new england biolabs,b9000s)。5-(3-氨基烯丙基)-dutp(invitrogen,am8439)。bspeg9(thermo scientific,21582)。丙烯酸nhs酯,90%(sigma-aldrich,a8060)。甲基丙烯酸nhs酯,98%(sigma-aldrich,730300)。无水dmso(molecular probes,d12345)。丙烯酰胺溶液,40%(bio-rad,161-0140)。bis溶液,2%(bio-rad,161-0142)。过硫酸铵(sigma-aldrich,a3678)。n,n,n',n'-四甲基乙二胺(sigma-aldrich,t9281)。ominipur sds,20%(calbiochem,7991)。蛋白酶k,rna级(invitrogen,25530049)。虾碱性磷酸酶(new england biolabs,m0371l)。dapi(molecular probes,d1306)。neurotrace荧光尼氏染色液,黄色(molecular probes,n-21480)。pmsf(sigma,93482)。木瓜蛋白酶(worthington,ls003127)。人工基底膜(corning life sciences,356234)。neurobasal-a培养基(invitrogen,21103-049)。fbs(hyclone,sh3007103)。b-27补充剂(gibco,17504044)。2mm glutamax(gibco,35050-061)。氟脱氧尿苷(sigma,f-0503)。抗neun抗体(abcam,190565)。原代小鼠皮质神经元培养
[0142]
在小鼠幼鼠出生后第0天(p
0
),从这些幼鼠中取出新皮质或海马,用0.4mg/ml木瓜蛋白酶消化,然后以每孔65,000个细胞的密度接种至预先用1:30人工基底膜涂覆的24孔玻璃底培养板上。将经培养的神经元置于含有1.25%fbs、4%b-27补充剂、2mm glutamax和2mg/ml氟脱氧尿苷的neurobasal-a培养基中,然后将其置于温度为37℃且含5%co
2
的潮湿培养箱中。smfish
[0143]
配有quasar 570的小鼠gapdh用stellaris shipready smfish探针购自lgc bioresearch technologies(smf-3002-1)。smfish实验按照制造商针对粘附细胞和冷冻小鼠脑组织编制的方案进行。starmap探针设计
[0144]
snail探针设计如下:(1)所有小鼠蛋白的共有cdna序列(ccds)均下载自ftp://ftp.ncbi.nlm.nih.gov/pub/ccds/current_mouse,并下载参比转录组信息(hgdownload.cse.ucsc.edu/goldenpath/mm10/bigzips/)。对于具有多种转录异构体的基因,仅考虑最短的异构体;(2)使用picky 2.2(32位)设计每个探针对的杂交序列,其长度限制为40-46个核苷酸(nt);针对每个基因设计了4种序列;(3)将所得到的互补dna(cdna)序列(40-46nt)分成两半,各占20-25nt,两者之间间隔0-2nt,且两者之间的解链温度(tm)实现最佳匹配。所有探针长度均短于60nt组成的长度,且由integrated dna technologies(idt)制成96孔板。对于160个转录物实验,自制测序试剂包括六个读码探针(r1至r6)和十六个用alexa 488、546、594和647标记的2碱基编码荧光探针(2base_f1至2base_f16)。对于28-转录物大体积实验,所有snail引物探针均依据丙烯酰胺修饰进行订购,然后用11-nt正交读码探针(or1至or7)和四个1碱基荧光探针(1base_f1至1base_f4)进行测序。在发布者网站上以excel数据文件形式提供所有序列。适用于细胞培养物和薄组织切片的starmap程序样品制备
[0145]
用甲基丙烯酰氧基丙基三甲氧基硅烷(bind-silane)处理玻璃底12孔或24孔板。
对于脑组织切片,用聚-l-赖氨酸溶液对12孔板作进一步处理。用gel slick预处理2号微型盖玻片(12mm),以便随后按照制造商的说明进行聚合。将原代神经元细胞培养物用1.6%pfa溶于pbs后得到的溶液固定10分钟,然后将其转移至经预冷的(-20℃)甲醇中,而后置于-80℃下至少15分钟(至多1周)。对于脑组织,将新割取的小鼠大脑立即包埋入o.c.t.速冻。将组织储存在-80℃环境中或转移至低温恒温器中,并切割成16-μm的切片。将含有初级视皮层的切片置于经过预处理的玻璃底培养板上。在室温下,将大脑切片用4%pfa溶于pbs后得到的溶液固定10分钟,然后用-20℃甲醇透化,而后在杂交前于-80℃环境中放置15分钟。文库构建
[0146]
将snail探针溶于不含rnase的超纯水中,使其浓度达到100或200μm,然后混合。将探针混合物在90℃下加热2至5分钟,然后使其在室温下冷却。在-80℃下取样品,使样品平衡至室温5分钟,用pbstr(0.1%tween-20、0.1u/μl superase
·
in溶于pbs后所得到的溶液)洗涤2-5分钟,然后置于含有1x杂交缓冲液(2x ssc、10%甲酰胺、1%tween-20、20mm rvc、0.1mg/ml鲑鱼精dna和经混合的snail探针(每个寡核苷酸100nm))的40℃加湿烘箱中孵育并轻轻摇晃过夜。然后,在37℃下,用pbstr将样品洗涤两次(20分钟),随后置于4x ssc中洗涤一次(20分钟),而后将所得物溶于pbstr中。最后,在室温下用pbstr将样品简单冲洗一次。然后,在室温下用t4 dna连接混合物(1:50倍稀释的t4 dna连接酶稀释液,且加入了1x bsa和0.2u/μl superase-in)孵育并轻轻搅拌样品2小时。然后,用pbstr将样品洗涤两次,随后在30℃下用rca混合物(1:50倍稀释的phi29 dna聚合酶稀释液、250μm dntp、1x bsa、0.2u/μl superase-in以及20μm 5-(3-氨基烯丙基)-dutp)孵育并搅拌2小时。接下来,在室温下,将样品置于pbst(pbstr,不含superase
·
in)中洗涤两次,然后用20mm丙烯酸nhs酯溶于pbst后得到的溶液处理2小时。在室温下,用pbst将样品简单洗涤一次,然后用单体缓冲液(4%丙烯酰胺、0.2%双丙烯酰胺、2x ssc)孵育30分钟。吸取缓冲液,然后将10μl聚合混合物(0.2%过硫酸铵、0.2%四甲基乙二胺溶于单体缓冲液后得到的溶液)添加至样品中心,而后立即用涂覆有gel slick的盖玻片覆盖,在室温下孵育1小时,然后用pbst洗涤两次,每次5分钟。组织凝胶杂交体用蛋白酶k(0.2mg/ml)在37℃消化1小时,然后用pbst洗涤3次(每次5分钟)。成像和测序
[0147]
对于单基因检测,将与dna扩增子互补的19-nt荧光寡核苷酸置于1x ssc溶于pbst后得到的溶液中稀释,使其浓度为500nm,接着在室温下孵育样品30分钟,然后在成像前用pbst洗涤3次,每次5分钟。对于测序,每个测序循环均始于在室温下用剥离缓冲液(60%甲酰胺、0.1%triton-x-100)处理样品两次(10分钟),然后用pbst洗涤3次,每次5分钟。在室温下,用测序混合物(1x t4 dna连接酶缓冲液、1:25倍稀释的t4 dna连接酶稀释液、1x bsa、10μm读码探针和5μm荧光寡核苷酸)孵育样品3小时。然后,在成像之前,分别用洗涤和成像缓冲液(2x ssc和10%甲酰胺)冲洗样品3次(10分钟)。在第1个循环之前以及第6个循环之后,按照制造商的说明进行dapi染色,以便用nissl染色对测序图像进行配准。在第6个循环之后,按照制造商的说明进行nissl染色,以便进行细胞分割。使用配有405二极管、白光激光器、40倍油浸物镜(na 1.3)的leica tcs sp8共聚焦显微镜采集图像,体素大小为78nm
×
78nm
×
315nm。
薄切片starmap数据处理
[0148]
所有图像处理步骤均使用matlab r2017a实施。图像配准
[0149]
利用三维快速傅里叶变换法(fft)来计算在所有平移偏移量下两个图像体之间的交叉相关性,从而完成图像配准。确定最大相关系数的位置,并将其用于平移图像体以补偿偏移量。基于第一轮测序配准所有图像,首先针对整个视场进行全局变换,然后分别针对各图块(对应于图像采集期间显微镜使用的各图块视场)进行变换。点识别
[0150]
配准后,基于第一轮测序,分别识别出每个颜色通道中的单个点。对于160-基因实验,首先用三维高斯拉普拉斯算子滤波器对图像体进行滤波,然后在3d中确定局部极大值,从而识别出直径约为7个像素的点。对于1020-基因实验,采用类似的方法识别点,但是其中高斯拉普拉斯算子在多尺度下进行计算,且极大值也是在这些尺度下确定的。识别出每个点之后,在每一轮中,针对围绕该点位置的3x3x1体素体积,确定该点在所有四个通道中的主色。条形码滤波
[0151]
首先基于质量评分对点作滤波处理。质量评分量化了每个测序循环中每个点来自一种颜色而非混合颜色的概率。基于对条形码dna序列进行2碱基编码后得到的预期颜色序列,将条形码密码块转换为颜色空间。保留达到质量阈值且匹配密码块中的序列的点颜色序列,并用条形码表示的特定基因识别;拒绝所有其他点。然后,将密码块中的高质量点和相关的基因身份保存下来,以进行下游分析。2d细胞分割
[0152]
在完成最后一轮测序后,依据dapi通道的最大强度投影手动识别细胞核。首先基于nissl染色,利用ilastik中采用的random forests分类器识别细胞体。用从所有样品中随机选择的裁剪区域子集训练分类器,然后将其应用于整个图像。而后,将设有阈值的概率图进行像素扩张以填充剩余孔。最后,基于合并的设有阈值的细胞体图和确定的细胞核位置,将基于标记的分水岭变换用于分割设有阈值的细胞体。在每个细胞体周围进行凸包计算。然后,将与每个凸包在2d中重叠的点分配给所述细胞,以计算每个细胞的基因表达矩阵。单细胞数据预处理
[0153]
所有单细胞分析均采用python中的自定义软件包进行,以便进行starmap实验分析。首先,采用以下公式,针对每个细胞i的所有基因j的表达值eij,使每个细胞的表达矩阵归一化:
[0154]
n
ij
=ln(1+median(e
i:
)*(e
ij
/σe
i:
))
[0155]
为了进行聚类,使用线性模型对与每个细胞的转录物数量、样品一致性以及实验条件(光照与黑暗处理)有关的影响进行回归分析:
[0156]
e
ij
=nspots
i
+exptid
i
+exptcond
i
,并假设e
ij
符合泊松分布。顶级单细胞聚类
[0157]
归一化和缩放后,进行主成分(pc)分析来减少细胞表达矩阵的维数。基于解释的方差比率,依据对各pc的解释的方差比率进行的手动分析,将顶级pc用于顶级聚类。然后,
采用共享最近邻(snn)算法和louvain距离对顶级pc进行聚类。将富含兴奋性神经元标记slc17a7(囊泡谷氨酸转运蛋白)、抑制性神经元标记gad1和非神经元标记mqp的聚类手动合并,以形成代表这些细胞类型的三个主要聚类。采用统一流形逼近与投影(umap)(https://github.com/lmcinnes/umap)显示细胞。然后,利用pca分解对各聚类的细胞进行亚聚类,而后进行louvain snn聚类,以确定具体细胞类型。单细胞亚聚类
[0158]
采用与应用于主要聚类相同的方法对抑制性、兴奋性和非神经聚类进行亚聚类。差异表达分析
[0159]
采用bimod检验(似然比检验),计算每个聚类与所有其他聚类之间每个基因的差异表达的p值,从而选择所述亚聚类中特定可变的基因。根据聚类数对p值进行fdr校正。适用于厚组织切片的starmap程序样品制备
[0160]
采用与薄组织切片相同的方式对玻璃底12孔板和微型盖玻片(12mm)进行预处理。给小鼠灌注pfa,然后在冰上后固定2-3小时,接着转移至置于冰上的pbs中处理30分钟,然后切割成150-μm切片。将含有初级视皮层的切片转移至经过预处理的玻璃底培养板上,并用冰冷的pbs洗涤一次。文库构建
[0161]
在4℃下,用-20℃冷冻甲醇对样品进行1小时的预透明化处理,然后将其置于含有1
×
透化和杂交缓冲液(2x ssc、10%甲酰胺、1%triton-x-100、20mm rvc、0.1mg/ml鲑鱼精dna、经混合的snail探针(每个寡核苷酸100nm)和0.2%sds)的40℃加湿烘箱中孵育并轻轻摇晃两天。甲醇处理可防止样品膨胀和变形;为了联合检测蛋白和rna(thy1-yfp),跳过了甲醇预透明化操作。在37℃下,用pbstv(0.1%triton和2mm rvc)洗涤样品两次,每次1小时,然后用pbs洗涤一次,一次1小时。接下来,在4℃下,用聚合混合物i(4%丙烯酰胺、0.2%双丙烯酰胺、2x ssc、0.5%va-044)孵育样品1小时。吸取缓冲液,然后将40μl聚合混合物ii(0.1%过硫酸铵、0.1%四甲基乙二胺溶于聚合混合物i后得到的溶液)添加至样品中心,而后立即用涂覆有gel slick的盖玻片覆盖,并在40℃下孵育1小时。然后,用pbstv将样品洗涤两次,每次20分钟。在37℃下,用蛋白酶k(0.2mg/ml溶于2xssc后得到的溶液、1%sds)对组织凝胶杂交体进行过夜消化处理,然后用pbsf(2mm pmsf溶于pbs后得到的溶液)和pbstr洗涤两次(每次30分钟)。接下来,在室温下用t4 dna连接混合物(1:50倍稀释的t4 dna连接酶稀释液,且加入了1x bsa和0.2u/μl superase-in)孵育并轻轻搅拌样品12小时。然后,用pbstr将样品洗涤两次(每次1小时),随后在30℃下用rca混合物(1:50倍稀释的phi29 dna聚合酶稀释液、250μm dntp、1x bsa、0.2u/μl superase-in以及20μm 5-(3-氨基烯丙基)-dutp)孵育12至24小时。最后,样品通过bspeg9实现交联。成像和测序
[0162]
首先,将样品用dapi染色过夜,然后用pbs冲洗1小时。每个循环均始于在室温下用剥离缓冲液(60%甲酰胺、0.1%triton-x-100)处理样品两次(20分钟),然后用pbst洗涤3次,每次20分钟。在室温下,用大量测序混合物(1x t4 dna连接酶缓冲液、1:50倍稀释的t4 dna连接酶稀释液、1x bsa、5μm正交读码探针和400nm 1碱基荧光寡核苷酸)孵育样品4小时。然后,用pbs冲洗样品两次(每次20分钟),然后进行成像。使用配有405nm二极管、白光激
光器和25倍水浸物镜(na 0.95)的leica tcs sp8共聚焦显微镜采集图像,体素大小为0.9μm
×
0.9μm
×
1μm。大容量starmap数据处理
[0163]
再次进行图像配准(3d fft配准),但使用dapi通道配准的情况除外。具体而言,每一轮的dapi通道均依据第一轮的情况进行全局配准,然后在与用于采集图像的视场图块相对应的4
×
5网格中逐段配准。细胞识别与量化
[0164]
配准后,采用应用于dapi通道的高斯拉普拉斯算子滤波器的极小值来识别细胞。为了量化每个基因的表达,针对围绕各细胞核的10x10x3体素体积,取每个颜色通道的平均强度的平均值。3d细胞分析
[0165]
首先,通过k-means聚类,利用gad1、slc17a7和若干非神经元基因将细胞聚类至抑制性、兴奋性和非神经元聚类中。然后,通过k-means聚类对每个聚类进行亚聚类。将k-means聚类的初始值设置为各标记基因的平均表达值。为了计算细胞类型之间的距离,使用kd树(适于利用欧氏距离进行快速最近邻计算),对所有兴奋性神经元中的细胞与每个抑制性神经元亚型之间的最近邻距离进行计算。利用actb插入基因评估starmap的物理限制
[0166]
100和1000个基因在挂锁中具有共有18nt序列(序列a),该序列将在最终纳米微球中扩增。针对actb用不同的18nt序列(序列b)设计了另一套snail探针。将actb的snail探针与0、100或1,000个基因的snail探针混合在一起,并用于杂交。actb插入基因以及100和1,000个基因都经过相同的连接和扩增步骤,以确保效率一致性。为了读取读数,将两个荧光检测寡核苷酸(与序列b互补的alexa488探针和靶向序列a的alexa 647探针)加入样品中;在两个独立通道中对actb的扩增子和其余基因的扩增子进行成像。然后,测试actb rna的扩增子,以确定是否可以通过增加其他基因的数量来稀释扩增子的数量,以作为分子拥挤的指示(图16a-16e)。澄清组织的免疫染色
[0167]
如先前shendure等人(2005)的相应出版物中所述,处理经pfa固定的组织。简而言之,在4℃下,将厚度为200μm的pfa固定大脑切片置于1%丙烯酰胺包埋溶液中23小时,然后在37℃下包埋4小时,而后进行5天的被动透明化处理。透明化切片在pbst中洗涤2天,接着在室温下用抗neun(1:100)染色24小时,然后在pbst中洗涤24小时。采用共聚焦显微技术对切片进行成像。自动原位测序设备(预计)
[0168]
实验过程的自动化步骤包括三种在室温下大量保存的缓冲液:1)洗涤缓冲液,2)成像缓冲液和3)剥离缓冲液。一根装有连接酶混合物的试管的温度将保持在4℃下。实验过程中会有8根含有荧光标记成像材料的试管,其温度也保持在4℃下。其中六根试管将含有荧光标记的寡核苷酸和杂交用探针。其中一根试管将含有小分子nissl染色剂,另一根试管将含有小分子dapi染色剂。如果在成像时无法混合连接酶和寡核苷酸,则可以将其预混合并存放于温度维持在4℃的环境中。
[0169]
测序过程包括将样品置于定制成像室中以及连接至流体系统。在六轮测序的每一
轮中,需要混合连接酶混合物和6种寡核苷酸混合物中的任一种(总体积为200-400μl),然后用其处理样品3小时。接下来,使洗涤缓冲液流经样品,持续10分钟。然后,将洗涤缓冲液替换成成像缓冲液。接着,系统会向显微镜发送触发信号,该触发信号将执行荧光成像操作。成像完成后,显微镜会向系统发送触发信号以开始下一轮操作。系统会使剥离缓冲液流经样品,持续10分钟。而后,使洗涤缓冲液流经5分钟以去除残留的剥离缓冲液。在下一轮中使用连接酶和荧光标记的寡核苷酸。重复此过程六次后,剥离并洗涤激光轮,然后分别用nissl和dapi溶液处理一小时。接着洗涤此设备,并在成像缓冲液中成像。最后,实验完成后,应当使用漂白剂冲洗整个系统,以将其清洗干净以备下次使用。
[0170]
计算机控制的流体设备可以泵出各种溶液,将连接酶与寡核苷酸溶液混合,并选择每轮使用的寡核苷酸溶液。此序列中的所有参数(流速、时间等)应当均可程序化。
[0171]
对于整个组织,定制成像室会将组织切片密封在一个容量小且带有流入和流出端口的位置,并用配有24孔板支架的显微镜对其进行操作。图24a描述了用于starmap测序的整体硬件配置,图24b描述了本文所述的示例性流体系统的设计。结果示例1:starmap
[0172]
本文所揭示的方法(包括原位测序技术)可在完整生物组织内进行高度多重基因检测(至多1000个基因)。所述方法始于原始生物组织(新鲜或保存的组织,最小规格:一个细胞;最大规格:以毫米计),其可在亚细胞和细胞分辨率下输出基于图像的基因定量,且效率高,错误率低,处理时间短。
[0173]
有关本文所述的starmap的示意图,请见图1a。准备好脑组织后(有关小鼠大脑获取方案,请参阅“方法”部分),对于与完整组织内的细胞内mrna(虚线部分)接触并杂交的定制snail探针(图2a),以酶促方式将其作为cdna扩增子复制。通过丙烯酸n-羟基琥珀酰亚胺部分修饰原位构建扩增子,然后使其与丙烯酰胺共聚,以包埋入水凝胶网络(波浪线部分)中,然后去除未结合脂质和蛋白(图3a-3f)。每个snail探针均含有一个独特基因标识符片段,该片段通过原位测序和2碱基编码读出,以便纠错(sedal,图4a-4l)。最后,3d中的高度多重rna定量揭示了空间内的基因表达和细胞类型。
[0174]
图1a描述了以下关于snail的方法:一对引物和挂锁探针扩增了靶特异性信号,且去除了通常由单个探针的非特异性杂交产生的噪点。图1c和1d表明,仅引物和挂锁探针的相邻结合能使信号扩增。mrna a表示gapdh,mrna b表示actb。荧光图像均显示小鼠脑切片中的gapdh mrna(灰色)和细胞核(蓝色)标记;注意到由于引物和挂锁错配而无标记(图1d,右图)。比例尺为10μm。图1e描述了通过sedal(为starmap设计的一种经改进的连接法测序方法)对组织水凝胶复合物中的dna扩增子进行的原位测序。对于每个循环,读码探针(不带星号标记的线)在5'末端(5'p)含有长度递增的简并碱基(n表示a、t、c和g的等量混合物)和磷酸盐,以便设置读码位置;解码探针(带有星号标记的线)被荧光团标记,且在3'末端具有适用于二核苷酸的颜色编码。仅当两种探针与dna模板完全互补(较低序列)时,才将这两种探针连接以形成具有较高解链温度的稳定产物,从而允许随后在冲洗掉未连接的探针后进行成像。在每个成像循环完成后,使用60%甲酰胺从坚韧结实的组织水凝胶中剥离出探针,以便开始下一循环操作。x表示待读取的未知碱基;“下划线”表示解码序列;ch1-4表示荧光通道。比例尺为2μm。
示例2:snail
[0175]
逆转录可能是原位测序中的主要效率限制步骤,而snail可以采用设计的一对引物和挂锁探针绕过该步骤(图2a),这仅当两个探针都与同一rna分子杂交时方才有效。snail探针(starmap的一个组成部分)的设计包括以下内容:每个引物或挂锁探针(19-25个核苷酸;nt,蓝色)的设计t
m
(核酸的解链温度)为60℃或更高,以便与靶rna杂交,而对于t
m
低于室温的各测试组时,引物与挂锁之间的互补序列仅为6nt,因此在40℃下,在dna-rna杂交过程中,引物-挂锁dna-dna杂交可忽略不计,但允许在下一步骤中用t4 dna连接酶进行dna连接。
[0176]
将挂锁探针环化并进行滚环扩增,以生成含有多个cdna拷贝的cdna纳米微球(扩增子)(图1a-1d)。这种机制确保了靶特异性信号的扩增,且去除了由单个探针的非特异性杂交而不可避免地产生的噪点。实际上,与市售单分子荧光原位杂交(smfish)探针相比,此机制下的绝对强度和信噪比(snr)要高得多(图2b-2f)。图2b描述了靶向小鼠皮质细胞培养物和小鼠视皮层切片中的gapdh mrna的市售smfish探针和snail探针的信噪比(snr;信号斑的平均强度/背景的平均强度)的比较。误差条表示斑点强度的标准差(s.d.)。误差条表示对应于源自所采集图像中640,000个像素的rna信号的39,398个像素、30,297个像素、97,555个像素和19,392个像素的s.d.;***p<0.0001,student t检验。图2c-2f描述了皮质细胞培养物(图2c和2d)和视皮层切片(图2e和2f)中的gapdh smfish(图2c和2e)和snail探针(图2d和2f)的荧光图像;比例尺为10μm。图2g描述了使用滚环扩增(rca)进行的多重rna成像方法比较。与fisseq和挂锁探针相比,snail探针克服了逆转录的效率限制步骤,大大简化了实验流程;playr需要四个探针、一个额外步骤和两个连接位点,而snail仅需要一对探针和一个连接位点。通过单细胞rna测序(scrna-seq,ref)和starmap(提取自视皮层的160-基因图谱)测量了每个细胞中rna的151个细胞类型基因标记的箱形图(图2g)。箱形图描述了第一和第三四分位数;中线表示中位数;箱须表示5%和95%数据点;p值表示秩和检验。对于单细胞rna测序和基于rca的多重rna检测方法的概述,从参考文献中提取了一些数字(图2i)。示例3:cdna扩增子包埋入组织水凝胶环境中
[0177]
为了使cdna扩增子包埋入组织水凝胶环境中,将经胺修饰的核苷酸掺入滚环扩增反应物中,然后用丙烯酰胺部分(同时使用丙烯酸n-羟基琥珀酰亚胺酯)使其官能化,并使其与丙烯酰胺单体共聚以形成水凝胶(图1a,图3a)。有关薄组织切片中用于starmap的水凝胶组织化学方法的示意图,请见图3a。在少量5-(3-氨基烯丙基)-dutp存在的情况下合成dna扩增子,其中将t改为较低速率,并用可聚合丙烯酰胺部分(同时使用丙烯酸n-羟基琥珀酰亚胺酯(aa-nhs))使其官能化,从而使得dna扩增子在聚丙烯酰胺网络内的多个位点处实现共价锚定(图3a,右图)。然后,对所得的组织水凝胶进行蛋白消化和脂质去除操作,以提高透明度(图3b-3e)。荧光图像(来自所有四个荧光通道的总强度)表示小鼠视皮层中的160-基因检测结果(图3b和3c)以及小鼠内侧缰核中的16个基因检测结果(图3d和3e)。与未处理的样品(图3b和3d)相比,用5-(3-氨基烯丙基)-dutp htc处理并去除了脂质和蛋白的样品(图3c和3e)的不透明度和自发荧光有所降低/减少。比例尺为50μm。dna凝胶交联可使dna扩增子留存于凝胶中。在有或无aa-nhs的情况下制备160-基因样品,并在内侧前额叶皮层中成像(图3f-3g)。与经aa-nhs处理的样品相比,未经aa-nhs处理而制备的新制样品信号
损失36%,且在室温下储存24小时后,进一步出现40%的信号损失,而经aa-nhs处理的样品的信号变化仅为9%(图3f)。荧光强度是四次技术平行测定结果的平均值,成像尺寸为120μm
×
120μm
×
3μm。误差条显示为平均值
±
标准差;***p<0.001,双侧t检验。荧光图像描述请见图3g,比例尺为3.5μm。
[0178]
由于这种设计化学方法要求扩增子与水凝胶网络共价连接,因此可以通过多个检测循环来维持靶标的位置和形状。图3h描述了视皮层中一个神经元的放大荧光图像,其通过starmap检测gapdh rna(第1个循环),在第2个循环时进行剥离;此外也合并第1个循环和第2个循环的图像,展示了dna扩增子在测序循环过程中的稳定空间位置。比例尺为2μm。示例4:sedal
[0179]
设计了一个5碱基条形码(文库大小为1,024),并将其内置于各挂锁探针中,作为待测序的独特基因标识符,从而实现了多重基因检测(图1a)。避免了合成法测序范式,因为其要求的反应温度更高,与在室温下实施的连接法测序方法相比,这反过来又对成像和样品稳定性造成了影响。但是,对于这种具有挑战性的完整组织应用而言,报告或可商购的连接法测序方法均无法获得必要的snr或准确度(图4a-4l)。因此,专为starmap设计了一种称之为sedal的新方法(图4a-4l)。
[0180]
有关sedal的示意图请见图4a。sedal涉及一种t4 dna连接酶,其活性严重受阻于碱基错配,且有两种测序探针:设置待询问的碱基位置的读码探针,以及将碱基信息转化为用于成像的颜色的荧光解码探针。与使用预先退火的读码探针(或等效物)的其他连接法测序方法不同,sedal中的读码探针较短(11nt,t
m
接近室温),部分简并(例如,如图4a所示,对于第4个循环,5'末端的前两个碱基为n,n是a、t、c和g的等量混合物),且与解码探针和t4 dna连接酶混合以便实现一步反应。在室温下,读码探针与dna模板保持动态退火状态,且此探针脱离dna模板。仅当读码探针与dna模板完美匹配时,t4 dna连接酶才会与荧光8-nt解码探针连接。也就是说,仅在发生完美匹配时,两个探针才会连接以形成用于成像的稳定产物。然后,洗涤短读码和解码探针,使荧光19-nt产物与dna扩增子稳定杂交以进行成像。对于下一个循环,剥离先前的荧光产物,而且读码探针还包括一个简并碱基,能使读码框移动一个碱基(图1e)。5'p表示5'磷酸盐。3'invt表示3'倒置dt碱基,这可以防止读码探针自连接;3'oh表示3'羟基。
[0181]
在对应于碱基读数的每个循环之后,用甲酰胺剥离荧光产物,这消除了随着测序的进行而产生的错误积累(图1e和图4b)。有关所有连接法测序方法的关键特性比较,请见图4c-4f。应用于小鼠脑组织时,与市售solid测序试剂盒相关的背景问题请见图4c和4d,而与定制sedal试剂相关的背景问题最少的情况请见图4e和4f。信号图像(图4c和4e)表示malat1、actb、calm1和snap25基因的第一个测序循环。背景图像(图4d和4f)在第一个循环的裂解/剥离操作完成后采集。比例尺为50μm。
[0182]
在有或无单个测序错误(颜色错误)的情况下,有关1碱基和2碱基编码范式的示意图以及示例结果请见图4g和4h。对于1碱基编码,单个测序错误会导致一个碱基突变,从而导致测序错误5碱基密码(图4g)。对于2碱基编码,六循环范式起到了减少错误的作用。由于任何测序循环中的单个错误都会传递下去并导致旁侧已知碱基g突变为其他碱基,因此拒绝了错误读段(图4h)。设计并实施2碱基编码方案,以减少与高密度斑点成像有关的任何残留错误(图4g-4h)。
[0183]
基于由四个高度表达的测试基因组成的测试组,starmap的错误率相较于现有方法的错误率低一个数量级以上(约1.8%比29.4%;图4i-4l)。源自cpal(表示1碱基编码方案)和sedal(表示2碱基编码方案)的实际数据被用于小鼠视皮层的4基因检测。malat1、actb、calm1和snap25的snail探针在两种情况下均相同,且四个5碱基密码对中每对的汉明距离均为5(即,完全非同源性);采用这种稀疏编码,可以依据错误斑点(并非所使用的四个5碱基密码)在所有检测到的斑点中的占比估算测序错误率。(图4i-4j)。有关由cpal和sedal检测到的四个基因的空间图,请分别参见图4i和图4j。4基因实验中cpal的错误率(图4i)为29.4%(图4k),而sedal的错误率(图4j)在内置误差减小(图4l)后为1.8%。示例5:利用starmap对初级视皮层中的细胞类型进行细胞分类
[0184]
为了测试starmap能否在必要的灵敏度和准确性下实现单细胞转录状态的高内涵3d完整组织测序的初始目标,将starmap应用于神经科学领域当前最亟待解决的挑战:对细胞类型进行检测和分类以及遵循成年小鼠大脑新皮质的组织结构原则。小鼠初级视觉新皮层的解剖结构和功能已得到广泛研究,可以通过与先前的研究结果进行比较来验证相应结果,所述研究结果涉及多篇论文、方法学和数据源,但是对于视皮层内经深层分子定义的细胞类型的多样性,尚未在单个实验中对其进行空间解析,因此无法识别3d体积中潜在的基本联合统计数据和组织原则。在此类信息可以发挥的实验杠杆作用的许多示例中,联合3d细胞类型图谱用于帮助将神经活动触发的基因表达的时空逻辑解码为细胞类型和空间位置的函数。
[0185]
沿冠状面切开初级视皮层(v1),并在冠状小鼠脑切片的六轮原位sedal测序中使用5碱基条形码编码的snail探针(图1a,图5a-5b),以研究一个由160个基因(包括112个推定细胞类型标记,依据小鼠皮质单细胞rna测序情况整理得出)和48个活性调节基因(arg)组成的大型精选基因集。在小鼠队列的一个测试组中,在将小鼠置于黑暗环境中饲养四天后,通过光暴露1小时引起视觉诱发的神经活动;在处死前,将其他小鼠连续置于黑暗环境中饲养。对涉及所有皮质层的含有600-800个细胞的8μm厚的物质进行成像。图5b描述了过程中starmap的原始荧光图像,包括第1个循环的全视图(图5b,上图)和全部六个循环的放大视图(图5b,下图)。全视图表示1.4mm
×
0.3mm的视图,比例尺为100μm;放大区域表示11.78μm
×
11.78μm的区域,比例尺为2μm;通道表示适用于四个荧光通道的颜色代码;l1-6表示六个新皮质层;cc表示胼胝体;hpc表示海马体。
[0186]
经过六轮测序后,通过荧光nissl染色分割细胞体,从而使扩增子归属于个体细胞(图6a-6b)。图6a描述了列明从原始成像数据中提取解码读段的处理流水线的简图(有关各步骤的详细信息,另请参见“方法”部分):(1)对样品进行多轮成像;(2)样品在各轮中进行配准,其中有两轮(绿色和紫色)出现未对准的情况,必须通过配准进行校正;(3)在每个颜色通道中将斑点自动识别(在第一轮中独立地进行)为推定扩增子,这些扩增子将基于每轮中该点的颜色值进行解码;(4)通过将各通道内每轮中每个斑点的最大强度与各条形码dna序列(颜色空间编码的条形码)的预测颜色序列进行比较来识别读段;(5)采用基于机器学习的分割法来检测细胞,该分割法考虑了各种强度和纹理特征,以便从背景中分割出含有nissl的细胞(详见(图6b));以及(6)通过计算各有效读段的位置与各细胞分割区域的凸包之间的重叠值,将读段分配给细胞。
[0187]
将由与细胞的凸包重叠的读段编码的基因分配给该细胞。图6b描述了一种用于确
定细胞相关情况的方法:(1)基于nissl染色数据的一个下采样集训练随机森林分类器(一种用于标记预测的非参数机器学习算法),以区分含有细胞的区域与背景;(2)通过dapi(细胞核)通道手动选择细胞位置;(3)将分类器应用于整个图像以预测细胞位置;(4)采用基于标记的分水岭,根据该预测对细胞进行分割,该分水岭根据已知的细胞核位置将图像的细胞标记区域分割为离散的细胞体。
[0188]
图5c中的直方图给出了每个细胞的读段(dna扩增子)(图5c,左图)和每个细胞的基因(图5c,右图)。对应于每个细胞的扩增子和每个细胞的基因的值基本上都发生了变化(图5c),而生物学平行测定之间的160-基因表达模式是一致的(r=0.94-0.95,图5d),这表明能在单细胞水平上可靠地检测转录物多样性。有关生物学平行测定的定量再现性,请见图5d,无论是在光照条件下还是黑暗条件下:绘制了整个成像区域160个基因的log
2
(扩增子数量)相关图像。rep1表示第一次平行测定中的表达值,rep2表示第二次平行测定中的表达值。
[0189]
此160-基因试验忠实地复制了已知皮质层标记和中间神经元的空间分布,此处通过比较源自成对公共图谱的原位图像与starmap结果加以阐释(图5e)。图5e中所示的starmap验证描述了allen institute of brain science(aibs)提供的原位图像(图5e,左栏)以及提取自160-基因starmap的个体基因的rna模式,该模式可靠地再现了aibs的空间基因表达模式(图5e,右栏)。
[0190]
利用112个细胞类型标记的表达数据进行细胞分类。首先,在主成分分解后,利用基于图表的聚类,将汇集自四次生物学平行测定的3,000多个细胞聚类为三种主要细胞类型(兴奋性神经元、抑制性神经元和非神经元细胞),然后在各类别下进一步进行亚聚类(图5f-5h和图6c)。统一流形逼近(umap)图是一种用于使两个维度上细胞转录组的相似性可视化的非线性降维技术,其显示了汇集自四次生物学平行测定的3,142个细胞中主要细胞类型的一致聚类:2,199个兴奋性神经元、324个抑制性神经元和619个非神经元细胞(图5f)。图5g中所示的112个细胞类型标记的基因表达热图与每个细胞聚类对齐,并按抑制性、兴奋性或非神经元细胞类型显示聚类。对于每个细胞中的所有基因,对每个基因的表达进行z评分。有关新皮层内外的代表性细胞分辨的空间图,请见图5h;有关细胞类型编码,请见图5f。兴奋性和抑制性亚型的聚类(图5i-5n)描述了代表性基因的umap图(图5i和5l)、条形图(图5j和5m)(该聚类中所有细胞基因表达的平均值
±
s.e.m.,各条均可放大至所有聚类的平均表达最大值),也描述了兴奋性(图5i-5k)和抑制性(图5l-5n)神经元的原位空间分布(图5k和5n)。每个聚类中的细胞数如下:l2/3:589;l4:649;l5:393;l6:368;pv神经元:111;vip神经元:46;sst神经元:46;npy神经元:56。聚类中细胞的纳入完全依据每个细胞中的扩增子表示进行,而无需使用空间信息;兴奋性细胞聚类根据观察到的该聚类的空间分层来命名,而抑制性细胞聚类则基于扩增子标记的高度隔离,根据优势细胞类型扩增子命名。
[0191]
图6c描述了一种用于对每个细胞的表达数据进行聚类和亚聚类的方法:(1)数据以按基因排列的细胞矩阵表示,可表示为经z评分的对数变换计数;(2)将主成分分析(pca)应用于矩阵,以缩小按因素排列的细胞矩阵;(3)采用可视化用统一流形逼近(umap)(用于高维数据2d可视化的非线性降维技术)标明细胞位置;(4)使用基于共享最近邻的图表聚类,依据pca值对细胞进行聚类;以及(5)取对应于各个聚类的细胞的表达值,并再次用于亚聚类。
[0192]
依据与解剖学皮质层的空间对应和已知层特异性基因标记的表达谱,将定义明确的兴奋性神经元分为四个主要类型,分别表示为(el2/3、el4、el5和el6;图5i-5k和图7a-7b)。图7a中所示的兴奋性细胞类型的z评分表达矩阵列明了按细胞类型分列的多个差异表达基因的聚类。对于各聚类中的细胞与任何其他聚类中的细胞中表达的基因,采用似然比检验,根据错误发现率(fdr)调整后的p值阈值10-10
和log10最小倍数变化0.1来选择所显示的基因。图7b描述了细胞各聚类中富集的多个已知层特异性基因相对表达(归一化为所有兴奋性细胞的最小值和最大值)的umap可视化,表明大多数都富集于特定兴奋性亚型中。图7c描述了图7a中所选择的抑制性细胞类型的表达矩阵。图7d描述了umap可视化,其列明了已知中间神经元标记基因的相对表达,表明每种都在抑制性神经元亚型中特异性富集。
[0193]
虽然四种兴奋性细胞类型的空间组织呈分层模式,但每一层中不同细胞类型之间高度混合。抑制性神经元也聚类为四种主要类型,其用每种亚型的优势中间神经元标记表示(vip、sst、npy和pvalb,图5l-5n和图7c-7d);观察到vip和npy类型主要分布在上层(l1-3),而sst和pvalb类型则通常分布于下层(l4-6)。
[0194]
还检测了非神经元细胞类型,包括星形胶质细胞、少突胶质细胞、内皮细胞和平滑肌细胞(图8a-8c)。此处所示的主要细胞类型数量(总计12种)可以进一步细分(单细胞rna测序可以使其细化为40种或更多种亚型,这与每种类型中基因表达的明显异质性相一致;图7a-7d;图8a-8c)。有关4种非神经细胞类型的umap可视化,请见图8a。有关非神经细胞类型的z评分表达矩阵,请见图8b。对于各聚类中的细胞与任何其他聚类中的细胞中表达的基因,采用似然比检验,根据错误发现率(fdr)调整后的p值阈值10-10
和log10最小倍数变化0.1来选择所显示的基因。图8c描述了非神经元细胞类型的标记基因(各聚类的顶级差异表达基因)每个细胞的表达的umap可视化,表明了对该聚类的特异性。颜色表示所有非神经元细胞中每个基因的相对表达(归一化为最小值和最大值)。
[0195]
利用靶向的含112个基因的集合,在每个样品含600-800个细胞的规格下,可以可靠地检测全部12种主要细胞类型,无批处理效应,且在四次生物学平行测定中表现出高度相似的空间模式(图9a-9g)。图9a-9c描述了由样品平行测定编码,然后按主要聚类(图9a)、兴奋性亚聚类(图9b)和抑制性亚聚类(图9c)进行分组的细胞的umap可视化。所有细胞类型(图9d)、兴奋性细胞类型(图9e)、抑制性细胞类型(图9f)和非神经元细胞类型(图9g)的光照和黑暗环境平行测定对的空间图(图9d-9g,上图和下图)。示例6:单细胞rna测序
[0196]
对starmap在单细胞水平下的定量能力进行了评估,以测试在整个实验条件下,在分子定义的细胞类型中的差异基因表达分析。评估视觉刺激依赖性基因表达模式(通过48种定义的arg和单细胞原位分辨率实现)。为了进一步开发单细胞rna测序程序,对小鼠大脑作速冻处理,以最大限度地缩短处死后的处理时间(不到5分钟),且无需药物处理,以便最大限度地保留天然转录标签。光暴露1小时后,在初级视皮层中观察到已知立即早期基因的全局性诱导(fos、egr1和egr2,图10a-10d)。在单细胞分辨率下,arg变化的定量程度(表达倍数变化)在各神经元细胞类型中表现出极大的多样性(图10b-10c和图11a-11c)。图10a验证了被称为立即早期基因(ieg)的原型arg在视皮层中的空间表达模式。在黑暗处理中或在光暴露1小时后处死。图10b和10c描述了抑制性和兴奋性细胞类型在光照和黑暗条件下基因表达的对数倍数变化的火山图。表达显著增加或减少的基因(错误发现率调整后的p值<
0.05,wilcoxon秩和检验)标记为绿色,变化最显著的基因(p值<0.05,倍数变化>2)标记为红色。许多arg表现出细胞类型特异性,这表明激发-转录偶联存在意外细胞类型特异性逻辑。图10d描述了按细胞类型显示的egr2表达的小提琴图。****p<0.0001,n.s.表示不显著,wilcoxon秩和检验;红色标记的细胞类型,倍数变化大于2。一般而言,不同层的兴奋性神经元中的arg表达程序高度相似,而抑制性细胞中的arg表达程序则表现出明显不同的细胞类型特异性特征(图11b);例如,egr2在兴奋性神经元中表现出光诱导性(图10d),但在抑制性神经元中无此特性,而相比之下,prok2在vip抑制性神经元中上调(图10c)。
[0197]
最后,由于神经活动可以触发arg增强子内部非编码rna的共转录,因此对这些增强子rna的示例进行了研究(fos基因的erna 1-5);这些未聚腺苷酸化的转录物用当前的单细胞rna测序很难测定。但是,已将erna3确定为最重要、最一致的arg标记(图11b)。图11a描述了黑暗/光照条件下生物学平行测定中160个基因的相关性,这表明相同条件下的样品相较于不同条件下的样品相关性更高;比例尺,spearman r值。图11b描述了抑制性和兴奋性神经元亚型中arg的对数比例表达数据(每个细胞的计数)。任何细胞类型中表达显著增加的基因以红色突出显示。图11c描述了基于聚类中对光做出反应的所有arg的平均表达相关性的神经元亚型相关性热图,这表明相较于兴奋性细胞类型,源自抑制性细胞类型的细胞与其他抑制性细胞类型的相关性更高,反之亦然。请注意,比例尺范围为r=0.8至r=1。示例7:适用于大组织体积的starmap方法
[0198]
对不超过1个细胞体厚度的脑切片进行了160-基因实验,因此尚未测试starmap方法捕获组织体积中细胞的3d结构的能力。进一步开发了starmap,以克服完整组织体积在扩散通道和成像通量方面的局限性,并提出在细胞分辨率下线性读出基因表达的策略,以实现组织体积中的高通量分子分析(图12和图13)。图12描述了本文所揭示的方法,包括样品尺寸标定、文库制备、成像和测序以及数据输出的步骤。对于薄组织(z<16μm,单层细胞),使用新鲜冷冻的小鼠大脑制备文库,然后用低温恒温器切片,进行pfa固定、透化、杂交、连接和扩增以及水凝胶包埋和组织透明化。成像和测序包括单扩增子分辨率;高na油浸物镜;每小时对200个细胞进行成像;sedal与简并探针反应;以及在循环中获取基因的指数读数。数据输出包括3d扩增子和2d细胞分型(图1a-1e、图5a-5n和图10a-10d)。对于较厚组织(z>100μm,具有多个细胞层),使用经pfa固定的小鼠大脑制备文库,然后用振动切片机切片,进行透化和杂交、水凝胶包埋和组织透明化以及连接和扩增。成像和测序包括单细胞分辨率;低na水浸物镜;每小时对10,000个细胞进行成像;sedal与正交探针反应;以及在循环中获取基因的线性读数。数据输出包括3d细胞分型(图13a-13i)。
[0199]
图13a描述了通过连续sedal基因读出实现的体积star测绘。使用修改后的starmap程序(图12,右图)和循环基因读数(每个循环中的4个基因),在单细胞分辨率下对大体积组织进行快速测绘,而每个扩增子均未过采样。最初使用thy1::yfp小鼠大脑测试大容量starmap的特异性和穿透深度,其中starmap成功检测到了厚度为150μm的组织的yfp mrna,且在单细胞分辨率下明确共定位了yfp蛋白和mrna(图13b),而无需标记成千上万个散布的相邻细胞。验证显示了3d皮质层中表达yfp的神经元(源自转基因thy1::yfp小鼠品系)的特异性starmap标记。比例尺为0.5mm。
[0200]
小鼠初级视皮层的空间细胞分型扩展至整个六层和胼胝体中的30,000多个细胞。使用包括23个细胞类型标记和5个arg在内的28个基因在线性sedal测序的7个循环中进行
读段(图13c-13d和图14a-14b)时,将标记基因的k-means聚类(方法)应用于每种细胞类型(回收了11个细胞类型,其对应于通过160-基因实验提取的大多数细胞类型,但此处仅涉及28个基因)。图13c描述了在视皮质starmap中经过多轮操作获取的主要细胞类型的代表性标记(图13c,左图)、层特异性标记(图13c,左中)、抑制性标记(图13c,右中)和活性调节基因(图13c,右图)。
[0201]
11个细胞类型的3d模式(图13e-13f)与160-基因薄切片组织结果一致,但提供了准确、定量的细胞空间分布分析,且细胞数要大得多。兴奋性、抑制性和非神经元细胞类型的空间直方图采用与图13d(图13e)中相同的标记。在2d最大投影中,以5μm组距对细胞进行计数,并以密度(细胞计数/μm)作为胼胝体(cc)与软脑膜之间的距离的函数,绘制相应图表,同时针对垂直于皮质层的直条取平均值。最大投影细胞位置的图表按照图13d(图13e,下图)中的聚类进行编码。正如空间直方图(图13e)和相关分析图(图14b)所示,兴奋性亚型分层分布,每个亚型的空间密度在整个空间内逐渐降低,直至与相邻层齐平。尽管vip亚型(主要位于第2/3层)以及sst和pvalb亚型(在第4和5层)表现出分层偏好,但相比之下,抑制性亚型更加分散。图14a描述了每个基因在xy平面上投影的3d最大投影中的表达,其显示了用于后续聚类的每个细胞的提取基因表达值的空间分布。在所有基因中,按细胞对每个基因进行z评分。图14b描述了在25μm网格上归入统计堆的每种细胞类型的分布之间的体素相关系数。
[0202]
非神经元细胞主要见于第1层和白质中。图13d描述了源自32,845个单细胞的28个基因按细胞分列的表达矩阵,所述单细胞取自被聚类为多个兴奋性、抑制性和非神经元细胞类型的物质中,并且对每个细胞的基因进行z评分,以归一化细胞之间总信号的平均差异。列按进行的测序轮次排序,以4个为一组。图13f在三个维度上描述了每种细胞类型(兴奋性、抑制性、非神经元性)和亚型的空间分布。每个点代表一个单细胞;空间尺寸以μm为单位。
[0203]
为了找到更精细的体积模式,分析了每个测序定义亚型的各细胞与其最近邻的距离分布,结果出乎意料地发现,任何抑制性神经元的最近邻倾向于是其自身的亚型,而非兴奋性神经元或其他抑制性亚型(图13g)。有关在3d中计算的所有兴奋性细胞(excite)与每个抑制性细胞类型之间的平均最近邻距离,请见图13g。为了进行自我比较,最近邻被定义为最接近的非同一细胞;持续的自相关揭示了抑制性亚型的自聚类性。如果抑制性神经元在纯椒盐分布中随机分布于丰度更高的兴奋性神经元中,则抑制性神经元之间的距离将大于抑制性神经元与兴奋性神经元之间的距离(图13h)。如图13h所示,分析了同一距离,但使用了不同(随机)的细胞类型标记。抑制性神经元的实际亚型内距离要短得多(约15μm,相当于单个神经元的大小,表明存在直接体细胞并置的情况;图13i)。图13i描述了在3d中计算的某种类型的每个抑制性细胞与同一类型的任何成员(inhib
→
inhib,eg vip
→
vip)或任何兴奋性神经元(inhib
→
excite)之间的最近邻距离;****p<0.0001,wilcoxon秩和检验。图13i揭示了物质的抑制性亚型的自聚类结构,其只能在3d中准确测量,而无法在2d中准确测量(图15a-15c)。在图13a-13i(图15a)中所示的同一3d体积内,在8μm(薄于一个细胞)切片的2d投影中计算出兴奋性和不同抑制性细胞类型之间沿z方向的最近邻距离,取其平均值。对于图13d中所示的同一细胞类型,2d最近邻距离无法准确估计(高估)相应3d距离。这种模式可能与功能相关;例如,体内成像显示,视皮层中的抑制性神经元分组可以增强视觉
反应。图15b描述了抑制性神经元的3d短程聚类的示例,其放大视图如图13c所示。图15c描述了在转基因小鼠的初级视皮层中观察到的短程抑制性神经元聚类(通过parv-ires-cre与ai14交联产生):用标记的tdtomato标记pvalb细胞,并用alexa 647共轭的抗neun对所有神经元细胞核进行免疫染色。示例8:starmap的可扩展性
[0204]
starmap适用于更长的测序长度或更多的基因数量;基因数量或rna种类无固有限制,starmap可以同时定量对其进行操作(图16a-16e)。图16a描述了在共检测更多数量的其他rna时检测actb mrna,以测试探针混合物的潜在稀释效果以及细胞对snail dna扩增子的物理能力。将actb的snail探针设计为具有正交dna序列,以便进行检测,并将其掺入混合物中,所述混合物中含有由0(图16a)、100(图16b)或1,000(图16c)个其他基因组成的探针。如果snail探针在混合环境中工作时效率不如单个探针有效,或者如果无足够的空间进行滚环扩增,则actb插入基因会导致扩增子减少,和/或各扩增子的强度减弱。在小鼠视皮层中获取荧光图像;绿色:actb扩增子的alexa 546通道;红色:所有其他基因的alexa 647通道;蓝色:对细胞核进行的dapi染色。图16a-16c的定量请见图16d。箱形图显示,稀释和细胞空间限制的任何影响至少在1,000个基因尺度范围内都是微不足道的。方框表示第一和第三四分位数;中线表示中位数;箱须表示5%和95%数据点;n表示整个228x228x2μm成像体中actb扩增子的数量;y轴:绝对荧光强度。图16e描述了starmap可扩展性的实验和理论估计。编码表明,5-nt密码可以编码1,024个基因;snail探针除rna互补序列外,还具有35-nt的编码空间。sedal需要17-nt作为测序单元(11-nt对接区用于读码探针,再加上5-nt密码和1-nt旁侧碱基),因此snail探针可容纳两个这样的单元,且允许存在4
10
(10
6
)个密码;如果针对较长读段(例如,solid,对于引物结合,为18-nt;对于编码,为17-nt)使用其他测序方法,则上限接近10
11
。在哺乳动物神经元中已验证了至多1000个基因的物理能力;由于通过afm和tem确定的dna扩增子的物理大小约为100-200nm,因此,假设细胞直径约为15μm,且使用密排模型(空间效率为74%),则估计最大容量为每个细胞10
6
个扩增子。对于小鼠海马细胞培养物,通过1,020-基因实验和视皮层实验验证了光学体积;扩增子/细胞是指已在全部6轮测序中成功配准的扩增子/细胞。采用共聚焦显微技术成像时,dna扩增子的平均直径为400-600nm;应用与物理极限实验中使用的相同模型,最大容量为每个细胞2x10
4
个扩增子。1,020个基因的实验数据也接近这一极限值。在不受任何科学理论束缚的情况下,细胞培养物与组织切片之间的数值差异可能归因于以下考虑因素:(1)全细胞在细胞培养物中成像,而细胞碎片在组织切片中成像(8μm,<1个细胞厚度);(2)与成年小鼠大脑相比,海马细胞培养物分化程度较低,因此每个细胞所含的rna(更多基因)存在较大差异;(3)与脑组织中细胞的密集3d填充相反,体外培养的细胞在xy平面中较为分散,且在z方向上逐渐变薄,而xy平面的图像显示的光学分辨率高于z方向(体素大小为78x78x250μm)。示例9:在starmap160-基因实验和已发表的单细胞rna测序结果中识别出的神经元类型的相关性
[0205]
图17描述了已识别的starmap兴奋性和抑制性聚类中所有基因的平均基因表达的皮尔逊相关性,以及通过获取自allen brain institute的单细胞rna-seq识别出的相应聚类。请参阅,例如,lein等人,(2007)。对于单细胞rna-seq数据,取主要类型(例如,l2/3)内所有亚型的表达均值,且仅使用单细胞rna-seq和160-基因v1实验之间共有的基因来计算
相关性;比例尺为0-0.6,皮尔逊相关系数。示例10:采用starmap对内侧前额叶皮层(mpfc)的细胞类型亚聚类进行基因表达分析
[0206]
图18a描述了兴奋性亚聚类的umap可视化。图18b描述了各兴奋性亚聚类的差异表达基因。图18c描述了抑制性亚聚类的umap可视化。图18d描述了各抑制性亚聚类的差异表达基因。图18e描述了非神经亚聚类的umap可视化。图18f描述了各非神经亚聚类的差异表达基因。
[0207]
图19a-19c描述了兴奋性亚聚类(图19a)、抑制性亚聚类(图19b)和非神经元亚聚类(图19c)的四次生物学平行测定的空间图。示例11:小鼠海马细胞培养物中1020个基因的细胞类型亚聚类的基因表达分析
[0208]
图20a-20c描述了采用本文所述的方法在6-轮测序中对小鼠海马细胞培养物中的1020个基因进行的分析。图20a描述了合并第一轮四个荧光通道的原始荧光图像。图20b描述了细胞类型标记的示例。神经元基因标记(scna)与非神经元基因标记(mt1)适当分离,且神经元亚型标记(reln,sst)的分布情况也非常明显。图20c描述了每个细胞的扩增子和基因的统计分析,成像面积为270x270μm。
[0209]
图21a-21c描述了采用本文所述的方法对小鼠初级视皮层中的1020个基因进行操作而获取的其他基因表达信息。图21a描述了兴奋性亚聚类的umap可视化(图21a,左图)和各兴奋性亚聚类的差异表达基因(图21a,右图)。图21b描述了抑制性亚聚类的umap可视化(图21b,左图)和各抑制性亚聚类的差异表达基因(图21b,右图)。图21c描述了非神经亚聚类的umap可视化(图21c,左图)和各非神经亚聚类的差异表达基因(图21c,右图)。
[0210]
图22a-22d描述了采用starmap对小鼠初级视觉层中1020个基因的测量值进行的再现性测定和交叉方法比较。图22a描述了视皮层中两次1,020-基因平行测定之间每个基因的读段相关性。图22b描述了每个细胞的已检测读段的直方图(图22b,左图)和每个细胞的已检测基因(图22b,右图)。图22c描述了1,020-基因视皮层实验的其他平行测定中的细胞类型的空间图。图22d描述了已识别的starmap 1,020-基因聚类中所有基因的平均基因表达的皮尔逊相关性,以及通过获取自allen brain institute的单细胞rna-seq识别出的相应聚类。示例12:适用于薄组织切片和厚组织切片的starmap
[0211]
图23a描述了适用于薄组织和厚组织的starmap的实验流程图。图23b显示了用于大体积实验的经修饰引物探针的制备:订购带有5'胺修饰的dna探针,将其混合,并通过aa-nhs转化为可聚合部分。图23c显示了具有各种基因数的不同实验设计的实验持续时间。图23d显示了starmap与其他单细胞方法在rna物种、空间分辨率和通量方面的比较。单细胞rna测序可以与最近开发的空间转录组方法结合使用,以获得区域空间分辨率(100μm)。
[0212]
尽管已经参照本发明的特定实施例进行了阐述,但本领域技术人员应当理解,在不脱离本发明的真实精神和范围的情况下,可以作出各种变更并且可以用等效物替换。此外,为了使特定情况、材料、物质组成、过程、一个或多个操作步骤能够适应本发明的目的、精神和范围,可进行多种修改。所有这类修改内容旨在被所附权利要求的范围覆盖。参考文献1.n.crosetto,m.bienko,a.van oudenaarden,空间分辨转录组学及其他,遗传学自然综述,16,57-66。
2.e.lein,l.e.borm,s.linnarsson,在分子细胞分型时代将空间转录组学应用于神经科学领域的前景,科学,358,64-69(2017)。3.e.lubeck,l.cai,通过连续杂交进行单细胞原位rna表达谱分析,自然方法,9,743-748(2012)。4.k.h.chen,a.n.boettiger,j.r.moffitt,s.wang,x.zhuang,空间分辨的高度多重单细胞rna表达谱分析,科学,348,aaa6090(2015)。5.r.ke等人,适用于保存组织和细胞中的rna分析的原位测序,自然方法,10,857-860(2013)。6.j.h.lee等人,高度多重亚细胞rna原位测序,科学,343,1360-1363(2014)。7.n.a.peppas,j.z.hilt,a.khademhosseini,r.langer,,生物学和医学领域的水凝胶:从分子原理到生物纳米技术,先进材料18,1345-1360(2006)。8.a.m.rosales和k.s.anseth,可逆水凝胶设计以捕获细胞外基质动力学特征,天然材料综述,1,1-15(2016)。9.r.y.tam,l.j.smith,m.s.shoichet,用光和酶促反应水凝胶改造细胞微环境:趋向于仿生3d细胞培养模型,化学研究评述,50,703-713(2017)。10.k.chung等人,完整生物系统的结构和分子询问,自然,497,332-337(2013)。11.e.l.sylwestrak,p.rajasethupathy,m.a.wright,a.jaffe,k.deisseroth,在细胞分辨率下进行完整组织多重转录分析,细胞,164,792-804(2016)。12.s.shal等人,通过杂交链反应以及组织水凝胶包埋和去除在深度上进行单分子rna检测,开发,143,2862-2867(2016)。13.j.r.moffitt等人,在基质印迹和清除下于培养物和组织中进行高性能多重荧光原位杂交,美国科学院院报,113,14456-14461(2016)。14.f.chen等人,采用膨胀显微技术对rna进行纳米成像,自然方法,13,679-684(2016)。15.j.shendure等人,已进化的细菌基因组的精确多重聚合酶克隆测序,科学,309,1728-1732(2005)。16.j.h.lee等人,对rna进行荧光原位测序(fisseq)以在完整细胞和组织中进行基因表达谱分析,自然实验手册,10,442-458(2015)。17.r.drmanac等人,在自组装dna纳米阵列上使用解链碱基读段的人类基因组测序,科学,327,78-81(2010)。18.l.l.glickfeld,r.c.reid,m.l.andermann,具有高级视皮层功能的小鼠模型,神经生物学最新观点24,28-33(2014)。19.b.tasic等人,通过单细胞转录组学揭示成年小鼠皮质细胞分类,自然神经科学,19,335-346(2016)。20.a.zeisel等人,通过单细胞rna序列揭示小鼠皮质和海马中的细胞类型,科学,347,1138-1142(2015)。21.t.k.kim等人,神经元活性调节增强子的广泛转录,自然,465,182-187(2010)。22.a.r.mardinly等人,感官体验通过在vip神经元中诱导igf-1来调节皮质性抑制,自然,531,371-375(2016)。
23.s.hrvatin等人,小鼠视皮层中经验依赖性转录组状态的单细胞分析,自然神经科学,21,120-129(2018)。24.e.s.lein等人,成年小鼠大脑中基因表达的全基因组图谱,自然,445,168-176(2007)。25.k.shekhar等人,通过单细胞转录组学对视网膜双极神经元进行全面分类,细胞,166,1308-1323(2016)。26.j.y.joo等人,神经元c-fos增强子的刺激特异性组合功能,自然神经科学,19,75-83(2016)。27.t.ebina等人,gaba能神经元的3d聚类增强了对小鼠视皮层中兴奋性神经元的抑制作用,细胞报告,9,1896-1907(2014)。28.a.paul等人,突触沟通的转录结构阐明了gaba能神经元身份,细胞,171,522-539(2017)。29.t.n.lerner,l.ye,k.deisseroth,神经回路中的沟通:工具、机遇和挑战,细胞,164,1136-1150(2016)。30.a.mcdavid等人,基于单细胞qpcr的基因表达实验中的数据探索、质量控制和测试,生物信息学,15,461-467(2013)。31.j.l.bentley,用于关联搜索的多维二进制搜索树,通信,acm 18,509-517(1975)。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1