对称bola型槐糖苷的改良生产
发明的技术领域
本发明涉及微生物生产新型生物表面活性剂的领域。更特别地,本发明公开了具有功能失调的cyp52m1细胞色素p450单加氧酶和功能失调的fao1脂肪醇氧化酶的真菌菌株诸如酵母球拟假丝酵母(starmerellabombicola)用于生产大量所谓的“对称(乙酰化)bola型槐糖苷”的用途,其中两个槐糖部分通过糖苷键连接至疏水接头。此外,本发明进一步公开了后者酵母还可以用于生产(乙酰化)烷基槐糖苷。
背景技术:
已经证明,可以利用生产工业槐糖脂的酵母球拟假丝酵母作为用于生产糖脂和其他生化产品的平台生物(roelantsetal.,2013;roelantsetal.,2016)。
此方面中的最新成就之一,描述了该酵母的重新设计以生产所谓的bola槐糖苷(ss)(vanrenterghemetal.,2018)(图1)。这些bolass是新型的糖脂,其提供了更早描述的bola槐糖脂(sl)的化学上更稳定的替代物(soetaertetal.,2013;vanbogaertetal.,2016)。实际上,vanrenterghemetal.(2018)公开了缺乏其乙酰转移酶(at)、内酯酶酯酶(sble)和醇氧化酶1(fao1)的球拟假丝酵母菌株当供给脂肪醇时会产生bola-槐糖苷。然而,后者的bola-槐糖苷包括–除了bola-槐糖苷之外–仍然大量的bola型槐糖脂。因此,仍然需要进一步的菌株改良,以将bola型槐糖脂生产更多地转向槐糖苷化合物。此外,vanrenterghem生产的bola槐糖苷是非对称(即一个槐糖部分是近末端(subterminally)连接的,同时另一个则是末端连接的)和对称bola槐糖苷(两个槐糖都是末端连接的)的混合物。vanrenterghem所描述的分子由于缺失at基因(乙酰转移酶)而是非乙酰化的。
takahashietal.(2016)描述了与供给脂肪醇的野生型相比,具有缺失fao1基因的球拟假丝酵母菌株增加了烷基槐糖苷的产量。然而,这种产量增加仍然伴随有酸性和内酯槐糖脂的产生,这是不期望的。
附图的简要说明
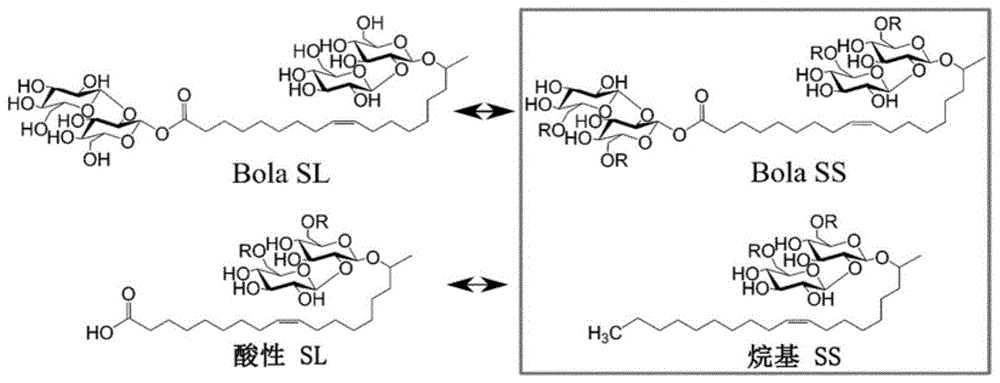
图1:槐糖脂(sl)(左)和槐糖苷(ss)(右,灰色圈)的化学结构。bolasl和酸性sl作为比较示出。指出糖苷键和酯键以突出bola槐糖脂和槐糖苷之间的差异,而指出烷基ss的甲基基团以突出具有羧基基团的酸性sl之间的差异。r基团代表h或乙酰基(coch3)基团。
图2:脂肪醇氧化酶(fao1)敲除盒及其在ura3营养缺陷型δcyp52m1菌株的fao1基因座处的整合的示意图。将ura3基因用作标记基因。用于检查fao1敲除盒的正确整合的菌落pcr的各自引物对以橙色描绘。
图3:与摇瓶中的亲代δcyp52m1菌株(○)相比,用于表征δcyp52m1δfao1菌株(●)的重要参数。表示了a)log(cfu/ml)、b)ph和c)葡萄糖浓度(g/l)的平均值和各自的标准偏差。在培养48h后,添加1.8(w/v)%的油醇作为疏水底物。
图4:两者均供给1.8(w/v)%油醇(两者均稀释3x),a)δcyp52m1δfao1菌株相比于b)δcyp52m1菌株的摇瓶实验的最终样品的uplc-elsd色谱图。在各自的峰上方描绘了用uplc-ms测定的各自的质量。对应于烷基ss的质量以粗体描绘。表2给出了可能的糖脂质量的概述。
图5:当供给油醇时,所提出的δcyp52m1δfao1菌株中烷基槐糖苷(ss)的生产途径。(1)脂肪醇氧化酶fao1、(2)脂肪醛脱氢酶fad、(3)细胞色素p450单加氧酶cyp52m1、(4)葡糖基转移酶ugta1、(5)葡糖基转移酶ugtb1、(6)乙酰转移酶at和(7)sl转运体mdr。通过敲除fao1和cyp52m1基因(由叉号指示),脂肪醇不会向相应的脂肪醛转化,也不会向相应的二醇(在这种情况下为1,18-十八烯二醇)转化,也不会从头脂肪酸羟基化(由叉号指示)然后进入sl生物合成。以这种方式,通过葡糖基转移酶ugta1和ugtb1将积累的醇直接糖基化,其分别在脂肪醇和烷基葡糖苷主链上依次添加葡萄糖分子。获得非乙酰化烷基ss,其应通过乙酰转移酶at乙酰化,产生非乙酰化、单乙酰化和二乙酰化烷基ss的混合物。最后,大概通过负责野生型sl分泌的mdr转运体,这些糖脂可能被转运出细胞(vanbogaertetal.,2013)。
图6:使用δcyp52m1δfao1菌株并向后者供给油醇的生产途径概述。通过敲除cyp52m1基因,预期只能按照途径a的建议进行糖基化,产生烷基ss的乙酰化混合物(最多两个乙酰化),用r基团代表乙酰化。然而,由于球拟假丝酵母中大概cyp52酶的另一未知和未预期的活性,观察到羟基化,其在糖基化后会产生乙酰化bolass(最多四个乙酰化)。最后,发现主要bolass和少量烷基ss的混合物。与vanrenterghemetal.(2018)中报道的δatδsbleδfao1菌株形成对比,羟基化仅在末端发生。
图7:通过δcyp52m1δfao1菌株产生的基于纯化的油醇(c18:1)的bolass的结构确定的组成。仅发现100%末端(ω)羟基化化合物。
图8:当供给不同的伯醇(月桂醇、肉豆蔻醇、棕榈醇、硬脂醇或油醇)时,δcyp52m1δfao1菌株的a)log(cfu/ml)和b)葡萄糖浓度与培养时间的函数。示出了平均值和各自的标准偏差。在培养48h后,添加各自的1.8(w/v)%的醇。
图9:培养48h后供给1.8(w/v)%的(a)月桂醇、(b)肉豆蔻醇、(c)棕榈醇、(d)硬脂醇或(e)油醇,δcyp52m1δfao1菌株的最终uplc-elsd色谱图。所有最终液(broth)稀释3x。指示出了烷基(最多两个可能的乙酰化)和bolass(最多四个可能的乙酰化)的保留时间。以粗体描绘了当将各自供给的醇掺入bolass(深灰色)和烷基ss(黑色)、醇和烷基gs(浅灰色)中时的糖脂化合物。具有保留时间<1min的峰对应于以糖、蛋白质和盐存在于样品中的强亲水性化合物的混合物。
图10:培养48h后,当供给1.8(w/v)%的各自的伯醇时,δcyp52m1δfao1菌株的bolass(a)和烷基ss产量(b)与培养时间的函数。产量表示为通过uplc-elsd测定的峰面积总和(v.sec)。(c)培养48h后,供给1.8(w/v)%的月桂醇(黑色)、肉豆蔻醇(深灰色)、棕榈醇(中灰色)、硬脂醇(浅灰色)或油醇(白色),用不同糖脂类型的uplc-elsd测定的球拟假丝酵母δcyp52m1δfao1菌株的最终液的相对峰面积(%)。
图11:三重敲除菌株(δcyp52m1δfao1δugtb1)产生(乙酰化)对称bola葡糖苷(gs)。图示出了合成(乙酰化)对称bola葡糖苷的途径。底部图示出了实际的(乙酰化)对称bola葡糖苷c18:1。r=coch3或h。
发明的说明
本发明涉及生产完全对称bola槐糖苷的方法,所述bola槐糖苷没有受到槐糖脂(酸性、内酯或bola)的污染,包括向突变真菌菌株诸如球拟假丝酵母菌株供给具有至少6个碳的脂肪族尾链长的脂肪醇,其中,所述真菌菌株具有功能失调的cyp52m1细胞色素p450单加氧酶和功能失调的fao1脂肪醇氧化酶。
术语‘完全对称bola槐糖苷’是指bola槐糖苷(即如vanrenterghemetal.(2018)描述的由位于脂肪疏水接头或脂肪族尾的每一侧的两个槐糖单元组成的槐糖苷),其中两个槐糖实体或单元都附接在脂肪疏水接头的专用末端位置(ω位置)上。
脂肪(疏水)接头或脂肪族链可以包含至少6个(即6、7、8、9、10、11、12、13、14、15、16、17、18、19、20或更多个)碳原子,可以是支链的和/或可以包含不饱和。
术语‘没有受到槐糖脂的污染’是指在完全对称bola槐糖苷的生产中,没有可测量的量的酸性、bola和/或内酯槐糖脂作为污染的副产物产生。
术语‘真菌菌株’是指能够产生槐糖脂的特定真菌诸如酵母菌株的任何遗传变体或亚型。换句话说,本发明涉及如上文所描述的用途,其中,所述真菌菌株是内源性地或在基因修饰后能够产生槐糖脂的真菌菌株。更特别地,这种真菌菌株是包括但不限于以下的真菌物种:蜜生假丝酵母(candidaapicola)(gorinetal.,1961)其最初被确定为木兰假丝酵母(c.magnolia)、水解假丝酵母(c.bombicola)(spenceretal.,1970)、拟威克酵母(wickerhamielladomericqiae)(chenetal.,2006)、博戈里亚红酵母(rhodotorulabogoriensis)(tullochetal.,1968)、巴蒂斯塔假丝酵母(candidabatistae)(konishietal.,2008)、居花假丝酵母(candidafloricola)(imuraetal.,2010)、里约克假丝酵母(candidariodocensis)、星状假丝酵母(candidastellate)和假丝酵母属nrrly-27208(kurzmanetal.,2010)、郭氏假丝酵母(candidakuoi)(kurtzman,2012)以及starmerella分支的任何其他菌株。本发明更特别地涉及如上文所描述的用途,其中,所述球拟假丝酵母(水解假丝酵母)(starmerella(candida)bombicola)是菌株球拟假丝酵母(水解假丝酵母)atcc22214(cbs6009)或其衍生的菌株。
术语“突变真菌菌株”涉及如上文所定义的真菌菌株,其中所述菌株是突变的,使得酶cyp52m1和fao1是无功能的或功能失调的。对于cyp52m1,这意指可以不再发生脂肪醇底物的羟基化,并且对于fao1,这意指可以不再发生存在于脂肪醇上的oh基团向相应的醛的氧化。
术语‘功能失调的’意指通常基因或蛋白,其‘不正常地’发挥功能,和/或,具有缺失或受损的功能。因此,该术语是指以下基因或蛋白:a)由于不存在而无功能的,b)仍然存在但呈现无功能的,或c)存在但具有减弱或减少的功能。术语“功能失调的”特别涉及完全或部分地失去其编码全功能酶cyp52m1和fao1的能力的基因,或者完全或部分地失去其cyp52m1和fao1活性的多肽/蛋白。‘部分地’意指通过本领域已知的任何方法测量的后者的酶的活性当与所述酶的野生型对应物的活性比较时显著较低(p<0.05)。
如上文所定义的,‘功能失调的’核酸分子可以通过突变或通过任何已知的方式使所述核酸的转录或翻译沉默来获得。后者的方式包括在靶基因的功能编码或非编码部分中插入核酸片段、标记基因或任何其他分子,靶基因的功能编码或非编码部分的突变或去除,特定sirna、mirna或其组合的使用,或技术人员已知的任何其他方式。
术语‘突变’是指所述真菌菌株的基因组中的自发突变和/或诱导的突变。所述突变可以是点突变、缺失、插入或任何其他类型的突变。
类似地,可以通过任何(小)化合物或其他方式以减弱或破坏本发明的靶基因的功能来获得如上文定义的‘功能失调的’的多肽。使转录或翻译沉默的方式,或破坏本发明的靶基因的功能的方式,或破坏靶基因的必需调控/激活蛋白的功能的方式,包括使用任何分子诸如-但不限于-抗体、氨基酸、肽、小分子、适配体、核酶、寡核糖核苷酸序列诸如用于引发rna干扰(rnai)的dsrna或反义核酸。此类分子因此能够结合至靶蛋白或其激活/调控蛋白上,或者能够通过-例如-结合并使mrna编码靶蛋白或其激活因子/调控因子退化而干扰靶酶或其激活因子/调控因子的细胞合成。
“功能失调的”cyp52m1和fao1是指通过本领域技术人员已知的任何方法获得的活性降低的酶。所述方法的非限制性实例是点突变的引入、截短的或突变的酶的使用、抑制剂或抗体的使用以及上文描述的任何方法。
术语“功能失调的”因此还指在应用的真菌菌株的基因组中缺失上文提及的特定基因(cyp52m1和fao1)。
基因和它们编码的酶cyp52m1和fao1在本领域中是众所周知的,并且–例如-在wo2011154523(cyp52m1)和takahashietal.(2016)(fao1)中描述。
因此,本发明更特别地涉及如上文所描述的方法,其中,编码cyp52m1细胞色素p450单加氧酶的基因和编码fao1脂肪醇氧化酶的基因被敲除。
本发明进一步涉及如上文所描述的方法,其中,具有至少6个碳的脂肪族尾链长的所述醇是己醇、辛醇、癸醇、十一烷醇、月桂醇、十三烷醇、肉豆蔻醇、十五烷醇、鲸蜡醇、棕榈油醇、十七烷醇、硬脂醇、异硬脂醇、油醇、十九烷醇、花生醇或其混合物。
本发明还涉及如上文所描述的方法,其中,所述完全对称bola槐糖苷是(四、三、二或单)乙酰化的。
术语‘乙酰化’特别意指bola或烷基槐糖苷,其在所述bola或烷基槐糖苷中存在的两个槐糖部分中的一个或两个的6’或6”位上包含‘乙酰’官能。术语‘乙酰化’(或乙酰基化)更一般地描述将乙酰官能团引入化学化合物产生乙酰氧基基团的反应,即乙酰基基团取代活性氢原子。涉及用乙酰基基团(ch3co)取代羟基基团的氢原子的反应产生特定的酯,乙酸酯。
本发明还涉及具有功能失调的cyp52m1细胞色素p450单加氧酶和功能失调的fao1脂肪醇氧化酶的突变真菌菌株,诸如球拟假丝酵母菌株。
该后者菌株可以通过本领域已知的和如上文所描述的任何方法制备。在“实施例”部分的“材料和方法”部分中进一步描述了创建cyp52m1细胞色素p450单加氧酶和fao1敲除菌株的特定但非限制性方法。
因此,并且更特别地,本发明涉及如上文所描述的突变真菌菌株诸如球拟假丝酵母菌株,其中,所述编码cyp52m1细胞色素p450单加氧酶的基因和所述编码fao1脂肪醇氧化酶的基因被敲除。
本发明进一步涉及如上文所描述的突变真菌菌株诸如球拟假丝酵母菌株用于生产如上文所描述的没有受到包含槐糖脂的脂肪酸污染的完全对称bola槐糖苷的用途。
本发明还涉及如上文所描述的突变真菌菌株诸如球拟假丝酵母菌株用于生产完全对称二醇的用途。后者的二醇是对称bola槐糖苷的前体,如图6所示出。
本发明进一步涉及如上文所描述的突变真菌菌株诸如球拟假丝酵母菌株的用途,其中,所述对称bola槐糖苷是进一步包括烷基槐糖苷的混合物的一部分。
后者混合物的形成是因为一些脂肪醇分子通过酶ugta1和ugtb1的随后作用而被糖基化(还参见进一步),并然后在供给的脂肪醇可被羟基化之前就被分泌了出来。这导致了作为‘未完成的’bola槐糖苷的烷基槐糖苷生产或其他bola槐糖苷中间体连同bola槐糖苷的生产。
因此,本发明还涉及如上文所描述的突变真菌菌株诸如球拟假丝酵母菌株用于生产烷基槐糖苷的用途。
实际上,当供给的脂肪醇在脂肪族链的另一侧没有被羟基化,并且被糖基化并作为烷基槐糖苷分泌时,产生了后者的烷基槐糖苷。
本发明进一步涉及如上文所描述的突变真菌菌株,其中,所述真菌菌株进一步包括负责槐糖脂/槐糖苷生物合成途径中的第二糖基化步骤的功能失调的葡糖基转移酶(ugtb1)。
wo2011154523中详细描述了负责槐糖脂生物合成途径中的第二糖基化步骤的术语‘葡糖基转移酶’。实际上,wo2011154523公开了在槐糖脂途经中存在第一糖基化(参见wo2011154523的实施例2)和第二糖基化步骤(参见wo2011154523的实施例3),其中涉及‘第一’(即ugta1)和‘第二’葡糖基转移酶(即ugtb1,具有genbank登录号hm440974,并且也在saerensetal.2011(yeast:279-292)中详细描述)。
术语‘功能失调的’在上文已描述。
本发明还涉及如上文所描述的突变真菌菌株用于产生对称bola葡糖苷的用途。
术语‘对称bola葡糖苷’涉及通过如上文所描述的两个末端(ω)糖苷键在脂肪疏水接头或脂肪族尾(或链)的每一侧具有一个葡萄糖分子的葡糖苷。
本发明涉及‘乙酰化’和‘非乙酰化’对称bola葡糖苷两者,但特别涉及如上文所描述的突变真菌菌株的用途,其中,所述对称bola葡糖苷被乙酰化。
术语‘乙酰化’在上文已描述。
实施例
材料和方法
菌株、培养基和培养条件
使用sl缺陷型δcyp52m1菌株球拟假丝酵母作为亲代菌株(vanbogaertetal.,2013a)。与vanrenterghem(2018)所描述的类似,通过在其自身的启动子和酪氨酸激酶(tk)终止子的调节控制下,将ura3基因整合到δcyp52m1菌株中的各自的fao1基因座上,从而获得球拟假丝酵母脂肪醇氧化酶fao1敲除。与δcyp52m1亲代菌株平行,在生长和糖脂生产方面评估了新菌株的三个转化体菌落。如lodensetal.(2018)所述进行培养、选择和转化。
使用langetal.(2000)描述的生产培养基进行使用球拟假丝酵母的生产实验。对于摇瓶实验,在转移至摇瓶(4%接种)之前,将5ml试管培养物放置24h(30℃)。在培养48h后添加的脂肪醇:油醇、硬脂醇、月桂醇、肉豆蔻醇或鲸蜡醇的供给下进行生产实验。还评估了不添加疏水醇的δcyp52m1δfao1菌株。对于每个生产实验,当培养基中的葡萄糖耗尽时,停止培养。一式两份地进行实验,并表示出具有标准偏差的平均值。
分子技术
通用技术
如green和sambrook(2012)所述,采用了通用的分子技术。基于pgem-t(promega)和pjet(thermofisher)载体和如下描述的克隆步骤,从在大肠杆菌(e.coli)中克隆并维持的载体主链生成线性缺失盒。表1中示出了所有引物序列,以及图2中示出了菌株构建的图形表示。
表1:用于在δcyp52m1菌株中创建球拟假丝酵母脂肪醇氧化酶基因(fao1)的敲除菌株的引物。
δcyp52m1δfao1敲除菌株的创建
fao1敲除盒的创建由vanrenterghemetal.(2018)描述,并用于转化球拟假丝酵母δura3::0δcyp52m1::pgapd_hph_ttk菌株,或进一步称为δura3δcyp52m1菌株。hph基因是从吸水链霉菌(streptomyceshygroscopus)中分离的,并且编码潮霉素b磷酸转移酶抗性(gritz&davies,1983)。转化后,在选择性sd培养基上选择ura3阳性菌落。通过菌落pcr确认盒的正确整合。对于新创建的δura3::0δcyp52m1::pgapd_hph_ttkδfao1::pura3_ura3_ttk菌株,进一步称为δcyp52m1δfao1,分别选择了三个成功的菌落。
下游处理和表征
当供给油烯基时δcyp52m1δfao1菌株的生成产物的纯化通过进行碱性水解(ph12,5mnaoh,37℃,1h)来完成,以使糖脂完全脱乙酰化以获得更一致的产物。纯化和干燥的产物通过制备液相色谱法(plc)进一步分级,用于nmr分析(参见下文)。
制备层色谱法(plc)
使用涂覆有2mm硅胶,用绿色荧光指示剂(f254)(analtech)浸渍的uniplate20x20cmplc板。首先,将100mg样品溶解于milliq水中。随后,在距平板底部2cm处以长条形施加溶液。将plc板置于包含sl溶剂混合物氯仿/甲醇/水(65/15/2,v/v/v)的溶剂室中(asmeretal.,1988)。在溶剂显影并分别蒸发后,将板置于254nm的uv光下。随后,使用解剖刀刮掉突出的目的区域,并收集刮掉的硅胶。随后通过向falcon添加20mlmilliq水来溶解化合物,并在4500rpm下离心10分钟。收集上清液,并重复该过程。过滤包含bolass产物的总上清液(截留0.22μm,
分析技术
追踪生长
使用jascov630bio分光光度计(jascoeurope)在600nm下测量用生理溶液(9g/lnacl)稀释的1ml样品的培养物的光密度(od)。通过确定菌落形成单位(cfu)来评估培养实验中酵母细胞的生存力,菌落形成单位表示为每培养体积cfu的平均对数,即log(cfu/ml)(saerensetal.,2011)。替代地,通过将1ml发酵样品在配衡的eppendorf管中在14000rpm下离心5min,并且随后用1ml生理溶液洗涤细胞团粒两次,来测定细胞干重(cdw)。将剩余的细胞团粒置于70℃烘箱中5天,并随后称重。在减去eppendorf管的空重后,计算cdw(g/l)。
追踪葡萄糖浓度
使用2700select生化分析仪(ysiinc.)或使用超高效液相色谱(watersacquityh-classuplc)偶联蒸发光散射检测器(watersacquityelsd检测器)(uplc-elsd)测定葡萄糖浓度。对于uplc分析,在35℃下使用acquityuplcbehamide柱(
糖脂的分析
通过剧烈摇动1ml纯乙醇和0.5ml发酵液的混合物5分钟来制备用于糖脂分析的样品。随后,在15000rpm下离心5分钟后,去除细胞团粒,并使用ptfe过滤器(截留0.22μm,novolab)过滤上清液,并于50%乙醇中充分稀释(除非另有说明),然后进行(超)高压液相色谱-质谱((u)hplc-ms)和(u)hplc-elsd(蒸发光散射检测器)分析。
使用偶联至ms(micromassquattrolc)检测系统的lc(shimadzu)进行hplc-ms。在30℃下在chromolithperformancerp-18endcapped100-4.6mm柱(merckkgaa)上通过极性分离不同的组分。lc-ms方法使用基于两种溶剂的梯度洗脱:具有0.5%乙酸的milliq和纯乙腈(acn)。在分析期间,采用1ml/min的流速。梯度以5%乙腈开始,并在40min的过程中线性增加直至95%。在此之后,将95%乙腈保持另外的10min,在这之后在5min内其重新回到5%乙腈。每个样品的总分析时间为60min/样品。将ms的扫描范围设置为215-1100g/mol。使用对于hplc-ms所提及的类似条件,通过varianprostarhplc(thermoscientific)偶联2000eselsd(alltech)在40℃下进行hplc-elsd分析。所有其他条件均与hplc-ms所提及的条件相似。
采用与uplc-ms相同的柱和分析方法,在acquityh-classuplc(waters)和acquityelsd检测器(waters)上进行uplc-elsd分析。对于elsd检测,将雾化器在12℃下冷却,并将漂移管保持在50℃的温度下,将增益设置为200。为了定量糖脂,制备了纯化产物的稀释系列。采用可用的c18:1乙酰化bolass纯化批次(批次编号sl24a)和纯化的乙酰化c16:0烷基ss批次(批次编号aalkc16_2)分别定量bola和烷基ss。
替代地,用accela(thermofisherscientific)和exactiveplusorbitrap质谱仪(thermofisherscientific)进行uplc-ms。对于糖脂分析,采用acquityuplccshc18柱(
在配备有1h/bbz-梯度探针(bbo,5mm)的brukeravanceiii上,分别在400和100.6mhz下记录所有1h和13cnmr光谱。将dmso-[d6]用作溶剂,并且作为内部化学位移标准品(对于1h为2.50ppm,以及对于13c为39.52ppm)。使用topspin3.2软件处理所有光谱。通过bruker脉冲程序文库中可用的标准序列获取附接的质子测试(apt)、13c、cosy和hsqc光谱。根据文献(gheysen,mihai,conrath,&martins,2008;petersenetal.,2006),将自定义设置用于hmbc(32次扫描)、tocsy(100毫秒mlev自旋锁(spinlock)、0.1秒混合时间、1.27秒弛豫延迟、16次扫描)和h2bc(21.8毫秒混合时间、1.5秒弛豫延迟、16次扫描)。
统计分析
当比较两个不同的组时,使用graphpadprism7.04软件以95%的置信水平进行welch测试。对于多组比较,采用使用graphpadprism7.04软件以95%置信水平的具有bonferroni的多重比较测试校正的方差分析(anova)。对于参数ph、cfu、od和葡萄糖消耗,当酵母细胞达到它们的静止期时(培养48h后)取平均值。通常,图中表示的数据是两次实验重复的平均值和标准偏差(除非另有说明)。
结果
敲除菌株的构建
使用脂肪醇氧化酶fao1敲除盒(在vanrenterghemetal.,2018中描述)以转化球拟假丝酵母δcyp52m1δura3菌株。在选择性sd板上选择ura3+菌落后,通过使用两种引物组合进行菌落pcr(参见表1)来控制敲除盒两侧的正确整合。选择了新创建的δcyp52m1δfao1菌株的三个正确菌落用于进一步表征。新型菌株的三个选择的转化体在od、cfu、葡萄糖消耗和糖脂生产方面表现出彼此相似。因此,在下一节中仅讨论一个菌落,用于与亲代δcyp52m1菌株在生长、ph、葡萄糖消耗和糖脂生产方面进行比较。
敲除菌株的初始表征
对于野生型球拟假丝酵母,菜籽油(60-80%油酸)或纯油酸导致最佳的sl滴度(asmeretal.,1988;rauetal.,2001),即具有c18碳链长的疏水底物。因此,首先在供给c18脂肪醇即油醇(c18:1)作为疏水底物的摇瓶中评估新创建的fao1敲除菌株。
生长、ph和葡萄糖消耗
图3中描绘了重要参数诸如log(cfu/ml)、ph和葡萄糖消耗。示出了评估的复制品的平均值和标准偏差。由于用油醇底物的测量的干扰,未表示出od600变化。在log(cfu/ml)值与培养时间的函数方面(图3a),在新菌株和参考菌株之间未获得显著不同的cfu值。观察到的ph下降是相等的(图3b)。如图3c所示,δcyp52m1δfao1和亲代菌株的葡萄糖消耗速率是相似的(0.47±0.06和0.47±0.01g/l.h)。
糖脂生产
当查看图4描绘的评估的菌株的糖脂生产时,与δcyp52m1亲代菌株相比,可以观察到δcyp52m1δfao1菌株的截然不同的生产概况。
亲代δcyp52m1菌株(图4b)未产生(或产生非常少量)糖脂(<7min)。在较晚的保留时间(>7min)(与δcyp52m1δfao1菌株观察到的相似)可看到对应于油酸的小峰(282g/mol)。几乎没有检测到烷基ss的事实表明供给的油醇主要通过仍有功能性的ω-氧化途径(由于未敲除fao)被氧化为相应的油酸。随后,由于通过cyp52m1敲除抑制了油酸的羟基化,葡糖基转移酶不能将脂肪酸糖基化,因此油酸会积聚或被β-氧化分解。
与亲代菌株形成对比,清楚地观察到δcyp52m1δfao1菌株(图4a)的糖脂生产。在3.0-4.5min之间的保留时间发现显著量的糖脂,以及在5.5-6.5min之间发现少量。在uplc-ms分析后,令人惊讶地发现,在早期保留范围(3-4.5min)内的质量实际上对应于bolass(900-1100g/mol范围),而不是针对的烷基ss(550-700g/mol范围)。确实检测到烷基ss,但是仅在上文提及的5.5-6.5min之间的少量中。在此菌株中bolass的这种合成理论上(基于本领域)是不可能的,因为由于缺失cyp52m1基因,经由供给的脂肪醇的羟基化而形成二醇(参见图5)(对于bolass合成是必需的)应该是不可能的。实际上,在亲代菌株中未观察到此种作用(参见图4b),如在本领域中所提及的,其实际上并未示出对油醇(参见图4b)或对油酸和/或菜籽油的任何氧化/羟基化活性(vanbogaertetal.,2013)。
因此,令人惊讶的是,当供给油醇时,δcyp52m1δfao1菌株主要产生bolass(图6),对应于早期保留时间(3.0-4.5min)。由于未在此菌株中敲除at基因(与设计用于生产bolass的菌株不同)(soetaertetal.,2013;vanrenterghemetal.,2018),对于上文描述的此新菌株还观察到了bolass的乙酰化。在4.4min处的四乙酰化c18:1bolass(1100g/mol)是bolass中最丰富的组分,随后是较少丰富的三乙酰化和二乙酰化bolass(分别为1016和1058g/mol)。还检测到非乙酰化和单乙酰化c18:1bolass(分别为932和974g/mol)。单乙酰化、二乙酰化和三乙酰化bolass出现在于4.05和4.15min处的两个不同的峰中的事实,可以通过分子的不同乙酰化方式解释,与如文献中示出的酸性sl所示出的相似(davilaetal.,1993;saerensetal.,2011;saerens,2012)。除了c18:1bolass外,还检测到基于c16:0的ss(906g/mol),由供给的油醇底物中的c16量引起(2-10%的鲸蜡醇或1-十六烷醇的污染量存在于底物中)。还产生了少量的烷基ss,并且主要检测到c18:1非乙酰化、单乙酰化和二乙酰化烷基ss(分别为592/634/676g/mol),但还发现了痕量的c16:0烷基ss(分别为566/608/650g/mol)。
因此看起来,供给的醇有利于羟基化为相应的二醇,并且照此经历ugta1和ugtb1的糖基化循环两次,以产生bolass(参见图6),而不是仅仅积累至烷基ss。由于供给醇的亲代菌株当供给油醇时不会产生这些化合物,因此看起来cyp52m1和fao1敲除的组合是至关重要的。
为了能够详细表征产生的化合物,从如描述的混合物中纯化bolass和烷基ss。
nmr结构分析
对来源于δcyp52m1δfao1菌株的液(broth)的纯化的非乙酰化c18:1bolass标准品进行nmr分析。
令人惊讶的是,nmr分析示出了在生产的bolass中,两个槐糖部分都仅以末端(ω)方式连接至疏水接头,在图7中示出。因此获得完全对称的糖脂分子,其具有化学式c42h76o22。
供给不同链长的脂肪醇
出乎意料地,当供给油醇时,对于δcyp52m1δfao1菌株未成功获得bolass或烷基ss的统一生产。取而代之,发现了两者的混合物,尽管大多数新型糖脂是(乙酰化)bolass,并且仅产生了少量的烷基ss。四乙酰化bolass的产生是出乎意料的,由于cyp52m1酶被认为是迄今为止在球拟假丝酵母中参与糖脂生产的唯一酶。为了评估伯醇的链长对糖脂生产的影响,将不同的底物供给δcyp52m1δfao1菌株。平行评估亲代菌株δcyp52m1。与davilaetal.(1994)报道的烷烃相似,选择12至18链长之间的中和长链醇。与上文所描述的实验相似,培养48h后加入疏水底物。
生长、ph和葡萄糖消耗
与δcyp52m1δfao1菌株相比,添加月桂醇、肉豆蔻醇、鲸蜡醇或油醇不会显著影响δcyp52m1菌株的cfu值(图8)。然而,与所有其他供给的底物相比,当添加月桂醇时,可注意到cfu的显著下降(图8a)。与鲸蜡醇或硬脂醇相比,当供给肉豆蔻醇或油醇时发现显著更高的葡萄糖消耗速率(0.48g/l.h与0.38g/l.h)。在加入月桂醇后(接种后48h),葡萄糖消耗停止。仅对于δcyp52m1δfao1菌株,在添加底物后100h,葡萄糖消耗再次开始(0.33g/l.h),直到耗尽所有葡萄糖。这与cfu变化是一致的(图8a)。
还研究了当不添加疏水底物时的δcyp52m1δfao1菌株。cfu和葡萄糖消耗与供给醇(月桂醇除外)的培养物无显著不同。
糖脂生产
在添加伯醇之前,δcyp52m1δfao1和δcyp52m1培养物均未示出可量化的糖脂生产。这是可以预料的,因为由于cyp52m1敲除,从头脂肪酸不能在糖脂生产途径中实施,并且必须供给醇以引发新型糖脂生产。
在对δcyp52m1菌株添加疏水底物后,在elsd上分析后没有峰是可见的,这与预期以及先前已经被描述的(vanbogaert,2010)相一致。在uplc-elsd上分析的对于不同供给的伯醇的δcyp52m1δfao1菌株的糖脂最终生产概况在图9中表示。对于供给的每种醇,产生了乙酰化bola和烷基ss的混合物。如所期望的,所有产生的糖脂直接来源于供给的醇。后者是由于敲除了cyp52m1基因的事实,因此消除了任何从头(主要是c16-c18)或生成的(醇的可能氧化)脂肪酸的实施。
对于月桂醇,可以检测到从非乙酰化直到四乙酰化c12:0bolass(580/934/976/1018g/mol)。除c12:0bolass外,在较晚的保留时间还发现了非乙酰化至二乙酰化c12:0烷基ss(510/552/594g/mol)。然而,色谱图中最丰富的峰对应于c12:0烷基葡糖苷(gs)(348g/mol),其位于单乙酰化和二乙酰化烷基ss峰之间。
对于肉豆蔻醇和鲸蜡醇,观察到非常相似的生产概况。对应于c14:0或c16:0bolass(3.00–4.00min和3.00–4.3min)以及c14:0或c16:0烷基ss(4.5–5.8min和5.2–6.5min)的清晰保留时间可以用各自的乙酰化来区分。使用ms检测c14:0和c16:0非乙酰化烷基gs(376和404g/mol)。可检测出少量的二乙酰化c14:0/或c16:0醇ss(或bolagl)(638或666g/mol)。
当将硬脂醇供给δcyp52m1δfao1菌株时,再次观察到乙酰化c18:0bolass(934/976/1018/1060/1102g/mol)和c18:0烷基ss(594/636/678g/mol)的混合生产。此外,检测到少量的c18:0烷基gs(432g/mol)。相似地,对于肉豆蔻醇和鲸蜡醇,检测到二乙酰化c18:0醇ss(或bolagl)(694g/mol)。
添加油醇导致上文所描述的糖脂生产概况。还检测到非乙酰化、单乙酰化和二乙酰化c16:0和c18:1烷基ss(分别为566/608/650g/mol和592/634/676g/mol)以及非乙酰化c16:0和c18:1烷基gs(404和430g/mol)。与其他醇相似,还检测到二乙酰化c18:1醇ss(或bolagl)(692g/mol)。
生成三重敲除菌株(δcyp52m1δfao1δugtb1)用于生产对称bola葡糖苷。
对于三重敲除菌株(δcyp52m1δfao1δugtb1)的生成,首先从双重敲除菌株(δcyp52m1δfao1)移除ura3标记,如通过lodensetal.,2019(biotechnologyandbioengineering:1-13)描述的。使用pfuultrahighfidelitypcr(stratagene)以及引物对gtii-472f和gtii+239r(gtii-472for:5'-gagagtgggacctgattc-3'(seqidn°19)/gtii+239rev:5'-ctgctctcaacaccgagtgtag-3'(seqidn°20)),从由saerensetal,2011描述的质粒“pgkougtb1”生成具有ura3标记的线性ugtb1敲除盒。将这种缺失盒转化至ura3阴性δcyp52m1δfao1菌株中,并选择正确的转化体。所得的菌株产生(乙酰化)对称bola葡糖苷,如图11中示出。
参考文献
asmer,h.-j.j.,lang,s.s.,wagner,f.,&wray,v.(1988).microbialproduction,structureelucidationandbioconversionofsophoroselipids.americanoilchemists’society,65(9),1460–1466.
davila,a.-m.m.,marchal,r.,&vandecasteele,j.-p.p.(1994).sophoroselipidproductionfromlipidicprecursors:predictiveevaluationofindustrialsubstrates.journalofindustrialmicrobiology,13(4),249–257.https://doi.org/10.1007/bf01569757
davila,a.m.,marchal,r.,monin,n.,&vandecasteele,j.p.(1993).identificationanddeterminationofindividualsophorolipidsinfermentationproductsbygradientelutionhigh-performanceliquidchromatographywithevaporativelight-scatteringdetection.journalofchromatographya,648(1),139–149.https://doi.org/10.1016/0021-9673(93)83295-4
gheysen,k.,mihai,c.,conrath,k.,&martins,j.c.(2008).rapididentificationofcommonhexapyranosemonosaccharideunitsbyasimpletocsymatchingapproach.chemistry-aeuropeanjournal,14(29),8869–8878.https://doi.org/10.1002/chem.200801081
green,m.r.,&sambrook,j.(2012).molecularcloning:alaboratorymanual.fourthedition.
gritz,l.,&davies,j.(1983).plasmid-encodedhygromycinbresistance:thesequenceofhygromycinbphosphotransferasegeneanditsexpressioninescherichiacoliandsaccharomycescerevisiae.gene,25(2–3),179–187.https://doi.org/10.1016/0378-1119(83)90223-8
guilmanov,v.,ballistreri,a.,impallomeni,g.,&gross,r.a.(2002).oxygentransferrateandsophoroselipidproductionbycandidabombicola.biotechnologyandbioengineering,77(5),489–494.https://doi.org/10.1002/bit.10177
huang,f.c.,peter,a.,&schwab,w.(2014).expressionandcharacterizationofcyp52genesinvolvedinthebiosynthesisofsophorolipidandalkanemetabolismfromstarmerellabombicola.appliedandenvironmentalmicrobiology,80(2),766–776.https://doi.org/10.1128/aem.02886-13
lang,s.,brakemeier,a.,heckmann,r.,
lodens,s.,degraeve,m.,roelants,s.l.k.w.l.k.w.,demaeseneire,s.l.l.,&soetaert,w.(2018).transformationofanexoticyeastspeciesintoaplatformorganism:acasestudyforengineeringglycolipidproductionintheyeaststarmerellabombicola.p.inj.bramaned.synth.biol.springerpublishingco.series“methodsinmolecularbiology.,”1772,95–123.https://doi.org/10.1007/978-1-4939-7795-6
petersen,b.o.,vinogradov,e.,kay,w.,würtz,p.,nyberg,n.t.,duus,j.,&
rau,u.,hammen,s.,heckmann,r.,&wray,v.(2001).sophorolipids:asourcefornovelcompounds.industrialcropsandproducts,13,85–92.
roelants,s.l.k.w.k.w.,ciesielska,k.,demaeseneire,s.l.,moens,h.,everaert,b.,verweire,s.,…soetaert,w.(2016).towardstheindustrializationofnewbiosurfactants:biotechnologicalopportunitiesforthelactoneesterasegenefromstarmerellabombicola.biotechnologyandbioengineering,113(3),550–559.https://doi.org/10.1002/bit.25815
roelants,s.l.k.w.,saerens,k.m.j.,derycke,t.,li,b.,lin,y.-c.,vandepeer,y.,soetaert,w.(2013).candidabombicolaasaplatformorganismfortheproductionoftailor-madebiomolecules.biotechnologyandbioengineering,110(9),2494–2503.https://doi.org/10.1002/bit.24895
saerens,k.m.j.(2012).synthesisofglycolipidsbycandidabombicola.retrievedfromhttp://lib.ugent.be/catalog/rug01:001796661
saerens,k.m.j.,saey,l.,&soetaert,w.(2011).one-stepproductionofunacetylatedsophorolipidsbyanacetyltransferasenegativecandidabombicola.biotechnologyandbioengineering,108(12),2923–2931.
soetaert,w.,vanbogaert,i.,&roelants,s.(2013).methodstoproducebolaamphiphilicglycolipids.wo2015028278a1.50p.
takahashi,f.,igarashi,k.,&hagihara,h.(2016).identificationofthefattyalcoholoxidasefao1fromstarmerellabombicolaandimprovednovelglycolipidsproductioninanfao1knockoutmutant.appliedmicrobiologyandbiotechnology,100(22),9519–9528.https://doi.org/10.1007/s00253-016-7702-6
vanbogaert,i.n.a.,buyst,d.,martins,j.c.,roelants,s.l.k.w.k.w.,&soetaert,w.k.(2016).synthesisofbolaformbiosurfactantsbyanengineeredstarmerellabombicolayeast.biotechnologyandbioengineering,113(12),2644–2651.https://doi.org/10.1002/bit.26032
vanbogaert,i.n.a.,holvoet,k.,roelants,s.l.k.w.,li,b.,lin,y.-c.c.,vandepeer,y.,&soetaert,w.(2013).thebiosyntheticgeneclusterforsophorolipids:abiotechnologicalinterestingbiosurfactantproducedbystarmerellabombicola.molecularmicrobiology,88(3),501–509.https://doi.org/10.1111/mmi.12200
vanbogaert,i.n.,roelants,s.,develter,d.,&soetaert,w.(2010).sophorolipidproductionbycandidabombicolaonoilswithaspecialfattyacidcompositionandtheirconsequencesoncellviability.biotechnologyletters,32(10),1509–1514.https://doi.org/10.1007/s10529-010-0323-8
vanrenterghem,l.,roelants,s.l.k.w.,baccile,n.,uyttersprot,k.,taelman,m.c.,everaert,b.,…soetaert,w.(2018).fromlabtomarket:anintegratedbioprocessdesignapproachfornew-to-naturebiosurfactantsproducedbystarmerellabombicola.biotechnologyandbioengineering,115(5),1195–1206.https://doi.org/10.1002/bit.26539。
序列表
<110>根特大学&欧洲生物基地试验工厂(universiteitgent&biobaseeuropepilotplant)
<120>对称bola型槐糖苷的改良生产
<130>ppi21170905be
<150>ep18207793.3
<151>2018-11-22
<160>20
<170>patentinversion3.5
<210>1
<211>26
<212>dna
<213>人工序列
<220>
<223>引物
<400>1
aaggcgggctggaatgcatatctgag26
<210>2
<211>24
<212>dna
<213>人工序列
<220>
<223>引物
<400>2
gatgtcgaatagccgggctgctac24
<210>3
<211>24
<212>dna
<213>人工序列
<220>
<223>引物
<400>3
aagaacatcgattttccatggcag24
<210>4
<211>23
<212>dna
<213>人工序列
<220>
<223>引物
<400>4
cgactcactatagggagagcggc23
<210>5
<211>40
<212>dna
<213>人工序列
<220>
<223>引物
<400>5
ctcgagtttttcagcaagattgccaagtcgttcaacacag40
<210>6
<211>40
<212>dna
<213>人工序列
<220>
<223>引物
<400>6
aggagatcttctagaaagatctgagacagcagcttgtcac40
<210>7
<211>42
<212>dna
<213>人工序列
<220>
<223>引物
<400>7
gtgacaagctgctgtctcagatctttctagaagatctcctac42
<210>8
<211>45
<212>dna
<213>人工序列
<220>
<223>引物
<400>8
ctgtgttgaacgacttggcaatcttgctgaaaaactcgagccatc45
<210>9
<211>20
<212>dna
<213>人工序列
<220>
<223>引物
<400>9
tgccaagtcgttcaacacag20
<210>10
<211>20
<212>dna
<213>人工序列
<220>
<223>引物
<400>10
ctgagacagcagcttgtcac20
<210>11
<211>28
<212>dna
<213>人工序列
<220>
<223>引物
<400>11
gccttggcattcaacatctcagggaatc28
<210>12
<211>20
<212>dna
<213>人工序列
<220>
<223>引物
<400>12
gcacgcccttagcttcagag20
<210>13
<211>40
<212>dna
<213>人工序列
<220>
<223>引物
<400>13
gactgagatgacggaagaggcccgaacataccagtttcgc40
<210>14
<211>40
<212>dna
<213>人工序列
<220>
<223>引物
<400>14
aagcttagtgagatccgcgtgaacaaacgacccaacaccc40
<210>15
<211>41
<212>dna
<213>人工序列
<220>
<223>引物
<400>15
gggtgttgggtcgtttgttcacgcggatctcactaagcttc41
<210>16
<211>40
<212>dna
<213>人工序列
<220>
<223>引物
<400>16
gcgaaactggtatgttcgggcctcttccgtcatctcagtc40
<210>17
<211>20
<212>dna
<213>人工序列
<220>
<223>引物
<400>17
gccagtgcaacaagtatgag20
<210>18
<211>20
<212>dna
<213>人工序列
<220>
<223>引物
<400>18
gaccaggctaaacgcatcac20
<210>19
<211>18
<212>dna
<213>人工序列
<220>
<223>引物
<400>19
gagagtgggacctgattc18
<210>20
<211>22
<212>dna
<213>人工序列
<220>
<223>引物
<400>20
ctgctctcaacaccgagtgtag22
- 还没有人留言评论。精彩留言会获得点赞!