抗PD-1结合蛋白及其使用方法与流程
抗pd
‑
1结合蛋白及其使用方法
1.1.相关申请的交叉引用
2.本技术要求于2018年12月27日提交的美国临时专利申请号62/785,660的优先权和权益,其全部内容通过引用并入本文。
3.2.序列表
4.本技术包含具有12221个序列的序列表,该序列表已通过efs
‑
web提交,其全部内容通过引用并入本文。所述ascii副本创建于2019年12月20日,名为ggn
‑
011wo_sl.txt,大小为2,018,899字节。
3.技术领域
5.本文提供了对pd
‑
1具有结合特异性的抗原结合蛋白(abp)和包含此类abp的组合物,包括药物组合物、诊断组合物和试剂盒。还提供了制备pd
‑
1abp的方法和使用pd
‑
1abp的方法,例如,用于治疗目的、诊断目的和研究目的。
4.
背景技术:
6.pd
‑
1,也称为程序性细胞死亡蛋白1和cd279(分化簇279),是抑制t细胞炎性活性的细胞表面受体。pd
‑
1由免疫细胞表达,包括t细胞、b细胞和巨噬细胞。pd
‑
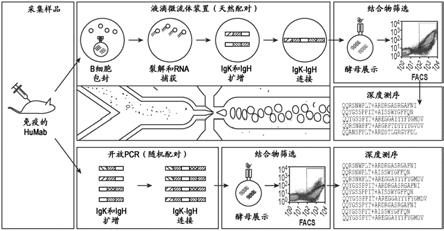
l1也由免疫细胞表达,其是pd
‑
1的主要配体。pd
‑
1和pd
‑
l1之间的相互作用对于通过抑制t细胞炎性活性来下调免疫应答和促进自我耐受至关重要。该活性防止自身免疫性疾病,以及阻止免疫系统杀死癌细胞。
7.肿瘤细胞通过上调pd
‑
l1来挟制(hijack)pd
‑
1/pd
‑
l1通路,且因此抑制抗肿瘤免疫应答。最近,pd
‑
1抑制剂已显示出拮抗pd
‑
1/pd
‑
l1结合,从而激活免疫系统以攻击肿瘤。因此,pd
‑
1抑制剂在治疗一些类型的癌症方面取得了不同程度的成功。
8.还发现抑制pd
‑
1活性在动物中减少脑淀粉样蛋白β斑块并改善认知能力。阻断pd
‑
1活性被证明会引发ifn
‑
γ依赖性免疫应答,该应答将单核细胞衍生的巨噬细胞募集到大脑,其然后能够从组织中清除淀粉样蛋白β斑块。因此,还建议将抗pd
‑
1抗体作为治疗阿尔茨海默氏病的治疗剂。
9.因此,需要开发可用于治疗、诊断和研究各种疾病(包括癌症和阿尔茨海默氏病)的pd
‑
1abp。
5.
技术实现要素:
10.本文提供了具有针对pd
‑
1的结合特异性的新型abp以及使用此类abp的方法。所述pd
‑
1是人pd
‑
1(seq id:7001)或人pd
‑
1的片段。
11.abp可以包含抗体。在一些实施方式中,抗体是单克隆抗体。在一些实施方式中,抗体是嵌合抗体。在一些实施方式中,抗体是人源化抗体。在一些实施方式中,抗体是人抗体。在一些实施方式中,abp包含抗体片段。在一些实施方式中,abp包含替代支架。在一些实施方式中,abp包含单链可变片段(scfv)。
12.本文提供的abp可诱导与pd
‑
1的抑制相关的各种生物学效应。在一些实施方式中,本文提供的abp阻止pd
‑
1和pd
‑
l1之间的结合。在一些实施方式中,本文提供的abp阻止效应t细胞的抑制。在一些实施方式中,abp共刺激效应t细胞。在一些实施方式中,abp抑制调节性t细胞对效应t细胞的抑制。在一些实施方式中,abp增加组织中或体循环中效应t细胞的数量。在一些实施方式中,组织是肿瘤。在一些实施方式中,组织是被病毒感染的组织。
13.还提供了试剂盒,其包含一种或多种含有abp的药物组合物,以及药物组合物的使用说明书。
14.还提供了编码本文提供的abp的分离的多核苷酸,及其部分。
15.还提供了包含此类多核苷酸的载体。
16.还提供了包含此类多核苷酸的重组宿主细胞和包含此类载体的重组宿主细胞。
17.还提供了使用本文提供的多核苷酸、载体或宿主细胞生产abp的方法。
18.还提供了包含abp和药学上可接受的赋形剂的药物组合物。
19.更具体地,本公开提供了一种分离的抗原结合蛋白(abp),其特异性结合人程序性细胞死亡蛋白1(pd
‑
1),其包含:(a)cdr3
‑
l,其具有选自seq id no:3001
‑
3028的序列,和cdr3
‑
h,其具有选自seq id no:6001
‑
6028的序列;或者(b)cdr3
‑
l,其具有选自seq id no:10092
‑
10614的序列,和cdr3
‑
h,其具有选自seq id no:11661
‑
12183的序列;或者(c)cdr3
‑
l,其具有以atcc登录号pta
‑
125509保藏的文库中任一克隆的cd3
‑
l的序列,和cdr3
‑
l,其具有以atcc登录号pta
‑
125509保藏的文库中任一克隆的cd3
‑
l的序列。在一些实施方式中,所述cdr3
‑
l和所述cdr3
‑
h是同源对。
20.在一些实施方式中,所述abp包含(a)cdr1
‑
l,其具有选自seq id no:1001
‑
1028的序列,和cdr2
‑
l,其具有选自seq id no:2001
‑
2028的序列;和cdr1
‑
h,其具有选自seq id no:4001
‑
4028的序列;和cdr2
‑
h,其具有选自seq id no:5001
‑
5028的序列;或者(b)cdr1
‑
l,其具有选自seq id no:9046
‑
9568的序列;和cdr2
‑
l,其具有选自seq id no:9569
‑
10091的序列,和cdr1
‑
h,其具有选自seq id no:10615
‑
11137的序列;和cdr2
‑
h,其具有选自seq id no:11138
‑
11660的序列;或者(c)cdr1
‑
l,其具有以atcc登录号pta
‑
125509保藏的文库中任一克隆的cdr1
‑
l的序列;和cdr2
‑
l,其具有以atcc登录号pta
‑
125509保藏的文库中任一克隆的cdr2
‑
l的序列;和cdr1
‑
h,其具有以atcc登录号pta
‑
125509保藏的文库中任一克隆的cdr1
‑
h的序列;和cdr2
‑
h,其具有以atcc登录号pta
‑
125509保藏的文库中任一克隆的cdr2
‑
h的序列。
21.在一些实施方式中,所述abp包含cdr1
‑
l、cdr2
‑
l、cdr3
‑
l、cdr1
‑
h、cdr2
‑
h和cdr3
‑
h,其中所述cdr1
‑
l由seq id no:1001组成、所述cdr2
‑
l由seq id no:2001组成、所述cdr3
‑
l由seq id no:3001组成、所述cdr1
‑
h由seq id no:4001组成、所述cdr2
‑
h由seq id no:5001组成和所述cdr3
‑
h由seq id no:6001组成;或者所述cdr1
‑
l由seq id no:1002组成、cdr2
‑
l由seq id no:2002组成、所述cdr3
‑
l由seq id no:3002组成、所述cdr1
‑
h由seq id no:4002组成、所述cdr2
‑
h由seq id no:5002组成和所述cdr3
‑
h由seq id no:6002组成;或者所述cdr1
‑
l由seq id no:1003组成、所述cdr2
‑
l由seq id no:2003组成、所述cdr3
‑
l由seq id no:3003组成、所述cdr1
‑
h由seq id no:4003组成、所述cdr2
‑
h由seq id no:5003组成和所述cdr3
‑
h由seq id no:6003;或者所述cdr1
‑
l由seq id no:1004组成、所述cdr2
‑
l由seq id no:2004组成、所述cdr3
‑
l由seq id no:3004组成、所述cdr1
‑
h由seq id no:
4004组成、所述cdr2
‑
h由seq id no:5004组成和所述cdr3
‑
h由seq id no:6004;或者所述cdr1
‑
l由seq id no:1005组成、所述cdr2
‑
l由seq id no:2005组成、所述cdr3
‑
l由seq id no:3005组成、所述cdr1
‑
h由seq id no:4005组成、所述cdr2
‑
h由seq id no:5005组成和所述cdr3
‑
h由seq id no:6005;或者所述cdr1
‑
l由seq id no:1006组成、所述cdr2
‑
l由seq id no:2006组成、所述cdr3
‑
l由seq id no:3006组成、所述cdr1
‑
h由seq id no:4006组成、所述cdr2
‑
h由seq id no:5006组成和所述cdr3
‑
h由seq id no:6006;或者所述cdr1
‑
l由seq id no:1007组成、所述cdr2
‑
l由seq id no:2007组成、所述cdr3
‑
l由seq id no:3007组成、所述cdr1
‑
h由seq id no:4007组成、所述cdr2
‑
h由seq id no:5007组成和所述cdr3
‑
h由seq id no:6007;或者所述cdr1
‑
l由seq id no:1008组成、所述cdr2
‑
l由seq id no:2008组成、所述cdr3
‑
l由seq id no:3008组成、所述cdr1
‑
h由seq id no:4008组成、所述cdr2
‑
h由seq id no:5008组成和所述cdr3
‑
h由seq id no:6008;或者所述cdr1
‑
l由seq id no:1009组成、所述cdr2
‑
l由seq id no:2009组成、所述cdr3
‑
l由seq id no:3009组成、所述cdr1
‑
h由seq id no:4009组成、所述cdr2
‑
h由seq id no:5009组成和所述cdr3
‑
h由seq id no:6009;或者所述cdr1
‑
l由seq id no:1010组成、所述cdr2
‑
l由seq id no:2010组成、所述cdr3
‑
l由seq id no:3010组成、所述cdr1
‑
h由seq id no:4010组成、所述cdr2
‑
h由seq id no:5010组成和所述cdr3
‑
h由seq id no:6010;或者所述cdr1
‑
l由seq id no:1011组成、所述cdr2
‑
l由seq id no:2011组成、所述cdr3
‑
l由seq id no:3011组成、所述cdr1
‑
h由seq id no:4011组成、所述cdr2
‑
h由seq id no:5011组成和所述cdr3
‑
h由seq id no:6011;或者所述cdr1
‑
l由seq id no:1012组成、所述cdr2
‑
l由seq id no:2012组成、所述cdr3
‑
l由seq id no:3012组成、所述cdr1
‑
h由seq id no:4012组成、所述cdr2
‑
h由seq id no:5012组成和所述cdr3
‑
h由seq id no:6012;或者所述cdr1
‑
l由seq id no:1013组成、所述cdr2
‑
l由seq id no:2013组成、所述cdr3
‑
l由seq id no:3013组成、所述cdr1
‑
h由seq id no:4013组成、所述cdr2
‑
h由seq id no:5013组成和所述cdr3
‑
h由seq id no:6013;或者所述cdr1
‑
l由seq id no:1014组成、所述cdr2
‑
l由seq id no:2014组成、所述cdr3
‑
l由seq id no:3014组成、所述cdr1
‑
h由seq id no:4014组成、所述cdr2
‑
h由seq id no:5014组成和所述cdr3
‑
h由seq id no:6014;或者所述cdr1
‑
l由seq id no:1015组成、所述cdr2
‑
l由seq id no:2015组成、所述cdr3
‑
l由seq id no:3015组成、所述cdr1
‑
h由seq id no:4015组成、所述cdr2
‑
h由seq id no:5015组成和所述cdr3
‑
h由seq id no:6015;或者所述cdr1
‑
l由seq id no:1016组成、所述cdr2
‑
l由seq id no:2016组成、所述cdr3
‑
l由seq id no:3016组成、所述cdr1
‑
h由seq id no:4016组成、所述cdr2
‑
h由seq id no:5016组成和所述cdr3
‑
h由seq id no:6016;或者所述cdr1
‑
l由seq id no:1017组成、所述cdr2
‑
l由seq id no:2017组成、所述cdr3
‑
l由seq id no:3017组成、所述cdr1
‑
h由seq id no:4017组成、所述cdr2
‑
h由seq id no:5017组成和所述cdr3
‑
h由seq id no:6017;或者所述cdr1
‑
l由seq id no:1018组成、所述cdr2
‑
l由seq id no:2018组成、所述cdr3
‑
l由seq id no:3018组成、所述cdr1
‑
h由seq id no:4018组成、所述cdr2
‑
h由seq id no:5018组成和所述cdr3
‑
h由seq id no:6018;或者所述cdr1
‑
l由seq id no:1019组成、所述cdr2
‑
l由seq id no:2019组成、所述cdr3
‑
l由seq id no:3019组成、所述cdr1
‑
h由seq id no:4019组成、所述cdr2
‑
h由seq id no:5019组成和所述cdr3
‑
h由seq id no:6019;或者所述cdr1
‑
l由seq id no:1020组成、所述cdr2
‑
l由seq id no:2020组成、所述cdr3
‑
l由seq id no:3020组成、所
述cdr1
‑
h由seq id no:4020组成、所述cdr2
‑
h由seq id no:5020组成和所述cdr3
‑
h由seq id no:6020;或者所述cdr1
‑
l由seq id no:1021组成、所述cdr2
‑
l由seq id no:2021组成、所述cdr3
‑
l由seq id no:3021组成、所述cdr1
‑
h由seq id no:4021组成、所述cdr2
‑
h由seq id no:5021组成和所述cdr3
‑
h由seq id no:6021;或者所述cdr1
‑
l由seq id no:1022组成、所述cdr2
‑
l由seq id no:2022组成、所述cdr3
‑
l由seq id no:3022组成、所述cdr1
‑
h由seq id no:4022组成、所述cdr2
‑
h由seq id no:5022组成和所述cdr3
‑
h由seq id no:6022;或者所述cdr1
‑
l由seq id no:1023组成、所述cdr2
‑
l由seq id no:2023组成、所述cdr3
‑
l由seq id no:3023组成、所述cdr1
‑
h由seq id no:4023组成、所述cdr2
‑
h由seq id no:5023组成和所述cdr3
‑
h由seq id no:6023;或者所述cdr1
‑
l由seq id no:1024组成、所述cdr2
‑
l由seq id no:2024组成、所述cdr3
‑
l由seq id no:3024组成、所述cdr1
‑
h由seq id no:4024组成、所述cdr2
‑
h由seq id no:5024组成和所述cdr3
‑
h由seq id no:6024;或者所述cdr1
‑
l由seq id no:1025组成、所述cdr2
‑
l由seq id no:2025组成、所述cdr3
‑
l由seq id no:3025组成、所述cdr1
‑
h由seq id no:4025组成、所述cdr2
‑
h由seq id no:5025组成和所述cdr3
‑
h由seq id no:6025;或者所述cdr1
‑
l由seq id no:1026组成、所述cdr2
‑
l由seq id no:2026组成、所述cdr3
‑
l由seq id no:3026组成、所述cdr1
‑
h由seq id no:4026组成、所述cdr2
‑
h由seq id no:5026组成和所述cdr3
‑
h由seq id no:6026;或者所述cdr1
‑
l由seq id no:1027组成、所述cdr2
‑
l由seq id no:2027组成、所述cdr3
‑
l由seq id no:3027组成、所述cdr1
‑
h由seq id no:4027组成、所述cdr2
‑
h由seq id no:5027组成和所述cdr3
‑
h由seq id no:6027;或者所述cdr1
‑
l由seq id no:1028组成、所述cdr2
‑
l由seq id no:2028组成、所述cdr3
‑
l由seq id no:3028组成、所述cdr1
‑
h由seq id no:4028组成、所述cdr2
‑
h由seq id no:5028组成和所述cdr3
‑
h由seq id no:6028组成。
22.在一些实施方式中,所述abp包含可变轻链(v
l
),其包含与选自seq id no:1
‑
28的序列具有至少97%同一性的序列,和可变重链(v
h
),其包含与选自seq id no:101
‑
128的序列具有至少97%同一性的序列;或者可变轻链(v
l
),其包含与选自seq id no:8000
‑
8522的序列具有至少97%同一性的序列,和可变重链(v
h
),其包含与选自seq id no:8523
‑
9045的序列具有至少97%同一性的序列;或者可变轻链(v
l
),其包含与以atcc登录号pta
‑
125509保藏的文库中任一克隆的v
l
序列具有至少97%同一性的序列,和可变重链(v
h
),其包含与以atcc登录号pta
‑
125509保藏的文库中任一克隆的v
h
序列具有至少97%同一性的序列。在一些实施方式中,所述v
l
和所述v
h
是同源对。
23.在一些实施方式中,所述abp包含可变轻链(v
l
),其包含选自seq id no:1
‑
28的序列,和可变重链(v
h
),其包含选自seq id no:101
‑
128的序列;或者可变轻链(v
l
),其包含选自seq id no:8000
‑
8522的序列,和可变重链(v
h
),其包含选自seq id no:8523
‑
9045的序列;或者可变轻链(v
l
),其包含以atcc登录号pta
‑
125509保藏的文库中任一克隆的v
l
序列,和可变重链(v
h
),其包含以atcc登录号pta
‑
125509保藏的文库中任一克隆的v
h
序列。在一些实施方式中,所述v
l
和所述v
h
是同源对。
24.在一些实施方式中,所述abp包含scfv或全长单克隆抗体。在一些实施方式中,所述abp包含免疫球蛋白恒定区。
25.在一些实施方式中,如通过生物层干涉法或表面等离子体共振所测量的,所述abp以小于500nm的k
d
结合人pd
‑
1。在一些实施方式中,如通过生物层干涉法或表面等离子体共
振所测量的,所述abp以小于200nm的k
d
结合人pd
‑
1。在一些实施方式中,如通过生物层干涉法或表面等离子体共振所测量的,所述abp以小于25nm的k
d
结合人pd
‑
1。在一些实施方式中,所述abp以小于25nm的k
d
结合细胞表面上的人pd
‑
1。
26.本公开的另一个方面提供了一种药物组合物,其包含任何一种所公开的abp和赋形剂。
27.本公开的另一个方面提供了一种治疗疾病的步骤,其包括步骤:向有需要的受试者施用有效量的本文公开的abp或本文公开的药物组合物。在一些实施方式中,所述疾病选自以下:癌症、aids、阿尔茨海默氏病和病毒或细菌感染。在一些实施方式中,所述方法还包括向所述受试者施用一种或多种另外的治疗剂的步骤。在一些实施方式中,所述另外的治疗剂选自ctla
‑
4抑制剂、tigit抑制剂、化学治疗剂、免疫刺激剂、辐射、细胞因子、编码细胞因子的多核苷酸及其组合。
6.附图说明
28.图1总结了从分离自全人小鼠的b细胞生成scfv文库并选择表达对抗原具有高亲和力的抗体的b细胞的方法。图1按照出现顺序分别公开了seq id no:12194
‑
12221。
29.图2说明了scfv扩增程序。首先,将针对igk c区、igg c区和所有v区的引物的混合物用于分别扩增igk和igh。其次,v
‑
h和c
‑
k引物包含互补区,其导致形成作为igk和igh之间的融合产物的重叠延伸扩增子。该互补区包含编码富含gly
‑
ser的scfv接头序列的dna序列。再次,进行半巢式pcr以添加用于illumina测序或酵母展示的衔接子。
30.图3包括显示指示的单克隆抗体和派姆单抗的表位分箱(epitope binning)的表位图。
7.具体实施方式
31.7.1.定义
32.除非本文另有定义,否则与本公开相关的科学和技术术语应具有本领域普通技术人员通常理解的含义。此外,除非上下文另有要求,否则单数术语应包括复数,而复数术语应包括单数。通常,与本文所述的细胞和组织培养、分子生物学、免疫学、微生物学、遗传学以及蛋白质和核酸化学和杂交相关的命名法和技术是本领域熟知和常用的那些。除非另有说明,否则本公开的方法和技术通常根据本领域熟知的常规方法进行,并且如在本说明书通篇引用和讨论的各种一般性和更具体的参考文献中所描述的。参见,例如,sambrook等,molecular cloning:a laboratory manual,2d ed.,cold spring harbor laboratory press,cold spring harbor,n.y.(1989)和ausubel等,current protocols in molecular biology,greene publishing associates(1992),以及harlow和lane antibodies:a laboratory manual cold spring harbor laboratory press,cold spring harbor,n.y.(1990),其通过引用并入本文。酶促反应和纯化技术根据生产厂商的说明书进行,如本领域中通常完成的或如本文所述的。与本文所述的分析化学、合成有机化学以及药用和药物化学相关使用的术语,以及其实验室程序和技术是本领域熟知和常用的那些。可以用于化学合成、化学分析、药物制备、制剂、和递送以及患者治疗的标准技术。
33.除非另有说明,否则以下术语应理解为具有以下含义:
34.术语“pd
‑
1”、“pd
‑
1蛋白”和“pd
‑
1抗原”在本文中可互换使用,指人pd
‑
1或任何变体(例如,剪接变体和等位基因变体)、异形体以及人pd
‑
1的物种同源物,其由细胞天然表达,或者由转染了pdcd1基因的细胞表达。在一些方面中,pd
‑
1蛋白是由灵长类(例如,猴或人)、啮齿类(例如,小鼠或大鼠)、犬、骆驼、猫、奶牛、山羊、马或绵羊天然表达的pd
‑
1蛋白。在一些方面中,pd
‑
1蛋白是人pd
‑
1(hpd
‑
1;seq id no:7001)。
35.术语“免疫球蛋白”指一类结构相关的蛋白,其通常包含两对多肽链:一对轻(l)链和一对重(h)链。在“完整免疫球蛋白”中,所有这四条链均通过二硫键相互连接。免疫球蛋白的结构已被很好地表征。参见,例如,paul,fundamental immunology 7th ed.,ch.5(2013)lippincott williams&wilkins,philadelphia,pa。简言之,每条重链通常包含重链可变区(v
h
)和重链恒定区(c
h
)。重链恒定区通常包含三个结构域,缩写为c
h1
、c
h2
和c
h3
。每条轻链通常包含轻链可变区(v
l
)和轻链恒定区。轻链恒定区通常包含一个结构域,缩写为c
l
。
36.术语“抗原结合蛋白”(abp)指包含特异性结合抗原或表位的一个或多个抗原结合结构域的蛋白。在一些实施方式中,抗原结合结构域以与天然存在的抗体相似的特异性和亲和力结合抗原或表位。在一些实施方式中,abp包含抗体。在一些实施方式中,abp由抗体组成。在一些实施方式中,abp基本上由抗体组成。在一些实施方式中,abp包含替代支架。在一些实施方式中,abp由替代支架组成。在一些实施方式中,abp基本上由替代支架组成。在一些实施方式中,abp包含抗体片段。在一些实施方式中,abp由抗体片段组成。在一些实施方式中,abp基本上由抗体片段组成。“pd
‑
1abp”、“抗pd
‑
1abp”或“pd
‑
1特异性abp”是如本文所提供的abp,其与抗原pd
‑
1特异性结合。在一些实施方式中,abp结合pd
‑
1的胞外域。在某些实施方式中,本文提供的pd
‑
1abp结合在来自不同物种的pd
‑
1蛋白之间或之中保守的pd
‑
1的表位。
37.术语“抗体”在本文中以其最广泛的含义使用,包括某些类型的免疫球蛋白分子,其包含一个或多个特异性结合抗原或表位的抗原结合结构域。抗体特别地包括完整抗体(例如,完整免疫球蛋白)、抗体片段和多特异性抗体。抗原结合结构域的一个实例是由v
h
‑
v
l
二聚体形成的抗原结合结构域。抗体是abp的一种类型。
38.术语“替代支架”是指一种分子,其中一个或多个区域可以多样化以产生一个或多个与抗原或表位特异性结合的抗原结合结构域。在一些实施方式中,抗原结合结构域以与天然存在的抗体相似的特异性和亲和力结合抗原或表位。示例性替代支架包括来源于纤连蛋白(例如,adnectins
tm
)、β
‑
夹心(例如,imab)、脂质运载蛋白(例如,)、eeti
‑
ii/agrp、bpti/laci
‑
d1/iti
‑
d2(例如,kunitz结构域)、硫氧环蛋白肽适体、蛋白a(例如,)、锚蛋白重复序列(例如,darpins)、γ
‑
b
‑
晶状体蛋白/泛素(例如,affilins)、ctld3(例如,四联蛋白)、fynomers和(ldlr
‑
a模块)(例如,avimers)的那些。在binz等,nat.biotechnol.,2005 23:1257
‑
1268;skerra,current opin.in biotech.,2007 18:295
‑
304;和silacci等,j.biol.chem.,2014,289:14392
‑
14398中提供了替代支架的其他新型;其每一个的全部内容通过引用并入。替代支架是abp的一种类型。
39.术语“抗原结合结构域”指能够特异性结合抗原或表位的abp的部分。
40.术语“全长抗体”、“完整抗体”和“全抗体”在本文中可互换使用,指具有与天然存在的抗体结构基本相似的结构并且具有包含fc区的重链的抗体。
41.术语“fc区”是指免疫球蛋白重链的c末端区域,在天然存在的抗体中,其与fc受体和补体系统的某些蛋白相互作用。各种免疫球蛋白fc区的结构以及其中包含的糖基化位点是本领域公知的。参见schroeder和cavacini,j.allergy clin.immunol.,2010,125:s41
‑
52,其全部内容通过引用并入。fc区可以是天然存在的fc区,或者如本公开其他地方所述的经修饰的fc区。
42.v
h
和v
l
区可以进一步细分为高变区(“高变区(hvr);”也称为“互补性决定区”(cdr)),其中散布着更保守的区域。更保守的区域称为框架区(fr)。每个v
h
和v
l
通常包含三个cdr和四个fr,其按照以下顺序排列(从n末端到c末端):fr1
‑
cdr1
‑
fr2
‑
cdr2
‑
fr3
‑
cdr3
‑
fr4。cdr参与抗原结合,并影响抗体的抗原特异性和结合亲和力。参见kabat等,sequences of proteins of immunological interest 5th ed.(1991)public health service,national institutes of health,bethesda,md,其全部内容通过引用并入。
43.基于其恒定结构域的序列,来自任何脊椎动物物种的轻链可以归为两种类型之一,称为κ(κ)和λ(λ)。
44.来自任何脊椎动物物种的重链可以归为五种不同类型(或同种型)之一:iga、igd、ige、igg和igm。这些类别也分别称为α、δ、ε、γ和μ。igg和iga类别根据序列和功能的差异进一步分为亚类。人表达以下亚类:igg1、igg2、igg3、igg4、iga1和iga2。
45.cdr的氨基酸序列边界可由本领域技术人员使用多种已知编号方案中的任一种确定,包括由kabat等,同上(“kabat”编号方案);al
‑
lazikani等,1997,j.mol.biol.,273:927
‑
948(“chothia”编号方案);maccallum等,1996,j.mol.biol.262:732
‑
745(“contact”编号方案);lefranc等,dev.comp.immunol.,2003,27:55
‑
77(“imgt”编号方案);和honegge和pl
ü
ckthun,j.mol.biol.,2001,309:657
‑
70(“aho”编号方案)描述的那些;其每一个的全部内容通过引用并入。
46.表1提供了cdr1
‑
l(v
l
的cdr1)、cdr2
‑
l(v
l
的cdr2)、cdr3
‑
l(v
l
的cdr3)、cdr1
‑
h(v
h
的cdr1)、cdr2
‑
h(v
h
的cdr2)和cdr3
‑
h(v
h
的cdr3)的位置,如通过kabat和chothia方案鉴定的。对于cdr1
‑
h,使用kabat和chothia编号方案两者提供残基编号。
47.例如,可以使用抗体编号软件分配cdr,如从www.bioinf.org.uk/abs/abnum/获得的abnum,以及在abhinandan和martin,immunology,2008,45:3832
‑
3839中对其进行了描述,其全部内容通过引用并入。
[0048][0049]
*当使用kabat编号惯例编号时,cdr1
‑
h的c末端在32和34之间变化,其取决于cdr的长度。
[0050]
当涉及抗体重链恒定区中的残基时,通常使用“eu编号方案”(例如,如在kabat等中报道的,同上)。
[0051]“抗体片段”包含完整抗体的一部分,如完整抗体的抗体结合或可变区。抗体片段包括例如fv片段、fab片段、f(ab’)2片段、fab’片段、scfv(sfv)片段和scfv
‑
fc片段。
[0052]“fv”片段包含一个重链可变结构域和一个轻链可变结构域非共价连接的二聚体。
[0053]
除了重链和轻链可变结构域以外,“fab”片段包含轻链的恒定结构域和重链的第一恒定结构域(c
h1
)。fab片段可以例如通过重组方法或通过完整抗体的木瓜蛋白酶消化产生。
[0054]“f(ab’)
2”片段包含两个fab’片段,其在铰链区附近通过二硫键连接。f(ab’)2片段可以例如通过重组方法或通过完整抗体的木瓜蛋白酶消化产生。f(ab’)片段可以被解离,例如,通过使用β
‑
巯基乙醇处理。
[0055]“单链fv”、“sfv”或“scfv”抗体片段包含在单一多肽链中的v
h
结构域和v
l
结构域。v
h
和v
l
通常通过肽接头连接。参见pl
ü
ckthun a.(1994)。在一些实施方式中,接头是(ggggs)
n
(seq id no:12190)。在一些实施方式中,n=1、2、3、4、5或6。参见antibodies from escherichia coli.rosenberg m.&moore g.p.(eds.),the pharmacology of monoclonal antibodies vol.113(pp.269
‑
315).springer
‑
verlag,new york,其全部内容通过引用并入。
[0056]“scfv
‑
fc”片段包含附接至fc结构域的scfv。例如,fc结构域可以附接至scfv的c末端。fc结构域可以在v
h
或v
l
之后,这取决于在scfv中可变结构域的方向(即,v
h
‑
v
l
或v
l
‑
v
h
)。可以使用本领域公知的或本文所述的任何适宜fc结构域。在一些情况下,fc结构域包含igg4 fc结构域。
[0057]
术语“单域抗体”指其中抗体的一个可变结构域特异性结合抗原而不存在其他可变结构域的分子。单域抗体及其片段如在arabi ghahroudi等,febs letters,1998,414:521
‑
526和muyldermans等,trends in biochem.sci.,2001,26:230
‑
245中所描述的,其每一个的全部内容通过引用并入。
[0058]“单特异性abp”是包含与单个表位特异性结合的结合位点的abp。单特异性abp的实例是天然存在的igg分子,其虽然是二价的,但在每个抗原结合结构域识别相同表位。结合特异性可以以任何适宜的化合价存在。
[0059]
术语“单克隆抗体”指来自一组基本同质的抗体的抗体。除了在单克隆抗体生产过程中通常可能出现的变体以外,一组基本上同质的抗体包含基本上相似并结合一个或多个相同表位的抗体。此类变体通常仅以少量存在。单克隆抗体通常通过包括从多种抗体中选择单一抗体的方法获得。例如,选择方法可以是从多个克隆中选择独特克隆,如杂交瘤克隆、噬菌体克隆、酵母克隆、细菌克隆或其他重组dna克隆。可以进一步改变选择的抗体,例如,以提高对靶点的亲和力(“亲和力突变”)、使抗体人源化、提高其在细胞培养物中的产量和/或降低其在受试者中的免疫原性。
[0060]
术语“嵌合抗体”指重链和/或轻链的一部分来源于特定来源或物种,而重链和/或轻链的其余部分来源于不同来源或物种的抗体。
[0061]“人源化”形式的非人抗体是嵌合抗体,其包含来源于非人抗体的最小序列。人源化抗体通常是人抗体(受体抗体),其中来自一个或多个cdr的残基被来自非人抗体(供体抗
体)的一个或多个cdr残基替代。供体抗体可以是任何适宜的非人抗体,如具有所需特异性、亲和力或生物学效应的小鼠、大鼠、家兔、鸡或非人灵长类抗体。在一些情况下,受体抗体的选定框架区残基被来自供体抗体的相应康佳区残基替代。人源化抗体还包含在受体抗体或供体抗体中均未发现的残基。可以进行此类修饰以进一步完善抗体功能。对于进一步的细节,参见jones等,nature,1986,321:522
‑
525;riechmann等,nature,1988,332:323
‑
329;和presta,curr.op.struct.biol.,1992,2:593
‑
596,其每一个的全部内容通过引用并入。
[0062]“人抗体”是这样一种抗体,其具有与由人或人细胞产生的或源自利用人抗体文库或人抗体编码序列的非人来源抗体的氨基酸序列相对应的氨基酸序列(例如,从人类来源获得或从头设计)。人抗体明确排除人源化抗体。在一些实施方式中,啮齿动物经基因改造,用人抗体替代其啮齿动物抗体序列。
[0063]“分离的abp”或“分离的核酸”是已从天然环境的组分中分离和/或回收的abp或核酸。天然环境的组分可以包括酶、激素和其他蛋白或非蛋白材料。在一些实施方式中,分离的abp被纯化到足以获得至少15个n
‑
末端或内部氨基酸序列残基的程度,例如通过使用旋转杯测序仪。在一些实施方式中,在还原或非还原条件下通过凝胶电泳(例如,sds
‑
page)将分离的abp纯化至均质,并通过考马斯蓝或银染进行检测。分离的abp包括重组细胞内的原位abp,因为abp天然环境的至少一种组分不存在。在一些方面中,分离的abp或分离的核酸通过至少一个纯化步骤制备。在一些实施方式中,分离的abp或分离的核酸被纯化至以重量计至少80%、85%、90%、95%或99%。在一些实施方式中,分离的abp或分离的核酸被纯化至以体积计至少80%、85%、90%、95%或99%。在一些实施方式中,分离的abp或分离的核酸以溶液形式提供,所述溶液包含以重量计至少85%、90%、95%、98%、99%至100%的abp或核酸。在一些实施方式中,分离的abp或分离的核酸以溶液形式提供,所述溶液包含以体积计至少85%、90%、95%、98%、99%至100%的abp或核酸。
[0064]“亲和力”指分子(例如,abp)的单个结合位点与其结合伴体(例如,抗原或表位)之间的非共价相互作用总和的强度。除非另有说明,否则如本文所用,“亲和力”指内在结合亲和力,其反映了结合对成员(例如,abp和抗原或表位)之间的1:1相互作用。分子x对其伴体y的亲和力可以用解离平衡常数(k
d
)表示。在下面更详细地描述了有助于解离平衡常数的动力学组分。可以通过本领域公知的通常方法测量亲和力,包括本文所述的哪些。可以例如使用表面等离子体共振(spr)技术(例如,)或生物层干涉法(例如,)确定亲和力。
[0065]
关于abp与靶分子的结合,术语“结合”、“特异性的结合”、“特异性结合”、“特异性针对”、“选择性结合”和“选择性针对”特定抗原(例如,多肽靶标)或特定抗原上的表位意指与非特异性或非选择性相互作用(例如,与非靶分子)显著不同的结合。例如,可以通过测量与靶分子的结合并将其与同非靶分子的结合进行比较来测量特异性结合。特异性结合也可以通过与模拟靶分子上识别的表位的对照分子的竞争来确定。在这种情况下,如果abp与靶分子的结合被对照分子竞争性抑制,则表明特异性结合。在一些方面中,pd
‑
1abp对非靶分子的亲和力小于对pd
‑
1亲和力的约50%。在一些方面中,pd
‑
1abp对非靶分子的亲和力小于对pd
‑
1亲和力的约40%。在一些方面中,pd
‑
1abp对非靶分子的亲和力小于对pd
‑
1亲和力的约30%。在一些方面中,pd
‑
1abp对非靶分子的亲和力小于对pd
‑
1亲和力的约20%。在一些
方面中,pd
‑
1abp对非靶分子的亲和力小于对pd
‑
1亲和力的约10%。在一些方面中,pd
‑
1abp对非靶分子的亲和力小于对pd
‑
1亲和力的约1%。在一些方面中,pd
‑
1abp对非靶分子的亲和力小于对pd
‑
1亲和力的约0.1%。
[0066]
如本文所用,术语“k
d”(秒
‑1)指特定abp
‑
抗原相互作用的解离速率常数。该值也称为k
off
值。
[0067]
如本文所用,术语“k
a”(m
‑1×
秒
‑1)指特定abp
‑
抗原相互作用的结合速率常数。该值也称为k
on
值。
[0068]
如本文所用,术语“k
d”(m)指特定abp
‑
抗原相互作用的解离平衡常数。k
d
=k
d
/k
a
。
[0069]
如本文所用,术语“k
a”(m
‑1)指特定abp
‑
抗原相互作用的结合平衡常数。k
a
=k
a
/k
d
。
[0070]“亲和力成熟”的abp是一种具有一个或多个改变(例如,在一个或多个cdr或fr中)的abp,与不具有一个或多个改变的亲本abp相比,其导致abp对其抗原的亲和力提高。在一个实施方式中,亲和力成熟的abp针对靶抗原具有纳摩尔或皮摩尔的亲和力。亲和力成熟的abp可以使用本领域公知的各种方法生产。例如,marks等,(bio/technology,1992,10:779
‑
783,其全部内容通过引用并入)描述了通过v
h
和v
l
结构域重排的亲和力成熟。通过以下描述了cdr和/或框架残基的随机诱变,例如,barbas等,(proc.nat.acad.sci.u.s.a.,1994,91:3809
‑
3813);schier等,gene,1995,169:147
‑
155;yelton等,j.immunol.,1995,155:1994
‑
2004;jackson等,j.immunol.,1995,154:3310
‑
33199;和hawkins等,j.mol.biol.,1992,226:889
‑
896;其每一个的全部内容通过引用并入。
[0071]“免疫缀合物”是与一种或多种异源分子缀合的abp。
[0072]“效应功能”指由抗体fc区介导的生物学活性,其活性可以因抗体同种型而异。抗体效应功能的实例包括激活补体依赖性细胞毒性(cdc)的c1q结合、激活抗体依赖性细胞毒性(adcc)和抗体依赖性细胞吞噬作用(adcp)的fc受体结合。
[0073]
当本文在两个或多个abp的背景下使用时,术语“与
……
竞争”或“与
……
交叉竞争”表示该两个或更多个abp竞争结合抗原(例如,pd
‑
1)。在一个示例性测定中,将pd
‑
1涂覆在表面上并与第一pd
‑
1abp接触,然后加入第二pd
‑
1abp。在另一个示例性测定中,将第一pd
‑
1abp涂覆在表面上并与pd
‑
1接触,然后加入第二pd
‑
1abp。如果第一pd
‑
1abp的存在降低了第二pd
‑
1abp的结合,则在任一测定中abp竞争。术语“与
……
竞争”还包括abp的组合,其中一个abp减少了另一个abp的结合,但是当abp以相反顺序添加时没有观察到竞争。然而,在一些实施方式中,第一和第二abp抑制彼此的结合,无论它们的添加顺序如何。在一些实施方式中,一种abp将另一种abp与其抗原的结合降低至少25%、至少50%、至少60%、至少70%、至少80%、至少85%、至少90%或至少95%。技术人员可以基于abp对pd
‑
1的亲和力和abp的价数选择用于竞争测定的抗体浓度。在该定义中描述的测定是说明性的,且技术人员可以利用任何适宜的测定来确定抗体是否相互竞争。例如在cox等,“immunoassay methods,”assay guidance manual[internet],2014年12月24日更新(www.ncbi.nlm.nih.gov/books/nbk92434/;2015年9月29日访问);silman等,cytometry,2001,44:30
‑
37;和finco等,j.pharm.biomed.anal.,2011,54:351
‑
358中描述了适宜的测定;其每一个的全部内容通过引用并入。
[0074]
术语“表位”指特异性结合abp的抗原的一部分。表位通常由表面可接近的氨基酸残基和/或糖侧链组成,并且可能具有特定的三维结构特征以及特定的电荷特征。构象和非
构象表位的区别在于,在变性溶剂的存在下可能会失去与前者而不是后者的结合。表位可以包含直接参与结合的氨基酸残基,以及不直接参与结合的其他氨基酸残基。abp与其结合的表位可以使用已知的用于表位测定的技术来确定,例如,测试abp与具有不同点突变的pd
‑
1变体或嵌合pd
‑
1变体的结合。
[0075]
多肽序列和参考序列之间的“同一性”百分比,定义为在比对序列并引入缺口(如果需要)之后,多肽序列中与参考序列中的氨基酸残基相同的氨基酸残基的百分比,以达到最大的序列同一性百分比。可以以本领域技术范围内的各种方式实现用于确定氨基酸序列同一性百分比目的的比对,例如,使用公开可用的计算机软件,如blast、blast
‑
2、align、megalign(dnastar)、clustalw、clustal omega或muscle软件。本领域技术人员可以确定用于比对序列的适当参数,包括在被比较序列的全长上实现最大比对所需的任何算法。
[0076]“保守性置换”或“保守性氨基酸置换”指使用化学或功能上相似的氨基酸置换氨基酸。提供相似氨基酸的保守性置换表是本领域熟知的。例如,表2
‑
4中提供的氨基酸组在一些实施方式中被认为是彼此的保守性置换。
[0077][0078]
[0079][0080][0081]
其他保守性置换可以参见例如creighton,proteins:structures and molecular properties 2nd ed.(1993)w.h.freeman&co.,new york,ny。通过在亲本abp中制备一个或多个保守性氨基酸残基置换产生的abp称为“保守性修饰的变体”。
[0082]
术语“治疗(treating)”(及其变体,如“治疗(treat)”或“处理(treatment)”)指试图改变有需要的受试者的疾病或病症的自然过程的临床干预。治疗即可以用于预防,也可以在临床病理过程中进行。治疗的预期效果包括预防疾病的发生或复发、减轻症状、减轻疾病的任何直接或间接病理后果、预防转移、降低疾病进展速度、改善或缓解疾病状态以及缓解或改善预后。
[0083]
如本文所用,术语“治疗有效量”或“有效量”指本文提供的abp或药物组合物的量,当施用于受试者时,可有效治疗疾病或病症。
[0084]
如本文所用,术语“受试者”指哺乳动物受试者。示例性受试者包括人、猴、犬、猫、小鼠、大鼠、奶牛、马、骆驼、山羊、家兔和绵羊。在某些实施方式中,受试者是人。在一些实施方式中,受试者患有能够使用本文提供的abp治疗的疾病或病况。在一些方面中,疾病或病况是癌症。在一些方面中,疾病或病况是病毒感染。
[0085]
术语“包装说明书”用于指通常包含在治疗或诊断产品(例如,试剂盒)的商业包装中的说明书,其中包含使用此类治疗或诊断产品所关注的有关适应症、用法、剂量、给药、联合治疗、禁忌症和/或使用警告信息。
[0086]
如本文所用,术语“细胞毒剂”指抑制或阻止细胞功能和/或导致细胞死亡或破坏的物质。
[0087]“化学治疗剂”指用于治疗癌症的化学化合物。化学治疗剂包括“抗激素剂”或“内分泌治疗剂”,其作用是调节、减少、阻断或抑制可促进癌症生长的激素的作用。
[0088]
术语“细胞抑制剂”指在体外或体内阻止细胞生长的化合物或组合物。在一些实施方式中,细胞抑制剂是降低s期细胞百分比的药剂。在一些实施方式中,细胞抑制剂降低s期细胞百分比至少约20%、至少约40%、至少约60%或至少约80%。
[0089]
术语“肿瘤”指所有肿瘤细胞生长和增殖,无论是恶性的还是良性的,以及所有癌前和癌变细胞和组织。术语“癌症”、“癌性”、“细胞增殖性病症”、“增殖性病症”和“肿瘤”在本文中并不互相排斥。术语“细胞增殖性病症”和“增殖性病症”指与某些程度的异常细胞增殖相关的病症。在一些实施方式中,细胞增殖性病症是癌症。
diego,ca和baron等,1995,nucleic acids res.23:3605
–
06[0078]中描述了调控序列的其他实例。
[0102]“宿主细胞”是可用于表达核酸(例如,本公开的核酸)的细胞。宿主细胞可以是原核细胞,例如,a host cell can be a prokaryote,例如,大肠杆菌,或者其可以是真核细胞,例如,单细胞真核生物(例如,酵母或其他真菌)、植物细胞(例如,烟草或番茄植物细胞)、动物细胞(例如,人细胞、猴细胞、仓鼠细胞、大鼠细胞、小鼠细胞或昆虫细胞)或者杂交瘤。宿主细胞的实例包括cs
‑
9细胞、猴肾细胞cos
‑
7细胞系(atcc crl 1651)(参见gluzman等,1981,cell 23:175)、l细胞、c127细胞、3t3细胞(atcc ccl 163)、中国仓鼠卵巢(cho)细胞或其衍生物,如veggie cho和在无血清培养基中生长的相关细胞系(参见rasmussen等,1998,cytotechnology 28:31)、hela细胞、bhk(atcc crl 10)细胞系、来源于非洲绿猴肾细胞系cv1(atcc ccl 70)的cv1/ebna细胞系(参见mcmahan等,1991,embo j.10:2821)、人胚肾细胞,如293、293ebna或msr 293、人表皮a431细胞、人colo205细胞、其他转化的灵长类细胞系、正常二倍体细胞、来源于原代组织体外培养物的细胞系、原代外植体、hl
‑
60、u937、hak或jurkat细胞。通常,宿主细胞是可以用编码多肽的核酸转化或转染的培养细胞,然后其可以在宿主细胞中表达。
[0103]
短语“重组宿主细胞”可用于表示已用待表达的核酸转化或转染的宿主细胞。宿主细胞也可以是包含核酸但不以所需水平表达其的细胞,除非将调控序列引入宿主细胞使其与核酸可操作地连接。应理解的是,术语宿主细胞不仅指特定的受试者细胞,而且指这种细胞的后代或潜在后代。因为某些修饰可能由于例如突变或环境影响而在后续世代中发生,所以此类后代实际上可能与亲代细胞不同,但仍包括在如本文所用术语的范围内。
[0104]
7.2.其他解释性惯例
[0105]
将此处所述的范围理解为该范围内所有值的简写,包括所列举的端点。例如,将1至50的范围理解为包括来自以下的任何数字、数字组合或子范围:1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49和50。
[0106]
除非另有说明,否则提及具有一个或多个立体中心的化合物是指其每种立体异构体及其立体异构体的所有组合。
[0107]
7.3.核酸
[0108]
在一个方面中,本公开提供了分离的核酸分子。核酸包括,例如,编码全部或部分抗原结合蛋白的多核苷酸,例如,本公开的抗体的一条或两条链,或其片段、衍生物、突变蛋白或变体,足以用作杂交探针、pcr引物或测序引物以鉴定、分析、突变或扩增编码多肽的多核苷酸的多核苷酸,用于抑制多核苷酸表达的反义核酸,以及上述的互补序列。核酸可以是任何长度。例如,其长度可以是5、10、15、20、25、30、35、40、45、50、75、100、125、150、175、200、250、300、350、400、450、500、750、1,000、1,500、3,000、5,000个或更多个核苷酸,和/或可以包含一个或多个另外的序列,例如,调控序列,和/或是更大核酸(例如,载体)的一部分。核酸可以是单链的或双链的,且可以包含rna和/或dna核苷酸,及其人工变体(例如,肽核酸)。
[0109]
编码抗体多肽(例如,重链或轻链、仅可变结构域或全长)的核酸可从已用pd
‑
1免疫的小鼠的b细胞中分离。核酸可通过常规程序如聚合酶链式反应(pcr)分离。
[0110]
本文显示了编码重链可变区和轻链可变区的核酸序列。本领域技术人员将意识到的是,由于遗传密码的简并性,因而本文公开的每个多肽序列由大量其他核酸序列编码。本公开提供了编码本公开的每种抗原结合蛋白的每种简并核苷酸序列。
[0111]
本公开还提供了在特定杂交条件下与其他核酸(例如,包含任何pdcd1基因的核苷酸序列的核酸)杂交的核酸。用于杂交核酸的方法是本领域熟知的。参见,例如,curr.prot.in mol.biol.,john wiley&sons,n.y.(1989),6.3.1
‑
6.3.6。如本文所定义的,中等严格杂交条件使用含有5x氯化钠/柠檬酸钠(ssc)的预洗涤溶液、0.5%sds、1.0mm edta(ph 8.0)、约50%甲酰胺的杂交缓冲液、6x ssc和55℃的杂交温度(或其他类似杂交溶液,如含有约50%甲酰胺的溶液,及杂交温度42℃)以及60℃,在0.5x ssc、0.1%sds中的洗涤条件。严格杂交条件在6x ssc中45℃下杂交,然后在0.1x ssc、0.2%sds中68℃下洗涤一次或多次。此外,本领域技术人员可以操纵杂交和/或洗涤条件以增加或降低杂交的严格性,使得包含彼此至少65、70、75、80、85、90、95、96、97、98或99%相同的核苷酸序列的核酸通常保持彼此杂交。影响杂交条件选择的基本参数和设计适宜条件的指导原则通过,例如,sambrook,fritsch和maniatis(1989,molecular cloning:a laboratory manual,cold spring harbor laboratory press,cold spring harbor,n.y.,第9章和第11章;以及curr.prot.in mol.biol.1995,ausubel等编著,john wiley&sons,inc.,第2.10和6.3
‑
6.4节)给出,并且可以由本领域普通技术人员基于例如dna的长度和/或碱基组成容易地确定。
[0112]
可以通过突变将改变引入核酸中,从而导致其编码的多肽(例如,抗原结合蛋白)的氨基酸序列发生改变。可以使用本领域公知的任何技术引入突变。在一个实施方式中,使用例如定点诱变方案改变一个或多个特定氨基酸残基。在另一个实施方式中,使用例如随机诱变方案改变一个或多个随机选择的残基。无论其是如何制备的,可以表达和筛选突变多肽的所需性质(例如,与pd
‑
1结合)。
[0113]
可以将突变引入核酸中而不显著改变其编码的多肽的生物活性。例如,可以进行核苷酸取代,导致在非必需氨基酸残基处的氨基酸置换。在一个实施方式中,本文提供的针对pd
‑
1或其所需片段、变体或衍生物的核苷酸序列被突变,以使得其编码包含一个或多个氨基酸残基的缺失或置换的氨基酸序列,其在本文中针对pd
‑
1显示为其中两个或更多个序列不同的残基。或者,可以将一个或多个突变引入核酸中,其选择性地改变其编码的多肽的生物学活性(例如,pd
‑
1的结合)。例如,突变可以定量或定性地改变生物学活性。定量改变的实例包括增加、减少或消除活性。定性改变的实例包括改变抗原结合蛋白的抗原特异性。
[0114]
在另一方面中,本公开提供了适合用作用于检测本公开的核酸序列的引物或杂交探针的核酸分子。本公开的核酸分子可以仅包含编码本公开的全长多肽的核酸序列的一部分,例如,可用作探针或引物的片段或者编码本公开多肽的活性部分(例如,pd
‑
1结合部分)的片段。
[0115]
基于本公开的核酸序列的探针可用于检测核酸或类似核酸,例如,编码本公开的多肽的转录物。探针可以包含标记基团,例如,放射性同位素、荧光化合物、酶或酶辅因子。可以将此类探针用于鉴定表达该多肽的细胞。
[0116]
7.4.表达载体
[0117]
本公开提供了包含编码本公开的多肽或其部分的核酸的载体。载体的实例包括但不限于质粒、病毒载体、非游离基因哺乳动物载体和表达载体,例如,重组表达载体。
[0118]
在本公开的另一个方面中,还提供了包含本公开的核酸分子和多核苷酸的表达载体和使用此类载体转化的宿主细胞,以及还提供了生产多肽的方法。术语“表达载体”指用于从多核苷酸序列表达多肽的质粒、噬菌体、病毒或载体。用于表达多肽的载体包含载体增殖和克隆插入片段表达所需的最少序列。表达载体包含转录单元,其包含以下组件:(1)在基因表达中具有调控作用的一个或多个遗传元件,例如,启动子或增强子,(2)编码多肽和蛋白的序列,可转录成mrna并翻译成蛋白,和(3)适合的转录起始和终止序列。这些序列可以进一步包含选择性标记物。适合在宿主细胞中表达的载体很容易获得,并且使用标准重组dna技术将核酸分子插入到载体中。此类载体可以包括在特定组织中起作用的启动子,以及用于在目标人或动物细胞中表达多肽的病毒载体。
[0119]
本公开的重组表达载体可以包含适于在宿主细胞中表达核酸的形式的本公开的核酸。重组表达载体包含一个或多个基于待用于表达的宿主细胞选择的调控序列,其与待表达的核酸序列可操作地连接。调控序列包括在很多类型的宿主细胞中指导核苷酸序列组成型表达的那些序列(例如,sv40早期基因增强子、劳斯肉瘤病毒启动子和巨细胞病毒启动子)、指导核苷酸序列仅在某些宿主细胞中表达的那些序列(例如,组织特异性调控序列,参见voss等,1986,trends biochem.sci.11:287,maniatis等,1987,science 236:1237,其全部内容通过引用并入本文)以及指导核苷酸序列响应特定治疗或病况的可诱导表达的那些序列(例如,在哺乳动物细胞中的金属硫蛋白启动子以及原核和真核系统中的tet响应性和/或链霉素响应性启动子(参见同上))。本领域技术人员将意识到的是,表达载体的设计可以取决于诸如待转化宿主细胞的选择、所需蛋白的表达水平等因素。可以将本公开的表达载体引入宿主细胞,从而生产由如本文所述的核酸编码的蛋白或肽,包括融合蛋白或肽。
[0120]
在一些实施方式中,表达载体是从以atcc保藏号pta
‑
125509保藏的pd
‑
1结合克隆文库的克隆之一纯化的表达载体。在一些实施方式中,表达载体是通过对从以atcc保藏号pta
‑
125509保藏的pd
‑
1结合克隆文库纯化的克隆之一中的表达载体之一进行遗传修饰而产生的。在一些实施方式中,表达载体是通过使用以atcc登录号pta
‑
125509保藏的pd
‑
1结合克隆文库的克隆之一的重链和轻链可变区序列产生的。
[0121]
本公开还提供了制备多肽的方法。可以利用多种其他表达/宿主系统。可以通过常规转化或转染技术将载体dna引入原核或真核系统。这些系统包括但不限于微生物,如使用重组噬菌体、质粒或粘粒dna表达载体转化的细菌(例如,大肠杆菌);使用酵母表达载体转化的酵母;使用病毒表达载体(例如,杆状病毒)感染的昆虫细胞系统;使用病毒表达载体(例如,花椰菜花叶病毒,camv;烟草花叶病毒,tmv)转染的或使用细菌表达载体(例如,ti或pbr322质粒)转化的植物细胞系统;或者动物细胞系统。在重组蛋白生产中使用的哺乳动物细胞包括但不限于vero细胞、hela细胞、中国仓鼠卵巢(cho)细胞系或其衍生物,如veggie cho和在无血清培养基中生长的相关细胞系(参见rasmussen等,1998,cytotechnology 28:31)或cho细胞株dx
‑
b11,其在dhfr中存在缺陷(参见urlaub等,1980,proc.natl.acad.sci.usa 77:4216
‑
20)、cos细胞,如猴肾细胞cos细胞系(atcc crl 1651)(参见gluzman等,1981,cell 23:175)、w138、bhk、hepg2、3t3(atcc ccl 163)、rin、mdck、a549、pc12、k562、l细胞、c127细胞、bhk(atcc crl 10)细胞系、来源于非洲绿猴肾细胞系cv1(atcc ccl 70)的cv1/ebna细胞系(参见mcmahan等,1991,embo j.10:2821)、人胚肾细胞,如293、293ebna或msr 293、人表皮a431细胞、人colo205细胞、其他转化的灵长类细胞
系、正常二倍体细胞、来源于原代组织体外培养物的细胞株、原代外植体、hl
‑
60、u937、hak或jurkat细胞。哺乳动物表达允许生产可以从生长培养基中回收的分泌或可溶性多肽。
[0122]
对于哺乳动物细胞的稳定转染,众所周知,根据所使用的表达载体和转染技术,只有一小部分细胞可以将外源dna整合到其基因组中。为了鉴定和选择这些整合体,通常将编码选择性标记物(例如,针对抗生素抗性)的基因与目标基因一起引入宿主细胞。例如,一旦用包含选择性标记物以及所需表达盒的载体转化此类细胞,就可以让细胞在富集培养基中生长,然后再将其转换为选择性培养基。将选择性标记物设计为允许成功表达引入序列的细胞生长和回收。可以使用适合于所用细胞系的组织培养技术来增殖稳定转化细胞的抗性团块(clump)。重组蛋白表达的综述参见methods of enzymology,v.185,goeddell,d.v.,ed.,academic press(1990)。优选的选择性标记物包括赋予药物抗性的哪些,如g418、潮霉素和甲氨蝶呤。用引入的核酸稳定转染的细胞可以通过药物选择(例如,掺入选择性标记物基因的细胞将存活,而其他细胞死亡)等方法进行鉴定。
[0123]
可以在促进多肽表达的条件下培养转化的细胞,并通过常规蛋白质纯化程序回收多肽(如上文所定义)。一种此类纯化程序包括使用亲和层析,例如,在具有与其结合的pd
‑
1的全部或部分(例如,胞外结构域)的基质上。预期用于本文的多肽包括基本上不含污染性内源材料的基本上均质的重组哺乳动物抗pd
‑
1抗体多肽。
[0124]
在一些情况下,如在使用原核系统的表达中,本公开的表达多肽可能需要“重折叠”并氧化成适当的三级结构和生成的二硫键以具有生物活性。可以使用本领域众所周知的多种程序实现重折叠。此类方法包括例如在离液剂存在下将溶解的多肽暴露于通常高于7的ph。离液剂的选择类似于用于包含体溶解的选择;然而,离液体通常以较低的浓度使用。示例性离液剂是胍和尿素。在大多数情况下,重折叠/氧化溶液还将包含特定比例的还原剂及其氧化形式,以产生特定的氧化还原电位,允许发生二硫化物重排以形成半胱氨酸桥。一些常用的氧化还原对包括半胱氨酸/胱胺、谷胱甘肽/二硫代双gsh、氯化铜、二硫苏糖醇dtt/二噻烷dtt和2
‑
巯基乙醇(bme)/二硫代
‑
bme。在很多情况下,可以使用共溶剂来提高重折叠的效率。常用的助溶剂包括甘油、各种分子量的聚乙二醇和精氨酸。
[0125]
此外,多肽可以根据常规技术在溶液中或在固体支持物上合成。各种自动合成器是可商购的并且可以根据已知方案使用。参见,例如,stewart和young,solid phase peptide synthesis,2d.ed.,pierce chemical co.(1984);tam等,j am chem soc,105:6442,(1983);merrifield,science 232:341
‑
347(1986);barany和merrifield,the peptides,gross and meienhofer,eds,academic press,new york,1
‑
284;barany等,int j pep protein res,30:705
‑
739(1987)。
[0126]
本公开的多肽和蛋白可以根据本领域技术人员公知的蛋白纯化技术进行纯化。这些技术在一个层面上涉及蛋白和非蛋白级分的粗分馏。将肽多肽与其他蛋白分离后,可以使用色谱和电泳技术进一步纯化目标肽或多肽以实现部分或完全纯化(或纯化至均质)。如本文所用,术语“纯化的多肽”旨在指一种组合物,其与其他组分分离,其中多肽相对于其天然可获得的状态被纯化至任何程度。因此,纯化的多肽也指脱离其可能天然存在的环境的多肽。通常,“纯化的”将指经过分级分离以去除各种其他组分的多肽组合物,并且所述组合物基本上保留了其表达的生物活性。当使用术语“基本上纯化的”时,该名称将指肽或多肽组合物,其中多肽或肽构成组合物的主要组分,如构成约50%、约60%、约70%、约80%、约
services,phs,nih,nih出版物编号91
‑
3242,1991的定义。
[0135]
术语“人抗体”,也称为“全人抗体”包括具有一个或多个来源于人免疫球蛋白序列的可变区和恒定区的所有抗体。在一个实施方式中,全部的可变和恒定结构域来源于人免疫球蛋白序列(全人抗体)。这些抗体可以以多种方式制备,其实例如下所述,包括通过用小鼠的目的抗原免疫接种,所述小鼠经遗传修饰以表达来源于人重链和/或轻链编码基因的抗体。
[0136]
人源化抗体的序列与来源于非人物种的抗体的序列不同,其通过一个或多个氨基酸置换、缺失和/或添加,以使得当将其施用于人受试者时,与非人物种抗体相比,人源化抗体不太可能诱导免疫应答,和/或诱导不严重的免疫应答。在一个实施方式中,在非人物种抗体的重链和/或轻链的框架和恒定结构域中的某些氨基酸被突变以产生人源化抗体。在另一个实施方式中,人抗体的一个或多个恒定结构域融合至非人物种的一个或多个可变结构域。在另一个实施方式中,当非人抗体施用于人受试者时,改变非人抗体的一个或多个cdr序列中的一个或多个氨基酸残基以降低非人抗体可能的免疫原性,其中改变的氨基酸残基对于抗体与其抗原的免疫特异性结合不是关键的,或者对氨基酸序列所做的改变是保守的改变,以使得人源化抗体与抗原的结合不明显比非人抗体与抗原的结合差。如何制备人源化抗体的实例可以参见美国专利号6,054,297、5,886,152和5,877,293。
[0137]
术语“嵌合抗体”指包含来自一种抗体的一个或多个区域和来自一种或多种其他抗体的一个或多个区域的抗体。在一个实施方式中,一个或多个cdr来源于人抗pd
‑
1抗体。在另一个实施方式中,所有cdr来源于人抗pd
‑
1抗体。在另一个实施方式中,来自一种以上人抗pd
‑
1抗体的cdr在嵌合抗体中混合和匹配。例如,嵌合抗体可以包含来自第一人抗pd
‑
1抗体轻链的cdr1、来自第二人pd
‑
1抗体轻链的cdr2和cdr3及来自第三抗pd
‑
1抗体重链的cdr。此外,框架区可以来源于相同抗pd
‑
1抗体之一,来源于一种或多种不同抗体(如人抗体)或来源于人源化抗体。在嵌合抗体的一个实例中,重链和/或轻链的一部分与来自特定物种或属于特定抗体类别或亚类的抗体相同、与其同源或来源于该抗体,而该链的其余部分与来自另一物种或属于另一抗体类别或亚类的抗体相同、与其同源或来源于该抗体。还包括显示出所需生物活性(即,特异性结合pd
‑
1的能力)的此类抗体的片段。
[0138]
依照本说明书的教导并使用本领域众所周知的技术,本领域普通技术人员可以容易地制备抗体的片段或类似物。优选的片段或类似物的氨基和羧基末端出现在功能性结构域的边界附近。可以通过将核苷酸和/或氨基酸序列数据与公共或专有序列数据库进行比较来鉴定结构和功能结构域。计算机化的比较方法可用于鉴定存在于其他已知结构和/或功能的蛋白中的序列基序或预测的蛋白构象结构域。鉴定折叠成已知三维结构的蛋白序列的方法是已知的。参见,例如,bowie等,1991,science 253:164。
[0139]
来源于抗体的抗原结合片段可以,例如,通过抗体的蛋白水解,例如,根据常规方法的完整抗体的胃蛋白酶或木瓜蛋白酶消化获得。例如,抗体片段可以通过用胃蛋白酶对抗体进行酶切来产生,以提供称为f(ab’)2的5s片段。还可以使用巯基还原剂进一步切割该片段以产生3.5s fab’单价片段。任选地,可以使用由二硫键断裂产生的巯基的保护基团来进行切割反应。作为替代方案,使用木瓜蛋白酶的酶切可直接产生两个单价fab片段和一个fc片段。这些方法在例如goldenberg,美国专利号4,331,647,nisonoff等,arch.biochem.biophys.89:230,1960;porter,biochem.j.73:119,1959;edelman等,
methods in enzymology 1:422(academic press 1967);和andrews,s.m.和titus,j.a.current protocols in immunology(coligan j.e.,等编著),john wiley&sons,new york(2003),第2.8.1 2.8.10和2.10a.12.10a.5页中进行了描述。也可以使用其他切割抗体的方法,如分离重链以形成单价轻重链片段(fd)、进一步切割片段或其他酶促、化学或遗传技术,只要片段与被完整抗体识别的抗原结合即可。
[0140]
抗体片段还可以是任何合成或基因工程化蛋白。例如,抗体片段包括由轻链可变区组成的分离的片段、由重链和轻链的可变区组成的“fv”片段、其中轻链和重链可变区通过肽接头连接的重组单链多肽分子(scfv蛋白)。
[0141]
抗体片段的另一种形式是包含抗体的一个或多个互补性决定区(cdr)的肽。cdr(也称为“最小识别单元”或“高变区”)可以共价或非共价掺入分子中,使其成为抗原结合蛋白。cdr可以通过构建编码目标cdr的多核苷酸获得。此类多核苷酸例如通过使用聚合酶链式反应以抗体产生细胞的mrna作为模板合成可变区制备(参见,例如,larrick等,methods:a companion to methods in enzymology 2:106,1991;courtenay luck,“genetic manipulation of monoclonal antibodies,”monoclonal antibodies:production,engineering and clinical application,ritter等编著,第166页(cambridge university press 1995);和ward等,“genetic manipulation and expression of antibodies,”monoclonal antibodies:principles and applications,birch等编著,第137页(wiley liss,inc.1995))。
[0142]
因此,在一个实施方式中,结合剂包含如本文所述的至少一个cdr。结合剂可以包含如本文所述的至少2、3、4、5或6个cdr。结合剂还可以包含本文所述的抗体的至少一个可变区结构域。可变区结构域可以是任何尺寸或氨基酸组成,并且将通常包含至少一个负责结合人pd
‑
1的cdr序列(例如,cdr1
‑
h、cdr2
‑
h、cdr3
‑
h、cdr1
‑
l、cdr2
‑
l和cdr3
‑
l,具体如本文所述的),并且其与一个或多个框架序列相邻或同框。一般而言,可变(v)区结构域可以是免疫球蛋白重(v
h
)和/或轻(v
l
)链可变结构域的任何适宜排列。因此,例如,v区结构域可以是单体,并且可以是v
h
或v
l
结构域,其能够以如下所述的至少等于1x107m或更低的亲和力独立地结合人pd
‑
1。或者,v区结构域可以是二聚的,并且包含v
h v
h
、v
h v
l
或v
l v
l
二聚体。v区二聚体包含可以是非共价结合的至少一个v
h
和至少一个v
l
链(下文中称为f
v
)。如果需要,链可以直接共价偶联,例如,通过两个可变结构域之间的二硫键,或通过接头,例如肽接头,偶联以形成单链fv(scfv)。
[0143]
可变区结构域可以是任何天然存在的可变结构域或其工程化形式。工程化形式指使用重组dna工程技术创建的可变区结构域。此类工程化形式包括例如通过在特定抗体的氨基酸序列中插入、缺失或改变而从特定抗体可变区产生的那些。具体实例包括工程化的可变区结构域,其含有来自第一抗体的至少一个cdr和任选地一个或多个框架氨基酸以及来自第二抗体的可变区结构域的其余部分。
[0144]
可变区结构域可以在c末端氨基酸处共价连接至至少一个其他抗体结构域或其片段。因此,例如,在可变区结构域中存在的v
h
结构域可以连接至免疫球蛋白ch1结构域或其片段。类似地,v
l
结构域可以连接至ck结构域或其片段。以这种方式,例如,抗体可以是fab片段,其中抗原结合结构域含有相关的v
h
和v
l
结构域,在其c末端分别与ch1和ck结构域共价连接。ch1结构域可以用更多氨基酸延伸,例如以提供在fab’片段中发现的铰链区或铰链区
结构域的一部分,或者以提供更多结构域,如抗体ch2和ch3结构域。
[0145]
如本文所述,抗体包含至少一个这些cdr。例如,可以将一个或多个cdr引入已知抗体框架区(igg1、igg2等),或缀合至适宜载剂以增强其半衰期。适宜载剂包括但不限于fc、聚乙二醇(peg)、白蛋白、转铁蛋白等。这些和其他适宜载剂是本领域公知的。此类缀合的cdr肽可以是单体、二聚体、四聚体或其他形式。在一个实施方式中,一种或多种水溶性聚合物键合在粘合剂的一个或多个特定位置,例如氨基末端。
[0146]
在另一个实例中,来自抗体(即,pd
‑
1抗体)的单个v
l
或v
h
链可用于搜寻可以形成具有相同特异性的抗原结合片段(或fab)的其他v
h
或v
l
链。因此,v
h
和v
l
链ig基因的随机组合可以在噬菌体文库(如fd或λ噬菌体)中表达为抗原结合片段。例如,组合文库可以通过分别利用与抗原结合特异性v
l
或v
h
链文库组合的亲本v
l
或v
h
链文库来产生。然后,可以通过常规技术筛选组合文库,例如通过使用放射性标记的探针(如放射性标记的pd
‑
1)。参见,例如,portolano等,j.immunol.v.150(3)pp.880
‑
887(1993)。
[0147]
双体抗体是包含两条多肽链的二价抗体,其中每条多肽链包含由接头连接的vh和vl结构域,该接头太短而不能在同一条链上的两个结构域之间配对,从而允许每个结构域与另一条多肽链上的互补结构域配对(参见,例如,holliger等,1993,proc.natl.acad.sci.usa 90:6444
‑
48,和poljak等,1994,structure 2:1121
‑
23)。如果双体抗体的两条多肽链相同,则由其配对产生的双体抗体将具有两个相同的抗原结合位点。具有不同序列的多肽链可以用于制备具有两个不同抗原结合位点的双体抗体。类似地,三体抗体和四体抗体是分别包含三条和四条多肽链,并分别形成三个和四个抗原结合位点的抗体,其可以是相同的或不同的。
[0148]
在美国专利号6,703,199中还公开了抗体多肽,包括纤连蛋白多肽单体。在美国专利公开号2005/0238646中公开了其他抗体多糖,其是单链多肽。
[0149]
在某些实施方式中,抗体包含一个或多个水溶性聚合物连接物,包括但不限于聚乙二醇、聚氧乙二醇或聚丙二醇。参见,例如,美国专利号4,640,835、4,496,689、4,301,144、4,670,417、4,791,192和4,179,337。在某些实施方式中,衍生的结合剂包括单甲氧基
‑
聚乙二醇、葡聚糖、纤维素或其他碳水化合物基聚合物、聚
‑
(n
‑
乙烯基吡咯烷酮)
‑
聚乙二醇、丙二醇均聚物、聚环氧丙烷/环氧乙烷共聚物、聚氧乙烯化多元醇(例如,甘油)和聚乙烯醇的一种或多种,以及此类聚合物的混合物。在某些实施方式中,一种或多种水溶性聚合物随机附接至一条或多条侧链。在某些实施方式中,peg能够起到提高结合剂(如抗体)的治疗能力的作用。例如,在美国专利号6,133,426中讨论了某些此类方法,出于任何目标将其通过引用并入本文。
[0150]
7.6.抗原结合蛋白
[0151]
在一个方面中,本公开提供了结合pd
‑
1的抗原结合蛋白(例如,抗体、抗体片段、抗体衍生物、抗体突变蛋白和抗体变体)。
[0152]
抗原结合蛋白可以具有例如天然存在的免疫球蛋白结构。“免疫球蛋白”是四聚化分子。在天然存在的免疫球蛋白中,每个四聚体由两对相同的多肽链组成,每对具有一条“轻”链(约25kda)和一条“重”链(约50
‑
70kda)。每条链的氨基末端部分包含主要负责抗原识别的约100至110个或更多个氨基酸的可变区。每条链的羧基末端部分定义了一个主要负责效应功能的恒定区。人轻链分为κ轻链和λ轻链。重链分为μ、δ、γ、α或ε,并将抗体的同种
型分别定义为igm、igd、igg、iga和ige。在轻链和重链内,可变区和恒定区由约12个或更多氨基酸的“j”区连接,重链还包含约10个或更多个氨基酸的“d”区。通常参见,fundamental immunology ch.7(paul,w.编著,2nd ed.raven press,n.y.(1989))(出于所有目的其全部内容通过引用并入)。每个轻/重链对的可变区形成抗体结合位点,以使得完整的免疫球蛋白具有两个结合位点。
[0153]
根据本公开的抗原结合蛋白包括抑制pd
‑
1的生物学活性的抗原结合蛋白。
[0154]
不同的抗原结合蛋白可与pd
‑
1的不同结构域结合或通过不同作用机制发挥作用。如本文中特别指出的,除非另有说明,结构域区域被指定以包括该组。例如,氨基酸4
‑
12指9个氨基酸:在位置4和12的氨基酸,以及在该序列中的七个中间氨基酸。其他实例包括抑制pd
‑
1与pd
‑
l1结合的抗原结合蛋白。抗原结合蛋白无需完全抑制pd
‑
1诱导的活性即可用于本公开;相反,也考虑使用降低pd
‑
1特定活性的抗原结合蛋白。(本文对pd
‑
1结合抗原结合蛋白在治疗特定疾病中的特定作用机制的讨论仅是说明性的,本文提出的方法不限于此。)
[0155]
在另一个方面中,本公开提供了抗原结合蛋白,其包含选自以下的轻链可变区:a1lc
‑
a28lc,或选自以下的重链可变区:a1hc
‑
a28hc,及其片段、衍生物、突变蛋白和变体。此类抗原结合蛋白可以使用命名法“lxhy”表示,其中“x”对应于轻链可变区的数量和“y”对应于重链可变区的数量,如其在以下序列中被标记的。也就是说,例如,“a1hc”表示包含seq id no:101的氨基酸序列的重链可变区;“a1lc”表示包含seq id no:1的氨基酸序列的轻链可变区,等等。更一般来说,“l2h1”指具有包含l2的氨基酸序列的轻链可变区(seq id no:2)和包含h1的氨基酸序列的重链可变区(seq id no:101)的抗原结合蛋白。为清楚起见,由组的至少两个成员表示的所有范围包括组中的所有成员,包括末端范围成员。因此,组范围a1
‑
a28,包括a1至a28之间的所有成员,以及成员a1和a28本身。组范围a4
‑
a6包括成员a4、a5和a6等。
[0156]
在一些实施方式中,抗原结合蛋白包含与以atcc登录号pta
‑
125509保藏的pd
‑
1结合克隆文库中的一个克隆相同的重链和轻链序列的可变(v(d)j)区。在一些实施方式中,抗原结合蛋白包含与以atcc登录号pta
‑
125509保藏的pd
‑
1结合克隆文库中的一个克隆相同的重链或轻链序列的可变(v(d)j)区。在一些实施方式中,抗原结合蛋白从以atcc登录号pta
‑
125509保藏的pd
‑
1结合克隆文库的一个克隆中的表达载体表达。
[0157]
下面还显示了形成抗原结合位点的部分的cdr(下划线)的位置,而框架区(fr)是这些可变域序列的中间区段。在轻链可变区和重链可变区中,有三个cdr(cdr1
‑
3)和四个fr(fr 1
‑
4)。每条轻链和重链的cdr区也按抗体类型(a1、a2、a3等)分组。本公开的抗原结合蛋白包括,例如,具有选自由以下组成的组合的组的轻链和重链可变结构域组合的抗原结合蛋白:l1h1(抗体a1)、l2h2(抗体a2)、l3h3(抗体a3)、l4h4(抗体a4)、l5h5(抗体a5)、l6h6(抗体a6)、l7h7(抗体a7)、l8h8(抗体a8)、l9h9(抗体a9)、l10h10(抗体a10)、l11h11(抗体a11)、l12h12(抗体a12)、l13h13(抗体a13)、l14h14(抗体14)、l15h15(抗体15)、l16h16(抗体16)、l17h17(抗体17)、l18h18(抗体18)、l19h19(抗体19)、l20h20(抗体20)、l21h21(抗体21)、l22h22(抗体22)、l23h23(抗体23)、l24h24(抗体24)、l25h25(抗体25)、l26h26(抗体26)、l27h27(抗体27)和l28h28(抗体28)。
[0158]
在一些实施方式中,抗原结合蛋白包含与以atcc登录号pta
‑
125509保藏的pd
‑
1结合克隆文库中的克隆之一相同的所有六个cdr序列(轻链的三个cdr和重链的三个cdr)。在
一些实施方式中,抗原结合蛋白包含与以atcc登录号pta
‑
125509保藏的pd
‑
1结合克隆文库中的克隆之一相同的六个cdr序列(轻链的三个cdr和重链的三个cdr)中的三个。在一些实施方式中,抗原结合蛋白包含与以atcc登录号pta
‑
125509保藏的pd
‑
1结合克隆文库中的克隆之一相同的六个cdr序列中的一个、两个、三个、四个或五个。
[0159]
在一个实施方式中,本公开提供了包含轻链可变结构域的抗原结合蛋白,所述轻链可变结构域包含的氨基酸序列与选自l1至l28的轻链可变结构域的序列仅在15、14、13、12、11、10、9、8、7、6、5、4、3、2或1个残基处不同,其中每个此类序列差异独立地是一个氨基酸残基的缺失、插入或置换。在另一个实施方式中,轻链可变结构域包含与选自l1
‑
l28的轻链可变结构域的序列具有至少70%、75%、80%、85%、90%、95%、96%、97%、98%或99%同一性的氨基酸序列。在另一个实施方式中,轻链可变结构域包含由与编码选自l1
‑
l28(其包括l1、l2、l3、l4、l5、l6、l7、l8、l9、l10、l11、l12、l13、l14、l15、l16、l17、l18、l19、l20、l21、l22、l23、l24、l25、l26、l27和l28)的轻链可变结构域的核苷酸序列具有至少70%、75%、80%、85%、90%、95%、96%、97%、98%或99%同一性的核苷酸序列编码的氨基酸序列。在另一个实施方式中,轻链可变结构域包含由多核苷酸编码的氨基酸序列,该多核苷酸在中等严格条件下与编码选自l1
‑
l28的轻链可变结构域的多核苷酸的互补序列杂交。在另一个实施方式中,轻链可变结构域包含由多核苷酸编码的氨基酸序列,该多核苷酸在中等严格条件下与编码选自l1
‑
l28的轻链可变结构域的多核苷酸的互补序列杂交。在另一个实施方式中,轻链可变结构域包含由多核苷酸编码的氨基酸序列,该多核苷酸在中等严格条件下与l1
‑
l28的轻链多核苷酸的互补序列杂交。
[0160]
在一个实施方式中,本公开提供了包含轻链可变结构域的抗原结合蛋白,所述轻链可变结构域包含仅在15、14、13、12、11、10、9、8、7、6、5、4、3、2或1个残基处不同于由以atcc登录号pta
‑
125509保藏的pd
‑
1结合克隆文库中的一个克隆编码的轻链可变域序列的氨基酸序列,其中每个此类序列差异独立地是一个氨基酸残基的缺失、插入或置换。在另一个实施方式中,轻链可变结构域包含与由以atcc登录号pta
‑
125509保藏的pd
‑
1结合克隆文库中的一个克隆编码的轻链可变结构域的序列具有至少70%、75%、80%、85%、90%、95%、96%、97%、98%或99%同一性的氨基酸序列。在另一个实施方式中,轻链可变结构域包含由与以atcc登录号pta
‑
125509保藏的pd
‑
1结合克隆文库中的一个克隆的核苷酸序列具有至少70%、75%、80%、85%、90%、95%、96%、97%、98%或99%同一性的核苷酸序列编码的氨基酸序列。
[0161]
在另一个实施方式中,本公开提供了抗原结合蛋白,其包含重链可变结构域,所述重链可变结构域包含的氨基酸序列与选自h1至h28的重链可变结构域的序列仅在15、14、13、12、11、10、9、8、7、6、5、4、3、2或1个残基不同,其中每个此类序列的差异独立地是一个氨基酸残基的缺失、插入或置换。在另一个实施方式中,重链可变结构域包含与选自由h1
‑
h28组成的组的重链可变结构域的序列具有至少70%、75%、80%、85%、90%、95%、96%、97%、98%或99%同一性的氨基酸序列。在另一个实施方式中,重链可变结构域包含由与编码选自由h1
‑
h28组成的组的重链可变结构域的核苷酸序列具有至少70%、75%、80%、85%、90%、95%、96%、97%、98%或99%同一性的核苷酸序列编码的氨基酸序列。在另一个实施方式中,重链可变结构域包含由多核苷酸编码的氨基酸序列,该多核苷酸在中等严格条件下与编码选自由h1
‑
h28组成的组的重链可变结构域的多核苷酸的互补序列杂交。在
另一个实施方式中,重链可变结构域包含由多核苷酸编码的氨基酸序列,该多核苷酸在中等严格条件下与编码选自由h1
‑
h28组成的组的重链可变结构域的多核苷酸的互补序列杂交。在另一个实施方式中,重链可变结构域包含由多核苷酸编码的氨基酸序列,该多核苷酸在中等严格条件下与本文公开的重链多核苷酸的互补序列杂交。
[0162]
在一个实施方式中,本公开提供了包含重链可变结构域的抗原结合蛋白,所述重链可变结构域包含仅在15、14、13、12、11、10、9、8、7、6、5、4、3、2或1个残基处不同于由以atcc登录号pta
‑
125509保藏的pd
‑
1结合克隆文库中的一个克隆编码的重链可变域序列的氨基酸序列,其中每个此类序列差异独立地是一个氨基酸残基的缺失、插入或置换。在另一个实施方式中,重链可变结构域包含与由以atcc登录号pta
‑
125509保藏的pd
‑
1结合克隆文库中的一个克隆编码的重链可变结构域的序列具有至少70%、75%、80%、85%、90%、95%、96%、97%、98%或99%同一性的氨基酸序列。在另一个实施方式中,重链可变结构域包含由与以atcc登录号pta
‑
125509保藏的pd
‑
1结合克隆文库中的一个克隆的核苷酸序列具有至少70%、75%、80%、85%、90%、95%、96%、97%、98%或99%同一性的核苷酸序列编码的氨基酸序列。
[0163]
本公开的抗原结合蛋白的特定实施方式包含与本文提及的一个或多个cdr和/或fr的氨基酸序列相同的一个或多个氨基酸序列。在一个实施方式中,抗原结合蛋白包含如上所示的轻链cdr1序列。在另一个实施方式中,抗原结合蛋白包含如上所示的轻链cdr2序列。在另一个实施方式中,抗原结合蛋白包含如上所示的轻链cdr3序列。在另一个实施方式中,抗原结合蛋白包含如上所示的重链cdr1序列。在另一个实施方式中,抗原结合蛋白包含如上所示的重链cdr2序列。在另一个实施方式中,抗原结合蛋白包含如上所示的重链cdr3序列。
[0164]
在一个实施方式中,本公开提供了抗原结合蛋白,其包含一个或多个cdr序列,所述cdr序列与上述cdr序列的差异不超过5、4、3、2或1个氨基酸残基。
[0165]
在一些实施方式中,至少一个抗原结合蛋白的cdr1序列是来自如表5或表9中所示的a1
‑
a28的cdr1序列,cdr1
‑
l1至28或cdr1
‑
h1至28,或者如在表7中所示的其共有序列。在一些实施方式中,至少一个抗原结合蛋白的cdr2序列是来自如表5或表9中所示的a1
‑
a28的cdr2序列,cdr2
‑
l1至28或cdr2
‑
h1至28,或者如在表7中所示的其共有序列。在一些实施方式中,至少一个抗原结合蛋白的cdr3序列是来自如表5或表9中所示的a1
‑
a28的cdr3序列,cdr3
‑
l1至28或cdr3
‑
h1至28,或者如在表7中所示的其共有序列。
[0166]
在另一个实施方式中,抗原结合蛋白的轻链cdr3序列是来自如表5或表9中所示的a1
‑
a28的cdr3序列或cdr3
‑
l1至28,或在表7中所示的其共有序列,以及抗原结合蛋白的重链cdr3序列是来自如表5或表9中所示的a1
‑
a28的重链序列或cdr3
‑
h1至28,或在表7中所示的其共有序列。
[0167]
在另一个实施方式中,抗原结合蛋白包含1、2、3、4或5个cdr序列,其各自独立地与a1
‑
a28的cdr序列相差6、5、4、3、2、1或0个单氨基酸添加、置换和/或缺失,以及抗原结合蛋白还包含1、2、3、4或5个cdr序列,其各自独立地与cdr序列相差6、5、4、3、2、1或0个单氨基酸添加、置换和/或缺失。在一些实施方式中,抗原结合蛋白包含1、2、3、4或5个cdr序列,其每个与a1
‑
a28的cdr序列具有至少50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%或99%序列同一性。
[0168]
a1
‑
a28的核苷酸序列或a1
‑
a28的氨基酸序列可以,例如,通过随机诱变或通过定点诱变(例如,寡核苷酸定向位点特异性诱变)改变以产生改变的多核苷酸,与未突变的多核苷酸相比,其包含一个或多个特定核苷酸取代、缺失或插入。用于进行此类改变的技术的实例描述于walder等,1986,gene 42:133;bauer等,1985,gene 37:73;craik,biotechniques,1985年1月,12
‑
19;smith等,1981,genetic engineering:principles and methods,plenum press;和美国专利号4,518,584和4,737,462中。这些和其他方法可以用于制备,例如,具有所需性质的抗pd
‑
1抗体的衍生物,例如,与未衍生化的抗体相比增加的对pd
‑
1的亲和力、亲合力或特异性,增加的体内或体外活性或稳定性,或降低的体内副作用。
[0169]
本公开范围内的抗pd
‑
1抗体的其他衍生物包括抗pd
‑
1抗体或其片段与其他蛋白质或多肽的共价或聚集缀合物,如通过表达包含与抗pd
‑
1抗体多肽的n
‑
末端或c
‑
末端融合的异源多肽的重组融合蛋白。例如,缀合的肽可以是异源信号(或前导)多肽,例如,酵母α因子前导或诸如表位标签的肽。含抗原结合蛋白的融合蛋白可以包含添加的肽以便于抗原结合蛋白的纯化或鉴定(例如,聚
‑
his)。抗原结合蛋白还可以连接至flag肽asp
‑
tyr
‑
lys
‑
asp
‑
asp
‑
asp
‑
asp
‑
lys(dykddddk)(seq id no:12191),如在hopp等,bio/technology 6:1204,1988和u.s.专利5,011,912中所描述的。flag肽具有高度抗原性,并提供被特定单克隆抗体(mab)可逆结合的表位,从而能够快速测定和轻松纯化表达的重组蛋白。可用于制备其中flag肽与给定多肽融合的融合蛋白的试剂是可商购的(sigma,st.louis,mo)。
[0170]
在pct申请wo 93/10151(通过引用在此并入)中描述的一种合适的fc多肽是从人igg1抗体fc区的n
‑
末端铰链区延伸至天然c
‑
末端的单链多肽。另一种有用的fc多肽是在美国专利5,457,035中和在baum等,1994,embo j.13:3992
‑
4001中描述的fc突变蛋白。该突变蛋白的氨基酸序列与wo 93/10151中提供的天然fc序列的氨基酸序列相同,除了氨基酸19已从leu变为ala,氨基酸20已从leu变为glu,以及氨基酸22已从gly变为ala以外。突变蛋白对fc受体显示出降低的亲和力。
[0171]
在其他实施方式中,抗pd
‑
1抗体的重链和/或轻链的可变部分可以替代抗体重链和/或轻链的可变部分。
[0172]
可以将含有一个或多个抗原结合蛋白的寡聚体作为pd
‑
1拮抗剂使用。寡聚体可以是共价连接的或非共价连接的二聚体、三聚体或更高级的寡聚体形式。考虑使用包含两个或更多个抗原结合蛋白的寡聚体,其一个实例是同二聚体。其他寡聚体包括异二聚体、同三聚体、异三聚体、同四聚体、异四聚体等。
[0173]
一个实施方式涉及包含通过与抗原结合蛋白融合的肽部分之间的共价或非共价相互作用连接的多个抗原结合蛋白的寡聚体。此类肽可以是肽接头(间隔物),或具有促进寡聚化的性质的肽。亮氨酸拉链和某些来源于抗体的多肽属于可促进与其相连的抗原结合蛋白寡聚化的肽,如下文更详细描述的。
[0174]
在特定实施方式中,寡聚体包含两至四个抗原结合蛋白。寡聚体的抗原结合蛋白可以是任何形式,如上述任何形式,例如,变体或片段。优选地,寡聚体包含具有pd
‑
1结合活性的抗原结合蛋白。
[0175]
在一个实施方式中,寡聚体是使用来源于免疫球蛋白的多肽制备的。例如,ashkenazi等,1991,pnas usa 88:10535;byrn等,1990,nature 344:677;和hollenbaugh
等,1992curr.prot.s in immunol.,suppl.4,第10.19.1
‑
10.19.11页已描述了包含融合到抗体衍生多肽的各个部分(包括fc结构域)的某些异源多肽的融合蛋白的制备。
[0176]
本公开的一个实施方式涉及包含通过将抗pd
‑
1抗体的pd
‑
1结合片段与抗体的fc区融合而产生的两个融合蛋白的二聚体。二聚体可以通过例如将编码融合蛋白的基因融合物插入到合适的表达载体中,在用重组表达载体转化的宿主细胞中表达基因融合物,并使表达的融合蛋白更像抗体分子一样组装而制备,从而在fc部分之间形成链间二硫键以产生二聚体。
[0177]
或者,寡聚体是包含多个抗原结合蛋白的融合蛋白,其具有或不具有肽接头(间隔物肽)。适宜的肽接头是美国专利4,751,180和4,935,233中描述的那些。
[0178]
用于制备寡聚抗原结合蛋白的另一种方法涉及使用亮氨酸拉链。亮氨酸拉链结构域是促进其发现的蛋白质寡聚化的肽。亮氨酸拉链最初在几种dna结合蛋白中被识别(landschulz等,1988,science 240:1759),并且此后在多种不同蛋白质中发现。在已知的亮氨酸拉链中有二聚化或三聚化的天然存在的肽及其衍生物。pct申请wo 94/10308中描述了适于产生可溶性寡聚蛋白质的亮氨酸拉链结构域的实例,以及hoppe等,1994,febs letters 344:191中描述了来源于肺表面活性蛋白d(spd)的亮氨酸拉链,在此通过引用并入。在fanslow等,1994,semin.immunol.6:267
‑
78中描述了允许将与其融合的异源蛋白质稳定三聚化的修饰的亮氨酸拉链的使用。在一种途径中,包含与亮氨酸拉链肽融合的抗pd
‑
1抗体片段或衍生物的重组融合蛋白在适宜的宿主细胞中表达,并且形成的可溶性寡聚抗pd
‑
1抗体片段或衍生物从培养物上清液中回收。
[0179]
在一个方面中,本公开提供了干扰pd
‑
1与pd
‑
l1结合的抗原结合蛋白。此类抗原结合蛋白可以针对pd
‑
1或其片段、变体或衍生物产生,并在常规测定中筛选干扰pd
‑
1与pd
‑
l1结合的能力。合适的测定的实例是测试抗原结合蛋白抑制pd
‑
l1与表达pd
‑
1的细胞结合的能力的测定,或测试抗原结合蛋白降低因pd
‑
l1与细胞表面pd
‑
1结合而导致的生物或细胞反应的能力。例如,抗体可以根据其与固定的抗体表面(pd
‑
1)结合的能力来筛选。阻断pd
‑
1与pd
‑
l1结合的抗原结合蛋白可用于治疗任何pd
‑
1相关病症,包括但不限于恶病质。在一个实施方式中,通过涉及免疫转基因小鼠的程序产生的人抗pd
‑
1单克隆抗体用于治疗此类病症。
[0180]
可以通过常规技术生产本公开的抗原结合蛋白的抗原结合片段。此类片段的实例包括但不限于fab和f(ab’)2片段。还涉及通过基因工程技术生产的抗体片段和衍生物。
[0181]
其他实施方式包括嵌合抗体,例如,非人(例如,小鼠)多克隆抗体的人源化形式。此类人源化抗体可以通过公知技术制备,并且在将抗体施用于人时提供降低免疫原性的优势。在一个实施方式中,人源化单克隆抗体包含小鼠抗体的可变结构域(或其抗原结合位点的全部或部分)和来源于人抗体的恒定结构域。或者,人源化抗体片段可以包含小鼠单克隆抗体的抗原结合位点和来源于人抗体的可变结构域片段(缺乏抗原结合位点)。生产嵌合和进一步工程化的单克隆抗体的程序包括在riechmann等,1988,nature 332:323,liu等,1987,proc.nat.acad.sci.usa 84:3439,larrick等,1989,bio/technology 7:934,和winter等,1993,tips 14:139中描述的那些。在一个实施方式中,嵌合抗体是cdr移植抗体。在例如美国专利号5,869,619、5,225,539、5,821,337、5,859,205、6,881,557,padlan等,1995,faseb j.9:133
‑
39,和tamura等,2000,j.immunol.164:1432
‑
41中讨论了用于人源化
抗体的技术。
[0182]
已开发了用于在非人动物中产生人或部分人抗体的程序。例如,制备了其中一种或多种内源性免疫球蛋白基因已通过各种方式灭活的小鼠。已将人免疫球蛋白基因引入小鼠以替代灭活的小鼠基因。动物体内产生的抗体整合由引入动物中的人类遗传物质编码的人类免疫球蛋白多肽链。在一个实施方式中,使用pd
‑
1多肽免疫非人动物(如转基因小鼠),以使得在动物中产生针对pd
‑
1多肽的抗体。
[0183]
适宜的免疫原的一个实例是可溶性人pd
‑
1,如包含具有以下序列seq id:7001的蛋白质的胞外域或蛋白质的其他免疫原性片段的多肽。在以下描述了生产和使用用于产生人或部分人抗体的转基因动物的技术的实例:美国专利5,814,318、5,569,825和5,545,806,davis等,2003,production of human antibodies from transgenic mice in lo,ed.antibody engineering:methods and protocols,humana press,nj:191
‑
200,kellermann等,2002,curr opin biotechnol.13:593
‑
97,russel等,2000,infect immun.68:1820
‑
26,gallo等,2000,eur j immun.30:534
‑
40,davis等,1999,cancer metastasis rev.18:421
‑
25,green,1999,j immunol methods.231:11
‑
23,jakobovits,1998,advanced drug delivery reviews 31:33
‑
42,green等,1998,j exp med.188:483
‑
95,jakobovits a,1998,exp.opin.invest.drugs.7:607
‑
14,tsuda等,1997,genomics.42:413
‑
21,mendez等,1997,nat genet.15:146
‑
56,jakobovits,1994,curr biol.4:761
‑
63,arbones等,1994,immunity.1:247
‑
60,green等,1994,nat genet.7:13
‑
21,jakobovits等,1993,nature.362:255
‑
58,jakobovits等,1993,proc natl acad sci u s a.90:2551
‑
55,chen,j.,m.trounstine,f.w.alt,f.young,c.kurahara,j.loring,d.huszar.inter’l immunol.5(1993):647
‑
656,choi等,1993,nature genetics 4:117
‑
23,fishwild等,1996,nature biotech.14:845
‑
51,harding等,1995,annals of the new york academy of sciences,lonberg等,1994,nature 368:856
‑
59,lonberg,1994,transgenic approaches to human monoclonal antibodies in handbook of experimental pharmacology 113:49
‑
101,lonberg等,1995,internal review of immunology 13:65
‑
93,neuberger,1996,nature biotechnology 14:826,taylor等,1992,nucleic acids res.20:6287
‑
95,taylor等,1994,inter’l immunol.6:579
‑
91,tomizuka等,1997,nature genetics 16:133
‑
43,tomizuka等,2000,pro.nat’lacad.sci.usa 97:722
‑
27,tuaillon等,1993,pro.nat’lacad.sci.usa 90:3720
‑
24,和tuaillon等,1994,j.immunol.152:2912
‑
20。
[0184]
本公开的抗原结合蛋白(例如,抗体、抗体片段和抗体衍生物)可以包含本领域公知的任何恒定区。轻链恒定区可以是例如κ或λ型轻链恒定区,例如,人κ或λ型轻链恒定区。重链恒定区可以是例如α、δ、ε、γ或μ型重链恒定区,例如,人α、δ、ε、γ或μ型重链恒定区。在一个实施方式中,轻链或重链恒定区是天然存在的恒定区的片段、衍生物、变体或突变蛋白。
[0185]
用于从目标抗体衍生不同亚类或同种型抗体的技术是公知的,即亚类转换。因此,igg抗体可以来源于igm抗体,例如,反之亦然。此类技术能够制备具有给定抗体(亲本抗体)的抗原结合性质的新抗体,但也表现出与同亲本抗体不同的抗体同种型或亚类相关的生物学性质。编码特定抗体多肽的克隆dna可用于此类程序,例如,编码所需同种型抗体恒定结构域的dna。亦然参见lantto等,2002,methods mol.biol.178:303
‑
16。
[0186]
在一个实施方式中,本公开的抗原结合蛋白包含任何a1
‑
a28(h1
‑
h28)的igg1重链结构域或任何a1
‑
a28(h1
‑
h28)的igg1重链结构域的片段。在另一个实施方式中,本公开的抗原结合蛋白包含a1
‑
a28(l1
‑
l28)的κ轻链恒定区,或a1
‑
a28(l1
‑
l28)的κ轻链恒定区的片段。在另一个实施方式中,本公开的抗原结合蛋白包含a1
‑
a28(l1
‑
l28)的igg1重链结构域或其片段和a1
‑
a28(l1
‑
l28)的κ轻链结构域或其片段两者。
[0187]
因此,本公开的抗原结合蛋白包括包含以下的那些:例如可变结构域组合l1h1、l2h2、l3h3、l4h4、l5h5、l6h6、l7h7、l8h8、l9h9、l10h10、l11h11、l12h12、l13h13、l14h14、l15h15、l16h16、l17h17、l18h18、l19h19、l20h20、l21h21、l22h22、l23h23、l24h24、l25h25、l26h26、l27h27、l28h28,其具有所需同种型(例如,iga、igg1、igg2、igg3、igg4、igm、ige和igd)以及其fab或f(ab’)2片段。此外,如果igg4是所需要的,则也可能需要在铰链区中引入点突变(cpscp(seq id no:12192)
‑
>cppcp(seq id no:12193)),如在bloom等,1997,protein science 6:407中所描述的(通过引用并入本文),以减轻形成h链内二硫键的趋势,这可能导致igg4抗体的异质性。
[0188]
在一个实施方式中,抗原结合蛋白具有1x10
‑
4 s
‑1或更低的k
off
。在另一个实施方式中,k
off
是5x10
‑
5 s
‑1或更低。在另一个实施方式中,k
off
与具有选自由以下组成的组合的轻链和重链可变结构域序列组合的抗体基本相同:l1h1、l2h2、l3h3、l4h4、l5h5、l6h6、
…
和l28h28。在另一个实施方式中,抗原结合蛋白以与包含一个或多个来自具有选自以下的轻链和重链可变结构域序列的组合的抗体的cdr的抗体基本相同的k
off
结合pd
‑
1:l1h1、l2h2、l3h3、l4h4、l5h5、l6h6、
……
和l28h28。在另一个实施方式中,抗原结合蛋白以与包含上述氨基酸序列之一的抗体基本相同的k
off
结合pd
‑
1。在另一个实施方式中,抗原结合蛋白以与包含一个或多个来自包含上述氨基酸序列之一的抗体的cdr的抗体基本相同的k
off
结合pd
‑
1。
[0189]
在一个方面中,本公开提供了本公开的抗pd
‑
1抗体的抗原结合片段。此类片段可以完全由抗体衍生序列组成或可以包含另外的序列。抗原结合片段的实例包括fab、f(ab’)2、单链抗体、双体抗体、三体抗体、四体抗体和域抗体。在lunde等,2002,biochem.soc.trans.30:500
‑
06中提供了其他实例。
[0190]
单链抗体(scfv)可以通过经由氨基酸桥(短肽接头,例如,氨基酸残基的合成序列)连接重链和轻链可变结构域(fv区)片段来形成,从而产生单一多肽链。此类单链fv(scfv)已通过在编码两种可变结构域多肽(v
l
和v
h
)的dna之间融合编码肽接头的dna来制备。所得多肽能够自身折叠形成抗原结合单体,或者其能够形成多聚体(例如,二聚体、三聚体或四聚体),这取决于两个可变结构域之间的柔性接头的长度(kortt等,1997,prot.eng.10:423;kortt等,2001,biomol.eng.18:95
‑
108,bird等,1988,science 242:423
‑
26和huston等,1988,proc.natl.acad.sci.usa 85:5879
‑
83)。通过将不同的包含v
l
和v
h
的多肽组合,可以形成结合不同表位的多聚化scfv(kriangkum等,2001,biomol.eng.18:31
‑
40)。为了生产单链抗体而开发的技术包括在美国专利号4,946,778;bird,1988,science 242:423;huston等,1988,proc.natl.acad.sci.usa 85:5879;ward等,1989,nature 334:544,de graaf等,2002,methods mol biol.178:379
‑
87中描述的那些。本公开涵盖了包含可变结构域组合l1h1、l2h2、l3h3、l4h4、l5h5、l6h6
……
和l28h28的scfv。
[0191]
7.7.单克隆抗体
[0192]
在另一个方面中,本公开提供了结合pd
‑
1的单克隆抗体。本公开的单克隆抗体可以使用各种公知技术产生。在通常情况下,可以通过本领域技术人员公知的方法获得结合特定抗原的单克隆抗体(参见,例如,kohler等,nature 256:495,1975;coligan等(编著),current protocols in immunology,1:2.5.12.6.7(john wiley&sons 1991);美国专利号re 32,011、4,902,614、4,543,439和4,411,993;monoclonal antibodies,hybridomas:a new dimension in biological analyses,plenum press,kennett,mckearn和bechtol(编著)(1980);和antibodies:a laboratory manual,harlow和lane(编著),cold spring harbor laboratory press(1988);picksley等,“production of monoclonal antibodies against proteins expressed in e.coli,”dna cloning 2:expression systems,第2版,glover等(编著),第93页(oxford university press 1995))。抗体片段可以使用任何合适的标准技术,如蛋白水解消化,或任选地通过蛋白水解消化(例如,使用木瓜蛋白酶或胃蛋白酶)随后二硫键的温和还原和烷基化来从其衍生。或者,此类片段还可以通过如本文所述的重组遗传工程技术产生。
[0193]
根据本领域公知和本文所述的方法,单克隆抗体可以通过使用包含人pd
‑
1[序列seq id 7001]或其片段的免疫原注射如本领域公知的动物获得,例如,大鼠、仓鼠、家兔或优选地小鼠,包括例如转基因或敲除的。可以在初始注射后和/或强化注射后,通过获取血清样品并使用本领域公知的和本文所述的几种免疫检测方法中的任何一种检测与人pd
‑
1或肽结合的抗体的存在来监测特异性抗体产生的存在。从产生所需抗体的动物,取出淋巴样细胞,最常见的是来自脾细胞或淋巴结的细胞,以获得b淋巴细胞。然后,将b淋巴细胞与药物致敏的骨髓瘤细胞融合伴体融合,优选是与免疫的动物同源并且任选地具有其他所需性质(例如,不能表达内源性ig基因产物,例如,p3x63
‑
ag 8.653(atcc no.crl 1580);nso,sp20)的融合伴体,以产生杂交瘤,其是永生化的真核细胞系。
[0194]
淋巴样(例如,脾)细胞和骨髓瘤细胞可以与膜融合促进剂(如聚乙二醇或非离子去垢剂)组合几分钟,然后以低密度接种在支持杂交瘤细胞而非未融合骨髓瘤细胞的生长的选择培养基上。优选的选择培养基是hat(次黄嘌呤、氨基蝶呤、胸腺嘧啶)。经过足够的时间,通常约一到两周后,观察到细胞集落。分离单集落,并且可以使用本领域公知的和本文所述的多种免疫测定法中的任一种来测试由细胞产生的抗体对人pd
‑
1的结合活性。将杂交瘤克隆(例如,通过有限稀释克隆或通过软琼脂噬菌斑分离),并且选择和培养产生对pd
‑
1特异的抗体的阳性克隆。可以从杂交瘤培养物上清液分离来自杂交瘤培养物的单克隆抗体。
[0195]
用于产生小鼠单克隆抗体的另一种方法是将杂交瘤细胞注射到同基因小鼠的腹腔中,例如,已进行处理(例如,降植烷激发)的小鼠,以促进含有单克隆抗体的腹水形成。可以通过各种已良好建立的技术分离和纯化单克隆抗体。此类分离技术包括使用蛋白a琼脂糖的亲和层析、体积排阻层析和离子交换层析(参见,例如,coligan,在第2.7.1
‑
2.7.12页和第2.9.1
‑
2.9.3页;baines等,“purification of immunoglobulin g(igg),”methods in molecular biology,vol.10,第79
‑
104页(the humana press,inc.1992))。单克隆抗体可以通过亲和层析使用基于抗体的特定特性(例如,重链或轻链同种型、结合特异性等)选择的适当配体来纯化。固化在固体支持物上的适宜配体的实例包括蛋白a、蛋白g、抗体恒定区(轻链或重链)抗体、抗独特型抗体和tgfβ结合蛋白或者其片段或变体。
[0196]
可以使用本领域公知的任何技术产生单克隆抗体,例如,通过永生化从完成免疫程序后的转基因动物中收获的脾细胞。脾细胞可以通过使用本领域公知的任何技术永生化,例如,通过将其与骨髓瘤细胞融合以产生杂交瘤。鉴定产生结合pd
‑
1多肽的抗体的杂交瘤细胞系。本公开包括此类杂交瘤细胞系和由其产生的抗pd
‑
1单克隆抗体。用于产生杂交瘤的融合程序的骨髓瘤细胞优选是非产生抗体的、具有高融合效率和酶缺陷,这使得其不能在仅支持所需融合细胞(杂交瘤)生长的某些选择性培养基中生长。用于小鼠融合的适宜细胞系的实例包括sp
‑
20、p3
‑
x63/ag8、p3
‑
x63
‑
ag8.653、ns1/1.ag41、sp210
‑
ag14、fo、nso/u、mpc
‑
11、mpc11
‑
x45
‑
gtg 1.7和s194/5xx0 bul;用于大鼠融合的细胞系的实例包括r210.rcy3、y3
‑
ag 1.2.3、ir983f和4b210。可用于细胞融合的其他细胞系是u
‑
266、gm1500
‑
grg2、licr
‑
lon
‑
hmy2和uc729
‑
6。可以进一步筛选杂交瘤或mab以鉴定具有特定性质的mab,如阻断pd
‑
1诱导的活性的能力。
[0197]
本公开的抗体还可以是全人单克隆抗体。提供了一种与pd
‑
1特异性结合的分离的全人抗体,其中抗原结合蛋白具有人抗pd
‑
1抗体的至少一种体内生物学活性。
[0198]
7.8.产生抗体的方法
[0199]
可以通过本领域普通技术人员熟知的多种技术产生全人单克隆抗体。此类方法包括但不限于人外周血细胞(例如,含有b淋巴细胞)的爱泼斯坦巴尔病毒(ebv)转化、人b细胞的体外免疫、来自携带插入的人免疫球蛋白基因的免疫转基因小鼠的脾细胞的融合、从人免疫球蛋白v区噬菌体文库分离或如本领域公知的和基于本公开的其他程序。例如,全人单克隆抗体可以从转基因小鼠中获得,这些小鼠经过工程改造以响应于抗原激发产生特异性人抗体。在以下中描述了用于从转基因小鼠获得全人抗体的方法,例如,green等,nature genet.7:13,1994;lonberg等,nature 368:856,1994;taylor等,int.immun.6:579,1994;美国专利号5,877,397;bruggemann等,1997curr.opin.biotechnol.8:455 58;jakobovits等,1995ann.n.y.acad.sci.764:52535。在这项技术中,将人重链和轻链基因座的元件引入来源于胚胎干细胞系的小鼠品系中,其含有内源性重链和轻链基因座的靶向破坏(亦参见bruggemann等,curr.opin.biotechnol.8:455 58(1997))。例如,人免疫球蛋白转基因可以是小基因构建体,或酵母人工染色体上的转座点(translocus),其在小鼠淋巴组织中经历b细胞特异性dna重排和超突变。全人单克隆抗体可以通过对转基因小鼠进行免疫获得,其进而产生对pd
‑
1特异性的人抗体。根据本文所述的方法,经免疫的转基因小鼠的淋巴细胞可用于产生分泌人抗体的杂交瘤。还可以从免疫动物的血液中获得含有全人抗体的多克隆血清。
[0200]
用于产生本公开的人抗体的另一种方法包括通过ebv转化来永生化人外周血细胞。参见,例如,美国专利号4,464,456。这种产生与pd
‑
1特异性结合的单克隆抗体的永生化b细胞系(或淋巴母细胞系)可以通过如本文提供的免疫检测方法例如elisa来鉴定,然后通过标准克隆技术分离。根据本领域公知的方法,通过将转化细胞系与鼠骨髓瘤融合以产生小鼠人杂交细胞系,可以提高产生抗pd
‑
1抗体的淋巴母细胞系的稳定性(参见,例如,glasky等,hybridoma 8:377 89(1989))。产生人单克隆抗体的又一种方法是体外免疫,其包括使用人pd
‑
1启动人脾脏b细胞。然后将启动的b细胞与异源杂交融合伴体融合。参见,例如,boerner等,1991j.immunol.147:86 95。
[0201]
在某些实施方式中,选择产生人pd
‑
1抗体的b细胞,并根据本领域公知(wo 92/
02551;美国专利5,627,052;babcook等,proc.natl.acad.sci.usa 93:7843 48(1996))和本文所述的分子生物学技术从b细胞克隆轻链和重链可变区。通过选择产生与pd
‑
1特异性结合的抗体的细胞,可以从脾脏、淋巴结或外周血样品中分离来自免疫动物的b细胞。还可以从人(例如,从外周血样品)中分离b细胞。
[0202]
检测产生具有所需特异性的抗体的单一b细胞的方法是本领域公知的,例如,通过噬斑形成、荧光激活细胞分选、体外刺激然后检测特异性抗体等。选择产生特异性抗体的b细胞的方法包括,例如,在含有人pd
‑
1的软琼脂中制备b细胞的单细胞悬液。b细胞产生的特异性抗体与抗原的结合导致形成复合物,其可以作为免疫沉淀物可见。
[0203]
在一些实施方式中,通过使用允许鉴定天然配对抗体的方法来选择产生特异性抗体的b细胞。例如,可以使用在adler等,a natively paired antibody library yields drug leads with higher sensitivity and specificity than a randomly paired antibody library,mabs(2018)中描述的方法,其全部内容通过引用并入本文。如来自adler等中采用的图1中所总结的,该方法组合了微流体技术、分子基因组学、酵母单链可变片段(scfv)展示、荧光激活细胞分选(facs)和深度测序。简言之,可以从免疫动物中分离b细胞,然后合并。将b细胞用oligo
‑
dt珠和裂解液包封在液滴中,从液滴纯化mrna结合的珠,然后注射到含有oe
‑
rt
‑
pcr扩增混合物第二乳液中,其生成编码具有天然重链和轻链ig对的scfv的dna扩增子。然后将天然配对的扩增子的文库电穿孔到酵母中用于scfv展示。facs用于鉴定高亲和力scfv。最后,可以将深度抗体测序用于鉴定分选前和分选后scfv文库中的所有克隆。
[0204]
在选择生产所述抗体的b细胞后,可以根据本领域公知和本文所述的方法通过分离和扩增dna或mrna来克隆特异性抗体基因。
[0205]
获得本公开抗体的方法也可以采用本领域公知的各种噬菌体展示技术。参见,例如,winter等,1994annu.rev.immunol.12:433 55;burton等,1994adv.immunol.57:191 280。可以在噬菌体载体中建立人或鼠免疫球蛋白可变区基因组合文库,可以对噬菌体载体进行筛选以选择与pd
‑
1结合蛋白或其变体或片段特异性结合的ig片段(fab、fv、sfv或其多聚体)。参见,例如,美国专利号5,223,409;huse等,1989science 246:1275 81;sastry等,proc.natl.acad.sci.usa 86:5728 32(1989);alting mees等,strategies in molecular biology 3:19(1990);kang等,1991proc.natl.acad.sci.usa 88:4363 66;hoogenboom等,1992j.molec.biol.227:381 388;schlebusch等,1997hybridoma 16:47 52以及其中引用的参考文献。例如,包含多个编码ig可变区片段的多核苷酸序列的文库可以与编码噬菌体衣壳蛋白的序列同框地插入丝状噬菌体如m13或其变体的基因组中。融合蛋白可以是衣壳蛋白与轻链可变区结构域和/或与重链可变区结构域的融合体。根据某些实施方式,还可以在噬菌体颗粒上展示免疫球蛋白fab片段(参见,例如,美国专利号5,698,426)。
[0206]
与另一种蛋白(如次要衣壳蛋白)融合的抗体片段也可以用于使用抗原富集噬菌体。然后,使用来自对抗原(例如,pd
‑
1)的小鼠免疫的重排重(v
h
)和轻(v
l
)链的随机组合文库,在噬菌体表面展示多样的抗体片段文库。可以筛选这些文库的互补性可变结构域,并且结构域通过例如亲和柱纯化。参见clackson等,nature,v.352pp.624
‑
628(1991)。
[0207]
还可以在λ噬菌体重制备重链和轻链免疫球蛋白cdna表达文库,例如,使用λlmmunozap
tm
(h)和λimmunozap
tm
(l)载体(stratagene,la jolla,california)。简言之,从b
细胞群重分离mrna,并用于在λimmunozap(h)和λimmunozap(l)载体重形成重链和轻链免疫球蛋白cdna表达文库。可以单独筛选这些载体或共表达以形成fab片段或抗体(参见huse等,同上;亦参见sastry等,同上)。随后可以将阳性噬菌斑转化为非裂解质粒,该质粒允许来自大肠杆菌的单克隆抗体片段的高水平表达。
[0208]
在一个实施方式中,在杂交瘤中,使用核苷酸引物扩增表达目标单克隆抗体基因的可变区。这些引物可以由本领域普通技术人员合成,或者可以从市售来源购买。(参见,例如,stratagene(la jolla,california),该公司销售小鼠和人可变区引物,其中包括v
ha
、v
hb
、v
hc
、v
hd
、c
h1
、v
l
和c
l
区的引物。)这些引物可以用于扩增重链或轻链可变区,然后可以将其分别插入载体,如immunozap
tm
h或immunozap
tm
l(stratagene)。然后可以将这些载体引入大肠杆菌、酵母或基于哺乳动物的表达系统。可以使用这些方法生产大量包含v
h
和v
l
结构域的融合蛋白的单链蛋白(参见bird等,science 242:423 426,1988)。
[0209]
一旦使用任何上述免疫和其他技术获得生产根据本公开的抗体的细胞,可以根据本文所述的标准程序通过从中分离和扩增dna或mrna来克隆特异性抗体基因。可以对由此产生的抗体进行测序并且鉴定cdr并且可以如先前描述的那样操作编码cdr的dna以产生根据本公开的其他抗体。
[0210]
本公开的pd
‑
1结合剂优选地在本文所述的基于细胞的测定中和/或在本文所述的体内测定中调节pd
‑
1功能和/或结合一个或多个本文所述的结构域和/或交叉阻断在本技术中所述的抗体之一的结合和/或被在本技术中所述的抗体之一交叉阻断与pd
‑
1的结合。因此,可以使用本文所述的测定鉴定此类结合剂。
[0211]
在某些实施方式中,通过首先鉴定结合一个或多个本文提供的结构域和/或在本文所述的基于细胞的测定和/或在体内测定中中和和/或交叉阻断在本技术中所述的抗体和/或被在本技术中所述的抗体之一交叉阻断与pd
‑
1的结合产生的抗体。然后来自这些抗体的cdr区用于插入适当的生物相容性框架中以产生pd
‑
1结合剂。结合剂的非cdr部分可以由氨基酸组成,或者可以是非蛋白质分子。本文中所述的测定允许鉴定结合剂。优选地,本公开的结合剂是如本文所定义的抗体。
[0212]
根据本公开的其他抗体可以通过如本文所述和本领域公知的常规免疫和细胞融合程序获得。
[0213]
抗体结合位点中心的互补性决定区(cdr)的分子进化也已用于分离亲和力增加的抗体,例如,对c
‑
erbb
‑
2具有增加的亲和力的抗体,如在schier等,1996,j.mol.biol.263:551中所描述的。因此,此类技术可用于制备针对pd
‑
1的抗体。例如,在体外或在体内检测pd
‑
1多肽存在的测定中,可以使用针对pd
‑
1的抗原结合蛋白。抗原结合蛋白还可用于通过免疫亲和色谱纯化pd
‑
1蛋白。
[0214]
尽管人抗体、部分人抗体或人源化抗体适用于很多应用,特别是涉及将抗体施用于人受试者的那些应用,但其他类型的抗原结合蛋白也适用于某些应用。非人抗体可来源于任何产生抗体的动物,如小鼠、大鼠、兔、山羊、驴或非人灵长类(如,猴(例如,食蟹猴或恒河猴)或猿(例如,黑猩猩))。来自特定物种的抗体可以通过以下方式制备:例如,用所需免疫原(例如,pd
‑
1多肽)免疫该物种的动物或使用用于产生该物种的抗体的人工系统(例如,用于产生特定物种的抗体的基于细菌或噬菌体展示的系统),或通过例如用来自其他物种的恒定区替换抗体的恒定区,或通过替换抗体的一个或多个氨基酸残基将来自一个物种的
抗体转化为来自另一物种的抗体,以使得其更密切类似于来自其他物种的抗体序列。在一个实施方式中,抗体是嵌合抗体,其包含来源于来自两个或更多个不同物种的抗体的氨基酸序列。
[0215]
可以通过多种常规技术中的任何一种来制备抗原结合蛋白,并筛选所需特性。某些技术涉及分离编码目标抗原结合蛋白(例如,抗pd
‑
1抗体)多肽链(或其部分)的核酸,并通过重组dna技术操纵该核酸。例如,核酸可以与另一目标核酸融合,或进行改变(例如,通过诱变或其他常规技术)以添加、缺失或置换一个或多个氨基酸残基。此外,可以使用本领域公知的任何技术从天然表达抗原结合蛋白的细胞中纯化(例如,抗体可以从产生其的杂交瘤中纯化)或在重组表达系统中产生抗原结合蛋白。参见,例如,monoclonal antibodies,hybridomas:a new dimension in biological analyses,kennet等(编著),plenum press,new york(1980);和antibodies:a laboratory manual,harlow和land(编著),cold spring harbor laboratory press,cold spring harbor,ny,(1988)。
[0216]
可以将本领域公知的任何表达系统用于制备本公开的重组多肽。表达载体已在上文中全面详述。在通常情况下,使用包含编码所需多肽的dna的重组表达载体转化宿主细胞。可以使用的宿主细胞包括原核细胞、酵母或高等真核细胞。原核生物包括革兰氏阴性或革兰氏阳性生物,例如大肠杆菌或杆菌。高等真核细胞包括昆虫细胞和哺乳动物来源的已建立细胞系。适宜哺乳动物宿主细胞系的实例包括猴肾细胞的cos
‑
7细胞系(atcc crl 1651)(gluzman等,1981,cell 23:175)、l细胞、293细胞、c127细胞、3t3细胞(atcc ccl 163)中国仓鼠卵巢(cho)细胞、hela细胞、bhk(atcc crl 10)细胞系和来源于非洲绿猴肾细胞系cvi的cvi/ebna细胞系(atcc ccl 70),如mcmahan等,1991,embo j.10:2821所描述的。pouwels等(cloning vectors:a laboratory manual,elsevier,new york,1985)描述了用于细菌、真菌、酵母和哺乳动物细胞宿主的适宜克隆和表达载体。
[0217]
将意识到的是,本公开的抗体可以具有至少一个氨基酸置换,条件是该抗体保留结合特异性。因此,对抗体结构的修饰包括在本公开的范围内。这些可以包括氨基酸置换,其可以是保守的或非保守的(其不会破坏抗体的pd
‑
1结合能力)。保守氨基酸置换可包括非天然存在的氨基酸残基,其通常通过化学肽合成而非通过生物系统中的合成来掺入。这些包括肽模拟物和其他反向或倒置形式的氨基酸部分。保守氨基酸置换还可以涉及用标准残基取代天然氨基酸残基的置换,使得对该位置氨基酸残基的极性或电荷几乎没有影响或没有影响。
[0218]
非保守性置换可能涉及将一类氨基酸或氨基酸模拟物的成员交换为具有不同物理性质(例如,尺寸、极性、疏水性、电荷)的另一类成员。可以将此类置换的残基引入人抗体与非人抗体同源的区域,或引入分子的非同源区域。
[0219]
此外,本领域技术人员可以产生在每个所需氨基酸残基处含有单个氨基酸置换的测试变体。然后,可以使用本领域技术人员公知的活性测定筛选变体。此类变体可用于收集有关适宜变体的信息。例如,如果发现对特定氨基酸残基的改变导致活性破坏、活性不合需要的降低或不适宜的活性,则可以避免具有这种改变的变体。换言之,基于从此类常规实验收集的信息,本领域技术人员能够容易地确定应避免的单独或与其他突变组合的进一步置换的氨基酸。
[0220]
本领域技术人员将能够使用众所周知的技术来确定本文所述多肽的适宜变体。在
某些实施方式中,本领域技术人员可以通过靶向被认为对活性不重要的区域来鉴定可以在不破坏活性的情况下改变的分子的合适区域。在某些实施方式中,能够识别在相似多肽中保守的分子残基和部分。在某些实施方式中,甚至对生物活性或结构可能重要的区域也可以进行保守的氨基酸置换而不破坏生物活性或对多肽结构没有不利影响。
[0221]
此外,本领域技术人员可以回顾结构
‑
功能研究,以鉴定相似多肽中对活性或结构很重要的残基。鉴于这种比较,人们可以预测蛋白中氨基酸残基的重要性,该氨基酸残基对应于对相似蛋白中的活性或结构很重要的氨基酸残基。本领域技术人员可以选择化学上相似的氨基酸置换来替代这种预测的重要氨基酸残基。
[0222]
本领域技术人员还可以分析类似多肽中与该结构相关的三维结构和氨基酸序列。鉴于这些信息,本领域技术人员可以针对其三维结构预测抗体的氨基酸残基的比对。在某些实施方式中,本领域技术人员可以选择不对预测在蛋白表面上的氨基酸残基进行彻底改变,因为这些残基可能涉及与其他分子的重要相互作用。
[0223]
许多科学出版物都致力于预测二级结构。参见moult j.,curr.op.in biotech.,7(4):422
‑
427(1996),chou等,biochem.,13(2):222
‑
245(1974);chou等,biochem.,113(2):211
‑
222(1974);chou等,adv.enzymol.relat.areas mol.biol.,47:45
‑
148(1978);chou等,ann.rev.biochem.,47:251
‑
276和chou等,biophys.j.,26:367
‑
384(1979)。此外,目前可以使用计算机程序来帮助预测二级结构。预测二级结构的一种方法是基于同源性建模。例如,序列同一性大于30%,或相似性大于40%的两种多肽或蛋白质往往具有相似的结构拓扑。蛋白结构数据库(pdb)最近的发展增强了二级结构的可预测性,包括多肽或蛋白质结构内的潜在折叠数。参见holm等,nucl.acid.res.,27(1):244
‑
247(1999)。有人建议(brenner等,curr.op.struct.biol.,7(3):369
‑
376(1997))给定的多肽或蛋白的折叠数量有限,一旦确定了关键数量的结构,结构预测将变得更加准确。
[0224]
预测二级结构的其他方法包括“穿线”(jones,d.,curr.opin.struct.biol.,7(3):377
‑
87(1997);sippl等,structure,4(1):15
‑
19(1996))、“性质分析”(bowie等,science,253:164
‑
170(1991);gribskov等,meth.enzym.,183:146
‑
159(1990);gribskov等,proc.nat.acad.sci.,84(13):4355
‑
4358(1987)),和“进化连接”(参见holm,同上(1999),和brenner,同上(1997))。
[0225]
在某些实施方式中,抗体的变体包括糖基化变体,其中糖基化位点的数量和/或类型与亲本多肽的氨基酸序列相比已经改变。在某些实施方式中,变体包含与天然蛋白相比更多或更少数量的n连接糖基化位点。n连接糖基化位点可以通过以下序列表征:asn
‑
x
‑
ser或asn
‑
x
‑
thr,其中指定为x的氨基酸残基可以是除脯氨酸以外的任何氨基酸残基。氨基酸残基的置换以产生该序列为添加n
‑
连接的碳水化合物链提供了潜在的新位点。或者,消除该序列的置换将除去现有n连接的碳水化合物链。还提供了一种n
‑
连接的碳水化合物链的重排,其中一个或多个n
‑
连接的糖基化位点(通常是天然存在的)被消除并产生一个或多个新的n
‑
连接的位点。其他优选的抗体变体包括半胱氨酸变体,其中与亲本氨基酸序列相比,一个或多个半胱氨酸残基从另一氨基酸(例如,丝氨酸)中缺失或置换。当抗体必须重新折叠成生物活性构象时,例如在分离不溶性包涵体之后,半胱氨酸变体可能很有用。半胱氨酸变体通常具有比天然蛋白质更少的半胱氨酸残基,并且通常具有偶数以最小化由未配对的半胱氨酸导致的相互作用。
[0226]
所需的氨基酸置换(无论是保守的还是非保守的)可由本领域技术人员在需要此类置换时确定。在某些实施方式中,氨基酸置换可用于鉴定针对pd
‑
1的抗体的重要残基,或用于增加或降低本文所述的针对pd
‑
1的抗体的亲和力。
[0227]
根据某些实施方式,优选的氨基酸置换是以下那些:(1)降低对蛋白水解的敏感性,(2)降低对氧化的敏感性,(3)改变蛋白复合物的结合亲和力,(4)改变结合亲和力,和/或(4)赋予或改变此类多肽的其他生理化学或功能性质。根据某些实施方式,单个或多个氨基酸置换(在某些实施方式中,保守性氨基酸置换)可以是在天然存在的序列中(在某些实施方式中,在形成分子间接触的一个或多个结构域外的多肽部分中)。在某些实施方式中,保守性氨基酸置换通常不会显着改变亲本序列的结构特征(例如,替换氨基酸不应倾向于破坏亲本序列中出现的螺旋,或破坏表征亲本序列的其他类型的二级结构)。在蛋白、结构和分子原理(creighton,ed.,w.h.freeman and company,new york(1984));蛋白结构介绍(c.branden和j.tooze编著,garland publishing,new york,n.y.(1991));和thornton等,nature 354:105(1991)中描述了本领域公认的多肽的二级和三级结构的实例,其每一个通过引用并入本文。
[0228]
在某些实施方式中,本公开的抗体可以与多具体、脂质或其他部分化学键合。
[0229]
结合剂可以包含并入生物相容性框架结构中的至少一种本文所述的cdr。在一个实例中,生物相容性框架结构包含足以形成构象稳定的结构支持物或框架或支架的多肽或其部分,其能够在局部表面区域展示一种或多种与抗原结合的氨基酸序列(例如,cdr、可变区等)。这样的结构可以是天然存在的多肽或多肽“折叠”(结构基序),或者相对于天然存在的多肽或折叠可以具有一个或多个修饰,如氨基酸的添加、缺失或置换。这些支架可以源自任何物种(或多于一个物种)的多肽,如人、其他哺乳动物、其他脊椎动物、无脊椎动物、植物、细菌或病毒。
[0230]
通常,生物相容性框架结构基于除免疫球蛋白结构域之外的蛋白支架或骨架。例如,可以使用基于纤连蛋白、锚蛋白、脂质运载蛋白、新制癌素、细胞色素b、cp1锌指、pst1、卷曲螺旋、laci
‑
d1、z结构域和tendamist结构域的那些(参见例如,nygren和uhlen,1997,curr.opin.in struct.biol.,7,463
‑
469)。
[0231]
可以使用本领域公知的技术产生人源化抗体,如本文所述的那些(zhang,w.,等,molecular immunology.42(12):1445
‑
1451,2005;hwang w.等,methods.36(1):35
‑
42,2005;dall’acqua wf,等,methods 36(1):43
‑
60,2005;和clark,m.,immunology today.21(8):397
‑
402,2000)。
[0232]
此外,本领域技术人员将认识到适宜的结合剂包括这些抗体的部分,如具有seq id no 1001
‑
1011的cdr1
‑
l1至11;具有seq id no 2001
‑
2011的cdr2
‑
l1至11;具有seq id no 3001
‑
3011的cdr3
‑
l1至11;具有seq id no 4001
‑
4011的cdr1
‑
h1至11;具有seq id no 5001
‑
5011的cdr2
‑
h1至11;和具有seq id no 6001
‑
6011的cdr3
‑
h1至11的一个或多个,如本文所具体公开的。cdr区的至少一个区域可以具有与本文提供的序列的至少一个氨基酸置换,条件是抗体保留未置换的cdr的结合特异性。抗体的非cdr部分可以是非蛋白质分子,其中结合剂交叉阻断本文公开的抗体与pd
‑
1的结合和/或中和pd
‑
1。抗体的非cdr部分可以是非蛋白质分子,其中抗体在竞争结合测定中表现出与抗体a1
‑
a28中的至少一种相似的与人pd
‑
1肽的结合模式,和/或中和pd
‑
1。抗体的非cdr部分可由氨基酸组成,其中抗体是重组
结合蛋白或合成肽,并且重组结合蛋白交叉阻断本文公开的抗体与pd
‑
1的结合和/或中和pd
‑
1。抗体的非cdr部分可由氨基酸组成,其中抗体是重组抗体,并且该重组抗体在人pd
‑
1肽表位竞争结合测定(下文中描述的)中表现出与人pd
‑
1肽相似的结合模式,如抗体a1
‑
a28中的至少一种所表现的,和/或中和pd
‑
1。
[0233]
当抗体包含如上所述的cdr1
‑
h、cdr2
‑
h、cdr3
‑
h、cdr1
‑
l、cdr2
‑
l和cdr3
‑
l中的一种或多种时,其可以通过从含有编码这些序列的dna的宿主细胞中表达而获得。可以根据cdr的氨基酸序列确定编码每个cdr序列的dna,并酌情使用寡核苷酸合成技术、定点诱变和聚合酶链反应(pcr)技术与任何所需的抗体可变区框架和恒定区dna序列一起合成。本领域技术人员可从基因序列数据库如中广泛获得编码可变区框架和恒定区的dna。
[0234]
一旦合成,编码本公开的抗体或其片段的dna可以根据用于核酸切除、连接、转化和转染的多种熟知程序中的任一种使用任何数量的已知表达载体增殖和表达。因此,在某些实施方式中,抗体片段的表达可以优选地在原核宿主中,如大肠杆菌(参见,例如,pluckthun等,1989methods enzymol.178:497 515)。在某些其他实施方式中,抗体或其片段的表达可以优选地在真核宿主细胞中,包括酵母(例如,酿酒酵母、粟酒裂殖酵母和毕赤酵母)、动物细胞(包括哺乳动物细胞)或植物细胞。适宜动物细胞的实例包括但不限于骨髓瘤(如小鼠nso细胞系)、cos、cho或杂交瘤细胞。植物细胞的实例包括烟草、玉米、大豆和水稻细胞。
[0235]
可以制备一种或多种含有编码抗体可变区和/或恒定区的dna可复制表达载体,并将其用于转化合适的细胞系,例如,非生产性骨髓瘤细胞系,如小鼠nso细胞系或细菌,如大肠杆菌,其中将进行抗体生产。为了获得有效的转录和翻译,在每个载体中的dna序列应包含适宜的调控序列,特别是与可变结构域序列可操作地连接的启动子和前导序列。以这种方式产生抗体的具体方法通常是众所周知的并且是常规使用的。例如,在maniatis等,(molecular cloning,a laboratory manual,2nd ed.,cold spring harbor laboratory,new york,1989;亦参见maniatis等,3rd ed.,cold spring harbor laboratory,new york,(2001))中描述了基本分子生物学操作。可以根据sanger等,(pnas 74:5463,(1977))和amersham international plc测序手册中所描述的进行dna测序,并且根据本领域公知的方法进行定点诱变(kramer等,nucleic acids res.12:9441,(1984);kunkel proc.natl.acad.sci.usa 82:488 92(1985);kunkel等,methods in enzymol.154:367 82(1987);anglian biotechnology ltd.手册)。此外,很多出版物描述了适用于通过操作dna、创建表达载体以及转化和培养适当细胞来制备抗体的技术(mountain a和adair,j r,biotechnology and genetic engineering reviews(tombs,m p编著,10,第1章,1992,intercept,andover,uk);“current protocols in molecular biology”,1999,f.m.ausubel(ed.),wiley interscience,new york)。
[0236]
当需要提高根据本公开的抗体的亲和力时,包含一个或多个上述cdr的抗体可以通过多种亲和力成熟方案获得,包括保持cdr(yang等,j.mol.biol.,254,392 403,1995)、链改组(marks等,bio/technology,10,779 783,1992)、使用大肠杆菌突变菌株(low等,j.mol.biol.,250,350 368,1996)、dna改组(patten等,curr.opin.biotechnol.,8,724 733,1997)、噬菌体展示(thompson等,j.mol.biol.,256,7 88,1996)和有性pcr(crameri等,nature,391,288 291,1998)。在vaughan等,(nature biotech.,16,535 539,1998)中讨
论了亲和力成熟的所有这些方法。
[0237]
本领域技术人员将理解,一些蛋白(如抗体)可以经历多种翻译后修饰。这些修饰的类型和程度通常取决于用于表达蛋白的宿主细胞系以及培养条件。此类修饰可包括在糖基化、甲硫氨酸氧化、二酮哌嗪形成、天冬氨酸异构化和天冬酰胺脱酰胺中的变化。一种常见的修饰是由于羧肽酶的作用失去了羧基末端的碱性残基(如赖氨酸或精氨酸)(如在harris,r.j.journal of chromatography 705:129
‑
134,1995中所描述的)。
[0238]
7.9.序列
[0239]
抗体a1
‑
a28包含重链和轻链v(j)d多核苷酸(在本文中分别称为l1
‑
l28和h1
‑
h28)。抗体a1
‑
a28包含在表5中列出的序列。例如,抗体a1包含轻链l1(seq id no:1)和重链h1(seq id no:101)。在轻链(l1
‑
l28)和重链(h1
‑
h28)重的cdr序列也以特定seq id no提供。例如,针对l1的三个cdr序列(cdr1、cdr2和cdr3)分别是cdr1
‑
l1(seq id no:1001)、cdr2
‑
l1(seq id no:2001)和cdr3
‑
l1(seq id no:3001)和针对h1的三个cdr序列(cdr1、cdr2和cdr3)是cdr1
‑
h1(seq id no:4001)、cdr2
‑
h1(seq id no:5001)和cdr3
‑
h1(seq id no:6001)。
[0240]
[0241]
[0242]
[0243][0244]
7.10.药物组合物
[0245]
还提供了包含本公开的蛋白和多肽的药物组合物。此类组合物包含与药学上可接受的材料和生理学上可接受的制剂材料混合的治疗或预防有效量的多肽或蛋白。
[0246]
所述药物组合物可包含用于改变、维持或保存例如组合物的ph、渗透压、粘度、澄清度、颜色、等渗性、气味、无菌性、稳定性、溶解或释放速率、吸收或渗透的制剂材料。
[0247]
适宜的制剂材料包括但不限于氨基酸(如甘氨酸、谷氨酰胺、天冬酰胺、精氨酸或赖氨酸);抗菌剂;抗氧化剂(如抗坏血酸、亚硫酸钠或亚硫酸氢钠);缓冲剂(如硼酸盐、碳酸氢盐、tris
‑
hcl、柠檬酸盐、磷酸盐、其他有机酸);蓬松剂(如甘露醇或甘氨酸)、螯合剂(如乙二胺四乙酸(edta));络合剂(如咖啡因、聚乙烯吡咯烷酮或羟丙基
‑
β
‑
环糊精);填充剂;单糖;二糖和其他碳水化合物(如葡萄糖、甘露糖或糊精);蛋白(如血清白蛋白、明胶或免疫球蛋白);染色剂;调味剂和稀释剂;乳化剂;亲水性聚合物(如聚乙烯吡咯烷酮);低分子量多肽;成盐反离子(如钠);防腐剂(如苯扎氯铵、苯甲酸、水杨酸、硫柳汞、苯乙醇、对羟基苯甲酸甲酯、对羟基苯甲酸丙酯、氯己定、山梨酸或过氧化氢);溶剂(如甘油、丙二醇或聚乙二醇);糖醇(如甘露醇或山梨糖醇);悬浮剂;表面活性剂或润湿剂(如普朗尼克、peg、脱水山
梨醇酯、聚山梨醇酯,如聚山梨酯20、聚山梨酯80、triton、氨丁三醇、卵磷脂、胆固醇、泰洛沙帕);稳定性增强剂(蔗糖或山梨糖醇);张力增强剂(如碱金属卤化物(优选氯化钠或氯化钾、甘露醇、山梨糖醇);递送载剂;稀释剂;赋形剂和/或药物佐剂。中性缓冲盐水或与同种血清白蛋白混合的盐水是合适稀释剂的实例。根据适当的行业标准,还可以添加防腐剂,例如苯甲醇。可以使用合适的赋形剂溶液(如蔗糖)作为稀释剂将组合物配制成冻干物。在所采用的剂量和浓度下,合适的组分对受体是无毒的。药物制剂中可以使用的组分的其他实例可以参见remington’s pharmaceutical sciences,16th ed.(1980)和20th ed.(2000),mack publishing company,easton,pa。
[0248]
任选地,所述组合物另外包含一种或多种生理学活性剂,例如,抗血管生成物质、化学治疗物质(如卡培他滨、5
‑
氟尿嘧啶或多柔比星)、镇痛物质等,其非穷尽性实例在此提供。在各种特定实施方式中,除了pd
‑
1结合蛋白以外,组合物包含1、2、3、4、5或6种生理学活性剂。
[0249]
在本公开的另一个实施方式中,可以将本文公开的组合物以中性或盐形式制剂加成盐。示例性的药学上可接受的盐包括酸加成盐(与蛋白的游离氨基形成),并且其与无机酸,例如,盐酸或磷酸,或诸如乙酸、草酸、酒石酸、扁桃酸等的有机酸形成。与游离羧基形成的盐也可以衍生自无机碱,例如氢氧化钠、氢氧化钾、氢氧化铵、氢氧化钙或氢氧化铁,以及有机碱,例如异丙胺、三甲胺、组氨酸、普鲁卡因等。在配制时,溶液将以与制剂相容的方式并且以治疗有效量施用。
[0250]
载体还可包括任何和所有溶剂、分散介质、载剂、包衣、稀释剂、抗细菌剂和抗真菌剂、等渗剂和吸收延迟剂、缓冲剂、载体溶液、悬浮液、胶体等。此类介质和药剂用于药物活性物质的用途是本领域公知的。除非任何常规介质或药剂与活性成分不相容,否则考虑其在治疗组合物中的用途。还可以将补充活性成分加入组合物中。短语“药学上可接受的”是指当施用于人时不产生过敏或类似不良反应的分子实体和组合物。
[0251]
最佳药物组合物将由本领域技术人员根据例如预期的给药途径、递送形式和所需剂量来确定。参见例如,remington’s pharmaceutical sciences,同上。此类组合物可影响多肽的物理状态、稳定性、体内释放速率和体内清除速率。例如,适宜的组合物可以是注射用水、胃肠外施用的生理盐水溶液。
[0252]
7.10.1.药物活性成分的含量
[0253]
在典型的实施方式中,活性成分(即,本公开的蛋白和多肽)以至少0.01mg/ml、至少0.1mg/ml、至少0.5mg/ml或至少1mg/ml的浓度存在于药物组合物中。在某些实施方式中,活性成分以至少1mg/ml、2mg/ml、3mg/ml、4mg/ml、5mg/ml、10mg/ml、15mg/ml、20mg/ml或25mg/ml的浓度存在于药物组合物中。在某些实施方式中,活性成分以至少30mg/ml、35mg/ml、40mg/ml、45mg/ml或50mg/ml的浓度存在于药物组合物中。
[0254]
在一些实施方式中,除了本公开的蛋白或多肽以外,药物组合物包含一种或多种另外的活性成分。一种或多种另外的活性成分可以是靶向不同检查点受体的药物,如ctla
‑
4抑制剂(例如,抗ctla
‑
4抗体)或tigit抑制剂(例如,抗tigit抗体)。
[0255]
7.10.2.一般制剂
[0256]
所述药物组合物可以是任何适用于人或兽药的形式,包括液体、油、乳剂、凝胶、胶体、气雾剂或固体。
[0257]
可以配制药物组合物以通过适合于人或兽药的任何施用途径施用,包括肠内和胃肠外施用途径。
[0258]
在各种实施方式中,所述药物组合物配制成用于吸入施用。在这些实施方式的某些中,所述药物组合物配制成用于通过蒸发器施用。在这些实施方式的某些中,所述药物组合物配制成用于通过雾化器施用。在这些实施方式的某些中,所述药物组合物配制成用于通过气雾器施用。
[0259]
在各种实施方式中,所述药物组合物配制成用于口服施用、用于口腔施用或用于舌下施用。
[0260]
在一些实施方式中,所述药物组合物配制成用于静脉内、肌内或皮下施用。
[0261]
在一些实施方式中,所述药物组合物配制成用于鞘内或脑室内施用。
[0262]
在一些实施方式中,所述药物组合物配制成用于局部施用。
[0263]
7.10.3.适于注射的药物组合物
[0264]
对于静脉内、皮肤或皮下注射,或在患病部位注射,活性成分将是无热原的,并具有合适的ph、等渗性和稳定性的肠胃外可接受的水溶液形式。本领域相关技术人员能够很好地使用例如等渗载体如氯化钠注射液、林格注射液、乳酸林格注射液制备合适的溶液。根据需要,可以包含防腐剂、稳定剂、缓冲剂、抗氧化剂和/或其他添加剂。
[0265]
在各种实施方式中,所述单位剂型是小瓶、安瓿、瓶或预充式注射器。在一些实施方式中,所述单位剂型包含0.01mg、0.1mg、0.5mg、1mg、2.5mg、5mg、10mg、12.5mg、25mg、50mg、75mg或100mg药物组合物。在一些实施方式中,所述单位剂型包含125mg、150mg、175mg或200mg药物组合物。在一些实施方式中,所述单位剂型包含250mg药物组合物。
[0266]
在典型实施方式中,在单位剂型中的药物组合物是在液体形式中。在各种实施方式中,所述单位剂型包含0.1ml至50ml之间的药物组合物。在一些实施方式中,所述单位剂型包含1ml、2.5ml、5ml、7.5ml、10ml、25ml或50ml药物组合物。
[0267]
在特定实施方式中,所述单位剂型是小瓶,其含有浓度为0.01mg/ml、0.1mg/ml、0.5mg/ml或1mg/ml的1ml药物组合物。在一些实施方式中,所述单位剂型是小瓶,其含有浓度为0.01mg/ml、0.1mg/ml、0.5mg/ml或1mg/ml的2ml药物组合物。
[0268]
在一些实施方式中,在单位剂型中的药物组合物是固体形式,如适合溶解的冻干物。
[0269]
适用于皮下、皮内或肌肉内给药的单位剂型实施方式包括预装注射器、自动注射器和自动注射笔,各自含有预定量的上文所述的药物组合物。
[0270]
在各种实施方式中,所述单位剂型是预负载注射器,其包含注射器和预定量的药物组合物。在某些预负载注射器的实施方式中,注射器适于皮下施用。在某些实施方式中,注射器适于自我施用。在特定实施方式中,预负载注射器是一次性注射器。
[0271]
在各种实施方式中,预负载注射器含有约0.1ml至约0.5ml药物组合物。在某些实施方式中,注射器含有约0.5ml药物组合物。在特定实施方式中,注射器含有约1.0ml药物组合物。在特定实施方式中,注射器含有约2.0ml药物组合物。
[0272]
在某些实施方式中,所述单位剂型是自动注射笔。自动注射笔包含含有如本文所述的药物组合物的自动注射笔。在一些实施方式中,自动注射笔递送预定体积的药物组合物。在其他实施方式中,自动注射笔被配置为递送由用户设定的一定体积的药物组合物。
[0273]
在各种实施方式中,自动注射笔含有约0.1ml至约5.0ml药物组合物。在特定实施方式中,自动注射笔含有约0.5ml药物组合物。在特定实施方式中,自动注射笔含有约1.0ml药物组合物。在其他实施方式中,自动注射笔含有约5.0ml药物组合物。
[0274]
7.11.单位剂型
[0275]
药物组合物可以方便地以单位剂型存在。
[0276]
单位剂型通常适于药物组合物的一种或多种特定施用途径。
[0277]
在各种实施方式中,所述单位剂型适于通过吸入施用。在这些实施方式的某些中,所述单位剂型适于通过蒸发器施用。在这些实施方式的某些中,所述单位剂型适于通过雾化器施用。在这些实施方式的某些中,所述单位剂型适于通过气雾器施用。
[0278]
在各种实施方式中,所述单位剂型适于通过口服施用、通过口腔施用或通过舌下施用。
[0279]
在一些实施方式中,所述单位剂型适于通过静脉内、肌内或皮下施用。
[0280]
在一些实施方式中,所述单位剂型适于通过鞘内或脑室内施用。
[0281]
在一些实施方式中,所述药物组合物配制成用于局部施用。
[0282]
可与载体材料组合以产生单一剂型的活性成分的量通常是产生治疗效果的化合物的量。
[0283]
7.12.使用方法
[0284]
可以使用与完整pd
‑
1特异性结合的治疗性抗体。
[0285]
可以任选地采用体内和/或体外测定来帮助确定最佳剂量范围。制剂中使用的精确剂量还取决于给药途径和病情的严重程度,应根据从业者的判断和每个受试者的情况来决定。有效剂量可以从体外或动物模型试验系统的剂量反应曲线中推断出来。
[0286]
如果寡肽或多肽的氨基酸序列与本文提供的至少一个cdr;和/或与交叉阻断抗体a1
‑
a28的至少一种与pd
‑
1结合的pd
‑
1结合剂的cdr,和/或被抗体a1
‑
a28的至少一种交叉阻断与pd
‑
1的结合的cdr;和/或与pd
‑
1结合剂的cdr(其中所述结合剂可阻断pd
‑
1与pd
‑
l1的结合)具有至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性,则该寡肽或多肽在本公开的范围内。
[0287]
如果pd
‑
1结合剂多肽和抗体具有与抗体a1
‑
a28的至少一种的可变区具有至少85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的氨基酸序列,并且交叉阻断抗体a1
‑
a28的至少一种与pd
‑
1的结合,和/或被抗体a1
‑
a28的至少一种交叉阻断与pd
‑
1的结合;和/或可阻断pd
‑
1对pd
‑
l1的抑制作用,则pd
‑
1结合剂多肽和抗体在本公开的范围内。
[0288]
根据本公开的抗体对人pd
‑
1可以具有小于或等于5x 10
‑7m、小于或等于1x 10
‑7m、小于或等于0.5x 10
‑7m、小于或等于1x 10
‑8m、小于或等于1x 10
‑9m、小于或等于1x 10
‑
10
m、小于或等于1x 10
‑
11
m或小于或等于1x 10
‑
12
m的结合亲和力。
[0289]
抗体或结合伴体的亲和力,以及抗体抑制结合的程度,可由本领域普通技术人员使用常规技术确定,例如,scatchard等,(ann.n.y.acad.sci.51:660 672(1949))描述的那些,或通过表面等离子体共振(spr;biacore,biosensor,piscataway,nj)。对于表面等离子体共振,将靶分子固化在固相上,并与流动池中流动相中的配体接触。如果配体与固定靶点
发生结合,局部折射率会发生变化,从而导致spr角度发生变化,这可以通过检测反射光强度的变化来实时监测。可以分析spr信号的变化率以产生结合反应的结合和解离阶段的表观速率常数。这些值的比率给出了表观平衡常数(亲和力)(参见,例如,wolff等,cancer res.53:2560 65(1993))。
[0290]
根据本公开的抗体可以属于任何免疫球蛋白类别,例如igg、ige、igm、igd或iga。其可以从动物获得或来源于动物,例如,家禽(例如,鸡)和哺乳动物,包括但不限于小鼠、大鼠、仓鼠、家兔或其他啮齿动物、牛、马、绵羊、山羊、骆驼、人类或其他灵长类动物。抗体可以是内化抗体。在美国专利公开号2004/0146888 a1中一般地公开了抗体的生产。
[0291]
在上文所述产生根据本公开的抗体的方法中,包括将特定a1
‑
a28 cdr操纵到新的框架和/或恒定区中,选择所需抗体的适当测定是可用的(即,用于确定与pd
‑
1的结合亲和力的测定;交叉阻断测定;基于biacore的竞争结合测定;体内测定)。
[0292]
7.12.1.治疗对pd
‑
1抑制剂产生反应的疾病的方法
[0293]
在另一个方面中,提出了用于治疗患有对pd
‑
1抑制剂产生反应的疾病的受试者的方法。所述疾病可以是癌症、aids、阿尔茨海默氏病或者病毒或细菌感染。
[0294]
术语“治疗”、“处理”等在本文中用于一般意指获得期望的药理学和/或生理学效果。就完全或部分预防疾病、病况或其症状而言,效果可以是预防性的,和/或就部分或完全治愈疾病或病况和/或副作用(如归因于疾病或病况的症状)而言,可以是治疗性的。如本文所用,“治疗”涵盖对哺乳动物,特别是人疾病或病况的任何治疗,并且包括:(a)在可能易患该疾病或病况但尚未被诊断为患有该疾病或病况的受试者中预防该疾病或病况的发生;(b)抑制疾病或病况(例如,阻止其进展);或者(c)缓解疾病或病况(例如,使疾病或病况消退,改善一种或多种症状)。根据本领域已知的标准方法和技术,可以容易地评估任何条件的改善。通过疾病的方法治疗的受试者群体包括患有不希望的病症或疾病的受试者,以及处于发展成病况或疾病的风险中的受试者。
[0295]
术语“治疗有效剂量”或“有效量”是指产生所施用的所需效果的剂量或量。确切的剂量或量将取决于治疗的目的,并且本领域技术人员可以使用已知技术确定(参见,例如,lloyd(1999)the art,science and technology of pharmaceutical compounding)。
[0296]
术语“足够的量”指足以产生所需作用的量。
[0297]
术语“治疗有效量”是有效改善疾病症状的量。治疗有效量可以是“预防有效量”,因为预防可以被认为是治疗。
[0298]
术语“改善”指在治疗疾病状态(例如,神经变性疾病状态)重的任何治疗上有益的结果,包括预防、减轻其严重性或进展、缓解或治愈。
[0299]
实际给药量、给药速率和时程将取决于所治疗的蛋白聚集疾病的性质和严重程度。治疗处方(例如,决定剂量等)由全科医生和其他医生负责,并且通常会考虑待治疗的病症、个体患者的状况、递送部位、施用方法和从业者已知的其他因素。上文提及的技术和方案的实例可以参见remington's pharmaceutical sciences,第16版,osol,a.(ed),1980。
[0300]
在一些实施方式中,所述药物组合物通过吸入施用、口服、通过口腔施用、通过舌下施用、通过注射或通过局部应用。
[0301]
在一些实施方式中,所述药物组合物以足以调节神经元存活或多巴胺释放的量施用。在一些实施方式中,以每剂低于1g、低于500mg、低于100mg、低于10mg的量施用主要大麻
素。
[0302]
在一些实施方式中,所述药物组合物每天施用一次、每天2
‑
4次、每周2
‑
4次、每周一次或每两周一次。
[0303]
组合物可以单独施用或与其他治疗组合施用,根据待治疗的病况同时或顺序地施用。例如,药物组合物可以与一种或多种靶向不同检查点受体的药物联合施用,如ctla
‑
4抑制剂(例如,抗ctla
‑
4抗体)或tigit抑制剂(例如,抗tigit抗体)。
[0304]
8.实施例
[0305]
以下是用于实施本公开的具体实施方式的实例。提供这些实例仅用于说明目的,并不旨在以任何方式限制本公开的范围。已努力确保所用数字(例如,量、温度等)的准确性,但当然应允许一些实验误差和偏差。
[0306]
除非另有说明,否则本公开的实践将采用本领域技术范围内的蛋白质化学、生物化学、重组dna技术和药理学的常规方法。这些技术在文献中有充分的解释。参见,例如,t.e.creighton,proteins:structures and molecular properties(w.h.freeman and company,1993);a.l.lehninger,biochemistry(worth publishers,inc.,当前版本);sambrook,等,molecular cloning:a laboratory manual(第2版,1989);methods in enzymology(s.colowick和n.kaplan编著,academic press,inc.);remington's pharmaceutical sciences,第18版(easton,pennsylvania:mack publishing company,1990);carey和sundberg advanced organic chemistry 3rd ed.(plenum press)a和b卷(1992)。此外,可以使用在adler等,a natively paired antibody library yields drug leads with higher sensitivity and specificity than a randomly paired antibody library,mabs(2018),和adler等,rare,high
‑
affinity mouse anti
‑
pd
‑
1antibodies that function in checkpoint blockade,discovered using microfluidics and molecular genomics,mabs(2017)中进行解释的产生和选择抗体的方法,其全部内容通过引用并入本文。
[0307]
8.1.1.实施例1:抗原结合蛋白的产生
[0308]
小鼠免疫和样品制备:
[0309]
首先,使用titermax作为佐剂,用seq id no:7001的可溶性pd
‑
1免疫原(即,his标记的pd
‑
1蛋白(r&d systems))对携带插入的人免疫球蛋白基因的转基因小鼠进行免疫。将1μg免疫原注射至每只爪中,将3μg免疫原腹膜内施用,每3天一次持续15天。从1:200稀释开始,在每只动物血清的1:2系列稀释液上通过酶联免疫吸附测定(elisa)评估效价。在收获前每只动物给予2.5μg/爪(无佐剂)进行最终的静脉内强化。处死后,手术取出淋巴结(腘窝、腹股沟、腋窝和肠系膜)。通过手动破坏然后通过70μm过滤器制备每只动物的单细胞悬液。接下来,将easysep
tm
小鼠泛b细胞分离试剂盒(stemcell technologies)负性选择试剂盒用于从每个样品分离b细胞。通过在c
‑
chip血细胞计数仪(incyto)上计数来定量淋巴结b细胞群,并使用台盼蓝评估存活力。然后,在含12%optiprep
tm
密度梯度介质(sigma)的磷酸盐缓冲液(pbs)中将细胞稀释至5,000
–
6,000个细胞/ml。将该细胞混合物用于微流体包封。通过乳液液滴微流体平台运行来自六只动物中每一只的大约一百万的b细胞。
[0310]
产生配对重链和轻链文库:
[0311]
使用乳液液液滴微流体平台或涡流乳液产生具有天然重链ig配对完整的编码单
细胞rna的scfv的dna文库。将用于产生dna文库的方法分为1)poly(a)+mrna捕获,2)多路复用重叠延伸逆转录酶聚合酶链反应(oe
‑
rt
‑
pcr),和3)巢式pcr,以除去人工物并添加用于深度测序或酵母展示文库的衔接子。scfv文库由来自达到阳性elisa滴度的每只动物的大约一百万b细胞产生。
[0312]
对于poly(a)+mrna捕获,使用由玻璃(dolomite)制造的定制设计的融合乳液液滴微流体芯片。微流体芯片具有两个用于氟碳油(dolomite)的输入通道,一个上述细胞悬液混合物的输入通道,和一个输入通道,用于1.25mg/ml的oligo
‑
dt小珠(neb)的细胞裂解缓冲液(20mm tris ph 7.5,0.5m nacl,1mm乙二胺四乙酸(edta),0.5%吐温
‑
20和20mm二硫苏糖醇)。对于大多数芯片长度,在大部分芯片的长度下蚀刻到50μm乘以150μm的输入通道,在液滴结处窄到55μm,并用疏水性pico
‑
glide(dolomite)涂覆。使用三个mitos p泵压力泵(dolomite)来泵送液体通过芯片。液滴尺寸取决于压力,但通常直径~45mm的液滴是最佳稳定的。将乳液收集到冷却的2ml微量纤维管中,并在40℃下温育15分钟以进行mrna捕获。使pico
‑
glide(dolomite)从液滴中提取小珠。在一些实施方式中,使用涡旋制备类似的单细胞分区乳液。
[0313]
对于多路复用oe
‑
rt
‑
pcr,使用玻璃telos液滴乳液微流体芯片(dolomite)。将mrna结合的小珠重悬到oe
‑
rt
‑
pcr混合物中,并在产生27μm液滴的压力下用矿物油基表面活性剂混合物(可从gigagen购买获得)注射至微流体芯片中。oe
‑
rt
‑
pcr混合物含有2x一步rt
‑
pcr缓冲液、2.0mm mgso4、superscript iii逆转录酶和platinum taq(thermo fisher scientific),以及针对igk c区、igg c区和所有v区的引物混合物(图2)。重叠区是编码富含gly
‑
ser的scfv接头序列的dna序列。使用液滴破碎溶液(可从gigagen购买获得)从液滴中回收dna片段,然后使用qiaquick pcr纯化试剂盒(qiagen)纯化。在一些实施方式中,使用涡旋制备类似的oe
‑
rt
‑
pcr乳液。
[0314]
对于巢式pcr(图2),首先在1.7%琼脂糖凝胶上在150v下运行纯化的oe
‑
rt
‑
pcr产物80分钟。切下与连接产物相对应的1200
‑
1500个碱基对(bp)的条带,并使用nucleospin凝胶和pcr clean
‑
up试剂盒(macherey nagel)纯化。然后进行pcr以添加用于illumina测序或酵母展示的衔接子;对于测序,加入7个核苷酸的随机物以在随后的新一代测序步骤中增加碱基呼叫准确度。巢式pcr用2x nebnext高保真扩增混合物(neb)进行,其具有含有引物的illumina衔接子或用于克隆进入酵母表达载体的引物。在1.2%琼脂糖凝胶上在150v下运行巢式pcr产物50分钟。切下800
‑
1100bp的条带,并使用nucleospin凝胶和pcr clean
‑
up试剂盒(macherey nagel)纯化。
[0315]
在一些实施方式中,scfv文库不是天然配对的,例如,通过直接从b细胞分离的rna扩增scfv随机配对。
[0316]
8.1.2.实施例2:通过酵母展示分离pd
‑
1结合物
[0317]
文库筛选:
[0318]
使用ez
‑
link micro sulfo
‑
nhs
‑
lc
‑
生物素化试剂盒(thermo fisher scientific)对人igg1
‑
fc(thermo fisher scientific)和pd
‑
1(r&dsystems)蛋白进行生物素化。将生物素化试剂重悬至9mm并以50倍摩尔过量加入到蛋白质。将反应物在冰上孵育2小时,然后使用zeba脱盐柱(thermo fisher scientific)去除生物素化试剂。使用bradford测定计算最终蛋白质浓度。
[0319]
接下来,6种dna文库在酵母中作为表面scfv表达。构建了包含gal1/10启动子、aga2细胞壁系链(cell wall tether)和c末端c
‑
myc标签的酵母表面展示载体(pyd)。gal1/10启动子在含有半乳糖的培养基中诱导scfv蛋白的表达。需要aga2细胞壁系链将scfv穿梭到酵母细胞表面并将scfv栓系到细胞外空间。c
‑
myc标签在流式分选过程中用于对表达框内scfv蛋白的酵母细胞进行染色。用凝胶纯化的巢式pcr产物和线性化的pyd载体对酿酒酵母细胞(atcc)进行电穿孔(bio
‑
rad gene pulser ii;0.54kv,25uf,电阻设置为无穷大)用于体内同源重组。扩增转化细胞,并用半乳糖诱导以产生酵母scfv展示文库。
[0320]
将来自扩增的scfv文库的200万个酵母细胞用抗
‑
c
‑
myc(thermo fisher scientific a21281)和af488缀合的二抗(thermo fisher scientific a11039)染色。为了选择与pd
‑
1结合的scfv表达细胞,在一抗孵育期间将生物素化的pd
‑
1抗原添加到酵母培养物中(最终7nm),然后用pe
‑
抗生物素蛋白链菌素(thermo fisher scientific)染色。酵母细胞在bd influx(stanford shared facs facility)上流式分选双阳性细胞(af488c/pec),然后将回收的克隆接种在含有卡那霉素、链霉素和青霉素(teknova)的sd
‑
caa平板上进行扩增。然后将扩增的第一轮facs克隆以相同摩尔浓度(最终7nm)使用相同抗原进行第二轮facs。使用从最终facs分选回收的酵母制备质粒小量制备物(zymo research)。尾端pcr用于将illumina衔接子添加到质粒文库以进行深度测序。
[0321]
在典型facs点图中,右上象限包含针对抗原结合和scfv表达(由c末端c
‑
myc标签识别)染色的酵母。左下象限包含未针对抗原或scfv表达染色的酵母。右下象限包含表达scfv但不结合抗原的酵母。通过将针对抗原和scfv表达双重染色的酵母计数除以表达scfv的酵母计数来估计每个库中结合物的频率。当以7nm最终抗原浓度分选时,从免疫的小鼠生成的文库产生低scfv结合物百分比(范围0.08%
–
1.28%)。血清效价和在库中结合物的频率之间没有明确的关联。在这些分选的细胞扩增后,使用7nm最终抗原浓度的第二轮facs用于增加筛选的特异性。在第二facs中结合物的频率总是显著高于第一facs,其范围8.39%
–
84.4%。通常,在第一分选中结合物的较低频率在第二分选中产生较低结合物频率。据推测,这是由于对于在原始库中真正结合物较少的样品的较低门控特异性。
[0322]
深度库测序:
[0323]
将pd
‑
1结合克隆作为文库(“pd
‑
1结合克隆文库”)回收,并进行深度库测序。pd
‑
l1结合克隆文库于2018年11月20日根据布达佩斯条约以atcc登录号pta
‑
125509保藏,atcc帐户号97361(美国典型培养物保藏中心(atcc),10801university boulevard,manassas,va 20110usa)。文库中的每个克隆包含scfv,其包含来源于单一细胞的重链和轻链序列的配对可变(v(d)j)区。深度库测序确定了重链和轻链序列的所有配对可变(v(d)j)区的序列。在seq id no:1
‑
28和seq id no:101
‑
128中提供了从酵母scfv文库测序获得的一些重链和轻链序列。在seq id no 8001
‑
9045中提供了从酵母scfv文库测序获得的另外的序列。具体地,其可变轻链(v
l
)序列包括seq id no:8001
‑
8522。其可变重链(v
h
)序列包括seq id no:8523
‑
9045。
[0324]
使用定量pcr illumina文库定量试剂盒(kapa)对深度抗体测序文库进行定量并稀释至17.5pm。根据生产厂商的说明书,使用500次循环miseq试剂盒v2在miseq(illumina)上对文库进行测序。为了获得具有保持重链和轻链连接的高质量序列读数,在两个单独的运行中进行测序。在第一个运行(“连接的运行”)中,对scfv文库直接测序以获得针对轻链
v
‑
基因和cdr3的340个循环的正向读取,以及覆盖重链cdr3和重链v
‑
基因的一部分的162个循环的反向读取。在第二个运行(“未连接的运行”)中,将scfv文库首先用作pcr的模板,以分别扩增重链和轻链v
‑
基因。然后,分别获得重链和轻链ig的340个循环的正向读取和162个循环的反向读取。这会产生在cdr3和部分v
‑
基因重叠的正向和反向读取,这增加了对核苷酸检出的置信度。
[0325]
为消除碱基检出错误,读取的预期错误数(e)是根据其phred分数计算的。在默认情况下,弃去e>1的读取,留下最可能的碱基检出错误数为零的读取。作为另外的质量过滤器,单例核苷酸读数被弃去,因为发现两次或更多次的序列很可能是正确的。最后,通过合并来自连接的和未连接的运行的过滤序列,生成了高质量的连接的抗体序列。简言之,首先合并来自未连接的运行的正向和反向度数的一系列脚本是用python编写的。弃去任何包含错配的正向和反向序列对。接下来,来自连接的运行的核苷酸序列用于查询未连接的运行中的合并序列。脚本的最终输出是一系列全长、高质量的可变(v(d)j)序列,具有天然的重链和轻链ig配对。
[0326]
为了识别阅读框架和fr/cdr连接,首先处理精心策划的免疫球蛋白序列数据库,以生成每个fr/cdr连接的位置特异性序列矩阵(pssm)。将这些pssm用于鉴定使用上述过程生成的每个合并核苷酸序列的fr/cdr连接。这确定了每个核苷酸序列的蛋白阅读框架。对pssm具有低鉴定分数的cdr序列用感叹号表示。然后,将python脚本用于翻译序列。读取需要具有有效的预测cdr3序列,因此,例如,在v和j区段之间具有移码的读取被弃去。接下来,ublast使用scfv核苷酸序列作为查询和来自imgt数据库的v和j基因序列作为参考序列运行。具有最低e
‑
值的ublast比对用于分配v和j基因家族并计算种系的%id。
[0327]
在第二facs选择后,每只动物产生了38
‑
50个以0.1%或更高频率存在的独特scfv序列,包括总共28个独特的scfv候选结合物(轻链:seq id no:1
‑
28;重链:seq id no:101
‑
128)。具有seq id no:[n]的序列的轻链和具有seq id no:[100+n]的序列的重链是来自单细胞的同源对,并形成单scfv。例如,seq id no:1的轻链和seq id no:101的重链是同源对,seq id no:11的轻链和seq id no:111的重链是同源对,等等。
[0328]
在该方法中,两轮facs导致pd
‑
1结合scfv的富集。此外,在来自免疫小鼠的初始b细胞群的测序数据中未检测到很多scfv,并且在facs后消除了预分选小鼠库中存在的大部分scfv。因此,这项工作表明,免疫小鼠的库中存在的大多数抗体都不是免疫原的强结合物,并且这种方法可以从免疫小鼠的初始b细胞群中富集稀有的nm亲和力结合物。
[0329]
8.1.3.实施例3:抗体结合蛋白的生物学特征
[0330]
然后在中国仓鼠卵巢(cho)细胞中合成在分选前文库中以低频率出现并在分选后文库中变为高频率的scfv序列作为全长mab。这些mab包含针对每只动物在第二轮facs中2
‑
3个丰度最高的序列。此外,选择了表明sjl和balb/c小鼠品系之间趋同进化的抗体序列。
[0331]
通过生物层干涉法(bli)和/或表面等离子体共振(spr)验证了全长mab的结合动力学,并通过体外细胞测定验证了检查点抑制。
[0332]
靶结合性质:
[0333]
使用bli和/或spr确定每个全长抗体对pd
‑
1的结合特异性和亲和力。抗人pd
‑
1亲和力针对a1
‑
a11使用spr和针对a12
‑
a28使用bli。使用bli测量抗cyno pd
‑
1亲和力。
[0334]
对于bli,使用octet red96系统(fortebio)将抗体加载到抗人igg fc(ahc)生物
传感器上。将负载的生物传感器从300nm开始浸入抗原稀释液中,以1:3的比例进行6次系列稀释。使用1:1结合模型和全局拟合进行动力学分析。
[0335]
对于spr,将中等密度(>>1,000个反应单位)的抗人igg
‑
fc试剂(southern biotech 2047
‑
01)胺缀合至xantec cmd
‑
50m芯片(50nm羧甲基葡聚糖中等密度的官能团)上,使用含133mm edc(sigma)和33.3mm s
‑
nhs(thermofisher)的100mm mes ph 5.5活化。然后,将山羊抗人igg fc(southern biotech 2047
‑
01)在10mm乙酸钠ph 4.5(carterra inc.)中以25mg/m l缀合10分钟。然后,用1m乙醇胺ph 8.5(carterra inc.)使表面失活。用平板固化的运行缓冲液是hbs
‑
epc(10mm hepes、150mm nacl、3mm edta、0.05%吐温20,ph 7.4;teknova)。
[0336]
然后将传感器芯片转移到连续流微点仪(cfm;carterra inc.)进行阵列捕获。将mab上清液稀释50倍(最终浓度为3
‑
10mg/ml)到含有1mg/ml bsa的hbs
‑
epc中。将样品分别在第一次和第二次打印上以15分钟和4分钟的捕获步骤捕获两次,以使用65ml/min流速建立多个密度。在cfm中运行缓冲液也是hbs
‑
epc。
[0337]
接下来,将传感器芯片加载到spr阅读器(mx
‑
96系统;ibis technologies)上进行动力学分析。pd
‑
1在运行缓冲液(含1.0mg/ml bsa的hbs
‑
epc)中以浓度1.95、7.8、31.25、125和500nm的四倍稀释系列的五个递增浓度进样。pd
‑
1进样为5分钟,在非再生动力学系列中以8ml/秒解离15分钟。在系列结束时进样75mg/ml的山羊抗人igg fc捕获抗体以验证每个mab的捕获水平。结合数据通过扣除点间(interspot)表面和空白进样来双重参考,并使用kinetic interaction tool软件(carterra inc.)分析ka(结合速率)、kd(解离速率)和kd(亲和力)。
[0338]
对于细胞表面结合研究,生成稳定表达pd
‑
1的flp
‑
in cho(thermo fisher scientific)细胞,并以50:50的比率混合。使用含1μg抗pd
‑
1重组抗体的200μl macs缓冲液(含0.5%牛血清白蛋白和2mm edta的dpbs)将1百万个细胞在4℃下染色30分钟。然后,将细胞用抗人cd134(ox40)
‑
apc[ber
‑
act35](biolegend 350008)和抗人igg fc
‑
pe[m1310g05](biolegend 41070)抗体在4℃下共染色30分钟。将抗人cd279(pd
‑
1)
‑
fitc[eh12.2h7](biolegend 329903)抗体作为这些混合实验的对照,并使用dapi评估细胞存活力。在stanford shared facs faccility的bd influx上进行流式细胞术分析,并使用flowjo分析数据。
[0339]
鉴定了与pd
‑
1特异性结合的抗体,其亲和力(k
d
)范围10
–
280nm。表6中提供了每种抗体对pd
‑
1的亲和力(k
d
)。
[0340]
本领域技术人员可以理解,非同源配对的抗体(例如,adler等,2018)通常保留强亲和力和所需的药理学性质。在一些表现形式中,本公开描述了表6中的重链或轻链序列,与表6中的其他重链或轻链序列非同源配对,或与任何其他重链或轻链序列非同源配对。
[0341][0342][0343]
体外细胞测定:
[0344]
为了分析抗体阻断pd
‑
1/pd
‑
l1相互作用的能力,根据生产厂商的说明书使用pd
‑
1/pd
‑
l1阻断生物测定(promega)。在测定前一天,将pd
‑
l1 aapc/cho
‑
k1细胞解冻到90%ham’s f
‑
12/10%胎牛血清(fbs)中,并接种到两个96孔板的内部60个孔中。将细胞在37℃、5%co2下孵育过夜。在测定当天,在99%rpmi/1%fbs中稀释抗体。将抗体稀释液添加到含pd
‑
l1 aapc/cho
‑
k1细胞的孔中,随后添加pd
‑
1效应细胞(解冻到99%rpmi/1%fbs中)。将细胞/抗体混合物在37℃、5%co2下孵育6小时,随后添加bio
‑
glo试剂,并使用spectramax i3x酶标仪(molecular devices)读取荧光。通过计算[有抗体的信号]/[无抗体的信号]的比率绘制倍数诱导,并且使用softmax pro(molecular devices)将这些图用于计算ic50。将内部产生的派姆单抗用作阳性对照,并将结合至无关抗原的抗体用作阴性对照。
[0345]
pd
‑
1与pd
‑
l1的结合导致t细胞信号传导的抑制。因此,结合pd
‑
1并拮抗pd
‑
1/pd
‑
l1相互作用的抗体可以消除这种抑制作用,从而允许激活t细胞。pd
‑
1/pd
‑
l1检查点阻断通过体外细胞活化t细胞核因子(nfat)荧光素酶报告分析进行测试。在该测定中,抗pd
‑
1表位落在pd
‑
l1结合结构域内的抗体拮抗pd
‑
1/pd
‑
l1相互作用,导致nfat
‑
荧光素酶报告体的增加。测定了可以结合cho细胞中表达的pd
‑
1的全长mab候选物。为产生针对每种mab的ic50值,在多个浓度上进行了测量。一些全长mab(tpd1.1(a1)、tpd1.3(a3)、tpd1.4(a4)、tpd1.5(a5)、tpd1.6(a6)、tpd1.16(a9)和tpd1.19(a10))以剂量依赖性方式在检查点阻断中起作用,如表6中所总结的。七个抗体的cdr序列是保守的,如下表7中所总结的,并且可以使用其共有序列提供。
[0346]
在本公开的一些实施方式中,抗pd
‑
1抗体通过抗体依赖性细胞介导的细胞毒性(adcc)发挥药理作用。在本公开的一些实施方式中,与抗pd
‑
1抗体疗法相关的免疫相关毒性被在adcc中起作用但在检查点阻断中不起作用的抗体消除。
[0347]
[0348][0349]
使用carterra(a1
‑
a11)或fortebio(a12
‑
a28)确定每种抗体对人pd
‑
1的亲和力。确定结合速率、解离速率和k
d
,并且在表8中显示。
[0350]
[0351][0352]
表位分箱:
[0353]
使用高通量阵列spr以改良的经典夹心方法进行表位分箱。使用carterra cfm和类似于spr亲和性研究的方法对传感器芯片进行官能化,不同之处在于使用cmd
‑
200m芯片类型(200nm羧甲基葡聚糖,xantec)并以50mg/ml偶联mab,以形成具有更高结合容量的表面(固化了~3,000个反应单位)。根据上清液中mab的浓度,将mab上清液在运行缓冲液中以1:1或1:10的比例稀释。
[0354]
将传感器芯片置于mx
‑
96仪器中,使用二价胺反应性接头双(磺基琥珀酰亚胺)辛二酸酯(bs3,thermofisher)将捕获的mab(“配体”)交联到表面,在10分钟内以0.87nm进样到水中。将过量活化的bs3用1m乙醇胺ph 8.5中和。对于每个分箱循环,将7分钟进样250mg/ml人igg(jackson immunoresearch 009
‑
000
‑
003)用于封闭参考表面和靶点的任何剩余容量。
[0355]
接下来,将250nm pd
‑
1蛋白注射到传感器芯片上,然后注射稀释的mab上清液(“分析物”)或缓冲液空白作为阴性对照。因此,如果分析物mab不与配体mab竞争,则其仅与抗原
结合。在每个循环结束时,使用4份pierce igg洗脱缓冲液(thermofisher#21004)、一份5m nacl(最终0.83m)和1.25份0.85%h3po4(最终0.17%)的溶液进行一分钟的再生注射。通过多次再生,仅有18种mab作为配体保持活性,因此分箱分析包含18x 46的竞争矩阵。
[0356]
然后在spr表位数据分析软件包(carterra inc.)中使用网络社区图算法来确定表位分箱。值得注意的是,聚类算法将仅有分析物数据可用的mab与配体和分析物数据都可用的mab分开聚类。这种现象是不完全竞争矩阵的假象。具有配体和分析物数据两者的mab具有更多mab
‑
mab测量值,导致更多mab
‑
mab连接,其导致社区图中更密切的关系。
[0357]
将经过表位分箱的抗体分配到三个不同组(在表6和图3中的a、b和c)中。
[0358]
9.通过引用并入
[0359]
本技术中引用的所有出版物、专利、专利申请和其他文件出于所有目的通过引用整体并入本文,就如同每个单独的出版物、专利、专利申请或其他文件都被单独指明为针对所有目的以引用方式并入一样。
[0360]
10.等同
[0361]
尽管已经说明和描述了各种特定实施方式,但上述说明书不是限制性的。应当理解,在不脱离本公开的精神和范围的情况下可以进行各种改变。在阅读本说明书后,本领域技术人员将意识到很多变化。
[0362]
表9提供了抗体轻链、抗体重链、相应cdr和pd
‑
1的序列和序列标识符
[0363]
[0364]
[0365]
[0366]
[0367]
[0368]
[0369]
[0370][0371]
表10提供了指定克隆的轻链、重链和cdr的序列标识符
[0372]
[0373]
[0374]
[0375]
[0376]
[0377]
[0378]
[0379]
[0380]
[0381]
[0382]
[0383]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1