一种增强化学动力治疗与饥饿治疗联合的金属有机框架材料、制备方法及应用与流程
本发明涉及利用一种常见的金属有机框架材料,通过在其内部装载能够分解葡萄糖的药物或者生物酶,并在外部修饰能够分解谷胱甘肽的金属氧化物,构建起能够实现饥饿与化学动力协同治疗的材料体系。实现饥饿治疗与化学动力治疗的结合,降低化学药物的使用,减少副作用。
背景技术:
癌(cancer)是指起源于上皮组织的恶性肿瘤,癌症具有细胞分化和增殖异常、生长失去控制、浸润性和转移性等生物学特征,其发生是一个多因子、多步骤的复杂过程,分为致癌、促癌、演进三个过程。2018年2月,国家癌症中心发布了中国最新癌症数据,汇总了全国339家癌症登记点的数据,共覆盖2.8亿人群。
癌症已经成为了人类健康的杀手,每年世界上有很多人死于癌症,针对癌症的诊断及治疗成为了人们面临的重要课题。传统的治疗手段包括外科手术、放射治疗、化学药物治疗。其中外科手术会带来癌症肿瘤的扩散和转移,达到的治疗效果有限,放射治疗对人体正常组织和细胞具有很大的副作用,化学药物虽然能够很好地杀死癌症细胞,但是对于正常细胞的毒副作用也很强,截至目前为止,如何减少药物对于正常细胞的损害,增强药物的生物相容性和靶向性,开发新型治疗手段是人们研究的重点。
肿瘤微环境是指肿瘤的发生、生长及转移与肿瘤细胞所处的内外环境。肿瘤细胞可以通过自分泌和旁分泌,改变和维持自身生存和发展的条件,促进肿瘤的生长和发展,肿瘤微环境具有与正常组织不同的特征。
肿瘤组织周围细胞包括:癌细胞(cancercells)及间质细胞(stromalcells),如纤维状细胞、巨噬细胞、淋巴细胞,与肿瘤的转移及促进肿瘤生长有密切关联。其主要特征有:血管畸形,直径、形状不规则,出现渗漏结构,甚至某些区域缺少内皮细胞及基底膜;肿瘤微环境内氧含量低,接近0mmhg水平,正常细胞组织约在30mmhg左右;缺氧细胞无氧呼吸产生大量乳酸等酸性物质导致ph在6.0-7.0左右,正常组织为7.4,细胞内部ph值更低;组织压力偏大,细胞密度大,血管渗漏、淋巴管异常、肿瘤细胞外基质多;肿瘤细胞外基质(ecm)含有大量胶原纤维、糖蛋白、多糖、蛋白质。
根据这些性质,人们设计出了不同的响应、靶向机制,增强药物在肿瘤组织当中的富集,并利用这些特征来精确控制药物的释放,从而增强治疗效果,减少药物毒性。
传统药物运输载体有无机非金属、金属纳米颗粒、有机药物载体,它们具有一定的优点,但缺点也十分明显,例如无机非金属及金属纳米颗粒材料虽然药物装载量大、具有独特的物理化学特性,但生物相容性差,靶向性差,毒性较大,而有机药物载体虽然生物相容性较好,却也存在载药量低,控释困难的问题。
金属有机框架材料(metal-organicframeworks,mofs)是一种采用金属离子或者由金属作为中心构建的次级建构单元(secondbuildingunit,sbu)为结点,并通过有机配体进行连接而形成多孔晶体。
mofs具有比表面积大,孔隙率超高和孔径可调、功能位点丰富、生物相容性良好等优点而被作为一种潜力巨大的药物载体材料。由于mofs材料具有强的可设计性,联合肿瘤微环境中的各种特征,人们开发设计出了不同类别的药物释放响应机制,例如温度、压强、内部的ph、谷胱甘肽(gsh)、h2o2、h2s、自由基、dna、酶等;为了降低药物的使用量,人们还开发设计出了新的治疗手段和方法,例如化学动力治疗、饥饿治疗、光热治疗等;同时,癌细胞上各种过度表达的受体或特异性化学物质被利用于增强药物载体靶向运输作用,如在mof上修饰叶酸可以增强癌细胞的药物摄入量。
作为一种新兴的治疗手段,化学动力学疗法(cdt)利用芬顿或类芬顿反应产生高细胞毒性的羟基自由基(·oh)。芬顿和类芬顿反应在形成活性氧(ros)过程中主要依赖于催化剂与h2o2的相互作用,无需氧气和外源能量输入。因此,cdt有望克服肿瘤光动力疗法(目前最常用的基于ros的治疗手段)的一些难题,例如乏氧环境下ros形成效率低、光穿透深度不足等。近来,cdt试剂的开发受到广大科研工作者的关注。目前,一些芬顿催化剂通过将癌细胞的内源过氧化氢(h2o2)转化为·oh,从而实现癌症的cdt。然而,肿瘤细胞自身的内源h2o2并不足以实现满意的化学动力学疗效。因此,发展具备增加细胞内h2o2功能的化学动力学试剂是非常有意义的。
金属有机框架材料(mofs)优异的孔道结构可以装载各种不同的客体分子,同时其可修饰性也很强,因此在癌症治疗领域收到了人们的广泛关注。本发明利用金属有机框架材料对肿瘤微环境的响应机制,提出了将饥饿治疗与化学动力治疗两种新型癌症治疗手段结合的材料体系,从而减少了抗癌药物的使用,降低了治疗过程中的副作用。
技术实现要素:
本发明的目的在于提供一种联合谷胱甘肽的分解、利用类芬顿反应,达到饥饿治疗与化学动力治疗协同作用的材料体系。
本发明的增强化学动力治疗与饥饿治疗联合的金属有机框架材料为金属氧化物、zif-8、可分解葡萄糖的物质三者的复合材料,在zif-8内部包裹有可分解葡萄糖的物质,在zif-8表面修饰有金属氧化物;所述的金属氧化物可分解谷胱甘肽且产生的金属离子可催化过氧化氢分解产生·oh。
所述的金属氧化物为二氧化锰、氧化铜、或氧化亚铜。其与谷胱甘肽反应可以产生的类芬顿反应的金属离子为锰离子、铜离子。
所述的可分解葡萄糖的物质为葡萄糖氧化酶或金属配合物类药物,下文中简称为药物。
所述的金属配合物类药物为二-3羟基-2-甲基-4-吡喃酮氧钒化合物。
该体系是在zif-8生长条件之下,加入葡萄糖分解物质如生物酶或者金属配合物类药物,在金属有机框架材料形成晶体的过程中将葡萄糖分解物包裹在晶体内部,之后将得到的固体粉末材料进行后修饰,在其表面上修饰金属氧化物的纳米颗粒,并且加入聚醚物质f127来增强材料的分散性与生物相容性。
本发明的增强化学动力治疗与饥饿治疗联合的金属有机框架材料的制备方法,包括以下步骤:
在超纯水中加入2-甲基咪唑,溶解以后加入葡萄糖分解物的超纯水溶液,之后加入六水合硝酸锌的超纯水溶液,可同时加入六水合硝酸铜的超纯水溶液,室温下反应后,产物用超纯水洗涤并离心,干燥,得到粉末产物zif-8@药物。取适量粉末于超纯水中,并加入可获得所述金属氧化物的原料,将zif-8@药物与金属氧化物结合,之后加入聚醚物质f127,增强材料在溶液中的分散性和生物相容性,体系搅拌反应12h,洗涤离心后干燥,得到粉末固体mox@zif-8@药物。
本发明成功在金属有机框架材料zif-8晶体生长阶段,原位封装包裹了葡萄糖分解物质,实现了将蛋白质生物大分子或药物包裹在zif-8内部。
当采用的可分解葡萄糖的物质为葡萄糖氧化酶时,制得的zif-8@gox经过紫外可见吸收光谱的测试可以测得在mofs内部葡萄糖氧化酶的质量分数在20wt%左右,并且对zif-8@药物的性能进行了测试:在ph=5的条件下,外层的zif-8逐渐分解释放内部包裹的葡萄糖氧化酶,葡萄糖氧化酶催化底物葡萄糖分解产生葡萄糖酸和过氧化氢,过氧化氢在二价锰的催化作用下分解产生·oh使指示剂亚甲基蓝褪色。
得到的zif-8@gox为淡黄色粉末,溶于水后,将zif-8@gox与金属氧化物结合,得到mox@zif-8@gox的粉末。并针对复合材料对于谷胱甘肽的分解作用进行了测试,在不同浓度的谷胱甘肽和8mm的过氧化氢浓度之下,材料可以与谷胱甘肽反应产生金属离子,金属离子可以催化过氧化氢分解产生羟基自由基从而达到指示剂亚甲基蓝褪色的效果。随着谷胱甘肽含量的增加,反应产生的金属离子数量也增多,催化过氧化氢能够产生更多的羟基自由基,褪色效果更加明显,实验发现,从0到1mm谷胱甘肽,溶液的褪色效果逐渐增强,并在1mm处达到最大值,之后,由于谷胱甘肽过量,产生的羟基自由基被过量的谷胱甘肽反应,导致最后褪色的效果有所降低,在癌细胞的肿瘤微环境中,谷胱甘肽的含量约在10mm左右,证明了反应得到的产物可以有效降低谷胱甘肽的含量,从而提高治疗效果,同时材料也进行了mtt细胞毒性实验,发现材料的生物相容性较好,在化学动力治疗领域有广阔的应用前景。
本发明具体的有益效果在于:
1、本发明在zif-8内部包裹了可分解葡萄糖的物质,并对材料进行了表面修饰,实现了饥饿治疗与化学动力治疗的联合作用。
2、本发明材料表面的金属氧化物能够有效降解谷胱甘肽,并且产生能够催化类芬顿反应的金属离子,并且金属离子的毒性较低,生物相容性好。
3、zif-8具有ph响应的效果,mofs在肿瘤低ph的条件下可以分解,同时释放其内部包裹的葡萄糖氧化酶(gox)或具有类似功能的药物。
4、本发明提供了一种将不同的癌症治疗手段结合的材料设计思路,外部金属氧化物消耗gsh,增强化学动力作用效果,搭载的酶或者药物可以降低细胞内营养物质含量,从而实现饥饿治疗与化学动力治疗的联合,可利用这一思路选择具有类似功能效果的材料。
5、本发明避免了使用对人体副作用较大的化学药物,而采用了两种治疗方法的联合,具有很好的发展前景。
附图说明
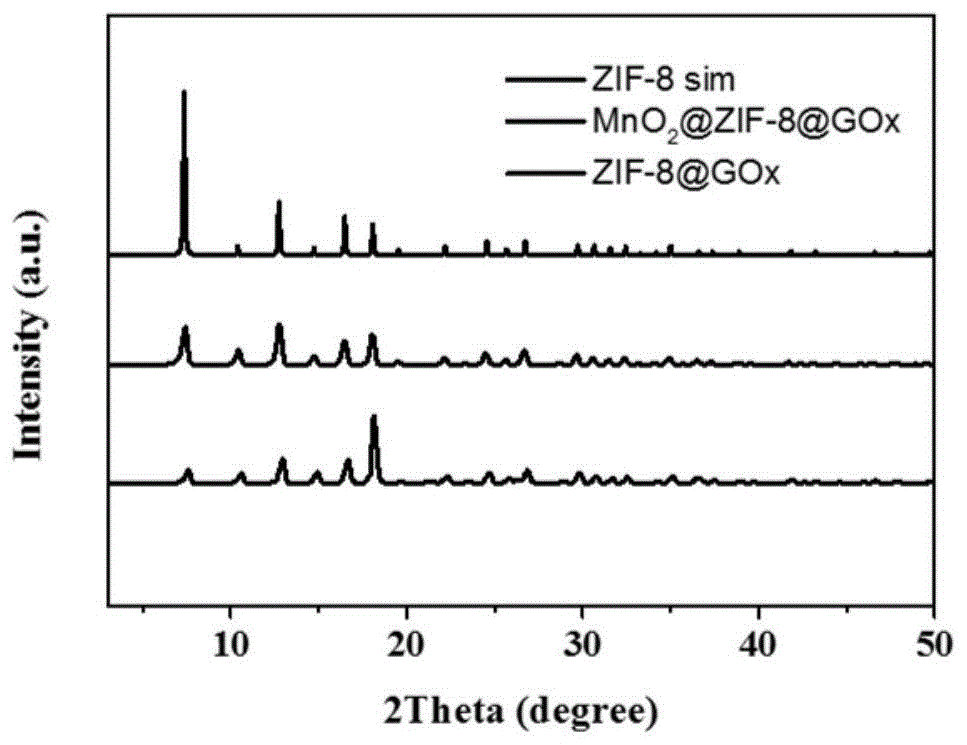
图1是本发明的金属有机框架及复合材料的xrd图谱;
图2是本发明的金属有机框架复合材料的扫描电镜照片;
图3是本发明测定材料中酶的含量的紫外可见吸收光谱;
图4是本发明的材料zif-8@gox在不同的葡萄糖浓度下的催化性能;
图5是本发明的材料mno2@zif-8@gox分解不同浓度谷胱甘肽的紫外可见吸收光谱;
图6是本发明的材料mno2@zif-8@gox生物相容性实验图。
具体实施方式
实施例1:
利用2-甲基咪唑与六水合硝酸锌通过室温共沉淀法合成zif-8,并且将葡萄糖氧化酶(gox)包裹在mofs的内部,其具体的合成路线如下:
将410mg的2-甲基咪唑溶于4ml超纯水中,加入1ml的10mg/ml的葡萄糖氧化酶超纯水溶液,并不断搅拌,将37mg六水合硝酸锌溶于1ml超纯水中,逐滴加入到反应体系中,25℃下反应1h,产物用超纯水洗涤3次,在10000r/min条件下离心7min,在37℃真空干燥箱内干燥12h,得到淡黄色粉末产物。取50mg淡黄色粉末溶于10ml超纯水中,加入20μl0.15m一水合硫酸锰超纯水溶液,加入20μl0.1m高锰酸钾超纯水溶液,反应15min,产物用超纯水洗涤三次,10000r/min条件下离心7min。将产物加入10ml超纯水中,加入4mg的f127,25℃下搅拌反应12h,洗涤离心后在37℃下真空干燥,得到棕色粉末固体。
通过粉末及薄膜xrd射线衍射分析可得,mno2@zif-8@gox材料和zif-8@gox材料保持着zif-8粉末的晶型。这表明在反应前后,zif-8的晶体结构依旧保持得完好。
利用扫描电镜对材料的形貌特征进行了观察,发现相较于纯zif-8晶体颗粒,我们得到的复合材料颗粒尺寸大约在400-500nm,颗粒表面附着有直径约为几十纳米的颗粒,通过eds元素分析发现,mn元素覆盖在晶体的表面,其含量大约为8%,表明我们成功过在zif-8内部装载了葡萄糖氧化酶(gox),并且在其表面修饰了二氧化锰金属氧化物。
葡萄糖氧化酶在382nm和452nm处有两个特征吸收峰,通过测量反应前后上清液在该处的紫外可见吸收峰,可以定性判断葡萄糖氧化酶已经被包裹在了zif-8的内部。
随后,配制了不同浓度梯度gox溶液,测量在452nm处的吸收强度,绘制标准曲线。测量反应后上清液在452nm的吸收,确定上清液gox含量。结合产物的质量,得到酶的质量分数为23.5%。
对zif-8@gox的化学动力性能进行测试,在ph=5的缓冲溶液条件下,加入50μg/ml的zif-8@gox,设置不同浓度梯度的葡萄糖浓度,mncl2作为催化剂,其含量为0.5mm,指示剂为亚甲基蓝,材料放置5h后加入25mmnahco3/5%co2缓冲溶液,测试随着时间变化,溶液在665nm处的紫外可见吸收峰值,反映材料对于葡萄糖的分解消耗能力。结果表明随着反应时间增加,溶液在665nm处的吸收值不断降低,且葡萄糖浓度越高,下降幅度越明显,证明了材料在酸性条件下会逐渐分解释放出葡萄糖氧化酶,并且催化葡萄糖反应产生过氧化氢,能够消耗营养物质葡萄糖,达到饥饿治疗的目的。
而后对mno2@zif-8@gox复合材料对于谷胱甘肽的分解作用进行测试,在25mmnahco3/5%co2缓冲溶液条件下,gsh的浓度梯度为0,0.01,0.25,0.5,1,2,10mm,反应30min,之后加入5μg/ml的指示剂mb,8mmh2o2,在37℃下放置30min,测量溶液在665nm的吸光度。
实验发现,随着gsh浓度的不断上升,二氧化锰与gsh反应产生mn2+越多,能够进一步催化过氧化氢分解产生羟基自由基导致mb褪色,随着浓度增加,褪色效果也逐渐明显,在1mm处达到最大幅度,而后随着gsh的过量,反应产生的羟基自由基被过量gsh还原,导致溶液吸光度的下降幅度减少。
对mno2@zif-8@gox进行mtt细胞毒性实验,发现材料与细胞进行共培养之后,细胞的存活率较高,证明了材料的细胞毒性较低。
实验证明了得到的复合材料能够催化葡萄糖的氧化分解产生过氧化氢,同时还能分解过量的谷胱甘肽产生类芬顿反应的金属离子用于化学动力治疗,实现了化学动力与饥饿治疗的联合作用平台的构建,具有长远的应用前景。
实施例2:
利用2-甲基咪唑与六水合硝酸锌及六水合硝酸铜通过室温共沉淀法合成铜掺杂的cu/zif-8,并且将葡萄糖氧化酶(gox)包裹在mofs的内部,其具体的合成路线如下:
将1.62g的2-甲基咪唑溶于20ml超纯水中,加入1ml的25mg/ml的葡萄糖氧化酶超纯水溶液,并不断搅拌,将370mg六水合硝酸锌和370mg六水合硝酸铜溶于1ml超纯水中,逐滴加入到反应体系中,25℃下搅拌反应1h,产物用超纯水洗涤3次,在10000r/min条件下离心7min,在37℃真空干燥箱内干燥12h,得到粉末产物。取50mg淡黄色粉末溶于10ml超纯水中,加入20μl0.15m一水合硫酸锰超纯水溶液,加入20μl0.1m高锰酸钾超纯水溶液,反应15min,产物用超纯水洗涤三次,10000r/min条件下离心7min。将产物加入20ml超纯水中,加入5mg的f127,25℃下搅拌反应12h,洗涤离心后在37℃下真空干燥,得到粉末固体。
得到的粉末固体材料的稳定性保持良好,依旧维持zif-8的形貌特征和xrd衍射峰,外层的二氧化锰纳米颗粒可以与谷胱甘肽反应生成二价锰离子,进入细胞之后,在酸性的条件下,cu/zif-8分解,释放的二价铜离子可以进一步与谷胱甘肽反应产生一价铜离子,同时内部包裹的葡萄糖氧化酶可以分解细胞内部的葡萄糖产生过氧化氢,在前面产生的锰离子和铜离子的作用之下,过氧化氢分解产生细胞高毒性的羟基自由基,从而实现了化学动力与饥饿治疗的联合作用,有望在未来运用于癌症的治疗中。
- 还没有人留言评论。精彩留言会获得点赞!