一种抗胰蛋白酶的胞外水解酶及其应用的制作方法
本发明属于微生物及基因工程技术领域,具体涉及一种抗胰蛋白酶的胞外水解酶及其在抗胰蛋白酶抑制/瓦解微生物生物被膜中的应用。
背景技术:
生物被膜与人类密切相关,在临床上往往引起很难治愈的慢性感染。这主要是因为细菌一旦形成生物被膜,对抗菌药物的抗药性与游离状态相比会增加成百上千倍,并能够更容易地逃避宿主的免疫反应,因而大大增加了治疗的难度。细菌生物被膜引起的感染主要有两种:一种是生物医学材料相关感染,如导管、插管、生物材料移植物相关感染;另一种是细菌生物被膜疾病,如肺囊性纤维化、慢性骨髓炎等。而目前临床上还缺乏能够有效、稳定地抑制或瓦解铜绿假单胞菌等微生物的生物被膜的制剂和方法。
最近的临床实验表明铜绿假单胞菌自身产生的胞外水解酶pslg可以用来治疗猪和小鼠的伤口感染,大幅提高抗生素的疗效,预示将来可将pslg用于临床上治疗生物被膜引起的感染。然而,pslg可能使用的环境中存在大量的蛋白酶,尤其是胰蛋白酶类蛋白酶,这些酶的存在会严重抑制pslg的活性。研究表明人类基因组中有约2%的基因编码蛋白酶,其中一大部分是胰蛋白酶类。此外,铜绿假单胞菌自身也可以分泌多种胞外蛋白酶,其中也包括胰蛋白酶类蛋白酶,这些严重限制了pslg的应用。因此,迫切需要开发能抗胰蛋白酶的胞外水解酶。检索发现有关抗胰蛋白酶的胞外水解酶及其在抗胰蛋白酶抑制/瓦解微生物生物被膜中的应用的专利还未见报道。
技术实现要素:
针对现有技术的不足,本发明要解决的问题是提供一种抗胰蛋白酶的胞外水解酶及其在抗胰蛋白酶抑制/瓦解微生物生物被膜中的应用。
本发明所述的抗胰蛋白酶的胞外水解酶,其特征在于:所述酶的相应氨基酸序列如seqidno.1所示。
本发明所述的抗胰蛋白酶的胞外水解酶的基因,其特征在于:所述基因的核苷酸序列如seqidno.2所示。
一种制备上述抗胰蛋白酶的胞外水解酶蛋白的方法,其特征在于:将seqidno.2基因的核苷酸序列连接表达载体pgl01,然后转化e.colibl21(de3)进行iptg诱导表达,用ni-nta亲和层析、source15q阴离子交换层析及superdex20010/300gl分子排阻层析方法纯化得到蛋白。
本发明所述抗胰蛋白酶的胞外水解酶在对胰蛋白酶的耐受程度研究中的应用。
本发明所述抗胰蛋白酶的胞外水解酶在抑制细菌生物被膜形成中的应用。
本发明所述抗胰蛋白酶的胞外水解酶在瓦解已形成的细菌生物被膜中的应用。
其中:所述细菌优选是铜绿假单胞菌。
本发明利用蛋白质三维结构分析与胰蛋白酶酶切串联质朴分析相结合设计突变位点,并对突变体蛋白进行抗胰蛋白酶酶切实验,筛选得到具有抗胰蛋白酶特性的胞外水解酶(命名为pslgk286a/k433s蛋白)。
实验证实:与现有pslg蛋白相比,新得到的抗胰蛋白酶胞外水解酶蛋白pslgk286a/k433s对胰蛋白酶的耐受程度显著增强。pslgk286a/k433s的ic50(在所用实验条件下37℃、30min水解50%起始pslg蛋白量所需的胰蛋白酶浓度)比已有的野生型pslg提升了10倍。
实验证实:在实验条件中不添加胰蛋白酶时,pslgk286a/k433s抑制/瓦解微生物生物被膜的效果与野生型pslg无明显差异,表明突变未影响胞外水解酶的底物结合以及其抑制/瓦解微生物生物被膜的活性。
实验证实:在实验条件中添加胰蛋白酶时,pslgk286a/k433s抑制微生物生物被膜的效果与野生型pslg相比显著提高,表明pslgk286a/k433s具有更强的胰蛋白酶耐受性。
与现有技术相比,本发明突出的效果为:新发现的胞外水解酶pslgk286a/k433s对胰蛋白酶的耐受程度显著增强,其抑制/瓦解微生物生物被膜的效果不受影响。
附图说明
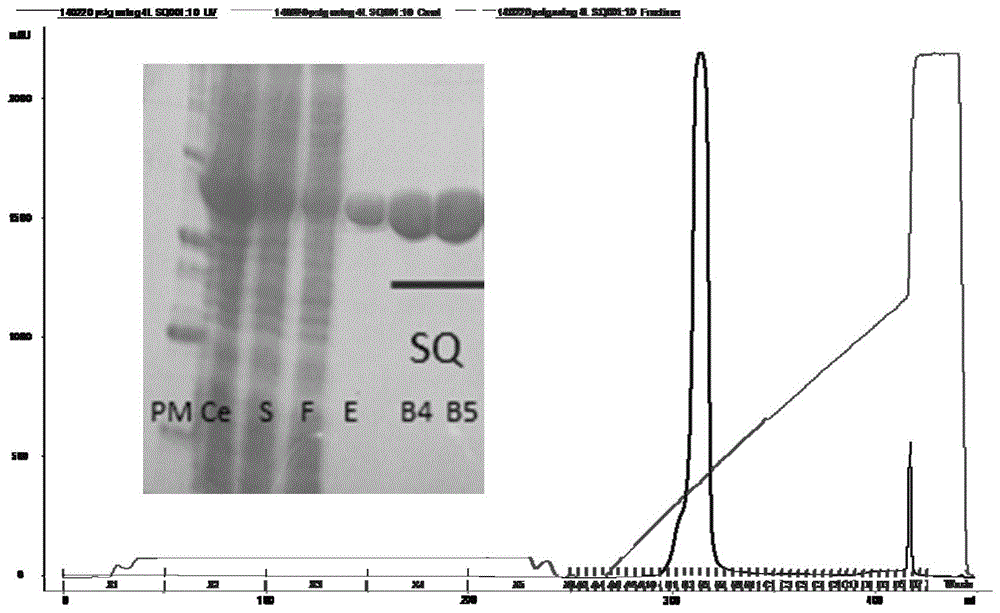
图1为抗胰蛋白酶胞外水解酶pslgk286a/k433s在大肠杆菌中表达纯化结果。
其中:图1a为ni-nta及阴离子交换层析source15q纯化结果,pm:proteinmarker;ce:celllysis;s:supernatant;f:flowthrough;e:elution;图1b为分子排阻层析superdex200纯化结果。
图2为抗胰蛋白酶的胞外水解酶蛋白pslgk286a/k433s与现有野生型pslg蛋白的胰蛋白酶水解图。
其中:图2a为野生型pslg与pslgk286a/k433s蛋白经不同浓度的胰蛋白酶在37度处理30min的酶切结果图;图2b为imagej软件对图2a进行定量、拟合分析的结果图。
图3为外加pslgk286a/k433s和野生型pslg蛋白抑制铜绿假单胞菌生物被膜的形成对比图。在不添加胰蛋白酶情况下,50nmpslgk286a/k433s蛋白可以抑制约80%生物被膜的形成,与wtpslg蛋白活性相比无明显差异。
图4为pslgk286a/k433s与野生型pslg蛋白对已形成的铜绿假单胞菌生物被膜的瓦解结果图。如图所示,50nmpslgk286a/k433s与wtpslg蛋白处理30min均可瓦解约75%的生物被膜。
图5为胰蛋白酶存在时,pslgk286a/k433s和野生型pslg蛋白的生物被膜抑制活性对比图。
结果显示,在添加胰蛋白酶情况下,pslgk286a/k433s蛋白抑制生物被膜活性较野生型pslg蛋白显著增加。当所添加pslg与胰蛋白酶摩尔比为32.4:1时,pslgk286a/k433s蛋白和wtpslg可分别抑制30%和10%的生物被膜形成;当所添加pslg蛋白与胰蛋白酶的摩尔比为0.6:1时,wtpslg彻底失活,而pslgk286a/k433s蛋白仍可抑制10%生物被膜的形成。
图6为将seqidno.1所示的氨基酸序列中氨基酸k286和k433分别突变为其它氨基酸,所得到的蛋白对胰蛋白酶的耐受结果图。
结果显示,分别将seqidno.1所示的氨基酸序列中氨基酸k286和k433突变为a、s、d,所得突变蛋白对胰蛋白酶的耐受程度均显著提高,表明氨基酸k286和k433为胰蛋白酶酶切位点。
图7为将seqidno.1所示的氨基酸序列中氨基酸k286和k433分别突变为其它氨基酸,所得到的蛋白降解生物被膜活性图。
结果显示,分别将seqidno.1所示的氨基酸序列中氨基酸k286和k433突变为a、s、d,所得突变蛋白对铜绿假单胞菌生物被膜降解活性与野生型相比无明显差异。
具体实施方式
下面结合具体附图和实施例对本发明内容进行详细说明。如下所述例子仅是本发明的较佳实施方式而已,应该说明的是,下述说明仅仅是为了解释本发明,并非对本发明作任何形式上的限制,凡是依据本发明的技术实质对实施方式所做的任何简单修改,等同变化与修饰,均属于本发明技术方案的范围内。
下述实施例中,所使用的实验方法,未做具体说明的,均为常规方法,例如可以参考《分子克隆实验指南》(sambrook和russell,2001)。
下述实施例中,所使用的材料、试剂、菌株、载体等,如无特殊说明,均从商业途径得到。其中,所述表达载体pgl01是由载体pet15b以常规方法改造制成,在n端his-tag后添加了prepscissionprotease(ppase)酶的酶切位点用于切除融合蛋白n端的his-tag。
实施例1抗胰蛋白酶的胞外水解酶蛋白的制备
通过聚合酶链式反应(pcr)从铜绿假单胞菌(p.aeruginosa)pao1菌株的基因组dna中扩增得到编码pslg蛋白第31-442氨基酸的基因序列,并将其连接入pgl01表达载体中,所得质粒为野生型pgl01-pslg。抗胰蛋白酶胞外水解酶蛋白的表达质粒以野生型pgl01-pslg质粒为模板,通过quickchange方法引入氨基酸突变k286a和k433s,所得质粒为pgl01-pslgk286a/k433s。将pgl01-pslgk286a/k433s质粒转化大肠杆菌e.colibl21(de3),并将转化后所得细胞接种于含有终浓度为100μgml-1氨苄青霉素的lb培养基中。将细胞置于37度、200rpm培养直至od600约为0.8,降温至16度1小时后向培养基中添加终浓度为0.12mm的isopropylβ-d-thiogalactopyranoside,200rpm培养过夜。
第二天,收集菌体(4200rpm,4℃,15min),加入lysisbuffer(25mmtrisph8.0,200mmnacl)重悬菌液,并进行超声破碎。将破碎后所得菌液离心(14000rpm,4℃,45min),上清液上样到ni-nta亲和层析柱上,用lysisbuffer冲洗约10个柱体积,除去非特异性吸附的杂蛋白,然后加入2个柱体积lysisbuffer,0.12mgml-1ppase,4℃孵育过夜切去his-tag。
第三天,用lysisbuffer洗脱ni-nta柱5-8个柱体积,所得蛋白溶液通过阴离子交换层析(source15qhr16/10,gehealthcare)和分子排阻层析(superdex20010/300gl,gehealthcare)进一步进行纯化。阴离子交换层析所用梯度洗脱buffer为0-1mnacl,25mmtrisph8.0,分子排阻层析所用buffer为100mmnacl,10mmtrisph8.0。最后,通过sds-page对蛋白样品的浓度和纯度进行鉴定,确定得到抗胰蛋白酶的胞外水解酶蛋白(命名为pslgk286a/k433s蛋白)。采用该方法1l表达细胞可获得约20mgpslgk286a/k433s蛋白。图1所示为通过ni-nta、阴离子交换层析、分子排阻层析进行蛋白纯化的结果。
实施例2抗胰蛋白酶的胞外水解酶蛋白对胰蛋白酶的耐受程度显著提高使用实施例1制得的抗胰蛋白酶的胞外水解酶蛋白pslgk286a/k433s,分组使其蛋白浓度均为2.7mg/ml,所用胰蛋白酶浓度依次为2,1,1/3,1/9,1/27,1/81,1/243,1/729,0mg/ml;同时设定pslgwt(野生型)对照组。将各组蛋白与胰蛋白酶等体积混匀后放置37℃反应30min,加入sdsloadingbuffer终止反应,进行sds-page分析。
结果如图2所示,与pslgwt(野生型)相比,本发明的抗胰蛋白酶的胞外水解酶蛋白(pslgk286a/k433s蛋白)所能耐受的胰蛋白酶的浓度显著提高。wtpslg和抗胰蛋白酶的胞外水解酶蛋白的ic50(37℃30min内降解起始蛋白量的一半所需的胰酶浓度)分别为0.028mg/ml和0.283mg/ml,即与wtpslg相比,pslgk286a/k433s蛋白的ic50提高近10倍。
上述结果表明,本发明的抗胰蛋白酶的胞外水解酶(pslgk286a/k433s蛋白)稳定性较对照(野生型)大大提高,能更好地应用于各种环境。
实施例3外加抗胰蛋白酶的胞外水解酶(pslgk286a/k433s蛋白)抑制铜绿假单胞菌生物被膜的形成
接lbns平板上新鲜单克隆铜绿假单胞菌pao1于lbns液体培养基中,在37℃、200rpm/min震荡培养12小时,然后以1%接种量接在jensen培养基中。同时,分别添加终浓度为50nm的pslgk286a/k433s蛋白或wtpslg蛋白,不添加pslg样品为空白对照。菌液于96孔板中在30℃静止培养24小时后,采用结晶紫法检测生物被膜的生物量:弃去孔中游离的菌体后,水洗三次;接着用0.1%的结晶紫对生物被膜进行染色,水洗三次后,用30%的醋酸溶解结合在生物被膜上的结晶紫,利用分光光度计检测其od560的吸收值。
结果如图3所示,在不添加胰蛋白酶情况下,50nmpslgk286a/k433s蛋白可以抑制约80%生物被膜的形成,与wtpslg蛋白活性相比无明显差异。
实施例4抗胰蛋白酶的胞外水解酶(pslgk286a/k433s蛋白)对已形成的铜绿假单胞菌生物被膜的瓦解
接lbns平板上新鲜单克隆铜绿假单胞菌pao1于lbns液体培养基中,在37℃下200rpm/min震荡培养12小时,然后以1%接种量接在jensen培养液中,于96孔板中30℃静止培养24小时。弃去游离的菌体,水洗3次后分别添加200μl含有50nmpslgk286a/k433s蛋白或wtpslg的新鲜jensen培养液,并以空白培养液作为对照。30℃处理30min后,用结晶紫染色法检测处理后的生物被膜的生物量(结晶紫染色法具体操作步骤可参照实施例3)。
结果如图4所示,50nmpslgk286a/k433s蛋白处理30min可瓦解约75%的生物被膜,与wtpslg蛋白活性相比无明显差异。
实施例5胰蛋白酶存在时,抗胰蛋白酶的胞外水解酶(pslgk286a/k433s蛋白)的生物被膜抑制活性较wtpslg显著增加
接lbns平板上新鲜单克隆铜绿假单胞菌pao1于lbns液体培养基中,在37℃、200rpm/min震荡培养12小时,然后以1%接种量接在jensen培养基中。分别向培养基中添加终浓度为50nm的pslgk286a+k433s蛋白或wtpslg蛋白,并同时添加不同浓度的胰蛋白酶,不添加pslg样品为空白对照。菌液于96孔板中在30℃静止培养24小时后,采用结晶紫法检测生物被膜的生物量:弃去孔中游离的菌体后,水洗三次;接着用0.1%的结晶紫对生物被膜进行染色,水洗三次后,用30%的醋酸溶解结合在生物被膜上的结晶紫,利用分光光度计检测其od560的吸收值。设置2个实验组,所添加pslg蛋白与胰蛋白酶的摩尔比分别设置为32.4:1和0.6:1。
结果如图5所示,在添加胰蛋白酶情况下,pslgk286a/k433s蛋白抑制生物被膜活性较野生型pslg蛋白显著增加。当所添加pslg与胰蛋白酶摩尔比为32.4:1时,pslgk286a/k433s蛋白和wtpslg可分别抑制30%和10%的生物被膜形成;当所添加pslg蛋白与胰蛋白酶的摩尔比为0.6:1时,wtpslg彻底失活,而pslgk286a/k433s蛋白仍可抑制10%生物被膜的形成。
实施例6将seqidno.1所示的氨基酸序列中氨基酸k286和k433分别突变为其它氨基酸,胰蛋白酶耐受程度仍显著提高
实验方法同实施例1和实施例2。
结果如图6所示,分别将seqidno.1所示的氨基酸序列中氨基酸k286和k433突变为a、s、d,所得突变蛋白对胰蛋白酶的耐受程度均显著提高,表明氨基酸k286和k433为胰蛋白酶酶切位点。
实施例7将seqidno.1所示的氨基酸序列中氨基酸k286和k433突变不影响所述的胞外水解酶降解生物被膜活性
实验方法同实施例1和实施例3、实施例4。
结果如图7所示,分别将seqidno.1所示的氨基酸序列中氨基酸k286和k433突变为a、s、d,所得突变蛋白对铜绿假单胞菌生物被膜降解活性与野生型相比无明显差异。
序列表
<110>山东大学
<120>一种抗胰蛋白酶的胞外水解酶及其应用
<141>2020-02-10
<160>2
<210>1
<211>442
<212>prt
<213>铜绿假单胞菌(p.aeruginosa)pao1
<221>抗胰蛋白酶的胞外水解酶的氨基酸序列
<222>(1)…(442)
<400>1
markglylggsalllavvlllvfwgrpadaeiqvlkapravvwkdflgvnaqflwfsper60
ynkqidrlqdlglewvrldlhwdrletaedqyqlasldqlvkdlearqlksvfylvgsar120
fittapfyspfqdqypprdpevfarrmamlsqrypsvaawqvwnepnligfwrpkadpeg180
yakllqastialrmvdpekpvvsagmaffsempdgrtmfdalghlgveslgtiatyhpyt240
qlpegnypwnldfvshanqinralrnagvpaiwstewgwsaykgpaelqdiigvegqady300
vlrrlalmsaldydriflftlsdldqrasvrdrdyglldldanpkpvylalqrflkvtgp360
klrpadppvtedlpdgsfsigwtredgrnvwlfwsarggnvrlpklkeatlhdplsgkvt420
plsgsdglevpvssslqmlvwe442
<210>2
<211>1329
<212>dna
<213>铜绿假单胞菌(p.aeruginosa)pao1
<221>抗胰蛋白酶的胞外水解酶基因的核苷酸序列
<222>(1)…(1329)
<400>2
atggcacgtaagggactctatctgggcggcagcgcgctgctgctcgccgtggtactgctg60
ctggtgttctgggggcgtcccgccgacgccgagatccaggtactgaaggcgcctcgcgcg120
gtggtctggaaagacttcctcggggtcaacgcgcagttcctctggttcagcccggagcgt180
tacaacaagcagatcgaccgcctgcaggacctggggctggagtgggtgcgcctggacctg240
cactgggaccgcctggaaaccgccgaggaccagtaccagctggcctccctcgaccagttg300
gtcaaagatctcgaggcgcgccagctgaagtcggtgttctacctggtcggctcggcccgc360
ttcatcaccaccgcgccgttctactcgcccttccaggaccagtatccgccgcgcgacccg420
gaagtcttcgcccggcgcatggcgatgctctcgcagcgctacccgagcgtggccgcctgg480
caggtatggaacgagcccaacctgatcggcttctggcggcccaaggccgacccggaaggc540
tacgccaagctgctccaggccagcaccatcgccctgcgcatggtcgacccggagaagccg600
gtggtttccgccggcatggccttcttcagcgagatgcccgacggccgcaccatgttcgac660
gccctcggccacctgggcgtggagagcctcggcaccatcgccacctaccacccctatacc720
cagttgccggaaggcaactacccgtggaacctggacttcgtctcccacgccaaccagatc780
aaccgcgccctgcgcaacgccggcgtgccggcgatctggagcaccgagtggggctggtcg840
gcctacaaggggccggcagagttgcaggacatcattggcgtcgaaggccaggccgactac900
gtgctgcgtcgcctggcgctgatgagtgcgctggactacgaccggatcttcctcttcacc960
ctcagcgatctcgaccagcgcgccagcgtgcgcgaccgcgactacggcctgctcgacctg1020
gacgccaaccccaagccggtctacctggccctgcaacgcttcctcaaggtcaccgggccg1080
aagctgcgcccggccgacccgccggtcaccgaggacctgcccgacggttccttcagcatc1140
ggctggacccgcgaggacggtcgcaacgtctggctgttctggtcggcccgcggcggcaac1200
gtgcgcctgccgaagctcaaggaggccaccctgcacgatccgctcagcggcaaggtcacg1260
cccttgagcggcagcgacggcctggaagtcccggtgagttccagcctgcagatgctggtc1320
tgggagtga1329
- 还没有人留言评论。精彩留言会获得点赞!