用于肿瘤治疗的11-脱氧皮质醇的17α,21-二酯的制作方法
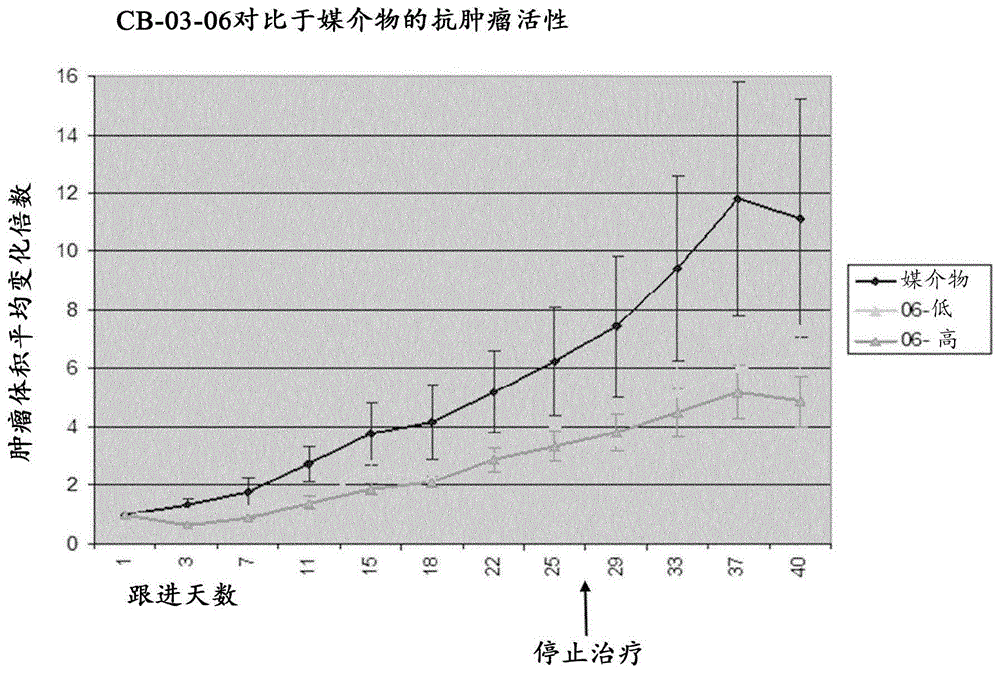
本申请是申请日为2015年10月7日,申请号为201580060690.2,发明名称为“用于在肿瘤的治疗中使用的11-脱氧皮质醇的17α,21-二酯”的申请的分案申请。相关申请本申请根据35usc$119要求于2014年10月8日提交的欧洲专利申请第14188063.3号题为“17α-monoestersand17α,21-diestersofcortexoloneforuseinthetreatmentoftumors”的优先权权益,其所有内容通过引用全文并入本文。本申请涉及用于在肿瘤的治疗中使用的11-脱氧皮质醇的17α-单酯和17α,21-二酯。发明背景肿瘤(tumor)或赘生物(neoplasm)被定义为新组织团块(amassofnewtissue),其独立于其周围结构存留和生长,并且其没有生理用途(doreland’smedicaldictionary,23ed.1960)。几种分类可用于肿瘤:对于本专利申请的开发,最重要的是上皮肿瘤。上皮肿瘤是源自上皮细胞的赘生物,是作为中空内脏和体表的内衬的细胞类型;这组包含许多最常见的癌症,并且包含在乳腺、前列腺、肺、胰腺和胃肠道中发展的那些癌症的大部分。在一些情况下,上皮肿瘤还能够以在肿瘤细胞中存在给予肿瘤激素敏感性的特定激素受体为特征。上皮癌(carcinomas)是来自上皮细胞的恶性肿瘤,在每一百个癌症中约占85个(85%)。上皮癌的一个实例是胰腺癌(pancreaticcarcinoma)(也称胰腺癌(pancreaticcancer))。胰腺癌是最致命的癌症形式之一。胰腺的外分泌和内分泌细胞形成完全不同类型的肿瘤。外分泌胰腺肿瘤构成最常见类型的胰腺癌(多于95%)。虽然良性(非癌性)囊肿和良性肿瘤(腺瘤)可在胰腺中发展,但大多数外分泌胰腺肿瘤是恶性的。胰腺癌,特别是外分泌胰腺癌,并且更特别是最常见的一种,即导管腺癌,落入男性死亡的五个最常见原因中,并且是女性死亡的第四大原因。它是具有最不利预后的肿瘤之一,诊断后5年的男性存活率仅为5%,女性为6%。最高发病率发生在60-70岁之间(aiom.lineaguidacarcinomadelpancreasesocrino,ed.2013)。外分泌胰腺癌的病因是未知的。存在公认的遗传倾向(家族性)和一些风险因素例如抽烟、脂肪饮食、2型糖尿病、慢性胰腺炎、环境因素例如溶剂或农药。外分泌胰腺癌在其早期阶段是无症状的,并且这解释了诊断的延迟,其通常在疾病处于晚期阶段时进行,除了在其他腹部疾病的诊断程序中意外检测到。诊断为胰腺癌的患者典型地具有不良预后:考虑到上述诊断的延迟,只有约15%的病例显示出限于胰腺的肿瘤,而在其余的病例中,在约25%的患者中检测到扩散至区域性(loco-regional)淋巴结,且在60%的病例中检测到转移的存在。该癌症从诊断起的中位存活期(mediansurvival)为约三至六个月,而五年存活期显著低于5%。当可能时,胰腺癌的疗法是手术,也伴随姑息目的。根治性胰十二指肠切除术(radicalpancreaticoduodenectomy)是目前治愈的唯一机会,特别是对于微小病变。还与放射疗法相关的药物疗法限于不可切除的病例、或当转移存在时、或作为手术后的辅助治疗。尽管存在个体患者对吉西他滨或氟尿嘧啶,或对多柔比星、甲氨蝶呤、顺铂、奥沙利铂、伊立替康、厄洛替尼等的联合方案有反应的偶尔报道,但化疗的结果通常不能令人满意并且经常不比完全不治疗好(martindale,31ed.,第530页)。theve等人在1983年综述了性激素对胰腺的可能影响,基于关于胰腺组织中类固醇受体蛋白、人胰腺中雌激素结合蛋白的高容量以及人胰腺组织转化主要外周雌激素即硫酸雌酮进入终末生物活性雌二醇-17β的报道。在这种背景下,他们尝试在有不可切除的胰腺腺癌的患者中使用他莫昔芬(雌激素受体的拮抗剂),一些初步结果与wong等人在1993年的结果相似。随后几年的临床实践并没有给出预期的结果,但结论是即使抗雌激素不构成疗法的最佳形式,其他种类的激素治疗也应该在胰腺癌中被尝试。鉴于以上,迫切需要肿瘤治疗的新方法,特别地,用于癌症的治疗,并且更特别是用于上皮肿瘤的治疗,特别是用于前列腺癌或胰腺癌(优选外分泌胰腺癌)的治疗。称为11-脱氧皮质醇的17α-单酯、21-单酯和17α,21-二酯的许多化合物及其制备方法是本领域已知的。wo03/014141描述了主要具有抗雄激素活性的属于与11-脱氧皮质醇(也称为11-脱氧皮质酮(11-deoxycortisone))结构相关的类固醇家族的化合物。这些化合物,例如11-脱氧皮质醇17α-丙酸酯,通过干扰雄激素激素对组织中雄激素受体(ar)的直接作用起作用。wo2007/031349公开了9,11-脱氢皮质醇的c3-c1017α-酯,其是与11-脱氧皮质醇结构相关的衍生物,作为抗促性腺激素剂,其可对治疗与过量促性腺激素产生密切相关的紊乱有用。wo2009/019138公开了用于获得11-脱氧皮质醇的17α-单酯和9,11-脱氢皮质醇的酶解方法;此外,它还公开了几种结晶形式的11-脱氧皮质醇17α-丙酸酯的存在,即结晶i型、i型、iii型和水合物iv型,以及获得它们的某些方法。醋酸环丙孕酮(简称cpa)是一种合成类固醇,被认为是用于治疗雄激素敏感性肿瘤,特别是前列腺癌的标准疗法。醋酸环丙孕酮的标准疗法在具有雄激素受体表达减少或缺失的肿瘤中结果很无效(br.j.cancer(1989),60,789-792)。在本领域已知的是,17α-酯化的存在赋予11-脱氧皮质醇17α-酯不同的抗雄激素活性,该活性在动物中证实(celasco等人,arzneim-forsch2005;5:179,581-7)。发明概述本发明提供式(i)的某些11-脱氧皮质醇(cortexolone)衍生物:和用于作为抗肿瘤活性成分使用,用于癌前病变、发育不良、化生和肿瘤疾病(包含恶性瘤形成和转移)的有疗效的或辅助的、或新辅助的或姑息的治疗的11-脱氧皮质醇衍生物。本发明的另一方面涉及包括至少一种式(i)的11-脱氧皮质醇衍生物作为活性成分与至少一种生理上可接受的赋形剂的药物组合物,并且涉及用于作为抗肿瘤活性成分使用,用于前期病变、发育不良、化生和肿瘤疾病(包含恶性瘤形成和转移)的有疗效的或辅助的、或新辅助的或姑息的治疗的同样的药物组合物。现在已经令人惊讶地发现,在体外分离的癌细胞系和在进入动物的体内异种移植的前列腺和胰腺癌模型中,11-脱氧皮质醇17α(alpha)-单酯、21-单酯和17α(alpha),21-二酯均具有非预期的抗肿瘤作用。本发明的抗肿瘤作用在携带雄激素受体的癌细胞(ar+)中(例如在前列腺癌细胞lncap或胰腺癌细胞panc1的情况下),以及出人意料地在雄激素受体表达缺失或减少的细胞(ar-)中(例如前列腺癌细胞pc3或胰腺癌细胞miapaca)均是明显的。本发明的抗肿瘤作用在乳腺癌(ar-)和胃肠道癌(ar-)中也是明显的。本申请还提供以下各项:项目1.一种式(i)的化合物:其中:r是c(o)-r1;r1是氢或含有2至5个碳原子的线性烷基链;且r'是含有3至6个碳原子的线性烷基链或任选地取代的芳基基团或任选地取代的杂芳基基团;其中r1和r'不相同。项目2.根据项目1所述的化合物,其中所述任选地取代的芳基基团是苯基。项目3.根据项目1所述的化合物,其中r1是氢或ch2ch3,并且r'是-(ch2)3-ch3或苯基。项目4.根据项目1所述的化合物,所述化合物具有式:项目5.根据项目1至4中任一项所述的化合物,所述化合物用于作为药物使用。项目6.根据项目5所述的用于使用的化合物,所述化合物具有式:项目7.根据项目1至4中任一项所述的化合物,所述化合物用于在治疗癌前病变、发育不良、化生和肿瘤疾病中使用,所述肿瘤疾病任选地包含恶性瘤形成和转移。项目8.根据项目5至7中任一项所述的用于使用的化合物,所述化合物作为抗肿瘤剂使用。项目9.根据项目7或8所述的用于使用的化合物,其中所述肿瘤疾病是实体瘤,优选上皮肿瘤。项目10.根据项目9所述的用于使用的化合物,其中所述上皮肿瘤是前列腺癌;乳腺癌;胰腺癌;肺癌;胃肠道癌,例如结肠癌;肾癌;甲状腺癌;子宫癌;或肾上腺癌。项目11.根据项目10所述的用于使用的化合物,其中所述上皮肿瘤是前列腺癌。项目12.根据项目11所述的用于使用的化合物,其中所述前列腺癌是或变成对抗雄激素靶向疗法,例如恩扎鲁胺有抗性。项目13.根据项目10所述的用于使用的化合物,其中所述上皮肿瘤是胰腺癌,优选外分泌胰腺癌。项目14.根据项目10所述的用于使用的化合物,其中所述上皮肿瘤是乳腺癌,优选三阴性乳腺癌(tnbc)。项目15.根据项目14所述的用于使用的化合物,其中所述乳腺癌是三阴性乳腺癌,并且受试者是常规疗法的复发或无反应者。项目16.根据项目10所述的用于使用的化合物,其中所述上皮肿瘤是胃肠道癌,例如结肠癌。项目17.根据项目7至16中任一项所述的用于使用的化合物,其中所述化合物是11-脱氧皮质醇17α-戊酸酯-21-丙酸酯。项目18.根据项目1至4中任一项所述的化合物,所述化合物用于作为糖皮质激素受体(gr)调节剂使用,优选用于作为糖皮质激素拮抗剂使用。项目19.根据项目18所述的用于使用的化合物,所述化合物具有式:项目20.一种药物组合物,所述药物组合物包括至少一种根据项目1至4中任一项所述的化合物,以及至少一种生理上可接受的赋形剂。项目21.根据项目20所述的药物组合物,所述药物组合物还包括用于同时、分别或顺序施用的至少一种其他活性成分,优选化疗活性成分。项目22.根据项目20或21所述的药物组合物,所述药物组合物用于在治疗癌前病变、发育不良、化生和肿瘤疾病中使用,所述肿瘤疾病任选地包含恶性瘤形成和转移。项目23.根据项目20或21所述的药物组合物,所述药物组合物用于作为抗肿瘤剂使用。项目24.根据项目22或23所述的用于使用的药物组合物,其中所述肿瘤疾病是实体瘤,优选上皮肿瘤,例如前列腺癌;乳腺癌;胰腺癌;肺癌;胃肠道癌,例如结肠癌;肾癌;甲状腺癌;子宫癌;肾上腺癌。项目25.根据项目24所述的用于使用的药物组合物,其中所述上皮肿瘤是前列腺癌。项目26.根据项目25所述的用于使用的药物组合物,其中所述前列腺癌是或变成对抗雄激素靶向疗法,例如恩扎鲁胺有抗性。项目27.根据项目24所述的用于使用的药物组合物,其中所述上皮肿瘤是胰腺癌,优选外分泌胰腺癌。项目28.根据项目24所述的用于使用的药物组合物,其中所述上皮肿瘤是乳腺癌,优选三阴性乳腺癌(tnbc)。项目29.根据项目28所述的用于使用的药物组合物,其中所述乳腺癌是三阴性乳腺癌并且受试者是常规疗法的复发或无反应者。项目30.根据项目24所述的用于使用的药物组合物,其中所述上皮肿瘤是胃肠道癌,例如结肠癌。项目31.根据项目20至30中任一项所述的药物组合物,其中所述化合物是11-脱氧皮质醇17α-戊酸酯-21-丙酸酯。项目32.根据项目20所述的药物组合物,所述药物组合物用于作为糖皮质激素受体(gr)调节剂使用,优选用于作为糖皮质激素拮抗剂使用。项目33.根据项目32所述的药物组合物,其中所述化合物是11-脱氧皮质醇17α-戊酸酯-21-丙酸酯。项目34.一种在有相应需要的受试者中治疗癌前病变、发育不良、化生和肿瘤疾病的方法,所述方法包括向所述受试者施用治疗有效量的式(i)的化合物:其中:r是c(o)-r1;r1是氢或含有2至5个碳原子的线性烷基链;且r'是含有3至6个碳原子的线性烷基链或任选地取代的芳基基团或任选地取代的杂芳基基团;其中r1和r'不相同。项目35.根据项目34所述的方法,其中所述肿瘤疾病是恶性瘤形成或转移。项目36.根据项目35所述的方法,其中所述受试者是哺乳动物。项目37.根据项目36所述的方法,其中所述哺乳动物是人。项目38.根据项目37所述的方法,其中所述肿瘤疾病是实体瘤。项目39.根据项目38所述的方法,其中所述实体瘤是上皮肿瘤。项目40.根据项目39所述的方法,其中所述上皮肿瘤是前列腺癌、乳腺癌、子宫癌、胰腺癌、肺癌、胃肠道癌(优选结肠癌)、肾癌、甲状腺癌和肾上腺癌等等。项目41.根据项目40所述的方法,其中所述上皮肿瘤是前列腺癌、胰腺癌、外分泌胰腺癌、胃肠道癌(优选结肠癌)或乳腺癌。项目42.根据项目41所述的方法,其中所述前列腺癌是或变成对抗雄激素靶向疗法,例如恩扎鲁胺有抗性。项目43.根据项目41所述的方法,其中所述乳腺癌是三阴性乳腺癌。项目44.根据项目43所述的方法,其中所述受试者是常规疗法的复发或无反应者。项目45.根据项目34-44中任一项所述的方法,其中:r是c(o)-r1;r1是氢或ch2ch3;且r'是-(ch2)3-ch3或苯基基团;其中r1和r'不相同。项目46.根据项目45所述的方法,其中所述化合物是11-脱氧皮质醇17α-戊酸酯-21-丙酸酯。项目47.一种在有相应需要的受试者中治疗由糖皮质激素介导的疾病或紊乱的方法,所述方法包括向所述受试者施用治疗有效量的式(i)的化合物:其中:r是c(o)-r1;r1是氢或含有2至5个碳原子的线性烷基链;且r'是含有3至6个碳原子的线性烷基链或任选地取代的芳基基团或任选地取代的杂芳基基团;其中r1和r'不相同。项目48.根据项目47所述的方法,其中:r是c(o)-r1;r1是氢或ch2ch3;且r'是-(ch2)3-ch3或苯基基团;其中r1和r'不相同。项目49.根据项目48所述的方法,其中所述化合物是11-脱氧皮质醇17α-戊酸酯-21-丙酸酯。附图简述本发明现将通过以下非限制性附图和实施例来描述。图1:在裸小鼠的异种移植动物模型(miapaca胰腺细胞系)中以低剂量(230μm)和高剂量(1150μm)的11-脱氧皮质醇17α-苯甲酸酯(在图中被称为“06”和“cb-03-06”)相对于皮下(sc)治疗开始时测量的胰腺肿瘤体积的平均变化倍数。提及“媒介物”是用生理盐水中0.4%(v/v)吐温80和0.5%(w/v)羧甲基纤维素的对照处理组。小鼠连续28天被用化合物和媒介物每天sc处理。停止治疗箭头是指治疗结束的那一天。图2:在裸小鼠的异种移植动物模型(miapaca胰腺细胞系)中以低剂量(230μm)和高剂量(1150μm)的11-脱氧皮质醇17α-戊酸酯-21-丙酸酯(在图中被称为“10”和“cb-03-10”)相对于sc治疗开始时测量的胰腺肿瘤体积的平均变化倍数。提及“媒介物”是用生理盐水中0.4%(v/v)吐温80和0.5%(w/v)羧甲基纤维素的对照处理组。小鼠连续28天被用化合物和媒介物每天sc处理。停止治疗箭头是指治疗结束的那一天。图3:在裸小鼠的异种移植动物模型(miapaca胰腺细胞系)中用醋酸环丙孕酮(在图中称为cpa)、11-脱氧皮质醇17α-戊酸酯-21-丙酸酯(在图中称为“10”)和11-脱氧皮质醇17α-苯甲酸酯(在图中称为“06”)(每种化合物以低剂量和高剂量),以及用“媒介物”(即生理盐水中0.4%(v/v)吐温80和0.5%(w/v)羧甲基纤维素)处理对照组相对于sc治疗开始时测量的胰腺肿瘤体积的平均变化倍数。所有小鼠连续28天(治疗天数)被用化合物和媒介物每天sc治疗。停止治疗箭头是指治疗结束的那一天。图4:显示来自于图3的最佳剂量相对于媒介物(即生理盐水中0.4%(v/v)吐温80和0.5%(w/v)羧甲基纤维素)处理对照组的p值的图。所有小鼠连续28天(治疗天数)被用化合物和媒介物每天sc治疗。停止治疗箭头是指治疗结束的那一天。图5:人前列腺(a)和胰腺(b)癌细胞系中的11-脱氧皮质醇衍生化合物的细胞毒性的剂量滴定。图6:癌细胞系上的雄激素受体的表达水平。图7:cb-03-10和cb-03-05糖皮质激素拮抗剂活性。米非司酮被用作阳性对照(有效的糖皮质激素拮抗剂)。图8:cb-03-10和cb-03-05糖皮质激素激动剂活性,地塞米松(dex)被用作阳性对照(有效的糖皮质激素激动剂)。图9:在miapaca2细胞中cb-03-10对细胞凋亡的诱导。图10:在miapaca2细胞中不同浓度的cb-03-10对细胞周期停滞的诱导。图11:在miapaca2细胞中胱天蛋白酶激活的时间过程(8-24-48小时)。20μm(条纹条)或50μm(实心条)表示化合物的浓度。吉西他滨是使用的一种有效的抗胰腺细胞毒性药物和阳性对照。图12:lncap前列腺癌细胞系上的胱天蛋白酶激活。图13:(a)人和(b)大鼠血浆中cb-03-10和cb-03-05的体外代谢。图14:皮下和口服施用后,在小鼠血浆中体内评估的cb-03-10和cb-03-05药代动力学。图15:皮下施用时,cb-03-10对胰腺癌的小鼠异种移植模型的体内抗肿瘤活性。图16:通过口服管饲施用时,在前列腺癌的小鼠异种移植模型中cb-03-10的体内抗肿瘤活性。恩扎鲁胺(enza),一种有效的抗前列腺细胞毒性药物,被用作阳性对照。我们的结果显示,cb-03-10与媒介物相比从第7天至多达第60天是统计学上显著不同的。相比之下,恩扎鲁胺与媒介物相比只在第14和25天是统计学上显著的。这一比较表明,与媒介物相比cb-03-10达到高统计学显著性,而与媒介物相比恩扎鲁胺没有达到统计学显著性。图17:cb-03-10和cb-03-05对来自lncap癌细胞系的体外基线psa分泌的抑制。图18:不同癌细胞系中的雄激素和糖皮质激素受体表达。定义除非另有定义,否则本文使用的所有领域术语、符号和其他科学术语意图具有本公开内容所属领域的技术人员通常理解的含义。在一些情况下,为了清楚和/或便捷引用,本文定义了具有通常理解的含义的术语;因此,本文包含这些定义不应被解释为代表与本领域中通常理解的实质差异。特别地,本文中术语“生理上可接受的赋形剂”或“药学上可接受的赋形剂”是指其本身没有任何药理学作用的物质,并且当施用于哺乳动物,优选人时不产生不良反应。生理上可接受的赋形剂是本领域熟知的,并且例如在handbookofpharmaceuticalexcipients,第六版(2009)中公开,通过引用并入本文。本文使用的术语“烷基”是指饱和直链或支链烃。本文的术语“芳基”是指芳族单环和多碳环系统,其中多碳环系统中的个体碳环可通过单键彼此稠合或附接。合适的“芳基”基团包括但不限于苯基、萘基、联苯基等等。本文的术语“杂芳基”是指在环系统中包括至少一个杂原子的芳族单碳环和多碳环系统,其中所述杂原子选自包括但不限于氮、硫、氧等等的组,并且其中多碳环系统中的个体环可通过单键彼此稠合或附接。合适的“杂芳基”基团包括但不限于吡啶基、咪唑基、吡咯基、呋喃基、苯并咪唑基、噻吩基(thiofuranyl)等。芳基基团可在环的至少一个碳原子上被选自低级烷基、低级烯基、低级卤代烷基、低级卤代烯基、低级烷氧基、低级卤代烯基、低级烯氧基、卤素、硝基、氰基、低级烷硫基等等的基团任选地取代。杂芳基基团可在环的至少一个碳原子上或至少一个杂原子上被选自低级烷基、低级卤代烷基、低级烷氧基、低级烯基、低级卤代烯基、低级烯氧基、卤素、硝基、氰基、低级烷硫基等等的基团任选地取代。本文的术语“大约”是指可能在测量中发生的实验误差的范围。术语“包括(comprising)”、“具有(having)”、“包含(including)”和“含有(containing)”将被解释为开放式术语(即意味着“包含但不限于”),并且将被认为是包含和/或还提供支持给如“主要由...组成(consistessentiallyof)”、“主要由...组成(consistingessentiallyof)”、“由...组成(consistof)”或“由...组成(consistingof)”的术语。术语“主要由...组成(consistessentiallyof)”、“主要由...组成(consistingessentiallyof)”将被解释为半封闭式术语(semi-closedterms),意味着不包含实质上影响本发明的基本和新颖特征的其他成分(任选地赋形剂可因此被包含)。术语“由...组成(consistof)”、“由...组成(consistingof)”将被解释为封闭式术语。如本文使用的,术语“治疗有效量”和“有效量”是指足以引起期望的生物反应的量。在本发明中,期望的生物反应是抑制、减少或改善疾病、紊乱或状况的严重性、持续时间、进展或发作,阻止疾病、紊乱或状况或与疾病、紊乱或状况相关的症状的前进、复发或进展。施用于受试者的化合物的精确量将取决于施用形式,疾病、紊乱或状况的类型和严重性以及受试者的特征,例如总体健康、年龄、性别、体重和对药物的耐受性。本领域技术人员将能够根据这些和其他因素确定合适的剂量。对于经批准的剂,合适的剂量是已知的,并且能够由本领域技术人员根据受试者的状况、被治疗的状况的类型和所使用的本文所述的化合物的量来调整。在其中量未被明确指出的情况下,应假定有效量。例如,对于治疗性治疗,本文所述的化合物和药物组合物能够以约0.01至100mg/kg体重/天的剂量范围施用于受试者。如本文使用的,术语“治疗(treat)”、“治疗(treatment)”和“治疗(treating)”是指治疗性治疗(therapeutictreatments),包括由施用一种或多种治疗(例如,一种或更多治疗剂,例如本发明的化合物或组合物)导致的减少或改善疾病、紊乱或状况的进展、严重性和/或持续时间、或改善疾病、系统或状况的一种或更多种症状(具体地,一种或更多种可辨别的症状)。在具体实施方案中,治疗性治疗包含改善疾病、紊乱或状况的至少一种可测量的物理参数。在其他实施方案中,治疗性治疗包含物理上通过例如可辨别的症状的稳定、或生理上通过物理参数的稳定,或是通过两者来抑制状况的进展。在其他实施方案中,治疗性治疗包含疾病、紊乱或状况的减少或稳定。本文使用的术语“有疗效的治疗”是指旨在治愈疾病或旨在改善与疾病相关的症状的治疗。本文使用的术语“姑息治疗”是指不旨在治愈疾病而是旨在提供缓解的治疗或疗法。本文使用的术语“辅助治疗”是指除基本的、主要的或初始的治疗之外给予的治疗。本文使用的术语“新辅助治疗”是指在主要治疗之前给予的治疗,其目的是减少肿瘤的大小或程度,从而减轻如果肿瘤的大小或程度没有减少将会需要的更广泛的治疗技术的后果。如本文所述的,本发明的化合物可任选地被一个或更多个取代基取代,例如在以下通常地阐明,或由本发明的特定种类举例说明。应当理解,短语“任选地取代的”与短语“取代或未取代的”互换使用。通常,术语“取代的”无论在其前是否有术语“任选地”,都是指用特定的取代基的自由基取代给定结构中的一个或多个氢自由基。除非另有说明,否则任选地取代的基团可在该基团的每个可取代位置具有取代基。当在给定的结构中多于一个位置能够被选自指定的组的多于一个取代基取代时,取代基可在每个位置处是相同的或是不同的。当术语“任选地取代的”在列表之前时,所述术语是指该列表中的所有随后的可取代基团。如果取代基自由基或结构未被标明或定义为“任选地取代的”,则该取代基自由基或结构是未被取代的。本发明设想的取代基的选择和取代基的组合是导致形成稳定或化学上可行的化合物的那些。本文使用的术语“稳定”是指当经受允许其生产、检测、以及特别是其回收、纯化和用于本文公开的一个或多个目的的用途的条件时大体上不改变的化合物。在一些实施方案中,稳定的化合物或化学上可行的化合物是当在不存在水分或其他化学反应性条件的情况下在40℃或更低的温度下保持至少一周时大体上不改变的化合物。只有那些导致稳定结构的取代基的选择和组合被设想。这样的选择和组合对于本领域普通技术人员将是明显的,并且可在没有过多实验的情况下被确定。术语“同时、分开或顺序施用”在本文是指同时施用第一种和第二种化合物,或以使得两种化合物同时作用于患者身体的方式施用,或以使得提供治疗作用的方式在一种化合物之后施用另一种化合物。在一些实施方案中,化合物是与餐食一起服用的。在其他实施方案中,化合物是在餐后服用的,例如餐后30分钟或60分钟。在一些实施方案中,给患者施用一种化合物一段时间,继而施用另一种化合物。如本文使用的,术语“受试者”和“患者”可互换地使用。术语“受试者”和“患者”是指动物(例如,鸟,例如鸡、鹌鹑或火鸡,或哺乳动物),具体地说“哺乳动物”,包含非灵长类动物(例如,牛、猪、马、绵羊、兔、豚鼠、大鼠、猫、狗和小鼠)和灵长类动物(例如,猴、黑猩猩和人类),更具体地说是人类。在一个实施方案中,受试者是人。发明详述现在已经意外地发现,一些11-脱氧皮质醇衍生物具有针对肿瘤,优选上皮和/或激素依赖性肿瘤的有治疗意义的抗肿瘤特性。根据一般概念,本发明由式(i)的化合物来表示其中r是氢或c(o)-r1,其中r1是含有2至5个碳原子的线性烷基链,并且其中r'是含有3至6个碳原子的线性烷基链或任选地取代的芳基基团或任选地取代的杂芳基基团。式(i)的优选化合物是其中r是氢或c(o)-r1的那些,其中r1是ch2ch3且其中r'是-(ch2)3-ch3或苯基。本发明的一个目的(object)由式i的化合物来表示其中r是c(o)-r1,其中r1为氢或含有2至5个碳原子的线性烷基链,其中r'为含有3-6个碳原子的线性烷基链或任选地取代的芳基基团或任选地取代的杂芳基基团,其中r1和r'不相同。本发明的一个目的(object)由式i的化合物来表示其中r是c(o)-r1,其中r1是含有2至5个碳原子的线性烷基链,并且其中r'是含有3至6个碳原子的线性烷基链或任选地取代的芳基基团或任选地取代的杂芳基基团,其中r1和r'不相同。式(i)的优选化合物是其中r是c(o)-r1的那些,其中r1是氢或ch2ch3,并且其中r'是-(ch2)3-ch3或苯基,其中r1和r'不相同。式(i)的优选化合物是其中r是c(o)-r1的那些,其中r1是ch2ch3,并且其中r'是-(ch2)3-ch3或苯基,其中r1和r'不相同。式(i)的最优选化合物是其中r是c(o)-r1的化合物,其中r1是ch2ch3,并且其中r'是-(ch2)3-ch3,即11-脱氧皮质醇17α-戊酸酯-2-丙酸酯(本文还称为“10”或“cb-03-10”),其式在本文报告如下:除非另有说明,否则本文描绘的结构也意在包含该结构的所有异构的(例如,对映的、非对映的、顺式-反式、构象的和旋转的)形式。例如,除非仅具体地描述异构体之一,否则本发明中包括每个不对称中心的r和s构型、(z)和(e)双键异构体以及(z)和(e)构象异构体。如本领域技术人员将理解的,取代基能够围绕任何可旋转键自由旋转。因此,当前的化合物的单个立体化学异构体以及对映的、非对映的、顺式/反式、构象的和旋转的混合物在本发明的范围内。除非另有说明,否则本发明化合物的所有互变异构形式都在本发明的范围内。另外,除非另有说明,否则本文描绘的结构还意图包含仅在一个或更多个同位素富集的原子的存在方面不同的化合物。例如,除了通过氘或氚替换氢,或通过13c-或14c-富集的碳替换碳以外,具有当前的结构的化合物在本发明的范围内。这样的化合物作为例如生物测定中的分析工具或探针是有用的。这样的化合物,特别是氘类似物也能够是治疗上有用的。本发明的化合物通过其化学结构和/或化学名称在本文被定义。当化合物由化学结构和化学名称两者所提及,并且化学结构和化学名称相冲突时,化学结构决定了化合物的身份。药学上可接受的盐、溶剂化物、包合物、前药和其他衍生物本文所述的化合物能够以游离形式,或在适当时以盐形式存在。药学上可接受的那些盐是特别有意义的,因为它们在为了医疗目的施用以下描述的化合物中有用。不是药学上可接受的盐在制造方法中、用于分离和纯化目的是有用的,并且在一些情况下,用于分离本发明化合物或其中间体的立体异构形式。如本文所用,术语“药学上可接受的盐”是指在合理的医学判断范围内适合用于与人类和低等动物的组织接触而没有不适当的副作用例如毒性、刺激、过敏反应等,并且与合理的利益/风险比匹配的化合物的盐。药学上可接受的盐在本领域中是众所周知的。例如,s.m.berge等人在j.pharmaceuticalsciences,1977,66,1-19中详细描述了药学上可接受的盐,其通过引用并入本文。本文所述的化合物的药学上可接受的盐包含衍生自合适的无机和有机的酸和碱的那些。这些盐能够在化合物的最终分离和纯化期间原位制备。应当理解,本发明包括不同的药学上可接受的盐的混合物/组合以及游离形式的化合物和药学上可接受的盐的混合物/组合。除了本文所述的化合物之外,这些化合物的药学上可接受的溶剂化物(例如,水合物)和包合物也可在组合物中采用以治疗或预防本文标明的紊乱。如本文使用的,术语“药学上可接受的溶剂化物”是由一种或多种药学上可接受的溶剂分子与本文所述的化合物之一缔合形成的溶剂化物。术语溶剂化物包括水合物(例如,半水合物、一水合物、二水合物、三水合物、四水合物等)。如本文使用的,术语“水合物”是指还包含化学计量的或非化学计量的量的由非共价分子间力结合的水的本文所述的化合物或其盐。如本文使用的,术语“包合物”是指处于包含具有捕获在其中的客体分子(例如,溶剂或水)的空间(例如,通道)的晶格(crystallattice)形式的本文所述的化合物或其盐。除了本文所述的化合物之外,这些化合物的药学上可接受的衍生物或前药也可在组合物中采用以治疗或预防本文标明的紊乱。“药学上可接受的衍生物或前药”包含本文所述的化合物的任何药学上可接受的酯、酯的盐或其他衍生物或其盐,其在施用于接受者时能够直接或间接地提供本文所述的化合物或其抑制活性代谢物或残留物。特别有利的衍生物或前药是当将此类化合物施用到患者时增加化合物的生物利用度(例如,通过允许口服施用的化合物更容易被吸收到血液中)的那些,或增强向与母体物质有关的生物学隔室(例如,脑或淋巴系统)递送母体化合物的那些。本文所述的化合物的药学上可接受的前药包含但不限于酯、氨基酸酯、磷酸酯、金属盐和磺酸酯。药用用途本发明的另一个目的由用于作为药物使用的式(i)的化合物表示。本发明的另一个目的是用于作为药物使用的11-脱氧皮质醇17α-戊酸酯(本文也称为“05”或“cb-03-05”),表示为:在一个实施方案中,用于作为药物使用的本发明的化合物是11-脱氧皮质醇17α-戊酸酯-21-丙酸酯(cb-03-10)和11-脱氧皮质醇17α-戊酸酯(cb-03-05)。在另一个实施方案中,本发明是包括式(i)的化合物的组合物和药物组合物,所述组合物和药物组合物用于作为药物使用。在一个实施方案中,本发明是包括化合物11-脱氧皮质醇17α-戊酸酯-21-丙酸酯(cb-03-10)和11-脱氧皮质醇17α-戊酸酯(cb-03-05)的组合物和药物组合物,所述组合物和药物组合物用于作为药物使用。在另一个方面,本发明涉及式(i)的所述化合物,包含11-脱氧皮质醇17α-戊酸酯-21-丙酸酯(cb-03-10)和11-脱氧皮质醇17α-戊酸酯(cb-03-05),所述化合物用于作为糖皮质激素受体(gr)调节剂(优选糖皮质激素拮抗剂)使用。在另一个实施方案中,本发明是包含式(i)的化合物的组合物和药物组合物,所述组合物和药物组合物用于作为糖皮质激素受体(gr)调节剂(优选糖皮质激素拮抗剂)使用。在另一个实施方案中,本发明是包含11-脱氧皮质醇17α-戊酸酯-21-丙酸酯(cb-03-10)和11-脱氧皮质醇17α-戊酸酯(cb-03-05)的组合物和药物组合物,所述组合物和药物组合物用于作为糖皮质激素受体(gr)调节剂(优选糖皮质激素拮抗剂)使用。在又另一个方面,本发明涉及用于在治疗由糖皮质激素介导的疾病或紊乱中使用的式(i)的所述化合物。在一个实施方案中,在治疗由糖皮质激素介导的疾病或紊乱中的本发明的化合物是11-脱氧皮质醇17α-戊酸酯-21-丙酸酯(cb-03-10)和11-脱氧皮质醇17α-戊酸酯(cb-03-05)。在仍另一个方面,本发明涉及式(i)的所述化合物,包括11-脱氧皮质醇17α-戊酸酯-21-丙酸酯(cb-03-10)和11-脱氧皮质醇17α-戊酸酯(cb-03-05),所述化合物用于在癌前病变、发育不良、化生和肿瘤疾病(包含恶性瘤形成和转移)的治疗中使用;根据另一个方面,这种治疗可以是有疗效的、辅助的、新辅助的或姑息的。理想地,式(i)的化合物,包括11-脱氧皮质醇17α-戊酸酯-21-丙酸酯(cb-03-10)和11-脱氧皮质醇17α-戊酸酯(cb-03-05),用于作为抗肿瘤剂使用。在一个实施方案中,所述肿瘤疾病是实体瘤,优选上皮肿瘤,例如,举例来说,前列腺癌、乳腺癌、胰腺癌、肺癌、胃肠道癌(优选结肠癌)、肾癌、甲状腺癌、子宫癌和肾上腺癌等。在本文公开的发明的优选实施方案中,所述上皮肿瘤是前列腺癌、胰腺癌(优选外分泌胰腺癌)、胃肠道癌(优选结肠癌)和乳腺癌(mammarycarcinoma)(优选三阴性乳腺癌(triplenegativebreastcancer))。在本文公开的发明的优选实施方案中,肿瘤疾病是前列腺癌。在本文公开的发明的优选实施方案中,前列腺癌是腺癌。在本文公开的发明的优选实施方案中,肿瘤疾病是ar表达缺失或减少的前列腺癌。在本发明的另一个优选实施方案中,肿瘤疾病是具有突变或截短的雄激素受体的前列腺癌。理想地,式(i)的化合物,包括11-脱氧皮质醇17α-戊酸酯-21-丙酸酯(cb-03-10)和11-脱氧皮质醇17α-戊酸酯(cb-03-05),用于作为抗肿瘤剂使用,其中肿瘤疾病是具有突变或截短的雄激素受体的前列腺癌。式(i)的化合物,包含11-脱氧皮质醇17α-戊酸酯-21-丙酸酯(cb-03-10)和11-脱氧皮质醇17α-戊酸酯(cb-03-05),的一种特别有利的用途是用于在已经或已经变得对抗雄激素治疗,例如恩扎鲁胺有抗性的前列腺癌的治疗中使用。这是本发明的特别有利的实施方案,因为最近已经发现,在6个月的治疗之后,因为ar已经突变或改变,30%的前列腺癌变得对恩扎鲁胺有抗性。有趣的是,这些有抗性的癌细胞上调gr。式(i)的化合物,包含11-脱氧皮质醇17α-戊酸酯-21-丙酸酯(cb-03-10)和11-脱氧皮质醇17α-戊酸酯(cb-03-05),能够用于治疗例如活性也通过gr介导的癌症。在本文公开的发明的优选实施方案中,外分泌胰腺癌是腺癌。在优选的实施方案中,外分泌胰腺癌具有缺失或减少表达的ar。在本文公开的发明的优选实施方案中,所述上皮肿瘤是胃肠道癌(优选结肠癌)。在本文公开的发明的仍然优选的实施方案中,所述上皮肿瘤是乳腺癌(优选三阴性乳腺癌)。任选地,被治疗的受试者或患者是对常规疗法的无反应或复发者。在优选的实施方案中,本发明提供式(i)的化合物,其中r是c(o)-r1,其中r1是氢或ch2ch3,并且r'是-(ch2)3-ch3或苯基基团,其中r1和r'不相同,用于在癌前病变、发育不良、化生和肿瘤疾病(包含恶性瘤形成和转移)的治疗中使用;根据另一个方面,这种治疗可以是有疗效的、辅助的、新辅助的或姑息的。理想地,该化合物用于作为抗肿瘤剂使用。在优选的实施方案中,本发明提供式(i)的化合物,其中r为c(o)-r1,其中r1为ch2ch3且r'为-(ch2)3-ch3或苯基基团,其中r1和r'不相同,用于在癌前病变、发育不良、化生和肿瘤疾病(包含恶性瘤形成和转移)的治疗中使用;根据另一个方面,这种治疗可以是有疗效的、辅助的、新辅助的或姑息的。理想地,该化合物用于作为抗肿瘤剂使用。在另一个实施方案中,本发明提供式(i)的化合物,其中r为c(o)-r1,其中r1为ch2ch3并且其中r'为-(ch2)3-ch3,即为11-脱氧皮质醇17α-戊酸酯-21-丙酸酯(本文也称为“10”或“cb-03-10”),用于在癌前病变、发育不良、化生和肿瘤疾病(包含恶性瘤形成和转移)的治疗中使用;根据另一个方面,这种治疗可以是有疗效性的、辅助的、新辅助的或姑息的。理想地,该化合物用于作为抗肿瘤剂使用。在一个实施方案中,所述肿瘤疾病是实体瘤,优选上皮肿瘤,例如,举例来说,前列腺癌、乳腺癌、胰腺癌、肺癌、胃肠道癌(优选结肠癌)、肾癌、甲状腺癌、子宫癌和肾上腺癌等。在本文公开的发明的优选实施方案中,所述上皮肿瘤是前列腺癌、胰腺癌(优选外分泌胰腺癌)、胃肠道癌(优选结肠癌)和乳腺癌(优选三阴性乳腺癌)。在本文公开的发明的优选实施方案中,肿瘤疾病是前列腺癌。在本文公开的发明的优选实施方案中,前列腺癌是腺癌。在本文公开的发明的优选实施方案中,肿瘤疾病是具有突变、缺失或减少表达的ar的前列腺癌。在本文公开的发明的优选实施方案中,外分泌胰腺癌是腺癌。在优选的实施方案中,外分泌胰腺癌具有缺失或减少表达的ar。本发明的另一个目的由用于在用于治疗癌前病变、发育异常、化生和肿瘤疾病(包含恶性瘤形成和转移)的药物的制造中使用的式(i)的化合物代表;根据另一个方面,这种治疗可以是有疗效的、辅助的、新辅助的或姑息的。在一个实施方案中,本发明的化合物用于在用于治疗癌前病变、发育异常、化生和肿瘤疾病(包含恶性瘤形成和转移)的药物的制造中使用,并且本发明的化合物是11-脱氧皮质醇17α-戊酸酯-21-丙酸酯(cb-03-10)和11-脱氧皮质醇17α-戊酸酯(cb-03-05)。理想地,式(i)的化合物用于在抗肿瘤剂的制造中使用。在一个实施方案中,用于在抗肿瘤剂的制造中使用的本发明的化合物是11-脱氧皮质醇17α-戊酸酯-21-丙酸酯(cb-03-10)和11-脱氧皮质醇17α-戊酸酯(cb-03-05)。在一个实施方案中,所述肿瘤疾病是实体瘤,优选上皮肿瘤,例如,举例来说,前列腺癌、乳腺癌、胰腺癌、肺癌、胃肠道癌(优选结肠癌)、肾癌、甲状腺癌、子宫癌和肾上腺癌等。在另一个方面,本发明涉及用于在用于治疗由糖皮质激素介导的疾病或紊乱的药物的制造中使用的式(i)的所述化合物。在一个方面,本文公开的发明提供了用于治疗癌前病变、发育不良、化生和肿瘤疾病(包含恶性瘤形成和转移)的方法,所述方法包含向有相应需要的受试者施用有效量的式(i)的化合物:其中r为c(o)-r1,其中r1为氢或含有2至5个碳原子的线性烷基链,且其中r'为含有3至6个碳原子的线性烷基链或任选地取代的芳基基团或任选地取代的杂芳基基团,其中r1和r'不相同。优选地,所述受试者是哺乳动物。优选地,所述哺乳动物是人。在一个方面,本文公开的发明提供了用于治疗癌前病变、发育不良、化生和肿瘤疾病(包含恶性瘤形成和转移)的方法,所述方法包含向有相应需要的受试者施用有效量的式(i)的化合物:其中r是c(o)-r1,其中r1是含有2至5个碳原子的线性烷基链,并且其中r'是含有3至6个碳原子的线性烷基链或任选地取代的芳基基团或任选地取代的杂芳基基团,其中r1和r'不相同。优选地,所述受试者是哺乳动物。优选地,所述哺乳动物是人。在一个实施方案中,所述肿瘤疾病是实体瘤,特别是上皮肿瘤,例如,举例来说,前列腺癌、乳腺癌、子宫癌、胰腺癌、肺癌、胃肠道癌(优选结肠癌)、肾癌、甲状腺癌和肾上腺癌等。在一个实施方案中,所述肿瘤疾病是实体瘤,特别是上皮肿瘤,例如,举例来说,前列腺癌、乳腺癌、子宫癌、胰腺癌、肺癌、胃肠道癌(优选结肠癌)、肾癌、甲状腺癌和肾上腺癌等。在本文公开的发明的优选实施方案中,所述上皮肿瘤是前列腺癌或胰腺癌,更优选外分泌胰腺癌,或乳腺癌,例如三阴性乳腺癌。在本文公开的发明的优选实施方案中,肿瘤疾病是ar表达缺失或减少的前列腺癌。在本发明的另一个优选实施方案中,肿瘤疾病是具有突变或截短的雄激素受体的前列腺癌。以这种方式,可根据本发明治疗的前列腺癌可以是或已经变得对抗雄激素靶向疗法,例如恩扎鲁胺有抗性。根据优选实施方案,所述方法包括向有相应需要的哺乳动物施用有效量的式(i)的化合物,其中r是c(o)-r1,其中r1是氢或ch2ch3,并且r'是-(ch2)3-ch3或苯基基团,其中r1和r'不相同。根据优选的实施方案,所述方法包括向有相应需要的哺乳动物施用有效量的式(i)的化合物,其中r是c(o)-r1,其中r1是ch2ch3,并且r'是-(ch2)3-ch3或苯基基团,其中r1和r'不相同。在最优选的实施方案中,所述方法包括施用有效量的式(i)的化合物,其中r是c(o)-r1,r1是ch2ch3,并且r'是-(ch2)3-ch3,即11-脱氧皮质醇17α-戊酸酯-21-丙酸酯(cb-03-10)。在一个方面,本文公开的发明提供了一种用于治疗癌前病变、发育异常、化生和肿瘤疾病(包含恶性瘤形成和转移)的方法,所述方法包括对有相应需要的受试者施用有效量的11-脱氧皮质醇17α-戊酸酯(cb-03-05)。优选地,所述受试者是哺乳动物。优选地,所述哺乳动物是人。在一个实施方案中,所述肿瘤疾病是实体瘤,特别是上皮肿瘤,例如,举例来说,前列腺癌、乳腺癌、子宫癌、胰腺癌、肺癌、胃肠道癌(优选结肠癌)、肾癌、甲状腺癌和肾上腺癌等。在本文公开的发明的优选实施方案中,所述上皮肿瘤是前列腺癌或胰腺癌,更优选外分泌胰腺癌或乳腺癌,例如三阴性乳腺癌。本发明的化合物能够用于不同的治疗应用,特别是肿瘤学应用。更详细地,已经发现本文公开的根据本发明的化合物对胰腺癌(优选外分泌胰腺癌)和前列腺癌的治愈的或辅助的、或新辅助的或姑息的治疗特别有效。本发明的化合物的药理学性质的说明将在下文的实验部分中找到。式(i)的化合物可根据任何常规方法制备,例如通过wo03/014141和wo2009/019138中公开的方法,其各自的内容通过引用全文并入本文。根据本发明的一个实施方案,11-脱氧皮质醇17α-戊酸酯-21-丙酸酯(cb-03-10)和11-脱氧皮质醇17α-戊酸酯(cb-03-05)能够根据实施例11中公开的方法制备。药物组合物本文所述的化合物能够配制成还包括药学上可接受的载体、稀释剂、辅剂(adjuvant)或媒介物(vehicle)的药物组合物。在一个实施方案中,本发明涉及包括本文所述的本发明的化合物和药学上可接受的载体、稀释剂、辅剂或媒介物的药物组合物。在一个实施方案中,本发明是包括有效量的本发明的化合物或其药学上可接受的盐和药学上可接受的载体、稀释剂、辅剂或媒介物的药物组合物。药学上可接受的载体包含,例如关于预期施用形式适当选择的,并且与常规药学实践一致的药物稀释剂、赋形剂或载体。本发明的另一个目的由药物组合物表示,所述药物组合物包括与至少一种生理上可接受的赋形剂关联的至少一种式(i)的化合物作为活性成分,其中r是-c(o)-r1,其中r1是氢或含有2至5个碳原子的线性烷基链,并且其中r'是含有3至6个碳原子的线性烷基链或任选地取代的芳基基团或任选地取代的杂芳基基团,其中r1和r’不相同。本发明的另一个目的由药物组合物表示,所述药物组合物包括与至少一种生理上可接受的赋形剂关联的至少一种式(i)的化合物作为活性成分,其中r是c(o)-r1,其中r1是含有2至5个碳原子的线性烷基链,并且其中r'是含有3至6个碳原子的线性烷基链或任选地取代的芳基基团或任选地取代的杂芳基基团,其中r1和r’不相同。根据本发明的优选实施方案,所述药物组合物包括至少一种式(i)的化合物作为活性成分,其中r为c(o)-r1,其中r1为氢或-ch2ch3并且r'为-(ch2)3-ch3或苯基基团,其中r1和r'不相同。根据本发明的优选实施方案,所述药物组合物包含至少一种式(i)的化合物作为活性成分,其中r为c(o)-r1,其中r1为ch2ch3并且r'为-(ch2)3-ch3或苯基基团,其中r1和r'不相同。根据最优选的实施方案,所述药物组合物包含与至少一种生理上可接受的赋形剂关联的11-脱氧皮质醇17α-戊酸酯-21-丙酸酯(cb-03-10)作为活性成分。本发明的另一个目的由包括与至少一种生理上可接受的赋形剂关联的11-脱氧皮质醇17α-戊酸酯(cb-03-05)作为活性成分的药物组合物表示。在另一个目的中,本发明的化合物和药物组合物用于作为药物使用,优选在癌前病变、发育异常、化生和肿瘤疾病(包含恶性瘤形成和转移)的治疗中;根据另一个方面,这种治疗可以是有疗效的、辅助的、新辅助的或姑息的。以这种方式,它们作为抗肿瘤剂被使用。优选地,所述肿瘤疾病是实体瘤。更优选地,所述实体瘤是上皮肿瘤,例如,举例来说,前列腺癌、乳腺癌、胰腺癌、肺癌、胃肠道癌(优选结肠癌)、肾癌、甲状腺癌、子宫癌和肾上腺癌等。在本文公开的发明的优选实施方案中,所述上皮肿瘤是前列腺癌和胰腺癌,更优选为外分泌胰腺癌或乳腺癌,例如三阴性乳腺癌。在本发明的另一个优选实施方案中,肿瘤疾病是具有突变或截短的雄激素受体的前列腺癌。理想地,包括式(i)的化合物,包含11-脱氧皮质醇17α-戊酸酯-21-丙酸酯(cb-03-10)和11-脱氧皮质醇17α-戊酸酯(cb-03-05),的用于作为抗肿瘤剂使用的药物组合物,其中肿瘤疾病是具有突变或截短的雄激素受体的前列腺癌。以这种方式,可根据本发明治疗的前列腺癌可以是或已经变得对抗雄激素靶向疗法,例如恩扎鲁胺有抗性。如以上所述,在另一个实施方案中,提供了包括式(i)的化合物,包含11-脱氧皮质醇17α-戊酸酯-21-丙酸酯(cb-03-10)和11-脱氧皮质醇17α-戊酸酯(cb-03-05)的用于作为糖皮质激素受体(gr)调节剂(优选糖皮质激素拮抗剂)使用的药物组合物。本发明的药物组合物能够是固体形式,例如,举例来说,粉剂、冷冻干燥粉剂、颗粒剂、丸剂、片剂或胶囊剂。如果需要,还可加入某些甜味剂、调味剂或着色剂。本发明的化合物也能够是具有一种或多种赋形剂的微胶囊形式。片剂、胶囊、丸剂和颗粒剂的固体剂型能够制备为带有包衣和壳,例如肠溶衣和药物制剂领域众所周知的其他包衣。用于固体药物组合物的合适的赋形剂可选自但不限于本领域技术人员已知的类别,例如吸附剂、填充剂、表面活性剂、压缩助剂、粘合剂、润滑剂、崩解剂、稀释剂、分散剂、流动促进剂、冷冻干燥剂、助流剂、冻干助剂、成膜剂、染料、抗氧化剂等。作为实例,用于固体药物组合物的合适赋形剂能够以非限制性方式选自磷酸钙、硬脂酸镁、滑石、糖、乳糖、糊精、淀粉、明胶、纤维素以及其衍生物、聚乙烯吡咯烷酮、包衣剂、染料和蜡。这些赋形剂的任何混合物能够根据本发明适当地使用。根据本发明,例如片剂、颗粒剂、丸剂、胶囊等的固体药物组合物能够配制成即时释放形式或延迟释放形式或控制释放形式或持续释放(extendedrelease)形式或延长释放(prolongedrelease)形式,并且适用于通过口服或舌下施用途径或作为植入物施用。受控的、持续的和/或延长的组合物可根据任何常规方法或系统制备,例如根据通过引用全文并入本文的wo00/76478。本发明的药物组合物也能够是液体形式,例如溶液、乳剂、悬浮液或糖浆。用于口服施用的液体剂型包含但不限于药学上可接受的乳剂、微乳剂、溶液、悬浮液、糖浆剂和酏剂。除了活性化合物之外,液体剂型可含有本领域通常使用的惰性稀释剂。除惰性稀释剂之外,口服组合物还能够包含辅剂,比如润湿剂、乳化剂和悬浮剂、甜味剂、调味剂和增香剂。用于液体药物组合物的适当赋形剂能够选自但不限于本领域技术人员熟知的类别,例如溶剂、助溶剂、油质媒介物(oleaginousvehicles)、缓冲剂、表面活性剂、乳化剂、溶解度增强剂、助悬剂、增溶剂、螯合剂、酸化剂、碱化剂、抗氧化剂、防腐剂、渗透剂、张度剂、粘度控制剂等。举例来说,用于液体制剂的合适的药物赋形剂能够选自注射用水、有机溶剂或共溶剂(例如乙醇、二醇和甘油及其混合物)、天然油(例如大豆油、中链甘油三酯、聚氧乙烯15-羟基硬脂酸酯、聚山梨醇酯80、聚氧乙烯35-蓖麻油、氯化钠、磷酸钠、磷酸钾)等。根据本发明,所述液体药物组合物能够是无菌或非无菌的。在一个实施方案中,液体药物组合物通过本领域技术人员熟知的技术进行终末灭菌,例如干热灭菌、湿热灭菌、γ辐射、电子束灭菌等。在另一个实施方案中,液体药物组合物通过无菌过滤灭菌并且在最终的初级包装容器中无菌填充。根据本文公开的发明的液体药物组合物能够用于注射、输注或灌注,例如静脉内、肌肉内、腹膜内、皮下或肿瘤内施用。施用方法本文所述的化合物和组合物可被口服、肠胃外、通过雾化吸入、局部、直肠、鼻、含服、阴道或经由植入的容器施用。本文使用的术语“肠胃外的”包含但不限于皮下、静脉内、肌内、关节内、滑膜内、胸骨内、鞘内、肝内、病灶内(intralesional)和颅内注射或输注技术。可注射的制剂,例如无菌的可注射的水性或油性悬浮液可根据已知技术使用合适的分散剂或润湿剂和悬浮剂来配制。无菌的可注射的制剂还可为在无毒的肠胃外可接受的稀释剂或溶剂中的无菌的可注射的溶液、悬浮液或乳剂。可注射的制剂能够被灭菌,例如,通过过滤经过保留细菌的过滤器,或在无菌固体组合物形式中,通过掺入灭菌剂来灭菌,该无菌固体组合物能够在使用之前被溶解或分散在无菌水或其他无菌可注射的介质中。本文所述的化合物和组合物的无菌可注射形式可以是水性或油性悬浮液。这些悬浮液可根据本领域已知的技术使用合适的分散剂或湿润剂和悬浮剂来配制。无菌可注射的制剂还可为在无毒的肠胃外可接受的稀释剂或溶剂中的无菌可注射的溶液或悬浮液。用于本发明方法的化合物能够以单位剂型配制。术语“单位剂型”是指适合作为用于接受治疗的受试者的单一剂量的物理上不连续的单位,每个单位含有计算以产生所需的治疗作用的预定数量的活性物质,任选地与合适的药物载体相关联。单位剂型能够是用于单次日剂量或多次日剂量(例如,每天约1至4次或更多次)中的一次。当使用多次日剂量时,每个剂量的单位剂型能够相同或不同。根据本发明,式(i)的化合物或包括所述化合物的药物组合物优选通过静脉内注射施用,更优选通过输注袋或注射器或泵导管,或通过肌内注射,或通过皮下注射,或以片剂或胶囊剂的形式口服(peros)(通过口)施用。根据一个实施方案,所述药物组合物为液体形式并且适于注射,并且包含范围为从0.1%至50.0%重量比体积(w/v),优选地从0.25%至25%w/v,更优选地从0.5%至10%w/v,更加优选地从1%至5%w/v的量的式(i)的11-脱氧皮质醇衍生化合物。根据另一个实施方案,所述药物组合物为固体形式,并且包含范围为从0.1%至50%重量比重量(w/w),优选地从0.5%至40%w/w,更优选地从1%至30%w/w的量的式(i)的11-脱氧皮质醇衍生化合物。所述药物组合物中至少一种式(i)的化合物的量是使得在向患有癌前病变、发育异常、化生和肿瘤疾病(包含恶性瘤形成和转移)的哺乳动物施用时能够获得有效剂量水平。用于有疗效的或辅助的、或新辅助的或姑息的治疗癌前期病变、发育异常、化生和肿瘤疾病(包含恶性瘤形成和转移)的式(i)的化合物和包括其作为抗肿瘤活性成分的药物组合物优选地施用于哺乳动物,所述哺乳动物是人,或优选地施用于动物,优选人。联合疗法根据另一个实施方案,化合物、组合物和药物组合物可含有至少另一种活性成分,优选化疗活性成分,作为组合用于同时、分别或顺序施用。在某些实施方案中,根据本发明的式(i)的化合物和包括至少一种式(i)的化合物和至少一种生理学上可接受的赋形剂的药物组合物能够与至少一种其他药物(特别是化疗药物)以组合疗法使用。在某些实施方案中,本发明的化合物能够与另一种药物(特别是化疗药物)的施用同时施用。在某些实施方案中,本发明的化合物能够在另一种药物(特别是化疗药物)的施用之前或之后施用。所述至少一种其他药物,特别是化疗药物,能够对于治疗相同或不同的疾病、紊乱或状况是有效的。本发明的方法包含施用本发明的一种或多种式(i)的化合物或包含至少一种式(i)的化合物和至少另一种药物,优选化疗药物的药物组合物,条件是组合施用不抑制本发明的一种或多种化合物的治疗功效和/或不产生不可接受的不利组合作用。11-脱氧皮质醇17α-戊酸酯(本文也称为“05”或“cb-03-05”)如上所述,本发明的另一个目的是用于作为药物使用的11-脱氧皮质醇17α-戊酸酯(本文也称为“05”或“cb-03-05”),表示为:理想地,11-脱氧皮质醇17α-戊酸酯用于在癌前病变、发育不良、化生和肿瘤疾病(任选地包含恶性瘤形成和转移)的治疗中使用。优选地,11-脱氧皮质醇17α-戊酸酯用于作为抗肿瘤剂使用。优选地,肿瘤疾病是实体瘤,优选上皮肿瘤。上皮肿瘤可选自前列腺癌;乳腺癌;胰腺癌(优选外分泌胰腺癌);肺癌;胃肠道癌,例如结肠癌;肾癌;甲状腺癌;子宫癌;以及肾上腺癌。根据一个实施方案,上皮肿瘤是前列腺癌。在本发明的另一个优选实施方案中,肿瘤疾病是具有突变或截短的雄激素受体的前列腺癌。以这种方式,可根据本发明治疗的前列腺癌可以是或已经变得对抗雄激素靶向疗法,例如恩扎鲁胺有抗性。根据另一个实施方案,上皮肿瘤是胰腺癌,优选外分泌胰腺癌。根据一个实施方案,上皮肿瘤是乳腺癌,优选三阴性乳腺癌(tnbc)。在一个实施方案中,乳腺癌是三阴性乳腺癌,并且受试者是常规治疗的复发或无反应者。根据另一个实施方案,上皮肿瘤是胃肠道癌,例如结肠癌。根据另一个实施方案,11-脱氧皮质醇17α-戊酸酯用于作为糖皮质激素受体(gr)调节剂,优选糖皮质激素拮抗剂使用。根据另一个方面,提供了药物组合物,该药物组合物包括以下结构式的化合物:以及至少一种生理上可接受的赋形剂,所述药物组合物用于作为药物使用,优选在癌前病变、发育不良、化生和肿瘤疾病(任选地包含恶性瘤形成和转移)的治疗中使用。优选地,所述肿瘤疾病是实体瘤,优选上皮肿瘤,例如前列腺癌;乳腺癌;胰腺癌;肺癌;胃肠道癌,例如结肠癌;肾癌;甲状腺癌;子宫癌;肾上腺癌。根据另一个实施方案,所述上皮肿瘤是前列腺癌。在本发明的另一个优选实施方案中,肿瘤疾病是具有突变或截短的雄激素受体的前列腺癌。以这种方式,可根据本发明治疗的前列腺癌可以是或已经变得对抗雄激素靶向疗法,例如恩扎鲁胺有抗性。根据另一个实施方案,上皮肿瘤是胰腺癌,优选外分泌胰腺癌。根据另一个实施方案,上皮肿瘤是乳腺癌,优选三阴性乳腺癌(tnbc)。在一个实施方案中,乳腺癌是三阴性乳腺癌,并且受试者是常规治疗的复发或无反应者。根据另一个实施方案,上皮肿瘤是胃肠道癌,例如结肠癌。药物组合物还可包括至少一种其他活性成分,优选化疗活性成分,用于同时、分别或顺序施用。根据另一个方面,提供了药物组合物,该药物组合物包括以下结构式的化合物:以及至少一种生理上可接受的赋形剂,所述药物组合物用于作为糖皮质激素受体(gr)调节剂,优选糖皮质激素拮抗剂使用。另一方面,提供了在有相应需要的受试者中治疗癌前病变、发育不良、化生和肿瘤疾病的方法,包括对所述受试者施用治疗有效量的以下结构式的化合物:或包含所述化合物的药物组合物。根据一个实施方案,肿瘤疾病是恶性瘤形成或转移。优选地,受试者是哺乳动物。理想地,哺乳动物是人。根据一个实施方案,肿瘤疾病是实体瘤。任选地,实体瘤是上皮肿瘤。上皮肿瘤可选自前列腺癌、乳腺癌、子宫癌、胰腺癌、肺癌、胃肠道癌(优选结肠癌)、肾癌、甲状腺癌和肾上腺癌等。根据另一个实施方案,上皮肿瘤是前列腺癌、胰腺癌、外分泌胰腺癌、或乳腺癌。根据另一个实施方案,所述上皮肿瘤是前列腺癌。在本发明的另一个优选实施方案中,肿瘤疾病是具有突变或截短的雄激素受体的前列腺癌。以这种方式,可根据本发明治疗的前列腺癌可以是或已经变得对抗雄激素靶向疗法,例如恩扎鲁胺有抗性。根据另一个实施方案,上皮肿瘤是胰腺癌,优选外分泌胰腺癌。根据另一个实施方案,其中乳腺癌是三阴性乳腺癌。在一个实施方案中,乳腺癌是三阴性乳腺癌,并且受试者是常规治疗的复发或无反应者。根据另一个实施方案,上皮肿瘤是胃肠道癌,例如结肠癌。根据本发明的另一个方面,提供了在有相应需要的受试者中治疗由糖皮质激素介导的疾病或紊乱的方法,该方法包括施用治疗有效量的11-脱氧皮质醇17α-戊酸酯或包括11-脱氧皮质醇17α-戊酸酯的药物组合物。实施例实施例1:11-脱氧皮质醇17α-苯甲酸酯(cb-03-06)对前列腺癌细胞系的体外抗肿瘤活性进行实验以测试和定义11-脱氧皮质醇17α-苯甲酸酯对分别代表具有雄激素受体(ar)阳性或阴性表达的前列腺癌细胞系的lncap(ar+)和pc3(ar-)的体外抗肿瘤活性。实验方法由以下组成:1.将3000个癌细胞接种在96孔平底板中含有2%活性炭解吸的牛血清的完全培养基中。2.24小时后,向培养物中加入具有或不具有抗雄激素化合物的10nmdht(二氢睾酮)或dmso媒介物(阴性对照)。3.3天后,使用atp依赖性增殖测定定量活细胞数。考虑到化合物在体内动物试验中的潜在应用,测试的目的是确定每种化合物杀死50%的癌细胞的浓度(ic50)。通过s型剂量响应曲线拟合并且使用prizm统计分析软件分析来自实验1的数据。使用prizm统计分析软件中的非线性回归最小二乘法曲线拟合分析来自实验2的数据。对每一细胞系发现的ic50值报告在下表中,并与众所周知的比较物做比较,所述比较物为最有效的抗雄激素类固醇cpa和恩扎鲁胺(一种口服雄激素受体抑制剂,能够延长患有转移性去势抗性前列腺癌的男性存活,目前用于治疗前列腺癌)。2组实验结果如下。实验1通过prizm统计分析软件中的s型剂量响应曲线拟合结果。ic50值显示,11-脱氧皮质醇17α-苯甲酸酯的抗肿瘤活性虽然具有较弱的相关性趋势,但可被认为不严格依赖于雄激素受体表达,与比较物不同。实验2以下结果包括除实验1中的那些实验以外的另外的实验。使用prizm统计分析软件中的非线性回归最小二乘法曲线拟合分析结果。实施例2:11-脱氧皮质醇17α-戊酸酯-21-丙酸酯(cb-03-10)对前列腺癌细胞系的体外抗肿瘤活性进行实验以测试和定义11-脱氧皮质醇17α-戊酸酯-21-丙酸酯(cb-03-10)对分别代表具有ar阳性或阴性表达的前列腺癌细胞系的lncap(ar+)和pc3(ar-)的体外抗肿瘤活性。实验方法由以下组成:1.将3000个癌细胞接种在96孔平底板中含有2%活性炭解吸的牛血清的完全培养基中。2.24小时后,向培养物中加入具有或不具有抗雄激素化合物的10nmdht(二氢睾酮)或dmso媒介物(阴性对照)。3.3天后,使用atp依赖性增殖测定定量活细胞数。考虑到化合物在体内动物试验中的潜在应用,测试的目的是确定每种化合物杀死50%的癌细胞的浓度(ic50)。通过s型剂量响应曲线拟合并且使用prizm统计分析软件分析来自实验1的数据。使用prizm统计分析软件中的非线性回归最小二乘法曲线拟合分析来自实验2的数据。对每一细胞系发现的ic50值报告在下表中,并与众所周知的以下比较物做比较:最有效的抗雄激素类固醇cpa和恩扎鲁胺(一种口服ar拮抗剂,能够延长患有转移性去势抗性前列腺癌的男性存活)。实验1通过prizm统计分析软件中的s型剂量响应曲线拟合结果。实验2以下结果包括除实验1中的那些实验以外的另外的实验。使用prizm统计分析软件中的非线性回归最小二乘法曲线拟合分析结果。ic50值显示,11-脱氧皮质醇17α-戊酸酯-21-丙酸酯(cb-03-10)的抗肿瘤活性可与细胞系中雄激素受体的表达有关。实施例3:11-脱氧皮质醇17α-苯甲酸酯(cb-03-06)对胰腺癌细胞系的体外抗肿瘤活性进行实验以测试和定义11-脱氧皮质醇17α-苯甲酸酯对代表胰腺癌细胞系的两种胰腺肿瘤细胞系panc1(ar+)和miapaca2(ar低)的体外抗肿瘤活性。对于雄激素受体的存在和表达,细胞系也被分类为阳性(ar+)或阴性/低(ar+/-)。实验方法由以下组成:1.将3000个癌细胞接种在96孔平底板中含有2%活性炭解吸的牛血清的完全培养基中。2.24小时后,向培养物中加入具有或不具有抗雄激素化合物的10nmdht(二氢睾酮)或dmso媒介物(阴性对照)。3.3天后,使用atp依赖性增殖测定定量活细胞数。考虑到化合物在体内动物试验中的潜在应用,测试的目的是确定每种化合物杀死50%的癌细胞的浓度(ic50)。通过s型剂量响应曲线拟合并且使用prizm统计分析软件分析来自实验1的数据。使用prizm统计分析软件中的非线性回归最小二乘法曲线拟合分析来自实验2的数据。对每一细胞系发现的ic50值报告在下表中,并与众所周知的比较物做比较,所述比较物为最有效的抗雄激素类固醇cpa和恩扎鲁胺(一种有效的口服ar拮抗剂)。实验1通过prizm统计分析软件中的s型剂量响应曲线拟合结果。实验2以下结果包括除实验1中的那些实验以外的另外的实验。使用prizm统计分析软件中的非线性回归最小二乘法曲线拟合分析结果。ic50值显示,11-脱氧皮质醇17α-苯甲酸酯的抗肿瘤活性比比较物(cpa和恩扎鲁胺)的活性高至少两倍。由于miapaca2以低/无效的ar表达为特征,该化合物的抗癌活性与癌细胞系中的雄激素受体表达不直接相关。实施例4:11-脱氧皮质醇17α-戊酸酯-21-丙酸酯(cb-03-10)对胰腺癌细胞系的体外抗肿瘤活性进行实验以测试和定义11-脱氧皮质醇17α-戊酸酯-21-丙酸酯(cb-03-10)对代表胰腺肿瘤的细胞系即代表胰腺癌细胞系的panc1(ar+)和miapaca2(ar低)的体外抗肿瘤活性。对于雄激素受体的存在和表达,细胞系也被分类为阳性(ar+)或阴性/低(ar+/-)。实验方法由以下组成:1.将3000个癌细胞接种在96孔平底板中含有2%活性炭解吸的牛血清的完全培养基中。2.24小时后,向培养物中加入具有或不具有抗雄激素化合物的10nmdht(二氢睾酮)或dmso媒介物(阴性对照)。3.3天后,使用atp依赖性增殖测定定量活细胞数。考虑到化合物在体内动物试验中的潜在应用,测试的目的是确定每种化合物杀死50%的癌细胞的浓度(ic50)。通过s型剂量响应曲线拟合并且使用prizm统计分析软件分析来自实验1的数据。使用prizm统计分析软件中的非线性回归最小二乘法曲线拟合分析来自实验2的数据。对每一细胞系发现的ic50值报告在下表中,并与众所周知的以下比较物做比较:最有效的抗雄激素类固醇cpa和恩扎鲁胺(一种口服ar拮抗剂)。实验1通过prizm统计分析软件中的s型剂量响应曲线拟合结果。实验2以下结果包括除实验1中的那些实验以外的另外的实验。使用prizm统计分析软件中的非线性回归最小二乘法曲线拟合分析结果。ic50值显示,11-脱氧皮质醇17α-戊酸酯-21-丙酸酯(cb-03-10)的抗肿瘤活性与胰腺癌细胞系上的雄激素受体表达无相关性。实施例5:小鼠中的体内人胰腺肿瘤异种移植物11-脱氧皮质醇17α-苯甲酸酯(cb-03-06)对裸雄性小鼠中胰腺异种移植肿瘤生长的活性已经通过与最有效的抗雄激素类固醇醋酸环丙孕酮(cpa)相比较而评价。将11-脱氧皮质醇17α-苯甲酸酯和醋酸环丙孕酮分别稀释于dmso/2-羟丙基β-环糊精(媒介物)中。进行测试比较两种不同剂量(8.0mg/kg,相当于约230μm,和40mg/kg,相当于大约1150μm)的11-脱氧皮质醇17α-苯甲酸酯的抗肿瘤活性,对比于媒介物(即生理盐水中0.4%(v/v)吐温80和0.5%(w/v)羧甲基纤维素)和对比于两种不同剂量(7.4mg/kg和37mg/kg)的比较物醋酸环丙孕酮。将悬浮于基质胶中的1×106个miapaca-2细胞皮下注射到6周龄的无胸腺裸小鼠中。在移植后肿瘤体积达到50mm3之后,用测试化合物、用媒介物和用比较化合物的治疗开始。所有化合物以100μl/小鼠的低剂量溶液(约230μm)或100μl/小鼠的高剂量溶液(约1150μm)分别皮下注射11-脱氧皮质醇17α-苯甲酸酯、媒介物和醋酸环丙孕酮。化合物和对照每天皮下施用,持续28天。每4天用数字卡尺测量肿瘤。结果在图1中绘制为相对于开始治疗时的肿瘤体积的平均变化。根据公式0.5236(r1)2(r2)计算肿瘤体积,其中r1<r2。误差棒是每个治疗组7至10只小鼠的sem。根据student’st检验计算p值。高剂量的11-脱氧皮质醇17α-苯甲酸酯保持胰腺肿瘤大小增加小于开始治疗时肿瘤大小的5倍。相比之下,媒介物和醋酸环丙孕酮治疗组中的平均肿瘤大小增加到12倍。从这些数据,本发明的化合物,11-脱氧皮质醇17α-苯甲酸酯的抗肿瘤活性是明显的。实施例6-小鼠中的体内人胰腺肿瘤异种移植物11-脱氧皮质醇17α-戊酸酯-21-丙酸酯(cb-03-10)对裸雄性小鼠中胰腺肿瘤异种移植模型的活性已经通过与抗雄激素类固醇醋酸环丙孕酮(cpa)相比较而评价。将11-脱氧皮质醇17α-戊酸酯-21-丙酸酯(cb-03-10)和醋酸环丙孕酮分别稀释于dmso/2-羟丙基β-环糊精(媒介物)中。进行测试比较两种不同剂量(约8.6mg/kg和43mg/kg)的11-脱氧皮质醇17α-戊酸酯-21-丙酸酯(cb-03-10)的抗肿瘤活性对比于媒介物(即生理盐水中0.4%(v/v)吐温80和0.5%(w/v)羧甲基纤维素)和对比于两种不同剂量(7.4mg/kg和37mg/kg)的比较物醋酸环丙孕酮。将悬浮于基质胶中的1×106个miapaca-2细胞皮下注射到6周龄的无胸腺裸小鼠中。在移植后肿瘤体积达到50mm3之后,用测试化合物、用媒介物和用比较化合物的治疗开始,以100μl/小鼠的低剂量溶液(约230μm)或100μl/小鼠的高剂量溶液(约1150μm)分别皮下注射11-脱氧皮质醇17α-戊酸酯-21-丙酸酯(cb-03-10)、媒介物和醋酸环丙孕酮。化合物和对照每天皮下施用,持续28天。每4天用数字卡尺测量肿瘤。结果在图2中绘制为相对于开始治疗时的肿瘤体积的平均变化。根据公式0.5236(r1)2(r2)计算肿瘤体积,其中r1<r2。误差棒是每个治疗组7至10只小鼠的sem。根据t检验计算p值。高剂量的11-脱氧皮质醇17α-戊酸酯-21-丙酸酯(cb-03-10)保持胰腺肿瘤大小增加小于治疗时初始肿瘤大小的5倍。此外,当治疗停止时,肿瘤大小趋于再次增加,但是以较低的速率和程度。相比之下,媒介物和醋酸环丙孕酮治疗组中的平均肿瘤大小增加到12倍和以上,从而出于伦理原因需要抑制这些组的一些动物。从这些数据,本发明的化合物11-脱氧皮质醇17α-戊酸酯-21-丙酸酯(cb-03-10)的抗肿瘤活性是明显的。从实施例5和6的数据,确认了11-脱氧皮质醇17α-苯甲酸酯和11-脱氧皮质醇17α-戊酸酯-21-丙酸酯(cb-03-10)体内对胰腺肿瘤的体内抗肿瘤活性,并且这两种化合物在同一动物模型中具有高于醋酸环丙孕酮的抗肿瘤活性(参见图3)。实施例7:胰腺癌细胞系的体外治疗指数为了评价待测化合物在细胞系生存力实验中的安全性,应考虑影响细胞存活率和生存力的所有因素。在这个意义上,化合物和比较物的固有毒性的评价是非常重要的。化合物对外周血单核细胞(pbmc)的ic50与对癌细胞系的ic50的比例构成了治疗指数(therapeuticindex),并显示了什么是更安全的待测化合物。在2种不同的激活状态下测试pbmc中的ic50:受激的–活跃分裂细胞静息的-静止的、非分裂细胞结果报告在下表中,分别与受激的pbmc和静息的pbmc有关:对受激的pbmc的ic50(μm)实验1实验2平行地对静息的pbmc重复了相同的实验,获得如下结果。对静息的pbmc的ic50(μm)实验1实验2对受激的pbmc计算得到的治疗指表(ti)报告在下表中:对受激的pbmc的ti实验1实验2并且对静息的pbmc计算得到的治疗指数报告在下表中:对静息的pbmc的ti实验1实验2在表中,0值表示在pbmc中比在癌细胞系中有更高的毒性。实施例8:11-脱氧皮质醇17α-苯甲酸酯和11-脱氧皮质醇17α-戊酸酯-21-丙酸酯(cb-03-10)对上皮肠癌细胞系的体外抗肿瘤活性进行实验以测试和定义11-脱氧皮质醇17α-苯甲酸酯和11-脱氧皮质醇17α-戊酸酯-21-丙酸酯对代表上皮肠肿瘤的细胞系即ht29的体外抗癌活性。实验方法由以下组成:1.将单层ht-29细胞铺板于:96孔板,密度为2×104个细胞/ml。将接种的细胞在37℃保持在5%co2中,并且静置使贴附24小时。2.然后将细胞在浓度分别为0.16、0.8、4、20、100和500mm的测试化合物中孵育72小时。3.处理72h后,进行mtt比色测定。考虑到化合物在体内动物试验中的潜在应用,测试的目的是确定每种化合物杀死50%的癌细胞的浓度(ic50)。使用prizm统计分析软件中的非线性回归最小二乘法曲线拟合分析数据。对每一细胞系发现的ic50值报告在下表中。两种产品在不同微摩尔浓度(micromolarconcentration)下对ht29的抑制(%)对两种产品计算的ic50值(报告在下表)显示,两种化合物均对ht29显示出明显的抗癌活性。计算的ic50(微摩尔浓度)cb-03-0615.97cb-03-1034.16实施例9:对上皮肠癌细胞系的体外治疗指数为了评价待测化合物在细胞系生存力实验中的安全性,应考虑影响细胞存活率和生存力的所有因素。在这个意义上,化合物和比较物的固有毒性的评价是非常重要的。化合物对pbmc的ic50与对癌细胞系的ic50之间的比例构成了治疗指数,治疗指数是一个在安全条件下定义产品功效的重要参数。在2种不同的激活状态下测试pbmc中的ic50:受激的–活跃分裂细胞静息的-静止的、非分裂细胞。对受激的和静息的pbmc计算得到的治疗指数(ti)报告在下表中:实验1实验2从这些数据,对比于上皮肠癌细胞,本发明的化合物11-脱氧皮质醇17α-戊酸酯-21-丙酸酯的抗肿瘤活性和安全性得到了确认。实施例10-11-脱氧皮质醇17α-苯甲酸酯的合成根据包含以下步骤的合成方案制备11-脱氧皮质醇17α-苯甲酸酯:在步骤1中,将11-脱氧皮质醇溶解在合适的溶剂(例如乙酸乙酯)中。以催化量(1-10%mol)加入甲苯磺酸吡啶鎓盐(pyridiniumtosilate)或对甲苯磺酸(p-toluenesulfonicacid),然后加入原苯甲酸三烷基酯(r=甲基或r=乙基)。将反应混合物加热至80℃,持续3至6小时。除去溶剂并在醇溶剂中结晶后,得到作为固体的11-脱氧皮质醇正苯甲酸酯(cortexoloneorthobenzoate)1。在步骤2中,将11-脱氧皮质醇正苯甲酸酯1(r=甲基或r=乙基)溶解在醇溶剂(例如甲醇)中,并在回流下用0.1n乙酸缓冲液处理。除去溶剂后,残余物通过除盐水(demiwater)处理纯化,并将11-脱氧皮质醇-17-α-苯甲酸酯作为固体回收。实施例11:11-脱氧皮质醇17-α-戊酸酯-21-丙酸酯(cb-03-10)(3)和11-脱氧皮质醇17α-戊酸酯(cb-03-05)(2)的合成根据以下合成方案制备了11-脱氧皮质醇17α-戊酸酯-21-丙酸酯(cb-03-10):步骤1:将11-脱氧皮质醇溶解在合适的溶剂(例如乙酸乙酯)中。以催化量(1-10%mol)加入甲苯磺酸吡啶鎓盐或对甲苯磺酸,然后加入原戊酸酯三烷基酯(tri-alkylorthovalerate)(r=甲基或r=乙基)。将反应混合物加热至80℃,持续3-5小时,除去溶剂并在醇溶剂中结晶后,得到11-脱氧皮质醇原戊酸酯(cortexoloneorthovalerate)1。在步骤2中,将11-脱氧皮质醇原戊酸酯1(r=甲基或r=乙基)溶于醇溶剂(例如甲醇)中,并在回流下用0.1n乙酸缓冲液(ph3至3.9)处理。除去溶剂后,随后用纯化水处理,将11-脱氧皮质醇-17α-戊酸酯2作为固体回收。在步骤3中,将11-脱氧皮质醇-17α-戊酸酯2溶于吡啶中并加入1当量丙酰氯。当转化完成时,将混合物用水稀释,并且产物3作为固体回收并通过用醇结晶进行纯化。实施例12-11-脱氧皮质醇衍生化合物cb-03-10的体外抗癌活性分析测试cb-03-10在体外抑制建立的癌细胞系生长的能力。将癌细胞系以3000个细胞接种在96孔平底板中含有2%活性炭解吸的牛血清的完全培养基中。24小时后,加入测试化合物或dmso/媒介物(0.1%终浓度作为阴性对照)。cpa和恩扎鲁胺,两种有效的公认的抗雄激素作为细胞毒性的阳性对照使用。3天后,使用atp依赖性细胞生存力测定(promegacelltiterglo)定量活细胞数。图5显示了11-脱氧皮质醇衍生化合物对人和胰腺细胞系的细胞毒性活性的剂量滴定。进行每种化合物杀死50%的癌细胞的浓度(ic50)的确定以表示cb-03-10和其他化合物抑制癌细胞生长的能力。每种化合物从3um滴定至200um。3天后,使用atp依赖性增殖测定定量活细胞数。使用prizm统计软件中的非线性回归最小二乘法曲线拟合分析表i中所示的数据。表i.前列腺和胰腺癌细胞系中体外测试的cb-03-10的ic50从图5和表i所示的数据清楚,11-脱氧皮质醇衍生的化合物以各种浓度和ic50杀死癌细胞。cb-03-10杀死前列腺癌细胞(组a)优于有效的抗雄激素cpa。更重要的是,cb-03-10抑制前列腺癌细胞的体外生长优于恩扎鲁胺,恩扎鲁胺是一种新型有效的抗雄激素药物,目前在临床上作为雄激素依赖性前列腺癌的首选使用。有趣的是,cb-03-10抑制已知表达雄激素受体(ar)的快速生长胰腺细胞系(组b)的生长至非常低的水平。这些数据表明与细胞毒性而不是抗雄激素活性相关的独立作用机制。实施例13-测试的癌细胞系上的雄激素受体表达的分析对表i中测试的前列腺和胰腺细胞系进行facs测定,以更好地了解癌细胞系上的ar表达与cb-03-10抑制癌细胞生长的能力之间的关系。图6显示测试的癌细胞上的ar表达水平。如预期的,前列腺和胰腺细胞系中的facs分析ar表达与公布的表达水平一致:lncap>panc1>pc3=miapaca2。为了更好地阐明ar和ic50之间的相关性实施了表i,添加了测试的癌细胞系的ar表达(表ii)。表ii.前列腺和胰腺癌细胞系的ar表达和11-脱氧皮质醇衍生化合物的ic50如预期的,有效的抗雄激素cpa和恩扎鲁胺所显示的生长抑制与前列腺癌细胞中的ar表达相关。cb-03-10的抑制活性也与前列腺癌细胞中的ar表达相关(不太严格地)。然而,胰腺癌细胞中的ar表达与抑制活性之间存在负相关。与panc1细胞(ar+)相比,所有测试的化合物在表达较低ar的miapaca2(ar+/-)中更有活性。这一结果暗示了胰腺癌中可能的ar独立作用机制。cb-03-10是系列中最有效的化合物之一。值得注意的是,cb-03-10在前列腺癌细胞系中比恩扎鲁胺更有效。实施例14-11-脱氧皮质醇衍生化合物,特别是cb-03-10对来自实体瘤的癌细胞系的更大样本的体外抗癌活性分析由于cb-03-10的细胞毒性活性似乎与ar表达无关,因此实体瘤的更大样本被测试。mcf7(一种乳腺癌细胞系(ar+/-))、具有较高ar表达的另外的胰腺细胞系(bxpc3)和肠癌细胞系(ht29)(ar-)被添加到前面的组中。结果在表iii中被描述。表iii.cb-03-10对以ar和gr表达为特征的癌细胞系的ic50cb-03-10强烈抑制来自不同上皮起源的多种癌细胞系的细胞生存力。化合物的细胞毒性活性与ar的表达无关。此外,cb-03-10在所有测试的癌细胞系中比恩扎鲁胺更有效。实施例15-11-脱氧皮质醇衍生化合物对不同癌细胞系的治疗指数治疗指数(ti)(也称为治疗窗口或安全性窗口或有时称为治疗比)是引起治疗作用的治疗剂的量与引起毒性的量的比较。在从人血液分离的新鲜细胞(pbmc)上确定化合物的ic50。化合物毒性确定如下:治疗指数=安全性/功效=ic50受激的pbmc/ic50癌细胞结果如表iv所示。表iv.11-脱氧皮质醇衍生化合物对一组癌细胞系的治疗指数。所有11-脱氧皮质醇衍生化合物显示出稳固的安全性谱(safetyprofile)。cb-03-10显示出高治疗指数。这表明与cpa和恩扎鲁胺相比,cb-03-10具有更安全的谱。实施例16-cb-03-10对雄激素受体的结合亲和力以前的实验表明cb-03-10对源自不同来源的肿瘤的癌细胞系具有强的细胞毒性活性。这种细胞毒性活性与测试的癌细胞上的抗雄激素受体表达没有完全相关。基于这种证据,测试化合物对ar的亲和力的测定被设计。为了确定cb-03-10与野生型ar的相对结合亲和力,一种使用来自lifetechnologies的polarscreen试剂盒的竞争测定被使用。简言之,将ar加入到荧光雄激素配体(fluormonetmalgreen)中以形成复合物ar-lbd。竞争物取代来自ar-lbd的荧光fluormonetmalgreen配体,导致荧光配体在其荧光寿命期间快速暴跌(tumble),导致低极化值。非竞争物不会取代来自复合物的荧光配体,因此极化值保持高。在测试化合物存在下的极化值的偏移被用于确定测试化合物对ar-lbd的相对亲和力。cb03-10对ar受体的亲和力为1.1e-06(ic50摩尔);在相同的测定中,二氢睾酮(ar受体的有效结合物)的亲和力为1.1e-08。当与dht相比时,cb-03-10对ar受体的结合亲和力低,并且将cb-03-10表征为ar潜在的结合物。实施例17-cb-03-10对糖皮质激素受体的转录活性雄激素和糖皮质激素在细胞、组织和动物中引起分歧和经常相反的作用。广泛的生理学和分子生物学证据表明,介导这些作用的受体,即雄激素和糖皮质激素受体(分别为ar和gr)影响彼此的转录活性。在体外测定中测试cb-03-10gr拮抗和激动活性。简言之,用包含与基于发光的报道分子连接的gr结合位点的dna构建体转染人肾上皮细胞。24小时后,以拮抗或激动模式处理细胞。另外24小时后,与gr激动剂转录活性成比例的发光被定量。拮抗剂测定是基于地塞米松(dex)诱导的发光的抑制。将cb-03-10的拮抗活性与已知的gr拮抗剂米非司酮(也称为ru486)进行比较,如图7所示。激动剂测定-基于cb-03-10诱导的发光将cb-03-10的激动剂活性与已知不具有激动剂活性的ru486进行比较。如图8所示。如图7所示,cb-03-10是一种有效的拮抗剂(比ru486少10倍)。相比之下,cb-03-10作为gr激动剂是基本上无效的,因为需要非常高的浓度以诱导为50nmdex的活性的20%的活性。实施例18-cb-03-10诱导细胞凋亡和细胞周期停滞目前使用的大多数细胞毒性抗癌药物已经被显示在易感细胞中诱导细胞凋亡。与不同靶标相互作用的不同剂以一些共同特征诱导细胞死亡的事实表明,细胞毒性由细胞参与这一所谓的“程序化”细胞死亡的能力决定。评价cb-03-10以确定对癌细胞系的细胞毒性机制是否由细胞凋亡和细胞周期停滞介导。将癌细胞系接种在6孔平底板中。24小时后,加入测试化合物或dmso媒介物(阴性对照)。另外24小时后,刮去细胞并用荧光素缀合的膜联蛋白v(annexinv)和碘化丙啶染色,并通过流式细胞术分析。图9清楚地显示了cb-03-10如何能够在胰腺癌细胞系中诱导细胞凋亡。cb-03-10在总共28%的细胞(早期和晚期细胞凋亡)中诱导细胞凋亡,对比于对照仅11%。细胞凋亡可能发生在细胞周期的g1/s或g2/m的过渡时。将细胞用cb-03-10处理24小时,然后用多聚甲醛固定并用碘化丙啶染色。图10中的数据表明,cb-03-10以较低浓度诱导s期阻断,然后以较高浓度诱导g2/m阻断。缺少g1阻断表明对p53没有影响。s和g2/m阻断可指示对细胞周期检查点分子的活性。对于s期,可能的靶标是细胞周期蛋白依赖性激酶2(cdk2)。gemzar和顺铂(cisplatin)是在s期作用的示例药物。对于g2,可能的靶标是cdk1。实施例19-cb-03-10对胱天蛋白酶诱导的分析从以前的使用膜联蛋白v染色的研究中确定,cb-03-10在miapaca2细胞中诱导细胞凋亡。为了更好地分析该现象,测量了胱天蛋白酶8(外在途经的引发剂胱天蛋白酶)和胱天蛋白酶9(内在途经的引发剂胱天蛋白酶)以及胱天蛋白酶3和7(效应物胱天蛋白酶)的酶活性。为此,将miapaca2细胞接种在96孔平底培养板中。24小时后,将测试化合物加入到细胞中,吉西他滨(gemcitabine)(已知的胰腺癌化疗剂)和dmso分别作为阳性和阴性对照被使用。在与测试化合物孵育8、24和48小时后,将细胞在含有胱天蛋白酶3/7或8或9底物和专有缓冲液中的稳定的萤光素酶的缓冲液中裂解。在tecansafire仪器中测量发光之前,将裂解物转移到白色不透明板上。相同处理的平行板用于确定活细胞。所有胱天蛋白酶活性都对于活细胞数进行了校正。结果示于图11中。胱天蛋白酶8和9(组a和b)的活性由cb-03-10诱导。该诱导是快速、剂量相关的并且在8小时后已经明显,并且与对照相比高达7倍。吉西他滨(用于胰腺癌治疗使用的已知化疗剂)也诱导了胱天蛋白酶8和9的活性,但与cb-03-10相比具有延迟和效力较低的响应。胱天蛋白酶8和9活性的2、3倍增加直到48小时时才观察到。在这种情况下,胱天蛋白酶3/7(组c)早在8小时时就也被cb-03-10诱导,48小时孵育后达到真正的高水平。有趣的是,cb-03-05未显示出胱天蛋白酶激活的良好谱。吉西他滨对胱天蛋白酶活性的增加直到48小时时才观察到。使用lncap前列腺癌细胞系重复相同的测定(图12)。在这种情况下,阳性对照是恩扎鲁胺,一种用于临床治疗前列腺癌患者的有效和新型抗雄激素。孵育24小时当胱天蛋白酶活性达到顶峰时的结果显示于图12中。实验清楚显示,cb-03-10诱导的引发剂(8和9)和效应物(3/7)胱天蛋白酶活性优于恩扎鲁胺(作为阳性对照使用)。这些结果显示cb-03-10对前列腺癌细胞系的影响内在和外在途径二者的胱天蛋白酶活性的强诱导,证实了在miapaca2细胞系上观察到的抑制。实施例20-大鼠和人血浆中的cb-03-10体外代谢为了获得人和大鼠血浆中cb-03-10代谢的一些见解,一种特异性测定被设计。简言之,将化合物在37℃在人和大鼠血浆中孵育不同时间。孵育后,通过液相色谱测试样品中完整化合物的存在。时间过程和浓度如图13所示。结果表明,cb-03-10在人血浆中迅速降解为cb-03-05,与人血浆相比其在大鼠中降解的更快。实施例21-动物模型(小鼠)中cb-03-10的体内药代动力学分析cb-03-10的药代动力学在静脉(iv)、皮下(sc)和口服施用(po)后在小鼠的血浆中被评价。小鼠(每组3只)以下列剂量施用,在指定时间收集血液。通过hplc-ms/ms分析血浆样品。即使在1小时后,cb-03-10在血浆中也检测不到,无论施用途径如何。然而,cb-03-10代谢为cb-03-05,其身体暴露为189(sc)和47(po)小时/ng/ml(图14)。实施例22-cb-03-10在人胰腺癌(miapaca2细胞系)的小鼠异种移植模型中的体内测试从以前的研究中观察到cb-03-10强烈抑制miapaca2胰腺细胞系(ar+/-)的体外生长。对这一结果是否可转化到体内异种移植胰腺癌模型进行了研究。cpa,一种众所周知的抗雄激素作为对照使用。简单地,将悬浮在基质胶中的1×106个miapaca2细胞皮下(sc)注射到6周龄的雄性无胸腺裸小鼠中。肿瘤每4天用数字卡尺测量。肿瘤体积根据下式计算:0.5236(r1)2(r2),其中r1<r2。在肿瘤达到50mm3后,开始用cb-03-10和对照化合物进行处理。连续28天以每天40mg/kg的浓度每天皮下(sc)注射以dmso/2-羟丙基β-环糊精(媒介物)稀释的化合物(100μl/小鼠)。图15显示了与媒介物相比,在sc注射cb-03-10之后体内异种移植模型中的平均肿瘤增加。在图15中,与对照相比,cb-03-10显示出强大且显著的体内抗胰腺肿瘤活性。当与仅媒介物或cpa(未显示)相比时,其还显示出显著的抗肿瘤活性(p<0.5)。在治疗期间,相对于初始大小,cb-03-10维持胰腺肿瘤大小的增加小于5倍。相比之下,媒介物或cpa治疗组中的平均肿瘤大小增加到12倍。除抑制肿瘤生长外,cb-03-10还显示出在小鼠存活中的益处。重要的是,停止治疗14天后,cb-03-10治疗的小鼠与仅媒介物组相比仍然维持显著较小的肿瘤(分别为6倍和14倍)。用cb-03-10治疗的小鼠的中位生存期为70天,而对于媒介物治疗的小鼠为60天,cpa为40天。这种差异是显著的,媒介物治疗组的死亡风险高2至4倍。实施例23-在小鼠异种移植人前列腺癌模型(lncap细胞)中口服施用的cb-03-10的体内测试从以前的研究中观察到cb-03-10在体外抑制lncap前列腺癌细胞系的生长中也是有效的。对这一结果是否可转化到体内异种移植前列腺癌模型进行了研究。将悬浮于基质胶中的3×106个lncap细胞皮下注射(在右侧腹部)至6周龄的雄性无胸腺裸小鼠中。肿瘤如上所述测量。在肿瘤达到50mm3后,开始用cb-03-10和对照化合物进行治疗。在于20mm柠檬酸缓冲液(ph4)中的15%维生素e-tpgs和65%的0.5%w/vcmc溶液中制备制剂。连续28天每天口服给药(200μl/小鼠中100mg/kg)。结果绘制为相对于开始治疗时的肿瘤体积的平均变化。图16显示了在口服施用cb-03-10之后从体内异种移植前列腺癌模型获得的结果。恩扎鲁胺,一种新型有效的抗雄激素作为阳性对照使用。在28天的治疗期间,口服施用的cb-03-10显示比恩扎鲁胺更好的抗肿瘤活性。使用cb-03-10的肿瘤体积仅增加2倍,使用恩扎鲁胺的增加3倍,对比于阴性对照组为10倍。cb-03-10在治疗停止后维持小前列腺肿瘤的大小增加方面也比恩扎鲁胺更有效(5对比于8倍变化)。甚至治疗停止6周后,cb-03-10组的平均肿瘤体积也比媒介物组小3.6倍。实施例24-cb-03-10对来自lncap前列腺癌细胞的体外前列腺特异性抗原(psa)分泌的抑制前列腺特异性抗原,或psa,是由前列腺的细胞产生的蛋白质。psa测试测量男性血液中psa的水平。psa的血液水平通常在患有前列腺癌的男性中升高,并且其作为替代标记物使用以测试人群中前列腺癌的进展。观察到cb-03-10能够在体内抑制前列腺癌的生长之后,确定化合物抑制来自癌细胞的体外psa分泌的能力。将lncap细胞接种在96孔平底培养板中含有或不含10nmdht的含有活性炭解吸血清的培养基。24小时后,将测试化合物加入到细胞中,使用dmso作为媒介物阴性对照和恩扎鲁胺作为阳性对照。在与测试化合物孵育48小时后,收集上清液并用elisa测定法测试psa,并将相同的细胞裂解以用于细胞生存力评估。如预期的,纯抗雄激素恩扎鲁胺对于抑制psa分泌是有效的,ic50<3μm;cb-03-10也是有效的psa抑制剂(ic509μm)。然而,恩扎鲁胺活性的滴定结果没有cb-03-10那么好。值得注意的是,11-脱氧皮质醇,所有测试化合物的母体和最终代谢物,对psa分泌基本上无活性(ic50为612μm)。当测试这些细胞的细胞生存力时,恩扎鲁胺显示的ic50为61μm,并且cb-03-10显示的ic50为11μm。这证实了两种化合物的强生长抑制活性。重要和有趣的是,11-脱氧皮质醇,所有测试化合物的母体和最终代谢物,仅在非常高的浓度(ic50为153μm)抑制lncap的活力,并且其作为细胞毒性化合物对于癌细胞系基本上是无活性的。实施例25-cb-03-10对乳腺癌细胞系的体外抗癌活性分析三阴性乳腺癌(tnbc)占新诊断的浸润性乳腺癌的约20%。这种癌症亚型不由激素雌激素和孕激素支持,也不受过多her2受体的存在支持,因此患者对常规疗法(例如他莫昔芬或赫赛汀)无反应。因此,这种癌症的特征在于对化疗有抗性和患者的低生存率。这种癌症抗性与高gr表达之间存在相关性(cancertherapy2013)。有临床试验测试gr拮抗剂(米非司酮/ru486)联合化疗用于tnbc的治疗。然而,由于与孕酮受体(pr)拮抗作用相关的多药理学,米非司酮临床使用受损。为了评价cb-03-10是否可作为乳腺癌,并且特别是tnbc的潜在疗法使用,使用以各种激素受体表达为特征的乳腺癌细胞系进行细胞毒性测定。为该测定选择的乳腺癌细胞系为:mcf7乳腺癌细胞(er+pr+her2+,gr+/-)mda-mb-231tbnc细胞(er-pr-her2-,gr++)在测试细胞生长抑制之前,通过如前所述的facs表征了乳腺癌细胞的ar和gr受体表达。图18所示的数据证实了文献中指出的受体表达。对于细胞毒性测定:将细胞接种在96孔平底培养板中含有活性炭解吸的血清的培养基中。24小时后,将测试化合物加入细胞。将dmso作为媒介物阴性对照使用,并且ru486作为阳性对照。72小时后,孵育细胞被收获、裂解和使用用于生存力的细胞滴定光谱测定法确定生存力。表vi显示了cb-03-10对上述乳腺癌细胞系的ic50cb-03-10在两种乳腺癌细胞系中均有活性,但在mcf7细胞中似乎比在mda-mb-231中更有活性,也许暗示gr不是该化合物的唯一靶标。ru486,米非司酮(gr/pr拮抗剂)不像预期的那样影响gr+/-mcf7细胞的生存力,同时在100μm以非常低的程度将tnbcgr+mda-mb-231细胞的生存力抑制至最多25%。有趣的是,cb-03-05仅在mcf7中有活性,在mda-mb-231中没有。不清楚哪种受体负责这种差异作用,因为这些细胞对于至少4种受体是不同的。如果不是gr,则可以是在mcf7中表达但不在mda-mb-231中表达的er(雌激素受体)、pr(孕酮受体)或her2。一般结论这些实施例表明,特别是11-脱氧皮质醇17α-戊酸酯-21-丙酸酯(cb-03-10)具有优于其他已知11-脱氧皮质醇衍生化合物的活性。我们已经观察到体外和体内均有的增加的结果,例如关于:i)一般的体外抗肿瘤活性;ii)与ar表达不直接相关的体外抗肿瘤活性;iii)与gr表达直接相关的体外抗肿瘤活性;iv)治疗指数(ti);以及v)针对胰腺和前列腺肿瘤的体内抗肿瘤活性;vi)从下表i所示的数据清楚,11-脱氧皮质醇衍生的化合物以各种浓度和ic50杀死癌细胞。然而,cb-03-06和cb-03-10与11-脱氧皮质醇衍生系列中的其他化合物相比,在不同来源的癌细胞系中显示出最佳的ic50。甚至cb-03-10的代谢物cb-03-05在lncap前列腺癌细胞中显示出良好的ic50值(ic5032μm)。较低的ic50证明更强的体外抗肿瘤活性。表i.在前列腺和胰腺癌细胞系中测试的11-脱氧皮质醇衍生化合物的ic50ii)在癌细胞系上测试ar表达,参见表ii在前列腺癌细胞系中,如预期的那样,通过有效的抗雄激素(例如cpa和恩扎鲁胺)显示的生长抑制与前列腺癌细胞中的ar表达相关(ar表达越高,细胞毒性活性越好,表示为较低的ic50)。此外,当在lncap(表达高水平雄激素受体的前列腺癌细胞系)上测试时,cb-03-04显示出46的ic50,但当在ar表达低或无的pc3上测试时,ic50高得多(135)。值得注意的是,cb-03-06和cb-03-10的细胞毒性活性不明显受前列腺癌细胞上雄激素受体表达的影响。cb-03-06和cb-03-10的特征在于非常好的ic50,几乎与ar表达无关。在胰腺癌细胞系中,其中ar表达低或几乎无,cb-03-06和cb-03-10显示高于cpa和恩扎鲁胺的有效的细胞毒性活性。更高的活性可以是由于与另外受体的结合相关的另外的作用机制。表ii.前列腺和胰腺癌细胞系的ar表达和11-脱氧皮质醇衍生化合物的ic50iii)治疗指数(ti)(也称为治疗窗口、安全性窗口或治疗比)是引起治疗作用的治疗剂的量与引起毒性的量的比较。在从人血液分离的新鲜细胞(pbmc)上确定化合物的ic50。化合物毒性确定如下:治疗指数=安全性/功效=ic50受激的pbmc/ic50癌细胞表vii示出结果。所有11-脱氧皮质醇衍生化合物均显示出稳固的安全毒性谱。然而,在体外测试的所有7种癌细胞系中,cb-03-06和cb-03-10显示出最高的治疗指数。表vii.11-脱氧皮质醇衍生化合物对一组癌细胞系的治疗指数iv)如实施例25所示的三阴性乳腺癌(tnbc)。cb-03-10显示的细胞毒性活性特别令人印象深刻,因为通常常规治疗剂对于三阴性乳腺癌(tnbc)细胞系不起作用。tnbc被定义为不存在雌激素和孕酮受体表达以及erbb2扩增。它对内分泌或抗erbb2疗法无反应。最近的研究已经发现了tnbc的一些潜在的治疗靶标。然而,它仍然具有糟糕的结果。考虑到cb-03-10的细胞毒性活性和优异的安全性谱;cb-03-10是临床治疗这种癌症的新的和改进的候选者。现在将通过以下编号的实施方案来描述本发明。1.在一个实施方案中,本发明是式(i)的化合物其中r是氢或c(o)-r1,其中r1是含有2至5个碳原子的线性烷基链,并且其中r'是含有3至6个碳原子的线性烷基链或任选地取代的芳基基团或任选地取代的杂芳基基团。2.在另一个实施方案中,本发明是根据陈述1的式(i)的化合物,其中任选地取代的芳基基团是苯基。3.在另一个实施方案中,本发明是根据陈述1的式(i)的化合物,其中r1是氢或ch2ch3,且r'是-(ch2)3-ch3或苯基。4.在另一个实施方案中,本发明是根据陈述1的化合物,具有式:5.在另一个实施方案中,本发明是根据陈述1的化合物,具有式:6.在另一个实施方案中,本发明是根据陈述1至5中任一项所述的化合物,所述化合物用于作为药物使用。7.在另一个实施方案中,本发明是根据陈述1至5中任一项所述的化合物,所述化合物用于在癌前病变、发育异常、化生和肿瘤疾病的治疗中使用。8.在另一个实施方案中,本发明是根据陈述7用于使用的化合物,其特征在于所述肿瘤疾病包含恶性瘤形成和转移。9.在另一个实施方案中,本发明是根据陈述8用于使用的化合物,其特征在于所述肿瘤疾病是实体瘤,优选上皮肿瘤,例如前列腺癌;乳腺癌;胰腺癌;肺癌;胃肠道癌,例如结肠癌;肾癌;甲状腺癌;子宫癌;肾上腺癌。10.在另一个实施方案中,本发明是根据陈述9用于使用的化合物,其特征在于所述上皮肿瘤是前列腺癌或胰腺癌,优选外分泌胰腺癌。11.在另一个实施方案中,本发明是包括至少一种根据陈述1至5中任一项所述的式(i)的化合物与至少一种生理上可接受的赋形剂的药物组合物。12.在另一个实施方案中,本发明是根据陈述11的药物组合物,其特征在于它们是固体或液体形式。13.在另一个实施方案中,本发明是根据陈述12的固体形式的药物组合物,其特征为是粉剂、冷冻干燥粉剂、颗粒剂、丸剂、片剂或胶囊剂。14.在另一个实施方案中,本发明是根据陈述12的液体形式的药物组合物,特征为其是溶液、乳剂、悬浮液或糖浆。15.在另一个实施方案中,本发明是根据陈述11至14中任一项所述的药物组合物,特征为其含有至少另一种活性成分,优选化疗活性成分,作为组合,所述组合用于同时、分别或顺序施用。16.在另一个实施方案中,本发明是根据陈述11至15所述的药物组合物,所述药物组合物用于在癌前病变、发育异常、化生和肿瘤疾病的治疗中使用。17.在另一个实施方案中,本发明是根据陈述16所述的用于使用的药物组合物,其特征在于所述肿瘤疾病包含恶性瘤形成和转移。18.在另一个实施方案中,本发明是根据陈述17所述的用于使用的药物组合物,其特征在于所述肿瘤疾病是实体瘤,优选上皮肿瘤,例如前列腺癌;乳腺癌;胰腺癌;肺癌;胃肠道癌,例如结肠癌;肾癌;甲状腺癌;子宫癌;肾上腺癌。19.在另一个实施方案中,本发明是根据陈述18所述的用于使用的药物组合物,其特征在于所述上皮肿瘤是前列腺癌或胰腺癌,优选外分泌胰腺癌。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1