肿瘤诊疗一体化的硼携带剂、其制备方法和用途与流程
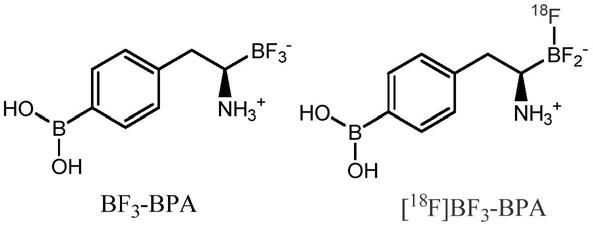
1.本发明一般涉及放射性药物及核医学领域,具体地涉及肿瘤诊疗一体化的硼携带剂,用于硼中子捕获治疗和肿瘤诊断。
背景技术:
2.硼中子俘获疗法(boron neutron capture therapy,bnct)是一种二元靶向放射精准医疗技术。先给患者施用能够在肿瘤细胞内富集的硼携带剂药物,再对病患进行热中子或者超热中子的照射。其原理是将强靶向性的含硼药物施于病患并在癌细胞中产生富集,10b对于热中子的捕获截面相对于人体组成的正常元素而言非常高,利用热中子与10b原子的俘获反应,使其产生的高能α粒子和li粒子的能量仅作用于约10μm的癌细胞内,对细胞的结构造成不可逆的损伤,使其不能修复而凋亡。使用该疗法进行恶性肿瘤治疗可在杀灭肿瘤组织同时,最大程度保留患部周围正常组织及功能,以提高患者治疗后生活质量与生存时期。4-硼酸-l-苯丙氨酸(4-l-boronophenylalanine,bpa)是fda批准的临床最常用的应用于bnct的硼携带剂药物。但是,由于bnct需要根据硼携带剂的药代动力学结果规划治疗策略,如何有效获取bpa在肿瘤及其他组织器官中的浓度则成为各项研究中的关键问题之一。
3.正电子发射断层扫描成像(positron emission tomography,pet)是一种依托于放射性分子探针的分子影像技术,其结合了分子探针和医学影像技术,能对活体内病理、生理过程在细胞及分子水平进行定性和定量研究。从11c,18f等正电子衰变的同位素中发射出来的带正电子,很快与周围广泛分布的带负电子碰撞发生湮灭,并将能量转化为两个方向相反的能量为511kev的光子。两个光子被仪器相对的两个探头同时检测到,表明两个探头连线上发生了一次湮灭。这样,pet就能够对体内放射性的分布进行准确的定位和定量。再经过计算机重建,即可获得三维的人体pet图像。pet是对活体内药物分布进行研究的最为有效的手段之一。
4.在pet成像的基础上结合治疗组件,实现肿瘤成像与治疗一体化是技术发展的方向。2-氟-4-硼酸-l-苯丙氨酸(2-fluoro-4-l-boronophenylalanine,fbpa)是苯环上2号位氟原子取代的bpa。这个氟原子可以是放射性的18f,此时该分子可以作为pet探针,以模拟bpa在体内的分布情况。以[
18
f]-fbpa为探针的pet影像技术现在已经应用于bnct的疗前诊断,帮助了解bpa在病患体内的动态分布信息(ishiwata k,et al.melanoma research,1992.pmid:1450671),然而,fbpa和bpa在分子结构上存在差异,探针剂量的fbpa不能代表治疗剂量的bpa在体内的分布情况,fbpa-pet技术并不成熟,因此发展一种全新的能够实现诊疗一体化药物分子刻不容缓。
技术实现要素:
[0005]
bnct治疗必须依赖于硼携带剂在肿瘤部位的高度富集,并根据其富集的情况,定制治疗方案,这要求对硼携带剂的体内浓度分布需要做实时监测。bpa作为目前唯一获批的
bnct药物,对其在体内的分布情况进行研究就尤为重要。其中重要方法即借助pet分子影像的方法,通过在bpa苯环上引入放射性的
18
f得到[
18
f]fbpa。通过[
18
f]fbpa模拟bpa在体内的分布,进而对bnct进行规划。但是,从化学结构上,以f原子取代苯环上的h原子,难以保证其化学性质及生物学性质与bpa仍然相同,这种差异将为bnct带来较大的不确定性。
[0006][0007]
针对现有的fbpa
--
pet不能准确有效反应bpa在体内的分布情况,精准高效实现bnct的问题,本发明提供一种新的诊疗一体硼携带剂bf
3-bpa,其可以进行便捷的放射性标记,标记前后具有相同的化学结构,可以准确反映其在体内的分布情况,以解决经典硼携带剂体内实时分布不清晰预测的问题,提供更加高效的bnct规划;并且通过分子内的两个硼原子,实现更加高效的bnct。
[0008][0009]
本发明的构思如下:硼氨酸是一类将天然氨基酸的羧基用三氟化硼取代进而发展的一类氨基酸衍生物。通过18f-19f同位素交换反应,其可以使用18f进行放射性标记构建放射性探针,进而实现pet成像。发明人在研究中发现,三氟化硼基团和羧酸根在电性上表现出高度的相似性,故而硼氨酸与其相应的天然氨基酸在生物识别、转运上亦表现出相似性。基于此,申请人发现,通过替换bpa中的羧酸根为三氟化硼基团,构建bf
3-bpa,可以在肿瘤区域有高富集。一方面,bf
3-bpa可以进行f-18标示实现体内的分子浓度分布分析;另一方面,其也可以直接作为bnct的硼携带剂,由于bf
3-bpa放射性标记前后具有完全一致的化学结构,通过[
18
f]bf
3-bpa可以准确的反映bf
3-bpa在体内的分布情况,为bnct治疗方案的实施提供重要依据。更重要的是,bf
3-bpa中具有2个硼原子,具有更强的硼元素载带能力,实现更高效的硼元素递送。
[0010]
由于本发明的分子在制备过程中产生具有两个硼酸的中间体,如果在错误地位置进行三氟硼酸化,三氟硼酸根带有的负电荷将严重影响分子的化学、药物性质,进而最终影响其疗效。在合成bf
3-bpa过程中,需要选择性地对α-氨基硼酸进行选择性三氟硼酸化,而避免产生对芳香环进行三氟化硼化。由于苯环与α-氨基的化学性质差异,在氟化过程中将优先生成芳香三氟化硼,无法获得目标的三氟硼酸化产物bf
3-bpa。在合成研究过程,申请人发现,α-氨基三氟化硼和芳香三氟化硼在水解速率上存在差异,后者较前者高102~103倍,这为合成bf
3-bpa提供可能。本发明还提供了一种新的制备bf
3-bpa的方法,包括通过在通用的三氟硼酸化条件下得到含有双三氟化硼的中间体,随后再在水解条件下进行水解将与苯环连接的三氟化硼水解,获得bf
3-bpa目标产物。
[0011]
在一方面,本发明提供了式i的化合物:
[0012][0013]
其中r基团为氢或烷基。
[0014]
在一个实施方案中,与苯环连接的硼原子是
10
b或天然硼。在一个实施方案中,-bf
3-中的至少一个氟原子是放射性标记的。
[0015]
在一个实施方案中,烷基是甲基。
[0016]
在一个实施方案中,-bf
3-中的硼原子是天然硼。
[0017]
在另一个方面,本发明提供了硼携带剂组合物,其包含一种或多种本发明的式i的化合物和药学可接受的载体。
[0018]
在一个实施方案中,硼携带剂组合物还包含果糖、十一氢巯基十二硼化二钠及其二聚体、硼化树枝状聚合物-egf生物缀合物、egfr单克隆抗体-硼酸盐缀合物、fr靶向性含硼脂质体、fr靶向性含硼纳米颗粒和硼酸盐卟啉中的一种或多种。
[0019]
在另一个方面,本发明提供了本发明的化合物的制备方法,其包括以下步骤:通过对化合物7添加khf2溶液,并且添加盐酸至ph<0,以产生含双三氟化硼的中间体然后将酸度增加至ph 1.5-4,优选ph2-2.5以得到本发明的化合物。
[0020]
在一个实施方案中,通过对化合物6添加naoh溶液至终浓度0.4-0.6m,室温搅拌20-40分钟,然后加入浓盐酸中和,以得到化合物7。
[0021]
在一个实施方案中,制备方法包括通过对化合物2添加
n-甲基亚氨基乙酸得到化合物3的步骤。
[0022]
在一个实施方案中,制备方法包括以下步骤:
[0023]
(1)将对溴苯乙醇转化成化合物2
[0024]
(2)在添加n-甲基亚氨基乙酸的情况下将化合物2转化成化合物3
[0025]
(3)将化合物3转化成化合物4
[0026]
(4)将化合物4转化成化合物5
[0027]
(5)将化合物5转化成化合物6
[0028]
(6)将化合物7转化成化合物8以及
[0029]
(7)任选地将化合物8转化成
[0030]
在又一个方面,本发明提供了本发明的化合物在制备药物中的用途,所述药物用于治疗或诊断癌症。
[0031]
在一个实施方案中,药物是用于肿瘤诊疗一体化或硼中子俘获疗法的硼携带剂。
[0032]
在一个实施方案中,癌症选自鳞状细胞癌、肺癌、腹膜癌、肝细胞癌、胃癌、黑素瘤、胰腺癌、成胶质细胞瘤、宫颈癌、卵巢癌、肝癌、膀胱癌、肝瘤、乳腺癌、结肠癌、结肠直肠癌、子宫癌、唾液腺癌、肾癌、肝癌、前列腺癌、外阴癌、甲状腺癌、肝癌、头颈癌、b细胞淋巴瘤或白血病。
[0033]
本发明的优点包括:
[0034]
(1)本发明使用了
18
f标记前后具有相同化学结构的bf
3-bpa与[
18
f]bf
3-bpa,可以用于肿瘤诊断与bnct治疗的诊疗一体化药物,通过其相同的化学结构提供可靠的药物体内分布结果。
[0035][0036]
(2)结构中具有两个b原子,具有更高的b递送效率。
[0037]
(3)本发明的方法实现单个硼的氟化。
[0038]
(4)本发明的化合物在肿瘤中具有高摄取。
[0039]
(5)本发明提供了一种新型诊疗一体化的硼携带剂bf
3-bpa,用于获取硼携带剂的动态分布,进行bnct前的治疗规划,亦可以直接用于bnct。
[0040]
(6)本发明提供了制备本发明的化合物的新方法。
附图说明
[0041]
图1:bf
3-bpa与[
18
f]bf
3-bpa的合成路线。
[0042]
图2a-b:化合物8(bf
3-bpa)的hplc-ms结果。
[0043]
图3:[
18
f]bf
3-bparadio-hplc结果。
[0044]
图4:化合物9的hplc-ms[m-h]-质谱结果。
[0045]
图5:化合物7的hplc-ms[m-h]-质谱结果。
[0046]
图6:化合物7以及副产物的高效液相色谱图。
[0047]
图7:化合物10的hplc-ms[m+h]+质谱图。
[0048]
图8:化合物11的hplc-ms[m-h]-质谱图。
[0049]
图9:[
18
f]bf
3-bpa在荷瘤小鼠上尾静脉注射的小动物pet/ct成像。
[0050]
图10:bf
3-bpa用于bnct肿瘤治疗的肿瘤生长曲线。
具体实施方式
[0051]
本发明提供了式i的化合物:
[0052][0053]
在式(i)中,r独立是氢或烷基。“烷基”是指饱和的线性烃基。例如,烷基可以是甲基、乙基、丙基、丁基、戊基等。优选地,r基团是甲基。
[0054]
在式(i)中,-bf
3-中的至少一个氟原子是放射性标记的。例如,1、2或3个氟原子是
18
f。-bf
3-中的硼原子可以是天然硼。
[0055]
在式(i)中,与苯环连接的硼原子是
10
b或天然硼。
[0056]
本发明还提供了硼携带剂组合物,其包含本发明的化合物和药学可接受的载体。硼携带剂组合物还可以包含果酸,或者可以包含其它硼携带剂,例如十一氢巯基十二硼化二钠及其二聚体、硼化树枝状聚合物-egf生物缀合物、egfr单克隆抗体-硼酸盐缀合物、fr靶向性含硼脂质体、fr靶向性含硼纳米颗粒和硼酸盐卟啉中的一种或多种。
[0057]
本发明的制备方法包括以下步骤:
[0058]
(1)将pcy3·
hbf4加入甲苯中,随后加入cuso4·
5h2o溶液和去离子水,并在室温下剧烈搅拌,随后在氮气保护下加入苄胺,形成深蓝色催化剂;加入甲苯,然后加入化合物5和b2pin2;随后,将反应体系于室温反应到反应物完全消失;加入饱和edta洗涤反应混合物,再用饱和食盐水洗涤;将有机相合并随后用无水na2so4干燥,并在真空中除去有机溶剂,得到黄色油状液体;以及
[0059]
(2)溶于乙腈中,加入naoh溶液,室温搅拌,然后加入浓盐酸进行中和反应,得到反应混合物;
[0060]
(3)向反应混合物中加入khf2溶液,再逐滴加入浓盐酸至ph<0,室温反应2小时;减压蒸发除去hcl降低酸度至ph~2,反应30min,加入乙腈共沸干燥,使用乙腈萃洗涤固体,弃去不溶物,对乙腈相纯化,得到化合物8:bf
3-bpa:
[0061][0062]
图1中显示了本发明的制备方法,包括以下步骤:
[0063]
将对溴苯乙醇(化合物1)溶解于无水四氢呋喃中,冷却至-90至-70℃(例如-78℃);逐滴加入正丁基锂/己烷溶液,溶液逐渐变黄后变为米白色糊状,保持在-90至-70℃(例如-78℃)搅拌(例如15min)。
[0064]
随后滴加硼酸三异丙酯,溶液变澄清,-90至-70℃(例如-78℃)反应(例如20min)。随后升至室温,加入盐酸,室温搅拌(例如15min)。分液,水相使用乙酸乙酯萃取,将有机相合并,饱和氯化钠洗涤,无水硫酸钠干燥,真空除去溶剂,得到白色固体化合物2。化合物无须进一步纯化,直接用于下步反应。化合物2:1h nmr(400mhz,methanol-d4)δ7.60
–
6.94(m,4h),3.75(t,j=7.1hz,2h),2.82(t,j=7.1hz,2h)。
[0065]
化合物2溶于甲苯中,加入dmso,再加入n-甲基亚氨基乙酸。回流,并安装加满甲苯的分水器,约2小时(例如1.5-3小时)后结束反应。在真空中除去有机溶剂,使用硅胶柱层析分离,得到白色晶体化合物3。化合物3:1h nmr(400mhz,methanol-d4)δ7.53
–
7.10(m,4h),4.35
–
3.96(m,4h),3.75(t,j=7.0hz,2h),3.31(s,3h),2.82(t,j=7.1hz,2h).
[0066]
将化合物3溶于无水二氯甲烷与无水四氢呋喃的混合溶剂中,加入dmp氧化剂,再加入碳酸氢钠粉末。室温反应(例如1小时)。加入饱和硫代硫酸钠溶液与饱和碳酸氢钠溶液,搅拌(例如15分钟)。过滤除去不溶物,分出有机相,水相使用乙酸乙酯萃取,将有机相合并,饱和氯化钠洗涤(例如30ml
×
2),无水硫酸钠干燥,真空除去溶剂。硅胶柱层析分离,得到白色固体化合物4。化合物4:1h nmr(400mhz,acetone-d6)δ9.74(s,1h),7.41(dd,j=100.7,7.9hz,4h),4.48
–
4.07(m,4h),2.75(s,3h)。
[0067]
将化合物4溶解于无水四氢呋喃中,加入叔丁基亚磺酰胺,滴加钛酸四乙酯,室温搅拌(例如2小时)。加入水猝灭反应并搅拌,过滤除去不溶物分出有机相,水相使用乙酸乙酯萃取(例如20ml
×
3),将有机相合并,饱和氯化钠洗涤(例如30ml
×
2),无水硫酸钠干燥,真空除去溶剂。例如用硅胶柱层析分离,得到黄色晶体化合物5(490mg,66%)。化合物5:1h nmr(400mhz,acetone-d6)δ8.07(s,1h),7.43(dd,j=83.2,7.9hz,4h),4.51
–
4.03(m,4h),3.91(d,j=5.1hz,2h),2.73(s,3h),1.12(s,9h)。
[0068]
将pcy3
·
hbf4加入甲苯中,随后加入cuso4
·
5h2o溶液和去离子水,并在室温下剧烈搅拌。随后在氮气保护下加入苄胺,立即形成深蓝色催化剂。加入甲苯,将反应体系维持在0-4℃(例如0℃),加入化合物5和b2pin2。随后,将反应体系恢复至室温,反应(例如1小时)至tlc显示反应物完全消失。加入饱和edta洗涤反应混合物,再用饱和食盐水洗涤。将有机相合并随后用无na2so4干燥,并在真空中除去有机溶剂,得到黄色油状液体化合物6。粗产品不用纯化直接用于下一步反应。
[0069]
将化合物6溶于乙腈中,加入naoh溶液,搅拌(例如室温搅拌半小时)。随后加入浓盐酸进行中和反应,得到含化合物7的反应混合物,直接用于下步反应。
[0070]
向含化合物7的反应混合物中加入khf2溶液,再逐滴加入4.7ml浓盐酸至ph<0,室温反应2小时。减压蒸发除去hcl降低酸度至ph~2,反应30min;加入乙腈共沸干燥,使用乙腈萃洗涤固体,弃去不溶物,对乙腈相纯化(例如使用pre-hplc纯化),得到bf
3-bpa(化合物8)。hplc-ms结果如图2b。
[0071]
将bf
3-bpa(化合物8)溶解于dmf中,再加入哒嗪-hcl缓冲液,随后加入水18f-水溶液。反应混合物,例如在85℃反应15min,随后用生理盐水猝灭反应,并除去游离的氟离子(例如使用用sep-pak alumina light cartridge)得到最终产物[
18
f]bf
3-bpa。radio-hplc结果如图3。
[0072]
本发明提供了硼携带剂组合物在制备药物中的用途,所述药物用于治疗或诊断癌症。药物可以是用于肿瘤诊疗一体化或硼中子俘获疗法的硼携带剂。
[0073]
术语“癌症”和“癌性”指或描述哺乳动物中特征通常为细胞生长不受调节的生理学状况。癌症的例子包括但不限于癌瘤、淋巴瘤、母细胞瘤、肉瘤、和白血病。此类癌症的更具体例子包括鳞状细胞癌、肺癌(包括小细胞肺癌、非小细胞肺癌、肺腺癌、和肺鳞癌)、腹膜癌、肝细胞癌、胃癌(包括胃肠癌)、黑素瘤、胰腺癌、成胶质细胞瘤、宫颈癌、卵巢癌、肝癌、膀胱癌、肝瘤、乳腺癌、结肠癌、结肠直肠癌、子宫内膜或子宫癌、唾液腺癌、肾癌、肝癌、前列腺癌、外阴癌、甲状腺癌、肝癌和各种类型的头颈癌,及b细胞淋巴瘤(包括低级/滤泡非何杰金氏淋巴瘤(nhl);小淋巴细胞(sl)nhl;中级/滤泡nhl;中级弥漫性nhl;高级成免疫细胞nhl;高级成淋巴细胞nhl;高级小无核裂细胞nhl;贮积病nhl;套细胞淋巴瘤;aids相关淋巴瘤;和瓦尔登斯特伦氏巨球蛋白血症);慢性淋巴细胞性白血病(cll);急性成淋巴细胞性白血病(all);毛细胞白血病;慢性成髓细胞性白血病;和移植后淋巴增殖性病症(ptld)、以及与瘢痣病、水肿(诸如与脑瘤有关的)和梅格斯氏(meigs)综合征有关的异常血管增殖。
[0074]
提供以下示例性的实施方案以进一步说明本发明。应当理解这些实施例仅仅是示例性的而非限制性的,本发明仅由所附权利要求书限定。
[0075]
实施例
[0076]
实施例1:本发明的化合物的制备方法
[0077]
如图1所示,化合物2至化合物8由可商业购买的对溴苯乙醇(化合物1)作为起始化合物合成。
[0078]
将对溴苯乙醇(5mmol,0.7ml,化合物1)溶解于50ml无水四氢呋喃中,冷却至-78℃。逐滴加入正丁基锂/己烷溶液(12mmol,2.4eq),溶液逐渐变黄后变为米白色糊状,保持在-78℃搅拌15min。随后滴加硼酸三异丙酯(15mol,3.5ml,3eq.),溶液变澄清,-78℃反应20min。随后升至室温,加入50ml10%盐酸,室温搅拌15min。分液,水相使用乙酸乙酯萃取(20ml x 3),将有机相合并,饱和氯化钠洗涤(30ml x 2),无水硫酸钠干燥,真空除去溶剂,得到白色固体化合物2(0.66g,80%)。化合物无须进一步纯化,直接用于下步反应。化合物2:1h nmr(400mhz,methanol-d4)δ7.60
–
6.94(m,4h),3.75(t,j=7.1hz,2h),2.82(t,j=7.1hz,2h)。
[0079]
化合物2(0.66g,4mmol)溶于16ml甲苯中,加入1.6ml dmso,再加入n-甲基亚氨基乙酸(647mg,4.4mmol,1.1eq.)。回流,并安装加满甲苯的分水器,约2小时后结束反应。在真空中除去有机溶剂,使用硅胶柱层析分离,得到白色晶体化合物3(650mg,59%)。化合物3:1h nmr(400mhz,methanol-d4)δ7.53
–
7.10(m,4h),4.35
–
3.96(m,4h),3.75(t,j=7.0hz,2h),3.31(s,3h),2.82(t,j=7.1hz,2h)。
[0080]
将化合物3(1.1g,4mmol)溶于40ml无水二氯甲烷与40ml无水四氢呋喃的混合溶剂中,加入dmp氧化剂(1.7g,4mmol,1eq.),再加入碳酸氢钠粉末(3.36g,40mmol,10eq.)。室温反应1小时。加入40ml饱和硫代硫酸钠溶液与40ml饱和碳酸氢钠溶液,搅拌15分钟。过滤除去不溶物,分出有机相,水相使用乙酸乙酯萃取(20ml x 3),将有机相合并,饱和氯化钠洗涤(30ml x2),无水硫酸钠干燥,真空除去溶剂。硅胶柱层析分离,得到白色固体化合物4(541mg,49%)。化合物4:1h nmr(400mhz,acetone-d6)δ9.74(s,1h),7.41(dd,j=100.7,7.9hz,4h),4.48
–
4.07(m,4h),2.75(s,3h)。
[0081]
将化合物4(541mg,1.97mmol)溶解于20ml无水四氢呋喃中,加入叔丁基亚磺酰胺(477mg,3.94mmol,2eq.),滴加钛酸四乙酯(3.94mmol,840μl,2eq.),室温搅拌2小时。加入
20ml水猝灭反应并搅拌10min,过滤除去不溶物分出有机相,水相使用乙酸乙酯萃取(20ml x 3),将有机相合并,饱和氯化钠洗涤(30ml x 2),无水硫酸钠干燥,真空除去溶剂。硅胶柱层析分离,得到黄色晶体化合物5(490mg,66%)。化合物5:1h nmr(400mhz,acetone-d6)δ8.07(s,1h),7.43(dd,j=83.2,7.9hz,4h),4.51
–
4.03(m,4h),3.91(d,j=5.1hz,2h),2.73(s,3h),1.12(s,9h)。
[0082]
将pcy3·
hbf4(124mg,6mol%)加入10ml甲苯中,随后加入cuso4·
5h2o溶液(82mg,6mol%)和去离子水(6ml),并在室温下剧烈搅拌10min。随后在氮气保护下加入苄胺(153μl,0.25eq.),立即形成深蓝色催化剂。加入额外的50ml甲苯,将反应体系维持在0℃,加入化合物5(2.2g,5.7mmol)和b2pin2(2.8g,2.0eq.)。随后,将反应体系恢复至室温,反应1小时至tlc显示反应物完全消失。加入饱和edta(2x 50ml)洗涤反应混合物,再用饱和食盐水(50ml)洗涤。将有机相合并随后用无na2so4干燥,并在真空中除去有机溶剂,得到黄色油状液体化合物6(3.0g)。粗产品不用纯化直接用于下一步反应。
[0083]
将化合物6(3.0g,5.7mmol)溶于50ml乙腈中,加入57ml 1m naoh溶液,室温搅拌半小时。随后加入4.7ml浓盐酸中和反应,得到含化合物7的反应混合物,直接用于下步反应。
[0084]
向含化合物7的反应混合物中加入14.25ml 3m的khf2溶液(10eq.),再逐滴加入4.7ml浓盐酸至ph<0,室温反应2小时。在30℃减压蒸发除去hcl降低酸度至ph~2,反应30min。加入乙腈共沸干燥,使用乙腈洗涤固体,弃去不溶物,乙腈相使用pre-hplc纯化(a相:乙腈,b相:水/0.1%tfa;0-2min:5%a,2-11min:5%a-50%a,其余为b),得到bf
3-bpa(化合物8)。hplc-ms结果如图2b。
[0085]
讨论
[0086]
本化合物的制备难点在于选择性地进行保护基的脱除与硼酸的氟化。本方法首次使用n-甲基亚氨基乙酸(mida)这一保护基,获得了bf3-bpa的前体化合物6,其氨基由叔丁基亚磺酰亚胺保护,α-氨基硼酸由硼酸频哪醇酯保护,苯硼酸由mida保护。
[0087][0088]
发明人使用一步氟解法尝试使用3m khf2(10eq.)/hcl(ph<0,室温2小时)与化合物6反应以直接获得目标产物bf3-bpa。该方法最终得到苯硼酸由mida保护的三氟化硼氨基酸化合物化合物9。图4显示了化合物9的[m-h]-质谱结果。
[0089]
苯硼酸mida需要在稀naoh溶液中水解脱除,因此使用naoh水溶液水解化合物7,可以得到氨基被保护的双硼酸化合物10(图7)。图5显示了化合物7
的[m+h]+质谱结果。但是,氢氧化钠水解的时间不可过长且浓度不可过高(naoh溶液至终浓度0.4-0.6m,室温搅拌30分钟),否则会导致苯硼酸氧化为苯酚及其他不可预知的副产物。如图6的高效液相色谱(a相:乙腈,b相:水/0.1%tfa;0-2min:5%a,2-15min:5%a-100%a,其余为b)图中所示,可见苯硼酸被部分氧化为苯酚结构。
[0090]
在得到氨基被保护的双硼酸化合物后,通过浓盐酸中和前步用于水解的naoh,再使用khf2/hcl进行氟化同时脱除氨基保护基。需要注意的是,尽管经典的α-氨基三氟化硼的制备使用ph~2的khf2/hcl溶液,但是在本实施例中,由于苯硼酸的存在,ph>0时,无法获得三氟化硼化合物,两个硼均以硼酸形式存在为了得到目标化合物,必须在khf2/hcl ph<0条件下,可以得到双三氟化硼结构(化合物11,图8)。在得到双三氟化硼结构基础上,减压蒸发的方法降低酸度至ph~2,最终可以得到目标产物bf3-bpa,表明α-氨基三氟化硼和芳香三氟化硼在此条件下的水解速率上存在差异,可以用于制备目标产物bf3-bpa。如图2a-b中所示,本发明的方法制备获得目标产物bf3-bpa(hplc方法,a相:乙腈,b相:水/0.1%tfa;20%a,余为b)。
[0091]
实施例2:放射化学标记
[0092]
将bf
3-bpa(化合物8,250nmol)溶解与5μl dmf中,再加入5μl哒嗪-hcl缓冲液(1.0m,ph~2.0),随后加入水
18
f-水溶液(30μl,370mbq)。反应混合物在85℃反应15min,随后用0.5ml生理盐水猝灭反应,并用sep-pakalumina light cartridge除去游离的氟离子得到最终产物[
18
f]bf
3-bpa(~55mbq,rcy 15%)。radio-hplc结果如图3(hplc方法,a相:乙腈,b相:水/0.1%tfa;20%a,余为b)。
[0093]
实施例3:pet小动物成像
[0094]
肿瘤模型动物的建立:将肿瘤细胞(bgc823人源胃癌细胞和b16-f10小鼠黑色素瘤)于5%co2培养箱中培育至适当规模。小鼠选取4-6周龄小鼠,右肩剃毛,将约106肿瘤细胞悬浮于50μl pbs中,注射于小鼠右肩上。在无菌环境中饲养1-2周,待肿瘤体积至特定体积,肿瘤模型建立完成。
[0095]
将标记的化合物[
18
f]bf
3-bpa取200μci溶于0.15ml生理盐水中,通过尾静脉注射进入肩部种植有肿瘤的小鼠体内,并在注射后1小时进行15分钟的pet/ct采集并作图像重建,结果如图9所示。可见[
18
f]bf
3-bpa在肿瘤部位有高富集,并在成像上体现出清晰的对比度,可见其可以用于肿瘤诊断并取得良好效果。
[0096]
实施例4:硼中子捕获治疗实验
[0097]
将含有天然硼的bpa、bf
3-bpa和bf3-phe以500mg/kg剂量溶解于生理盐水中,并通过尾静脉注射至上述肩部种植肿瘤的小鼠体内,在1h时进行bnct处理,在后续21天测量肿瘤大小,并与注射bpa、bf3-phe及单纯进行中子束照射的组别作对比。
[0098]
如图10所示,可以看出使用bf
3-bpa联合中子束进行bnct可以取得出色的肿瘤抑制效果,是出色的bnct药物。在bnct对比试验中,对比了经典bnct药物bpa、基于三氟化硼策略发展的含硼氨基酸bf3-phe与
本技术:
的bf
3-bpa在相同条件下进行bnct试验的效果。由此
可见,bf
3-bpa由于分子结构中含有两个硼原子,相比于分子结构中只有一个硼原子的bpa、bf3-phe,bf
3-bpa在相同试验条件下具有更高的硼递送效率,可以有效地提高bnct疗效。这对缩短治疗周期、减少药物用量、降低辐照剂量与患者费用支出,减少并发症与副作用具有重要意义。
[0099]
虽然参考其具体的实施方案描述了本发明,但本领域技术人员应了解可以进行多种改变,可以替换等同内容而不偏离本发明的精神和范围。另外,可进行许多修改以使具体的情况、材料、组合物、方法、一个或多个方法步骤适应本发明的目的、精神和范围。所有这类修改意在随附权利要求书的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1