一种AHL信号分子的制备方法及其用途与流程
本发明属于环境保护技术领域,具体涉及一种ahl信号分子的制备方法及其用途。
背景技术:
二氯甲烷(dcm)是一种重要的有机溶剂和中间产品,在很多工业中应用广泛。然而,其沸点较低,容易挥发进入大气环境中,造成大气污染。dcm在脂类中的溶解度较大,被人或动物吸入,容易在生物体的脂肪组织中积累,且往往具有致癌、致畸、致突变的三致作用,是美国环境保护署129种优先控制的有毒污染物之一。因此对dcm的有效去除具有重要的社会和环境意义。
经过多年努力,多位研究者已经从环境介质中分离出以dcm作为唯一碳源和能源的细菌纯菌株,我们实验室也在2010年分离纯化得到了一株二氯甲烷降解菌罗得西亚甲基杆菌(methylobacteriumrhodesianum)h13,并保藏于中国典型培养物保藏中心。在后续的应用中,接种m.rhodesianumh13菌株的生物滴滤塔实现了80-99%的二氯甲烷去除效率,但是挂膜期长达30天。这说明如何对填料上的生物膜实现有效的调控,已成为了强化滴滤塔去除二氯甲烷的关键手段之一。生物填料是生物滴滤塔的核心部分,塔内填料上的生物膜能有效降解有机污染物,因此填料挂膜是生物净化工艺的关键步骤。目前生物滴滤工艺挂膜时间普遍偏长,生物膜的形成受多重因素影响,包括运行条件、营养成分、微生物种类及填料性质等。最近几年越来越多的研究表明,群体感应qs(quorumsensing)跟细菌生物膜形成有紧密的相关性,群体感应ahl信号分子在其中起到了关键作用。
现有技术如授权公告号为cn101993839b的中国发明专利,公开了提供了一株能高效降解dcm的菌株——罗得西亚甲基杆菌(methylobacteriumrhodesianum)h13,保藏于中国典型培养物保藏中心,地址:中国,武汉,武汉大学,430072,保藏日期:2010年5月20日,保藏编号:cctccno:m2010121。该菌株为好氧革兰氏阴性杆菌,能够以dcm为唯一碳源与能源生长同时高效降解该底物,为生物法高效净化含dcm废水及废气的工程应用奠定了基础。
技术实现要素:
本发明的目的在于提供一种methylobacteriumrhodesianumh13自身产生的ahl信号分子—n-3-氧代辛酰高丝氨酸内酯(3oc8-hsl)的制备方法及其在强化微生物降解二氯甲烷中的应用,通过优化制备方法来提高3oc8-hsl产量,并通过控制3oc8-hsl的量来调控填料上的生物膜,从而缩短工艺的挂膜启动期,强化二氯甲烷的去除。
本发明为实现上述目的所采取的技术方案为:
提供一种群体感应ahl信号分子,中文名为n-3-氧代辛酰高丝氨酸内酯,化学式为3oc8-hsl,上述群体感应ahl信号分子产自二氯甲烷降解菌。
优选地,上述二氯甲烷降解菌为罗得西亚甲基杆菌(methylobacteriumrhodesianum)h13。
提供一种群体感应ahl信号分子的制备方法,包括以下步骤:
a、斜面培养:将methylobacteriumrhodesianumh13接种于斜面lb固体培养基,30℃培养24~36h,获得斜面菌体;
b、扩大培养:用接种环挑取步骤a获得的斜面菌体接种至lb液体培养基中,30℃,培养24~36h,获得od600=0.6-0.8的菌液;
c、取步骤b中的菌液,1000rpm离心15min取上清液过滤,滤液用乙酸乙酯等体积萃取三次,合并萃取液,氮吹挥发溶剂浓缩,提取液保存于-80℃备用;
步骤a中lb固体培养基终浓度组成为:nacl10g/l、胰蛋白胨10g/l、酵母粉5g/l,琼脂18~20g/l,溶剂为去离子水,ph值自然;
步骤b中lb液体培养基终浓度组成为:nacl10g/l、胰蛋白胨10g/l、酵母粉5g/l,溶剂为去离子水,ph值自然。
优选地,od600=0.7。
提供一种群体感应ahl信号分子在在强化微生物降解二氯甲烷中的用途。
提供一种强化微生物降解二氯甲烷的方法,包括:以二氯甲烷为底物,methylobacteriumrhodesianumh13为降解菌,无机盐培养基为介质,外加3oc8-hsl,在ph=5.5~10、转速为160rpm、温度为10℃~40℃条件下降解二氯甲烷。
更为优选地,上述ph=6.5~7.5、温度为20℃~35℃。
优选地,上述二氯甲烷的初始浓度为50-1000mg/l,3oc8-hsl外源添加量为0-2400nm。
更为优选地,上述二氯甲烷的初始浓度为300-500mg/l。
更为优选地,上述3oc8-hsl外源添加量为800-1600nm。
优选地,上述3oc8-hsl的制备方法为:以methylobacteriumrhodesianumh13作为菌种制备ahl信号分子生产源,从所述ahl信号分子生产源中提取3oc8-hsl;上述ahl信号分子生产源为以无机盐培养基作为培养基质的od600为0.6-0.8的m.rhodesianumh13的菌液。
更为优选地,上述ahl信号分子生产源为以无机盐培养基作为培养基质的1lod600为0.7的methylobacteriumrhodesianumh13的菌液。
优选地,上述二氯甲烷的形态为气态。
更为优选地,二氯甲烷气体的浓度为500mg/m3。
优选地,上述ahl信号分子生产源的制备方法具体包括:
斜面培养:将methylobacteriumrhodesianumh13接种于斜面lb固体培养基,30℃培养24~36h,获得斜面菌体;
扩大培养:用接种环挑取步骤1)获得的斜面菌体接种至lb液体培养基中,30℃,培养24~36h,获得od600=0.6-0.8的菌液;
上述lb固体培养基终浓度组成为:nacl10g/l、胰蛋白胨10g/l、酵母粉5g/l,琼脂18~20g/l,溶剂为去离子水,ph值自然;
上述lb液体培养基终浓度组成为:nacl10g/l、胰蛋白胨10g/l、酵母粉5g/l,溶剂为去离子水,ph值自然。
优选地,od600=0.7。
本发明的有益效果为:
本发明提供了一种methylobacteriumrhodesianumh13自身产生的ahl信号分子(3oc8-hsl),通过外源添加3oc8-hsl,能够促进methylobacteriumrhodesianumh13生长,有利于生物填料快速挂载生物膜,强化二氯甲烷的生物降解,为生物法净化含二氯甲烷废水及废气的工程应用提供了新的技术选择。
附图说明
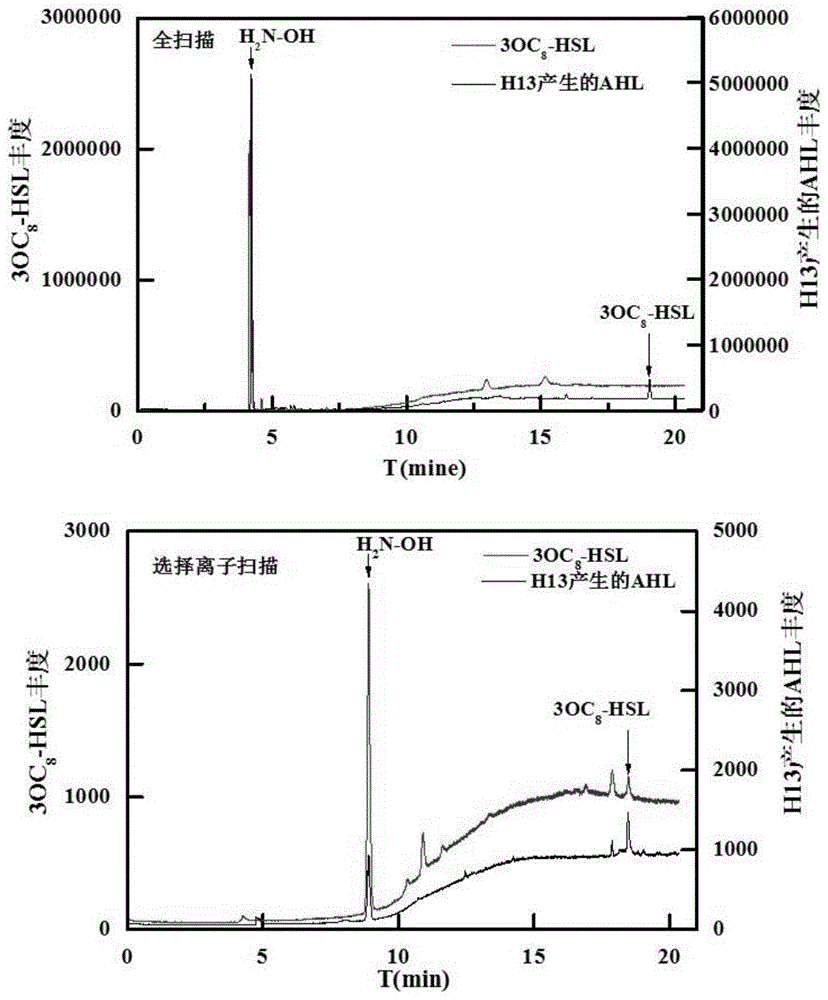
图1为本发明实施例1中ahl信号分子检测结果图;
图2为本发明实施例2中不同3oc8-hsl外源添加量对methylobacteriumrhodesianumh13的二氯甲烷降解(a)、生长(b)、矿化(c)的影响柱形图;
图3为本发明试验例1中sam浓度的测定结果;
图4为本发明试验例1中3oc8-hsl含量的测定结果;
图5为本发明试验例2中多糖和蛋白质含量的测定结果;
图6为本发明试验例2中生物膜生物量的测定结果;
图7为本发明试验例2中单位质量生物膜脱氢酶活性的测定结果;
图8为本发明试验例3中二氯甲烷废气去除率的测定结果。
具体实施方式
除非另外说明,本文所提及的所有出版物、专利申请、专利和其他参考文献都以整体援引的方式并入本文中,如同将其全文进行阐述。
除非另外定义,本文所使用的所有技术和科学术语具有本发明所属领域普通技术人员通常所理解的相同含义。在相抵触的情况下,则以本说明书中的定义为准。
当以范围、优选范围或一系列上限优选值和下限优选值给出数量、浓度或其他数值或参数时,应理解其具体公开了由任何较大的范围限制或优选值和任何较小的范围限制或优选值的任何一对数值所形成的所有范围,而无论这些范围是否分别被公开。例如,当描述“1至5”的范围时,所描述的范围应解释为包括“1至4”、“1至3”、“1至2”、“1至2和4至5”、“1至3和5”等范围。除非另有说明,在本文描述数值范围之处,所述的范围意图包括范围端值和范围内的所有整数和分数。
另外,在本发明的要素或组分之前的词语“一”和“一种”意图表示对于该要素或组分的出现(即发生)次数没有限制性。因此,“一”或“一种”应理解为包括一种或至少一种,除非明确表示数量为单数,否则单数形式的所述要素或组分也包括复数的情况。
本发明的实施方式,包括在发明内容部分中所述本发明的实施方式以及本文下述的任何其他的实施方式,均可任意地进行组合。
以下详述本发明。
本发明为实现上述目的所采取的技术方案为:
提供一种群体感应ahl信号分子,中文名为n-3-氧代辛酰高丝氨酸内酯,化学式为3oc8-hsl,上述群体感应ahl信号分子产自二氯甲烷降解菌。
优选地,上述二氯甲烷降解菌为罗得西亚甲基杆菌(methylobacteriumrhodesianum)h13。
提供一种群体感应ahl信号分子的制备方法,包括以下步骤:
a、斜面培养:将methylobacteriumrhodesianumh13接种于斜面lb固体培养基,30℃培养24~36h,获得斜面菌体;
b、扩大培养:用接种环挑取步骤a获得的斜面菌体接种至lb液体培养基中,30℃,培养24~36h,获得od600=0.6-0.8的菌液;
c、取步骤b中的菌液,1000rpm离心15min取上清液过滤,滤液用乙酸乙酯等体积萃取三次,合并萃取液,氮吹挥发溶剂浓缩,提取液保存于-80℃备用;
步骤a中lb固体培养基终浓度组成为:nacl10g/l、胰蛋白胨10g/l、酵母粉5g/l,琼脂18~20g/l,溶剂为去离子水,ph值自然;
步骤b中lb液体培养基终浓度组成为:nacl10g/l、胰蛋白胨10g/l、酵母粉5g/l,溶剂为去离子水,ph值自然。
优选地,上述步骤b的lb液体培养基中外加0.024-0.036g/l4-羟基-3-甲氧基苄醇。革兰氏阴性菌(g-)的信号分子ahl在胞内有关酶的作用下进行化学合成需要作为底物的酰基供体(acyl-acp)和腺苷甲硫氨酸(sam)提供高丝氨酸内酯。4-羟基-3-甲氧基苄醇能够促进methylobacteriumrhodesianumh13合成sam,促进sam与酰基供体发生反应合成高丝氨酸内酯,促进3oc8-hsl的合成,使得3oc8-hsl的制备方法具有低成本、高产量的优点。
优选地,od600=0.7。
提供一种群体感应ahl信号分子在在强化微生物降解二氯甲烷中的用途。
提供一种强化微生物降解二氯甲烷的方法,包括:以二氯甲烷为底物,methylobacteriumrhodesianumh13为降解菌,无机盐培养基为介质,外加3oc8-hsl,在ph=5.5~10、转速为160rpm、温度为10℃~40℃条件下降解二氯甲烷。
优选地,上述无机盐培养基中还外加(e)-4-异硫氰酸基-1-(甲基亚磺酰基)-1-丁烯,3oc8-hsl与(e)-4-异硫氰酸基-1-(甲基亚磺酰基)-1-丁烯的摩尔比为4.2-5.3:1。随着生物量的增加,细菌分泌的eps量发生相应改变,当eps量积累到一定浓度时,悬着态的微生物会向附着态转变。最初细菌固定到载体表面是靠胶联作用,随着细菌的生长,不同种群和同一种群之间的细菌主要靠分泌eps进行连接。因此eps的产生是生物膜的特性之一,研究eps在生物膜形成中的作用至关重要。3oc8-hsl与(e)-4-异硫氰酸基-1-(甲基亚磺酰基)-1-丁烯的摩尔比为4.2-5.3:1时,(e)-4-异硫氰酸基-1-(甲基亚磺酰基)-1-丁烯与3oc8-hsl发生协同作用,能够促进细胞分泌eps,提高细菌之间的连接作用,有利于生物膜的形成,使得生物膜量增加,能够降低挂膜启动时间,同时能够提高methylobacteriumrhodesianumh13细胞的代谢活性,从而进一步强化对二氯甲烷的降解能力。
更为优选地,上述ph=6.5~7.5、温度为20℃~35℃。
优选地,上述二氯甲烷的初始浓度为50-1000mg/l,3oc8-hsl外源添加量为0-2400nm。
更为优选地,上述二氯甲烷的初始浓度为300-500mg/l。
更为优选地,上述3oc8-hsl外源添加量为800-1600nm。
优选地,上述3oc8-hsl的制备方法为:以methylobacteriumrhodesianumh13作为菌种制备ahl信号分子生产源,从所述ahl信号分子生产源中提取3oc8-hsl;上述ahl信号分子生产源为以无机盐培养基作为培养基质的od600为0.6-0.8的methylobacteriumrhodesianumh13的菌液。
更为优选地,上述ahl信号分子生产源为以无机盐培养基作为培养基质的1lod600为0.7的methylobacteriumrhodesianumh13的菌液。
优选地,上述二氯甲烷的形态为气态。
更为优选地,二氯甲烷气体的浓度为500mg/m3。
优选地,上述ahl信号分子生产源的制备方法具体包括:
斜面培养:将methylobacteriumrhodesianumh13接种于斜面lb固体培养基,30℃培养24~36h,获得斜面菌体;
扩大培养:用接种环挑取步骤1)获得的斜面菌体接种至lb液体培养基中,30℃,培养24~36h,获得od600=0.6-0.8的菌液;
上述lb固体培养基终浓度组成为:nacl10g/l、胰蛋白胨10g/l、酵母粉5g/l,琼脂18~20g/l,溶剂为去离子水,ph值自然;
上述lb液体培养基终浓度组成为:nacl10g/l、胰蛋白胨10g/l、酵母粉5g/l,溶剂为去离子水,ph值自然。
优选地,od600=0.7。
以下结合实施例对本发明作进一步详细描述:
实施例中所用无机盐培养基组成为:na2hpo4·12h2o4.5g/l、kh2po41.0g/l、(nh4)2so42.5g/l、mgso4·7h2o0.2g/l、无水cacl20.023g/l,微量元素母液1ml/l,ph7.0,溶剂为去离子水;所述微量元素母液浓度组成:feso4·7h2o1.0g/l、cuso4·5h2o0.02g/l、h3bo30.014g/l、mnso4·4h2o0.10g/l、znso4·7h2o0.10g/l、na2moo4·2h2o0.02g/l、cocl2·6h2o0.02g/l,溶剂为去离子水。
所用lb固体培养基组成为:nacl10g/l、胰蛋白胨10g/l、酵母粉5g/l,琼脂18g/l,溶剂为去离子水,ph值自然。
所用lb液体培养基组成为:nacl10g/l、胰蛋白胨10g/l、酵母粉5g/l,溶剂为去离子水,ph值自然。
本发明所述室温是指26℃。
实施例1:
一种群体感应ahl信号分子的制备方法,包括以下步骤:
a、斜面培养:将methylobacteriumrhodesianumh13(m.rhodesianumh13)接种于斜面lb固体培养基,30℃培养30h,获得斜面菌体;
b、扩大培养:用接种环挑取步骤a获得的斜面菌体接种到1l液体lb培养基,在30℃、160r/min条件下摇床培养30h,获得od600=0.7的菌液;
c、ahl信号分子的萃取、浓缩:取步骤b中的菌液,1000rpm离心15min取上清液过滤,滤液用乙酸乙酯等体积萃取三次,合并萃取液,氮吹挥发溶剂浓缩至10ml,ahl信号分子含量为20mg/l,提取液保存于-80℃备用。
ahl信号分子的鉴定:采用气质联用仪(gc-ms)定性分析ahl信号分子。气相系统为hp6890gc,配备一根hp-5ms毛细管柱(30m*0.25mmid*0.25um),载气为氦气(99.999%),载气流速0.8ml/min,进样口温度200℃,分流比150:1,辅助通道温度280℃。质谱条件:离子源(70ev,500ua,msquad150℃,mssource230℃)。全扫描模式:m/z=15-800,选择离子扫描模式:m/z=143。ahl信号分子检测结果见图1,两种扫描模式下都测得了不同ahls信号分子检测中都会出现的物质h2n-oh,说明存在ahl信号分子,并在18min左右测得ahl信号分子3oc8-hsl。
实施例2:
一种强化微生物降解二氯甲烷的方法,包括以下步骤:
斜面培养:将m.rhodesianumh13接种于斜面lb固体培养基,30℃培养30h,获得斜面菌体;
扩大培养:用接种环挑取步骤获得的斜面菌体接种到1l液体lb培养基,在30℃、160r/min条件下摇床培养30h,获得od600=0.7的菌液;
用1mol/lnaoh水溶液或1mol/lh2so4水溶液调节无机盐培养基ph值为7.0,在二氯甲烷浓度为400mg/l的条件下接入制备的菌液,使各平行样中的初始菌体浓度以od600计为0.02,外源添加不同含量的3oc8-hsl(0、400、800、1200、1600、2000、2400nm)。将样品于30℃、160r/min恒温摇床里振荡培养,培养18h后取样,测反应液中二氯甲烷降解率、菌液od600值和co2值,实验过程中,设计3个平行样和一个不接菌株的空白对照组。不同3oc8-hsl外源添加量对m.rhodesianumh13的二氯甲烷降解(a)、生长(b)、矿化(c)的影响柱形图见图2。
由图2可以看出,在3oc8-hsl含量800~2400nm范围内,m.rhodesianumh13对二氯甲烷均有较高的降解率;尤其是3oc8-hsl含量=1600nm时,m.rhodesianumh13对二氯甲烷降解率达到最佳(99%以上)。同时m.rhodesianumh13的生长量和产生的co2值也有与二氯甲烷降解率一致的趋势。
实施例3:
一种群体感应ahl信号分子的制备方法,包括以下步骤:
a、斜面培养:将m.rhodesianumh13接种于斜面lb固体培养基,30℃培养30h,获得斜面菌体;
b、扩大培养:用接种环挑取步骤a获得的斜面菌体接种到1l液体lb培养基,液体lb培养基中添加0.03g/l4-羟基-3-甲氧基苄醇。在30℃、160r/min条件下摇床培养30h,获得od600=0.7的菌液;
c、取步骤b中的菌液,1000rpm离心15min取上清液过滤,滤液用乙酸乙酯等体积萃取三次,合并萃取液,氮吹挥发溶剂浓缩至10ml,ahl信号分子含量为20mg/l,提取液保存于-80℃备用。
实施例4:
模拟外源添加3oc8-hsl的生物滴滤塔处理二氯甲烷废气:
将实施例2方法培养制备的od600=0.7的m.rhodesianumh13菌液接种至两个相同的生物滴滤塔中(参见张定丰,房俊逸,叶杰旭等.生物滴滤塔净化多组分废气的研究[j].环境科学,2013.),滴滤塔参数如下:
接种量为3l,营养液喷淋量控制在11l·h-1,营养液每隔2d更换一次,采用0.5mol/l的naoh水溶液调节以维持其ph在7.0左右,温度为30℃,采用拉西环作为填料。挂膜启动过程中停留时间为35s,二氯甲烷进气浓度为500mg/m3。滴滤塔外源添加1600nm3oc8-hsl。
实施例5:
滴滤塔外源添加1600nm3oc8-hsl和320nm(e)-4-异硫氰酸基-1-(甲基亚磺酰基)-1-丁烯,其余部分和实施例4完全一致。
实施例6:
滴滤塔外源添加1600nm3oc8-hsl和390nm(e)-4-异硫氰酸基-1-(甲基亚磺酰基)-1-丁烯,其余部分和实施例4完全一致。
实施例7:
滴滤塔外源添加1600nm3oc8-hsl和300nm(e)-4-异硫氰酸基-1-(甲基亚磺酰基)-1-丁烯,其余部分和实施例4完全一致。
试验例1:
1.sam浓度的测定:分别取实施例1、实施例3中扩大培养8h、12h、20h、30h的菌液,12000rpm离心5min取菌体沉淀,测定葡萄糖浓度离心获得的发酵菌体用1ml的1.5m高氯酸混匀在4℃进行sam抽提4h以上。sam浓度通过hplc进行测定。色谱柱:thermobiobasicscxcolumn(4.6mm×250mm,5μm)(thermofisherscientific,waltham,ma);流动相:0.1m甲酸铵(甲酸调ph4.0),流速为1ml·min-1;柱温:25℃;检测波长:254nm。以5.0、10.0、20.0、40.0、60.0、120.0、240.0mg/l的sam标准系列溶液,按照上述色谱条件进行测定,以峰面积y对浓度x作标准曲线,其回归方程为:y=44090.957x+566.456,r2=0.998。样品中的sam浓度通过已知浓度sam样品标准曲线计算获得。sam浓度的测定结果见图3。
2.ahl信号分子的定量检测:分别取1l实施例1、实施例3中扩大培养8h、12h、20h、30h的菌液,1000rpm离心15min取上清液过滤,滤液用乙酸乙酯等体积萃取三次,合并萃取液,氮吹挥发溶剂浓缩至10ml。采用气质联用仪(gc-ms)定量分析ahl信号分子。气相系统为hp6890gc,配备一根hp-5ms毛细管柱(30m*0.25mmid*0.25um),载气为氦气(99.999%),载气流速0.8ml/min,进样口温度200℃,分流比150:1,辅助通道温度280℃。质谱条件:离子源(70ev,500ua,msquad150℃,mssource230℃)。选择离子扫描模式:m/z=143。以3.0、5.0、10.0、20.0、30.0、50.0mg/l的3oc8-hsl标准系列溶液,按照上述gc-ms条件进行测定,以峰面积y对浓度x作标准曲线,其回归方程为:y=6515.126x+1944.118,r2=0.997。样品中的ahl信号分子—3oc8-hsl的浓度通过已知浓度3oc8-hsl样品标准曲线计算获得。3oc8-hsl含量的测定结果见图4。
由图3可以看出,实施例3培养的菌液中sam浓度明显高于实施例1;由图4可以看出,从实施例3培养的菌液萃取浓缩得到的3oc8-hsl含量明显高于实施例1,这说明,4-羟基-3-甲氧基苄醇能够促进methylobacteriumrhodesianumh13合成sam,促进sam与酰基供体发生反应合成高丝氨酸内酯,促进3oc8-hsl的合成,使得3oc8-hsl的制备方法具有低成本、高产量的优点。
试验例2:
1.eps含量的测定:本研究以多糖和蛋白质代表eps的含量。
1.1eps的提取:1)分别把实施例4、5、6、7中的生物膜从填料上分离下来,放入烧杯中,向烧杯中加水,将ph调节至中性,搅拌均匀,得到悬浮样品。
1.2蛋白质的检测:取1ml悬浮样品,采用二喹啉甲酸法(bicinchoninicacidassay,bca)测定蛋白质,选用sk3501bca改良型试剂盒(上海生工,中国)。此方法选用牛血清蛋白为标准物,具体步骤参照试剂盒说明书。
1.3多糖的检测:多糖测定方法为苯酚-浓硫酸法,以葡萄糖为标准物,具体步骤如下:1)加入少许铝片到苯酚中,进行重蒸馏处理去除苯酚中的杂质。将处理好的苯酚配置成80%v/v的储存液放在4℃冰箱中避光保存备用。临用前将储存液稀释成6%v/v的苯酚工作液(每次测定均需现配)。2)称取干燥恒重的葡萄糖10mg,用蒸馏水准确定容至100ml得到100μg/l的葡萄糖标准液。3)标准葡萄糖曲线绘制:分别吸取葡萄糖标准液0、0.1、0.2、0.3、0.4、0.5、0.8、1.0ml于试管中,各以蒸馏水补至2ml,然后加入6%苯酚1ml及浓硫酸5ml,沸水浴放置15min后室温冷却放置20min。在波长490nm处测吸光度,以多糖浓度为横坐标,吸光度为纵坐标绘制标准曲线,标准曲线的回归方程为y=9.2937x-0.0039,r2=0.997。4)取1ml样品,加入1ml6%的苯酚溶液,然后缓慢加入5ml浓硫酸。沸水浴中煮15min,室温冷却放置20min以后于490nm测吸光度。根据标准曲线计算实际样品的浓度值。多糖和蛋白质含量的测定结果见图5。
2.生物膜生物量的测定:
设置未添加外源物质3oc8-hsl,其余条件和实施例4完全一致的空白对照组。
取实施例4、5、6、7及空白对照中带有生物膜的填料,用蒸馏水淋洗;坩埚预先105℃烘干,冷却称重记为w1;把带有生物膜的填料放入坩埚中,105℃烘干12h,冷却称重记为w2,然后置于550℃的马福炉内灼烧至恒重,冷却称重记为w3,;把填料放入水中浸泡1h,之后用玻璃棒搅拌使生物膜完全脱落;把填料放入原来的坩埚中,105℃烘干12h,冷却称重记为w4。生物膜生物量w的计算公式如下:
w=(w2-w3)/(w4-w1)×103mg/g填料
生物膜生物量的测定结果见图6。
由图5可以看出,实施例5生物膜的多糖和蛋白质含量明显高于实施例4、实施例6、实施例7;由图6可以看出,实施例4中挂膜第30天,滴滤塔填料生物量达到49mgvss/g填料,而无外源添加3oc8-hsl的滴滤塔填料生物量仅达到28mgvss/g填料,且实施例5生物量明显高于实施例4、实施例6、实施例7,实施例4、实施例6无明显差别且均明显高于实施例7,这说明,3oc8-hsl与(e)-4-异硫氰酸基-1-(甲基亚磺酰基)-1-丁烯的摩尔比为4.2-5.3:1时,(e)-4-异硫氰酸基-1-(甲基亚磺酰基)-1-丁烯与3oc8-hsl发生协同作用,能够促进细胞分泌eps,提高细菌之间的连接作用,有利于生物膜的形成,使得生物膜量增加,当(e)-4-异硫氰酸基-1-(甲基亚磺酰基)-1-丁烯的添加量小于这个范围时无明显影响,大于这个范围时则起抑制作用。
3.脱氢酶活性的检测:因为脱氢酶能使有机底物的氢原子活化并传递给特定的受氢体,所以脱氢酶活性可以表示生物活性及其代谢有机物的能力。
3.1标准曲线的制备:取2,3,5-氯化三苯基四氮唑(ttc)标准品预先在105℃烘干2h,然后配制浓度为20、40、60、80、100、120μg/ml的ttc标准溶液。取6支比色管,依次加入1ml不同浓度的ttc标准溶液,另取一支比色管不加ttc标准溶液做对照,再分别加入2mltris-hcl缓冲液和1ml10%na2s新配溶液,摇匀后放置20min。反应完全后,各管分别加入5ml甲苯,振荡摇匀以充分提取三苯基甲臢(tpf)。然后4000r/min下离心10min,取上层有机溶液在紫外分光光度计上波长485nm下比色,绘制标准曲线,即得到ttc还原的标准曲线。y=0.0322x-0.03355,r2=0.996。
3.2样品的制备:把实施例4、5、6、7中生物膜从填料上分离下来,放入烧杯中,向烧杯中加水,搅拌均匀。取1.5ml悬浮液,加入2ml0.05%ttc,37℃孵育2h。用6ml96%的乙醇提取生成的tpf。混合液在3500r/min下离心1min,之后取上层有机溶剂1ml在485nm处测定吸光度。测定的结果通过标准曲线进行计算。本试验定义脱氢酶特定活性为取1g干物质所测定的tpf的量,tpf——脱氢酶特定活性(mgtpf/g干物质)。单位质量生物膜脱氢酶活性的测定结果见图7。
由图7可以看出,实施例5的单位质量生物膜脱氢酶活性明显高于实施例4、实施例6、
实施例7,实施例4、实施例6明显高于实施例7,这说明,3oc8-hsl与(e)-4-异硫氰酸基-1-(甲基亚磺酰基)-1-丁烯的摩尔比为4.2-5.3:1时,(e)-4-异硫氰酸基-1-(甲基亚磺酰基)-1-丁烯与3oc8-hsl发生协同作用,能够提高methylobacteriumrhodesianumh13细胞的代谢活性,当(e)-4-异硫氰酸基-1-(甲基亚磺酰基)-1-丁烯的添加量小于这个范围时无明显影响,大于这个范围时则起抑制作用。
试验例3:
设置未添加外源物质,其余条件和实施例4完全一致的空白对照组。
二氯甲烷浓度的测定:采用安捷伦gc6890气相色谱(gc,hp-innowax硅胶毛细管柱,30m×0.32mm×0.5μm,j&wscientific,usa)来对dcm进行定量分析,检测条件为:汽化室温度250℃,检测器(fid)温度300℃,柱温80℃,载气流速1ml·min-1,分流比5:1。检测每日样品中二氯甲烷的浓度变化来分析菌株对二氯甲烷的去除率。二氯甲烷去除率的测定结果见图8。
由图8可以看出,填料生物膜生长情况与去除率结果一致,实施例4中外源添加3oc8-hsl的滴滤塔,经过15天的挂膜启动后,二氯甲烷去除率达80.2%-90.1%,未外源添加3oc8-hsl的滴滤塔,挂膜启动周期明显比前者长,经过30天的挂膜启动后,二氯甲烷去除率仅为63.3%;实施例5中经过10天的挂膜启动后,二氯甲烷去除率达82.1%-98.8%,实施例6中经过17天的挂膜启动后,二氯甲烷去除率达80.1%-88.5%、实施例7的挂膜启动周期明显较长,经过30天的挂膜启动后,二氯甲烷去除率仅为79.2%,可知,与实施例4、实施例6、实施例7相比,实施例5的挂膜启动期明显较短且二氯甲烷去除率明显较高,这说明,3oc8-hsl与(e)-4-异硫氰酸基-1-(甲基亚磺酰基)-1-丁烯的摩尔比为4.2-5.3:1时,(e)-4-异硫氰酸基-1-(甲基亚磺酰基)-1-丁烯与3oc8-hsl发生协同作用,能够能够降低挂膜启动时间,强化对二氯甲烷的降解能力,当(e)-4-异硫氰酸基-1-(甲基亚磺酰基)-1-丁烯的添加量小于这个范围时无明显影响,大于这个范围时则起抑制作用。
上述实施例中的常规技术为本领域技术人员所知晓的现有技术,故在此不再详细赘述。
以上实施方式仅用于说明本发明,而并非对本发明的限制,本领域的普通技术人员,在不脱离本发明的精神和范围的情况下,还可以做出各种变化和变型。因此,所有等同的技术方案也属于本发明的范畴,本发明的专利保护范围应由权利要求限定。
- 还没有人留言评论。精彩留言会获得点赞!