重组新城疫病毒及制备方法、重组质粒、及其应用与流程
1.本发明总地涉及生物技术领域,具体涉及重组新城疫病毒及制备方法、重组质粒、及其应用。
背景技术:
2.治疗癌症的手段主要有手术、放疗、化疗、免疫疗法、单克隆抗体疗法和病毒疫苗。
3.恶性肿瘤是危害人类健康的重大疾病之一。《2015全球癌症统计》数据显示,2015年全球新增约1410万例癌症病例,癌症死亡人 数达820万。预计到2025年,全球每年新增癌症病例数将高达2449万例。长期以来,人们治疗癌症的方法主要以传统的手术切除和 放化疗为主,这些手段可以在一定程度上控制肿瘤的发展,但是对于晚期肿瘤扩散患者的疗效有限,并且这些手段同时对人体的正常细胞 产生严重的创伤。因此,急需一种新的治疗恶性肿瘤的方法,溶瘤病毒疗法是一种通过病毒选择性感染肿瘤细胞来杀伤肿瘤的新型肿瘤治 疗方法。作为肿瘤免疫的重要组成部分,与其他肿瘤免疫疗法相比具有很大优势。溶瘤病毒疗法历经三个阶段的发展,已取得了很大的成 效。目前可以通过携带外源基因增加抗肿瘤效果,其中t-vec携带gm-csf后,展现出良好疗效,于2015年获得美国fda批准用于首次 复发不可切除的黑色素瘤局部治疗。同年12月t-vec又获得欧盟批准,表明溶瘤病毒的发展具有很大潜力。
4.20世纪50年代,人们发现ndv(newcastle disease virus新城疫病毒)能抑制胃癌转移。因此ndv可作为一种新兴的肿瘤生物 治疗因子,其本身的高靶向性以及分子生物技术的成熟使其在肿瘤治疗中的应用研究越来越深入。ndv为单股负链rna病毒,编码6种 结构蛋白(l、np、p、hn、f、m)。
5.与其他溶瘤病毒相比,新城疫病毒具有天然靶向肿瘤细胞、广谱抗肿瘤特性,在抗肿瘤方面具有更大的优势,但如何提高其溶瘤效果 和保证其安全性,仍然是我们需要面临的巨大难题。
技术实现要素:
6.本发明的目的在于提供重组新城疫病毒及制备方法、重组质粒、及其应用。
7.本发明提供了一种重组新城疫病毒,将新城疫病毒losata的f蛋白替换为新城疫病毒中毒株的f蛋白而获得。
8.可选地,如上述的重组新城疫病毒,所述重组新城疫病毒的f蛋白的编码dna如seq id no:1自5’末端7274-8935位所示。
9.可选地,如上述的重组新城疫病毒,将新城疫病毒losata的基因组中的f基因替换为新城疫病毒中毒株的f基因而获得。优选地,所 述重组新城疫病毒的f基因的对应dna如seq id no:1自5’末端7274-8935位所示。更优选地,所述重组新城疫病毒的基因组对应的 dna如seq id no:1所示。
10.可选地,如上述的重组新城疫病毒,所述重组新城疫病毒的基因组对应的dna还包
括外源基因,所述外源基因选自dr5、trail、 hil2、p53、pd1、cd和mil12中的一种或多种。
11.优选地,所述外源基因为dr5、trail、hil2、p53、pd1、cd或mil12。
12.优选地,所述外源基因为mil12-hil2、p53-hil2、pd1-hil2或dr5-trail。
13.优选地,所述dr5如seq id no:2所示,所述trail如seq id no:3所示,所述hil2如seq id no:4所示,所述p53如seq id no:5 所示,所述pd1如seq id no:6所示,所述cd如seq id no:7所示,所述mil12如seq id no:8所示。
14.优选地,所述外源基因位于所述重组新城疫病毒的p基因和m基因之间。
15.本发明还提供了一种重组质粒,将pbrlosata质粒中的f基因替换获得,所述重组质粒的f基因如seq id no:1自5’末端7274-8935 位所示。
16.可选地,如上述的重组质粒,所述重组质粒为如seq id no:1所示的dna分子质粒。
17.可选地,如上述的重组质粒,所述重组质粒还包括外源基因,所述外源基因选自dr5、trail、hil2、p53、pd1、cd和mil12中的 一种或多种。
18.优选地,所述外源基因为dr5、trail、hil2、p53、pd1、cd或mil12。
19.优选地,所述外源基因为mil12-hil2、p53-hil2、pd1-hil2或dr5-trail。
20.优选地,所述dr5如seq id no:2所示,所述trail如seq id no:3所示,所述hil2如seq id no:4所示,所述p53如seq id no:5 所示,所述pd1如seq id no:6所示,所述cd如seq id no:7所示,所述mil12如seq id no:8所示。
21.优选地,所述外源基因位于所述重组新城疫病毒的基因组p基因和m基因之间。
22.本发明还提供了一种重组新城疫病毒的制备方法,将上述的重组质粒转染至细胞或细胞系并培养,获得重组新城疫病毒。
23.可选地,如上述的制备方法,将上述的重组质粒、辅助质粒共转染至细胞或细胞系并培养。所述细胞为哺乳动物细胞。辅助质粒例如 为pbl-n质粒、pbl-p质粒、pbl-l质粒。
24.本发明还提供了上述的重组新城疫病毒、上述的重组质粒在制备药物中的应用。所述药物的功能如下(a)和/或(b)和/或(c):(a) 治疗肿瘤;(b)抑制肿瘤细胞增殖;(c)杀伤肿瘤细胞。
25.本发明还提供了一种药物,包括上述的重组新城疫病毒,和/或上述的重组质粒。所述药物的功能如下(a)和/或(b)和/或(c):(a) 治疗肿瘤;(b)抑制肿瘤细胞增殖;(c)杀伤肿瘤细胞。
26.可选地,所述肿瘤选自肝癌、乳腺癌、非小细胞肺癌、黑色素瘤、神经母细胞瘤、肺癌、胰腺癌、甲状腺癌、肾癌、神经胶质瘤、肌 肉瘤、食道癌、子宫癌、乳腺癌和结直肠癌中的一种或多种。
27.可选地,所述肿瘤细胞选自肝癌细胞、乳腺癌细胞、非小细胞肺癌细胞、黑色素瘤细胞、神经母细胞瘤细胞、肺癌细胞、胰腺癌细胞、 甲状腺癌细胞、肾癌细胞、神经胶质瘤细胞、肌肉瘤细胞、食道癌细胞、子宫癌细胞、乳腺癌细胞和结直肠癌细胞中的一种或多种。
28.本技术首先筛选出促细胞融合效果较强的毒株,获取其结构蛋白基因,利用反向遗传操作技术以及分子克隆技术,替换losata的结构 蛋白基因,且进一步地插入外源基因,成功构建和拯救出重组嵌合病毒。将重组嵌合病毒在鸡胚中连续传代10代,增殖稳定性实验结果 证明,重组新城疫病毒可以在鸡胚中持续稳定的增殖,并且系统地比较重组嵌合病毒杀伤肿瘤细胞的效果。
29.本技术的重组嵌合病毒能有效抑制肿瘤细胞,促进肿瘤细胞的凋亡,有效地治疗肿瘤,并且具有良好的安全性。
附图说明
30.图1为实施例1毒株筛选试验结果;
31.图2为实施例2外源基因表达位置确定试验结果;
32.图3a-3e为实施例4细胞融合实验检测重组嵌合病毒对肿瘤细胞的杀伤作用;
33.图4为实施例5 mtt法检测重组嵌合病毒对hepg-2细胞的杀伤作用;
34.图5为实施例5 mtt法检测重组嵌合病毒对caki-1细胞的杀伤作用;
35.图6为实施例5 mtt法检测重组嵌合病毒对a549细胞的杀伤作用;
36.图7为实施例5 mtt法检测重组嵌合病毒对sk-mel-5细胞的杀伤作用;
37.图8为实施例5 mtt法检测重组嵌合病毒对ln229细胞的杀伤作用;
38.图9为实施例5 annexin v/pi法检测重组嵌合病毒对肝癌细胞的杀伤效果
39.图10为实施例6重组嵌合病毒治疗h22荷瘤小鼠肿瘤体积的统计;
40.图11为实施例6重组嵌合病毒治疗h22荷瘤小鼠后肿瘤重量的统计;
41.图12为实施例6重组嵌合病毒治疗h22荷瘤小鼠后存活率统计;
42.图13为实施例6重组嵌合病毒治疗h22荷瘤小鼠后肿瘤组织病理观察。
具体实施方式
43.以下结合附图和实施例,对本发明的具体实施方式进行更加详细的说明,以便能够更好地理解本发明的方案以及其各个方 面的优点。然而,以下描述的具体实施方式和实施例仅是说明的目的,而不是对本发明的限制。
44.下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为自常规生 化试剂商店购买得到的。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。下述实施例中如未特别指明,实施 例中所用的技术手段为本领域技术人员所熟知的常规手段和市售的常用仪器、试剂,可参见《分子克隆实验指南(第3版)》(科 学出版社)、《微生物学实验(第4版)》(高等教育出版社)以及相应仪器和试剂的厂商说明书等参考。
45.提及“pbrlosata质粒”的文献:“identificationof optimal insertionsite in recombinant newcastle disease virus(rndv)vectorexpressingforeign gene to enhance its anti-tumor effect”,ziye pan,plos one.;哈尔滨博翱医药技术开发有限公司。
46.提及“pbl-n质粒”、“pbl-p质粒”和“pbl-l质粒”的文献:genetically engineered newcastle disease virus expressinginterleukin2is a potential drug candidate for cancer immunotherapy,fuliang bai,immunology letters.;哈尔滨博翱医药技术开发有限公司。
47.pbrlosata质粒中具有新城疫病毒的np基因、p基因、m基因、f基因、hn基因和l基因,其中p基因和m基因之间具 有pmei和sacⅱ酶切识别位点。将pbrlosata质粒、pbl-n质粒、pbl-p质粒和pbl-l质粒共转染哺乳动物细胞并培养(pbl-n 质粒、pbl-p质粒和pbl-l质
粒起辅助作用,pbrlosata质粒提供病毒的全基因组),得到毒株losata。
48.文中涉及的外源基因包括死亡受体基因dr5、肿瘤坏死因子相关凋亡诱导配体基因trail、人源白细胞介素基因2hil2、抑癌基因基 因p53、程序性死亡受体1基因pd1、自杀基因cd、鼠源白细胞介素基因12mil12。
49.pmd19-t:购至宝生物工程(大连)有限公司(大连takara公司)
50.bhk-21细胞(幼仓鼠肾细胞):购至atcc
51.肝癌细胞hepg2、肾癌细胞caki-1、非小细胞肺癌细胞a549、神经母细胞瘤细胞ln229、黑色素瘤细胞sk-mel5、肝癌细胞 hcclm3、黑色素瘤细胞sk-mel2、胰腺癌细胞aspc-1、甲状腺癌细胞ftc133、肾癌细胞786-o、神经胶质瘤细胞u87-mg、肌肉瘤 细胞ht1080、食管癌细胞kyse-150、子宫癌细胞hela、乳腺癌细胞mcf7、结直肠癌细胞hct116购自中国科学院上海生命科学研 究院细胞资源中心
52.高糖dmem培养基、胰蛋白酶,新生牛血清(fcs)、胎牛血清(fbs):购自gibco公司
53.spf鸡胚:购自中国科学院哈尔滨兽医研究所
54.balb/c小鼠(昆明小鼠):购自北京维通利华公司
55.实施例1毒株筛选
56.取处于对数生长期的鸡胚成纤维细胞,经胰蛋白酶消化后收集,接种于6孔板中,三株新城疫病毒强毒株f48e9、 turkey/us(nd)/43084/92(tknd)、game fowl/us(ca)/211472/02(ca02)和一株中毒株anhinga(毒株为southeast poultry researchlaboratory赠送,本实验室保存,涉及毒株的文献为evaluation of newcastle disease virus chimeras expressing thehemagglutinin-neuraminidase protein of velogenic strains in the context of a mesogenic recombinant virus backbone.virus research, volume 129,issue 2,november 2007,pages 182-190)分别以0.1moi感染细胞,control组为无病毒的spf鸡胚尿囊液。24h后 取出6孔板,于荧光倒置显微镜下观察细胞融合效果,通过分析合胞体形成的能力,筛选具有强融合能力且毒力较弱的毒株用 作后续实验,结果如图1,在四种毒株中,f48e9的促融合能力最强,anhinga株的促融合能力较强且毒力最弱。
57.实施例2、重组嵌合病毒的制备
58.一、重组质粒的构建(以f基因替换为例)
59.1、筛选促融合效果较强且毒力较弱的毒株anhinga,ncbi上获取其f基因序列(genbank:aas67135.1),设计overlap pcr引物。
60.2、以panh质粒(涉及文献为evaluation of newcastle disease virus chimeras expressingthe hemagglutinin-neuraminidase protein of velogenic strains in the context of a mesogenic recombinant virus backbone)为模板,采用f基因特异性引物pcr扩增f基因片段,连接 pmd19-t,转化大肠杆菌dh5α,提取质粒进行鉴定,鉴定正确的pmd19-t-f质粒用作下一步实验。
61.3、采用pcr技术,以pbrlosata质粒为模板扩增所需要的目的片段a和b,(a片段引物:5'cacgtg aaagcgccagagaagattcccggga 3';p2:5'tttggggcccatcttgcacctggagggcgccaaccgg 3';p3:5' tccaggtgcaagatgggccccaaaccccccaccggaa3'。b片段引物:p6:5'cctcatctgtgt tcatgtttttgtggtggctctcatc 3';p7:5'acaaaaacatgaacacagatgaggaacga
aggtttcc 3';p8:5' ggcctgagaggccacgcgtcgccgcgggccggtt 3')。以pmd19-t-f质粒为模板扩增所需要的目的片段f,胶回收纯化a,f,b片 段。然后通过overlap pcr的方法,以纯化后的a,f,b片段为模板,扩增目的片段a-f-b,连接pmd19-t载体,转化大肠杆菌dh5α,提 取质粒进行鉴定,鉴定正确的质粒命名为pmd19-t-a-f-b,该质粒带有pmli、sfii两个酶切位点。
62.4、用限制性内切酶pmli、sfii酶切步骤3中的质粒pmd19-t-a-f-b,胶回收酶切产物。
63.5、用限制性内切酶pmli、sfii酶切pbrlosata质粒,胶回收载体。
64.6、将步骤4的酶切产物和步骤5的载体连接,得到重组嵌合质粒pbrlosata-f。对重组嵌合质粒进行pcr和双酶切鉴定,鉴定正确的 质粒样品分装并送至上海生工进行测序,测序结果使用序列分析软件dnaman进行比对,将测序结果与目的序列一致的质粒命名为 pbrlosata-f,重组嵌合质粒pbrlosata-f的核苷酸序列如序列表的seq id no:1所示(序列表的seq id no:1中,自5’末端第7274-8935 位核苷酸为f基因的核酸序列)。
65.用同样的方式构建其他的重组嵌合质粒:pbrlosata-hn(hn基因序列genbank:aas67136.1)pbrlosata-p(p基因序列genbank: aas67133.1)、pbrlosata-m(m基因序列genbank:aas67134.1)。
66.二、外源基因最佳插入位置的确定
67.1、采用分子生物学的方法在pbrlosata-f质粒的np/p、p/m、m/f、f/hn位点分别引入酶切位点。获得重组质粒pbrlosata-f-np/p (ascⅰ、sfiⅰ)、pbrlosata-f-p/m(sacⅱ、pmeⅰ)、pbrlosata-f-m/f(hpai、mlui)、pbrlosata-f-f/hn(hpai、mlui)。
68.2、采用红荧光蛋白rfp基因特异性引物pcr扩增携带不同酶切位点的rfp基因片段(红荧光蛋白rfp基因序列 genbank:mg719763.1),连接pmd19-t载体,转化大肠杆菌dh5α,提取质粒进行鉴定,该质粒带有不同的酶切位点。
69.3、用限制性内切酶酶切步骤2中的质粒,胶回收酶切产物。
70.4、用限制性内切酶酶切步骤1中的重组质粒,胶回收载体。
71.5、将步骤3的酶切产物和步骤4的载体连接,得到重组质粒pbrlosata-f-np/p-rfp、pbrlosata-f-p/m-rfp、pbrlosata-f-m/f-rfp、 pbrlosata-f-f/hn-rfp。
72.6、步骤5中的重组质粒与辅助质粒共转染bhk-21细胞,获得重组病毒rlosata-f-np/p-rfp、rlosata-f-p/m-rfp、rlosata-f-m/f-rfp、 rlosata-f-f/hn-rfp。
73.7、取处于对数生长期的mcf7细胞,经胰蛋白酶消化后收集,接种于6孔板中,重组嵌合病毒rlosata-f-np/p-rfp、rlosata-f-p/m-rfp、 rlosata-f-m/f-rfp、rlosata-f-f/hn-rfp。分别以1moi感染细胞,亲本病毒rlosata用作对照,control组为无病毒的spf鸡胚尿囊液。 24h后取出6孔板,于流式细胞仪下检测各病毒感染后细胞的平均荧光强度。结果见图2,p、m位点之间红荧光强度最强,表明p、m位 点之间rfp表达量最高。
74.三、插入外源基因的重组质粒的构建(以pd1基因插入为例)
75.1、分离人外周血细胞中的单核细胞并提取rna并反转录成cdna, 根据genbank已发表的人pd1序列(ay238517.1),利用primer premier 5.0软件设计pcr引物p1和p2用于克隆完整pd1基因。引物两 端设计pmei和sacⅱ酶切位点,以匹配pbrlosata-f载体质粒;
76.2、步骤1的pcr产物连接pmd19-t,转化大肠杆菌,提取质粒进行鉴定,鉴定正确的
np、 pbrlosata-m、pbrlosata(f)-dr5、pbrlosata(f)-trail、pbrlosata(f)-hil2、pbrlosata(f)-p53、pbrlosata(f)-pd1、pbrlosata(f)-cd、 pbrlosata(f)-mil12、pbrlosata(f)-dr5-trail、pbrlosata(f)-mil12-hil2、pbrlosata(f)-p53-hil2和pbrlosata(f)-pd1-hil2通过该方法制 备的重组嵌合病毒。
88.以下描述若无特别指明,亲本病毒指新城疫病毒rlosata、anhinga。
89.实施例3、重组嵌合病毒毒力及致病力的测定
90.一、eid50的测定
91.将拯救的重组嵌合病毒或亲本病毒用灭菌处理的pbs分别连续10倍梯度稀释,从37℃培养箱中取出鸡胚,每个稀释度接种6枚9-11 日龄spf鸡胚(100μl/枚),37℃培养箱中继续孵育4-6天后,每个鸡胚都需通过ha实验检测,记录每个稀释度感染的鸡胚数,根据 reed and muench method方法计算重组嵌合病毒或亲本病毒的eid50。
92.二、tcid50的测定
93.1、用含有10%fbs、1%抗生素的dmem培养基接种df-1细胞于96孔微量培养板内,37℃,5%co2培养箱中过夜。
94.2、接种重组嵌合病毒和亲本病毒前,将步骤1中加入的原有细胞培养基弃掉,加入含有10%尿囊液、1%抗生素的180μl dmem新 鲜培养基。
95.3、取20μl重组嵌合病毒或亲本病毒接种于最上排细胞孔内,轻轻吹打混匀后,吸取20μl混合液向下方细胞孔做连续的10倍梯度 稀释。每个病毒设置3个重复样品。
96.4、37℃、5%co2细胞培养箱中,重组嵌合病毒或亲本病毒接种孵育1小时后,弃去步骤3加入的培养基并用pbs清洗一次,之后加 入含10%尿囊液,1%抗生素的200μl dmem新鲜培养基。
97.5、37℃,5%co2细胞培养箱中继续培养,72h后于光学倒置显微镜下观察细胞病变孔并记录病变孔的个数,根据reed and muenchmethod方法计算该病毒的效价。
98.三、mdt的测定
99.重组嵌合病毒或亲本病毒分别用灭菌后的pbs进行10倍梯度稀释,将倍比稀释的病毒通过尿囊腔接种于6枚10日龄spf鸡胚(100 μl/枚),37℃培养箱连续培养7天,每隔12h检查并记录每个稀释度接种鸡胚的死亡时间和死亡数,最后以病毒最高稀释倍数接种鸡胚 全部死亡的平均时间为该病毒的mdt。
100.四、icpi的测定
101.按照oie标准,重组嵌合病毒或亲本病毒分别先用灭菌处理的pbs进行10倍梯度稀释,经脑内接种10只1日龄spf雏鸡(50μl/ 只),连续观察10天,记录雏鸡每天发病率和死亡率,并根据reed and muench method方法计算病毒的脑内致病指数。
102.实施例3重组嵌合病毒毒力及致病力的测定结果见表1。亲本毒株anhinga的icpi值为1.47,rlosata-hn、rlosata-p和rlosata-m的 icpi值显著低于anhinga,分别为0.05、0.11、0.17,rlosata-f的icpi为1.59,较anhinga也有所下降。结果表明:与亲本毒株anhinga 相比,hn、p、m和f替换均能降低anhinga对鸡的致病力。rlosata-f作为重组病毒,相比于anhinga,可控性更高且相对安全。
103.表1病毒滴度、毒力及致病力的比较
[0104][0105]
实施例4、细胞融合实验检测重组嵌合病毒对肿瘤细胞的杀伤作用
[0106]
肿瘤细胞为肝癌细胞hepg2、肾癌细胞caki-1、非小细胞肺癌细胞a549、黑色素瘤细胞sk-mel-5、神经母细胞瘤细胞ln229。
[0107]
一、重组嵌合病毒感染肿瘤细胞
[0108]
取处于对数生长期的肿瘤细胞,经胰蛋白酶消化后收集,接种于6孔板中,重组嵌合病毒rlosata-hn、rlosata-f、rlosata-p、rlosata-m 分别以1moi感染细胞,亲本病毒rlosata用作对照,control组为无病毒的spf鸡胚尿囊液。24h后取出6孔板,于荧光倒置显微镜下观 察细胞融合效果。结果见图3a-3e。
[0109]
结果表明,与亲本病毒相比,重组嵌合病毒rlosata-hn、rlosata-p、rlosata-m产生合胞体数量高于rlosata,但差异不显著;而嵌合 病毒rlosata-f产生合胞体的数量高于rlosata,差异极显著。
[0110]
实施例5、重组嵌合病毒对肿瘤细胞的作用效果
[0111]
肿瘤细胞为肝癌细胞hepg2、肾癌细胞caki-1、非小细胞肺癌细胞a549、黑色素瘤细胞sk-mel-5、神经母细胞瘤细胞ln229。
[0112]
一、mtt法检测重组嵌合病毒对肿瘤细胞的抑制作用
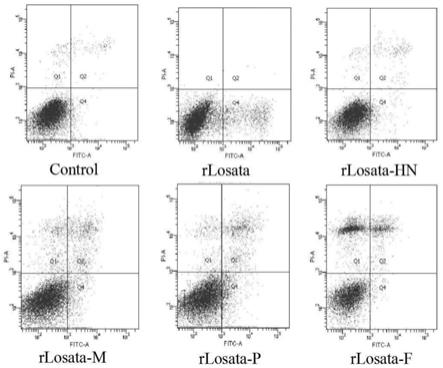
[0113]
将对数生长期的肿瘤细胞进行胰酶消化,然后用含10%小牛血清的dmem培养基或rpmi-1640培养基制成2
×
104个细胞/ml的细胞 悬液。将细胞悬液接种于96孔板(每孔200微升),置于5%co2、37℃环境中静置培养24h,弃培养上清,用pbs缓冲液洗涤,洗涤后分 组。每组实验孔内各加入0.01moi、0.1moi、1moi、10moi的嵌合病毒100μl,对照组内分别加入0.01moi、0.1moi、1moi、10moi 的rlosata 100μl;阴性对照孔内加100μl dmem。病毒感染1h后,弃去病毒液,每孔加入200μl pbs洗涤一次,加入含有5%血清的 细胞维持液进行培养。分别培养24h、48h后,向每孔加入20μl mtt溶液(5mg/ml),孵育4h,弃培养液,向每孔加入150μl dmso, 震荡10min后,酶标仪于测定490nm处的od值,计算细胞生长的抑制率。
[0114]
抑制率=(阴性对照处理孔的od值-试验处理孔的od值)/阴性对照处理孔的od值
×
100%。
[0115]
对hepg-2细胞的抑制率见图4;对caki-1细胞的抑制率见图5;对a549细胞的抑制率见图6;对sk-mel-5细胞的抑制率见图7; 对ln229细胞的抑制率见图8;
[0116]
结果表明:亲本病毒rlosata和嵌合病毒rlosata-hn、rlosata-f、rlosata-p、rlosata-m均对以上细胞具有抑制效果,嵌合病毒losata-f 的抑制效果显著高于亲本病毒于rlosata;其他嵌合病毒rlosata-hn、rlosata-np、rlosata-m的抑制效果高于亲本病毒rlosata,差异不显 著;而且重组病毒对肿瘤细胞的杀伤效果与时间和剂量成正相关。
[0117]
二、annexin v/pi法检测重组嵌合病毒对肝癌细胞的杀伤效果
[0118]
收集对数生长期的hepg2肿瘤细胞,制备成1-10
×
104个/ml(含0.001%胰酶)的细胞悬液,混匀后加入6孔板中,待细胞长到60-80%, 进行分组实验。
[0119]
添加无病毒spf鸡胚尿囊液的hepg2细胞作为空细胞对照组(control),加入1moi rlosata的hepg2细胞作为对照组,加入1moi 重组嵌合病毒的hepg2细胞为实验组。
[0120]
感染12h后,用0.25%的胰酶消化细胞(0.5-1
×
106个),用pbs洗2次,用移液器吸取500ul bindingbuffer轻柔的悬浮细胞,加入fitc 标记的10μl annexin-v,混匀,再加入5μl pi混匀,避光反应5-15min后立即用流式细胞术定量检测,同时设有不加annexinv-fitc及 pi的hepg2细胞作为阴性对照。
[0121]
结果见图9,结果表明,亲本病毒和重组嵌合病毒均能诱导肿瘤细胞发生凋亡,rlosata-f病毒的效果显著强于rlosata病毒,其余的 重组嵌合病毒的效果与rlosata病毒差异不显著。
[0122]
实施例6、重组嵌合病毒对肿瘤的治疗作用及病毒安全性检测
[0123]
一、重组嵌合病毒对肿瘤的治疗作用
[0124]
1、建立balb/c小鼠h22肝癌动物模型
[0125]
取6周龄昆明小鼠进行实验,将h22小鼠肝癌细胞接种于昆明小鼠腹腔,7天后待腹水长出断颈处死。无菌条件下抽取含有h22细胞 的腹水,加入适量pbs,配成癌细胞悬液,细胞计数及测定细胞活力,活细胞率达95%。调整细胞密度为106个/ml备用。每只balb/c小 鼠右侧腹股沟皮下注入剂量0.2ml,约含2
×
105个肿瘤细胞。8-12天后形成实体瘤直径在5-8mm,造模成功,可进行后续实验。取肿瘤 直径在5-8mm的小鼠,去除形态、大小差异大的个体,作为模型小鼠。
[0126]
2、重组嵌合病毒对肿瘤的治疗作用
[0127]
将模型小鼠随机分为六组,每组15只,分别处理如下:
[0128]
rlosata-hn组:每天向向模型小鼠的瘤内注射0.2ml实施例1制备的rlosata-hn病毒液(含107pfu病毒),治疗14天;
[0129]
rlosata-f组:每天向模型小鼠的瘤内注射0.2ml实施例1制备的rlosata-f病毒液(含107pfu病毒),治疗14天;
[0130]
rlosata-p组:每天向模型小鼠的瘤内注射0.2ml实施例1制备的rlosata-p病毒液(含107pfu病毒),治疗14天;
[0131]
rlosata-m组:每天向模型小鼠的瘤内注射0.2ml实施例1制备的rlosata-m病毒液(含107pfu病毒),治疗14天;
[0132]
rlosata组:每天向模型小鼠的瘤内注射0.2ml rlosata病毒液(含107pfu病毒),治疗14天;
[0133]
尿囊液组(model):每天向模型小鼠的瘤内注射0.2ml尿囊液,治疗14天。
[0134]
隔天测量肿瘤体积,治疗结束后,杀鼠,剥瘤,测量肿瘤体积和重量(结果如图10,
图11)。剩余小鼠在治疗结束后观察小鼠的存 活情况,control组为未经任何处理的正常小鼠(图12)。结果表明,与尿囊液组相比,亲本病毒和嵌合病毒均对肿瘤有显著的抑制效果, rlosata-p和rlosata-m的抗肿瘤效果高于rlosata-hn组,差异不显著,而rlosata-f的抑制效果显著高于以上三种嵌合病毒。与尿囊液组 相比,亲本病毒和嵌合病毒均能显著的提高小鼠存活率,与rlosata组相比,只有rlosata-f能显著提高小鼠存活率。
[0135]
3、肿瘤病理切片的观察
[0136]
为观察ndv嵌合病毒与对照组治疗后肿瘤组织细胞形态,取治疗后各组小鼠肿瘤组织,按常规方法制备肿瘤组织石蜡切片。在显微 镜下观察各治疗组肿瘤组织形态特征,并进行比较分析。
[0137]
结果表明:治疗后模型组肿瘤组织结构致密,细胞形态完好,生长旺盛;rlosata病毒对照组肿瘤组织出现轻微坏死;rlosata-hn、rlosata-p、 rlosata-m组细胞结构不完整,并伴有一定程度的淋巴细胞浸润;rlosata-f组肿瘤组织松散,细胞结构不完整并伴有大量的淋巴细胞浸润 (参见图13)。
[0138]
二、重组嵌合病毒的安全性检测
[0139]
急性毒性试验
[0140]
选用健康4-6周昆明系小白鼠,共20只,雌雄各半,分为两组,每组10只。对照组小鼠正常饲养。实验组每只小鼠腹腔内注射1
×
104pfurlosata-f,注射之后观察48h。实验的小鼠若出现呼吸受到抑制、四肢步伐不平稳、有瘫痪症状、惊厥、皮毛战栗等不良反应和死亡小鼠 均为阳性。
[0141]
亚急性毒性试验
[0142]
选用健康4-6周昆明系小白鼠,共20只,雌雄各半,分为两组,每组10只。实验组小鼠每天每只腹腔注射1
×
104pfu rlosata-f,对照 组小鼠正常饲养。连续记录小鼠4周内的反应情况,主要观察小鼠的进水、进食、毛色、体重等方面,若一切正常且无不良反应或死亡者, 为阴性。
[0143]
结果表明,重组嵌合病毒对小鼠的正常生长无不良影响,安全性可靠。
[0144]
实施例7、表达外源基因的重组嵌合病毒对肿瘤细胞的作用效果
[0145]
肿瘤细胞为肝癌细胞hcclm3、黑色素瘤细胞sk-mel2、肺癌细胞a549、胰腺癌细胞aspc-1、甲状腺癌细胞ftc133、肾癌细胞 786-o、神经胶质瘤细胞u87-mg、肌肉瘤细胞ht1080、食管癌细胞kyse-150、子宫癌细胞hela、乳腺癌细胞mcf7、结直肠癌细胞hct116。
[0146]
一、mtt法检测重组嵌合病毒对肿瘤细胞的抑制作用
[0147]
将对数生长期的肿瘤细胞进行胰酶消化,然后用含10%小牛血清的dmem培养基、f12培养基或rpmi-1640培养基制成2
×
104个细 胞/ml的细胞悬液。将细胞悬液接种于96孔板(每孔200微升),置于5%co2、37℃环境中静置培养24h,弃培养上清,用pbs缓冲液 洗涤,洗涤后分组。每组实验孔内各加入0.1moi表达外源基因的嵌合病毒100μl,对照组内加入0.1moi的rlosata-f;阴性对照孔内加 100μl dmem。病毒感染1h后,弃去病毒液,每孔加入200μl pbs洗涤一次,加入含有5%血清的细胞维持液进行培养。培养24h后, 向每孔加入20μl mtt溶液(5mg/ml),孵育4h,弃培养液,向每孔加入150μl dmso,震荡10min后,酶标仪于测定490nm处的 od值,计算细胞生长的抑制率(结果见表2)。
[0148]
抑制率=(阴性对照处理孔的od值-试验处理孔的od值)/阴性对照处理孔的od值*
100%。
[0149]
表2表达不同外源基因的重组病毒对不同肿瘤细胞的抑制效果(抑制率%)
[0150][0151]
结果表明:rlosata(f)-dr5、rlosata(f)-trail、rlosata(f)-hil2、rlosata(f)-p53、rlosata(f)-pd1、rlosata(f)-cd、rlosata(f)-mil12、 rlosata(f)-dr5-trail、rlosata(f)-mil12-hil2、rlosata(f)-p53-hil2和rlosata(f)-pd1-hil2均对以上细胞具有抑制效果,且对hcclm3、 sk-mel2、ftc133、786-o、u87-mg和ht1080的抑制率强于a549、aspc-1、kyse-150、hela、mcf7和hct116,而且,不同的毒 株对于a549、aspc-1、kyse-150、hela、mcf7和hct116的细胞毒性不完全一致。在这12种肿瘤细胞中,rlosata(f)-dr5、rlosata(f)-trail 和rlosata(f)-dr5-trail对hela细胞的抑制率较高,rlosata(f)-p53和rlosata(f)-p53-hil2对a549和aspc-1细胞的抑制率较高, rlosata(f)-hil2、rlosata(f)-mil12和rlosata(f)-mil12-hil2对a549、kyse-150、hela细胞的抑制率较高,rlosata(f)-cd对a549细胞的 抑制率较高,rlosata(f)-pd1和rlosata(f)-pd1-hil2对a549、mcf7和hct116细胞的抑制率较高。
[0152]
实施例8、表达外源基因的重组嵌合病毒对肿瘤的治疗作用
[0153]
1、根据实施例6中所述的方法建立balb/c小鼠4t1乳腺癌荷瘤小鼠。
[0154]
2、重组嵌合病毒对肿瘤的治疗作用
[0155]
将模型小鼠随机分为13组,每组10只,分别处理如下:
[0156]
rlosata(f)-dr5组:每天向向模型小鼠的瘤内注射0.1ml实施例1制备的rlosata(f)-dr5病毒液(含5
×
107pfu病毒),治疗21天;
[0157]
rlosata(f)-trail组:每天向模型小鼠的瘤内注射0.1ml实施例1制备的rlosata(f)-trail病毒液(含5
×
107pfu病毒),治疗21天;
[0158]
rlosata(f)-hil2组:每天向模型小鼠的瘤内注射0.1ml实施例1制备的rlosata(f)-hil2病毒液(含5
×
107pfu病毒),治疗21天;
[0159]
rlosata(f)-p53组:每天向模型小鼠的瘤内注射0.1ml实施例1制备的rlosata(f)-p53病毒液(含5
×
107pfu病毒),治疗21天;
[0160]
rlosata(f)-pd1组:每天向模型小鼠的瘤内注射0.1ml实施例1制备的rlosata(f)-pd1病毒液(含5
×
107pfu病毒),治疗21天;
[0161]
rlosata(f)-cd组:每天向模型小鼠的瘤内注射0.1ml实施例1制备的rlosata(f)-cd病毒液(含5
×
107pfu病毒),治疗21天;
[0162]
rlosata(f)-mil12组:每天向模型小鼠的瘤内注射0.1ml实施例1制备的rlosata(f)-mil12病毒液(含5
×
107pfu病毒),治疗21天;
[0163]
rlosata(f)-dr5-trail组:每天向模型小鼠的瘤内注射0.1ml实施例1制备的rlosata(f)-dr5-trail病毒液(含5
×
107pfu病毒), 治疗21天;
[0164]
rlosata(f)-mil12-hil2组:每天向模型小鼠的瘤内注射0.1ml实施例1制备的rlosata(f)-mil12-hil2病毒液(含5
×
107pfu病毒),治 疗21天;
[0165]
rlosata(f)-p53-hil2组:每天向模型小鼠的瘤内注射0.1ml实施例1制备的rlosata(f)-p53-hil2病毒液(含5
×
107pfu病毒),治疗21 天;
[0166]
rlosata(f)-pd1-hil2组:每天向模型小鼠的瘤内注射0.1ml实施例1制备的rlosata(f)-pd1-hil2病毒液(含5
×
107pfu病毒),治疗 21天;
[0167]
rlosata-f组:每天向模型小鼠的瘤内注射0.1ml rlosata病毒液(含5
×
107pfu病毒),治疗21天;
[0168]
尿囊液组(model):每天向模型小鼠的瘤内注射0.1ml尿囊液,治疗21天。
[0169]
隔天测量肿瘤体积,治疗结束后,杀鼠,剥瘤,测量肿瘤重量(结果如表3)。结果表明,与尿囊液组相比,rlosata-f和表达外源基 因的重组嵌合病毒均对肿瘤有显著的抑制效果,rlosata(f)-dr5、rlosata(f)-trail、rlosata(f)-cd的抗肿瘤效果高于rlosata-f组,差异 不显著;rlosata(f)-p53和rlosata(f)-mil12的抗肿瘤效果显著高于rlosata-f治疗组;rlosata(f)-hil2和rlosata(f)-pd1的抗肿瘤效果相较 于rlosata-f组差异极显著。而对于双基因治疗组,相比于单基因治疗,对肿瘤的抑制效果进一步增强,其中rlosata(f)-mil12-hil2和 rlosata(f)-pd1-hil2治疗组的效果最佳,治疗结束后个别小鼠的肿瘤几乎消退。
[0170]
表3表达外源基因的重组嵌合病毒治疗结束后平均体积和肿瘤重量
[0171][0172]
实施例9、插入外源基因的重组嵌合病毒安全性检测
[0173]
选用健康6周spf级balb/c小白鼠分组,每组10只。对照组小鼠正常饲养。实验组小鼠每只腹腔注射5
×
108pfu(10倍治疗剂量)重组嵌 合病毒(rlosata(f)-dr5、rlosata(f)-trail、rlosata(f)-hil2、rlosata(f)-p53、rlosata(f)-pd1、rlosata(f)-cd、rlosata(f)-mil12、 rlosata(f)-dr5-trail、rlosata(f)-mil12-hil2、rlosata(f)-p53-hil2或rlosata(f)-pd1-hil2)后观察30天。结果出现明显不良反应如精神萎 靡,皮毛竖起及死亡者为阳性。观察结束后,取各组小鼠的血清,检测ast、alt等相关指标。
[0174]
结果显示:注射第2天时,实验组个别小鼠皮毛竖起,饮食饮水未受到影响。连续注射一个星期后,小鼠皮毛恢复正常,继续观察一 个月,各实验组小鼠均未出现明显不良反应如精神萎靡,皮毛竖起,且无小鼠死亡。观察结束后,取各组小鼠的血清,采用elisa方法检 测ast,alt,bun和crea等相关指标。结果显示:与正常小鼠相比,各实验组谷草转氨酶(ast)和谷丙转氨酶(alt)活性以及血尿素氮 (bun),血肌酐(crea)的浓度略微升高,差异不显著。结果表明:嵌合病毒治疗不会引起肝肾损伤和严重的毒副反应。
[0175]
最后应说明的是:显然,上述实施例仅仅是为清楚地说明本发明所作的举例,而并非对实施方式的限定。对于所属领域的 普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法对所有的实施方式予以穷举。 而由此所引申出的显而易见的变化或变动仍处于本发明的保护范围之中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1