一种人参皂苷衍生物及其合成方法与应用与流程
本发明属于医药领域,特别涉及一种人参皂苷衍生物及其合成方法与应用。
背景技术:
人参皂苷(ginsenoside)是一种固醇类化合物,三萜皂苷,主要存在于人参属药材中。人参皂苷被视为是人参中的活性成分,因而成为研究的目标。其中人参皂苷rh2单体对癌细胞的生长有抑制作用,能诱导肿瘤细胞凋亡,逆转肿瘤细胞异常分化,抗肿瘤转移,与化疗药物联用能起到增效减毒的作用。
目前的研究表明,人参皂苷rh2以20(s)-rh2和20(r)-rh2两种立体异构体形式存在,其手性碳-20中心羟基的空间结构不同。其中20(r)-rh2对正常细胞的毒性较小,但是对肿瘤细胞的杀灭效果也较差;与20(r)-rh2相比,20(s)-rh2对肿瘤细胞的杀灭效果更好,但是其对正常细胞的毒性也较大,且溶解性也有所不足。
因此,希望对人参皂苷rh2进行改性处理,从而得到性能更为优良的人参皂苷衍生物。
技术实现要素:
本发明旨在至少解决上述现有技术中存在的技术问题之一。为此,本发明提出一种人参皂苷衍生物,与其前体20(s)-rh2相比,能够达到更好的肿瘤抑制效果和更小的细胞毒性,且溶解性得到显著增强。
本发明还公开了所述人参皂苷衍生物的合成方法。
一种人参皂苷衍生物,所述人参皂苷衍生物为如下结构所示的化合物或其在药学上可接受的盐:
上述人参皂苷衍生物的合成方法,包括以下步骤:包括以下步骤:以人参皂苷(20s)-rh2作为前体,在酮作催化剂下,添加氧化剂和碳酸氢钠进行氧化,得到所述人参皂苷衍生物。
本发明通过对人参皂苷(20s)-rh2进行氧化,在侧链上引入极性基团,以实现增加人参皂苷(20s)-rh2亲水性的目的。经试验,在同等条件下,所述人参皂苷衍生物的溶解性能较20(s)-rh2提高20倍以上,达到引入极性基团所预期的效果。
然而,让发明人感到意外的是,相比于20(s)-rh2单体,所述人参皂苷衍生物对肿瘤细胞的抑制效果显著上升,且对正常细胞的毒性明显减弱,这是发明人所不曾预料到的优良效果。
优选的,所述氧化剂选自过氧硫酸氢钾复合盐或过氧化氢。
优选的,所述氧化剂选用过氧硫酸氢钾复合盐时,反应的ph值为6.0-7.0;所述氧化剂选用过氧化氢时,反应的ph值为3.0-5.0。
一种抗肿瘤药物,包含上述的人参皂苷衍生物。目前人参皂苷已广泛应用于抗肿瘤领域,而本发明所述人参皂苷衍生物具备更好的肿瘤抑制效果,可应用于制备抗肿瘤的药物。
优选的,所述抗肿瘤药物中所述人参皂苷衍生物的质量含量为5-30%。
优选的,所述抗肿瘤药物中还包括药学上可接受的辅料。
上述人参皂苷衍生物在制备抗肺癌药物中的应用。实验表明,本发明所述人参皂苷衍生物对肺部肿瘤的抑制效果良好,且对动物无不良影响。
优选的,所述肿瘤包括肺癌、宫颈癌、肝癌和乳腺癌。
上述人参皂苷衍生物在制备抗肿瘤转移药物中的应用。实验表明,本发明所述人参皂苷衍生物可剂量依赖地抑制α-enolase(糖酵解酶)和stathmin蛋白等肿瘤转移标志物的表达,具有良好的抗肿瘤转移的作用。
相对于现有技术,本发明的有益效果如下:
(1)与人参皂苷(20s)-rh2相比,本发明所述人参皂苷衍生物在水中的溶解性能提高了20倍,大大提高了人参皂苷作为抗肿瘤药物的应用价值;
(2)与人参皂苷(20s)-rh2相比,本发明所述人参皂苷衍生物具有更强的抗癌作用,且未见明显的毒性反应;
(3)本发明所述人参皂苷衍生物的合成方法步骤简单,且不产生多余的副产物,因此有利于规模化生产和纯化。
附图说明
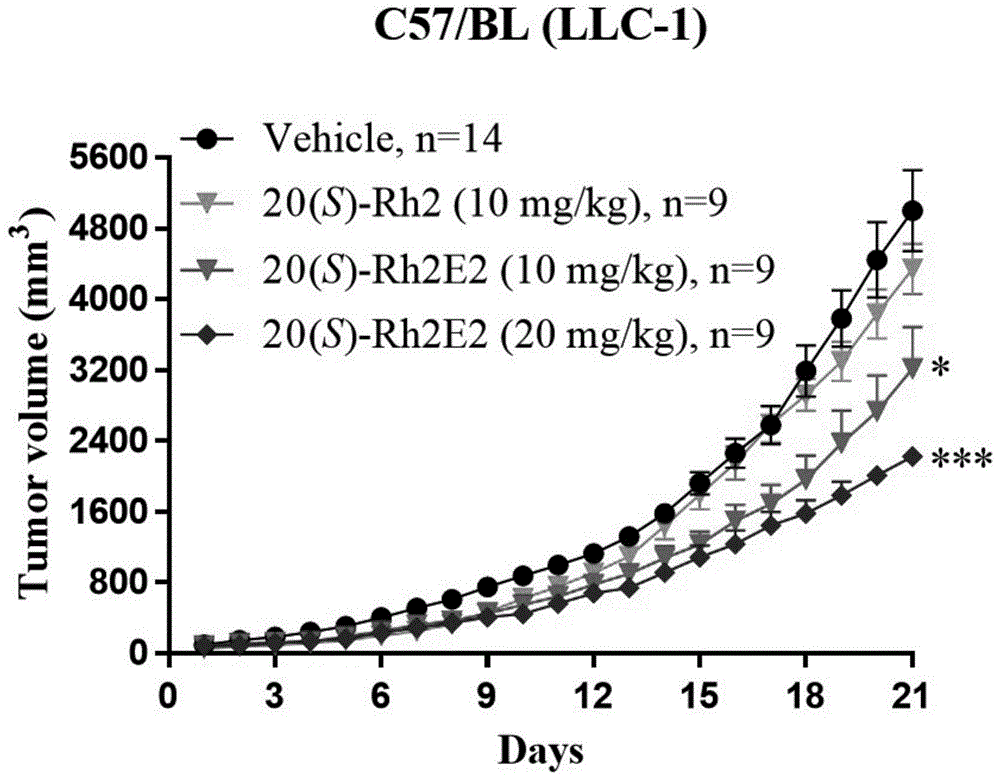
图1表示人参皂苷衍生物20(s)-rh2e2对llc-1异种移植瘤的体内抑瘤作用;
图2表示荷瘤小鼠腹腔注射人参皂苷衍生物20(s)-rh2e2后的体重变化情况;
图3表示荷瘤小鼠腹腔注射人参皂苷衍生物20(s)-rh2e2后的各器官重量情况;
图4表示c57bl/6小鼠口服7天人参皂苷衍生物20(s)-rh2e2的存活率;
图5表示c57bl/6小鼠口服7天人参皂苷衍生物20(s)-rh2e2的体重变化情况;
图6表示人参皂苷衍生物20(s)-rh2e2抑制llc-1异种移植瘤的肿瘤转移情况;
图7表示人参皂苷衍生物20(s)-rh2e2减少肿瘤转移负担的区域面积;
图8表示荷瘤小鼠具代表性的肺转移性病灶的h&e染色图像;
图9表示人参皂苷衍生物20(s)-rh2e2对荷瘤小鼠肿瘤组织中α-enolase和stathmin表达量的影响。
具体实施方式
为了让本领域技术人员更加清楚明白本发明所述技术方案,现列举以下实施例进行说明。需要指出的是,以下实施例对本发明要求的保护范围不构成限制作用。
以下实施例中所用的原料、试剂或装置如无特殊说明,均可从常规商业途径得到,或者可以通过现有已知方法得到。
在本发明的具体实施方式中,所用过氧硫酸氢钾复合盐(
实施例1
一种人参皂苷衍生物的合成方法,包括以下步骤:
取1g人参皂苷(20s)-rh2溶于600ml乙腈-edta二钠混合溶液(乙腈与edta二钠的体积比为1:1,edta二钠在混合溶液中的浓度为4×10-4mol/l)。将4942mg的过氧单磺酸钾盐(
称量1245mg的环氧化双缩酮催化剂(shiepoxidationdiketalcatalyst(ketone)),完全溶解于150ml乙腈后,逐滴加入到上述(20s)-rh2反应溶液中,室温搅拌过夜。反应液过滤,并减压回收乙腈后,进行ods柱层析,50%-90%甲醇梯度洗脱,经tlc检测(薄层色谱)合并相同组分,得到700mg目标产物(即人参皂苷衍生物),将该人参皂苷衍生物表示为(20s)-rh2e2。
该人参皂苷衍生物(20s)-rh2e2的表征数据为:
highresolution-esi-ms(positiveionmode):m/z639.4480[m+h]+(calculatedforc36h63o9:639.4467).1h-nmr(600mhz,c5d5n)δ:δ4.98(2h,d,j=8.4hz,h-1'),4.64(2h,d,j=11.6hz,h-6'a),4.44(2h,dd,j=11.64.2hz,h-6'b),4.31(2h,m,h-3'),4.24(2h,m,h-4'),4.22(1h,t,j=6.0hz,h-24,24s-epimer),4.09(2h,m,h-2'),4.06(2h,m,h-5'),3.99(1h,t,j=6.6hz,h-24,24r-epimer),3.80(2h,m,h-12),3.41(2h,dd,j=11.44.2hz,h-3),1.51,1.50(3heach,s,h-26),1.36(3h,s,h-27),1.36,1.35(3heach,s,h-28),1.33(3h,s,h-21),1.31(6h,s,h-27,h-21),1.04,0.10(3heach,s,h-30)1.04,1.00(3heach,s,h-29),0.96,0.94(3heach,s,h-19),0.86,0.79(3heach,s,h-18).
13c-nmr(150mhz,c5d5n)δ:δ39.83and39.78(c-1),27.30and27.26(c-2),89.4and89.3(c-3),40.3and40.2(c-4),57.03and57.00(c-5),19.1and19.0(c-6),35.72and35.67(c-7),40.6and40.5(c-8),51.3and51.1(c-9),37.6and37.5(c-10),33.0and32.7(c-11),71.7and71.4(c-12),50.03and49.97(c-13),57.03and57.00(c-14),29.3and29.2(c-15),33.2and33.1(c-16),50.2and48.9(c-17),18.9and18.6(c-18),17.14and17.09(c-19),87.7and87.3(c-20),29.6(c-21,24s-epimer),27.50(c-21,24r-epimer),26.4and26.0(c-22),32.2and33.4(c-23),89.0(c-24,24s-epimer),86.1(c-24,24r-epimer),71.0and70.7(c-25),27.53(c-26,24r-epimer),27.1(c-26,24s-epimer),28.0(c-27,24r-epimer)27.7(c-27,24s-epimer),28.69and28.66(c-28),17.33and17.29(c-29),16.2and16.1(c-30),107.5(c-1'),76.3(c-2'),79.3(c-3'),72.4(c-4'),78.9(c-5'),63.59and63.57(c-6').
表征数据证实该产物为预期的人参皂苷衍生物(20s)-rh2e2,且该合成步骤不产生其他副产物。
实施例2
细胞毒性试验
将20(s)-rh2e2溶于dmso(二甲基亚砜)中,使其最终浓度为50mmol/l,使用前储存于-40℃。将正常人类肝细胞lo2和各类肿瘤细胞(肺癌细胞a549、肺癌细胞h1299、宫颈癌细胞hela、肝癌细胞hepg2、小鼠肺癌细胞llc-1和乳腺癌细胞mcf-7)接种于96孔板中,然后暴露于不同浓度的20(s)-rh2e2溶液或作为对照的dmso中72小时。随后,每个孔加入10μl的mtt试剂,4小时后加入100μl增溶缓冲液(0.01mol/l盐酸中加入10%十二烷基硫酸钠)培养过夜。用酶标仪在570nm处测量吸亮度,通过下述公式计算细胞存活率:
细胞存活率(%)=(atreated–abackground)/(acontrol–abackground)×100.
表1
试验结果如表1所示,人参皂苷衍生物20(s)-rh2e2对所有被测癌细胞均表现出细胞毒性,但对正常人类肝细胞lo2则没有毒性(剂量超过100μm)。而已知人参皂苷20(s)-rh2对正常人类细胞具有一定的毒性,证明人参皂苷20(s)-rh2经改性为人参皂苷衍生物20(s)-rh2e2后,其对正常细胞的毒性明显减小。
实施例3
人参皂苷衍生物20(s)-rh2e2对抑制llc-1异种移植瘤的生长的作用
采用香港中文大学获得的6-8周龄的雄性c57bl/6小鼠(所有动物护理及实验均获中国澳门特别行政区卫生监督署动物伦理委员会批准,并按照澳门科技大学《动物护理机构及使用委员会指引》进行),将51只小鼠皮下注射小鼠肺癌肿瘤llc-1,随机分为5组。将实施例1所制得的人参皂苷衍生物20(s)-rh2e2溶于混合溶液(其中聚乙二醇400(peg400):乙醇:ddh2o=6:1:3),腹腔注射,剂量为10mg/kg和20mg/kg,连续注射21天;并设置一组对照组(vehicle组)和一组20(s)-rh2组(剂量为10mg/kg),每天测量体重和肿瘤体积(长×宽2×1/2)。
如图1所示,与vhicle组相比,注射10mg/kg/day和20mg/kg/day的20(s)-rh2e2组对肿瘤生长的抑制作用呈剂量依赖性,分别达到35.62%(p<0.05)和55.49%(p<0.001);而相比于20(s)-rh2组,20(s)-rh2e2组对肿瘤生长的抑制作用有更大幅度的改善。
如图2所示,经人参皂苷衍生物20(s)-rh2e2处理后,荷瘤小鼠的体重没有发生明显的降低;如图3所示,经人参皂苷衍生物20(s)-rh2e2处理后,荷瘤小鼠的各重要器官的重量没有发生明显的降低,表明人参皂苷衍生物20(s)-rh2e2在体内不会产生毒性。
实施例4
人参皂苷衍生物20(s)-rh2e2对小鼠的致死剂量
c57bl/6小鼠连续7天口服320mg/kg20(s)-rh2e2(n=4),以评估其致死剂量和治疗安全窗口。
如图4所示,口服320mg/kg20(s)-rh2e2后,c57bl/6小鼠在7天内并未发生死亡;如图5所示,c57bl/6小鼠经7天给药治疗后,每组四只小鼠的体重均无下降。
实施例5
解剖实施例3中各组小鼠,采用苏木精和伊红(h&e)对小鼠肺组织进行染色,通过显微镜每隔50μm检查转移病灶。样品由leicadfc310fx摄像机成像,肺面积由leicaapplicationsuitv4.4软件计算,转移性肺面积百分比按转移面积/肺面积计算。
肿瘤转移是肺癌患者死亡的主要原因。如图6所示,与vehicle组相比,高剂量20(s)-rh2e2治疗组小鼠肺转移的数量明显减少。如图7所示,每组转移面积的平均值分别为8.74%(vehicle组),3.78%(10mg/kg20(s)-rh2e2),2.11%(20mg/kg20(s)-rh2e2)。如图8所示,vehicle组的肺组织染色较强,染色的llc-1细胞较正常肺成纤维细胞大,表明接种后的llc-1细胞从皮下背侧区域向肺组织转移。综上所述,人参皂苷衍生物20(s)-rh2e2具有较好的抗肿瘤活性,可抑制llc-1荷瘤小鼠的肿瘤生长和转移。
实施例6
人参皂苷衍生物20(s)-rh2e2对荷瘤小鼠肿瘤组织中α-enolase和stathmin表达量的影响
由于癌症的转移与一些蛋白的表达量增加相关,如α-enolase,stathmin等,通过检测这些蛋白质在llc-1细胞上的表达以显示20(s)-rh2e2的抗肿瘤转移作用。
将切割过的肿瘤组织进行固定,然后加工成石蜡块,切片成5μm(制作石蜡切片)。姜安装好的组织切片在二甲苯中脱腊,然后在分级乙醇和ddh2o中再水化。使用柠檬酸缓冲液(sigma)进行抗原修复,在99℃条件下放20分钟,然后在室温下加入3%的过氧化氢10分钟,阻断内源性过氧化物酶活性。α-enolase和stathmin抗体作为一抗4℃孵育过夜,再加入superpicturetmhrp聚合物偶联物(zymedlab.,invitrogen,carlsbad,ca)作为二抗,反应1小时。洗涤后,将载玻片置于3,3’-二氨基联苯胺(dab)基质溶液中孵育,直到产生所需的染色强度。然后用苏木精对玻片进行复染、脱水、贴装,采用leicadm2500显微镜对免疫染色进行观察。
如图9所示,与未处理的llc-1细胞相比,人参皂苷衍生物20(s)-rh2e2处理后的α-enolase和stathmin的表达被剂量依赖地抑制。此外,对经20(s)-rh2e2处理的llc-1异种移植模型收集的肿瘤组织进行免疫组织化学分析,结果显示它们有着相似的信号表达,20mg/kg20(s)-rh2e2处理后的α-enolase和stathmin的表达被显著抑制,由此证实人参皂苷衍生物20(s)-rh2e2具有抑制肿瘤转移的作用。
- 还没有人留言评论。精彩留言会获得点赞!