一类含基于喹喔啉并苯并三唑的稠环单元的给体-受体型聚合物及其制备方法与应用与流程
本发明属于有机光电领域,具体涉及到一类含基于喹喔啉并苯并三唑的稠环单元的给体-受体型聚合物及其制备方法与应用。
背景技术:
有机太阳能电池材料起步于上世纪90年代,是一类新型的可持续再生的低成本绿色能源材料,且易制备大面积柔性电池,有着巨大的应用潜力。有机场效应晶体管是以有机半导体材料作为有源层的晶体管器件,以其低成本、柔性可弯曲以及可制备大面积器件的特点而受到广泛关注。因此,在有机光电领域吸引了世界上众多的研究机构和科研团队的关注和投入,而开发新型高效稳定的材料更是有机光电领域中备受关注的焦点。
光电探测器是基于光电效应,将光信号转化为电信号的元器件,在光通讯、图像感应、生物医用传感、环境监测、气象学以及军事等领域有重要应用。目前常用的光电探测器通常基本是基于无机半导体材料,如si基、ge基以及ingaas等。
相比于无机材料,有机/聚合物材料成本低、吸收波长易于调节、可通过溶液法成膜、容易在不同基底附着等优点,使得有机/聚合物太阳电池和有机/聚合物光电探测器等有机电子元器件的制造工艺简单、生产成本低、质量轻、易于大面积制备、可实现柔性器件,具有广泛的应用前景。
技术实现要素:
为了克服现有技术存在的上述不足,本发明的目的是提供一类含基于喹喔啉并苯并三唑的稠环单元的给体-受体型聚合物及其制备方法与应用。本发明以吸电性较强的基于喹喔啉并苯并三唑的稠环单元为基础,与给电子单元共同构建一类新型的给体-受体型聚合物半导体材料。
本发明的首要目的在于提供一类新型的给体-受体型聚合物,这类聚合物由基于喹喔啉并苯并三唑的稠环单元和给电子单元组成。这类聚合物具有较窄的带隙和较宽的吸收光谱,且光谱容易通过结构进行调节,可用于制备高效率的有机/聚合物电子器件,特别是有机/聚合物光电探测器和有机/聚合物太阳电池。
本发明的另一目的在于提供上述含基于喹喔啉并苯并三唑的稠环单元的给体-受体型聚合物的制备方法。
本发明的再一目的在于提供上述含基于喹喔啉并苯并三唑的稠环单元的给体-受体型聚合物在有机光电领域的应用。
本发明的目的至少通过如下技术方案之一实现。
本发明提供的一类含基于喹喔啉并苯并三唑的稠环单元的给体-受体型聚合物(含基于喹喔啉并苯并三唑的稠环单元的d-π-a型聚合物),化学结构式满足以下通式:
式中,x、y为各单元的摩尔分数,其中0<x≤1,0≤y<1,x+y=1;n为重复单元数,n为大于1的整数;
r1、r2分别为碳原子数1~30的烷基、碳原子数3~30的环烷基、碳原子数为6~60芳香族烃基或碳原子数为3~60的芳香族杂环基;
ar为碳原子数6~100的芳香族烃基或碳原子数3~100的芳香族杂环基。
进一步地,所述的ar单元优选为以下结构或以下结构的卤代、氘代、烷基取代衍生物中的一种或多种:
其中r3为碳原子数1~30的烷基、碳原子数3~30的环烷基、碳原子数为6~60芳香族烃基或碳原子数为3~60的芳香族杂环基。
本发明提供一种制备上述一类含基于喹喔啉并苯并三唑的稠环单元的给体-受体型聚合物的方法,包括以下步骤:
(1)在惰性气体保护下,将含双烷基锡官能团的ar单元单体与基于喹喔啉并苯并三唑的稠环单元的a单元单体溶解在溶剂中,然后加入催化剂,得到混合液,加热进行stille聚合反应,得到聚合反应后的混合物;
(2)将步骤(1)所述混合物纯化后,得到所述含基于喹喔啉并苯并三唑的稠环单元的给体-受体型聚合物。
进一步地,步骤(1)所述溶剂包括但不限于甲苯、四氢呋喃、二甲苯、氯苯、二氯苯等中的至少一种;所述催化剂为stille聚合催化剂,所述催化剂包括但不限于四(三苯基膦)钯、三(二亚苄基丙酮)二钯/三(邻甲基苯基膦)中的至少一种;所述基于喹喔啉并苯并三唑的稠环单元的a单元单体为双溴代的基于喹喔啉并苯并三唑的稠环单元的a单元单体或双碘代的基于喹喔啉并苯并三唑的稠环单元的a单元单体;所述催化剂的用量为反应单体摩尔总量的2‰~3%;在所述混合液中,所述含双烷基锡官能团的ar单元单体摩尔量与基于喹喔啉并苯并三唑的稠环单元的a单元单体的摩尔量相等;所述含双烷基锡官能团的ar单元单体的结构式为如下所示结构式中的一种:
其中r3为碳原子数1~30的烷基、碳原子数3~30的环烷基、碳原子数为6~60芳香族烃基或碳原子数为3~60的芳香族杂环基。
所述基于喹喔啉并苯并三唑的稠环单元的a单元单体的结构通式如下所示:
式中,r1、r2分别为碳原子数1~30的烷基、碳原子数3~30的环烷基、碳原子数为6~60芳香族烃基或碳原子数为3~60的芳香族杂环基,x为溴原子或碘原子。
所述含双烷基锡官能团的ar单元单体与双溴代或碘代的基于喹喔啉并苯并三唑的稠环单元的a单元单体的用量满足含双烷基锡能团的单体总摩尔量与含双溴和/或双碘官能团的单体总摩尔量相等。
进一步地,步骤(1)所述stille聚合反应的温度为60-180℃,stille聚合反应的时间为0.5-72小时。
进一步地,步骤(2)所述纯化包括:将所述聚合反应后的混合物冷却至室温,滴加入搅拌中的甲醇中沉淀,过滤,干燥得粗产物,粗产物先后用甲醇、丙酮抽提,再用氯苯溶解,浓缩后再次沉析在甲醇溶液中,过滤,干燥,得到目标产物含基于喹喔啉并苯并三唑的稠环单元的给体-受体型聚合物。
优选地,本发明提供的含基于喹喔啉并苯并三唑的稠环单元的给体-受体型聚合物的制备方法,包括以下步骤:
(1)在惰性气体保护下,将含双烷基锡官能团的ar单元单体与基于喹喔啉并苯并三唑的稠环单元的a单元单体溶解在溶剂中,加热进行stille聚合反应,得到混合物;往所述混合物中加入烷基锡噻吩,进行第一次保温反应,然后加入溴代噻吩,进行第二次保温反应,得到反应液;
(2)将步骤(1)所述反应液纯化后,得到所述含基于喹喔啉并苯并三唑的稠环单元的给体-受体型聚合物。
进一步地,所述烷基锡噻吩的用量为反应单体摩尔总量的10~40%;所述溴代噻吩的用量为烷基锡噻吩摩尔量的1~20倍;所述第一次保温反应的时间为6~12小时;第二次保温反应的时间为6~12小时。
在步骤(1)中加入烷基锡噻吩和溴代噻吩然后进行保温反应的步骤不是非必须步骤,必要时可以省略。
本发明提供的含基于喹喔啉并苯并三唑的稠环单元的给体-受体型聚合物能够应用在制备电子器件中。所述电子器件包括有机/聚合物光电探测器、有机/聚合物太阳电池、有机/聚合物薄膜晶体管、有机/聚合物发光晶体管、有机/聚合物光电晶体管、有机/聚合物有机发光电化学电池中的一种以上。
本发明提供的含基于喹喔啉并苯并三唑的稠环单元的给体-受体型聚合物可以应用在有机/聚合物电子器件,特别是有机/聚合物光电探测器和有机/聚合物太阳电池中的应用。
本发明提供的含基于喹喔啉并苯并三唑的稠环单元的给体-受体型聚合物在制备电子器件中的应用,包括:将所述含基于喹喔啉并苯并三唑的稠环单元的给体-受体型聚合物或者与至少一种其他物质混合溶于有机溶剂中,然后通过旋涂、喷墨打印或印刷成膜,得到有机/聚合物电子器件的活性层;所述有机溶剂包括但不限于二甲苯、四氢呋喃、氯苯、二氯苯中的一种以上。
与现有技术相比,本发明具有如下优点和有益效果:
(1)本发明提供的含基于喹喔啉并苯并三唑的稠环单元的给体-受体型聚合物,其d单元和a单元之间直接连接,平面性强且给体-受体效应更加显著;拥有更宽的吸收范围和较窄的带隙;溶解性易于通过苯并三唑与喹喔啉上连接的烷基链进行调节;
(2)本发明提供的含基于喹喔啉并苯并三唑的稠环单元的给体-受体型聚合物具有较高的电子迁移率,有利于制备高效率的有机电子器件,特别是有机/聚合物电池和有机/聚合物光电探测器;
(3)本发明的基于喹喔啉并苯并三唑的给体-受体化合物的制备路线短,原料易得,方法简单,可被高产率制备,可以推广应用工业中的放大合成与生产。
附图说明
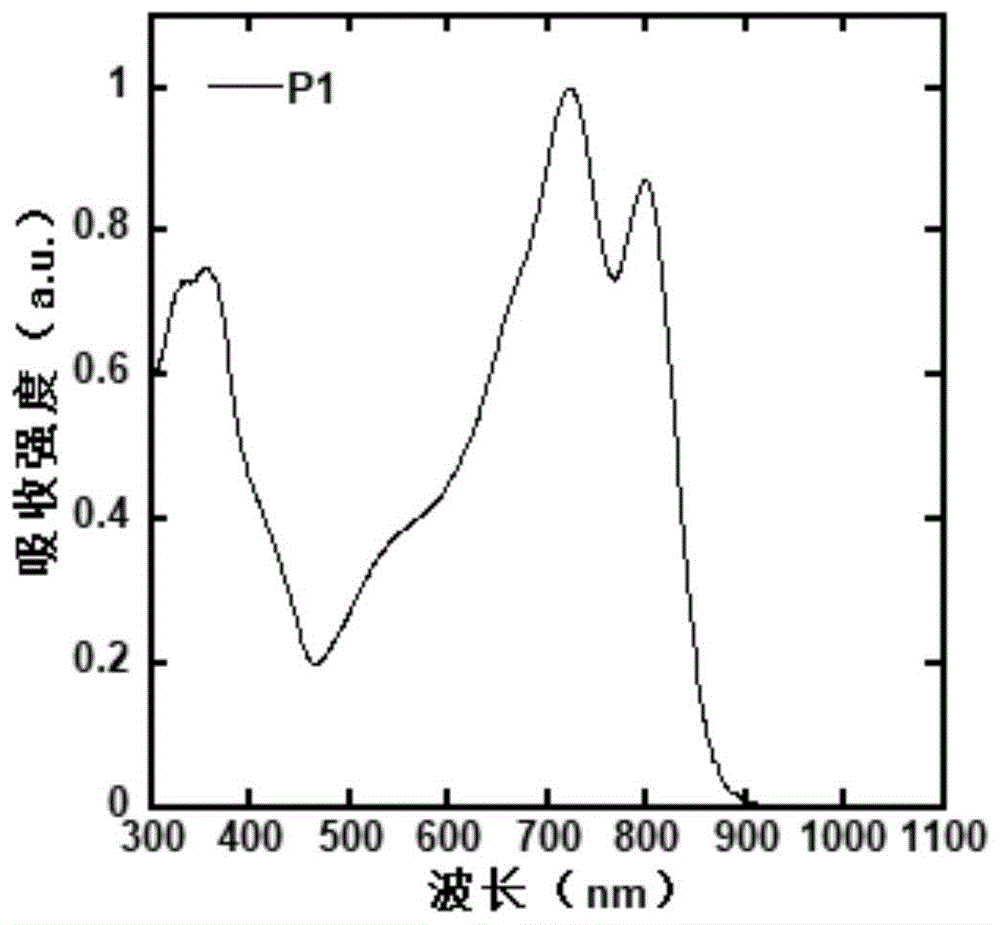
图1为聚合物p1在石英片上固态薄膜的吸收光谱;
图2为聚合物p3在石英片上固态薄膜的吸收光谱;
图3为聚合物p6在石英片上固态薄膜吸收光谱和在石英比色皿内以氯仿做溶剂的溶液吸收光谱;
图4为基于聚合物p3的聚合物光电探测器器件暗电流-电压(jd-v)曲线;
图5为基于聚合物p3的聚合物光电探测器器件在-0.1v偏压下的探测率。
具体实施方式
以下结合实例对本发明的具体实施作进一步说明,但本发明的实施和保护不限于此。需指出的是,以下若有未特别详细说明之过程,均是本领域技术人员可参照现有技术实现或理解的。所用试剂或仪器未注明生产厂商者,视为可以通过市售购买得到的常规产品。
实施例1
化合物7的制备
(1)化合物1的制备
氮气保护下,将苯并噻二唑(6.81g,50mmol)溶于200ml浓硫酸中,在60℃下将n-溴代丁二酰亚胺(18.71g,105mol)分三批加入,搅拌12小时。将反应液倒入900ml冰水中,抽滤,滤渣先后用去离子水、甲醇、正己烷各洗涤三遍。重复此操作3次,将最后得到的滤渣烘干,得到固体产物,产率69%。1hnmr、13cnmr、ms和元素分析结果表明所得到的化合物为目标产物。
(2)化合物2的制备
氮气保护下,将化合物1(5.0g,17mmol)、还原铁粉(11.40g,204mmol)溶于100ml无水乙酸中,将反应液加热至150℃反应3小时。冷却后,加入硅藻土抽滤,抽滤得到的滤液加入水和二氯甲烷萃取,将得到的有机相层旋干后再用二氯甲烷和水反复萃取两次,旋干后得到固体产物,产率92%。1hnmr、13cnmr、ms和元素分析结果表明所得到的化合物为目标产物。
(3)化合物3的制备
氮气保护下,将化合物2(4.0g,15mmol)溶于100ml无水乙酸中,将亚硝酸钠(1.56g,22.56mmol)溶于20ml去离子水中,通过恒压滴液漏斗逐滴加入到反应体系中。全部滴加完毕后反应6小时。将反应液抽滤,滤渣用去离子水洗涤三遍,将得到的滤渣烘干后得到固体产物,产率77%。1hnmr、13cnmr、ms和元素分析结果表明所得到的化合物为目标产物。
(4)化合物4的制备
氮气保护下,将化合物3(5.54g,20.0mmol)和碳酸钾(5.53g,40.0mmol)溶于200ml的经过硫酸镁除水的n,n-二甲基甲酰胺与5ml的二甲基亚砜的混合溶剂中,将反应液加热到80℃反应1小时,再在氮气保护下加入2-正丁基-1-溴辛烷(5.98g,24.0mmol),将反应液加热到90℃反应12小时。冷却后,将反应液倒入冷水中,用水和二氯甲烷萃取产物,重复3次。用柱层析法纯化,以200~300目硅胶为固定相,洗脱剂的极性是石油醚/二氯甲烷(4:1),得到淡黄色油状液体产物,产率72%。1hnmr、13cnmr结果表明所得到的化合物为目标产物。
(5)化合物5的制备
氮气保护下,在三口烧瓶中加入浓硫酸(40ml)与发烟硝酸(40ml)的混酸,将三口烧瓶置于冰浴条件下冷却至0℃,将化合物4(4.45g,10.0mmol)分4次,每次间隔10分钟地缓慢加入到混酸中。置于冰浴环境下反应1小时后将三口烧瓶移入室温继续反映6小时。将反应液倒入冰水中,抽滤,将滤渣用水清洗3次。之后用柱层析法纯化,以200~300目硅胶为固定相,洗脱剂的极性是石油醚/二氯甲烷(2:1),得到淡黄色固体产物,产率55%。1hnmr、13cnmr、ms和元素分析结果表明所得到的化合物为目标产物。
(6)化合物6的制备
氮气保护下,将化合物5(1.07g,2.0mmol)与还原铁粉(1.34g,24.0mmol)溶于100ml无水乙酸中,在60℃下反应4小时。冷却后将反应液倒入水中,用二氯甲烷和水萃取3次,之后用柱层析法纯化,以200~300目硅胶为固定相,洗脱剂的极性是石油醚/二氯甲烷(2:1),得到淡灰色固体产物,产率91%。1hnmr、13cnmr、ms和元素分析结果表明所得到的化合物为目标产物。
(7)化合物7的制备
氮气保护下,将化合物(0.72g,1.50mmol)溶于60ml无水乙酸中,再将丁二酮(274mg,3.18mmol)逐滴加入到反应液中,在50℃下反应12小时。冷却后将反应液倒入水中,用二氯甲烷和水萃取3次,之后用柱层析法纯化,以200~300目硅胶为固定相,洗脱剂的极性是石油醚/二氯甲烷(1:2)。再用通过甲醇重结晶得到黄色固体产物,产率为81%。1hnmr、13cnmr、ms和元素分析结果表明所得到的化合物为目标产物。
合成化合物1~7的化学反应方程式如下所示:
实施例2
化合物11的制备
(1)化合物8的制备
化合物3的做法参考实施例1。氮气保护下,将化合物3(5.54g,20.0mmol)和碳酸钾(5.53g,40.0mmol)溶于180ml的经过硫酸镁除水的n,n-二甲基甲酰胺与5ml的二甲基亚砜的混合溶剂中,将反应液加热到85℃反应1小时,再在氮气保护下加入1-溴己烷(3.32g,24.0mmol),将反应液加热到90℃反应8小时。冷却后,将反应液倒入冷水中,用水和二氯甲烷萃取产物,重复3次。用柱层析法纯化,以200~300目硅胶为固定相,洗脱剂的极性是石油醚/二氯甲烷(体积比为4:1),得到淡黄色油状液体产物,产率68%。1hnmr、13cnmr结果表明所得到的化合物为目标产物。
(2)化合物9的制备
氮气保护下,在三口烧瓶中先加入三氟甲磺酸(37.51g,250.0mmol),将三口烧瓶置于冰浴中冷却至0℃,在逐滴加入浓硫酸(6.30g,100.0mmol)。将反应体系在冰浴中冷却30分钟后提出到室温,在室温下将化合物(3.61g,10.0mmol)分6次地加入到反应体系中,每次间隔5分钟。之后将反应液加热到50℃反应6小时。冷却后,将反应液倒入大量冰水中,抽滤,将滤渣用水清洗3次。之后用柱层析法纯化,以200~300目硅胶为固定相,洗脱剂的极性是石油醚/二氯甲烷(3:2),得到淡黄色固体产物,产率47%。1hnmr、13cnmr结果表明所得到的化合物为目标产物。
(3)化合物10的制备
氮气保护下,将化合物9(2.26g,5.0mmol)与还原铁粉(3.36g,60.1mmol)溶于200ml无水乙酸中,在60℃下反应4小时。冷却后将反应液倒入水中,用二氯甲烷和水萃取3次,之后用柱层析法纯化,以200~300目硅胶为固定相,洗脱剂的极性是石油醚/二氯甲烷(3:2),得到灰色固体产物,产率88%。1hnmr、13cnmr、ms和元素分析结果表明所得到的化合物为目标产物。
(4)化合物11的制备
氮气保护下,将化合物10(976mg,2.5mmol)溶于120ml无水乙醇中,再将二(2-噻吩基)乙二酮(666mg,3.0mmol)逐滴加入到反应体系中。再加入10mg的对甲苯磺酰胺做催化剂,在回流反应条件下反应12小时。冷却后将反应液倒入水中,用二氯甲烷和水萃取3次,之后用柱层析法纯化,以200~300目硅胶为固定相,洗脱剂的极性是石油醚/氯仿(1:1)。再用通过甲醇重结晶得到黄色固体产物,产率为75%。1hnmr、13cnmr、ms和元素分析结果表明所得到的化合物为目标产物。
合成化合物8~11的化学反应方程式如下所示:
实施例3
化合物12的制备
氮气保护下,将化合物10(976mg,2.5mmol)溶于120ml无水乙酸中,再将丁二酮(451mg,5.24mmol)逐滴加入到反应体系中。在50℃下反应12小时。冷却后将反应液倒入水中,用二氯甲烷和水萃取3次,之后用柱层析法纯化,以200~300目硅胶为固定相,洗脱剂的极性是石油醚/二氯甲烷(体积比为2:3),最终得到淡黄色固体产物,产率为78%。1hnmr、13cnmr和元素分析结果表明所得到的化合物为目标产物。
实施例4
化合物13的制备
氮气保护下,将噻吩(4.21g,50mmol)溶于250ml无水四氢呋喃中,降温至-5℃,滴加正丁基锂(8ml,200mmol),-5℃下搅拌2小时。注入三甲基氯化锡的四氢呋喃溶液(450ml,450mmol),自然升至室温反应12小时。减压蒸馏除去四氢呋喃后,用二氯甲烷萃取产物,去离子水洗3遍后,旋干二氯甲烷。用甲醇重结晶得到白色固体产物,产率86%。1hnmr、13cnmr、ms和元素分析结果表明所得到的化合物为目标产物。
实施例5
化合物15的制备
(1)化合物14的制备
氮气气氛中,冰浴下,将二噻吩并环戊二烯(1.78g,10mmol)、叔丁醇钠(2.88g,30mmol)、溴代十六烷(6.67g,22mmol)加入100ml四氢呋喃中,搅拌反应24小时。减压旋干四氢呋喃,用二氯甲烷萃取,饱和氯化钠水溶液洗涤3遍,旋干二氯甲烷。粗产物用石油醚作淋洗剂柱层析提纯,得到白色固体产物,产率90%。1hnmr、13cnmr、ms和元素分析结果表明所得到的化合物为目标产物。
(2)化合物15的制备
氮气保护下,将化合物19(3.14g,5mmol)溶于150ml无水四氢呋喃中,降温至-5℃,滴加正丁基锂(8ml,20mmol),-5℃下搅拌2小时。注入三甲基氯化锡的四氢呋喃溶液(45ml,45mmol),自然升至室温反应12小时。减压蒸馏除去四氢呋喃后,用二氯甲烷萃取产物,去离子水洗3遍后,旋干二氯甲烷。用异丙醇重结晶得到白色固体产物,产率87%。1hnmr、13cnmr、ms和元素分析结果表明所得到的化合物为目标产物。
合成化合物19~20的化学反应方程式如下所示:
实施例6
化合物17的制备
(1)化合物16的制备
氮气保护下,将3,3’-二溴2,2’-联噻吩(3.24g,10mmol)、2-辛基十二胺(3.57g,12mmol)叔丁醇钠(2.40g,25mmol)、三(二亚苄基丙酮)二钯(0.46g,0.5mmol)、2,2’-双-(二苯膦基)-1,1’-联萘(0.62g,1mmol)加入100ml无水甲苯中。加热至100℃反应12小时后,用饱和氯化钠水溶液洗涤3遍,旋干有机层的溶剂后,粗产物用石油醚作淋洗剂柱层析提纯,得到无色油状产物,产率70%。1hnmr、13cnmr、ms和元素分析结果表明所得到的化合物为目标产物。
(2)化合物17的制备
化合物22的反应及提纯方法与化合物20类似,得到浅黄色油状产物,产率84%。1hnmr、13cnmr、ms和元素分析结果表明所得到的化合物为目标产物。
合成化合物21~22的化学反应方程式如下所示:
实施例7
化合物20的制备
(1)化合物18的制备
氮气保护下,将噻吩(8.41g,100mmol)溶于100ml无水四氢呋喃中,降温至-60℃,滴加正丁基锂(40ml,100mmol),然后在-60℃下搅拌2小时。之后向反应体系中加入溴代异辛烷(19.31g,100mmol),自然升至室温反应12小时。使用旋转蒸发仪除去四氢呋喃后,用石油醚萃取产物,去离子水洗3遍后,旋干二氯甲烷,之后通过减压蒸馏的方法进一步提纯,产率48%。1hnmr、13cnmr、ms和元素分析结果表明所得到的化合物为目标产物。
(2)化合物19的制备
氮气保护下,将化合物18(9.82g,50.0mmol),溶于150ml无水四氢呋喃中,降温至-10℃,滴加正丁基锂(40ml,100mmol),自然升至室温后在55℃下油浴加热,在55℃下反应2小时后在将反应体系置于冰浴中,加入苯并[1,2-b:4,5-b']二噻吩-4,8-二酮(3.97g,18.0mmol),之后再移入室温反应20分钟后,将二氯化锡(22.0g,116.1mmol)溶于25ml浓盐酸,加入到反应体系中。之后在室温下反应12小时。将反应液倒入冰水中,用二氯甲烷萃取,饱和氯化钠水溶液洗涤3遍,旋干二氯甲烷。之后用柱层析法纯化,以200~300目硅胶为固定相,洗脱剂的极性是石油醚/二氯甲烷(9:1),最终得到黄色固体产物,产率为66%。1hnmr、13cnmr和元素分析结果表明所得到的化合物为目标产物。
(3)化合物20的制备
氮气保护下,将化合物19(28.95g,50.0mmol)溶于250ml无水四氢呋喃中,降温至-10℃,滴加正丁基锂(8ml,20mmol),之后在-10℃下搅拌2小时。注入三甲基氯化锡的四氢呋喃溶液(45ml,45mmol),自然升至室温反应12小时。通过旋转蒸发仪除去四氢呋喃后,用二氯甲烷萃取产物,去离子水洗3遍后,旋干二氯甲烷。先用石油醚重结晶,再用无水醇重结晶,再用无水乙醇重结晶最终得到淡黄色固体,产率75%。1hnmr、13cnmr、ms和元素分析结果表明所得到的化合物为目标产物。
实施例8
聚合物p1的制备
氮气保护下,将化合物12(88.24mg,0.2mmol)和化合物19(180.92mg,0.2mmol)溶解在4.4ml无水氯苯中,再加入四(三苯基膦)钯(8mg)。在140℃下反应24小时,用2-(三丁基锡)噻吩(20mg)进行第一次封端,反应6小时后,用2-溴噻吩(30mg)进行第二次封端,继续反应6小时。结束反应,待反应降到室温后,将反应液沉析在甲醇中,过滤得到的聚合物先后用甲醇、丙酮、正己烷、氯仿通过索氏提取器进行抽提,每次抽提持续8小时。最后将氯仿抽提得到的溶液通浓缩,沉析在甲醇中,过滤之后干燥,得到纤维状聚合物。1hnmr和元素分析结果表明所得到的化合物为目标产物。
合成聚合物p1的化学反应方程式如下所示:
实施例9
聚合物p2的制备
聚合物p2的反应及提纯方法与聚合物p1类似,同样得到纤维状聚合物。1hnmr和元素分析结果表明所得到的化合物为目标产物。反应方程式如下:
实施例10
聚合物p3的制备
聚合物p3的反应及提纯方法与聚合物p1类似,同样得到纤维状聚合物。1hnmr和元素分析结果表明所得到的化合物为目标产物。
反应方程式如下:
实施例11
聚合物p4的制备
氮气保护下,将化合物12(88.24mg,0.2mmol)和化合物17(157.09mg,0.2mmol)溶解在4ml无水邻二氯苯中,再加入四(三苯基膦)钯(8mg)。在140℃下反应48小时,用2-(三丁基锡)噻吩(20mg)进行第一次封端,反应6小时后,用2-溴噻吩(30mg)进行第二次封端,继续反应6小时。结束反应,待反应降到室温后,将反应液沉析在甲醇中,过滤得到的聚合物先后用甲醇、丙酮、正己烷、氯仿通过索氏提取器进行抽提,每次抽提持续8小时。最后将氯仿抽提得到的溶液通浓缩,沉析在甲醇中,过滤之后干燥,得到纤维状聚合物。1hnmr和元素分析结果表明所得到的化合物为目标产物。
反应方程式如下:
实施例12
聚合物p5的制备
氮气气氛中,将化合物12(88.24mg,0.2mmol),化合物15(190.57mg,0.2mmol)、三(二亚苄基丙酮)二钯(4mg)和三(邻甲基苯基)磷(8mg)溶解在3.6ml无水氯苯中。140℃下反应48小时,用2-(三丁基锡)噻吩(20mg)进行第一次封端,反应6小时后,用2-溴噻吩(30mg)进行第二次封端,继续反应6小时。结束反应,待反应降到室温后,将反应液沉析在甲醇中,过滤得到的聚合物先后用甲醇、丙酮进行索氏抽提,以氯仿为洗脱剂进行柱层析,干燥,得到纤维状聚合物。1hnmr和元素分析结果表明所得到的化合物为目标产物。
合成聚合物p5的化学反应方程式如下所示:
实施例13
聚合物p6的制备
聚合物p6的反应及提纯方法与皆与聚合物p5的方法类似,同样得到纤维状聚合物。1hnmr和元素分析结果表明所得到的化合物为目标产物。
反应方程式如下:
实施例14
聚合物吸收光谱的测试
图1、图2、图3分别为聚合物p1、p3、p6在石英片上或氯苯溶液中薄膜的紫外–可见–近红外吸收光谱。由图1可知,p1在300~900nm的宽波长范围内均有吸收。由图2可知,p3在300~1000nm的宽波长范围内均有吸收。由图3可知,p3在300~1200nm的宽波长范围内均有吸收。由这三张图可知,聚合物p1、p3、p6在溶液和薄膜均展现出宽的吸收范围,其薄膜吸收最大吸收边带值分别在900纳米、1000nm、1200nm左右。
实施例15
聚合物太阳电池器件的制备
取预先做好的方块电阻为15ω的氧化铟锡(ito)玻璃,依次用丙酮,洗涤剂,去离子水和异丙醇超声清洗,等离子处理10分钟。在ito上旋涂参杂有聚苯乙烯磺酸的聚乙氧基噻吩(pedot:pss)膜,厚度为40nm。pedot:pss膜在氮气气氛的手套箱里80℃下干燥8小时。随后将质量比为1:1.5的聚合物p1和pc71bm的邻二氯苯溶液(1wt.%)旋涂在pedot:pss膜的表面,厚度为100nm。然后在活性层上旋涂一层5nm厚的pfn-br薄膜。最后蒸镀100nm厚的金属al层,器件结构为ito/pedot:pss/p1:pc71bm/pfn-br/al。
基于聚合物p1为电子给体材料的聚合物太阳电池拥有从300nm到1000nm的较宽的吸收,如图1所示。经由标准模拟灯体系在1个自然光照强度下测试其光电转化效率,器件的光电转换效率(pce)为5.1%,具有较好的光电转换性能。
实施例16
聚合物光电探测器的制备
取预先做好的方块电阻为15ω的氧化铟锡(ito)玻璃,依次用丙酮,洗涤剂,去离子水和异丙醇超声清洗,等离子处理10分钟。在ito上旋涂参杂有聚苯乙烯磺酸的聚乙氧基噻吩(pedot:pss)膜,厚度为25nm。pedot:pss膜在氮气气氛的手套箱里里80℃下干燥8小时。随后将质量比为1:1.2的聚合物p3和pc61bm的氯苯溶液(1wt.%)旋涂在pedot:pss膜的表面,厚度为100nm。然后在活性层上旋涂一层5nm厚的pfn-br薄膜。最后蒸镀100nm厚的金属al层,器件结构为ito/pedot:pss/p3:pc61bm/pfn-br/al。
基于聚合物p3为电子给体材料的聚合物光电探测器拥有从300nm到1000nm的较宽的响应,如图2所示,器件的电流电压数据由电流电压源(keithley2400)在-2v到2v的范围内,850nm的光照下扫描得到,在-0.1v电压时暗电流jd低至2.5×10-8a/cm2,其曲线如图4所示,850纳米波长处探测率可达1.09×1012jones,可以看到基于p3的器件有较低的暗电流与较高的开关比。其曲线如图5所示,可以看到基于p3的器件在宽波长范围内均有响应且光电探测率较高。
以上实施例仅为本发明较优的实施方式,仅用于解释本发明,而非限制本发明,本领域技术人员在未脱离本发明精神实质下所作的改变、替换、修饰等均应属于本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!