丁酸梭菌固体菌剂及其制备方法与流程
1.本发明涉及微生物领域,具体涉及一种丁酸梭菌固体菌剂及其制备方法。
背景技术:
2.丁酸梭菌(clostridium butyricum),即丁酸梭状芽孢杆菌,是存在于人和畜禽肠道的一种厌氧益生菌,可以改善宿主肠道细菌生态系统的平衡,被作为微生态制剂广泛应用于医药领域和饲料行业当中。由日本千叶医科大学宫入近治博士于1933年最先发现报导,不但可以抑制大肠杆菌、沙门氏杆菌等致病菌的生长,还可以促进肠道中有益菌如乳酸菌的生长。我国于1993年从日本引入,研究时间仅30多年,对于丁酸梭菌的筛选和培养方法还有很多探索的空间。以前的研究已经表明,丁酸梭菌的急性口服毒性试验和ames试验是安全的,并且由于其形成孢子的能力,能够抵抗胃肠道酸性环境。研究发现,丁酸梭菌具备良好的胃肠道黏附性,可以通过空间占位抑制鳗弧菌等致病菌,并且同时产生各种有益生物,以增强宿主的免疫功能。在使用过程中丁酸梭菌主要存在于的活菌制剂的状态。
3.随着发酵饲料行业发展,市场对饲料的需求供不应求,需要大量菌剂才能满足市场需求,目前市场固体菌剂多数是以喷雾方式制备固体菌剂,此方法菌体芽孢率损失率较高,且喷雾时间长、成本高。
技术实现要素:
4.本发明的目的是为了克服现有技术存在的喷雾方式制备丁酸梭菌的固体菌剂时损失率高、时间长和成本高的问题,提供一种丁酸梭菌固体菌剂及其制备方法,该方法具有损失率低、简单快速和成本低廉的优点。
5.为了实现上述目的,本发明第一方面提供一种丁酸梭菌固体菌剂的制备方法,该方法包括:将丁酸梭菌菌体在载体存在的情况下使用流化床制备丁酸梭菌固体菌剂。
6.优选地,所述丁酸梭菌菌体以菌泥的形式提供。
7.更优选地,所述丁酸梭菌菌泥与所述载体的重量比为1:1-10。
8.优选地,所述载体包含生物质材料和粘土。
9.优选地,所述载体中生物质材料和粘土的重量比为1:0.2-5。
10.优选地,所述流化床的工作条件使得所得丁酸梭菌固体菌剂中水分含量≤10%。
11.优选地,所述流化床的工作条件包括:进口温度为70-100℃,出口温度30-50℃,干燥时间10-40min。
12.本发明第二方面提供如上所述的方法制备得到的丁酸梭菌固体菌剂。
13.本发明使用流化床干燥的方法,不仅减少能耗,同时能降低温度对菌体的伤害,保护菌体的活性。
14.在本发明优选的实施方式中,通过采用优选的流化床工作条件、优选的载体以及优选的菌泥:载体的比例,能够得到流动性好、活菌数高、芽孢率高的丁酸梭菌固体菌剂,该固体菌剂还具有保藏周期长的优点。
具体实施方式
15.在本文中所披露的范围的端点和任何值都不限于该精确的范围或值,这些范围或值应当理解为包含接近这些范围或值的值。对于数值范围来说,各个范围的端点值之间、各个范围的端点值和单独的点值之间,以及单独的点值之间可以彼此组合而得到一个或多个新的数值范围,这些数值范围应被视为在本文中具体公开。
16.本发明一方面提供一种丁酸梭菌固体菌剂的制备方法,该方法包括:将丁酸梭菌菌体在载体存在的情况下使用流化床制备丁酸梭菌固体菌剂。
17.在本发明中,所述丁酸梭菌可以是本领域常规使用的丁酸梭菌,其种类不受特别的限制。
18.在本发明中,用于制备丁酸梭菌固体菌剂的菌体的形式可以不受特别的限制,优选地,所述丁酸梭菌菌体以发酵液或者菌泥的形式提供。
19.在本发明中,所述发酵液可以是丁酸梭菌经过活化、扩培或发酵得到的含丁酸梭菌的液体,为了便于工业生产,往往使用发酵得到的含丁酸梭菌的液体(或相应的菌泥)制备丁酸梭菌固体菌剂,本发明中对于活化或者扩培得到的含丁酸梭菌的液体不进行介绍,以下内容涉及的发酵液特指经过发酵得到步骤的发酵液。
20.在本发明的一种优选的实施方式中,所述丁酸梭菌菌体的制备方法包括:将丁酸梭菌菌种依次进行活化、扩培、发酵和可选的固液分离,得到丁酸梭菌菌体。
21.应当理解的是,当经过固液分离时,得到的是菌泥形式的丁酸梭菌菌体。
22.在本发明中,所述活化的方法可以是本领域常规使用的方法,比如,可以将保存在超低温冰箱中的丁酸梭菌油管自然解冻,然后以0.1-1体积%的接种量接种到种子培养基中进行活化,得到一级种子液。
23.在本发明中,所述种子培养基可以为本领域常规使用的培养基,优选地,所述种子培养基包含酵母浸粉、牛肉浸膏、胰蛋白胨、葡萄糖、可溶性淀粉、氯化钠、三水合乙酸钠和l-半胱氨酸盐酸盐;所述种子培养基的ph为6-7。
24.优选地,以所述种子培养基的总重量为基准,所述酵母浸粉的含量为0.2-0.4重量%,所述牛肉浸膏的含量为0.5-1.5重量%,所述胰蛋白胨的含量为0.5-1.5重量%,所述葡萄糖的含量为0.3-0.8重量%,所述可溶性淀粉的含量为0.02-0.2重量%,所述氯化钠的含量为0.3-0.8重量%,所述三水合乙酸钠的含量为0.1-0.5重量%,所述l-半胱氨酸盐酸盐的含量为0.01-0.02重量%。
25.在本发明中,优选地,所述活化的条件包括:温度为34-38℃,厌氧培养。
26.在本发明中,所述活化的时间可以不受特别的限制,优选为12-16h。
27.优选地,当一级种子液的od达到3.5以上,ph在4.5-5.5范围内,结束活化。
28.在本发明中,所述扩培的方法可以是本领域常规使用的方法,比如,可以将一级种子液按照0.1-1体积%的接种量接种到扩培培养基中,进行扩培,得到二级种子液。
29.在本发明中,所述扩培培养基可以为本领域常规使用的培养基,优选地,所述扩培培养基为如上所述的种子培养基。
30.在本发明中,优选地,所述扩培的条件包括:温度为34-38℃,厌氧培养。
31.在本发明中,所述扩培的时间可以不受特别的限制,优选为14-20h。
32.优选地,当二级种子液的od达到3.5以上,ph在4.5-5.5范围内,结束扩培。
33.在本发明中,所述发酵的方法可以是本领域常规使用的方法,比如,可以将二级种子液按照0.1-0.5体积%的接种量接种到发酵培养基中,进行发酵,得到发酵液。
34.在本发明中,所述发酵培养基可以为本领域常规使用的培养基,优选地,发酵在发酵培养基中进行,所述发酵培养基包含可溶性淀粉、酵母浸粉、硫酸铵、氯化钠、磷酸二氢钾、硫酸镁、硫酸锰和碳酸钙;所述种子培养基的ph为6-7。
35.优选地,以所述发酵培养基的总重量为基准,所述可溶性淀粉的含量为1-4重量%,所述酵母浸粉的含量为0.5-1.5重量%,所述硫酸铵的含量为2-4重量%,所述氯化钠的含量为1-3重量%,所述磷酸二氢钾的含量为1-2重量%,所述硫酸镁的含量为0.01-0.04重量%,所述硫酸锰的含量为0.01-0.04重量%,所述碳酸钙的含量为0.2-0.4重量%。
36.优选地,所述发酵的条件包括:温度为35-39℃,厌氧培养。
37.在本发明中,所述发酵可以在发酵罐中进行,本领域技术人员可以根据实际情况调整搅拌转速。
38.在本发明中,所述发酵的过程中可以通入氮气,在丁酸梭菌产气后停止氮气的通入。
39.在本发明中,所述发酵的时间可以不受特别的限制,优选为12-18h。
40.优选地,当发酵的od达到6以上,ph在4-5范围内,结束发酵。
41.在采用上述优选的活化、扩培和发酵条件和相应的培养基的条件下,能够提高制备得到的固体菌剂的品质。
42.在本发明中,得到的发酵液通过固液分离能够得到菌泥,其中,固液分离的方法可以是本领域常规使用的方法,比如可以通过离心和/或过滤。
43.在本发明中,优选地,所述丁酸梭菌菌体以菌泥的形式提供。
44.在本发明中,所述丁酸梭菌菌泥与所述载体的重量比可以在较宽的范围内选择,优选地,所述丁酸梭菌菌泥与所述载体的重量比为1:1-10,例如可以为1:1、1:2、1:3、1:4、1:5、1:6、1:7、1:8、1:9、1:10以及任意两个值之间组成的任意范围,更优选为1:2-5。在所述优选的条件下,能够提高固体菌剂的品质。
45.在本发明中,所述载体的种类可以不受特别的限制,优选地,所述载体包含生物质材料和粘土。
46.优选地,所述生物质材料选自淀粉、豆粕粉和菊粉中的至少一种。
47.其中,所述淀粉可以为本领域常规使用的淀粉,比如可以为玉米淀粉。
48.优选地,所述粘土为硅藻土和/或蒙脱石。
49.在本发明中,所述载体中生物质材料和粘土的重量比可以在较宽的范围内选择,优选地,所述载体中生物质材料和粘土的重量比为1:0.1-5,例如可以为1:0.1、1:0.2、1:0.4、1:0.6、1:0.8、1:1、1:2、1:3、1:4、1:5以及任意两个值之间组成的任意范围,更优选为1:0.2-0.8。
50.在本发明中,所述流化床的工作条件可以是本领域常规使用的工作条件,优选地,所述流化床的工作条件使得所得丁酸梭菌固体菌剂中水分含量≤10%。
51.优选地,所述流化床的工作条件包括:进口温度70-100℃,出口温度30-50℃,干燥时间10-40min。进一步优选地,所述流化床的工作条件包括:进口温度70-90℃,出口温度30-45℃,干燥时间10-40min。在所述优选的条件下,能够提高固体菌剂的品质。
52.本发明另一方面提供如上所述的方法制备得到的丁酸梭菌固体菌剂。
53.优选地,所述丁酸梭菌固体菌剂的参数包括:水分含量≤10%,活菌数≥1*10
11
cfu/g丁酸梭菌固体菌剂,芽孢率≥95%。
54.在本发明中,所述丁酸梭菌固体菌剂的参数评价参见t/cswsl006-2019。
55.以下将通过实施例对本发明进行详细描述。
56.以下实施例中,使用的丁酸梭菌购自中国工业微生物菌种保藏管理中心,菌株保藏编号:cicc23847。
57.以下实施例中,未作特殊说明的情况下,原料为商购获得。
58.所述丁酸梭菌固体菌剂的参数评价参见t/cswsl 006-2019。
59.制备例1
60.本制备例用于说明丁酸梭菌菌泥的制备方法
61.活化:将保存在超低温冰箱中丁酸梭菌油管提前0.5h自然解冻,以接种量0.5体积%接种到种子培养基中。在36
±
2℃条件下培养,厌氧瓶静置培养14h,od值长至4左右,ph为5左右,活化结束,得到的一级种子液中活菌数为1.0*108cfu/ml。
62.扩培:以接种量为0.4体积%,将一级种子液接种到种子培养基中,并在36
±
2℃条件下厌氧箱培养18h,od值长至4左右,ph为5左右,扩培结束,得到的二级种子液中的活菌数5.0*108cfu/ml。
63.发酵:以接种量为0.2体积%,将二级种子液接种到发酵培养基中,并在37
±
2℃条件下50l发酵罐中进行培养,控制转速100rppm,前4个小时充入氮气,然后停止充入氮气并继续培养10h左右,发酵液的od值长至6-7,ph为4.5左右,发酵罐培养结束,得到的发酵液中的活菌数8.5*109cfu/ml。
64.菌泥的制备:使用高速离心机对发酵液进行离心,转速为8000rpm,离心时间为5min,得到菌泥。
65.其中,所述种子培养基中,酵母浸粉0.3重量%,牛肉浸膏1重量%,胰蛋白胨1重量%,葡萄糖0.5重量%,可溶性玉米淀粉0.1重量%,氯化钠0.5重量%,三水合乙酸钠0.3重量%,l-半胱氨酸盐酸盐0.015重量%,初始ph6.5
±
0.2。
66.其中,所述发酵培养基中,可溶性玉米淀粉2重量%,酵母浸粉1重量%,硫酸铵3重量%,氯化钠2重量%,磷酸二氢钾1.5重量%,硫酸镁0.02重量%,硫酸锰0.02重量%,碳酸钙0.3重量%,初始ph6.5
±
0.2。
67.实施例1
68.本实施例用于说明本发明所述的丁酸梭菌固体菌剂的制备方法
69.100g菌泥+300g载体(玉米淀粉与硅藻土的重量比为2:1),流化床烘干:进口温度80℃,出口温度37℃,干燥时间20min。
70.将得到的固体菌剂在室温条件下保存18个月,测定并记录其活菌数变化,具体结果见表1。
71.实施例2
72.本实施例用于说明本发明所述的丁酸梭菌固体菌剂的制备方法
73.100g菌泥+300g载体(玉米淀粉与硅藻土的重量比为2:1),流化床烘干:进口温度90℃,出口温度44℃,干燥时间18min。
74.将得到的固体菌剂在室温条件下保存18个月,测定并记录其活菌数变化,具体结果见表1。
75.实施例3
76.本实施例用于说明本发明所述的丁酸梭菌固体菌剂的制备方法
77.100g菌泥+300g载体(玉米淀粉与硅藻土的重量比为2:1),流化床烘干:进口温度100℃,出口温度48℃,干燥时间16min。
78.将得到的固体菌剂在室温条件下保存18个月,测定并记录其活菌数变化,具体结果见表1。
79.实施例4
80.本实施例用于说明本发明所述的丁酸梭菌固体菌剂的制备方法
81.100g菌泥+300g载体(玉米淀粉与硅藻土的重量比为2:1),流化床烘干:进口温度70℃,出口温度33℃,干燥时间35min。
82.将得到的固体菌剂在室温条件下保存18个月,测定并记录其活菌数变化,具体结果见表1。
83.实施例5
84.本实施例用于说明本发明所述的丁酸梭菌固体菌剂的制备方法
85.实施例5-1:按照实施例1所述的方法进行制备,不同的是,使用等质量的豆粕粉替换玉米淀粉。
86.实施例5-2:按照实施例1所述的方法进行制备,不同的是,使用等质量的菊粉粉替换玉米淀粉。
87.将得到的固体菌剂在室温条件下保存18个月,测定并记录其活菌数变化,具体结果见表1。
88.实施例6
89.本实施例用于说明本发明所述的丁酸梭菌固体菌剂的制备方法
90.按照实施例1所述的方法进行制备,不同的是,使用等质量的蒙脱石替换硅藻土。
91.将得到的固体菌剂在室温条件下保存18个月,测定并记录其活菌数变化,具体结果见表1。
92.实施例7
93.本实施例用于说明本发明所述的丁酸梭菌固体菌剂的制备方法
94.实施例7-1:按照实施例1所述的方法进行制备,不同的是,使用玉米淀粉与硅藻土的重量比1:0.2。
95.实施例7-2:按照实施例1所述的方法进行制备,不同的是,使用玉米淀粉与硅藻土的重量比1:0.8。
96.实施例7-3:按照实施例1所述的方法进行制备,不同的是,使用玉米淀粉与硅藻土的重量比10:1。
97.实施例7-4:按照实施例1所述的方法进行制备,不同的是,使用玉米淀粉与硅藻土的重量比1:5。
98.将得到的固体菌剂在室温条件下保存18个月,测定并记录其活菌数变化,具体结果见表1。
99.实施例8
100.本实施例用于说明本发明所述的丁酸梭菌固体菌剂的制备方法
101.实施例8-1:按照实施例1所述的方法进行制备,不同的是,所述丁酸梭菌菌泥与所述载体的重量比为1:2。
102.实施例8-2:按照实施例1所述的方法进行制备,不同的是,所述丁酸梭菌菌泥与所述载体的重量比为1:5。
103.实施例8-3:按照实施例1所述的方法进行制备,不同的是,所述丁酸梭菌菌泥与所述载体的重量比为1:1。
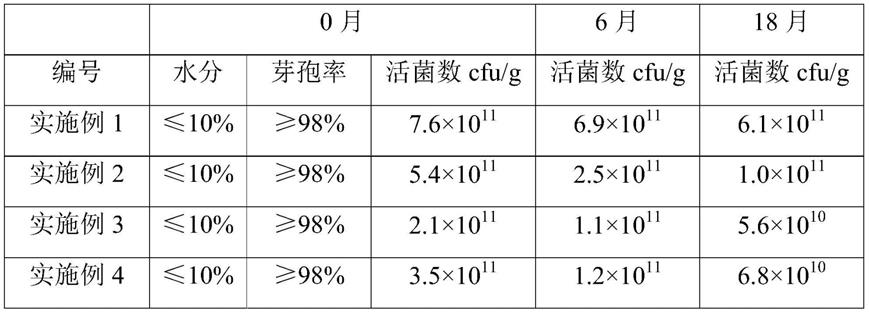
104.实施例8-4:按照实施例1所述的方法进行制备,不同的是,所述丁酸梭菌菌泥与所述载体的重量比为1:10。
105.将得到的固体菌剂在室温条件下保存18个月,测定并记录其活菌数变化,具体结果见表1。
106.实施例9
107.按照实施例1所述的方法进行制备,不同的是,使用的菌泥不同。具体的,所述菌泥在制备过程中使用的种子培养基和发酵培养基分别具有如下组成。
108.种子培养基:酵母浸粉0.3重量%,牛肉浸膏1重量%,胰蛋白胨1重量%,葡萄糖0.5重量%,可溶性玉米淀粉0.1重量%,氯化钠0.5重量%,三水合乙酸钠0.3重量%,l-半胱氨酸盐酸盐0.015重量%,初始ph6.5
±
0.2。
109.发酵培养基:葡萄糖2重量%,酵母粉1重量%,蛋白胨1重量%,氯化钙2重量%,磷酸二氢钾1.5重量%,硫酸镁0.02重量%,硫酸锰0.02重量%,初始ph6.5
±
0.2。
110.将得到的固体菌剂在室温条件下保存18个月,测定并记录其活菌数变化,具体结果见表1。
111.对比例1
112.本对比例用于说明参比的丁酸梭菌固体菌剂的制备方法
113.按照实施例1所述的方法进行制备,不同的是在烘箱中静态烘干,温度设定为60℃,时间为120min。
114.将得到的固体菌剂在室温条件下保存18个月,测定并记录其活菌数变化,具体结果见表1。
115.对比例2
116.本对比例用于说明参比的丁酸梭菌固体菌剂的制备方法
117.按照实施例1所述的方法进行制备,不同的是通过喷雾干燥制备,入口温度120-140℃,出口温度80-85℃,泵转速22.7rpm。
118.将得到的固体菌剂在室温条件下保存18个月,测定并记录其活菌数变化,具体结果见表1。
119.表1
[0120][0121][0122]
注:表中单位为cfu/g。
[0123]
通过表1的结果可以看出,采用本发明的方法制备得到的菌剂具有活菌数高和芽孢率高的优点,且经过18个月后的活菌数仍保持在较高水平,说明该菌剂的质量较稳定。
[0124]
与本发明的方法相比,对比例1的方法存在菌体芽孢率损失率较高的问题,且长期保存后菌剂质量有明显的下降。
[0125]
与本发明的方法相比,对比例2的方法存在菌体芽孢率损失率较高的问题,而且菌剂经长期保存后活菌损失较多,同时还具有成本高的问题。
[0126]
以上详细描述了本发明的优选实施方式,但是,本发明并不限于此。在本发明的技术构思范围内,可以对本发明的技术方案进行多种简单变型,包括各个技术特征以任何其它的合适方式进行组合,这些简单变型和组合同样应当视为本发明所公开的内容,均属于本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1