对猪瘟野毒及其疫苗、非洲猪瘟病毒、猪非典型瘟病毒鉴别诊断的基因芯片以及检测方法与流程
本发明涉及兽医诊断
技术领域:
,特别涉及一种对猪瘟病毒及其疫苗、非洲猪瘟病毒、猪非典型瘟病毒进行鉴别诊断的基因芯片以及使用该基因芯片的检测方法。
背景技术:
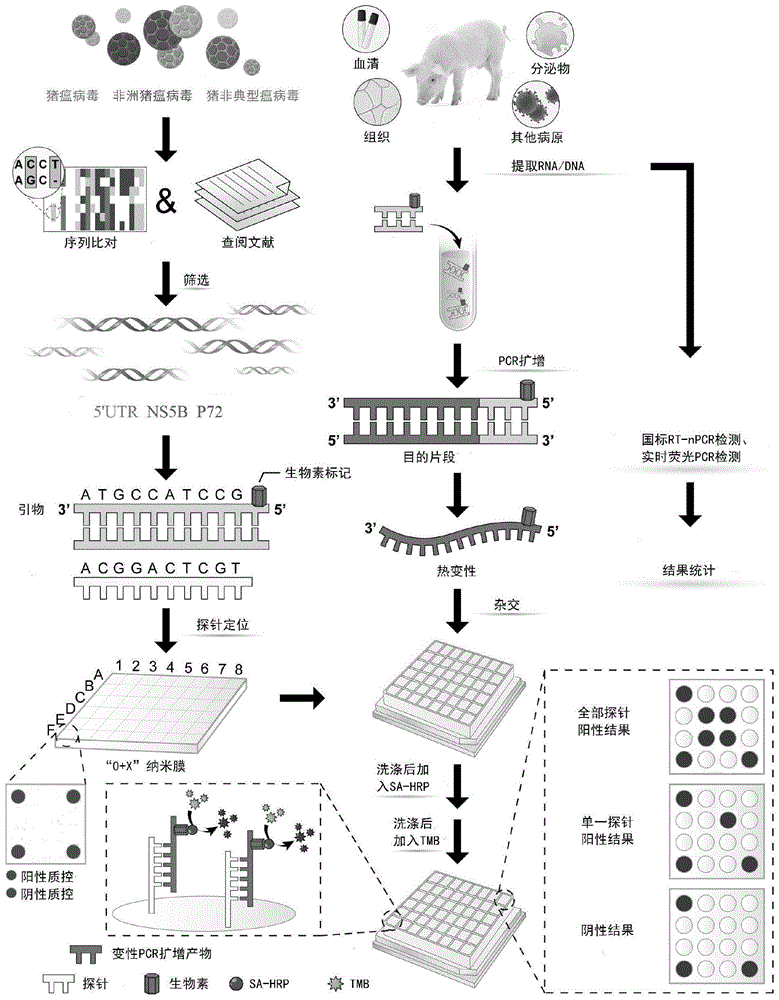
:猪瘟(classicalswinefever,csf)是由猪瘟病毒(classicalswinefevervirus,csfv)引起的高度接触性、致死性传染病。猪瘟被oie列为必须报告的动物疫病之一,在中国被列为“一类动物疫病”。非洲猪瘟(africanswinefever,asf)是由非洲猪瘟病毒(africanswinefevervirus,asfv)引起的一种急性,热性,高度接触性传染病,病程短,死亡率高达100%。仔猪先天性震颤,也称“仔猪抖抖病”或“跳跳病”,是一种由猪非典型瘟病毒(atypicalporcinepestivirus,appv)感染引起仔猪头部、四肢等局部或全身肌肉表现阵发性挛缩的一种疾病,可导致仔猪站立困难、吮乳受阻甚至死亡。该病毒于2015年在美国首次从具有ct症状的猪血清中发现,随后欧洲、中国和加拿大等国家相继报道在有症状的新生仔猪检测出该病毒,这表明其已在世界范围内流行。目前在我国这3种疾病均有流行,所以对其进行流行病学检测及临床的快速诊断具有十分重要的意义。目前对于猪瘟的防控,我国仍是以接种中国兽医药品监察所自主研发的c株疫苗为主,尽管疫苗的接种对于猪瘟的预防取得了很大的成果,世界上很多国家也已经消灭了猪瘟,但目前临床上缺少有效的诊断方法可以对猪瘟疫苗接种与野毒感染予以鉴别区分。而非洲猪瘟在国际上尚无可用的有效疫苗和药物去治疗和预防目前,对于猪瘟病毒的检测方法例如病毒分离培养、免疫荧光检测和酶联免疫吸附试验等虽然有其成功的应用,但在应对猪瘟病毒的野毒和疫苗的鉴别诊断问题上,往往一筹莫展。分子生物学检测方法虽然能对猪瘟病毒的野毒和疫苗进行区分,但是这些方法比较费时,操作步骤较为复杂,且难以适用于大量的样本检测。而对于非洲猪瘟病毒和猪非典型瘟病毒的诊断,目前还是以病毒分离及核酸检测还有血清学检测为主。因此,建立一种临床上区分猪瘟野毒感染和疫苗免疫同时能鉴别诊断非洲猪瘟和猪非典型瘟病毒的诊断方法十分必要。技术实现要素:近年来,基因芯片技术被广泛应用于医学领域,在基因功能表达、致病机理、临床诊断、药物开发、生物学检测等研究方面取得突出成效。本发明立足于基因芯片技术,针对非洲猪瘟病毒、猪瘟病毒及猪非典型瘟病毒的保守序列选取靶位基因分别设计了三对区分这三种不同病毒的检测引物和另一对鉴别区分猪瘟野毒及其疫苗的引物及相对应的探针,建立了一种可靠、快速的猪瘟野毒及其疫苗、非洲猪瘟病毒、猪非典型瘟病毒鉴别诊断基因芯片检测方法,并组装猪瘟野毒及其疫苗、非洲猪瘟病毒、猪非典型瘟病毒鉴别诊断基因芯片检测试剂盒,为猪瘟野毒及其疫苗、非洲猪瘟、猪非典型性瘟病毒的快速鉴别诊断和规模化猪场的疫病流行病学调查提供技术支撑。本申请因而提供了:1.一种探针组合物,其是用于对猪瘟野毒及其疫苗、非洲猪瘟病毒、猪非典型瘟病毒进行鉴别的探针组合物,其中的靶标探针包括:针对猪瘟野毒csfv-w的探针csfv-w-p,其序列如seq.id.no.1:ccctgggtggtctaagtcctgagtacag所示,针对猪瘟疫苗csfv-v的探针csfv-v-p,其序列如seq.id.no.2:atgcaggaggagataaccttgcagcc所示,针对非洲猪瘟病毒asfv的探针asfv-p,其序列如seq.id.no.3:tcactacggctgatcttgtgg所示,以及针对猪非典型瘟病毒appv的探针appv-p,其序列如seq.id.no.4:atgcccacgtccacccaagcc所示。2.一种基因芯片,其是用于对猪瘟野毒及其疫苗、非洲猪瘟病毒、猪非典型瘟病毒进行鉴别的基因芯片,其中,该基因芯片包括:权利要求1所述的探针组合物,以及载体材料,所述探针组合物固定在载体材料上。3.根据项2所述的基因芯片,其中,所述基因芯片的载体材料为改性硅胶膜。4.根据项3所述的基因芯片,其中,除了固定有如项1所述的4条靶标探针序列,所述基因芯片的每个孔还固定有一条芯片反应质控探针和两条pcr质控探针。5.一种引物组合物,其是对猪瘟野毒及其疫苗、非洲猪瘟病毒、猪非典型瘟病毒进行鉴别诊断时所使用的扩增引物,其包括:针对猪瘟野毒csfv-w的5’utr保守区域设计引物,分别为csfv-f1:seq.id.no.5:ggagggactagccrtagtg和csfv-r1:seq.id.no.6:acgtcgaactactgacgactg;针对猪瘟疫苗csfv-v的ns5b保守区域设计引物,分别为csfv-f2:seq.id.no.7:ccttcggggagaaagtaacgat和csfv-r2:seq.id.no.8:cctaccacagtcacggct;针对非洲猪瘟病毒asfv的p72保守区域设计引物,分别为asfv-f:seq.id.no.9:ttttatattagttgggacacgga和asfv-r:seq.id.no.10:gaaagttaatagcagatgccgat;以及针对猪非典型瘟病毒appv的5’utr保守区域设计引物,分别为appv-f:seq.id.no.11:cagacgtcaccgagtagtacacc和appv-r:seq.id.no.12:cccaggtccaccaccgat。6.一种试剂盒,其包括:项2-4中任一项所述的基因芯片;以及项5所述的引物组,所示试剂盒用于对猪瘟野毒及其疫苗、非洲猪瘟病毒、猪非典型瘟病毒进行鉴别诊断。7.根据项6所述的试剂盒,其还包括:质控引物、质控质粒、阳性对照、阴性对照、热反应酶、无菌无核酸酶水、辣根过氧化物酶、变性液a、洗脱液b、洗涤液c以及tmb显色液。8.一种对猪瘟野毒及其疫苗、非洲猪瘟病毒、猪非典型瘟病毒进行鉴别诊断的方法,该方法包括:-取得含有受试体dna/rna的样本,优选血液样本;-对该样本进行dna/rna提取;-使用引物组合物对提取到的dna/rna进行扩增;-使用经扩增的dna/rna与探针组合物进行杂交;-通过显色反应显示杂交结果以判断是否存在/共同存在猪瘟野毒、猪瘟疫苗、非洲猪瘟病毒、猪非典型瘟病毒的阴性/阳性。9.根据项8所示的方法,其中,所述引物组合物包括:针对猪瘟野毒csfv-w的5’utr保守区域设计引物,分别为csfv-f1:seq.id.no.5:ggagggactagccrtagtg和csfv-r1:seq.id.no.6:acgtcgaactactgacgactg;针对猪瘟疫苗csfv-v的ns5b保守区域设计引物,分别为csfv-f2:seq.id.no.7:ccttcggggagaaagtaacga和csfv-r2:seq.id.no.8:cctaccacagtcacggct;针对非洲猪瘟野毒asfv-p的p72保守区域设计引物,分别为asfv-f:seq.id.no.9:ttttatattagttgggacacgga和asfv-r:seq.id.no.10:gaaagttaatagcagatgccgat;以及针对猪非典型瘟病毒appv-p的5’utr保守区域设计引物,分别为appv-f:seq.id.no.11:cagacgtcaccgagtagtacacc和appv-r:seq.id.no.12:cccaggtccaccaccgat。10.根据项8或9所示的方法,其中,所述探针组合物包括:针对猪瘟野毒csfv-w的探针csfv-w-p,其序列如seq.id.no.1:ccctgggtggtctaagtcctgagtacag所示,针对猪瘟疫苗csfv-v的探针csfv-v-p,其序列如seq.id.no.2:atgcaggaggagataaccttgcagcc所示,针对非洲猪瘟病毒asfv的探针asfv-p,其序列如seq.id.no.3:tcactacggctgatcttgtgg所示,以及针对猪非典型瘟病毒appv的探针appv-p,其序列如seq.id.no.4:atgcccacgtccacccaagcc所示。附图说明图1为基因芯片检测技术路线图。图2为pcr产物示意图,图中,m表示marker;1:表示sx4;2:表示bjyq1;3:表示thiverval株;4:表示c-株;n表示阴性对照。图3为pcr产物示意图,图中,m表示marker;1:表示csfv;2:表示pcv-1;3:表示pcv-2;4:表示ppv;5:表示prv;6:表示prrsv;7:表示pedv;8:表示tgev;9:表示asfv;10:表示appv;11:表示fmdv;12:表示jev;13:表示bvdv;14:表示阴性对照。图4为芯片特异性实验示意图,图中csfv/shimen、csfv/bjyq1、csfv/sx4、csfv/hebhd2、csfv/hebhh1、csfv/hebbd1、csfv/tjnh1、csfv/hebjz1、csfv/hebqhd1、csfv/henzz1、csfv/hbes2、csfv/zjhz1、csfv/henzmd1、csfv/henxc3、csfv/jsxz1、csfv/gxfl1、csfv/hebcb2、csfv/henzmd2、csfv/henxc1、csfv/hbhg1、csfv/hbhm1、csfv/hbjz1、csfv/lncy1、csfv/scmy1、csfv/hbxy4、csfv/hbxy5、csfv/zybj1、csfv/hebbd4表示为检测28株猪瘟病毒野毒株芯片检测阳性结果图;csfv/thiverval、csfv/c株表示为检测2株猪瘟疫苗株芯片检测阳性结果图;asfv表示为单一检测非洲猪瘟病毒株芯片检测阳性结果图;appv表示为单一检测猪非典型瘟病毒株芯片检测阳性结果图;fmdv、bvdv、pcv-1、pcv-2、prv、ppv、prrsv、tgdv、pedv、jev分别表示为单一检测猪口蹄疫病毒株、牛病毒性腹泻毒株、猪圆环i型毒株、猪圆环ii型毒株、猪伪狂犬病毒株、猪细小病毒株、猪繁殖与呼吸综合征病毒株、猪传染性胃肠炎病毒株、猪流行性腹泻病毒株、猪乙型脑炎病毒株等临床常见10种猪病芯片检测阴性结果图;csfv+asfv+appv表示为猪瘟野毒和疫苗株、非洲猪瘟毒株以及猪非典型瘟联检芯片检测阳性结果图;negative表示为双蒸水作为实验阴性对照。具体实施方式下面将结合附图所描述的具体实施方式对本申请的技术方案进行进一步的说明。<与基因芯片技术相关的基础定义>基因芯片(dna/rna芯片、dna/rna微阵列和寡核苷酸微阵列)是生物芯片中的一种。该技术将已知序列信息的核苷酸探针固定于支持物表面,然后与扩增标记的样品分子进行特异性结合,通过观测各探针分子与样品的杂交信号强度来分析样品的分子数量及核苷酸序列信息。基因芯片技术可以同时将大量的核酸探针固定于支持物上,从而一次性检测和分析样品中的大量核酸序列。同时,可视芯片与传统的芯片相比,最大的优点是它不需要其他复杂昂贵的设备,可以直接通过肉眼观察探针点是否响应来判定样品中是否含有待检病原核酸。通常由于芯片所采用的支持物材料的不同,将其分为玻璃芯片、硅片芯片、尼龙膜芯片等,其中玻璃芯片较为常见。根据制备方法的不同,可分为两大类:原位合成芯片(syntheticgenechip)和dna/rna微阵列(dna/rnamicroarray)。而根据其用途,可以分为表达谱芯片、序列检测芯片、诊断芯片、指纹图谱芯片、毒理芯片等。整个基因芯片检测技术包括四个流程:芯片的制备、待检样品的制备、样品与芯片的生物反应以及反应后信号的检测与分析。目前,芯片的制备主要采用表面化学方法来处理固相载体(如玻璃片或硅片),然后使核苷酸片段或蛋白质分子按特定顺序排列在载体上)。目前,已有将近400000种不同的dna/rna核苷酸分子置于1cm2内的高密度基因芯片,同时可以包含数百万个dna/rna探针的人类基因芯片也正在制备中。临床检测样品的制备则是第二个关键步骤,一般来说,临床样品的成分比较复杂,直接让其进行芯片反应,很大程度上会影响芯片的检测效果。故将样品通过特定的条件处理后,提取其核酸信息分子,并在核酸扩增时加以生物素或荧光基团的标记,不仅可提高芯片检测灵敏度也可以提高芯片特异性。第三步就是处理后的样品分子与芯片的结合反应,合适的反应条件是减少分子生物间错配的关键,同时还可以使分子生物间的反应处于最佳状态。这样,就可以获取最真实直接的反应信号。反应信号的读取及结果分析是基因芯片检测中最后也是最为关键的一步。一般采用将反应后的芯片置于信号扫描仪中获取信号值,然后再借助相对应的分析软件进行生物信号数据分析。本实验中所涉及的芯片检测技术可直接用肉眼来观测反应信号,为检测人员带来更方便的操作并节约大量检测成本。<与试剂盒相关的基础定义>基于基因芯片的试剂盒的基本工作原理是:在取得生物样品后,首先提取核酸;其次,通过pcr反应对核酸样品进行扩增(在此步骤中用到经过标记的引物,具体地,引物标记可以为生物素,生物素在下文述及的最后一步可以用作显色反应,以指示靶标核酸序列的存在);再次,在基因芯片上进行核酸的生物亲和反应,最后,利用生物素的显色反应(配合辣根过氧化物酶标记链霉亲和素(streptavidin-horseradishperoxidase,sa-hrp))对反应结果进行读取。在此,在第二步中用到的靶标核酸序列引物和pcr反应质控引物、在第三步中使用到的安装有针对靶标核酸序列的探针的基因芯片以及促进生物亲和反应发生的杂交液、以及在最后一步中使用的洗脱液、sa-hrp溶液、显色液都应当在试剂盒产品中一起提供。在基因芯片上以及试剂盒配件中至少设有:1.芯片反应质控探针(在基因芯片上,又称biotin探针)在基因芯片上设有biotin探针,其由biotin(生物素)序列构成,也称芯片反应质控探针,在基因芯片上设置它的目的是判定在基因芯片上的显色反应(芯片上的杂交反应)有效。由于扩增时使用的引物都带有biotin序列,经扩增的靶标核酸都是带有生物素标记物的。所以,如果biotin探针有效显色,则可以认为,如果经扩增后存在靶标核酸,其必将正常显色。2.阴性对照阴性对照为无菌无核酸酶水,在试剂盒中设置它是为了证实样品中没有特异性模板因无任何显色。3.pcr反应质控探针(在基因芯片上,又称ic)(配合使用pcr反应质控引物、pcr反应质控质粒)pcr反应质控探针与pcr反应质控引物互补,经pcr反应后,pcr反应质控质粒在pcr反应质控探针和引物的共同工作下得到扩增,并在芯片上发生显色反应。在基因芯片上设置ic的目的是判定经由pcr的核酸扩增反应有效。pcr反应质控引物及探针信息如表1所示,pcr反应质控质粒:内置参照选择选择人源基因(beta-globingene)序列(genbank:ah001475.2)表1pcr反应质控引物及探针信息4.阳性对照(在试剂盒中,为与芯片上的靶标探针互补的核酸对照品)除了上述的pcr反应质控质粒,在试剂盒中的对照品还包括asfv阳性质粒、appv阳性质粒、csfv-w(猪瘟野毒)及csfv-v(猪瘟疫苗)的阳性质粒。它们的作用是被用作阳性对照。5.靶标探针(在基因芯片上,与样品中的待检测靶标核酸互补)在基因芯片上共设有四条靶标探针,它们分别为针对非洲猪瘟病毒的探针(asfv-p)、针对猪非典型瘟病毒的探针(appv-p)、针对猪瘟野毒的探针(csfv-w-p)及疫苗的探针(csfv-v-p)。<猪瘟病毒、猪瘟疫苗及非洲猪瘟和猪非典型瘟病毒>猪瘟俗称“烂肠瘟”也称“猪霍乱”,是由黄病毒科猪瘟病毒属的猪瘟病毒引起的一种急性、发热、接触性传染传染病。具有高度传染性和致死性。本病在自然条件下只感染猪,不同年龄、性别、品种的猪和野猪都易感,一年四季均可发生。该病症1885年首先在美国发现,以后传播到世界各大洲。中国大部分省都有发生。1903年美国兽医学家德希尼兹和多赛特鉴定本病的病原是披盖病毒科的瘟病毒属(pestivirus)中的猪瘟病毒。主要通过直接接触,或由于接触污染的媒介物而发病。消化道、鼻腔粘膜和破裂的皮肤均是感染途径。在此选择病毒高度保守的5’非编码区作为检测的靶基因。猪瘟疫苗在此包括c株和t株,其中,c株疫苗是由中国兽医药品监察所于1954年研发的猪瘟兔化弱毒疫苗,其全称为china株,简称c株;1956年开始在全国大范围推广应用,是目前世界范围内最常用的猪瘟疫苗。t株全称为thiverval株,为低温诱导的猪瘟弱毒疫苗法国株。c株和t株都是猪瘟的疫苗。在此,由于疫苗的ns5b基因与野毒相比存在一个碱基差异,因此,能够设计仅扩增猪瘟疫苗的引物及其相应探针。非洲猪瘟(英文名称:africanswinefever,简称:asf)是由非洲猪瘟病毒(英文名称:africanswinefevervirus,简称:asfv)感染家猪和各种野猪(如非洲野猪、欧洲野猪等)而引起的一种急性、出血性的烈性传染病。世界动物卫生组织(oie)将其列为法定报告动物疫病,该病也是我国重点防范的一类动物疫情。其特征是发病过程短,最急性和急性感染死亡率高达100%,临床表现为发热(达40~42℃),心跳加快,呼吸困难,部分咳嗽,眼、鼻有浆液性或粘液性脓性分泌物,皮肤发绀,淋巴结、肾、胃肠粘膜明显出血,非洲猪瘟临床症状与猪瘟症状相似,只能依靠实验室分子生物室监测学检测确诊。在此,选择该病毒的p72基因片段为检测的靶基因。猪非典型瘟病毒(英文名称:atypicalporcinepestivirus,appv)俗称“仔猪抖抖病”或“跳跳病”,是指仔猪出生后全身性或局部性肌肉出现阵发性痉挛,猪后肢呈跳跃性的一种临床疾病,该病主要发生新生仔猪,发病后死亡率较高。该病也是由病毒引发,在此,选择该病毒的高度保守的5’utr非编码区作为检测的靶基因。<本申请要解决的技术问题和对应的解决方案>1.技术问题:本申请旨在提供一种可对猪瘟野毒以及疫苗、非洲猪瘟病毒、猪非典型瘟病毒进行鉴别诊断的基因芯片检测试剂盒,其主要用于疑似临床样本的猪瘟野毒以及疫苗、非洲猪瘟病毒、猪非典型瘟病毒的快速鉴别检测。2.解决方案:该猪瘟野毒以及疫苗、非洲猪瘟病毒、猪非典型瘟病毒鉴别诊断基因芯片检测试剂盒的基本构成元件为:阳性对照、阴性对照、rt-pcr反应液、引物溶液、基因芯片杂交液、基因芯片洗脱液、基因芯片淋洗液、生物素溶液、tmb显色液、包装好的基因芯片(核心元件)、无菌无核酸酶水,其中:(1)阳性对照和阴性对照:将asfv阳性质粒、appv阳性质粒、csfv-w野毒及csfv-v疫苗的阳性质粒作为4件阳性对照和ic质控质粒(pcr反应质控质粒)一起使用,无菌无核酸酶水用作阴性对照;(2)rt-pcr反应液:每个反应需要:primescript1stepenzymemix1μl,2x1stepbuffer12.5μl(3)引物溶液:每个反应需要:5μl(4)基因芯片杂交液:取10ml20×ssc和1ml10%sds,加纯水定容至200ml(5)基因芯片洗脱液:取3ml20×ssc和1.2ml10%sds,加纯水定容至120ml(6)基因芯片淋洗液:取10ml1mol柠檬酸钠加纯水定容至100ml(7)辣根过氧化物酶标记链霉亲和素(streptavidin-horseradishperoxidase,sa-hrp)溶液:使用时sa-hrp和杂交液以1∶2000比例进行稀释,充分混匀后待用(8)包装好的基因芯片:将组装好的基因芯片置于铝箔袋中,放入一包干燥剂,抽真空密封后于2~8℃冷藏保存。在该基因芯片上固定有本申请要求保护的针对猪瘟病毒野毒及其疫苗、非洲猪瘟病毒和猪非典型瘟病毒的探针组合物,以及芯片反应质控探针(biotin)和pcr反应质控探针(ic)。(9)无菌无核酸酶水:超纯水高压灭菌后,加入终浓度为0.1%的焦碳酸二乙酯(depc),处理过夜,次日高压灭菌以去除depc。(10)tmb显色液:直接使用在得到生物样品和上述试剂盒后,如下进行使用:-取得含有受试体dna/rna的样本,优选血液样本;-对该样本进行dna/rna提取;-使用引物组合物对提取到的dna/rna进行扩增;-使用经扩增的dna/rna与位于基因芯片上的探针组合物进行杂交;-通过显色反应显示杂交结果以判断是否存在/共同存在猪瘟野毒及其疫苗、非洲猪瘟病毒、猪非典型瘟病毒的阴性/阳性。<本申请的试剂盒的研发过程/拼装步骤>1.引物和探针的设计针对genbank公布的非洲猪瘟病毒株、猪非典型瘟病毒株、猪瘟野毒株和猪瘟疫苗株序列的差异分析后发现p72是非洲猪瘟病毒抗原的保守序列,故以该区域作为非洲猪瘟病毒的检测靶位基因;选取猪非典型瘟病毒的保守区域5’utr作为其检测靶标;5’utr在所有猪瘟病毒序列中保守性最高,故以该区域作为猪瘟病毒通用型检测靶标;而猪瘟疫苗与猪瘟野毒相比在ns5b基因存在1个碱基差异,利用arms-pcr原理,设计仅能扩增猪瘟疫苗的引物探针,即只能扩增猪瘟疫苗,而不能扩增猪瘟野毒。引物及探针信息见表2及表3。表2引物信息表3探针信息其中:biotin为生物素标记,带有标记的引物扩增出目的基因片段后通过芯片反应与芯片上探针杂交结合,生物素与sa-hrp相结合后再经tmb液处理化学显色,即可判定结果。2.基因芯片的制备将2%edc(w/v,1-3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐)和1.21%nhs(w/v,n-羟基琥珀酰亚胺)置于超纯水中,充分溶解,配制活化液,后将76mm×65mm的改性硅胶膜(购自苏州艾比拓生物技术有限公司,该改性硅胶膜如下定义,其具有:1、零背景能力:即使在较高的蛋白质浓度下也可以防止蛋白发生非特异性吸附;2、共价固定能力:cooh在edc/nhs活化的条件下,可以固定带有氨基的探针,包括但不限于核酸,短肽,蛋白,细胞,病毒等等;3、超宽的负载区间:例如固定的是短肽,则以某个单抗为例在一系列点样浓度下检测出的行为;4、三维呈现能力,有利于prey-bait相互作用:减少空间位阻;5、定制化生产的可能性:根据客户的具体项目要求,可以对cooh密度,三维空间的尺度等进行调整。)改性硅胶膜为高瓴生物反应基底材料作为高性能生物芯片基底材料,在基因、蛋白质和多肽(小分子)等芯片的构建中,可替代尼龙膜、玻片等传统的基底材料。它具有独特的微纳结构和表面化学性质,可高密度地共价固定各种探针,并实现三维空间展示;可在无需bsa封闭的情况下,同时实现降低检测背景噪音和提升灵敏度;简化清洗步骤,节省操作时间。将改性硅胶膜置于活化槽中,正面朝上,均匀倒入15ml/块活化液,使膜表面完全侵入,浸泡30分钟。活化结束后,用超纯水冲洗膜3遍,用氮气吹干,保证膜表面干燥无异物。将活化后膜装载于膜架上,48孔板和装载膜的膜架装载于点样仪的相应位置。将探针用液稀释至终浓度为6μm,每孔加入4μl,设置点样仪参数为100drop,按照事先安排的点样顺序将探针点于48孔装配的sj改性硅胶膜上,温度为20~25℃,湿度为40%~70%,点击程序开始点样。点样完成后从点样仪中取出点样后的膜,检查膜上有无缺点或拖尾。将检查合格的膜放于粘贴双面胶的膜底座上,对准位置安装上盖,组装成基因芯片,确保每个孔的点在孔中。将组装好的基因芯片置于铝箔袋中,放入一包干燥剂,抽真空密封后于2~8℃冷藏保存。芯片点样模式如下表所示:表4芯片点样模式biotinappvasfvcsfv-wcsfv-vic-pic-pbiotin为芯片反应质控探针,其通过芯片反应与sa-hrp相结合后再经tmb液处理化学显色,即可判定结果,该质控点保证着芯片杂交反应过程的有效性;而ic-p为pcr反应质控探针,其保证了:1)目的基因片段扩增反应的有效性,同时2)由于探针点阵模式为正方形,此两条pcr反应质控探针可以为芯片结果的读取指示方向,以方便反应结果的正确读取。3.阳性对照的制备asfv质粒、appv质粒、csfv野毒及c株疫苗的质粒4件阳性对照与0.5ml的ic质控质粒(pcr反应质控质粒)一起、与等量的冻干保护液混合后,冻干后,-20℃保存。使用时加入1ml的生理盐水复溶。asfv质粒是将asfvb646l基因编码的p72片段连接在puc57载体上构建而成;appv质粒、csfv质粒和c株疫苗质粒是分别将高度保守区appv的5’utr基因片段、csfv/hebhh1的5’utr基因片段和c株ns5b基因片段连接在pgem-t载体上构建而成。以上载体为中国兽医药品监察所国家/oie猪瘟参考实验室构建和制备。4.阴性对照背景信息取0.5ml无菌无核酸酶水-20℃保存。5.试剂primescript1stepenzymemix一步法反转录酶与2x1stepbuffer缓冲液购自购自宝生物工程(大连)有限公司;6.引物及基因芯片由中国科学院苏州纳米技术与纳米仿生研究所合成组装。7.反应体系的建立按核酸提取试剂盒病毒rna/dna提取试剂盒(takaraminibestviralrna/dnaextractionkitver.5.0,cat:9766)说明书提取样本非洲猪瘟病毒dna及猪瘟病毒rna作为反应模板,一步法pcr扩增靶标上基因片段,反应体系为primescript1stepenzymemix1μl,2x1stepbuffer12.5μl,primerpool5μl,rna3μl,ddh2oupto25μl。反应条件为50℃20min,94℃1min,94℃10s,56℃20s,72℃20s,35个循环,4℃保存。8.芯片反应:反应前准备:配置杂交液a、洗脱液b、淋洗液c。将芯片至于孔板孵育器上47℃预热,b液47℃水浴预热。取10μlpcr产物与110μla液混合后加入芯片孔内,120μl/孔,47℃,200r/min,反应5min。47℃预热好的b液(100ul)淋洗三遍,辣根过氧化物酶标记链霉亲和素(streptavidin-horseradishperoxidase,sa-hrp)1:2000a液稀释,100μl/孔,200r/min,47℃反应5min。a液(100μl)室温淋洗2次,c液(100μl)室温淋洗2次,加入60μl/孔的tmb直接显色1分钟。纯水(200ul)洗2次,压缩空气罐轻轻吹干;观察实验结果,拍照并记录。仪器:pcr基因扩增仪;基因芯片孔板孵育器。依上述1至6方面的描述共为验证实验生产了10个批次的试剂盒。该十个批次的批号分别为19071501、19071502、19071503、19071504、19071505、19071506、19071507、19071508、19071509、19071510;这些试剂盒批次将用于下文的测试例。而后,选择测试优良的批次19071502依照上述7至8方面的描述进行实验例。<本申请的技术方案的有益效果>针对genbank公布的非洲猪瘟、非典型瘟病毒、猪瘟野毒及其疫苗序列的差异分析后发现p72是非洲猪瘟病毒的保守序列,故以该区域作为非洲猪瘟病毒的检测靶位基因;选取猪非典型瘟病毒保守区域的5’utr序列作为其检测靶标;5’utr在所有猪瘟病毒序列中保守性最高,故以该区域作为猪瘟病毒通用型检测靶标;而猪瘟疫苗株与野毒相比,疫苗的ns5b基因存在1个碱基差异,利用arms-pcr原理,设计仅能扩增兔化弱毒疫苗的引物及其相应探针,即可以实现只扩增疫苗,而不扩增野毒。经过反应条件的摸索和进一步优化,建立了可对猪瘟野毒及疫苗、非洲猪瘟病毒、猪非典型瘟病毒鉴别诊断基因芯片检测方法,并组装了猪瘟野毒及疫苗、非洲猪瘟病毒、猪非典型瘟病毒鉴别诊断基因芯片测试剂盒。通过对42个指控样本进行的特异性、敏感性、稳定性和重复性试验,证明该试剂盒只检测csfv、asfv和appv,不扩增猪圆环病毒ⅰ型、猪圆环病毒ⅱ型、猪细小病毒、伪狂犬病毒、日本乙型脑炎病毒、牛病毒性腹泻病毒、猪繁殖与呼吸综合征病毒、猪流行性腹泻病毒、猪传染性胃肠炎病毒、口蹄疫病毒共10种主要相关病毒核酸,显示良好的特异性;灵敏度实验结果显示该方法将asfv阳性质粒、appv阳性质粒、csfv-w阳性质粒及csfv-v阳性质粒测定浓度后进行10倍梯度稀释,用猪瘟野毒及其疫苗、非洲猪瘟病毒、猪非典型瘟病毒鉴别诊断基因芯片检测试剂盒检测,根据芯片反应结果计算芯片灵敏度。经计算,单一检测猪瘟野毒和疫苗检测时灵敏度可达1.98拷贝/μl和13.7拷贝/μl;单一检测非洲猪瘟病毒时检测灵敏度可达2.56拷贝/μl;单一检测猪非典型瘟病毒时检测灵敏度可达18拷贝/μl;混合联检时灵敏度为29拷贝/μl,说明该检测方法灵敏度高,优化的各反应体系和反应参数完全能保证dna/rna模板的有效扩增。6个月的稳定性试验及重复性实验证实该试剂盒具有良好的重复性和稳定性。该方法具有良好的重复性和稳定性,该试剂盒操作简单,自动化程度高。可在1h内完成对区分非洲猪瘟、猪非典型瘟病毒及猪瘟野毒感染和疫苗接种后临床样本的鉴别诊断,检测结果直观,判定简便,缩短了检测周期,节约生产成本,从而产生更明显的经济和社会效益,在猪病流行病学调查、鉴别诊断及净化等方面有良好的应用前景。本申请所设计探针长度均小于30bp,靶位基因的目标片段长度均小于100bp,这保证了响应信号的稳定与清晰。为方便芯片检测结果判定,本申请选用具有良好亲和性的生物素来标记引物,扩增出目的基因后与探针相结合再与hrp标记的链霉亲和素反应,最后使用底物显色液进行显色,即可在探针位置显现出肉眼可见的蓝色响应点,与传统基因芯片结果读取需要专用仪器相比,节约了大量成本。传统基因芯片多使用醛基化玻片作为支撑,其反应所需时间较长,本芯片选择“0+x”纳米改性硅胶膜作为支撑,与使用醛基化玻片的传统基因芯片相比,反应时间显著减少,节省了大量检测时间。本申请的技术方案的优点可以归纳为:1)特异性好:通过设计特异性的引物及探针,分别对猪瘟病毒、非洲猪瘟病毒和非典型瘟病毒的保守序列和snp位点进行甄别,靶序列由特异引物和探针双重控制的准确性高。2):反应过程对模板的扩增在闭管的情况下一步完成,减少了操作过程中污染的机会;3):检测时间短:与传统的方法相比较,该方法只需要在1小时内即可完成临床样本的检测,大大节省了时间成本;4)操作简单:只需要普通pcr仪及恒温摇床即可,该芯片杂交过程操作简便,不需要昂贵的辅助设备;5)结果判定直观:不用扫描、电泳等过程,反应结束后只需肉眼即可判定结果。<实施例部分>第一部分为测试例。它们是为了对依上述开发出的试剂盒的特异性、灵敏度、批间重复性等性能进行测试。验证实验样本信息:(csfv-w、csfv-v株分别为csfv野毒株和疫苗株的阳性对照)42份验证实验样本的背景信息见表5,验证实验的目的是对试剂盒特异性、重复性、灵敏度、敏感性、稳定性进行试验。将所有验证实验样本灭活后进行定量分装,200μl/管。表5验证实验样本信息测试例1.特异性试验采用同一批次的猪瘟病毒野毒及疫苗、非洲猪瘟病毒、猪非典型性瘟病毒鉴别诊断基因芯片检测试剂盒对42个验证实验样本进行检测,结果显示:该试剂盒检测猪瘟病毒野毒及疫苗、非洲猪瘟病毒、猪非典型性瘟病毒均为阳性,且能鉴别区分非洲猪瘟、猪非典型性瘟病毒及猪瘟野毒感染以及疫苗,其他病原均为阴性。证实该方法与其他相关病毒无交叉反应,具有良好的特异性,且能在检测诊断猪瘟病毒的同时区分野毒感染及疫苗接种。具体结果请参见图4。图4为芯片特异性实验示意图,图中csfv/shimen、csfv/bjyq1、csfv/sx4、csfv/hebhd2、csfv/hebhh1、csfv/hebbd1、csfv/tjnh1、csfv/hebjz1、csfv/hebqhd1、csfv/henzz1、csfv/hbes2、csfv/zjhz1、csfv/henzmd1、csfv/henxc3、csfv/jsxz1、csfv/gxfl1、csfv/hebcb2、csfv/henzmd2、csfv/henxc1、csfv/hbhg1、csfv/hbhm1、csfv/hbjz1、csfv/lncy1、csfv/scmy1、csfv/hbxy4、csfv/hbxy5、csfv/zybj1、csfv/hebbd4表示为检测28株猪瘟野毒株芯片检测阳性结果图;csfv/thiverval、csfv/c株表示为检测2株猪瘟疫苗株芯片检测阳性结果图;asfv表示为单一检测非洲猪瘟病毒株芯片检测阳性结果图;appv表示为单一检测猪非典型瘟病毒株芯片检测阳性结果图;fmdv、bvdv、pcv-1、pcv-2、prv、ppv、prrsv、tgdv、pedv、jev分别表示为单一检测猪口蹄疫病毒株、牛病毒性腹泻毒株、猪圆环i型毒株、猪圆环ii型毒株、猪伪狂犬病毒株、猪细小病毒株、猪繁殖与呼吸综合征病毒株、猪传染性胃肠炎病毒株、猪流行性腹泻病毒株、猪乙型脑炎病毒株等临床常见10种猪病芯片检测阴性结果图;csfv(w+v)+asfv+appv表示为猪瘟野毒和疫苗株、非洲猪瘟毒株以及猪非典型瘟联检芯片检测阳性结果图;negative表示为双蒸水作为阴性对照。测试例2.灵敏度试验将asfv阳性质粒、appv阳性质粒、csfv-w阳性质粒及csfv-v阳性质粒进行10倍梯度稀释后用猪瘟病毒野毒及疫苗、非洲猪瘟病毒、猪非典型性瘟病毒鉴别诊断基因芯片检测试剂盒检测,根据芯片反应结果计算芯片灵敏度。利用道尔顿拷贝数计算公式【拷贝数=质粒浓度×6.02×1023/(660×质粒长度)】得出:单一检测猪瘟野毒和疫苗检测时灵敏度可达1.98拷贝/μl和13.7拷贝/μl;单一检测非洲猪瘟病毒时检测灵敏度可达2.56拷贝/μl;单一检测猪非典型瘟病毒时检测灵敏度可达18拷贝/μl;混合联检时灵敏度为29拷贝/μl,说明优化的各反应体系和反应参数完全能保证dna/rna模板的有效扩增。测试例3.批间重复性试验由上面提及的10个批次中挑选三批:19071501、19071502、19071503进行针对重复性的验证性实验。对42个验证实验样本,按常规方法进行rna/dna抽提。将获得的rna/dna用猪瘟野毒及疫苗鉴别诊断基因芯片检测试剂盒进行检测。结果显示:19071501、19071502、19071503共3批猪瘟野毒及疫苗、非洲猪瘟病毒、猪非典型性瘟病毒鉴别诊断基因芯片检测试剂盒对42个验证实验样本的检测结果一致,批间差异率为0,说明19071501、19071502、19071503这3批试剂盒具有很好的批间重复性,同时证明所设计的猪瘟野毒及疫苗、非洲猪瘟病毒、猪非典型性瘟病毒鉴别诊断基因芯片检测试剂盒具有良好的批间重复性。测试例4.稳定性试验采用上面提及的19071501、19071502、19071503共3批检测试剂盒。对42个验证实验样本进行检测,每个月一次,每批次做3个重复,持续6个月,测定猪瘟病毒野毒及疫苗、非洲猪瘟病毒、猪非典型性瘟病毒鉴别诊断基因芯片检测试剂盒的稳定性。结果显示,3批猪瘟病毒野毒及疫苗、非洲猪瘟病毒、猪非典型性瘟病毒鉴别诊断基因芯片检测试剂盒对42个验证实验样本的检测结果一致,说明该试剂盒在6个月内具有很好的稳定性。第二部分是实验例。它们是为了说明使用本申请的技术方案对疾病进行鉴别诊断时的使用效果。它们的使用都遵循相同的步骤:(1)dna/rna的抽提及存放dna/rna的抽提采用商品化试剂盒或采用常规dna/rna抽提方法。提取的dna/rna须在2h内进行扩增;若需长期保存须放置-80℃冰箱。(2)反应体系的配制从试剂盒中取出各组分,室温融化后,2000r/min离心10s并震荡混匀。设需pcr数为n,其中n=待检样品数×重复数+1(阳性对照)+1(阴性对照),每个样本测试反应体系配制见表6。表6反应体系配制表(3)扩增将配制好的反应液放入pcr仪内,记录样本摆放顺序。条件设置:50℃20min,94℃1min,94℃10s,56℃20s,72℃20s,35个循环,4℃保存。芯片反应:反应前准备:配置杂交液a、洗脱液b、淋洗液c。将芯片置于孔板孵育器上47℃预热,b液47℃水浴预热。取10μlpcr产物与110μla液混合后加入芯片孔内,120μl/孔,47℃,200r/min,反应5min。47℃预热好的b液(100ul)淋洗三遍,辣根过氧化物酶标记链霉亲和素(streptavidin-horseradishperoxidase,sa-hrp)1:2000a液稀释,100μl/孔,200r/min,47℃反应5min。a液(100μl)室温淋洗2次,c液(100μl)室温淋洗2次,加入60μl/孔的tmb直接显色1分钟。纯水(200ul)洗2次,压缩空气罐轻轻吹干;观察实验结果,拍照并记录。(4)结果判定1)结果分析条件设定直接读取检测结果。结果判定:阴性质控点的颜色应不显色,阳性质控点的颜色为明显强于阴性质控点的蓝紫色,两个阳性质控点至少有一个显或深或浅的蓝紫色为有效实验结果。如被测样品所在探针所在点不显色,即为阴性;如果被测样片所在探针点为蓝紫色,则为阳性。微生物资源信息:本发明涉及的微生物资源由中国兽医药品监察所国家/oie猪瘟参考实验室鉴定、保存和供应。实验例1使用生产批次为19071502(该批次的产品性能最为优良)的试剂盒进行实验例。为检测该试剂盒对猪瘟临床样品鉴别诊断的准确性,对来自北京海淀某猪场(bjhd)、重庆垫江(cqdj)、四川万源(scwy)、河北保定(hebbd)哈尔滨兽医研究所等共177个临床样本经猪瘟病毒rt-npcr检测方法(gb/t26875-2018)检出猪瘟野毒感染30份,猪瘟疫苗42份,阴性105份;芯片检测猪瘟野毒感染30份,猪瘟疫苗毒41份,阴性106份,两种检测方法符合率为99.43%。具体数据见表7。表7临床样品检测结果asfv实时荧光定量pcr方法检出非洲猪瘟阳性9份(其中非洲猪瘟与猪瘟混合感染1份),appv普通pcr检测方法检出appv10份,猪瘟病毒rt-npcr检测方法(gb/t26875-2018)检出猪瘟野毒感染54份,疫苗42份,阴性106份;基因芯片法检出非洲猪瘟阳性9份(其中非洲猪瘟与猪瘟混合感染1份)猪瘟野毒感染54份,疫苗毒41份,阴性106份,两种检测方法符合率为99.08%。具体数据见表8。结果显示:猪瘟野毒及其疫苗、非洲猪瘟病毒、猪非典型瘟病毒鉴别诊断基因芯片检测方法完全可满足临床上猪瘟样本的诊断,并区分非洲猪瘟、猪非典型性瘟病毒及猪瘟野毒感染和疫苗接种,在猪病流行病学调查、鉴别诊断及净化等方面有良好的应用前景。表8临床样品检测结果序列表<110>中国兽医药品监察所<120>对猪瘟野毒及其疫苗、非洲猪瘟病毒、猪非典型瘟病毒鉴别诊断的基因芯片以及检测方法<130>tpc00792<141>2020-05-21<160>12<170>siposequencelisting1.0<210>1<211>28<212>dna<213>artificialsequence<400>1ccctgggtggtctaagtcctgagtacag28<210>2<211>26<212>dna<213>artificialsequence<400>2atgcaggaggagataaccttgcagcc26<210>3<211>20<212>dna<213>artificialsequence<400>3tcactacggctgatcttgtgg21<210>4<211>21<212>dna<213>artificialsequence<400>4atgcccacgtccacccaagcc21<210>5<211>19<212>dna<213>artificialsequence<400>5ggagggactagccrtagtg19<210>6<211>21<212>dna<213>artificialsequence<400>6acgtcgaactactgacgactg21<210>7<211>22<212>dna<213>artificialsequence<400>7ccttcggggagaaagtaacgat22<210>8<211>18<212>dna<213>artificialsequence<400>8cctaccacagtcacggct18<210>9<211>21<212>dna<213>artificialsequence<400>9ttttatattagttgggacacgga23<210>10<211>22<212>dna<213>artificialsequence<400>10gaaagttaatagcagatgccgat23<210>11<211>23<212>dna<213>artificialsequence<400>11cagacgtcaccgagtagtacacc23<210>12<211>18<212>dna<213>artificialsequence<400>12cccaggtccaccaccgat18当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1