一种基于氧杂芳环类光催化剂的高活性自由基聚合体系
本发明涉及有机光催化自由基聚合领域,具体是涉及以氧杂芳环类化合物 (二氧杂蒽嵌蒽类,pxx)为有机光催化剂(或称为光敏剂)的活性自由基聚合体系。在温和条件下,以有机卤化物或硫化物为引发试剂,可以实现甲基丙烯酸酯类、丙烯酸酯类单体、苯乙烯类等多种单体的可见光下的可控活性自由基聚合。
背景技术:
自1956年szwarc等报道了阴离子聚合方法后,活性聚合就成为高分子合成方法中最为有效的手段,因其实现了高分子的精确设计以及特定结构和性能的调控。“活性”可控自由基聚合(living radical polymerization/controlled radicalpolymerization)以其反应条件相对温和、适用单体更广、操作简单、工业成本低等特点和优势,引起了众多科研工作者极大的研究热情和兴趣。“活性”可控自由基聚合包括原子转移自由基聚合(atrp),有机金属自由基聚合(omrp),氮氧化物介导的聚合(nmp)和可逆加成-断裂链转移聚合(raft)等,都为具有明确结构的聚合物的精准构筑提供了可能。外界刺激的引入可以实现对聚合行为的调控,如光催化聚合、电催化聚合、机械力控制聚合、氧化还原剂控制聚合等。光作为一种能源被广泛应用于聚合中,与传统的热聚合相比,光聚合可在常温下进行、操作简单、反应平稳,以及可以通过“开”/“关”快速的启动和停止反应等优点。此外,光聚合反应的活化能低,适用于温敏性单体的聚合。在传统的自由基聚合中,大多是通过过渡金属催化剂[即cu(i),ru(ii), fe(ii)]介导休眠种与活性传播的自由基之间的平衡,以维持较低的活性自由基物种浓度。要最小化双分子终止并建立受控/活性链增长显得至关重要。然而,过渡金属催化剂的使用将在最终聚合产物中造成金属污染和残留,会加速聚合物的老化,这也严重限制其在生物医药和电子半导体等行业的应用。因此,自从最初发现光催化自由基聚合以来,大量的研究工作一直致力于降低催化剂的用量和聚合产品的纯化,以期尽量减少金属残留对产品及应用的影响。尽管已经取得了重大进展,但开发非金属催化的自由基聚合的新催化体系无疑是解决这一难题的一个理想方案。
技术实现要素:
本发明的目的是凸显二氧杂蒽嵌蒽类(pxx)化合物作为有机光催化剂在自由基聚合中的高效催化能力,可以实现甲基丙烯酸酯类、丙烯酸酯类、苯乙烯类、乙烯基醚类、乙烯基胺类等单体的在可见光调控下的活性自由基聚合,具有催化效率高,适用单体广,易操作易重复等优点。本发明所采用的具体技术方案为:一种基于氧杂芳环类光催化剂的高活性自由基聚合体系,该聚合体系包括单体、光催化剂和引发剂;所述光催化剂为二氧杂蒽嵌蒽类化合物,引发剂为有机卤化物或硫化物;所述光催化剂的结构如式i所示:
式i中,r1、r2、r3、r4、r5、r1’、r2’、r3’、r4’、和r5’独立地选自氢、卤素、氰基、c1~c24烷基、被一个或多个卤素取代的c1~c24烷基、c1~c24烷氧基、 c1~c24烷基o(c=o)-、c1~c24烷基(c=o)o-、c1~c24烷基(c=o)-、c1~c24烷基 (c=o)nh-、[c1~c24烷基(c=o)]2n-、r1-1r1-2r1-3si-、被一个或多个r1-4取代的 c6~c20芳基、或“杂原子选自n、o和s中的一种或多种,杂原子个数为1-3个”的被一个或多个r1-5取代的含c2~c20的杂芳基;当取代基为多个时,可相同或不同;r1-1、r1-2和r1-3独立地为c1~c18烷基、c1~c18烷氧基、苯基、或被一个或多个r1-1-1取代的苯基;当取代基为多个时,可相同或不同;r1-4、r1-5和r1-1-1独立地为卤素、c1~c18烷基、被一个或多个卤素取代的c1~c18烷基、c1~c18烷氧基、c1~c18烷基o(c=o)-、c1~c18烷基(c=o)o-、 c1~c18烷基(c=o)-、c1~c18烷基(c=o)nh-、[c1~c18烷基(c=o)]2n-、 r1-4-1r1-4-2r1-4-3si-、c6~c10芳基;当取代基为多个时,可相同或不同; r1-4-1、r1-4-2和r1-4-3独立地为c1~c8烷基、c1~c8烷氧基、苯基、或被一个或多个r1-1-1取代的苯基;当取代基为多个时,可相同或不同。非金属催化的自由基聚合的体系的发展关键在于开发高效的有机催化剂。鉴于此,基于“活性”可控自由基聚合的基本原理,我们开发了基于二氧杂蒽嵌蒽 (pxx)的氧杂芳环类有机光催化剂或光敏剂,可以在可见光的照射下,实现一系列烯基类单体的“活性”可控的自由基聚合。该氧杂芳环类光催化剂易于制备,空气敏感度低,化学稳定性高,环境耐受性好,保存期限长,与金属光催化相比,大大降低了聚合反应的成本以及后期的处理程序工艺,甚至可以直接免去聚合产物的后期纯化步骤。不仅扩大了光催化剂的范围,并将在可控自由基聚合领域,甚至是光催化小分子合成领域都将具有非常广阔的应用前景。在一定温度下(常在室温下即可),有机卤化物或硫化物为引发剂,pxx类化合物为有机光催化剂或光敏剂,分别实现一系列乙烯基单体,如甲基丙烯酸甲酯(mma),甲基丙烯酸苄基酯(bnma),甲基丙烯酸丁酯(bma),丙烯酸丁酯(ba),2,2,2-甲基丙烯酸三氟乙基酯(tfema)和苯乙烯(st)等聚合,得到分子量可控,分子量分布窄的聚合物。可以在较宽温度范围下(零下100度到零上100度),在多种溶剂中(极性,非极性或质子性溶剂),选用不同引发剂下(含卤素或硫的引发剂),在0.001ppm到1000ppm的光催化剂负载下,在波长为 300-1000nm范围内的光源照射下,实现可控自由基聚合,聚合物分子量随着转化率的增大而呈现出优异的线性增长,且得到分子量可控的聚合物。此外,所得聚合物,具有较高的末端基团保真度,可以作为大分子引发剂,进行链延长反应,或与其它烯烃类单体进行共聚来制备嵌段聚合物。
作为优选,r1、r3、r4、r5、r1’
、r3’
、r4’
和r5’
独立地为氢、卤素、c1~c
18
烷基、被一个或多个卤素取代的c1~c
18
烷基、被一个或多个r
1-4
取代的c6~c
20
芳基、“杂原子选自n、o和s中的一种或多种,杂原子个数为1-3个”的被一个或多个r
1-5
取代的含c2~c
12
的杂芳基;当取代基为多个时,可相同或不同;和/或,r
1-4
和r
1-5
为卤素、c1~c
18
烷基、被一个或多个卤素取代的c1~c8烷基,c1~c
18
烷氧基、被一个或多个卤素取代的c1~c8烷氧基、被一个或多个r
1-1-1
取代的c6~c
10
芳基;当取代基为多个时,可相同或不同;和/或,r
1-1-1
独立地为c1~c8烷基、被一个或多个卤素取代的c1~c8烷基、 c1~c8烷氧基、c6~c
10
芳基;和/或,r2和r2’
独立地为氢、卤素、c1~c
18
烷基。作为优选,当r1、r3、r4、r5、r1’
、r3’
、r4’
和r5’
独立地为c1~c
18
烷基时,所述的c1~c
18
烷基选自甲基、乙基、丙基、异丙基、正丁基、仲丁基、异丁基、叔丁基、戊基、环戊基、环己基、辛基、十二烷基、十四烷基、十八烷基;当r1、r3、r4、r5、r1’
、r3’
、r4’
和r5’
独立地为被一个或多个卤素取代的 c1~c
18
烷基时,选自三氟甲基、全氟丁基、全氟辛基;和/或,当r1、r3、r4、r5、r1’
、r3’
、r4’
和r5’
独立地为被一个或多个r
1-4
取代的c6~c
20
芳基时,选自被一个或多个r
1-4
取代的苯基;和/或,r
1-4
为c1~c
18
烷基时,选自甲基、乙基、异丙基、叔丁基、环戊基和环己基;和/或,r
1-4
为被一个或多个卤素取代的c1~c8烷基时,选自三氟甲基;和/或,r
1-4
为被一个或多个r
1-1-1
取代的c6~c
10
芳基时,选自被一个或多个 r
1-1-1
取代的苯基和萘基;当r1、r3、r4、r5、r1’
、r3’
、r4’
和r5’
独立地为“杂原子选自n、o和s 中的一种或多种,杂原子个数为1-3个”的被一个或多个r
1-5
取代的c2~c
12
的杂芳基时,选自呋喃、噻吩、吡咯、噻唑、咪唑、吡啶、吡嗪、嘧啶、哒嗪,或和/或,r
1-5
为c1~c
18
烷基时,选自甲基、乙基、异丙基、叔丁基、环戊基和环己基;和/或,r
1-5
为被一个或多个卤素取代的c1~c8烷基时,选自三氟甲基;和/或,r
1-5
为被一个或多个r
1-1-1
取代的c6~c
10
芳基时,选自被一个或多个 r
1-1-1
取代的苯基和萘基;和/或,r
1-1-1
独立地为c1~c8烷基时,选自甲基、乙基、异丙基、叔丁基;为被一个或多个卤素取代的c1~c8烷基时,为三氟甲基;为c6~c
10
芳基时,为苯基。作为优选,r1、r3、r4、r5、r1’
、r3’
、r4’
和r5’
独立地为氢、氟、氯、溴、碘、氰基、甲基、乙基、丙基、异丙基、正丁基、叔丁基、环己基、三氟甲基、甲氧基、乙氧基、
和/或,r2和r2’
独立地为氢、氟、溴。作为优选,所述的如式i所示的化合物包括但不限于以下结构:
作为优选,所述引发剂为包含至少一个c-x键,n-x键,s-x键,o-x键(x为卤素元素f/cl/br/i),硫氰酸酯基(-scn),黄原酸酯基(-s(c=s)or),三硫代碳酸酯基(-s(c=s)sr),硫代氨基甲酸酯基(-s(c=o)nrr’),包括但不限于以下物质:α-溴代苯基乙酸烷基酯,2-溴丙酸烷基酯、2-溴异丁酸烷基酯、溴代丙二酸二烷基酯、2-溴-2-甲基丙二酸二烷基酯,4-氰基-4-[(烷基磺酰硫代羰基)磺酰]
-ꢀ
戊酸等;所述的烷基、r和r’为c
1-c
24
烷基,包括但不限于:甲基,乙基,丙基,异丙基,丁基,叔丁基,戊基,己基,环己基。作为优选,有机引发剂在水性或有机溶剂或它们的混合物中表现出的氧化还原电位在约-0.2v至约-2.0v的范围内。作为优选,所述单体包含不饱和碳-碳或碳-氮键的单体,包括但不限于以下物质:包含任选取代的α-烯烃,二烯烃,内烯烃,环烯烃,丙烯酸酯,甲基丙烯酸酯,丙烯腈,乙酸乙烯酯,新戊酸乙烯酯,乙烯基酮,乙烯基醛,二甲基乙烯基膦酸酯,乙烯基醚,乙烯基胺,n-乙烯基吡咯烷酮,丙烯酰胺,甲基丙烯酰胺,n,n-二甲基丙烯酰胺,n-(2-羟丙基)甲基丙烯酰胺,
n-异丙基丙烯酰胺,低聚乙二醇的丙烯酸酯,低聚乙二醇的甲基丙烯酸酯;所述α-烯烃包括但不限于乙烯,丙烯,丁烯,戊烯,己烯,四氟乙烯,氯乙烯,乙烯基氯,或苯乙烯;所述二烯烃包括但不限于丁二烯,异戊二烯或氯丁二烯;所述内烯烃包括但不限于2-丁烯,2-己烯或3-己烯;所述环烯烃包括但不限于降冰片烯,环戊烯,环己烯,环辛烯或环辛二烯。作为优选,二氧杂蒽嵌蒽衍生物作为光催化剂或光敏剂,光源为包含300nm 至1000nm任何波段或多个波段混合的光源;光源包括但不限于紫外光,汞灯,白炽灯,荧光灯,太阳光,led光源。作为优选,光催化剂或光敏剂的浓度或用量0.001ppm到1000ppm。进一步,单体和引发试剂的摩尔比例为1:1-10000:1,催化剂用量可为0.001 ppm到1000ppm,反应温度为零下100度到零上100度,一般在室温下即可,光源包括波长在300nm到1000nm内的光;该聚合体系条件整体很温和,所述二氧杂蒽嵌蒽类化合物(pxx)是首次作为光催化剂或光敏剂应用到自由基聚合中。所述取代的二氧杂蒽嵌蒽类(pxx)氧杂芳环类光催化剂可以通过以下方法来制备。方法一、通过取代的联萘酚的氧化环化来制备二氧杂蒽嵌蒽类(pxx)化合物。典型合成步骤:向取代的联萘酚类化合物的溶液中加入一价卤化亚铜盐(碘化亚铜,氯化亚铜等),配体,以dmso为溶剂,氧气为氧化剂,特戊酸等在高温下进行酸性条件下的氧化关环或者以多取代苯为溶剂,氧气为氧化剂,碳酸钾等在高温下进行碱性条件下的氧化关环,生成取代的pxx类化合物。方法二、通过未取代的二氧杂蒽嵌蒽进行衍生化来制备取代的pxx类化合物典型合成步骤:在未取代的pxx溶液中,加入2当量以上的正丁基锂,拔掉氧原子附近碳上的氢,在进行低温下的卤代(碘化或者溴化),或不加正丁基锂直接卤化,生成二卤代物,再通过与相应的硼酸酯、格氏试剂等进行suzuki 偶联或者kumada偶联来引入取代基,合成在相应位置取代的pxx类化合物。聚合的实施方法与其他活性自由基聚合相似,都需要提前排除反应物和反应管中的氧气。将单体,引发剂,光催化剂,溶剂依次放入带有搅拌的反应容器中,根据需要可以通过冷冻解冻泵循环脱气除氧,最后向反应体系中充入惰性气氛保护。在一定温度下,选择合适的人工光源或者直接采用太阳光照射来引发聚合。反应监控,可以取少量反应混合物加入含有bht(250ppm)的氘代氯仿中终止聚合,通过核磁监测转化率。达到预定的转化率之后,聚合物自身可以沉降或者将反应液倾入不良溶剂(常用甲醇)中沉降分离,后经过洗涤干燥,
得到聚合物产品。聚合物分析,可以取干燥的聚合物配成四氢呋喃溶液(浓度1-1.5mg/ml) 并通过注射过滤器,过滤后的溶液由gpc测得聚合物的分子量及多分散性。实施实例中所使用的紫色led光源的最大发射在400nm,波长范围为375nm-425 nm,蓝色led光源的最大发射在460nm,波长范围为435-485nm。上述单体为包含碳-碳双键或碳-氮双键的单体,包括但不限于以下:包含任选取代的α-烯烃(包括但不限于乙烯,丙烯,丁烯,戊烯,己烯,四氟乙烯,氯乙烯,乙烯基氯,或苯乙烯),二烯烃(包括但不限于丁二烯,异戊二烯或氯丁二烯),内烯烃(包括但不限于2-丁烯,2-己烯或3-己烯),环烯烃(包括但不限于降冰片烯,环戊烯,环己烯,环辛烯或环辛二烯),丙烯酸酯,甲基丙烯酸酯,丙烯腈,乙酸乙烯酯,新戊酸乙烯酯,乙烯基酮,乙烯基醛,二甲基乙烯基膦酸酯,乙烯基醚,乙烯基胺,n-乙烯基吡咯烷酮,丙烯酰胺,甲基丙烯酰胺, n,n-二甲基丙烯酰胺,n-(2-羟丙基)甲基丙烯酰胺,n-异丙基丙烯酰胺,低聚乙二醇的丙烯酸酯,低聚乙二醇的甲基丙烯酸酯等。实施实例中所使用的单体包括甲基丙烯酸甲酯(mma),甲基丙烯酸苄基酯(bnma),甲基丙烯酸丁酯 (bma),丙烯酸丁酯(ba),2,2,2-甲基丙烯酸三氟乙基酯(tfema)和苯乙烯 (st)等。链延长实验:聚合前,将已经提前制备好的大分子引发剂充分干燥好,避光保存,准确称量好,按照优化的比例条件以此加入单体,pxx类光催化剂和溶剂,混合,置于反应容器中,密封,再通过冷冻解冻泵循环将反应混合物脱气,使得聚合在惰性气氛中进行。其中,上述大分子引发剂为均聚反应制得,实施实例中包括聚甲基丙烯酸甲酯(pmma-br),聚甲基丙烯酸苄基酯(pbnma-br)以及聚丙烯酸丁酯(pba-br)。本发明使用的取代pxx衍生物作为光催化剂,激发后具有较强的还原性,有机催化剂pc在光源照射下变成激发态pc
*
,处于激发态的pc
*
用于还原溴化物或硫化物产生自由基和溴或含硫负离子,自由基用于引发单体聚合形成链的增长,随后阴离子和活性链自由基(活性增长链)反应,再转移出电子使得有机光催化剂回到基态pc,同时活性自由基链在去活化后形成大分子休眠种。如此循环,通过激化活化和去活化,保持休眠种和活性增长链之间的可逆平衡使得聚合反应体系具有一定的可控性,得到分子量可控,分子量分布窄的均聚物或嵌段共聚物。本发明提供的制备方法简单易行,易操作和重复,具有较强的实用性。
附图说明:
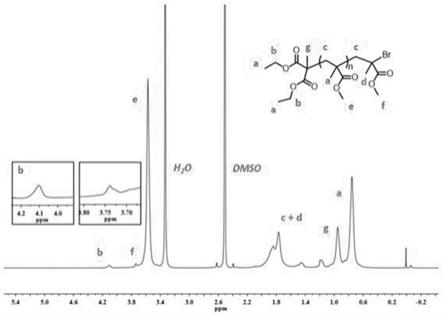
图1是6w紫光反应器和6w蓝光反应器以及太阳光照射下光反应聚合的反应装置图;图2是实施例子中聚合物pmma的核磁氢谱图;图3是实施例子中500ppm催化剂负载下大分子引发剂的链延长和共聚实验的 gpc曲线图;图4是实施例子中低催化剂用量下均聚物制备的一级动力学图;图5是实施例子中10ppm催化剂负载下链延长和共聚实验的gpc曲线图;图6是实施例子中分离得到的甲基丙烯酸苄酯聚合物的核磁氢谱图;图7是实施例子中分离得到的2,2,2-甲基丙烯酸三氟乙基酯聚合物的核磁氢谱图。
具体实施方式
以下通过一些实例具体描述本发明,但本发明不仅仅受限于这些实例。
实施例一pxx 1催化mma的光聚合实验单体mma在二氯甲烷(dcm)溶剂中的浓度分数为9.4m。按照摩尔比 [mma]:[ebp]:[pxx 1]=100:1:0.05,分别将上述原料加入到10ml schlenk管中,密封,再通过冷冻解冻泵循环将反应混合物脱气,使得聚合在惰性气氛中进行。在室温下,用磁力搅拌器充分搅拌反应混合物,并通过紫色led(6w)照射(控制反应管中心到光源的距离为2cm)混合物,并平行在蓝色led(6w)照射(控制反应管中心到光源的距离为2cm)混合物。(反应装置如图1)一定时间间隔,取少量反应混合物加入含有bht(250ppm)的氘代氯仿中终止聚合,通过核磁监测转化率,将余下的反应液在快速搅拌的甲醇中沉降,将所得沉淀物减压干燥至恒重,得到白色粉末。取干燥的聚合物配成四氢呋喃溶液(浓度1-1.5mg/ml) 并通过注射器过滤器,过滤后的溶液由gpc测得聚合物的分子量及多分散性。在该配比条件下,聚合物分子量随着转化率的增长而线性增加。在紫光led照射8h,单体转化率达到73.3%,聚合产物的m
n
=12.8kda,pdi=1.25;在蓝光led照射8h,单体转化率达到78.2%,聚合产物的m
n
=14.0kda,pdi=1.24.在该配比条件下,通过光开关实验发现,聚合的发生是依赖于光照的,只有在光照时才会转化,在黑暗中是不转化的。比较例一单体mma在溶剂(n,n-二甲基乙酰胺、甲苯、四氢呋喃)的浓度分数为9.4 m。按照摩尔比[mma]:[ebp]:[pxx 1]=100:1:0.5,分别将上述原料加入到10mlschlenk管中,密封,再通过冷冻解冻泵循环将反应混合物脱气,使得聚合在紫光下,惰性气氛中进行。其他操作参照实施例一。当体系溶剂换成n,n-二甲基乙酰胺(dma),反应8h,具有88.5%的转化,得到m
n
=20.1kda的聚合物(pdi=1.34),溶剂为甲苯时,反应8h,具有87.5%的转化,得到m
n
=17.4kda的聚合物(pdi=1.32);溶剂为四氢呋喃时,反应8h,具有91.2%的转化,得到m
n
=21.4kda的聚合物(pdi=1.37),说明二氯甲烷作为溶剂中的控制是明显优于n,n-二甲基乙酰胺等其他溶剂的,溶剂的选择对聚合反应的控制能力显得十分重要。比较例二单体mma在二氯甲烷(dcm)的浓度分数为9.4m。按照摩尔比 [mma]:[initiator]:[pxx 1]=100:1:0.5[引发剂分别为2-溴丙酸乙酯、2-溴异丁酸乙酯、溴代丙二酸二乙酯、2-溴-2-甲基丙二酸二乙酯],分别将上述原料加入到10mlschlenk管中,密封,再通过冷冻解冻泵循环将反应混合物脱气,使得聚合在紫光下,惰性气氛中进行。其他操作参照实施例一。当引发剂换成2-溴丙酸乙酯时,反应8h,具有72.7%的转化,得到m
n
=13.3 kda的聚合物(pdi=1.27);引发剂为2-溴异丁酸乙酯时,反应8h,具有78.2%的转化,得到m
n
=14.7kda的聚合物(pdi=1.24);引发剂为溴代丙二酸二乙酯时,反应8h,具有80.8%的转化,得到m
n
=13.7kda的聚合物(pdi=1.22);引发剂为2-溴-2-甲基丙二酸二乙酯时,反应8h,具有81.2%的转化,得到m
n
= 12.1kda的聚合物(pdi=1.19);说明2-溴-2-甲基丙二酸二乙酯引发,控制是明显优于其他引发剂的,引发剂的选择对聚合反应的控制亦显得十分重要。实施例二
pxx 42/2-溴-2-甲基丙二酸二乙酯(dbmm)引发mma的光聚合实验单体mma在二氯甲烷(dcm)溶剂中的浓度分数为9.4m。按照摩尔比 [mma]:[dbmm]:[pxx 42]=100:2:0.05,100:1:0.05和200:1:0.05别将上述原料加入到10ml schlenk管中,密封,再通过冷冻解冻泵循环将反应混合物脱气,使得聚合在紫光下,惰性气氛中进行。其他操作参照实施例一。在[mma]:[dbmm]:[pc]=100:2:0.05配比条件下,反应8h,单体转化率达到 62.5%,聚合产物的m
n
=6.40kda,pdi=1.13。在[mma]:[dbmm]:[pc]=100:1:0.05配比条件下,反应8h,单体转化率达到81.9%,聚合产物的m
n
=12.7kda,pdi=1.12。在[mma]:[dbmm]:[pc]=200:1:0.05配比条件下,反应8h,单体转化率达到 62.9%,聚合产物的m
n
=17.8kda,pdi=1.27。说明随着单体和引发剂比例的增大,对整个聚合的控制一定程度上略有降低,当减小单体和引发剂的比例后,聚合物的多分散性减小,并得到更优异的控制。实施例三pmma-br大分子引发剂的制备将mma(5.00ml,47mmol,1000eq.),dbmm(180μl,940μmol,20eq.) 和光催化剂pxx 42(23.5μmol,0.5eq.)溶解在7.50ml dcm中,将上述原料加入到10ml schlenk管中,密封,再通过冷冻解冻泵循环将反应混合物脱气,使得聚合在紫光下,惰性气氛中进行。其他操作参照实施例一。反应6h后,除去反应物,倒入400ml甲醇中并搅拌5h。然后通过真空过滤分离所得沉淀物并用过量甲醇洗涤。然后将聚合物再溶于最少量的dcm中,再次倒入200ml甲醇中并搅拌3h。通过真空过滤再次收集产物,并在减压下干燥,得到白色粉末(聚合物核磁如图2)(m
n
=4.10kda,pdi=1.19,图3中的gpc轨迹)。实施例四pmma-b-pmma链延长实验将mma(310μl,2.90mmol,240eq.),pmma大分子引发剂(参见上文)(50 mg,12μmol,1eq.)和光催化剂pxx 42(0.05eq.)溶解在1.00ml dcm中,将上述原料加入到10ml schlenk管中,密封,再通过冷冻解冻泵循环将反应混合物脱气,使得聚合在紫光下,惰性气氛中进行。其他操作参照实施例一。反应10h 后,除去反应物,倒入100ml甲醇中并搅拌3h。然后通过真空过滤分离所得沉淀物并用过量甲醇洗涤。然后将聚合物再溶于最少量的dcm中,再次倒入50 ml甲醇中并搅拌2h。根据上述通用聚合方法分离所得聚合物并分析(m
n
=32.5 kda,pdi=1.45)(如图3中的gpc轨迹)实施例五pmma-b-pbnma嵌段实验将pmma大分子引发剂(参见上文)(41mg,10μmol,1eq.),bnma(610μl, 3.6mmol,360eq.)和pxx 42(0.05eq.)溶解在1.50ml dcm中将上述原料加入到10ml schlenk管中,密封,再通过冷冻解冻泵循环将反应混合物脱气,使得聚合在紫光下,惰性气氛中进行。其他操作参照实施例一。反应10h后,除去反应物,倒入150ml甲醇中并搅拌5h。然后通过真空过滤分离所得沉淀物并用过量甲醇洗涤。根据上述一般聚合方法分离所得聚合物并分析(m
n
=98.2kda, pdi=1.58)(如图3中的gpc轨迹)
实施例六pmma-b-pba嵌段实验将pmma大分子引发剂(参见上文)(41mg,10μmol,1eq.),ba(518μl, 3.6mmol,400eq.)和pxx 42(0.05eq.)溶解在1.50ml dcm中将上述原料加入到10ml schlenk管中,密封,再通过冷冻解冻泵循环将反应混合物脱气,使得聚合在紫光下,惰性气氛中进行。其他操作参照实施例一。反应7h后,除去反应物,倒入150ml甲醇中并搅拌5h。然后通过真空过滤分离所得沉淀物并用过量甲醇洗涤。根据上述一般聚合方法分离所得聚合物并分析(m
n
=215kda,pdi =1.66)(如图3中的gpc轨迹)实施例七低催化剂负载下的聚合考察首先将催化剂pxx 42配置成一定浓度的稀溶液(4.7μmol,1eq.溶于5ml dcm中),即预制溶液,以体积换算摩尔用量添加,必要时要二次稀释。将mma (1.00ml,9.4mmol,1000eq.),dbmm(18μl,94μmol,10eq.)和光催化剂pxx 42(0.47μmol,0.05eq.,相对单体50ppm)溶解在1.20ml dcm中,将上述原料依次加入到10ml schlenk管中,整个操作都在手套箱中操作,且在聚合开始前,避光操作,拿出手套箱后,立即使得聚合在蓝光下开始进行。其他操作参照实施例一。反应12h后,除去反应物,倒入150ml甲醇中并搅拌5h。然后通过真空过滤分离所得沉淀物并用过量甲醇洗涤。然后将聚合物再溶于最少量的dcm 中,再次倒入50ml甲醇中并搅拌2h。通过真空过滤再次收集产物,并在减压下干燥,得到白色粉末(m
n
=13.7kda,pdi=1.18)比较例三将mma(1.00ml,9.4mmol,1000eq.),dbmm(18μl,94μmol,10eq.)和光催化剂pxx 42(0.094μmol,0.01eq.,相对单体10ppm)溶解在1.20ml dcm 中,将上述原料加入到10ml schlenk管中,整个操作都在手套箱中操作,且在聚合开始前,避光操作,拿出手套箱后,立即使得聚合在蓝光下开始进行。其他操作参照实施例一。当催化剂用量降低到10ppm,反应14h,具有90.4%的转化,得到m
n
=14.5 kda的聚合物(pdi=1.17),说明10ppm催化剂用量仍然有良好的控制作用,催化剂的用量可以从500ppm降低到50ppm,再到10ppm仍然保持对链端基团保真度和链增长的良好控制。比较例四将mma(1.00ml,9.4mmol,1000eq.),dbmm(18μl,94μmol,10eq.)和光催化剂pxx 42(0.047μmol,0.005eq.,相对单体5ppm)溶解在1.20ml dcm 中,将上述原料加入到10ml schlenk管中,整个操作都在手套箱中操作,且在聚合开始前,避光操作,拿出手套箱后,立即使得聚合在蓝光下开始进行。其他操作参照实施例一。当催化剂用量降低到5ppm,反应14h,具有83.2%的转化,得到m
n
=14.3 kda的聚合物(pdi=1.25),说明5ppm催化剂用量仍然是有效的,引发效率略有下降,但是仍保持优良的多分散性控制。比较例五将mma(1.00ml,9.4mmol,1000eq.),dbmm(18μl,94μmol,10eq.)和光催化剂pxx 42(0.0094μmol,0.001eq.,相对单体1ppm)溶解在1.20ml dcm 中,将上述原料加入到10ml schlenk管中整个操作都在手套箱中操作,且在聚合开始前,避光操作,拿出手套箱后,立即
使得聚合在蓝光下开始进行。其他操作参照实施例一。催化剂用量降低到1ppm,反应14h,具有85.5%的转化,得到m
n
=17.8kda 的聚合物(pdi=1.30),说明1ppm催化剂用量仍然保持对链端和链增长的不错控制,且得到的聚合物产品的多分散性≦1.30。比较例六将mma(1.00ml,9.4mmol,1000eq.),dbmm(18μl,94μmol,10eq.)和光催化剂pxx 42(0.0047μmol,0.0005eq.,相对单体0.5ppm)溶解在1.20ml dcm 中,将上述原料加入到10ml schlenk管中,整个操作都在手套箱中操作,且在聚合开始前,避光操作,拿出手套箱后,立即使得聚合在蓝光下开始进行。其他操作参照实施例一。当催化剂用量降低到0.5ppm,反应14h,具有77.4%的转化,得到m
n
=19.2 kda的聚合物(pdi=1.34),可以明显看到实验分子量和理论分子量的偏差,且多分散性变大,但仍然≦1.35,显示出极高的催化效率。.比较实例七将mma(1.00ml,9.4mmol,1000eq.),dbmm(18μl,94μmol,10eq.)和光催化剂pxx 42(0.00047μmol,0.00005eq.,相对单体0.05ppm)溶解在1.50mldcm中,将上述原料加入到10ml schlenk管中,整个操作都在手套箱中操作,且在聚合开始前,避光操作,拿出手套箱后,立即使得聚合在蓝光下开始进行。其他操作参照实施例一。当催化剂用量降低到0.05ppm,反应15h,具有62.5%的转化,得到m
n
=30.8 kda的聚合物(pdi=1.51),这是让人印象深刻的,强健的催化能力,也是非金属催化剂在极低催化剂负载下的真正实例。实施例八
[0071]
低催化剂负载下(10ppm)的动力学考察
[0072]
将mma(2.00ml,18.8mmol,2000eq.),dbmm(18μl,94μmol,10eq.) 和光催化剂pxx 42(0.188μmol,0.01eq.)溶解在2.50ml dcm中,将上述原料依次加入到10ml schlenk管中,整个操作都在手套箱中操作,且在聚合开始前,避光操作,拿出手套箱后,立即使得聚合在蓝光下开始进行。其他操作参照实施例一。分别间隔一定的时间取点,取少量反应混合物加入含有bht(250ppm) 的氘代氯仿中终止聚合,通过核磁监测转化率,将余下的反应液在快速搅拌的甲醇中沉降,将所得沉淀物减压干燥至恒重,得到白色粉末,然后将聚合物再溶于最少量的dcm中,再次倒入200ml甲醇中并搅拌1h。将所得沉淀物减压干燥至恒重,得到白色粉末。取干燥的聚合物配成四氢呋喃溶液(浓度1-1.5mg/ml) 并通过注射器过滤器,过滤后的溶液由gpc测得聚合物的分子量及多分散性。(如图4)。实施例九10ppm催化剂用量下的大分子引发剂pmma-br的制备将mma(5.00ml,47mmol,1000eq.),dbmm(180μl,940μmol,20eq.) 和光催化剂pxx 42(0.47μmol,0.01eq.,相对单体10ppm)溶解在7.50ml dcm 中,将上述原料加入到10ml schlenk管中,整个操作都在手套箱中操作,且在聚合开始前,避光操作,拿出手套箱后,立即使得聚合在蓝光下开始进行。其他操作参照实施例一。反应8h后,除去反应物,倒入400ml甲醇中并搅拌5h。然后通过真空过滤分离所得沉淀物并用过量甲醇洗涤。然后将聚合物再溶于最少量的dcm中,再次倒入200ml甲醇中并搅拌3h。通过真空过滤再次收集产物,并在减
压下干燥,得到白色粉末(m
n
=8.40kda,pdi=1.20,图5中的gpc轨迹)实施例十pmma-b-pmma链延长实验将165mg上述的pmma大分子引发剂(m
n
=8.40kda,1.0eq)溶解在0.90 ml的dcm中,0.46ml的mma(4.33
×
10-3
mol,220eq.),pxx 42(1.97
×
10-8
mol, 0.001eq.)(已预先配置为稀溶液以便准确地添加,下同)分别依次加到10ml schlenk管中,根据上述一般聚合步骤在蓝光下反应10h,其他操作参照实施例一。然后滴加到100ml甲醇中并搅拌3h,通过真空过滤分离所得沉淀物并用过量甲醇洗涤。然后将聚合物再溶于最少量的dcm中,再次倒入50ml甲醇中并搅拌2h,并在真空烘箱中干燥直至在30℃下恒重,以产生0.341g聚合物(通过重量分析法的转化率为57%)根据上述通用聚合方法分离所得的扩链的 pmma-b-pmma并分析(m
n
=22.8kda,pdi=1.46,图5中的gpc轨迹)实施例十一pmma-b-pbnma嵌段实验将142mg上述pmma大分子引发剂(m
n
=8.40kda,1.0eq.)溶解在1.20ml 的dcm中,0.58ml的bnma(3.4
×
10-3
mol,202eq.),pxx 42(1.69
×
10-8
mol,0.001 eq.)分别依次加到10ml schlenk管中,根据上述一般聚合步骤在蓝光下反应10h,其他操作参照实施例一。反应10h后,滴加到100ml甲醇中并搅拌5h,通过真空过滤分离所得沉淀物并用过量甲醇洗涤。然后将聚合物再溶于最少量的 dcm中,再次倒入50ml甲醇中并搅拌2h,并在真空烘箱中干燥直至在30℃下恒重,以产生0.350g的聚合物(产率为47%)。发现所得的pmma-b-bnma 共聚物的m
n
=34.2kda,pdi=1.60。(图5中gpc轨迹)。实施例十二pmma-b-pba嵌段实验将172mg的上述pmma大分子引发剂(m
n
=8.40kda,1.0eq.)溶解在1.2ml dcm中,0.58ml ba(4.01
×
10-3
mol,196eq.),pxx 42(2.04
×
10-8
mol,0.001eq.) 分别依次加到10ml schlenk管中,根据上述一般聚合步骤在蓝光下反应7h,其他操作参照实施例一。反应7h后,滴加到100ml甲醇中并搅拌2h,得到黄色油状物,并将溶液放入冰箱(约-20℃)中1h。然后倒出甲醇,并在减压下除去残留的溶剂。重复该过程一次,得到0.358g的黄色油(产率52%),所得的 pmma-b-ba共聚物的m
n
=125kda,pdi=1.65(图5中gpc曲线)实施例十三太阳光照射下的50ppm催化剂用量的聚合考察首先将催化剂pxx 42配置成一定浓度的稀溶液(4.7μmol,1eq.溶于5mldcm中),即预制溶液,以体积换算摩尔用量添加。将mma(1.00ml,9.4mmol, 1000eq.),dbmm(18μl,94μmol,10eq.)和光催化剂pxx 42(0.47μmol,0.05eq., 相对单体50ppm)溶解在1.20ml dcm中,将上述原料依次加入到10ml schlenk 管中,整个操作都在手套箱中操作,且在聚合开始前,避光操作,拿出手套箱后,立即放置在搭好的装置上,在日光下开始进行。从上午9点到下午4点,共反应 7h后,通过取样核磁测得49.2%的转化率,倒入150ml甲醇中并搅拌3h,通过真空过滤分离所得沉淀物并用过量甲醇洗涤。然后将聚合物再溶于最少量的 dcm中,再次倒入50ml甲醇中并搅拌1h。通过真空过滤再次收集产物,并在减压下干燥,得到白色粉末(m
n
=9.40kda,pdi=1.22)。
实施例十四50ppm催化剂用量下,甲基丙烯酸卞基酯的均聚考察首先将催化剂pxx 42配置成一定浓度的稀溶液(4.7μmol,1eq.溶于5mldcm中),即预制溶液,以体积换算摩尔用量添加。将bnma(1.72ml,9.4mmol, 1000eq.),dbmm(18μl,94μmol,10eq.)和光催化剂pxx 42(0.47μmol,0.05eq., 相对单体50ppm)溶解在1.80ml dcm中,将上述原料依次加入到10ml schlenk 管中,整个操作都在手套箱中操作,且在聚合开始前,避光操作,拿出手套箱后,立即使得聚合在蓝光下开始进行。其他操作参照实施例一。反应10h后,除去反应物,倒入200ml甲醇中并搅拌5h,通过真空过滤分离所得沉淀物并用过量甲醇洗涤。然后将聚合物再溶于最少量的dcm中,再次倒入100ml甲醇中并搅拌3h。取样核磁测得转化率为93.5%,通过真空过滤再次收集产物,并在减压下干燥,得到白色粉末(m
n
=11.5kda,pdi=1.29)。实施例十五10ppm催化剂用量下,丙烯酸丁酯的均聚考察首先将催化剂pxx 42配置成一定浓度的稀溶液(4.7μmol,1eq.溶于5ml dcm 中),即预制溶液,以体积换算摩尔用量添加。将ba(1.35ml,9.4mmol,1000eq.), dbmm(18μl,94μmol,10eq.)和光催化剂pxx 42(0.094μmol,0.01eq.,相对单体10ppm)溶解在1.50ml dcm中,将上述原料依次加入到10ml schlenk管中,整个操作都在手套箱中操作,且在聚合开始前,避光操作,拿出手套箱后,立即使得聚合在蓝光下开始进行。其他操作参照实施例一。反应7h后,除去反应物,倒入150ml甲醇中并搅拌3h,通过真空过滤分离所得沉淀物并用过量甲醇洗涤。然后将聚合物再溶于最少量的dcm中,再次倒入100ml甲醇中并搅拌1h。取样核磁测得转化率为81.3%,通过真空过滤再次收集产物,并在减压下干燥,得到白色粉末(m
n
=34.2kda,pdi=1.51)。实施例十六10ppm催化剂用量下,2,2,2-甲基丙烯酸三氟乙基酯的均聚考察首先将催化剂pxx 42配置成一定浓度的稀溶液(4.7μmol,1eq.溶于5mldcm中),即预制溶液,以体积换算摩尔用量添加。将tfema(1.33ml,9.4mmol, 1000eq.),dbmm(18μl,94μmol,10eq.)和光催化剂pxx 42(0.094μmol,0.01 eq.,相对单体10ppm)溶解在1.20ml dcm中,将上述原料依次加入到10mlschlenk管中,整个操作都在手套箱中操作,且在聚合开始前,避光操作,拿出手套箱后,立即使得聚合在蓝光下开始进行。其他操作参照实施例一。反应12h 后,除去反应物,倒入150ml甲醇中并搅拌5h,通过真空过滤分离所得沉淀物并用过量甲醇洗涤。然后将聚合物再溶于最少量的dcm中,再次倒入100ml 甲醇中并搅拌2h。取样核磁测得转化率为88.1%,通过真空过滤再次收集产物,并在减压下干燥,得到白色粉末(m
n
=19.8kda,pdi=1.16)。部分pxx催化剂的核磁数据
pxx 1:1h nmr(400mhz,cdcl3)δ7.30(d,j=9.2hz,2h),7.09-7.08(m,4h),6.91(d,j= 9.2hz,2h),6.64(t,j=4.4hz,2h).pxx 2:1h nmr(400mhz,cdcl3)δ7.30(d,j=9.2hz,2h),7.09-7.08(m,4h),6.91(d,j= 9.2hz,2h),6.64(t,j=4.4hz,2h)pxx 5:1h nmr(400mhz,cdcl3)δ7.11(br,2h),7.06(t,2h,j=7.8hz),7.02(br,2h),6.61 (br,2h),2.70(t,4h,j=7.4hz),1.70-1.62(m,4h),1.47-1.38(m,4h),0.97(t,6h,j= 7.4hz)pxx 7:1h nmr(400mhz,c6d6)δ6.93(s,2h),6.90-6.83(m,4h),6.58(dd,j=6.3,2.2hz, 2h),2.69-2.61(m,4h),1.72-1.65(m,4h),1.40-1.20(m,20h),0.89(t,j=9.2,4.5 hz,6h).pxx 12:1h nmr(400mhz,c6d6)δ7.02(d,j=9.0hz,2h),6.82(m,4h),6.70(d,j=9.0hz, 2h),2.53(t,j=7.5hz,4h),1.62-1.47(m,4h),1.28-1.07(m,20h),0.75(t,j=6.8 hz,6h).
pxx 14:1h nmr(400mhz,c6d6)δ7.02(d,j=9.0hz,2h),6.73(d,j=9.0hz,2h),6.70(s,2h), 6.39(s,2h),2.42(t,j=7.7hz,4h),1.55-1.40(m,4h),1.24-0.99(m,20h),0.74(t,j =6.8hz,6h).pxx 17:1h nmr(400mhz,cdcl3)δ7.63(d,j=7.6hz,4h),7.47(t,j=7.4hz,4h),7.41(d,j= 7.2hz,2h),7.35(s,2h),7.10-7.08(m,4h),6.57(d,j=7.2hz,2h)pxx 22:1h nmr(400mhz,c4d8o):δ6.93-6.95(d,j=7.8hz,2h),7.13-7.14(d,j=9.3hz, 2h),7.26-7.28(d,j=8.3hz,2h),7.54-7.56(d,j=6.3hz,2h),7.62-7.64(m,10h).
pxx 25:1h nmr(400mhz,c4d8o)δ1.15-1.18(t,j=14.6hz,6h),1.84-1.87(m,4h),2.81
-ꢀ
2.85(m,4h),6.90-6.92(d,j=8.3hz,2h),7.10-7.12(d,j=9.8hz,2h),7.23-7.25 (d,j=8.3hz,2h),7.45-7.47(d,j=8.3hz,4h),7.51-7.53(d,j=8.3hz,4h),7.62
-ꢀ
7.65(d,j=10.0hz,2h)。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1