基因SNG1缺失在提高酿酒酵母香草醛抗性中的应用的制作方法
本发明涉及酿酒酵母基因sng1缺失在提高香草醛抗性中的应用,属于生物技术领域。
背景技术:
酿酒酵母(saccharomycescerevisiae)是传统的乙醇生产菌株,它具有高效利用己糖,高乙醇低ph耐受力的鲁棒性,同时,酿酒酵母作为一种模式真菌,人们对其分子遗传操作认识较为丰富,操作工具和手段较多,因此成为发酵法生产乙醇以及高值化合物的主要细胞工厂(liuetal.,2009)。
木质纤维素是地球上储量最为丰富的可再生生物质资源。以木质纤维素为原料进行生物乙醇或其他高值化合物的生产,已被全球科学家广泛关注。香草醛是木质纤维素水解液中的一种主要的酚类抑制物,其浓度随着原料及预处理的方式不同而有所不同。香草醛与木质纤维素水解液中的其他抑制物如糠醛、5-羟甲基糠醛、乙酸等协同作用,通过破坏细胞膜结构,降低中心代谢相关酶的活性,断裂dna,抑制翻译起始从而严重抑制微生物的生长及后续发酵过程。科学家有利用生物脱毒来消除抑制物的抑制作用,但这一环节使得生产成本大大增加。同时,香草醛具有抗菌、抗诱变、抗癌和防腐功能(bezerraetal.,2016;kimetal.,2014),被广泛用于化妆品、药品、饮料和食品添加剂,具有极高经济价值。目前,香草醛的来源主要有两个,植物提取和人工合成。而天然的香草醛价格昂贵,每公斤高达1200-4000美元,是合成产品价格的300倍。现有也有利用代谢工程手段实现在酿酒酵母中构建香草醛合成途径,以葡萄糖为原料,对其进行从头合成(furuyaetal.,2017;hansenetal.,2009)。然而香草醛的毒性作用抑制了香草醛的产量,0.9gl-1的香草醛即可对酿酒酵母的生长发酵产生严重抑制,延滞期由2小时延长至24小时左右,发酵周期大幅度拉长。然而具有经济效益的香草醛产量一般应在1gl-1以上,因此发掘提高酿酒酵母香草醛抗性的突变体或元件或构建高香草醛抗性的酿酒酵母细胞工厂具有重要意义。检索发现,有关酿酒酵母sng1基因缺失在提高香草醛抗性中的应用鲜见报道。
技术实现要素:
针对现有技术的不足,本发明要解决的问题是提供一株酿酒酵母sng1基因缺失在提高香草醛抗性中的应用。
本发明所述酿酒酵母sng1基因缺失在提高香草醛抗性中的应用。
本发明所述的酿酒酵母sng1基因缺失突变体,其特征在于:所述突变体的基因序列从左至右由酿酒酵母sng1基因-18~+203bp的核苷酸片段、loxp-kanmx4-loxp的核苷酸片段、酿酒酵母sng1基因+1446~+1644bp的核苷酸片段构成,该突变体的核苷酸序列如seqidno.1所示;其中,所述酿酒酵母sng1基因-18~+203bp的核苷酸序列如seqidno.2所示,所述loxp-kanmx4-loxp的核苷酸序列如seqidno.4所示,所述酿酒酵母sng1基因+1446~+1644bp的核苷酸片段如seqidno.3所示。
上述的酿酒酵母sng1基因缺失突变体的构建方法是采用同源替换的方法。设计与野生型sng1基因序列两侧同源的突变体片段seqidno.1,该突变体的核苷酸序列从左至右分别是:与sng1基因左端序列同源的如seqidno.2所示的序列、如seqidno.4所示的筛选标记loxp-kanmx4-loxp的序列、与sng1基因右端序列同源的如seqidno.3所示的序列。构建时先将seqidno.2与loxp-kanmx4-loxp进行融合pcr,而后再与seqidno.3进行融合pcr,最终融合形成seqidno.1。并将seqidno.1所示的核苷酸转化酵母菌株,在添加有800μgml-1g418的平板上筛选转化子,得到由seqidno.1替代的sng1基因缺失突变体,命名为sng1δ突变体。具体构建步骤是:
(1)酿酒酵母by4741基因组的提取
将酿酒酵母by4741菌株过夜培养于5mlyepd液体培养基中,收集菌体,利用珠磨法破碎细胞提取by4741基因组。
(2)seqidno.2所示与sng1基因左端序列同源的序列片段的获得
以酿酒酵母by4741的基因组为模板进行pcr扩增。
扩增引物为上游引物f1f:gccgtacagagaacaaatatgactaaatcgg,下游引物f1r:attaagggttgtcgacctgcagcgtacgaagcttcagctgacagatgacaatgaggacggc,下划线为与loxp-kanmx4-loxp片段左端同源的序列,用于与loxp-kanmx4-loxp进行融合pcr。
(3)seqidno.3所示与sng1基因右端序列同源的序列片段的获得
以酿酒酵母by4741的基因组为模板进行pcr扩增。扩增引物为上游引物f2f:gaagttattaggtgatatcagatccactagtggcctatggggaagaaattacggtattctcgtggc,下划线部分为与loxp-kanmx4-loxp右端同源序列,用于与loxp-kanmx4-loxp融合pcr,下游引物f2r:ttaatttccgggcgggttgttatttttatcag。
(4)seqidno.4所示的loxp-kanmx4-loxp片段的获得
loxp-kanmx4-loxp从质粒pug6上扩增获得,以pug6质粒为模板进行pcr扩增。引物为上游引物f3f:cagctgaagcttcgtacgctg,下游引物f3r:gcataggccactagtggatctg。
(5)seqidno.1所示酿酒酵母sng1基因缺失突变体基因的核苷酸序列片段的获得
以seqidno.2、loxp-kanmx4-loxp、seqidno.3的核苷酸序列片段为模板进行融合pcr,通过pcr扩增获得seqidno.1所示酿酒酵母sng1基因缺失突变体基因。
(6)以seqidno.1所示酿酒酵母sng1基因缺失突变体基因转化酵母
将得到的seqidno.1所示的核苷酸序列片段进行dna凝胶纯化,再利用醋酸锂方法转入酿酒酵母by4741中,在含有800μgml-1g418的yepd平板上进行筛选。挑取突变体转化子,即初步获得酿酒酵母sng1基因缺失突变体,命名为sng1δ突变体。
(7)突变体的pcr验证:
从筛选平板上挑取单菌落,在含有200μgml-1g418的yepd液体培养基中30℃培养24h,200rpm。然后提取突变体基因组,以获得的基因组为模板,进行pcr验证。上游引物fy设计在sng1序列内部,位于+87~+110区,下游引物用f2r。
fy:cggggtttcgtacagtaatcagcg
f2r:attaaccctacccattaatttccgggcgg
结果判定,阳性对照by4741基因组能够扩增出1558bp的片段,若不能扩出片段,则证明敲除成功。因此正确的sng1δ突变体基因组则不能扩增出相关核苷酸片段。
本发明所述酿酒酵母sng1基因缺失突变体的基因在构建高香草醛抗性的酿酒酵母细胞中的应用。
本发明提供了一株酿酒酵母sng1基因缺失突变体,实验证实该突变株香草醛抗性大幅度提高,在香草醛胁迫下的延滞期和发酵周期大幅度缩短。为构建高香草醛抗性的酿酒酵母细胞提供了基础。
具体的,sng1δ突变体与野生型对照菌株by4741在含有6mmoll-1香草醛的yepd平板上进行梯度生长实验。sng1δ突变体的生长状况显著优于对照菌株。在含有6mmoll-1香草醛的sc培养基中进行有氧摇瓶发酵,突变体的最大比生长速率为0.225h-1,较对照菌株高70%。酿酒酵母解毒香草醛的方式是将其还原成低毒的香草醇,因此,菌株还原香草醛的速率越快,其香草醛的抗性就越强。sng1δ突变体能够快速的将香草醛还原成香草醇,其香草醛最大比还原速率为0.052gg-1h-1,较对照菌株提高48%。
本发明首次公开了一株酿酒酵母sng1基因缺失突变体(sng1δ突变体),该突变体在香草醛胁迫下的最大比生长速率和香草醛比还原速率显著高于对照菌株。该突变体适于以木质纤维素水解液为原料的发酵生产工艺,因其自身的香草醛高抗性,使得发酵过程中可以免去生物脱毒这一步骤,大大节约生产成本。同时该突变体也是香草醛或香草醇生产的优势菌种,具有极大的工业应用前景。进一步的实验证实:在无胁迫下,野生型与本发明所述sng1δ突变体的生长并无差别;但在香草醛胁迫下,sng1δ突变体的最大比生长速率较对照菌株高出70%,香草醛比消耗速率高出52%。提示该突变株适用于香草醛/醇生产或以木质纤维素为原料生产二代燃料乙醇或其他高值化合物的高香草醛耐受性酿酒酵母菌株的构制。
附图说明
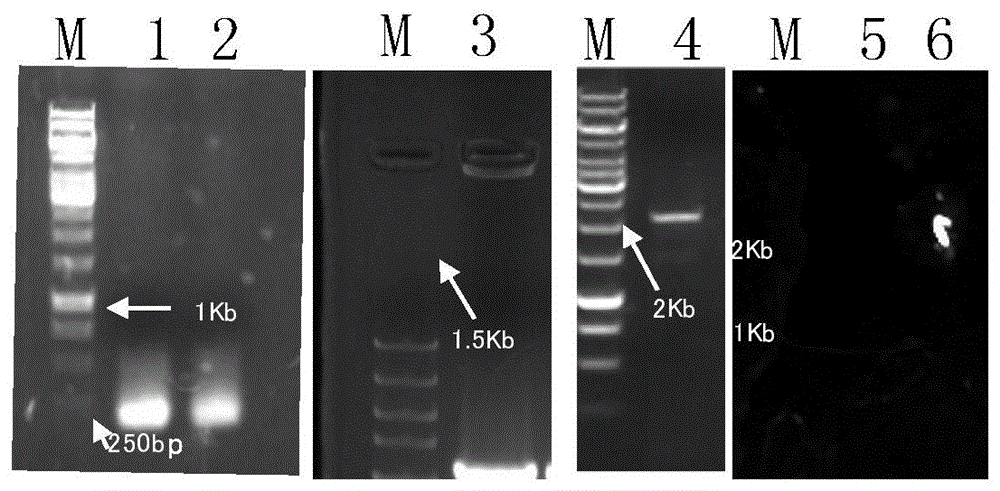
图1为sng1δ突变体构建过程的pcr凝胶电泳图。
其中,m:marker;1:seqidno.2所示的核苷酸片段;2:seqidno.3所示的核苷酸片段;3:loxp-kanmx4-loxp即seqidno.4所示的核苷酸片段;4:seqidno.1所示的核苷酸片段;5:sng1δ突变体基因组扩增sng1,未扩出目的片段则证明敲除成功;6:野生型菌株基因组sng1扩增,作为阳性对照。
图2为sng1δ及其对照菌株的梯度生长实验图。
图3为sng1δ及其对照菌株在香草醛胁迫下的摇瓶发酵生长图。
图4为sng1δ及其对照菌株代谢香草醛能力图。
图5为sng1δ及其对照菌株在正常条件下的摇瓶发酵生长图。
具体实施方式
下面结合具体附图和实施例对本发明内容进行详细说明。如下所述例子仅是本发明的较佳实施方式而已,应该说明的是,下述说明仅仅是为了解释本发明,并非对本发明作任何形式上的限制,凡是依据本发明的技术实质对实施方式所做的任何简单修改,等同变化与修饰,均属于本发明技术方案的范围内。
下述实施例中涉及的培养基和实验材料概述:
(1)酿酒酵母用yepd培养基:20gl-1蛋白胨,10gl-1酵母粉,20gl-1葡萄糖;固体培养基加20gl-1琼脂粉,115℃灭菌30min。用作筛选培养基时,可以加入终浓度为800ugml-1的g418。
酵母完全合成培养基(sc):酵母基础氮源6.7gl-1,硫酸铵5gl-1,csm-ura0.77gl-1,补加尿嘧啶至终浓度20mgl-1。115℃灭菌30min后,加入已灭菌的400gl-1葡萄糖母液至终浓度为20gl-1。
(2)酶与试剂
pcr所用dna聚合酶为phatamaxsuperfidelitydnapolymerasep505-d2,购自于南京诺唯赞生物科技有限公司(vazyme)。
(3)菌株与质粒
酿酒酵母by4741购自于淼灵质粒平台http://www.miaolingbio.com。pug6质粒构建方法见文献anewefficientgenedisruptioncassetteforrepeateduseinbuddingyeast[j].nucleicacidsres,1996,24(13):2519-2524。
其它所使用的材料、试剂等,如无特殊说明,均从商业途径得到。
实施例1:sng1δ突变体的构建
(1)酿酒酵母by4741基因组的提取
将酿酒酵母by4741接于5mlyepd培养基中,30℃,200rp培养过夜,离心收集菌体,用1ml的无菌水洗涤一次,加入200μl的裂解缓冲液悬浮细胞,转移至含有0.4g玻璃珠的螺口破胞管中,再加入200μl的酚/氯仿/异戊醇(25∶24∶1),涡旋振荡3min后,加200μlte溶液混匀,4℃下13000r/min离心10min,转移上清至新eppendorf管中,加1ml的-20℃无水乙醇沉淀dna,再于4℃条件下13000r/min离心10min,弃上清。真空干燥后加400μl的te溶液溶解dna,再加入10μl10mgml-1的rnasea,37℃温育15min后,加入10μl4moll-1的乙酸铵和1ml的无水乙醇混匀后,13000r/min离心10min,去上清,干燥后,用50μl的ddh2o溶解。
裂解缓冲液配制:2%tritonx-100,1%sds,100mmoll-1nacl,10mmoll-1tris-cl,1mmoll-1edta,调ph至8.0。
(2)seqidno.2所示与sng1基因左端序列同源的序列片段的获得
以酿酒酵母by4741的基因组为模板进行pcr扩增。
扩增引物为上游引物f1f:gccgtacagagaacaaatatgactaaatcgg,下游引物f1r:attaagggttgtcgacctgcagcgtacgaagcttcagctgacagatgacaatgaggacggc,下划线为与loxp-kanmx4-loxp片段左端同源的序列,用于与loxp-kanmx4-loxp进行融合pcr。
pcr体系如下:
pcr程序如下:
(3)seqidno.3所示与sng1基因右端序列同源的序列片段的获得
以酿酒酵母by4741的基因组为模板进行pcr扩增。扩增引物为上游引物f2f:gaagttattaggtgatatcagatccactagtggcctatggggaagaaattacggtattctcgtggc,下划线部分为与loxp-kanmx4-loxp右端同源序列,用于与loxp-kanmx4-loxp融合pcr,下游引物f2r:ttaatttccgggcgggttgttatttttatcag
pcr体系如下:
pcr程序如下:
(4)seqidno.4所示的loxp-kanmx4-loxp片段的获得
以pug6质粒为模板进行pcr扩增。引物为上游引物f3f:cagctgaagcttcgtacgctg,下游引物f3r:gcataggccactagtggatctg。
pcr体系如下:
pcr程序如下:
(5)seqidno.1所示酿酒酵母sng1基因缺失突变体基因的核苷酸序列片段的获得
以seqidno.2、loxp-kanmx4-loxp、seqidno.3的核苷酸序列片段为模板进行融合pcr,通过pcr扩增获得seqidno.1所示酿酒酵母sng1基因缺失突变体基因。
pcr扩增体系如下:
pcr程序如下:
(6)以seqidno.1所示酿酒酵母sng1基因缺失突变体基因转化酵母
将得到的seqidno.1所示的核苷酸序列片段进行dna凝胶纯化:pcr产物琼脂糖凝胶电泳后置于紫外灯下,仔细切下含有待回收的dna凝胶,置于eppendorf管中,称重。琼脂糖凝胶中dna片段的回收与纯化采用omegabio-tek公司(usa)的e.z.n.agelextraction试剂盒,根据试剂盒说明书操作。
获得纯化后的seqidno.1所示的核苷酸序列片段,利用醋酸锂方法转入酿酒酵母中。
具体操作如下:
挑单菌落于1-2mlyepd培养基中培养过夜,将过夜培养的菌转接至40mlyepd中,使初始菌体浓度od600为0.2,30℃振荡培养到od600至0.6-1.0之间,离心收集菌体,用无菌水洗涤后,用1ml的0.1moll-1liac重悬菌体转移至新的无菌的eppendorf管中,离心弃上清,重悬细胞于400μl的0.1moll-1liac;将重悬菌液分成50μl的小份放置于无菌的eppendorf管中,离心后,弃上清,依次加入240μl的50%(w/v)peg-3350,36μl1moll-1liac,10μl10mgml-1单链鱼精dna(用前需沸水煮5min后迅速放置冰上,半小时之内用),无菌重蒸水和质粒(或dna片段)共70μl,震荡混匀。30℃保温30min,42℃水浴中热激25min。离心除去上清,重悬细胞于yepd中孵育2-4h,离心后重悬于无菌水中,涂布于含有800μgml-1g418的yepd平板上进行筛选。初步获得酿酒酵母sng1基因缺失突变体,命名为sng1δ突变体。
(7)突变体的pcr验证:
从筛选平板上挑取单菌落,在含有200μgml-1g418的yepd液体培养基中30℃培养24h,200rpm。然后提取突变体基因组,用pcr进行验证。具体操作按照by4741基因组提取方法执行。
以上述获得的基因组为模板,按如下条件进行pcr验证。上游引物fy设计在sng1序列内部,位于+1551~+1571区,下游引物用f2r。
fy:cggggtttcgtacagtaatcagcg
f2r:attaaccctacccattaatttccgggcgg
结果判定,阳性对照by4741基因组能够扩增出1558bp的片段,若不能扩出片段,则证明敲除成功。因此正确的sng1δ突变体基因组则不能扩增出相关核苷酸片段。
pcr体系如下:
pcr程序如下:
实施例2:sng1δ突变体在提高香草醛抗性(香草醛耐受性)中的应用
(1)sng1δ突变体香草醛耐受实验
将获得的sng1δ突变体在含有6mmoll-1香草醛的yepd平板上进行梯度生长实验。具体操作如下:
接种sng1δ突变体于1-2ml的yepd培养基中,30℃过夜培养至对数生长期,将培养产物以初始od600为0.2转接至5ml新鲜的培养基中,培养过夜后离心收集菌体,用1ml无菌水清洗悬浮菌体3次,8000r/min离心后,再次用无菌水悬浮菌体,将其放在30℃放置9h,制备休止细胞。期间配制培养基倒平板,自然晾干。调节菌悬液浓度至od600为1.0,依次进行10倍梯度稀释,而后依次取4μl菌悬液点滴于测试平板,置于30℃温箱培养1-3天,观察菌落生长情况,拍照。对照菌株也按上述操作进行。
结果见图2,从图中可明显看出在香草醛胁迫下,sng1δ突变体生长状况优于对照菌株。
(2)摇瓶发酵:
挑取sng1δ突变体单菌落于1-2ml酵母完全合成培养基(sc)中,30℃200r/min培养约24h。以始od6000.2,转接于20ml新鲜培养基中进行二次活化,30℃200r/min过夜培养至对数中期。以初始od600为0.2,转接过夜培养物于含有40ml含有6mmoll-1香草醛的sc培养基中,30℃200rpm条件下摇床培养。定期取样测样品od600。
最大比生长速率计算方法:对数生长期ln(od600)对时间的线性回归斜率。sng1δ突变体香草醛胁迫下最大比生长速率为0.225h-1(见图3)。
胞外香草醛含量用上述取得的样品测完od600后离心,取上清用于hplc测定。
hplc测定香草醛方法如下:
发酵液样品经13000r/min离心10min后,用0.45μm微孔滤膜过滤去除沉淀后,使用高效液相色谱仪系统进行胞外代谢物的分析。香草醛的检测利用二极管阵列检测器(spd-m20a)和biosil-c18柱(bio-rad,usa),以40%甲醇为流动相,0.6mlmin-1的流速室温检测210nm处的吸光值。
香草醛比消耗速率根据细胞干重计算,细胞干重测定如下:分别取10ml、20ml、30ml、40ml和60ml培养液,先测定其od600,后用0.45μm孔径的硝酸纤维素滤膜(预先称重)过滤去除上清液,使用去离子水洗涤两次后置于微波炉360w加热20min后称重,根据质量差求得培养液细胞干重,利用od600乘以所取体积计算培养液中细胞的od600值;绘制细胞干重与od600线性关系图。发酵过程中的细胞干重利用od600与细胞干重的线性关系折算。by4741系列菌株每单位od600对应0.18gl-1的细胞干重。香草醛比消耗速率按下面公式进行推算:
其中,r为取样点m到n这段时间某种物质的比利用或比生成速率,a,b和t分别为取样点n,i,m处的代谢物浓度,生物质浓度和时间,比例用或比生成速率的单位为gg-1h-1。
根据计算,sng1δ突变体的香草醛比消耗速率为0.052gg-1h-1(见图4)。
野生型by4741也按上述操作进行摇瓶发酵,其最大比生长速率计算按照上述sng1δ突变体的最大比生长速率方法进行计算,为0.132h-1(见图3),香草醛比消耗速率也按照sng1δ突变体的香草醛比消耗速率方法进行计算,为0.035gg-1h-1(见图4)。
sng1δ突变体在无香草醛胁迫的sc培养基中进行摇瓶发酵,操作方法如胁迫条件发酵,最大比生长速率是0.293h-1(见图5)。
野生型by4741也按上述操作进行无胁迫摇瓶发酵,其最大比生长速率为0.304h-1(见图5)。
由发酵结果可知,在无胁迫下,野生型与sng1δ突变体的生长并无差别。但在香草醛胁迫下,sng1δ突变体的最大比生长速率较对照菌株高出70%,香草醛比消耗速率高出52%。
序列表
<110>齐鲁工业大学
<120>基因sng1缺失在提高酿酒酵母香草醛抗性中的应用
<141>2020-06-09
<160>4
<210>1
<211>2032
<212>dna
<213>人工序列
<221>酿酒酵母sng1基因缺失突变体基因的核苷酸序列
<222>(1)…(2032)
<400>1
gccgtacagagaacaaatatgactaaatcggttggtgatgaagagtcacagtacattgag60
gaccctagttttgcagcagcagctgcatttactggcggcagggacggggtttcgtacagt120
aatcagcgatttgctgagggttccggccattcttctgacttagcaaagtcattagaagac180
tatcggcctcctgatgaaaagccgtcctcattgtcatctgtagctgaagcttcgtacgct240
gcaggtcgacaacccttaatataacttcgtataatgtatgctatacgaagttattaggtc300
tagagatctgtttagcttgcctcgtccccgccgggtcacccggccagcgacatggaggcc360
cagaataccctccttgacagtcttgacgtgcgcagctcaggggcatgatgtgactgtcgc420
ccgtacatttagcccatacatccccatgtataatcatttgcatccatacattttgatggc480
cgcacggcgcgaagcaaaaattacggctcctcgctgcagacctgcgagcagggaaacgct540
cccctcacagacgcgttgaattgtccccacgccgcgcccctgtagagaaatataaaaggt600
taggatttgccactgaggttcttctttcatatacttccttttaaaatcttgctaggatac660
agttctcacatcacatccgaacataaacaaccatgggtaaggaaaagactcacgtttcga720
ggccgcgattaaattccaacatggatgctgatttatatgggtataaatgggctcgcgata780
atgtcgggcaatcaggtgcgacaatctatcgattgtatgggaagcccgatgcgccagagt840
tgtttctgaaacatggcaaaggtagcgttgccaatgatgttacagatgagatggtcagac900
taaactggctgacggaatttatgcctcttccgaccatcaagcattttatccgtactcctg960
atgatgcatggttactcaccactgcgatccccggcaaaacagcattccaggtattagaag1020
aatatcctgattcaggtgaaaatattgttgatgcgctggcagtgttcctgcgccggttgc1080
attcgattcctgtttgtaattgtccttttaacagcgatcgcgtatttcgtctcgctcagg1140
cgcaatcacgaatgaataacggtttggttgatgcgagtgattttgatgacgagcgtaatg1200
gctggcctgttgaacaagtctggaaagaaatgcataagcttttgccattctcaccggatt1260
cagtcgtcactcatggtgatttctcacttgataaccttatttttgacgaggggaaattaa1320
taggttgtattgatgttggacgagtcggaatcgcagaccgataccaggatcttgccatcc1380
tatggaactgcctcggtgagttttctccttcattacagaaacggctttttcaaaaatatg1440
gtattgataatcctgatatgaataaattgcagtttcatttgatgctcgatgagtttttct1500
aatcagtactgacaataaaaagattcttgttttcaagaacttgtcatttgtatagttttt1560
ttatattgtagttgttctattttaatcaaatgttagcgtgatttatattttttttcgcct1620
cgacatcatctgcccagatgcgaagttaagtgcgcagaaagtaatatcatgcgtcaatcg1680
tatgtgaatgctggtcgctatactgctgtcgattcgatactaacgccgccatccagtgtc1740
gaaaacgagctctcgagaacccttaatataacttcgtataatgtatgctatacgaagtta1800
ttaggtgatatcagatccactagtggcctatgcgggaagaaattacggtattctcgtggc1860
atgggttgccctcaatacatccttgatgccattttgtatgaagtttgcaggtaaaaaaat1920
gcaaaaaaatgctatgcaagcagcagaagccgctgtcgcagcagctacccagcgtgctag1980
ccgcccggcagaggccaatactgataaaaataacaacccgcccggaaattaa2032
<210>2
<211>221
<212>dna
<213>人工序列
<221>酿酒酵母sng1基因-18~+203bp的核苷酸序列
<222>(1)…(221)
<400>2
gccgtacagagaacaaatatgactaaatcggttggtgatgaagagtcacagtacattgag60
gaccctagttttgcagcagcagctgcatttactggcggcagggacggggtttcgtacagt120
aatcagcgatttgctgagggttccggccattcttctgacttagcaaagtcattagaagac180
tatcggcctcctgatgaaaagccgtcctcattgtcatctgt221
<210>3
<211>199
<212>dna
<213>人工序列
<221>酿酒酵母sng1基因+2445~+1644bp的核苷酸序列
<222>(1)…(199)
<400>3
gggaagaaattacggtattctcgtggcatgggttgccctcaatacatccttgatgccatt60
ttgtatgaagtttgcaggtaaaaaaatgcaaaaaaatgctatgcaagcagcagaagccgc120
tgtcgcagcagctacccagcgtgctagccgcccggcagaggccaatactgataaaaataa180
caacccgcccggaaattaa199
<210>4
<211>1612
<212>dna
<213>人工序列
<221>loxp-kanmx4-loxp的核苷酸序列
<222>(1)…(1612)
<400>4
agctgaagcttcgtacgctgcaggtcgacaacccttaatataacttcgtataatgtatgc60
tatacgaagttattaggtctagagatctgtttagcttgcctcgtccccgccgggtcaccc120
ggccagcgacatggaggcccagaataccctccttgacagtcttgacgtgcgcagctcagg180
ggcatgatgtgactgtcgcccgtacatttagcccatacatccccatgtataatcatttgc240
atccatacattttgatggccgcacggcgcgaagcaaaaattacggctcctcgctgcagac300
ctgcgagcagggaaacgctcccctcacagacgcgttgaattgtccccacgccgcgcccct360
gtagagaaatataaaaggttaggatttgccactgaggttcttctttcatatacttccttt420
taaaatcttgctaggatacagttctcacatcacatccgaacataaacaaccatgggtaag480
gaaaagactcacgtttcgaggccgcgattaaattccaacatggatgctgatttatatggg540
tataaatgggctcgcgataatgtcgggcaatcaggtgcgacaatctatcgattgtatggg600
aagcccgatgcgccagagttgtttctgaaacatggcaaaggtagcgttgccaatgatgtt660
acagatgagatggtcagactaaactggctgacggaatttatgcctcttccgaccatcaag720
cattttatccgtactcctgatgatgcatggttactcaccactgcgatccccggcaaaaca780
gcattccaggtattagaagaatatcctgattcaggtgaaaatattgttgatgcgctggca840
gtgttcctgcgccggttgcattcgattcctgtttgtaattgtccttttaacagcgatcgc900
gtatttcgtctcgctcaggcgcaatcacgaatgaataacggtttggttgatgcgagtgat960
tttgatgacgagcgtaatggctggcctgttgaacaagtctggaaagaaatgcataagctt1020
ttgccattctcaccggattcagtcgtcactcatggtgatttctcacttgataaccttatt1080
tttgacgaggggaaattaataggttgtattgatgttggacgagtcggaatcgcagaccga1140
taccaggatcttgccatcctatggaactgcctcggtgagttttctccttcattacagaaa1200
cggctttttcaaaaatatggtattgataatcctgatatgaataaattgcagtttcatttg1260
atgctcgatgagtttttctaatcagtactgacaataaaaagattcttgttttcaagaact1320
tgtcatttgtatagtttttttatattgtagttgttctattttaatcaaatgttagcgtga1380
tttatattttttttcgcctcgacatcatctgcccagatgcgaagttaagtgcgcagaaag1440
taatatcatgcgtcaatcgtatgtgaatgctggtcgctatactgctgtcgattcgatact1500
aacgccgccatccagtgtcgaaaacgagctctcgagaacccttaatataacttcgtataa1560
tgtatgctatacgaagttattaggtgatatcagatccactagtggcctatgc1612
- 还没有人留言评论。精彩留言会获得点赞!