VEGF-trap多肽及其应用的制作方法
vegf-trap多肽及其应用
技术领域
1.本技术涉及生物医药领域,具体的涉及一种vegf-trap多肽及其应用。
背景技术:
2.肿瘤的无限制侵袭性生长及其转移依赖于血管生成。血管内皮生长因子(vascularendothelial growth factor,vegf)是血管形成作用最强的正性调控因子之一,它通过与其特异性受体——血管内皮生长因子受体(vascular endothelial growth factor receptor,vegfr)结合而刺激新生血管的形成。因此阻碍vegfs信号通路的传导是目前治疗肿瘤的有效方法之一。
3.genentech公司所研发的bevacizumab(即vegf-trap,商品名,avastin)是一种重组的人鼠嵌合抗体,可通过封闭vegf-a阻断其与血管内皮细胞生长因子受体结合,使vegfr 无法活化而发挥抗血管生成的作用。
技术实现要素:
4.本技术提供了一种vegf-trap多肽及其应用。本技术所述的vegf-trap与seq id no.8 所示的序列相比,在第148位包含氨基酸的取代。本技术所述的vegf-trap可用于构建融合蛋白或免疫缀合物。本技术还提供了所述vegf-trap或融合蛋白或免疫缀合物在治疗疾病或病症中的应用。本技术所述的vegf-trap多肽的稳定性显著提高,和/或非特异性结合的能力显著下降。
5.一方面,本技术提供了一种vegf-trap多肽,其与seq id no.8所示的序列相比,在第 148位包含氨基酸的取代。
6.在某些实施方式中,所述的vegf-trap多肽与seq id no.8所示的序列相比,在第153 位包含氨基酸的取代。
7.在某些实施方式中,所述的vegf-trap多肽与seq id no.8所示的序列相比,在第156 位包含氨基酸的取代。
8.在某些实施方式中,所述的vegf-trap多肽包含选自下组的氨基酸残基处的氨基酸取代: k148、r153和k156。
9.在某些实施方式中,所述的vegf-trap多肽包含k148a或k148t所示的氨基酸取代。
10.在某些实施方式中,所述的vegf-trap多肽包含r153a或r153t所示的氨基酸取代。
11.在某些实施方式中,所述的vegf-trap多肽包含k156a或k156t所示的氨基酸取代。
12.在某些实施方式中,所述的vegf-trap多肽包含选自下组的氨基酸取代:
13.a)k148a、r153a和k156a;和,
14.b)k148t、r153t和k156t。
15.在某些实施方式中,所述的vegf-trap多肽包含vegfr1的第二ig结构域和vegfr2 的第三ig结构域的突变体。在某些实施方式中,所述突变体包含如seq id no.2-3中任一项所示的氨基酸序列。
16.在某些实施方式中,所述vegfr1的第二ig结构域包含seq id no.4所示的氨基酸序列。
17.在某些实施方式中,所述vegf-trap多肽包含seq id no.6-7中任一项所示的氨基酸序列。
18.在某些实施方式中,所述vegf-trap多肽能够结合vegf。
19.另一方面,本技术提供了一种融合蛋白或免疫缀合物,其包含本技术所述的vegf-trap 多肽。
20.另一方面,本技术提供了一种分离的核酸分子,其编码本技术所述的vegf-trap多肽和/ 或本技术所述的融合蛋白或免疫缀合物。
21.另一方面,本技术提供了一种载体,其包含本技术所述的分离的核酸分子。
22.另一方面,本技术提供了一种细胞,其包含或表达本技术所述的vegf-trap多肽、本技术所述的融合蛋白或免疫缀合物、本技术所述的分离的核酸分子或本技术所述的载体。
23.另一方面,本技术提供了一种制备本技术所述的vegf-trap多肽的方法,其包括在表达本技术所述的vegf-trap多肽的条件下,培养本技术所述的细胞。
24.另一方面,本技术提供了一种药物组合物,其包括本技术所述的vegf-trap多肽、本技术所述的融合蛋白或免疫缀合物、本技术所述的分离的核酸分子或本技术所述的载体和/或本技术所述的细胞,以及任选地药学上可接受的佐剂。
25.另一方面,本技术提供了一种本技术所述的vegf-trap多肽、本技术所述的融合蛋白或免疫缀合物,和/或本技术所述的药物组合物在制备治疗药物中的用途,所述药物用于治疗肿瘤。
26.另一方面,本技术提供了一种抑制人血管生长的方法,其包括施用有效量的本技术所述的vegf-trap多肽和/或本技术所述的融合蛋白或免疫缀合物。
27.另一方面,本技术提供了一种抑制vegf受体配体活性的方法,其包括施用有效量的本技术所述的vegf-trap多肽和/或本技术所述的融合蛋白或免疫缀合物。
28.另一方面,本技术提供了一种减轻或防止血浆渗漏的方法,其包括向有需要的受试者施用有效量的本技术所述的vegf-trap多肽和/或本技术所述的融合蛋白或免疫缀合物。
29.本领域技术人员能够从下文的详细描述中容易地洞察到本技术的其它方面和优势。下文的详细描述中仅显示和描述了本技术的示例性实施方式。如本领域技术人员将认识到的,本技术的内容使得本领域技术人员能够对所公开的具体实施方式进行改动而不脱离本技术所涉及发明的精神和范围。相应地,本技术的说明书中的描述仅仅是示例性的,而非为限制性的。
具体实施方式
30.以下由特定的具体实施例说明本技术发明的实施方式,熟悉此技术的人士可由本说明书所公开的内容容易地了解本技术发明的其他优点及效果。
31.术语定义
32.在本技术中,术语“多肽”通常是指由通过酰胺键(也称为肽键)线性连接的单体
(氨基酸)构成的分子。术语“多肽”可以是具有两个或更多个氨基酸的任意链,并且不指特定长度的产物。本技术所述多肽包括肽、二肽、三肽、寡肽、蛋白质、氨基酸链或任何其它用于指具有两个或更多个氨基酸的链,而且术语“多肽”可以代替这些术语中任一个或与其交换使用。术语“多肽”还可以指多肽的表达后修饰的产物,包括但不限于糖基化、乙酰化、磷酸化、酰化、通过已知的保护性/封闭性基团衍生化、蛋白水解分裂、或通过非天然存在的氨基酸修饰。多肽可以自天然的生物学来源衍生或通过重组技术生成。
33.在本技术中,术语“vegf”通常是指血管内皮细胞生长因子(vascular endothelial growth factor)。vegf可以涉及调节正常的和异常的血管发生及与肿瘤和眼内病症有关的新血管化 (参见ferrara,n.和davis-smyth,t.,endocr.rev.18,1997,4-25等)。vegf可以在胚胎血管生成期间在新血管形成中和在成年期间在血管发生中具有重要的调节功能。vegf可以促进肿瘤的生长。vegf是高度保守的同源二聚体糖蛋白。vegf有六个等型(isoforms):vegf-a、 vegf-b(包括vegf-b167以及vegf-b186)、vegf-c、vegf-d以及vegf-e。在本技术中,所述vegf可以为人vegf。
34.在本技术中,术语“vegfr1”通常是指血管内皮生长因子受体1。vegfr1是vegfr 的一种。vegfr属于受体酪氨酸激酶超家族,是一种膜镶嵌蛋白。vegfr的膜外部分大约有750个氨基酸残基,由7个与免疫球蛋白结构类似的ig结构域组成。vegfr1的膜外区中第第二个ig结构域是与配体结合的区域。vegfr1的不同剪接体可以竞争性结合vegf(例如,可以结合vegf-a、vegf-b),从而阻止vegf与vegfr2结合。
35.在本技术中,术语“vegfr2”通常是指血管内皮生长因子受体2。vegfr2的第三个ig 结构域可以对与配体的结合的专一性起作用。vegfr2可以与vegf-a、vegf-e结合。
36.在本技术中,术语“vegf-trap多肽”通常是指,其包括将vegfr1的第二个ig结构域和vegfr2的第三个ig结构域与人igg1的fc片段融合在一起的重组融合蛋白,以及在此基础上改造的修饰后的重组融合蛋白。vegf-trap多肽可以为由genentech公司研发的 aflibercept。所述vegf-trap多肽可以与人所有的vegf-a亚型结合。所述vegf-trap多肽还可以与pigf-2结合。所述vegf-trap多肽可以阻断vegf-a诱导vegfr1活化的过程,也可以阻断vegf-a诱导vegfr2活化的过程。所述vegf-trap多肽可以发挥抗肿瘤血管生成的作用,亦可有效地减少实体瘤的体积和转移。所述vegf-trap多肽可以单独使用,也可以与化疗药物联合使用治疗肿瘤,例如可以治疗复发性或顽固性的实体瘤。
37.在本技术中,术语“氨基酸取代”通常是指用另一种不同的氨基酸残基替换至少一个现有的氨基酸残基。所述替换的氨基酸残基可以是“天然存在的氨基酸残基”,例如,可以为丙氨酸(ala)、精氨酸(arg)、天冬酰胺(asn)、天冬氨酸(asp)、半胱氨酸(cys)、谷氨酰胺(gln)、谷氨酸(glu)、甘氨酸(gly)、组氨酸(his)、异亮氨酸(ile):亮氨酸(leu)、赖氨酸(lys)、甲硫氨酸(met)、苯丙氨酸(phe)、脯氨酸(pro)、丝氨酸(ser)、苏氨酸(thr)、色氨酸(trp)、酪氨酸(tyr)和缬氨酸(val)。所述替换的氨基酸残基也可以是非天然形式存在的氨基酸残基,例如可以为正亮氨酸、鸟氨酸、正缬氨酸、高丝氨酸、aib和其它氨基酸残基类似物。本技术中,所述的氨基酸取代可以为非保守取代。所述非保守取代可包括以非保守的形式改变目标蛋白或多肽中的氨基酸残基,例如将具有某种侧链大小或某种特性(例如,亲水性)的氨基酸残基变为具有不同侧链大小或不同特性(例如,疏水性)的氨基酸残基。本技术中,所述的氨基酸取代也可以为保守取代。所述保守取代可包括以保守的形式改变目标蛋
白或多肽中的氨基酸残基,例如将具有某种侧链大小或某种特性(例如,亲水性) 的氨基酸残基变为具有相同或相似侧链大小或者相同或相似特性(例如,仍为亲水性)的氨基酸残基。这样的保守取代通常不会对所产生的蛋白质的结构或功能带来很大影响。在本技术中,作为所述融合蛋白或其片段的氨基酸序列变体可包括不显著改变蛋白质结构或其功能(例如,具有人glp-1的至少部分活性的突变体)的保守氨基酸取代。
38.在本技术中,术语“核酸分子”通常是指可以编码本技术所述的vegf-trap多肽的任意核酸。本技术所述的核酸分子可以包括天然存在的核酸,如脱氧核糖核酸(dna)或核糖核酸(rna),以及化学合成或利用重组基因技术产生的人工设计的核酸,包括例如核酸类似物,例如肽核酸(pna)或锁核酸(lna)等(可以参见sambrook,j.和russel,d.w.(2001), molecular cloning:a laboratorymanual(第3版)cold spring harbor,ny,cold spring harborlaboratorypress)。天然存在的核酸可以包括dna序列(如基因组dna或cdna分子)、以及rna序列(如hnrna、mrna或rrna分子)或其反向互补核酸序列。所述的核酸分子可以是单链或双链分子。例如,其长度可以为30至5000个核苷酸,例如可以为30至3000 个核苷酸、45至2000个核苷酸、60至1000个核苷酸或75至500个核苷酸。
39.在本技术中,术语“载体”通常是指能够将遗传物质(例如本技术所述的核酸分子)转移至目标位置(例如细胞)的运载工具。所述载体可以包括质粒、病毒、粘粒和/或人工染色体。例如,所述载体可以包括工程化改造的载体。所述工程化改造的载体可以包含复制起点、多克隆位点和可选择标记。所述载体可以为核苷酸序列,例如可以为dna序列。所述载体可以包含待转移的目的核酸(例如本技术所述的核酸分子)以及发挥所述运载工具作用的核酸片段。所述载体可以包含能够调节和/或控制所述遗传物质表达的功能结构。所述载体还可以包含选自下组的一种或多种的功能结构:启动子、遗传标记、抗生素抗性、报告基因和蛋白质纯化标签。所述载体可以在靶细胞中发挥表达本技术所述的核酸分子的作用。
40.在本技术中,术语“细胞”通常是指包含本技术所述核酸分子的细胞,及其后代。所述细胞包含原代转化的细胞,也可以包含从其衍生的子代,且无论传代次数是多少。子代可以在核酸含量方面不与亲本细胞完全相同,可以含有突变。
41.在本技术中,术语“免疫缀合物”通常是指与治疗部分,例如细胞毒素、药物或放射性同位素连接的多肽(例如本技术所述的vegf-trap多肽)。所述细胞毒素或细胞毒性剂可以包括对细胞有害(例如,杀死)的任何药剂。例如可以包括紫杉醇和/或细胞松弛素b。所述放射性同位素可以包括放射性碘。
42.在本技术中,术语“药物组合物”通常是指可以向有需求的受试者施用的组合物。在某些实施方式中,所述药物组合物可以包含用于非肠道、透皮、内腔内、动脉内、膜内和/或鼻内给药或直接注射入组织的组合物。例如,所述药物组合物可以通过输注或注射向患者给药。例如可以通过静脉内、腹膜内、皮下、肌肉内、局部或皮内给药。所述的药物组合物可以包括药学上可接受的载体。例如,所述包括药学上可接受的载体可以包括磷酸盐缓冲盐溶液、水、乳剂(如油/水乳剂)、各类保湿剂、无菌溶液、脂质体。所述组合物可通过公知的常规方法来配制。向受试者给药时,所述药物组合物的剂量方案可由参与的医生和临床因素来确定。如现有医学技术所公知的,对于任一患者的剂量取决于许多因素,包括患者的身材、身体表面积、年龄、给药的特定化合物、性别、给药时间和途径、综合健康情况、以及同时给药的其他药物。
43.在本技术中,术语“包含”通常是指包括明确指定的特征,但不排除其他要素。
44.在本技术中,术语“约”通常是指在指定数值以上或以下0.5%-10%的范围内变动,例如在指定数值以上或以下0.5%、1%、1.5%、2%、2.5%、3%、3.5%、4%、4.5%、5%、5.5%、 6%、6.5%、7%、7.5%、8%、8.5%、9%、9.5%、或10%的范围内变动。
45.发明详述
46.一方面,本技术提供一种vegf-trap多肽,其与 sdtgrpfvemyseipeiihmtegrelvipcrvtspnitvtlkkfpldtlipdgkriiwdsrkgfii snatykeiglltceatvnghlyktnylthrqtntiidvvlspshgielsvgeklvlnctarte lnvgidfnweypsskhqhkklvnrdlktqsgsemkkflstltidgvtrsdqglytcaassg lmtkknstfvrvhekdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvs hedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsn kalpapiektiskakgqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpe nnykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg (seq id no.8)所示的序列相比,在第148位包含氨基酸的取代。
47.在本技术中,氨基酸的取代的位置可以从seq id no.8所示的氨基酸序列的n端起计算。
48.例如,与seq id no.8所示的序列相比,所述vegf-trap多肽可包含1-3个(例如,可以包含1个、2个或3个)氨基酸取代。
49.例如,所述的vegf-trap多肽与seq id no.8所示的序列相比,可以在第153位包含氨基酸的取代。
50.例如,所述的vegf-trap多肽与seq id no.8所示的序列相比,可以在第156位包含氨基酸的取代。
51.在本技术中,所述的vegf-trap多肽可以包含选自下组的氨基酸残基处的氨基酸取代: k148、r153和k156。例如,所述的vegf-trap多肽可以包含在k148处的氨基酸取代。例如,所述的vegf-trap多肽可以包含在r153处的氨基酸取代。例如,所述的vegf-trap多肽可以包含在k156处的氨基酸取代。例如,所述的vegf-trap多肽可以包含在k148和r153 处的氨基酸取代。例如,所述的vegf-trap多肽可以包含在r153和k156处的氨基酸取代。例如,所述的vegf-trap多肽可以包含在k148和k156处的氨基酸取代。又例如,所述的 vegf-trap多肽可以包含在k148、r153和k156处的氨基酸取代。
52.在本技术中,所述“氨基酸取代xn”是指在相应于seq id no:8所示的氨基酸序列中第n位的残基x处发生氨基酸取代,其中n为正整数,x为任意氨基酸残基的缩写。例如,“氨基酸取代k148”表示相应于seq id no:8所示的氨基酸序列中第148位的残基k处发生氨基酸取代。
53.在本技术中,所述氨基酸取代包括选择取代后的氨基酸的种类。包含所述氨基酸取代的本技术所述vegf-trap多肽的表达水平可以不被显著影响。同时,本技术所述vegf-trap多肽的稳定性(例如,在受试者中的体内稳定)可以显著提高。和/或,其非特异性结合的能力可以显著降低。
54.在本技术中,所述vegf-trap多肽的每一个氨基酸取代的取代后的氨基酸的种类是可以独立地选择的。本技术中,氨基酸取代“xny”是指相应于seq id no:8所示的氨基酸序列中第n位的残基x被取代为氨基酸残基y,其中n为正整数,x和y分别独立地为任意氨基
酸残基的缩写,且x不同于y。例如,氨基酸取代“k148a”是指相应于seq id no:8所示的氨基酸序列中第148位的氨基酸残基k被取代为氨基酸残基a。
55.例如,所述的vegf-trap多肽可以包含k148a或k148t所示的氨基酸取代。
56.例如,所述的vegf-trap多肽可以包含r153a或r153t所示的氨基酸取代。
57.例如,所述的vegf-trap多肽可以包含k156a或k156t所示的氨基酸取代。
58.例如,所述的vegf-trap多肽可以包含选自下组的氨基酸取代:
59.a)k148a、r153a和k156a;和,
60.b)k148t、r153t和k156t。
61.例如,所述vegf-trap多肽可以包含seq id no.6-7中任一项所示的氨基酸序列。
62.在本技术中,所述的vegf-trap多肽可以包含vegfr1的第二ig结构域和vegfr2的第三ig结构域的突变体。例如,所述突变体可以包含如seq id no.2-3中任一项所示的氨基酸序列。例如,所述vegfr1的第二ig结构域包含seq id no.4所示的氨基酸序列。
63.在本技术中,所述的vegf-trap多肽可以包含免疫球蛋白fc区。
64.本技术所述的免疫球蛋白fc区可以包括免疫球蛋白的重链恒定区1(ch1)和重链恒定区2(ch2)。此外,所述的免疫球蛋白fc区可以包含全部或部分的fc区,只要其具有与天然蛋白相似的生理活性。存在五种具有不同效应子功能和药物动力学特性的人类免疫球蛋白, iga、igd、ige、igg及igm。例如,本技术的所述fc区可以为源自igg的fc区。igg有四个亚类(gl、g2、g3和g4),各亚类具有称作效应子功能的不同生物学功能。这些效应子功能通常由与fc受体(fcγr)的相互作用或通过结合clq和固定补体介导。本技术所述免疫球蛋白fc区可以为源自igg1或igg4的fc区。
65.在本技术中,本技术所述vegf-trap多肽仍可以保留原始vegf-trap(例如aflibercept) 所具备的生物学特质。例如,本技术所述vegf-trap多肽能够结合vegf。
66.另一方面,本技术提供了一种融合蛋白或免疫缀合物,其包含本技术所述的vegf-trap 多肽。本技术所述的融合蛋白或免疫缀合物具有生物学活性。所述生物学活性包括vegf-trap 多肽所具备的生物学活性(例如能够结合vegf)。
67.另一方面,本技术提供了一种分离的核酸分子,其编码本技术所述的vegf-trap多肽和/ 或本技术所述的融合蛋白或免疫缀合物。
68.本技术所述的核酸分子可以为分离的。例如,其可以是通过以下方法产生或合成的:(i) 在体外扩增的,例如通过聚合酶链式反应(pcr)扩增产生的,(ii)通过克隆重组产生的, (iii)纯化的,例如通过酶切和凝胶电泳分级分离,或者(iv)合成的,例如通过化学合成。在某些实施方式中,所述分离的核酸是通过重组dna技术制备的核酸分子。重组dna和分子克隆技术包括由sambrook,j.,fritsch,e.f.和maniatis,t.molecular cloning:a laboratorymanual;cold spring harbor laboratory press:cold spring harbor,(1989)(maniatis)和由t. j.silhavy,m.l.bennan和l.w.enquist,experiments with gene fusions,cold spring harborlaboratory,cold spring harbor,n.y.(1984)以及由ausubel,f.m.等,current protocols inmolecular biology,pub.by greene publishing assoc.and wiley-interscience(1987)描述的那些技术。简而言之,可从基因组dna片段、cdna和rna制备所述核酸,所有这些核酸可直接从细胞中提取或通过各种扩增方法(包括但不限于pcr和rt-pcr)重组产生。
69.ratory press,cold spring harbor,n.y.,1989;和ausube等人current protocols in molecularbiology,greene publishing and wiley-interscience,new york n.y.,1993。
70.另一方面,本技术提供了一种载体,其包含本技术所述的分离的核酸分子。
71.例如,所述载体中可包含一种或多种所述核酸分子。此外,所述载体中还可包含其他基因,例如允许在适当的宿主细胞中和在适当的条件下选择该载体的标记基因。此外,所述载体还可包含允许编码区在适当宿主中正确表达的表达控制元件。这样的控制元件为本领域技术人员所熟知的,例如,可包括启动子、核糖体结合位点、增强子和调节基因转录或mrna 翻译的其他控制元件等。在某些实施方式中,所述表达控制序列为可调的元件。所述表达控制序列的具体结构可根据物种或细胞类型的功能而变化,但通常包含分别参与转录和翻译起始的5’非转录序列和5’及3’非翻译序列,例如tata盒、加帽序列、caat序列等。例如,5’非转录表达控制序列可包含启动子区,启动子区可包含用于转录控制功能性连接核酸的启动子序列。所述表达控制序列还可包括增强子序列或上游活化子序列。在本技术中,适当的启动子可包括,例如用于sp6、t3和t7聚合酶的启动子、人u6rna启动子、cmv启动子及其人工杂合启动子(如cmv),其中启动子的某部分可与其他细胞蛋白(如人gapdh,甘油醛-3-磷酸脱氢酶)基因启动子的某部分融合,其可包含或不包含另外的内含子。本技术所述的一种或多种核酸分子可以与所述表达控制元件可操作地连接。所述载体可以包括,质粒、粘粒、病毒、噬菌体或者在例如遗传工程中通常使用的其他载体。例如,所述载体为表达载体。
72.另一方面,本技术提供了一种细胞,其包含或表达本技术所述的vegf-trap多肽、本技术所述的融合蛋白或免疫缀合物、本技术所述的分离的核酸分子或本技术所述的载体。
73.所述细胞可以为原核细胞(例如,细菌细胞)、cho细胞、ns/0细胞、hek293t细胞或 hek293a细胞,或者可以为其他真核细胞,如来自植物的细胞、真菌或酵母细胞等。可通过本领域已知的方法将本技术所述的载体引入所述细胞中,例如电穿孔、lipofectine转染、 lipofectamin转染等。例如,所述宿主细胞可以为cos、cho、nso、sf9、sf21、dh5a、bl21 (de3)或tg1。
74.另一方面,本技术提供了一种制备本技术所述的vegf-trap多肽的方法,其包括在表达本技术所述的vegf-trap多肽的条件下,培养本技术所述的细胞。
75.例如,可通过使用适当的培养基、适当的温度和培养时间等,这些方法是本领域普通技术人员所了解的。在某些情形中,所述方法还可包括收获(例如分离和/或纯化),本技术所述 vegf-trap多肽的步骤。例如,可以采用蛋白g-琼脂糖或蛋白a-琼脂糖进行亲和层析,还可通过凝胶电泳和/或高效液相色谱等来纯化和分离本技术所述的vegf-trap多肽。
76.另一方面,本技术提供了一种药物组合物,其包括本技术所述的vegf-trap多肽、本技术所述的融合蛋白或免疫缀合物、本技术所述的分离的核酸分子或本技术所述的载体和/或本技术所述的细胞,以及任选地药学上可接受的佐剂。
77.所述药学上可接受的佐剂可以包括缓冲剂、抗氧化剂、防腐剂、低分子量多肽、蛋白质、亲水聚合物、氨基酸、糖、螯合剂、反离子、金属复合物和/或非离子表面活性剂等。
78.在本技术中,所述药物组合物可被配制用于口服给药,静脉内给药,肌肉内给药,在肿瘤部位的原位给药,吸入,直肠给药,阴道给药,经皮给药或通过皮下储存库给药。例
如,对于口服给药,药物组合物可以被制备成小片,片剂,胶囊,酏剂,混悬液,糖浆或薄片。对于注射制剂,药物组合物可以被制备成例如一次剂量的剂型的安瓿瓶或例如多剂量容器的单元型剂型。药物组合物还可以被制备成溶液,悬浮液,药片,药丸,胶囊和长效制剂。
79.所述药物组合物的给药频率和剂量可以通过多个相关因素被确定,该因素包括要被治疗的疾病类型,给药途径,病人年龄,性别,体重和疾病的严重程度以及作为活性成分的药物类型。由于所述药物组合物具有优良的体内功效和浓度的持续时间,它可以显著地减少所述药物的给药频率和剂量。
80.另一方面,本技术提供了一种本技术所述的vegf-trap多肽、本技术所述的融合蛋白或免疫缀合物,和/或本技术所述的药物组合物在制备治疗药物中的用途,所述药物用于治疗肿瘤。
81.本技术所述的vegf-trap多肽、本技术所述的融合蛋白或免疫缀合物,和/或本技术所述的药物组合物,其用于治疗肿瘤。
82.本技术提供了一种治疗肿瘤的方法,其包括向有需要的受试者施用有效量的本技术所述的vegf-trap多肽、本技术所述的融合蛋白或免疫缀合物,和/或本技术所述的药物组合物。
83.在本技术中,所述肿瘤可以为vegf阳性的肿瘤。所述肿瘤可以为实体瘤,也可以为非实体瘤。
84.另一方面,本技术提供了一种抑制血管(例如人)生长的方法,其包括施用有效量的本技术所述的vegf-trap多肽、本技术所述的融合蛋白或免疫缀合物,和/或本技术所述的药物组合物。
85.另一方面,本技术提供了一种抑制vegf受体配体活性的方法,其包括施用有效量的本技术所述的vegf-trap多肽、本技术所述的融合蛋白或免疫缀合物,和/或本技术所述的药物组合物。
86.例如,所述vegf受体配体活性可以包括vegf和/或vegfr本身的生物学活性和/或功能。例如,可以包括vegf与vegfr的结合。
87.另一方面,本技术提供了一种减轻或防止血浆渗漏的方法,其包括向有需要的受试者施用有效量的本技术所述的vegf-trap多肽、本技术所述的融合蛋白或免疫缀合物,和/或本技术所述的药物组合物。
88.例如,本技术所述的vegf-trap多肽、本技术所述的融合蛋白或免疫缀合物,和/或本技术所述的药物组合物可以缓解和/或治疗毛细血管渗漏综合征(capillary leak syndrome,cls)。例如,可以缓解和/或治疗进行性水肿、低血容量性及分布性休克和/或非蛋白尿性低蛋白血症等疾病和/或症状。
89.本技术包括以下的实施方式:
90.1.vegf-trap多肽,其与seq id no.8所示的序列相比,在第148位包含氨基酸的取代。
91.2.根据实施方式1所述的vegf-trap多肽,其与seq id no.8所示的序列相比,在第 153位包含氨基酸的取代。
92.3.根据实施方式1-2中任一项所述的vegf-trap多肽,其与seq id no.8所示的序列相比,在第156位包含氨基酸的取代。
93.4.根据实施方式1-3中任一项所述的vegf-trap多肽,其包含选自下组的氨基酸残基处的氨基酸取代:k148、r153和k156。
94.5.根据实施方式1-4中任一项所述的vegf-trap多肽,其包含k148a或k148t所示的氨基酸取代。
95.6.根据实施方式1-5中任一项所述的vegf-trap多肽,其包含r153a或r153t所示的氨基酸取代。
96.7.根据实施方式1-6中任一项所述的vegf-trap多肽,其包含k156a或k156t所示的氨基酸取代。
97.8.根据实施方式1-7中任一项所述的vegf-trap多肽,其包含选自下组的氨基酸取代:
98.a)k148a、r153a和k156a;和,
99.b)k148t、r153t和k156t。
100.9.根据实施方式1-8中任一项所述的vegf-trap多肽,其包含vegfr1的第二ig结构域和vegfr2的第三ig结构域的突变体,其中所述突变体包含如seq id no.2-3中任一项所示的氨基酸序列。
101.10.根据实施方式9所述的vegf-trap多肽,其中所述vegfr1的第二ig结构域包含 seq id no.4所示的氨基酸序列。
102.11.根据实施方式1-10中任一项所述的vegf-trap多肽,其包含seq id no.6-7中任一项所示的氨基酸序列。
103.12.根据实施方式1-11中任一项所述的vegf-trap多肽,其能够结合vegf。
104.13.融合蛋白或免疫缀合物,其包含实施方式1-12中任一项所述的vegf-trap多肽。
105.14.分离的核酸分子,其编码实施方式1-12中任一项所述的vegf-trap多肽和/或实施方式13所述的融合蛋白或免疫缀合物。
106.15.载体,其包含实施方式14所述的分离的核酸分子。
107.16.细胞,其包含或表达实施方式1-12中任一项所述的vegf-trap多肽、实施方式13所述的融合蛋白或免疫缀合物、实施方式14所述的分离的核酸分子或实施方式15所述的载体。
108.17.制备实施方式1-12中任一项所述的vegf-trap多肽的方法,其包括在表达实施方式 1-12中任一项所述的vegf-trap多肽的条件下,培养实施方式16所述的细胞。
109.18.药物组合物,其包括实施方式1-12中任一项所述的vegf-trap多肽、实施方式13所述的融合蛋白或免疫缀合物、实施方式14所述的分离的核酸分子或实施方式15所述的载体和/或实施方式16所述的细胞,以及任选地药学上可接受的佐剂。
110.19.实施方式1-12中任一项所述的vegf-trap多肽、实施方式13所述的融合蛋白或免疫缀合物,和/或实施方式18所述的药物组合物在制备治疗药物中的用途,所述药物用于治疗肿瘤。
111.20.一种抑制人血管生长的方法,其包括施用有效量的实施方式1-12中任一项所述的 vegf-trap多肽和/或实施方式13所述的融合蛋白或免疫缀合物。
112.21.一种抑制vegf受体配体活性的方法,其包括施用有效量的实施方式1-12中任
一项所述的vegf-trap多肽和/或实施方式13所述的融合蛋白或免疫缀合物。
113.22.一种减轻或防止血浆渗漏的方法,其包括向有需要的受试者施用有效量的实施方式1
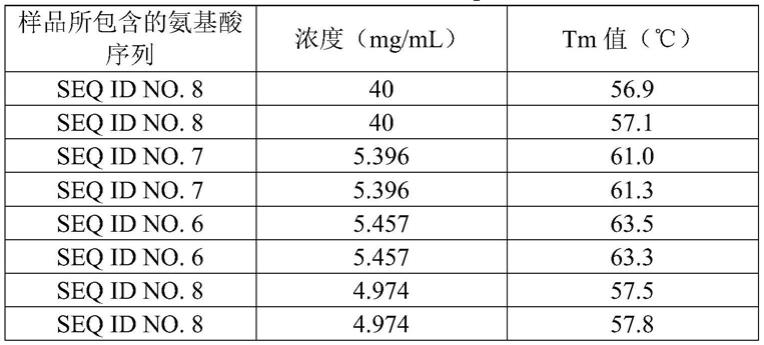
-ꢀ
12中任一项所述的vegf-trap多肽和/或实施方式13所述的融合蛋白或免疫缀合物。
114.不欲被任何理论所限,下文中的实施例仅仅是为了阐释本技术的融合蛋白、制备方法和用途等,而不用于限制本技术发明的范围。
115.实施例
116.实施例1检测本技术所述vegf-trap多肽的表达水平
117.根据本技术所述vegf-trap多肽的氨基酸序列(seq id no.6或seq id no.7),人工合成编码其的核苷酸序列。并且将该核苷酸序列放置在pcdna4.0表达载体上,再将该表达载体转染人293细胞。
118.培养能够表达上述vegf-trap多肽的人293细胞6~7天后,取培养上清,protein a一步纯化后得到目标蛋白,以此测定所述vegf-trap多肽的表达水平。其中,aflibercept(其包含seq id no.8所示的氨基酸序列)作为对照组,也被转染并在人293细胞中在相同的情况下表达。
119.结果显示,本技术所述vegf-trap多肽的表达水平均在300mg/l左右,与对照组的表达水平(200~300mg/l)相当,或略有提高。
120.实施例2检测本技术所述vegf-trap多肽的热力学稳定性
121.tm值方法:
122.利用unchained labs公司的蛋白热稳定性检测仪,测定微量体积的目的蛋白(即本技术所述vegf-trap多肽)。
123.升温程序:起始温度15℃,升温速率0.3℃/min,终点温度95℃。记录每个温度、每个波长下样品的荧光吸光度值。软件拟合变性温度tm值为置信波长bcm下一阶导数的最高点;起始聚合温度tagg值为静态光散射sls,473nm下一阶导数的十分之一值。
124.结果分别如表1-2所示:
125.表1本技术所述vegf-trap多肽的tm值
[0126][0127]
表2本技术所述vegf-trap多肽的tagg值
[0128][0129]
结果显示,与对照组相比,本技术所述vegf-trap多肽的tm值由56~57℃提高到61~63℃; tagg值从65℃提高到67℃。由于蛋白质越稳定,tm值越高,因此本技术所述vegf-trap多肽的稳定性较对照组更高。
[0130]
实施例3检测本技术所述vegf-trap多肽的结合能力
[0131]
bli(k2)方法:
[0132]
通过生物膜干涉技术bli,检测vegf-trap多肽针对重组人vegfa的结合能力。使用octet k2仪器进行测量。先将重组的骆驼抗人fc抗体固化到ahc biosensor上。然后将人 vegfa进行梯度稀释,进样150s,解离时间为900s,10mm glycine-hcl(ph1.7)再生5s。使用简单一对一languir结合模型(octet k2数据分析软件9.0版(data analysis 9.0))计算结合速率(kon)和解离速率(kdis)。平衡解离常数(kd)以比率kdis/kon计算。将aflibercept (其包含seq id no.8所示的氨基酸序列)作为对照组。
[0133]
结果显示,对照组以及本技术所述vegf-trap多肽(其氨基酸序列分别如seq id no.6 或seq id no.7所示)与vegfa特异性结合的k
d
值均为小于10-12
m。
[0134]
实施例4检测本技术所述vegf-trap多肽的体内半衰期
[0135]
体内半衰期检测方法:
[0136]
使用spf级、sd大鼠进行实验,动物周龄约6-8周,体重200-220g左右。实验在spf 动物房进行,动物房环境温度23
±
2℃,相对湿度40-70%,12小时明暗交替。实验动物实验前适应7天。期间保持实验动物健康并适应环境,自由饮食饮水。
[0137]
sd大鼠随机分组,将本技术所述vegf-trap多肽(其氨基酸序列分别如seq id no.6 或seq id no.7所示)以10mg/kg单次静脉注射sd大鼠。以相同给药方式施用aflibercept (其包含seq id no.8所示的氨基酸序列)的sd大鼠作为对照组。采血点为给药前和给药后若干个预定时间点,颈静脉采血约100μl。将采集的血液加入离心管中,室温静置30-60min 后低温离心,迅速分离血清,-80℃条件下保存。elisa法测定受试大鼠血清中vegf-trap多肽的浓度。
[0138]
结果显示,与对照组相比,本技术所述vegf-trap多肽的auc值增加为对照组的约2.5 倍;其t1/2值延长至对照组的t1/2值约2倍。
[0139]
前述详细说明是以解释和举例的方式提供的,并非要限制所附权利要求的范围。目前本技术所列举的实施方式的多种变化对本领域普通技术人员来说是显而易见的,且保留在所附的权利要求和其等同方案的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1