含芳香烃取代基的2-亚胺-1,10-菲罗啉金属配合物催化剂、制备方法及应用
1.本发明涉及聚烯烃催化剂技术领域,具体涉及一类含大位阻芳香烃取代基的2-亚胺-1,10-菲罗啉的过渡金属配合物,其制备方法及应用。
背景技术:
2.α-烯烃是指端基为双键的线性烯烃,可用作高密度聚乙烯(hdpe)和低密度线性聚乙烯(lldpe)的共聚单体,大量用于生产塑料,聚烯烃弹性体,表面活性剂和中间体,增塑剂用醇,合成润滑油,石油添加剂等,是现代科学技术和社会发展中不可或缺的重要材料,工业上通过蜡裂解所得的液态混合α-烯烃主要为c5~c
18
。在混合物中,含有正构α-烯烃,异构α-烯烃,内烯烃以其他非烯烃,这样的原料聚合得到的聚α-烯烃合成润滑剂,不但收率低,黏温性质差,并且其他各项性质与同粘度的矿物油相比,并无明显优势。
3.为了得到高纯度的α-烯烃,乙烯齐聚是最佳选择。而催化乙烯齐聚的催化剂的设计和开发则是发展聚α-烯烃产品的核心。目前,部分用于乙烯齐聚工业生产的茂金属催化剂活性较低且价格高昂。近些年来发展起来的后过渡金属催化剂则可高效催化乙烯齐聚(中国专利cn100372609c)从而越来越受到了关注。后过渡金属配合物催化剂是一类以fe、co、ni等金属为中心原子的过渡金属配合物,其制备简单,催化活性高,容易通过改变金属中心原子以及对催化剂结构的设计和修饰实现对齐聚物分布的调控,引起工业界和学术界的高度重视。
[0004][0005]
自从1998年brookhart与gibson等分别报道吡啶二亚胺铁系催化剂(如a所示)高活性催化乙烯聚合以来(j.am.chem.soc.,1998,120,4049;chem.commun.,1998,849),关于三齿氮配位后过渡金属配合物呈现飞速发展趋势。该类配合物以吡啶二亚胺为配体骨架,通过变换侧链芳环上取代基的立体位阻与电子特性,可以调节相应催化剂的催化活性以及
齐聚与聚合反应的选择性。而只有一边被取代时,则表现出了很高的催化乙烯齐聚的活性,并且所得齐聚物服从schulz-flory分布。此后陆续报道了关于三齿氮配位的后过渡金属配合物。
[0006]
本课题组在该方向上已经有了20多年的积累。我们通过在芳亚胺的苯环中引入大位阻苯胺基团,得到的配合物(如b所示)不仅极大了提高了热稳定型,而且聚合物的分子量可控性也得到了很大的提高(chem comun,2011,14,235)。我们曾合成了带有2,9-二亚胺基-1,10-菲罗啉配体的后过渡金属配合物(如c所示),钴和镍配合物表现出较好的乙烯齐聚或聚合活性,而相应的铁配合物却几乎没有活性(j.organomet.chem.,2002,658,62-70)。可能的原因是其中一个未参与配位的亚胺n原子在催化反应过程中能与铁活性中心进行配位,占据了乙烯配位所必需的位置,使催化反应无法进行。为了证明这一点,我们设计合成了一系列以2-亚胺基-1,10-菲罗啉为母体骨架的新型n^n^n三齿配体,得到了相应的铁(ii)配合物(如d所示),并系统研究了它们的乙烯催化性能。2-亚胺-1,10-菲罗啉络合的铁配合物表现出了非常高的乙烯齐聚的活性(达到4.91
×
107g
·
mol-1
·
h-1
),同时具有很高的α-烯烃选择性(》94%),同时齐聚产物的分布符合s
–
f规律(中国专利cn100372609c)。该类催化剂已经顺利实现500吨中试放大实验。随后,solan等报道类似结构的2-亚胺-1,10-菲罗啉钴配合物(如d所示),表现出比铁配合物更低的催化活性(j.organomet.chem.2006(691):4114-4123)。并且取代基的变化对配合物的催化活性具有非常重要的影响;催化活性随着吸电子取代基的吸电能力增强而减弱br》cl》f。后我们又报道了系列苯基取代的同系物(如e所示)其催化活性较配合物d大大降低(eur.j.inorg.chem.,2007,5584
–
5598)。众多结果表明配体结构中微小变化均导致催化性能的极大改变。
[0007]
后过渡金属配合物催化剂结构易于修饰,可以容易以此来调控产物(聚合物和齐聚物)结构和分子量。然而,作为新一代催化剂体系,在推进产业化过程中仍然还有难点和制约因素。一般来说,后过渡金属催化剂在高温下极易失活,由于链转移终止速率是随着温度的升高而增加,以及配合物本身的热稳定性较差,从而引起活性随反应温度升高而降低。这在一定程度上限制了金属配合物催化剂的在工业上应用研究。如何获得热稳定性较好的铁钴配合物,亦是能否尽快推进工业化的关键。
技术实现要素:
[0008]
为解决上述问题,本发明人经过锐意研究发现一种含有芳香取代基的2-亚胺-1,10-菲罗啉过渡金属配合物,具有良好的热稳定性,在较高温度下,该类配合物对乙烯齐聚的催化活性好,具有非常大的工业应用潜力。
[0009]
第一方面,本发明提供一种含有芳香取代基的2-亚胺-1,10-菲罗啉过渡金属配合物,所述配合物中过渡金属选自铁、钴、铬或镍,优选选自铁或钴。
[0010]
所述含有芳香取代基的2-亚胺-1,10-菲罗啉过渡金属配合物的结构式如式(i)所示:
[0011][0012]
其中,所述过渡金属m选自铁、钴、铬或镍,优选选自铁或钴;
[0013]
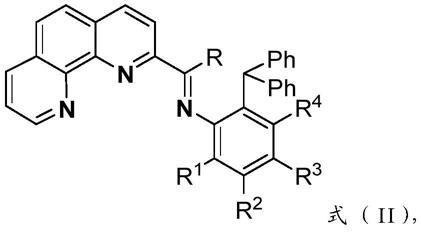
所述卤代基x1、x2各自独立地选自f、cl、br或i,优选地,所述卤代基x1、x2各自独立地选自cl或br,更优选地,所述卤代基x1、x2为cl;
[0014]
所述取代基r选自氢、c
1-c3烷基或苯基,优选选自氢或c
1-c3烷基,更优选为氢或甲基;
[0015]
所述取代基r1、r2、r3、r4各自独立的选自氢、卤代基、c
1-c6烷基、烷氧基、c
3-c
10
环烷基、c
3-c
10
杂环基、c
3-c
10
环烷基氧基、芳基、芳基氧基、芳基c
1-c6亚烷基,优选地,r1、r2、r3、r4各自独立的选自氢、卤代基、c
1-c6烷基、c
1-c6烷氧基、c
3-c
10
环烷基、c
3-c
10
环烷基氧基、c
6-c
14
芳基、c
6-c
14
芳基氧基、芳基c
1-c6亚烷基,更优选地,r1、r2、r3、r4各自独立的选自氢、氯、甲基、乙基、异丙基或二苯甲基;
[0016]
所述ph为苯基。
[0017]
优选地,本发明所述的含有芳香取代基的2-亚胺-1,10-菲罗啉过渡金属配合物选自具有如下基团的任意一种配合物:
[0018]
co-1:m=co,r1=-ch(c6h
11
)2,r2=h,r3=me,r4=h,r=me,x1=x2=cl;
[0019]
co-2:m=co,r1=-ch(c6h
11
)2,r2=h,r3=et,r4=h,r=me,x1=x2=cl;
[0020]
co-3:m=co,r1=-ch(c6h
11
)2,r2=h,r3=ipr,r4=h,r=me,x1=x2=cl;
[0021]
co-4:m=co,r1=-ch(c6h
11
)2,r2=h,r3=cl,r4=h,r=me,x1=x2=cl;
[0022]
co-5:m=co,r1=me,r2=h,r3=-ch(c6h
11
)2,r4=h,r=me,x1=x2=cl;
[0023]
co-6:m=co,r1=et,r2=h,r3=-ch(c6h
11
)2,r4=h,r=me,x1=x2=cl;
[0024]
co-7:m=co,r1=ipr,r2=h,r3=-ch(c6h
11
)2,r4=h,r=me,x1=x2=cl;
[0025]
co-8:m=co,r1=-ch(c6h
11
)2,r2=h,r3=-ch(c6h
11
)2,r4=h,r=me,x1=x2=cl;
[0026]
fe-1:m=fe,r1=-ch(c6h
11
)2,r2=h,r3=me,r4=h,r=me,x1=x2=cl;
[0027]
fe-2:m=fe,r1=-ch(c6h
11
)2,r2=h,r3=et,r4=h,r=me,x1=x2=cl;
[0028]
fe-3:m=fe,r1=-ch(c6h
11
)2,r2=h,r3=ipr,r4=h,r=me,x1=x2=cl;
[0029]
fe-4:m=fe,r1=-ch(c6h
11
)2,r2=h,r3=cl,r4=h,r=me,x1=x2=cl;
[0030]
fe-5:m=fe,r1=me,r2=h,r3=-ch(c6h
11
)2,r4=h,r=me,x1=x2=cl;
[0031]
fe-6:m=fe,r1=et,r2=h,r3=-ch(c6h
11
)2,r4=h,r=me,x1=x2=cl;
[0032]
fe-7:m=fe,r1=ipr,r2=h,r3=-ch(c6h
11
)2,r4=h,r=me,x1=x2=cl;
[0033]
fe-8:m=fe,r1=-ch(c6h
11
)2,r2=h,r3=-ch(c6h
11
)2,r4=h,r=me,x1=x2=cl;
[0034]
其中,me代表甲基,et代表乙基,ipr代表异丙基,-ch(c6h
11
)2代表二苯甲基。
[0035]
第二方面,本发明还提供一种含有芳香取代基的2-亚胺-1,10-菲罗啉,记为l,其结构式如式(ii)所示,
[0036][0037]
其中,r选自氢、c
1-c3烷基或苯基,优选选自氢或c
1-c3烷基,更优选为氢或甲基;
[0038]
r1、r2、r3、r4各自独立的选自氢、卤代基、c
1-c6烷基、烷氧基、c
3-c
10
环烷基、c
3-c
10
杂环基、c
3-c
10
环烷基氧基、芳基、芳基氧基、芳基c
1-c6亚烷基,优选地,r1、r2、r3、r4各自独立的选自氢、卤代基、c
1-c6烷基、c
1-c6烷氧基、c
3-c
10
环烷基、c
3-c
10
环烷基氧基、c
6-c
14
芳基、c
6-c
14
芳基氧基、芳基c
1-c6亚烷基,更优选地,r1、r2、r3、r4各自独立的选自氢、氯、甲基、乙基、异丙基或二苯甲基;
[0039]
ph为苯基。
[0040]
优选地,本发明所述含有芳香取代基的2-亚胺-1,10-菲罗啉选自具有如下基团的任意一种配合物:
[0041]
l1:r1=-ch(c6h
11
)2,r2=h,r3=me,r4=h,r=me;
[0042]
l2:r1=-ch(c6h
11
)2,r2=h,r3=et,r4=h,r=me;
[0043]
l3:r1=-ch(c6h
11
)2,r2=h,r3=ipr,r4=h,r=me;
[0044]
l4:r1=-ch(c6h
11
)2,r2=h,r3=cl,r4=h,r=me;
[0045]
l5:r1=me,r2=h,r3=-ch(c6h
11
)2,r4=h,r=me;
[0046]
l6:r1=et,r2=h,r3=-ch(c6h
11
)2,r4=h,r=me;
[0047]
l7:r1=ipr,r2=h,r3=-ch(c6h
11
)2,r4=h,r=me;
[0048]
l8:r1=-ch(c6h
11
)2,r2=h,r3=-ch(c6h
11
)2,r4=h,r=me;
[0049]
其中,me代表甲基,et代表乙基,ipr代表异丙基,-ch(c6h
11
)2代表二苯甲基。
[0050]
第三方面,本发明提供一种含有芳香取代基的2-亚胺-1,10-菲罗啉过渡金属配合物,其由所述含有芳香取代基的2-亚胺-1,10-菲罗啉和含过渡金属化合物制备得到。
[0051]
所述含有芳香取代基的2-亚胺-1,10-菲罗啉过渡金属配合物由以下方法制备得到:
[0052]
步骤1、将含有芳香取代基的2-亚胺-1,10-菲罗啉和含过渡金属化合物溶解在溶剂中,加热反应,得到反应液;
[0053]
步骤2、对反应液进行后处理,得到含有芳香取代基的2-亚胺-1,10-菲罗啉过渡金属配合物。
[0054]
第四方面,本发明提供所述含有芳香取代基的2-亚胺-1,10-菲罗啉的用途,用于制备含大位阻芳香烃取代基的2-亚胺-1,10-菲罗啉金属配合物,优选制备第一方面所述的过渡金属配合物。
[0055]
第五方面,本发明提供所述含有芳香取代基的2-亚胺-1,10-菲罗啉过渡金属配合物的制备方法,所述方法以所述含有芳香取代基的2-亚胺-1,10-菲罗啉和含过渡金属化合
物为原料。
[0056]
所述含有芳香取代基的2-亚胺-1,10-菲罗啉过渡金属配合物的制备方法包括以下步骤:
[0057]
步骤1、将含有芳香取代基的2-亚胺-1,10-菲罗啉和含过渡金属化合物溶解在溶剂ⅰ中,搅拌反应,得到反应液;
[0058]
步骤2、对反应液进行后处理,得到含有芳香取代基的2-亚胺-1,10-菲罗啉过渡金属配合物。
[0059]
第六方面,本发明还提供一种组合催化剂,所述组合催化剂包括主催化剂,优选地,还包括助催化剂,其中,所述主催化剂为上述第一方面所述配合物或根据第五方面所述方法制备得到的配合物,所述助催化剂选自铝氧烷、烷基铝和氯化烷基铝中的一种或多种。
[0060]
第七方面,本发明还提供本发明中所述组合催化剂的用途,用于催化乙烯齐聚反应。
[0061]
本发明具有以下有益效果:
[0062]
(1)本发明提供了一种含有芳香取代基的2-亚胺-1,10-菲罗啉过渡金属配合物及其配体的制备方法。该类配合物制备方法成本低、性能稳定,其制备过程均具有反应条件温和、周期短、操作条件简单等优点。
[0063]
(2)本发明还提供了含有芳香取代基的2-亚胺-1,10-菲罗啉过渡金属配合物在乙烯齐聚领域中的应用。该类配合物在较高温度下具有高温催化活性和热稳定性。
[0064]
(3)本发明提供的含有芳香取代基的2-亚胺-1,10-菲罗啉过渡金属配合物可作为催化剂应用于乙烯齐聚反应中,可以制备得到分布较窄的短链线性α-烯烃齐聚物。在助催化剂的作用下,反应温度50℃时,聚合反应五分钟之内其催化活性可高达4.80
×
105g/mol(co)h-1
,聚合反应半小时其催化活性为2.58
×
105g/mol(co)h-1
。
[0065]
(4)以本发明提供的含有芳香取代基的2-亚胺-1,10-菲罗啉过渡金属配合物为催化剂制备聚α-烯烃的方法操作简单,反应条件温和。
[0066]
(5)在本发明设计并合成的含有芳香取代基的2-亚胺-1,10-菲罗啉过渡金属配合物,可以制备出高选择性的2-丁烯,或者制备出高选择性的1-丁烯,还可以制备出c4~c
26
的齐聚物,可作为生产高密度聚乙烯、线性低密度聚乙烯等聚合物的共聚单体,以及化工生产过程中的加工助剂、乳化剂、润滑剂等多种添加剂,具有极大的工业应用潜力。
附图说明
[0067]
图1示出本发明中钴催化剂co-1的结构示意图;
[0068]
图2示出本发明中钴催化剂co-8的结构示意图。
具体实施方式
[0069]
下面通过具体实施方式对本发明进行详细说明,本发明的特点和优点将随着这些说明而变得更为清楚、明确。
[0070]
本发明中提供的含有芳香取代基的2-亚胺-1,10-菲罗啉过渡金属配合物具有良好的热稳定性和高温催化活性,作为催化剂制备得到的α-烯烃为窄分布的c4、α-c4和c6及α-c6,可作为生产高密度聚乙烯、线性低密度聚乙烯等聚合物的共聚单体。
[0071]
本发明提供的含有芳香取代基的2-亚胺-1,10-菲罗啉过渡金属配合物的结构式如式(i)所示:
[0072][0073]
其中,所述过渡金属m选自铁、钴、铬或镍,优选选自铁或钴,此时,所述含有芳香取代基的2-亚胺-1,10-菲罗啉过渡金属配合物为含有芳香取代基的2-亚胺-1,10-菲罗啉钴配合物或含有芳香取代基的2-亚胺-1,10-菲罗啉铁配合物;
[0074]
所述卤代基x1、x2各自独立地选自f、cl、br或i,优选地,所述卤代基x1、x2各自独立地选自cl或br,更优选地,所述卤代基x1、x2为cl;
[0075]
所述取代基r选自氢、c
1-c3烷基或苯基,优选选自氢或c
1-c3烷基,更优选为氢或甲基
[0076]
r1、r2、r3、r4各自独立的选自氢、卤代基、c
1-c6烷基、烷氧基、c
3-c
10
环烷基、c
3-c
10
杂环基、c
3-c
10
环烷基氧基、芳基、芳基氧基、芳基c
1-c6亚烷基,优选地,r1、r2、r3、r4各自独立的选自氢、卤代基、c
1-c6烷基、c
1-c6烷氧基、c
3-c
10
环烷基、c
3-c
10
环烷基氧基、c
6-c
14
芳基、c
6-c
14
芳基氧基、芳基c
1-c6亚烷基,更优选地,r1、r2、r3、r4各自独立的选自氢、氯、甲基、乙基、异丙基或二苯甲基;
[0077]
ph为苯基。
[0078]
优选地,本发明所述的含有芳香取代基的2-亚胺-1,10-菲罗啉过渡金属配合物选自具有如下基团定义的任意一种配合物:
[0079]
co-1:m=co,r1=-ch(c6h
11
)2,r2=h,r3=me,r4=h,r=me,x1=x2=cl;
[0080]
co-2:m=co,r1=-ch(c6h
11
)2,r2=h,r3=et,r4=h,r=me,x1=x2=cl;
[0081]
co-3:m=co,r1=-ch(c6h
11
)2,r2=h,r3=ipr,r4=h,r=me,x1=x2=cl;
[0082]
co-4:m=co,r1=-ch(c6h
11
)2,r2=h,r3=cl,r4=h,r=me,x1=x2=cl;
[0083]
co-5:m=co,r1=me,r2=h,r3=-ch(c6h
11
)2,r4=h,r=me,x1=x2=cl;
[0084]
co-6:m=co,r1=et,r2=h,r3=-ch(c6h
11
)2,r4=h,r=me,x1=x2=cl;
[0085]
co-7:m=co,r1=ipr,r2=h,r3=-ch(c6h
11
)2,r4=h,r=me,x1=x2=cl;
[0086]
co-8:m=co,r1=-ch(c6h
11
)2,r2=h,r3=-ch(c6h
11
)2,r4=h,r=me,x1=x2=cl;
[0087]
fe-1:m=fe,r1=-ch(c6h
11
)2,r2=h,r3=me,r4=h,r=me,x1=x2=cl;
[0088]
fe-2:m=fe,r1=-ch(c6h
11
)2,r2=h,r3=et,r4=h,r=me,x1=x2=cl;
[0089]
fe-3:m=fe,r1=-ch(c6h
11
)2,r2=h,r3=ipr,r4=h,r=me,x1=x2=cl;
[0090]
fe-4:m=fe,r1=-ch(c6h
11
)2,r2=h,r3=cl,r4=h,r=me,x1=x2=cl;
[0091]
fe-5:m=fe,r1=me,r2=h,r3=-ch(c6h
11
)2,r4=h,r=me,x1=x2=cl;
[0092]
fe-6:m=fe,r1=et,r2=h,r3=-ch(c6h
11
)2,r4=h,r=me,x1=x2=cl;
[0093]
fe-7:m=fe,r1=ipr,r2=h,r3=-ch(c6h
11
)2,r4=h,r=me,x1=x2=cl;
[0094]
fe-8:m=fe,r1=-ch(c6h
11
)2,r2=h,r3=-ch(c6h
11
)2,r4=h,r=me,x1=x2=cl;
[0095]
其中,me代表甲基,et代表乙基,ipr代表异丙基,-ch(c6h
11
)2代表二苯甲基。
[0096]
本发明中的含有芳香取代基的2-亚胺-1,10-菲罗啉结构式如式(ii)所示,记为l:
[0097][0098]
其中,r选自氢、c
1-c3烷基或苯基,优选选自氢或c
1-c3烷基,更优选为氢或甲基;
[0099]
r1、r2、r3、r4各自独立的选自氢、卤代基、c
1-c6烷基、烷氧基、c
3-c
10
环烷基、c
3-c
10
杂环基、c
3-c
10
环烷基氧基、芳基、芳基氧基、芳基c
1-c6亚烷基,优选地,r1、r2、r3、r4各自独立的选自氢、卤代基、c
1-c6烷基、c
1-c6烷氧基、c
3-c
10
环烷基、c
3-c
10
环烷基氧基、c
6-c
14
芳基、c
6-c
14
芳基氧基、芳基c
1-c6亚烷基,更优选地,r1、r2、r3、r4各自独立的选自氢、氯、甲基、乙基、异丙基或二苯甲基;
[0100]
ph为苯基。
[0101]
作为实例,本发明所述式(ii)化合物可以选自具有如下基团定义的任意一种配合物:
[0102]
l1:r1=-ch(c6h
11
)2,r2=h,r3=me,r4=h,r=me;
[0103]
l2:r1=-ch(c6h
11
)2,r2=h,r3=et,r4=h,r=me;
[0104]
l3:r1=-ch(c6h
11
)2,r2=h,r3=ipr,r4=h,r=me;
[0105]
l4:r1=-ch(c6h
11
)2,r2=h,r3=cl,r4=h,r=me;
[0106]
l5:r1=me,r2=h,r3=-ch(c6h
11
)2,r4=h,r=me;
[0107]
l6:r1=et,r2=h,r3=-ch(c6h
11
)2,r4=h,r=me;
[0108]
l7:r1=ipr,r2=h,r3=-ch(c6h
11
)2,r4=h,r=me;
[0109]
l8:r1=-ch(c6h
11
)2,r2=h,r3=-ch(c6h
11
)2,r4=h,r=me;
[0110]
其中,me代表甲基,et代表乙基,ipr代表异丙基,-ch(c6h
11
)2代表二苯甲基。
[0111]
本发明提供所述含有芳香取代基的2-亚胺-1,10-菲罗啉过渡金属配合物的制备方法,所述方法以所述含有芳香取代基的2-亚胺-1,10-菲罗啉和含过渡金属化合物为原料。
[0112]
所述含过渡金属化合物选自含铁化合物、含钴化合物、含铬化合物或含镍化合物,优选选自含钴化合物或含铁化合物,更优选为含钴卤化物或含铁卤化物。
[0113]
所述含有芳香取代基的2-亚胺-1,10-菲罗啉过渡金属配合物的制备方法包括以下步骤:
[0114]
步骤1、将含有芳香取代基的2-亚胺-1,10-菲罗啉和含过渡金属化合物溶解在溶剂ⅰ中,搅拌反应,得到反应液。
[0115]
所述含有芳香取代基的2-亚胺-1,10-菲罗啉的结构式为式(ii)。
[0116]
所述含过渡金属化合物选自含铁化合物、含钴化合物、含铬化合物或含镍化合物,优选选自含钴化合物或含铁化合物,更优选为含钴卤化物或含铁卤化物。
[0117]
优选地,
[0118]
所述含钴卤化物选自溴化钴或氯化钴,优选为氯化钴,
[0119]
所述含铁卤化物选自溴化亚铁二甲醚溶液、四水合氯化亚铁或氯化亚铁,优选为四水合氯化亚铁。
[0120]
所述反应优选在无氧条件下进行,例如在惰性气体如氮气的保护条件下进行。
[0121]
根据本发明,所述反应在溶剂ⅰ中进行,所述溶剂ⅰ为有机溶剂,选自卤代烷烃类溶剂、醇类溶剂或醚类溶剂的一种或多种,优选选自二氯甲烷、三氯甲烷、甲醇或四氢呋喃中的一种或多种,更优选为四氢呋喃和二氯甲烷的混合溶液或无水甲醇和二氯甲烷的混合溶液。
[0122]
在本发明的一种优选方式中,所述溶剂ⅰ为二氯甲烷和无水甲醇混合溶液,所述无水甲醇和二氯甲烷的体积比为5:(1.0~3.0),优选为5:(1.2~2.5),更优选为5:(1.8~2.2)。
[0123]
所述含过渡金属化合物与所述含有芳香取代基的2-亚胺-1,10-菲罗啉的摩尔比为1:(1~2),优选为1:(1~1.5),更优选为1:1.1。
[0124]
所述含有芳香取代基的2-亚胺-1,10-菲罗啉与溶剂ⅰ的摩尔体积比为0.22mmol:(5~12)ml,优选为0.22mmol:(5~9)ml,更优选为0.22mmol:(6~8)ml。
[0125]
所述反应的温度为10~35℃,优选为15~30℃,更优选为20~25℃;所述反应时间为4~12小时,优选为6~11小时,更优选8~10小时。
[0126]
所述含有芳香取代基的2-亚胺-1,10-菲罗啉的制备方法以2-酰基-1,10-菲罗啉和含芳香取代基的苯胺为原料,通过取代反应制备得到,具体包括以下步骤:
[0127]
步骤1-1、将2-酰基-1,10-菲罗啉与含芳香取代基的苯胺溶解在溶剂ⅱ中,搅拌反应,得到反应液ⅱ。
[0128]
所述2-酰基-1,10-菲罗啉的结构式如式(ⅲ)所示:
[0129][0130]
其中,r的选择范围与含有芳香取代基的2-亚胺-1,10-菲罗啉过渡金属配合物中的r选择范围相同。
[0131]
所述含芳香取代基的苯胺的结构式如式(iv)所示:
[0132][0133]
其中,ph为苯基;r1、r2、r3、r4的选择范围与含有芳香取代基的2-亚胺-1,10-菲罗
啉过渡金属配合物中的r1、r2、r3、r4选择范围相同。
[0134]
根据本发明,所述反应在催化剂存在下进行,所述催化剂选自有机酸或无机酸,优选为对甲苯磺酸、醋酸或盐酸,更优选为对甲苯磺酸。
[0135]
根据本发明,所述反应在溶剂中进行,所述溶剂选自芳烃类溶剂,如甲苯、二甲苯,酮类溶剂,如丙酮,醚类溶剂,如石油醚或四氢呋喃中的一种或多种,优选为芳香烃类溶剂,更优选为甲苯。
[0136]
根据本发明,所述反应优选在加热回流的条件下反应,所述反应温度为80~120℃,优选为85~115℃,更优选为90~110℃。所述反应时间为8-24小时,优选为12-20小时,更优选为14-16小时。
[0137]
根据本发明,所述2-酰基-1,10-菲罗啉与含芳香取代基的苯胺的摩尔比为(1~2):1,优选为(1.1~1.5):1,更优选为1.2:1。
[0138]
所述2-酰基-1,10-菲罗啉与催化剂的摩尔比为(1.1~1):1,优选为(1.05~1):1,更优选为1:1。
[0139]
步骤1-2、对反应液ⅱ进行后处理,得到所述含有芳香取代基的2-亚胺-1,10-菲罗啉。
[0140]
所述反应液ⅱ的后处理过程包括去除溶剂和提纯。
[0141]
所述去除溶剂为采用减压蒸馏的方法去除溶剂,得到粗产物。
[0142]
步骤1-2中,去除溶剂后,将粗产物溶于二氯甲烷中,进行提纯。所述提纯方法为柱层析,层析柱为碱性氧化铝柱,淋洗液为石油醚和乙酸乙酯的混合液,所述石油醚和乙酸乙酯的体积比为(15~35):1,优选为(20~30):1,更优选为25:1。柱层析后,减压蒸馏去除溶剂,得到所述含有芳香取代基的2-亚胺-1,10-菲罗啉。
[0143]
步骤2、对反应液进行后处理,得到含有芳香取代基的2-亚胺-1,10-菲罗啉过渡金属配合物。
[0144]
所述后处理包括过滤、洗涤和干燥。
[0145]
所述过滤为对反应液进行过滤,优选为抽滤,得到固体产物。所述洗涤为利用无水乙醚或正己烷对固体产物进行洗涤3~7次。所述干燥为对洗涤后的固体产物进行干燥,所述干燥温度为55~65℃,如60℃,干燥时间为12~24h。干燥后,得到含有芳香取代基的2-亚胺-1,10-菲罗啉过渡金属配合物。
[0146]
在本发明的一种优选方式中,所述含有芳香取代基的2-亚胺-1,10-菲罗啉过渡金属配合物为钴配合物时,利用无水乙醚进行洗涤,所述含有芳香取代基的2-亚胺-1,10-菲罗啉过渡金属配合物为铁配合物时,利用正己烷进行洗涤。
[0147]
本发明中提供的组合催化剂包括主催化剂,所述主催化剂为所述含有芳香取代基的2-亚胺-1,10-菲罗啉过渡金属配合物。
[0148]
优选地,所述组合催化剂还包括助催化剂。所述助催化剂选自铝氧烷、烷基铝和氯化烷基铝中的一种或多种,优选为铝氧烷,更优选为改性甲基铝氧烷(mmao)。
[0149]
在本发明的一种优选实施方式中,所述主催化剂为含有芳香取代基的2-亚胺-1,10-菲罗啉钴配合物或含有芳香取代基的2-亚胺-1,10-菲罗啉铁配合物,所述助催化剂为铝氧烷。
[0150]
所述主催化剂为含有芳香取代基的2-亚胺-1,10-菲罗啉钴配合物时,所述助催化
剂中的铝元素与主催化剂中钴元素的摩尔比为(200~3000):1,优选为(300~2500):1,更优选为(500~2000):1,如500:1、1000:1、1500:1、1750:1、2000:1。
[0151]
优选地,所述助催化剂为甲基铝氧烷(mmao)时,甲基铝氧烷(mmao)中铝元素与所述主催化剂中钴的摩尔比为(500~2000):1,优选为1750:1。
[0152]
所述主催化剂为含有芳香取代基的2-亚胺-1,10-菲罗啉铁配合物时,所述助催化剂中的铝元素与主催化剂中铁元素的摩尔比为(200~10000):1,优选为(300~9000):1,更优选为(500~8000):1,如500:1、1000:1、1500:1、1750:1、2000:1、2500:1、3000:1、4000:1、6000:1、8000:1。
[0153]
优选地,所述助催化剂为甲基铝氧烷(mmao)时,甲基铝氧烷(mmao)中铝元素与所述主催化剂中铁的摩尔比为(500~8000):1,优选为2000:1。
[0154]
本发明中的α-烯烃的制备方法以乙烯为原料,在组合催化剂ⅰ催化下,进行齐聚反应。
[0155]
优选地,所述齐聚反应优选在乙烯气氛下进行。
[0156]
根据本发明,所述组合催化剂溶解在反应溶剂ⅲ中,所述反应溶剂ⅲ选自甲苯、邻二甲苯、二氯甲烷、乙醇、四氢呋喃、己烷或环己烷中的一种或几种,优选为甲苯、邻二甲苯或二氯甲烷中的一种或几种,更优选为甲苯。
[0157]
优选地,所述齐聚反应的温度为20~80℃,如20℃、30℃、40℃、50℃、60℃、70℃、80℃;所述齐聚反应的时间为5~60min,如5min、15min、45min、60min;所述齐聚反应的压力为5~10atm,如5atm或10atm。
[0158]
所述组合催化剂中主催化剂在反应液中的浓度为(1.0
×
10-5
~3.0
×
10-5
)mol/l,优选为(1.5
×
10-5
~2.5
×
10-5
)mol/l,更优选为(1.8
×
10-5
~2.2
×
10-5
)mol/l。
[0159]
所述组合催化剂中助催化剂在反应液中的浓度为(1.0
×
10-2
~5.0
×
10-2
)mol/l,优选为(1.5
×
10-2
~4.50
×
10-2
)mol/l,更优选为(1.8
×
10-2
~4.0
×
10-2
)mol/l。
[0160]
本发明提供的含有芳香取代基的2-亚胺-1,10-菲罗啉过渡金属配合物制备成本低、性能稳定,高温下催化活性高,其制备方法反应条件温和、周期短、操作条件简单等优点。该配合物作为催化剂催化齐α-烯烃具有高选择性,能够得到分布较窄的短链线性α-烯烃齐聚物。催化反应得到的α-烯烃可作为生产高密度聚乙烯、线性低密度聚乙烯等聚合物的共聚单体,并广泛应用于化工生产过程中的加工助剂、乳化剂、润滑剂等多种添加剂,具有极大的工业应用潜力。
[0161]
实施例
[0162]
下述实施例中所述实验方法,如无特殊说明,均为常规方法;所述原材料和试剂,如无特殊说明,均可从公开商业途径获得。改性甲基铝氧烷(mmao)购自albemarle公司。
[0163]
实施例1
[0164]
称取0.79g的2-乙酰基-1,10-菲罗啉和1.32g的2,6-二(二苯甲基)-4-甲基苯胺加入反应瓶中,使其溶于甲苯溶剂40ml形成混合溶液,再称取对甲苯磺酸0.2g加入反应瓶中,均匀溶解形成反应混合物。反应混合物加热至110℃,回流,反应16h。冷却至室温,减压蒸馏去除溶剂。将所得粗产物溶于5ml二氯甲烷中,经过碱性氧化铝柱进行柱层析,以石油醚和乙酸乙酯的混合溶剂(体积比为25:1)为淋洗剂进行洗脱,收集第二组分,减压蒸馏除去溶剂,得到0.56g黄色粉末,产物为l1,产率为28.8%。
[0165]
实施例2
[0166]
称取0.79g的2-乙酰基-1,10-菲罗啉和1.36g的2,6-二(二苯甲基)-4-乙基苯胺加入反应瓶中,使其溶于甲苯溶剂40ml形成混合溶液,再称取对甲苯磺酸0.2g加入反应瓶中,均匀溶解形成反应混合物。反应混合物加热至110℃,回流,反应16h。冷却至室温,减压蒸馏去除溶剂。将所得粗产物溶于5~10ml二氯甲烷中,经过碱性氧化铝柱进行柱层析,以石油醚和乙酸乙酯的混合溶剂(体积比为25:1)为淋洗剂进行洗脱,收集第二组分,减压蒸馏去除溶剂,得到0.60g黄色粉末,产物为l2,产率为30.4%。
[0167]
实施例3
[0168]
称取0.79g的2-乙酰基-1,10-菲罗啉和1.40g的2,6-二(二苯甲基)-4-异丙基苯胺加入反应瓶中,使其溶于甲苯溶剂40ml形成混合溶液,再称取对甲苯磺酸0.2g加入反应瓶中,均匀溶解形成反应混合物。反应混合物加热至110℃,回流,反应16h。冷却至室温,减压蒸馏去除溶剂。将所得粗产物溶于5~10ml二氯甲烷中,经过碱性氧化铝柱进行柱层析,以石油醚和乙酸乙酯的混合溶剂(体积比为25:1)为淋洗剂进行洗脱,收集第二组分,减压蒸馏去除溶剂,得到0.74g黄色粉末,产物为l3,产率为36.8%。
[0169]
实施例4
[0170]
称取0.79g的2-乙酰基-1,10-菲罗啉和1.38g的2,6-二二苯甲基-4-氯苯胺加入反应瓶中,使其溶于甲苯溶剂40ml形成混合溶液,再称取对甲苯磺酸0.2g加入反应瓶中,均匀溶解形成反应混合物。反应混合物加热至110℃,回流,反应16h。冷却至室温,减压蒸馏去除溶剂,将所得粗产物溶于5~10ml二氯甲烷中,经过碱性氧化铝柱进行柱层析,以石油醚和乙酸乙酯的混合溶剂(体积比为25:1)为淋洗剂进行洗脱,收集第二组分,减压蒸馏去除溶剂,得到0.85g黄色粉末,产物为l4,产率为42.5%。
[0171]
实施例5
[0172]
称取0.79g的2-乙酰基-1,10-菲罗啉和1.32g的2,4-二(二苯甲基)-6-甲基苯胺加入反应瓶中,使其溶于甲苯溶剂40ml形成混合溶液,再称取对甲苯磺酸0.20g加入反应瓶中,均匀溶解形成反应混合物。反应混合物加热至110℃,回流,反应16h。冷却至室温,减压蒸馏去除溶剂。将所得粗产物溶于5~10ml二氯甲烷中,经过碱性氧化铝柱进行柱层析,以石油醚和乙酸乙酯的混合溶剂(体积比为25:1)为淋洗剂进行洗脱,收集第二组分,减压蒸馏除去溶剂,得到0.69g黄色粉末,产物为l5,产率为35.7%。
[0173]
实施例6
[0174]
称取0.79g的2-乙酰基-1,10-菲罗啉和1.36g的2,4-二(二苯甲基)-6-乙基苯胺加入反应瓶中,使其溶于甲苯溶剂40ml形成混合溶液,再称取对甲苯磺酸0.20g加入反应瓶中,均匀溶解形成反应混合物。反应混合物加热至110℃,回流,反应16h。冷却至室温,水泵抽真空,80℃下,减压蒸馏除去溶剂,将所得粗产物溶于5~10ml二氯甲烷中,经过碱性氧化铝柱进行柱层析,以石油醚和乙酸乙酯的混合溶剂(体积比为25:1)为淋洗剂进行洗脱,收集第二组分,水泵抽真空,80℃下,减压蒸馏除去溶剂,得到0.73g黄色粉末,产物为l6,产率为37.1%。
[0175]
实施例7
[0176]
称取0.79g的2-乙酰基-1,10-菲罗啉和1.40g的2,4-二(二苯甲基)-6-异丙基苯胺加入反应瓶中,使其溶于甲苯溶剂40ml形成混合溶液,再称取对甲苯磺酸0.20g加入反应瓶
中,均匀溶解形成反应混合物。反应混合物加热至110℃,回流,反应16h。冷却至室温,水泵抽真空,80℃下,减压蒸馏除去溶剂。将所得粗产物溶于5~10ml二氯甲烷中,经过碱性氧化铝柱进行柱层析,以石油醚和乙酸乙酯的混合溶剂(体积比为25:1)为淋洗剂进行洗脱,收集第二组分,水泵抽真空,80℃下,减压蒸馏除去溶剂,得到0.73g黄色粉末,产物为l7,产率为36.4%。
[0177]
实施例8
[0178]
称取0.79g的2-乙酰基-1,10-菲罗啉和1.78g的2,4,6-三(二苯甲基)苯胺加入反应瓶中,使其溶于甲苯溶剂40ml形成混合溶液,再称取对甲苯磺酸0.20g加入反应瓶中,均匀溶解形成反应混合物。反应混合物加热至110℃,回流,反应16h。冷却至室温,水泵抽真空,80℃下,减压蒸馏除去溶剂。将所得粗产物溶于5~10ml二氯甲烷中,经过碱性氧化铝柱进行柱层析,以石油醚和乙酸乙酯的混合溶剂(体积比为25:1)为淋洗剂进行洗脱,收集第二组分,水泵抽真空,80℃下,减压蒸馏除去溶剂,得到0.95g黄色粉末,产物为l8,产率为39.6%。
[0179]
实施例9
[0180]
将142mg的l1和26mg的cocl2,完全溶解于5ml无水甲醇和2ml二氯甲烷的混合溶液中。溶液的颜色迅速转变为黄褐色,有沉淀物产生。在室温下,对悬浮溶液搅拌8h,以确保反应充分。过滤收集沉淀物,并用5ml无水乙醚洗涤三次。60℃下真空干燥24小时后得到143mg棕色粉末,产物为co-1,产率:92.3%,co-1的结构示意图如图1所示。
[0181]
实施例10
[0182]
将145mg的l2和26mg的cocl2,完全溶解于5ml无水甲醇和2ml二氯甲烷的混合溶液中。溶液的颜色迅速转变为黄褐色,有沉淀物产生。在室温下,对悬浮溶液搅拌8h,以确保反应充分。沉淀物通过过滤收集,并用5ml无水乙醚洗涤三次。60℃下真空干燥24小时后得到148mg棕色粉末,产物为co-2,产率为93.8%。
[0183]
实施例11
[0184]
将148mg的l3和26mg的cocl2,完全溶解于5ml无水甲醇和2ml二氯甲烷的混合溶液中。溶液的颜色迅速转变为黄褐色,形成沉淀物。在室温下,对悬浮溶液搅拌8h,以确保反应充分。沉淀物通过过滤收集,并用5ml无水乙醚洗涤三次。60℃下真空干燥24小时后得到147mg棕色粉末,产物为co-3,产率为91.9%。
[0185]
实施例12
[0186]
将146mg的l4和26mg的cocl2,完全溶解于5ml无水甲醇和2ml二氯甲烷的混合溶液中。溶液的颜色迅速转变为黄褐色,形成沉淀物。在室温下,对悬浮溶液搅拌8h,以确保反应充分。沉淀物通过过滤收集,并用5ml无水乙醚洗涤三次。60℃下真空干燥24小时后得到147mg棕色粉末,产物为co-4,产率为92.5%。
[0187]
实施例13
[0188]
将142mg的l5和26mg的cocl2,完全溶解于5ml无水甲醇和2ml二氯甲烷的混合溶液中。溶液的颜色迅速转变为黄褐色,形成沉淀物。在室温下,对悬浮溶液搅拌8h,以确保反应充分。沉淀物通过过滤收集,并用5ml无水乙醚洗涤三次。60℃下真空干燥24小时后得到147mg棕色粉末,产物为co-5,产率为94.8%。
[0189]
实施例14
[0190]
将145mg的l6和26mg的cocl2,完全溶解于5ml无水甲醇和2ml二氯甲烷的混合溶液中。溶液的颜色迅速转变为黄褐色,形成沉淀物。在室温下,对悬浮溶液搅拌8h,以确保反应充分。沉淀物通过过滤收集,并用5ml无水乙醚洗涤三次。60℃下真空干燥24小时后得到151mg棕色粉末,产物为co-6,产率为95.6%。
[0191]
实施例15
[0192]
将148mg的l7和26mg的cocl2,完全溶解于5ml无水甲醇和2ml二氯甲烷的混合溶液中。溶液的颜色迅速转变为黄褐色,形成沉淀物。在室温下,对悬浮溶液搅拌8h,以确保反应充分。沉淀物通过过滤收集,并用5ml无水乙醚洗涤三次。60℃下真空干燥24小时后得到152mg棕色粉末,产物为co-7,产率为94.5%。
[0193]
实施例16
[0194]
将175mg的l8和26mg的cocl2,完全溶解于5ml无水甲醇和2ml二氯甲烷的混合溶液中。溶液的颜色迅速转变为黄褐色,形成沉淀物。在室温下,对悬浮溶液搅拌8h,以确保反应充分。沉淀物通过过滤收集,并用5ml无水乙醚洗涤三次。60℃下真空干燥24小时后得到173mg棕色粉末,产物为co-8,产率为93.3%,co-8的结构示意图如图2所示。
[0195]
实施例17
[0196]
将142mg的l1和40mg的fecl2·
4h2o,在氮气氛围下,完全溶解于5ml新蒸馏的四氢呋喃中。溶液的颜色迅速转变成蓝紫色,形成紫色沉淀物。在室温下,对悬浮溶液进行搅拌8h,以确保反应充分。沉淀物通过过滤收集,并用5ml正己烷洗涤3次。60℃下真空干燥24小时后得到140mg紫色粉末,产物为fe-1,产率为91.3%。
[0197]
实施例18
[0198]
将145mg的l2和40mg的fecl2·
4h2o,在氮气氛围下,完全溶解于5ml新蒸馏的四氢呋喃中。溶液的颜色迅速转变成蓝紫色,形成紫色沉淀物。在室温下,对悬浮溶液进行搅拌8h,以确保反应充分。沉淀物通过过滤收集,并用5ml正己烷洗涤3次。60℃下真空干燥24小时后得到144mg紫色粉末,产物为fe-2,产率为91.9%。
[0199]
实施例19
[0200]
将148mg的l3和40mg的fecl2·
4h2o,在氮气氛围下,完全溶解于5ml新蒸馏的四氢呋喃中。溶液的颜色迅速转变成蓝紫色,形成紫色沉淀物。在室温下,对悬浮溶液进行搅拌8h,以确保反应充分。沉淀物通过过滤收集,并用5ml正己烷洗涤3次。60℃下真空干燥24小时后得到150mg紫色粉末,产物为fe-3,产率为93.7%。
[0201]
实施例20
[0202]
将146mg的l4和40mg的fecl2·
4h2o,在氮气氛围下,完全溶解于5ml新蒸馏的四氢呋喃中。溶液的颜色迅速转变成蓝紫色,形成紫色沉淀物。在室温下,对悬浮溶液进行搅拌8h,以确保反应充分。沉淀物通过过滤收集,并用5ml正己烷洗涤3次。60℃下真空干燥24小时后得到142mg紫色粉末,产物为fe-4,产率为89.8%。
[0203]
实施例21
[0204]
将142mg的l5和40mg的fecl2·
4h2o,在氮气氛围下,完全溶解于5ml新蒸馏的四氢呋喃中。溶液的颜色迅速转变成蓝紫色,形成紫色沉淀物。在室温下,对悬浮溶液进行搅拌8h,以确保反应充分。沉淀物通过过滤收集,并用5ml正己烷洗涤3次。60℃下真空干燥24小时后得到142mg紫色粉末,产物为fe-5,产率为92.2%。
[0205]
实施例22
[0206]
将145mg的l6和40mg的fecl2·
4h2o,在氮气氛围下,完全溶解于5ml新蒸馏的四氢呋喃中。溶液的颜色迅速转变成蓝紫色,形成紫色沉淀物。在室温下,对悬浮溶液进行搅拌8h,以确保反应充分。沉淀物通过过滤收集,并用5ml正己烷洗涤3次。60℃下真空干燥24小时后得到142mg紫色粉末,产物为fe-6,产率为90.8%。
[0207]
实施例23
[0208]
将148mg的l7和40mg的fecl2·
4h2o,在氮气氛围下,完全溶解于5ml新蒸馏的四氢呋喃中。溶液的颜色迅速转变成蓝紫色,形成紫色沉淀物。在室温下,对悬浮溶液进行搅拌8h,以确保反应充分。沉淀物通过过滤收集,并用5ml正己烷洗涤3次。60℃下真空干燥24小时后得到146mg紫色粉末,产物为fe-7,产率为91.5%。
[0209]
实施例24
[0210]
将175mg的l8和40mg的fecl2·
4h2o,在氮气氛围下,完全溶解于5ml新蒸馏的四氢呋喃中。溶液的颜色迅速转变成蓝紫色,形成紫色沉淀物。在室温下,对悬浮溶液进行搅拌8h,以确保反应充分。沉淀物通过过滤收集,并用5ml正己烷洗涤3次。60℃下真空干燥24小时后得到166mg紫色粉末,产物为fe-8,产率为90.2%。
[0211]
实施例25
[0212]
在乙烯氛围下,将30ml的配合物co-3的甲苯溶液注射到250ml装有机械搅拌的不锈钢高压釜中,作为主催化剂,其中co-3的含量为2μmol,接着加入30ml甲苯,再加入所需量的1.0ml的助催化剂mmao正己烷溶液,其浓度为1.98mol/l,继续加入甲苯使反应液总体积为100ml。启动机械搅拌,保持400转/分,当聚合温度达到20℃时,往反应釜中充入乙烯气体,聚合反应开始。在20℃下保持10atm的乙烯压强,搅拌进行聚合反应30min。反应结束后用10%盐酸酸化的乙醇溶液猝灭反应液。通过gc测试得到:聚合活性:0.95
×
105g/mol(co)h-1
,齐聚物分布:c4/σc=94.1%(c4/σc为丁烯与所生成齐聚物总量的百分比),丁烯中2-c4含量为84.2%(2-c4为2-丁烯,α-c4为1-丁烯)。
[0213]
实施例26
[0214]
同实施例25,区别在于:聚合温度为30℃。聚合活性:1.32
×
105g/mol(co)h-1
,齐聚物分布:c4/σc=95.2%,丁烯中2-c4含量为83.9%。
[0215]
实施例27
[0216]
同实施例25,区别在于:聚合温度为40℃。聚合活性:1.00
×
105g/mol(co)h-1
,齐聚物分布:c4/σc=95.8%,丁烯中2-c4含量为68.8%。
[0217]
实施例28
[0218]
同实施例25,区别在于:聚合温度为50℃。聚合活性:1.44
×
105g/mol(co)h-1
,齐聚物分布:c4/σc=92.9%,丁烯中2-c4含量为87.6%。
[0219]
实施例29
[0220]
同实施例25,区别在于:聚合温度为60℃。聚合活性:1.09
×
105g/mol(co)h-1
,齐聚物分布:c4/σc=92.2%,丁烯中2-c4含量为78.5%。
[0221]
实施例30
[0222]
同实施例25,区别在于:聚合温度为70℃。聚合活性:0.94
×
105g/mol(co)h-1
,齐聚物分布:c4/σc=93.9%,丁烯中2-c4含量为65.6%。
[0223]
实施例31
[0224]
同实施例25,区别在于:聚合温度为80℃。聚合活性:0.98
×
105g/mol(co)h-1
,齐聚物分布:c4/σc=92.9%,丁烯中2-c4含量为85.6%。
[0225]
实施例32
[0226]
同实施例28,区别在于:0.5ml的助催化剂mmao溶液。聚合活性:0.13
×
105g/mol(co)h-1
,齐聚物分布:c4/σc=100%,丁烯中α-c4含量为100%。
[0227]
实施例33
[0228]
同实施例28,区别在于:1.5ml的助催化剂mmao溶液。聚合活性:1.63
×
105g/mol(co)h-1
,齐聚物分布:c4/σc=93.2%,丁烯中2-c4含量为79.1%。
[0229]
实施例34
[0230]
同实施例28,区别在于:1.75ml的助催化剂mmao溶液。聚合活性:2.58
×
105g/mol(co)h-1
,齐聚物分布:c4/σc=94.7%,丁烯中2-c4含量为78.9%。
[0231]
实施例35
[0232]
同实施例28,区别在于:2.0ml的助催化剂mmao溶液。聚合活性:1.56
×
105g/mol(co)h-1
,齐聚物分布:c4/σc=95.3%,丁烯中2-c4含量为68.2%。
[0233]
实施例36
[0234]
同实施例34,区别在于:聚合时间为5min。聚合活性:4.80
×
105g/mol(co)h-1
,齐聚物分布:c4/σc=100%,丁烯中2-c4含量为15.2%。
[0235]
实施例37
[0236]
同实施例34,区别在于:聚合时间为15min。聚合活性:2.71
×
105g/mol(co)h-1
,齐聚物分布:c4/σc=96.8%,丁烯中2-c4含量为52.1%。
[0237]
实施例38
[0238]
同实施例34,区别在于:聚合时间为45min。聚合活性:1.74
×
105g/mol(co)h-1
,齐聚物分布:c4/σc=94.5%,丁烯中2-c4含量为82.4%。
[0239]
实施例39
[0240]
同实施例34,区别在于:聚合时间为60min。聚合活性:2.30
×
105g/mol(co)h-1
,齐聚物分布:c4/σc=94.1%,丁烯中2-c4含量为90.4%。
[0241]
实施例40
[0242]
同实施例34,区别在于:乙烯气体压强为5atm。聚合活性:0.75
×
105g/mol(co)h-1
,齐聚物分布:c4/σc=94.9%,丁烯中α-c4含量为55.3%。
[0243]
实施例41
[0244]
同实施例34,区别在于:主催化剂为co-1。聚合活性:0.71
×
105g/mol(co)h-1
,齐聚物分布:c4/σc=93.3%,丁烯中2-c4含量为67.0%。
[0245]
实施例42
[0246]
同实施例34,区别在于:主催化剂为co-2。聚合活性:1.50
×
105g/mol(co)h-1
,齐聚物分布:c4/σc=96.1%,丁烯中2-c4含量为63.1%。
[0247]
实施例43
[0248]
同实施例34,区别在于:主催化剂为co-4。聚合活性:2.05
×
105g/mol(co)h-1
,齐聚物分布:c4/σc=94.9%,丁烯中2-c4含量为73.8%。
[0249]
实施例44
[0250]
同实施例34,区别在于:主催化剂为co-5。聚合活性:1.37
×
105g/mol(co)h-1
,齐聚物分布:c4/σc=99.9%,丁烯中α-c4含量为55.7%。
[0251]
实施例45
[0252]
同实施例34,区别在于:主催化剂为co-6。聚合活性:1.48
×
105g/mol(co)h-1
,齐聚物分布:c4/σc=99.8%,丁烯中2-c4含量为57.0%。
[0253]
实施例46
[0254]
同实施例34,区别在于:主催化剂为co-7。聚合活性:3.26
×
105g/mol(co)h-1
,齐聚物分布:c4/σc=98.1%,丁烯中2-c4含量为84.4%。
[0255]
实施例47
[0256]
同实施例34,区别在于:主催化剂为co-8。聚合活性:1.48
×
105g/mol(co)h-1
,齐聚物分布:c4/σc=95.8%,丁烯中2-c4含量为59.3%。
[0257]
实施例48
[0258]
在乙烯氛围下,将30ml的配合物fe-3的甲苯溶液注射到250ml装有机械搅拌的不锈钢高压釜中,作为主催化剂,其中fe-3的含量为2μmol,接着加入30ml甲苯,再加入所需量的1.0ml的助催化剂mmao正己烷溶液,其浓度为1.98mol/l,继续加入甲苯使反应液总体积为100ml。启动机械搅拌,保持400转/分,当聚合温度达到20℃时,往反应釜中充入乙烯气体,聚合反应开始。在20℃下保持10atm的乙烯压强,搅拌进行聚合反应30min。反应结束后用10%盐酸酸化的乙醇溶液猝灭反应液。通过gc测试得到:聚合活性:0.31
×
105g/mol(fe)h-1
,齐聚物分布以c4为主:c4/σc=93.0%,丁烯中α-c4含量为74.8%。
[0259]
实施例49
[0260]
同实施例48,区别在于:聚合温度为30℃。聚合活性:0.19
×
105g/mol(fe)h-1
,齐聚物分布,c4为主:c4/σc=95%,丁烯中α-c4含量为62.0%。
[0261]
实施例50
[0262]
同实施例48,区别在于:聚合温度为40℃。聚合活性:0.54
×
105g/mol(fe)h-1
,产物主要为丁烯,齐聚物分布:c4/σc=65%,丁烯中α-c4含量为59.4%。
[0263]
实施例51
[0264]
同实施例48,区别在于:聚合温度为50℃。聚合活性:0.41
×
105g/mol(fe)h-1
,齐聚物分布:c4/σc=91%,丁烯中α-c4含量为68.5%。
[0265]
实施例52
[0266]
同实施例48,区别在于:聚合温度为60℃。聚合活性:0.24
×
105g/mol(fe)h-1
,齐聚物分布:c4含量为100%,丁烯中α-c4含量为70.5%。
[0267]
实施例53
[0268]
同实施例48,区别在于:聚合温度为70℃。聚合活性:0.38
×
105g/mol(fe)h-1
,齐聚物分布:c4/σc=100%,丁烯中α-c4含量为81.5%。
[0269]
实施例54
[0270]
同实施例48,区别在于:聚合温度为80℃。聚合活性:0.51
×
105g/mol(fe)h-1
,齐聚物分布:c4/σc=100%,丁烯中α-c4含量为63.6%。
[0271]
实施例55
[0272]
同实施例50,区别在于:0.5ml的助催化剂mmao溶液。聚合活性:0.33
×
105g/mol(fe)h-1
,齐聚物分布:c4/σc=100%,丁烯中α-c4含量为70.9%。
[0273]
实施例56
[0274]
同实施例50,区别在于:1.5ml的助催化剂mmao溶液。聚合活性:0.64
×
105g/mol(fe)h-1
,齐聚物分布:c4/σc=100%,丁烯中α-c4含量为74.7%。
[0275]
实施例57
[0276]
同实施例50,区别在于:1.8ml的助催化剂mmao溶液。聚合活性:0.71
×
105g/mol(fe)h-1
,齐聚物分布:c4/σc=100%,丁烯中α-c4含量为71.9%。
[0277]
实施例58
[0278]
同实施例50,区别在于:2.0ml的助催化剂mmao溶液。聚合活性:0.89
×
105g/mol(fe)h-1
,齐聚物分布:c4/σc=100%,丁烯中α-c4含量为80.1%。
[0279]
实施例59
[0280]
同实施例50,区别在于:2.5ml的助催化剂mmao溶液。聚合活性:1.30
×
105g/mol(fe)h-1
,齐聚物分布:c4/σc=100%,丁烯中α-c4含量为86.7%。
[0281]
实施例60
[0282]
同实施例50,区别在于:3.0ml的助催化剂mmao溶液。聚合活性:1.47
×
105g/mol(fe)h-1
,齐聚物分布:c4/σc=100%,丁烯中α-c4含量为84.9%。
[0283]
实施例61
[0284]
同实施例50,区别在于:4.0ml的助催化剂mmao溶液。聚合活性:1.06
×
105g/mol(fe)h-1
,齐聚物分布:c4含量为100%,丁烯中α-c4含量为100%。
[0285]
实施例62
[0286]
同实施例50,区别在于:6.0ml的助催化剂mmao溶液。聚合活性:2.40
×
105g/mol(fe)h-1
,齐聚物分布:c4/σc=100%,丁烯中α-c4含量为100%。
[0287]
实施例63
[0288]
同实施例50,区别在于:8.0ml的助催化剂mmao溶液。聚合活性:3.29
×
105g/mol(fe)h-1
,齐聚物分布:c4/σc=100%,丁烯中α-c4含量为100%。
[0289]
实施例64
[0290]
同实施例58,区别在于:聚合时间为5min。聚合活性:4.38
×
105g/mol(fe)h-1
,齐聚物分布:产物为c4,含量100%,丁烯中α-c4含量为99%。
[0291]
实施例65
[0292]
同实施例58,区别在于:聚合时间为15min。聚合活性:1.39
×
105g/mol(fe)h-1
,齐聚物分布:c4/σc=13.2%,c6/σc=86.8%,丁烯中α-c4含量为80.1%。
[0293]
实施例66
[0294]
同实施例58,区别在于:聚合时间为45min。聚合活性:0.68
×
105g/mol(fe)h-1
,齐聚物分布:c4/σc=100%,丁烯中α-c4含量为75.0%。
[0295]
实施例67
[0296]
同实施例58,区别在于:聚合时间为60min。聚合活性:0.54
×
105g/mol(fe)h-1
,齐聚物分布:c4/σc=100%,丁烯中α-c4含量为63.6%。
[0297]
实施例68
[0298]
同实施例58,区别在于:乙烯压强为5atm。聚合活性:0.70
×
105g/mol(fe)h-1
,齐聚物分布:c4/σc=100%,丁烯中α-c4含量为100%。
[0299]
实施例69
[0300]
同实施例58,区别在于:主催化剂为fe-1。聚合活性:0.83
×
105g/mol(fe)h-1
,齐聚物分布:c4/σc=100%,丁烯中α-c4含量为86.0%。
[0301]
实施例70
[0302]
同实施例58,区别在于:主催化剂为fe-2。聚合活性:1.02
×
105g/mol(fe)h-1
,齐聚物分布:c4/σc=100%,丁烯中α-c4含量为84%。
[0303]
实施例71
[0304]
同实施例58,区别在于:主催化剂为fe-4。聚合活性:0.36
×
105g/mol(fe)h-1
,齐聚物分布:c4/σc=100%,丁烯中α-c4含量为100%。。
[0305]
实施例72
[0306]
同实施例58,区别在于:主催化剂为fe-5。聚合活性:0.92
×
105g/mol(fe)h-1
,齐聚物分布c4~c
26
:c4/σc=15.7%,丁烯中α-c4含量为60.2%
[0307]
实施例73
[0308]
同实施例58,区别在于:主催化剂为fe-6。聚合活性:1.27
×
105g/mol(fe)h-1
,齐聚物分布c4~c
26
:c4/σc=18.0%,丁烯中α-c4含量为55.1%,。
[0309]
实施例74
[0310]
同实施例58,区别在于:主催化剂为fe-7。聚合活性:1.20
×
105g/mol(fe)h-1
,齐聚物分布:c4/σc=20.0%,丁烯中α-c4含量为51.2%,c6/σc=64.5%,己烯中α-c6含量为62.5%,≥c8/σc=15.5%(≥c8/σc为8碳及以上的烯烃占与所生成齐聚物总量的百分比)。
[0311]
实施例75
[0312]
同实施例58,区别在于:主催化剂为fe-8。聚合活性:0.78
×
105g/mol(fe)h-1
,齐聚物分布:c4/σc=100%,丁烯中α-c4含量为80.3%
[0313]
实验例
[0314]
实验例1
[0315]
对实施例1~8中的l1~l8进行核磁共振测试。结果如下:l1:
[0316]1h nmr(400mhz,cdcl3.tms):δ9.18(d,j=4.0hz,1h);8.39(d,j=8.0hz,1h);8.20-8.14(m,2h);7.76(s,2h);7.59-7.56(m,1h);7.18-7.00(m,20h);6.72(s,2h);5.37(s,2h);2.17(s,3h);2.00(s,3h).
[0317]
13
c nmr(100mhz,cdcl3.tms):δ169.4,155.9,150.6,146.6,146.2,145.3,143.6,143.0,136.4,136.2,132.1,129.9,129.0,128.7,128.3,128.1,127.5,126.2,122.9,121.1,52.2,21.5,17.4.
[0318]
l2:
[0319]1h nmr(400mhz,cdcl3.tms):δ9.21(d,j=3.1hz,1h);8.37(d,j=7.9hz,1h);8.28(d,j=7.6hz,1h);8.26(d,j=8.0hz,1h);7.84(s,2h);7.65-7.62(m,1h);7.21-7.06(m,20h);6.74(s,2h);5.34(s,2h);2.73-2.70(m,2h);1.98(s,3h);1.08(s,3h).
[0320]
13
c nmr(100mhz,cdcl3.tms):δ169.7,156.1,151.0,146.8,146.5,145.3,143.7,
143.3,136.6,136.3,132.0,129.6,128.8,128.4,128.0,127.9,127.5,126.0,122.6,120.7,52.3,34.1,23.7,17.4,14.2.
[0321]
l3:
[0322]1h nmr(400mhz,cdcl3.tms):δ9.18(d,j=3.0hz,1h);8.38(d,j=8.0hz,1h);8.22-8.15(m,2h);7.78(s,2h);7.61-7.57(m,1h);7.18-7.02(m,20h);6.77(s,2h);5.36(s,2h);2.77-2.67(m,1h);1.99(s,3h);1.08(d,j=9.0hz,6h).
[0323]
13
c nmr(100mhz,cdcl3.tms):δ169.3,156.0,150.6,143.8,143.2,142.8,136.3,136.1,131.8,129.6,129.0,128.5,127.4,126.7,126.5,126.3,126.2,126.0,122.9,121.1,52.3,33.6,24.2,17.5.
[0324]
l4:
[0325]1h nmr(400mhz,cdcl3.tms):δ1h nmr(400mhz,cdcl3):δ9.10(d,j=4.0hz,1h);8.23(d,j=8.0hz,1h);8.14-8.07(m,2h);7.70(s,2h);7.52-7.49(m,1h);7.10-6.88(m,20h);6.80(s,2h);5.25(s,2h);1.87(s,3h).
[0326]
13
c nmr(100mhz,cdcl3.tms):δ170.0,155.3,150.5,147.0,146.4,145.2,142.6,141.9,136.3,136.2,134.3,129.7,129.6,129.4,129.0,128.7,128.5,128.2,128.1,127.6,126.6,126.5,126.3,123.0,120.9,52.1,17.6.
[0327]
l5:
[0328]1h nmr(400mhz,cdcl3.tms):δ9.12(s,1h);8.57(d,j=8.0hz,1h);8.22(d,j=8.0hz,1h);8.17(d,j=8.0hz,1h);7.75(s,2h);7.56(s,1h);7.76-7.53(m,10h);7.01
–
6.96(m,10h);6.80(s,1h);6.55(s,1h);5.38(s,1h);5.19(s,1h);2.01(s,3h);1.89(s,3h).
[0329]
13
c nmr(100mhz,cdcl3.tms):δ169.3,156.2,150.7,146.7,146.5,145.3,144.6,144.5,143.8,142.8,138.2,136.4,132.8,129.7,129.5,129.4,129.1,129.0,128.5,128.3,128.2,128.1,127.6,126.7,126.3,126.2,126.1,125.3,123.0,121.0,56.5,52.4,18.3,17.3.
[0330]
l6:
[0331]1h nmr(400mhz,cdcl3.tms):δ9.12(s,1h);8.57(d,j=12.0hz,1h);8.20(t,j=12.0hz,2h);7.76(s,2h);7.56(s,1h);7.17-7.07(m,10h);7.01
–
6.90(m,10h);6.85(s,1h);6.55(s,1h);5.37(d,j=12.0hz,1h);2.20
–
2.27(m,2h);2.02(s,3h);0.95(t,j=8.0hz,3h).
[0332]
13
c nmr(100mhz,cdcl3.tms):δ169.1,156.2,150.7,146.5,146.2,145.3,144.7,144.6,143.9,142.9,138.2,136.4,132.4,131.1,129.7,129.6,129.5,129.1,129.0,128.3,128.2,128.1,127.6,127.5,126.7,126.3,126.1,126.0,123.0,121.0,56.6,52.4,24.4,17.4,13.6.
[0333]
l7:
[0334]1h nmr(400mhz,cdcl3.tms):δ9.11(d,j=4.0hz,1h);8.57(d,j=8.0hz,1h);8.17(d,j=20hz,1h);8.12(d,j=4.0hz,1h);7.72(t,j=12.0hz,2h);7.52-7.49(m,1h);7.16-6.83(m,20h);6.83(s,1h);6.52(s,1h);5.37(d,j=8.0hz,1h);2.15(s,3h);0.99(d,j=8.0hz 3h);0.95(d,j=8.0hz 3h).
[0335]
13
c nmr(100mhz,cdcl3.tms):δ168.9,156.2,150.6,146.5,145.5,145.2,144.8,144.7,143.9,142.8,138.2,136.4,136.3,135.8,132.1,129.7,129.6,129.5,129.1,128.8,128.2,128.0,127.5,126.6,126.2,126.1,125.9,125.0,122.9,121.0,56.7,52.5,28.0,23.7,22.7,17.5.
[0336]
l8:
[0337]1h nmr(400mhz,cdcl3.tms):δ9.12(d,j=8.0hz,1h);8.33(d,j=8.0hz,1h);8.20-8.10(m,2h);7.74(s,2h);7.55-7.52(m,1h);7.16-6.82(m,30h);6.61(s,2h);5.30(s,1h);5.24(d,j=4.0hz,2h);1.90(s,3h).
[0338]
13
c nmr(100mhz,cdcl3.tms):δ169.2,156.0,150.5,146.8,146.3,145.4,144.9,144.8,143.6,143.1,137.9,137.0,136.7,132.5,130.1,130.0,129.8,129.7,129.5,129.4,128.6,128.5,128.3,128.1,126.7,126.3,126.2,126.0,125.1,122.6,121.0,56.5,52.3,30.9,28.6,20.1,17.4.
[0339]
实验例2
[0340]
对实施例1~8中的l1~l8进行红外光谱测试。结果如下:
[0341]
l1:
[0342]
ft-ir(cm-1
):3358,3051,3017,2959,2132,1644(ν
c=n
),1583,1552,1498,1461,1366,1324,1247,1183,1149,1110,1072,1029,891,860,831,822,811,779,759,705,692,661。
[0343]
l2:
[0344]
ft-ir(cm-1
):3361,3055,3019,2958,2134,1647(ν
c=n
),1581,1555,1502,1460,1369,1247,1186,1155,1117,1075,1032,896,873,837,819,784,755,711,690,661.
[0345]
l3:
[0346]
ft-ir(cm-1
):3355,3058,3022,2953,2159,1651(ν
c=n
),1600,1552,1491,1449,1366,1320,1243,1181,1155,1116,1075,1031,891,861,831,823,762,745,737,710,697,662.
[0347]
l4:
[0348]
ft-ir(cm-1
):3058,3022,2924,2023,1976,1641(ν
c=n
),1600,1552,1491,1447,1361,1319,1266,1178,1132,1115,1076,1029,916,884,860,829,789,765,742,706,695,665.
[0349]
l5:
[0350]
ft-ir(cm-1
):3357,3083,3061,3023,2962,2920,2864,2161,2021,1967,1640(ν
c=n
),1599,1552,1491,1448,1389,1364,1321,1256,1134,1116,1078,1031,911,885,855,830,761,743,697,660.
[0351]
l6:
[0352]
ft-ir(cm-1
):3357,3056,3024,2962,2927,2866,2161,2023,1967,1639(ν
c=n
),1599,1552,1491,1448,1389,1364,1321,1251,1134,1116,1078,1031,885,855,830,776,761,742,697,661.
[0353]
l7:
[0354]
ft-ir(cm-1
):3058,3023,2959,2924,2866,2160,2014,1967,1639(ν
c=n
),1599,
1552,1491,1448,1389,1363,1320,1251,1134,1115,1077,1030,912,885,855,830,775,762,742,698,661.
[0355]
l8:
[0356]
ft-ir(cm-1
):3058,3023,2962,2922,2866,2160,2019,1967,1640(ν
c=n
),1599,1552,1492,1448,1389,1364,1337,1257,1158,1115,1077,1030,904,884,856,830,762,744,697,660.
[0357]
从红外光谱的测试数据来看,产物中具有亚胺基。
[0358]
实验例3
[0359]
对实施例1~8中的l1~l8进行元素分析测试。结果如下:
[0360]
l1(c
47h37
n3,分子量643.83)元素质量占比:
[0361]
理论值:c,87.68;h,5.79;n,6.53。实际值:c,87.52;h,5.92;n,6.56。
[0362]
l2(c
48h39
n3,分子量657.86)元素质量占比:
[0363]
理论值:c,87.64;h,5.98;n,6.39。实际值:c,87.47;h,6.08;n,6.46。
[0364]
l3(c
49h41
n3,分子量671.89)元素质量占比:
[0365]
理论值:c,87.59;h,6.15;n,6.25。实际值:c,87.81;h,6.02;n,6.17。
[0366]
l4:(c
46h34
cln3,分子量664.25)元素质量占比:
[0367]
理论值:c,83.18;h,5.16;n,6.33。实际值:c,82.95;h,5.32;n,6.40。
[0368]
l5:(c
47h37
n3,分子量643.83)元素质量占比:
[0369]
理论值:c,87.68;h,5.79;n,6.53。实际值:c,87.44;h,5.92;n,6.64。
[0370]
l6:(c
48h39
n3,分子量657.86)元素质量占比:
[0371]
理论值:c,87.64;h,5.98;n,6.39。实际值:c,87.73;h,6.11;n,6.16。
[0372]
l7:(c
49h41
n3,分子量671.89)元素质量占比:
[0373]
理论值:c,87.59;h,6.15;n,6.25。实际值:c,87.76;h,6.05;n,6.19。
[0374]
l8:(c
59h45
n3,分子量796.03)元素质量占比:
[0375]
理论值:c,89.02;h,5.70;n,5.28。实际值:c,88.85;h,5.83;n,5.32。
[0376]
从元素分析的测试结果来看,各元素的质量占比能够与理论值相符合,说明产物中的各元素占比与目标产物基本一致。
[0377]
由上述实验例1~3中结构确证数据可知,可以确定,实施例1~8中所制备的化合物分别为l1~l8。
[0378]
以上结合具体实施方式和/或范例性实例以及附图对本发明进行了详细说明,不过这些说明并不能理解为对本发明的限制。本领域技术人员理解,在不偏离本发明精神和范围的情况下,可以对本发明技术方案及其实施方式进行多种等价替换、修饰或改进,这些均落入本发明的范围内。本发明的保护范围以所附权利要求为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1