一种氢溴酸伏硫西汀晶型及其制备方法、组合物与用途与流程
本发明涉及医药
技术领域:
,具体涉及一种氢溴酸伏硫西汀晶型及其制备方法、组合物与用途。
背景技术:
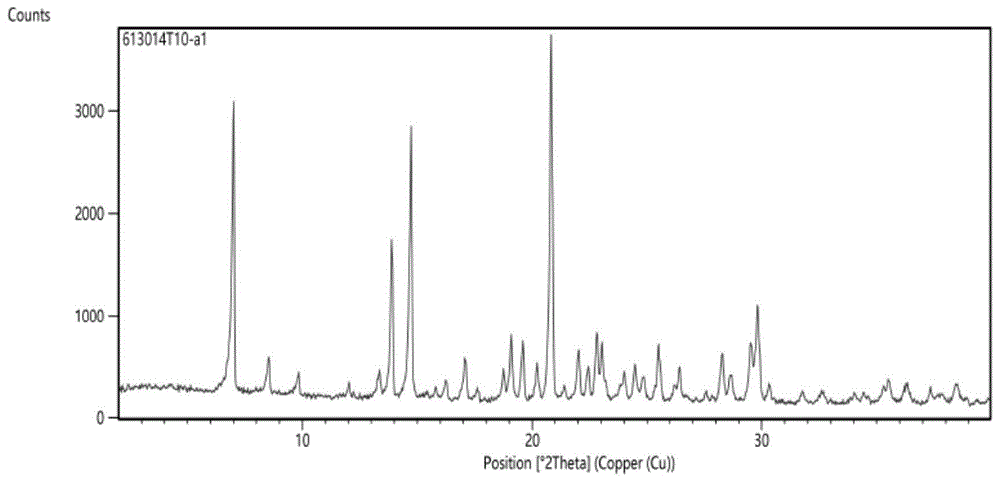
:氢溴酸伏硫西汀(英文名:vortioxetinehydrobromide),化学名为1-[2-(2,4-二甲基苯基硫基)苯基]哌嗪氢溴酸盐,其结构式如下式i所示。氢溴酸伏硫西汀是由丹麦灵北制药开发的一种选择性5-羟色胺重摄取抑制剂,同时对部分5-羟色胺受体亚型还具有拮抗或激动的作用,已于2013年获美国食品药品管理局fda批准用于治疗重度抑郁症。华南理工大学的莫贤炜在其硕士学位论文《沃替西汀前药的设计、合成、体外活性及药代动力学评价》中指出,伏硫西汀对5-羟色胺转运体的ic50略低于8.06μm。一种物质能以两种或两种以上不同的晶体结构存在的现象称为多晶现象。1912年m.von劳厄发现x射线衍射后,开始从结构上认识多晶现象。具有多晶现象的物质,其不同晶体结构即为其不同晶型,mccrone在1965年提出的多晶型概念中指出,同一种分子在不同固态晶格中有不同的填充、排列方式,多晶型现象的实质是由于同一种元素或化合物在不同的生成条件下质点(原子、离子或分子)排列的空间对称性不同,质点间的相互作用力和结合能量存在差异,从而导致其在外观形态、理化性质和生物活性上的差异。药物晶型不仅会影响药物的稳定性、溶解度与溶出度、生物利用度,还会影响其药理活性。中国专利申请cn101472906a公开了多种晶型的氢溴酸伏硫西汀,其中β型即为氢溴酸伏硫西汀在全球各国的药用晶型。日本pmda批准的氢溴酸伏硫西汀片的interviewform指出,β型氢溴酸伏硫西汀在水中的溶解度仅为1.3mg/ml(ph5.5),显著低于其在其他有机溶剂中的溶解度。美国fda批准的说明书指出,β型氢溴酸伏硫西汀片的口服绝对生物利用度约为75%,有待进一步提高。中国专利申请cn102317272a公开了一种1-[2-(2,4-二甲基苯基硫基)苯基]哌嗪的制造方法。在提纯氢溴酸伏硫西汀所用步骤复杂,需要分离得到异丙醇溶剂合物,后再溶解到其他溶剂中沉淀得到,操作步骤复杂。中国专利申请cn105367515a公开了一种氢溴酸沃替西汀α晶型的制备方法。其包括下述步骤:将氢溴酸沃替西汀一仲丁醇合物去除仲丁醇,即可得到所述的氢溴酸沃替西汀α晶型。但其收率明显较低。在精制氢溴酸伏硫西汀所用溶剂都为非常规试剂,存在潜在的溶剂残留的风险。中国专利申请cn110520415a公开了一种制备沃替西汀氢溴酸盐α晶型的制备方法,该方法包括以下步骤a)获得沃替西汀在基本上纯的甲苯中的沃替西汀溶液;b)在高于10℃的温度下,将步骤a)中获得的所述溶液与氢溴酸和c1-c3羧酸混合以获得混合物b);以及c)收集步骤b)中获得的沉淀物。其中,精制氢溴酸伏硫西汀时所用溶剂为甲苯,为ich限制性使用的第二类溶剂。因此,利用开发一种能解决上述技术问题的氢溴酸伏硫西汀晶型及其制备方法、组合物与用途是非常必要的。技术实现要素:本发明的目的是克服现有技术的不足而提供一种溶解度和口服生物利用度显著提高、安全、制备工艺简单、适合工业化生产的氢溴酸伏硫西汀晶型及其制备方法、组合物与用途。本发明是通过以下技术方案予以实现的:一种氢溴酸伏硫西汀晶型,所述晶型的x-射线衍射图谱至少在2θ±0.2°位置有特征峰,所述2θ为7.0、13.9、14.7、20.8和29.8。优选地,所述晶型的x-射线衍射图谱在2θ±0.2°位置有特征峰,所述2θ为7.0、8.5、13.9、14.7、17.1、18.8、19.1、19.6、20.2、20.8、22.0、22.8、23.0、24.5、25.5、26.4、28.3、29.5和29.8。本发明还涉及上述的氢溴酸伏硫西汀晶型的制备方法,包括如下步骤:取β型氢溴酸伏硫西汀加入水,升温至β型氢溴酸伏硫西汀溶解,降温至15-25℃,搅拌、过滤,干燥,即得。所述β型氢溴酸伏硫西汀是按照中国专利申请cn101472906a实施例4c中公开的方法制备得到的。优选地,所述β型氢溴酸伏硫西汀与水的质量体积比为1:6-8g/ml。优选地,所述搅拌的时间为1.5-2.5h。优选地,所述升温的速率为5-25℃/min。优选地,所述降温的速率为5-25℃/min。优选地,降温过程中先降温至45-55℃,保温1-5h,再降温至15-25℃。更优选地,所述升温的速率为5-25℃/min。更优选地,所述降温的速率为5-25℃/min。两次降温的速率相互独立。更优选地,所述制备方法包括如下步骤:取β型氢溴酸伏硫西汀加入6-8倍量的水,升温至β型氢溴酸伏硫西汀溶解至澄清,降温至15-25℃,搅拌1.5-2.5h、过滤,干燥,即得。更优选地,所述制备方法包括如下步骤:取β型氢溴酸伏硫西汀加入6-8倍量的水,以5-25℃/min升温至β型氢溴酸伏硫西汀溶解至澄清,然后以5-25℃/min降温至45-55℃,保温1-5h,再以5-25℃/min降温至15-25℃,搅拌1.5-2.5h、过滤,干燥,即得。本发明还涉及一种组合物,包括上述的氢溴酸伏硫西汀晶型或者上述的制备方法制备得到的氢溴酸伏硫西汀晶型。本发明还涉及一种药物制剂,其特征在于,包括上述的组合物和其药学上可接受的辅料。所述辅料既可以是各种制剂中常规使用的,如:但不仅限于,等渗剂、缓冲液、矫味剂、赋形剂、填充剂、粘合剂、崩解剂和润滑剂等;也可以是为了与所述物质相适应而选择使用的,如:乳化剂、增溶剂、抑菌剂、止痛剂和抗氧剂等,这类辅料能有效提高组合物所含化合物的稳定性和溶解性或改变化合物的释放速率和吸收速率等,从而改善本发明化合物在生物体内的代谢,进而增强给药效果。此外,还可以为实现特定的给药目的或方式,如:缓释给药、控释给药和脉冲给药等,而使用的辅料,如:但不仅限于,明胶、白蛋白、壳聚糖、聚醚和聚酯类高分子材料,如:但不仅限于,聚乙二醇、聚氨酯、聚碳酸酯及其共聚物等。所述制剂是有利于给药的剂型,所称的“有利于给药”的主要表现有:但不仅限于提高治疗效果、提高生物利用度、降低毒副作用和提高患者顺应性等。优选地,所述药物制剂为颗粒剂、胶囊剂与片剂中的一种。本发明还涉及上述的氢溴酸伏硫西汀晶型或者上述的制备方法制备得到的氢溴酸伏硫西汀晶型或上述的组合物或上述的药物制剂在制备治疗疾病的药物中的应用,所述疾病选自情感障碍、抑郁、严重抑郁性紊乱、产后抑郁症、与双相精神障碍有关的抑郁、阿尔茨海默氏症、精神病、癌症、老龄或帕金森氏症、焦虑、广泛性焦虑症、社交焦虑症、强迫症、惊恐障碍、恐慌发作、恐惧症、社交恐惧症、广场恐惧症、压力性尿失禁、呕吐、ibs、饮食紊乱、慢性疼痛、部分应答、治疗抵抗性抑郁、阿尔茨海默氏症、认知损伤、adhd、精神忧郁症、ptsd、热潮、睡眠呼吸暂停、酗酒、尼古丁或碳水化合物成瘾、药物滥用和酒精或毒品滥用中的至少一种。本发明的有益效果是:本发明的氢溴酸伏硫西汀晶型溶解度和口服生物利用度显著高于现有晶型。本发明在制备过程中仅采用水作为溶剂,避免了安全隐患,且制备工艺简单,可操作性强,有利于工业化生产,且不存在三废的产生。附图说明图1为实施例1氢溴酸伏硫西汀晶型的x射线衍射图。具体实施方式下面结合具体实施例来进一步描述本发明,本发明的优点和特点将会随着描述而更为清楚。但这些实施例仅是范例性的,并不对本发明的范围构成任何限制。本领域技术人员应该理解的是,在不偏离本发明的精神和范围下可以对本发明技术方案的细节和形式进行修改或替换,但这些修改和替换均落入本发明的保护范围内。实施例1氢溴酸伏硫西汀晶型制备的影响因素考察实施例1.1氢溴酸伏硫西汀/水质量体积比对所得晶型熔点、产率与溶解度的影响取三份β型氢溴酸伏硫西汀,每份1g,分别加入6、7或8ml纯化水,以20℃/min的速度升温至β型氢溴酸伏硫西汀完全溶解(100℃),再以20℃/min的速度降温至50℃,保温3小时后再以20℃/min的速度降温至20℃,搅拌2h后析出固体,过滤,干燥,称重,测氢溴酸伏硫西汀晶型的熔点与25℃下在水中的溶解度,结果如表1所示。表1β型氢溴酸伏硫西汀/水的质量体积比对所得固体熔点、产率与溶解度的影响实施例1.2升温速度对所得晶型的熔点、产率与溶解度的影响取3份β型氢溴酸伏硫西汀,每份1g,分别加入7ml纯化水,分别以5℃/min、20℃/min与25℃/min的速度升温至β型氢溴酸伏硫西汀完全溶解(99℃),再以20℃/min的速度降温至50℃,保温3小时后再以20℃/min的速度降温至20℃,搅拌2h后析出固体,过滤,干燥,称重,测氢溴酸伏硫西汀晶型的熔点与25℃下水中的溶解度结果如表2所示。表2升温速度对所得晶型的熔点、产率与溶解度的影响实施例1.3第一步降温速度对所得晶型的熔点、产率与溶解度的影响取3份β型氢溴酸伏硫西汀,每份1g,分别加入7ml纯化水,分别以20℃/min的速度升温至β型氢溴酸伏硫西汀完全溶解(100℃),再分别以5℃/min、20℃/min与25℃/min的速度降温至50℃,保温3小时后再以20℃/min的速度降温至20℃,搅拌2h后析出固体,过滤,干燥,称重,测氢溴酸伏硫西汀晶型的熔点与25℃下水中的溶解度结果如表3所示。表3第一步降温速度对所得晶型的熔点、产率与溶解度的影响实施例1.4第一步降温的终温度对所得晶型的熔点、产率与溶解度的影响取3份β型氢溴酸伏硫西汀,每份1g,分别加入7ml纯化水,分别以20℃/min的速度升温至β型氢溴酸伏硫西汀完全溶解(100℃),再以20℃/min的速度分别降温至45℃、50℃与55℃,保温3小时后再以20℃/min的速度降温至20℃,搅拌2h后析出固体,过滤,干燥,称重,测氢溴酸伏硫西汀晶型的熔点与25℃下水中的溶解度结果如表4所示。表4第一步降温的终温度对所得晶型的熔点、产率与溶解度的影响实施例1.5保温时间对所得晶型的熔点、产率与溶解度的影响取3份β型氢溴酸伏硫西汀,每份1g,分别加入7ml纯化水,分别以20℃/min的速度升温至β型氢溴酸伏硫西汀完全溶解(100℃),再以20℃/min的速度降温至50℃,分别保温0、2.5与5小时后再以20℃/min的速度降温至20℃,搅拌2h后析出固体,过滤,干燥,称重,测氢溴酸伏硫西汀晶型的熔点与25℃下水中的溶解度结果如表5所示。表5保温时间对所得晶型的熔点、产率与溶解度的影响实施例1.6第二步降温速度对所得晶型的熔点、产率与溶解度的影响取3份β型氢溴酸伏硫西汀,每份1g,分别加入7ml纯化水,分别以20℃/min的速度升温至β型氢溴酸伏硫西汀完全溶解(100℃),再以20℃/min的速度降温至50℃,保温3小时后再分别以5℃/min、20℃/min与25℃/min的速度降温至20℃,搅拌2h后析出固体,过滤,干燥,称重,测氢溴酸伏硫西汀晶型的熔点与25℃下水中的溶解度结果如表6所示。表6第二步降温速度对所得晶型的熔点、产率与溶解度的影响实施例1.7第二步降温的终温度对所得晶型的熔点、产率与溶解度的影响取3份β型氢溴酸伏硫西汀,每份1g,分别加入7ml纯化水,分别以20℃/min的速度升温至β型氢溴酸伏硫西汀完全溶解(100℃),再以20℃/min的速度降温至50℃,保温3小时后再以20℃/min的速度分别降温至15℃、20℃与25℃,搅拌2h后析出固体,过滤,干燥,称重,测氢溴酸伏硫西汀晶型的熔点与25℃下水中的溶解度结果如表7所示。表7第二步降温的终温度对所得晶型的熔点、产率与溶解度的影响实施例1.8搅拌时间对所得晶型的熔点、产率与溶解度的影响取3份β型氢溴酸伏硫西汀,每份1g,分别加入7ml纯化水,分别以20℃/min的速度升温至β型氢溴酸伏硫西汀完全溶解(100℃),再以20℃/min的速度降温至50℃,保温3小时后再以20℃/min的速度降温至20℃,分别搅拌1.5h、2h或2.5h后析出固体,过滤,干燥,称重,测氢溴酸伏硫西汀晶型的熔点与25℃下水中的溶解度结果如表8所示。表8搅拌时间对所得晶型的熔点、产率与溶解度的影响从表1~表8可以看出,各参数在各考察范围内,所得氢溴酸伏硫西汀晶型的产率、熔点与25℃下水中的溶解度效果良好。测试例1实施例1.1.2的氢溴酸伏硫西汀晶型的x射线衍射。结果如图1和表9所示。测试方法具体如下:cu靶(λ=0.154056nm)kα射线,室温下测试,管电压40kv,管电流40ma,扫描范围为2θ=5°~80°,扫描速度为0.02(°)/min。表9实施例1.1.2的氢溴酸伏硫西汀晶型xpd数据汇总测试例2溶解度测试:取β型氢溴酸伏硫西汀与本发明实施例1.1.2所述氢溴酸伏硫西汀新晶型各1g,向其中分别加入100ml蒸馏水,搅拌10min后,静置3小时,过滤未溶解的氢溴酸伏硫西汀,干燥至恒重后称重(计为wg),依下式计算溶解度(s):s(mg/ml)=(1-w)×10。重复测定三次,取其平均值,结果如表10所示。表10溶解度测定结果晶型溶解度(mg/ml)β型氢溴酸伏硫西汀1.56实施例1.1.28.59本发明各实施例制备得到的晶型熔点相似,溶解度相似(8~9mg/ml),因此,各实施例为同一晶型。测试例3大鼠口服生物利用度的测定结果健康雄性sd大鼠16只(体重220±15g),分为2组,每组8只,自由饮水,禁食12h后分别口服给予β型氢溴酸伏硫西汀与本发明实施例1.1.2所述的晶型,剂量均为20mg·kg-1),分别于给药后的15、30、60、120、180、240、360、480、720、1080与1440min眼眶取血0.3ml,3000×g离心10min,取上清液,-80℃冻存。采用hplc的外标法测定上清液中伏硫西汀的药物浓度,结果如表11所示。hplc条件如下所示:流动相:0.1%三氟乙酸水溶液—乙腈(52:48);固定相:lunaphenyl-hexyl,3μm(色谱柱品牌为:菲罗门);柱尺寸:150mm×4.6mm;检测波长:254nm;流速:0.6ml/min;进样量:10μl;柱温:40℃。表11两组大鼠的auc0→∞(mg·l-1·min)从表11可以看出,分别单次口服后,本发明所述的氢溴酸伏硫西汀新晶型在大鼠体内的auc0→∞(mg·l-1·min)显著高于β型氢溴酸伏硫西汀。上述详细说明是针对本发明其中之一可行实施例的具体说明,该实施例并非用以限制本发明的专利范围,凡未脱离本发明所为的等效实施或变更,均应包含于本发明技术方案的范围内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1