一种针对肿瘤细胞的自动化分离富集装置及方法与流程
本发明涉及细胞分选富集领域,具体涉及一种针对肿瘤细胞的自动化分离富集装置及方法。
背景技术:
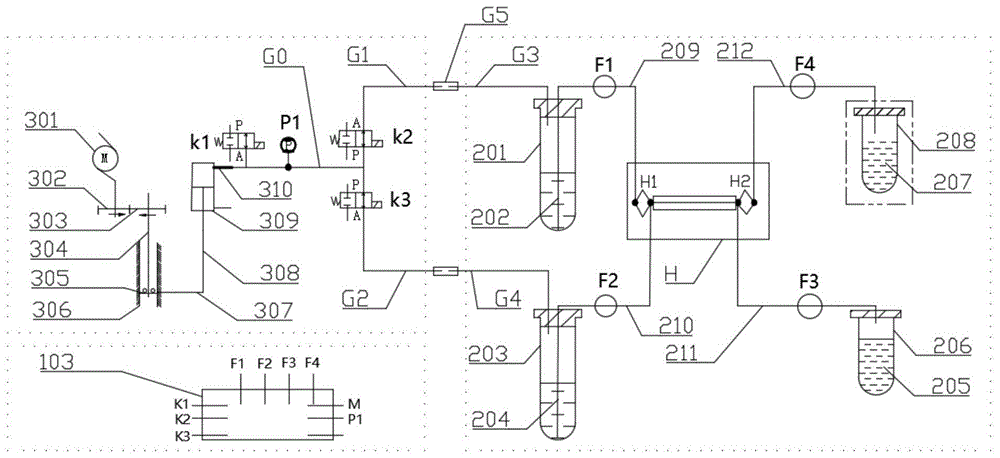
:循环肿瘤细胞(ctcs)是从肿瘤原发病灶或转移病灶进入外周血的肿瘤细胞,通过对ctcs的准确检测,可有效在体外进行早期诊断、对化疗药物进行快速评估、有助于对患者更好实现个体化治疗等。尤其是获取ctcs无损活细胞过程,其意义更是重大,通过对ctcs无损活细胞培养可以为ctcs的研究提供宝贵的复制样本。但由于肿瘤患者在外周血中ctcs数量稀少,研究表明平均在10^6~10^7个单核细胞中仅含有1个ctcs,再加上血液的复杂性,如何分离富集ctcs是一项非常复杂的技术。目前已有的技术有三种:密度梯度离心法、多微孔滤膜法、微流控芯片法。通过密度离心获得白膜层分离循环肿瘤细胞的方法中,白膜层细胞为单个核细胞,通过分离白膜层去除cd45阳性细胞的方法,虽然可以在一定程度上增大基于标记物分离方法的样本量,但是,这种方法仅可以用于分离核型较为正常的细胞,反而会损失细胞核异常的循环肿瘤细胞,这些细胞核异常的循环肿瘤细胞在很大程度上更能体现癌症的进展。膜过滤法,只能筛选特定粒径的细胞,对于大于或者小于该粒径的目标细胞容易造成漏检的情况,进而造成假阴性或者检测值比实际水平低的情况。基于标记物的分离方法,其中阳性筛选只能筛选特定的癌细胞类型,然而癌细胞的表达在很大程度上是未知的,这造成了目标细胞丢失,检测结果有效性偏低的问题;通过cd45负选的方法分离血液中cd45阳性细胞,这类细胞数量较大,利用这种方法对样本较多的细胞进行处理,容易出现分离效率不佳,残留较多白细胞;并且基于标记物的分离方法,在操作过程前需要裂解红细胞,在处理不得当的情况下,同时可能对目标细胞造成损伤。其中微流控芯片法是现有技术中较为常用的方法,此方法是利用流体力学方式对循环肿瘤细胞形态特征进行物理分离方式进行分离富集而已获得具有活性的目标细胞,但这种方法对整个分离富集系统要求较高。目前微流控芯片法还具有如下缺陷:1.分离和富集工序复杂,操作者参与度高,增加了中间环节出错的几率,从而对人员的专业技术要求较高;2.目标细胞回收率低,造成结果假阴性从而引起临床诊断的偏差;3.分离全血效率低,样本分离时间长,细胞经过较多的预处理,很大程度上造成细胞损伤并且失去活性。技术实现要素:针对现有技术的不足,本发明的目的旨在提供一种针对肿瘤细胞的自动化分离富集装置及方法。为实现上述目的,本发明采用如下技术方案:一种针对肿瘤细胞的自动化分离富集装置,包括动力单元、样本单元、缓冲液单元、芯片、富集液单元和废液单元,所述芯片的入口端连接所述缓冲液单元和样本单元,所述芯片的出口端连接所述富集液单元和废液单元,所述动力单元同时连接至所述样本单元和缓冲液单元;所述芯片为微流控芯片;所述样本单元包括样本管,所述样本管一端通过样本电磁阀连接动力单元,另一端通过第一管路连接至芯片入口端,所述第一管路上包括样本夹管阀;所述缓冲液单元包括缓冲液管,所述缓冲液管一端通过缓冲电磁阀连接动力单元,另一端通过第二管路连接至芯片入口端,所述第二管路上包括缓冲夹管阀;所述富集液单元包括富集液管,所述富集液管通过第四管路连接至芯片出口端,所述第四管路包括富集夹管阀;所述废液单元包括废液管,所述废液管通过第三管路连接至芯片出口端,所述第三管路包括废液夹管阀;所述缓冲电磁阀、样本夹管阀和缓冲夹管阀打开时,所述动力单元产生的压力迫使所述缓冲液管中的缓冲液进入样本管中;所述样本电磁阀、样本夹管阀、缓冲电磁阀、缓冲夹管阀、富集夹管阀和废液夹管阀打开时,所述动力单元产生的压力迫使所述样本管中的样本和缓冲液管中的缓冲液通过芯片分别进入富集液管和废液管中。进一步的,所述样本管的端口密封,所述样本管的端口分别连接样本气体输入管和第一管路,所述样本气体输入管通过样本气体输出管和样本电磁阀连接至所述动力单元的输出端;所述第一管路连接至所述芯片的入口端。进一步的,所述缓冲液管的端口密封,所述缓冲液管的端口分别连接缓冲气体输入管和第二管路,所述缓冲气体输入管通过缓冲气体输出管和缓冲电磁阀连接至所述动力单元的输出端;所述第二管路连接至所述芯片的入口端。进一步的,所述动力单元包括压力产生子单元和控制板,所述压力产生子单元的输出端口通过压力电磁阀连接至压力传感器,所述压力传感器连接至样本电磁阀和缓冲电磁阀;所述控制板同时连接压力电磁阀、样本电磁阀、缓冲电磁阀、样本夹管阀、缓冲夹管阀、富集夹管阀和废液夹管阀。进一步的,所述压力电磁阀、样本电磁阀和缓冲电磁阀均为两通电磁阀。进一步的,所述压力产生子单元包括传动机构和气缸,所述传动机构包括依次连接的步进电机、小齿轮、大齿轮、滚珠丝杆、滚珠轴承、导轨、滑动拨杆和活塞杆,所述步进电机的输出端通过小齿轮和大齿轮连接至滚珠丝杆的一端,所述滚珠丝杆的另一端通过所述滚动轴承连接至所述导轨,所述导轨通过滑动拨杆和活塞杆连接至所述气缸;所述步进电机转动,动力通过小齿轮、大齿轮、滚珠丝杠、滑动拨杆传输至活塞杆,所述活塞杆推动气缸产生压力。一种采用上述的自动化分离富集装置对肿瘤细胞进行分离富集的方法,包括如下步骤:s01:动力单元产生压力p2,富集夹管阀、废液夹管阀、样本电磁阀关闭,样本夹管阀、缓冲夹管阀和缓冲电磁阀打开;所述动力单元产生的压力p2使得缓冲液管中的缓冲液通过芯片进入样本管中,维持时间s1,使得样本管中样本被稀释;s02:动力装置产生压力p2保持不变,样本夹管阀和样本电磁阀关闭,缓冲电磁阀、缓冲夹管阀、富集夹管阀和废液夹管阀打开,所述动力单元产生的压力p2使得缓冲液管中的缓冲液分别通过第三管路和第四管路排出至富集液管和废液管中,维持时间s2,使得管路中气体排出并达到预润管路的目的;s03:富集夹管阀、废液夹管阀关闭,保留缓冲电磁阀和缓冲夹管阀打开,动力装置产生压力p2保持升为压力p3,维持时间s3,使得芯片中的气泡被完全去除;s04:动力装置产生压力p3保持不变,缓冲电磁阀、缓冲夹管阀、样本电磁阀、样本夹管阀、富集夹管阀和废液夹管阀打开;样本管中的样本和缓冲液管中的缓冲液在压力p3作用下进入芯片中进行分离富集,富集液进入所述富集液管中,废液进入所述废液管中;s05:样本跑完之后,对所述动力单元进行泄压。进一步的,所述步骤s01之间,将样本气体输入管和样本气体输出管通过钢针连接起来;将缓冲气体输入管和缓冲气体输出管通过钢针连接起来。进一步的,所述动力单元包括压力产生子单元和控制板,所述压力产生子单元的输出端口通过压力电磁阀连接至压力传感器,所述压力传感器连接至样本电磁阀和缓冲电磁阀;所述控制板用于控制压力电磁阀、样本电磁阀、缓冲电磁阀、样本夹管阀、缓冲夹管阀、富集夹管阀和废液夹管阀的开闭。进一步的,所述步骤s05具体包括:s051:样本跑完之后,关闭样本夹管阀、缓冲夹管阀、富集夹管阀和废液夹管阀,维持时间s4;s052:控制板控制压力电磁阀打开,对动力单元进行泄压;同时打开样本夹管阀、缓冲夹管阀、富集夹管阀和废液夹管阀。本发明的有益效果在于:本发明没有进行抗体标记,采用物理分选方法,通过抗体无标记的物理分选方法,利用仿生技术,配合精密传感器通过稳定可控的气相驱动力对液相的样本及缓冲液进行驱动,使样本能够匀速稳定的进入芯片,降低对细胞的损伤,能回收更多的目标细胞,保证循环肿瘤细胞在下游分析中的可靠性;本发明离5ml血液仅需20分钟,极大的保证了细胞的活性;本发明装置能够实现自动化操作,减少流程工序,且中途无需人工参与,降低了中间环节出现差错的几率,对人员的专业技术技能要求低,缩短了检测时间提高检测效率。附图说明附图1为本发明自动化分离富集装置的原理图;附图2为本发明自动化分离富集装置的正面示意图;附图3为本发明自动化分离富集装置的侧面剖视图;附图4为本发明自动化分离富集装置的的俯视图;附图5为实施例3中细胞观测结果示意图;附图6为实施例3中细胞培养生长曲线示意图;附图7为实施例5中细胞分离之后的观测图。附图标记:103控制板,200细胞过滤器,201样本管,202样本,203缓冲液管,204缓冲液,205富集液,206富集液管,207废液,208废液管,209第一管路,210第二管路,212第三管路,211第四管路,301步进电机,302小齿轮,303大齿轮,304滚珠丝杆,305滚珠轴承,306导轨,307滑动拨杆,308活塞杆,309气缸,401电源适配器接口,402电源开关,403开始按钮,404终止按钮,405按成按钮,406指示灯,407急停按钮,408细胞过滤器槽;g1样本气体输出管通,g2缓冲气体输出管,g3样本气体输入管,g4缓冲气体输入管,g5钢针,k1压力电磁阀,k2样本电磁阀,k3缓冲电磁阀,f1样本夹管阀,f2缓冲夹管阀,f4富集夹管阀,f3废液夹管阀,h芯片。具体实施方式下面,结合附图以及具体实施方式,对本发明做进一步描述:一种针对肿瘤细胞的自动化分离富集装置,包括动力单元、样本单元、缓冲液单元、芯片、富集液单元和废液单元,芯片h的入口端连接缓冲液单元和样本单元,芯片的出口端连接富集液单元和废液单元,动力单元同时连接至样本单元和缓冲液单元;本发明中芯片为微流控芯片。样本单元包括样本管201,样本管201一端通过样本电磁阀k2连接动力单元,另一端通过第一管路连接至芯片h入口端,第一管路中设置样本夹管阀f1;具体的,样本管201的端口密封,样本管的端口分别连接样本气体输入管g3和第一管路209,样本气体输入管通g3过样本气体输出管g1和样本电磁阀k2连接至动力单元的输出端;第一管路209通过样本夹管阀f1连接至芯片h的入口端。缓冲液单元包括缓冲液管203,缓冲液管203一端通过缓冲电磁阀k3连接动力单元,另一端通过缓冲夹管阀f2连接至芯片入口端;缓冲液管203的端口密封,缓冲液管203的端口分别连接缓冲气体输入管g4和第二管路210,缓冲气体输入管g4通过缓冲气体输出管g2和缓冲电磁阀k3连接至动力单元的输出端;第二管路210通过缓冲夹管阀f2连接至芯片的入口端。富集液单元包括富集液管206,富集液管206通过富集夹管阀f4连接至芯片出口端;废液单元包括废液管208,废液管208通过废液夹管阀f3连接至芯片出口端。动力单元包括压力产生子单元和控制板103,压力产生子单元的输出端口通过压力电磁阀k1连接至压力传感器p1,压力传感器p1连接至样本电磁阀k2和缓冲电磁阀k3;控制板103同时连接压力电磁阀k1、样本电磁阀k2、缓冲电磁阀k3、样本夹管阀f1、缓冲夹管阀f2、富集夹管阀f4和废液夹管阀f3。本发明中压力电磁阀、样本电磁阀和缓冲电磁阀均为常闭两通电磁阀;样本夹管阀、缓冲夹管阀、富集夹管阀和废液夹管阀均为常开夹管阀。压力产生子单元包括传动机构和气缸309,传动机构包括依次连接的步进电机301、小齿轮302、大齿轮303、滚珠丝杆304、滚珠轴承305、导轨306、滑动拨杆307和活塞杆308,步进电机301的输出端通过小齿轮302和大齿轮303连接至滚珠丝杆304的一端,滚珠丝杆304的另一端通过滚动轴承305连接至导轨306,导轨306通过滑动拨杆307和活塞杆308连接至气缸309;步进电机301转动,动力通过小齿轮302、大齿轮303、滚珠丝杠304、滑动拨杆307传输至活塞杆308,如附图所示,滑动拨杆307和活塞杆308为垂直连接结构,气缸309位于活塞杆的上方,最终活塞杆308将气缸向上推动使得气缸309产生一定压力的气体,压力的带下可以由压力传感器p1检测,同时压力传感器p1将检测数值反馈给主控板103,主控板再控制步进电机的进和退从而获得想要的气体压力。本发明中缓冲电磁阀、样本夹管阀和缓冲夹管阀打开时,动力单元产生的压力迫使缓冲液管中的缓冲液进入样本管中;样本电磁阀、样本夹管阀、缓冲电磁阀、缓冲夹管阀、富集夹管阀和废液夹管阀打开时,动力单元产生的压力迫使样本管中的样本和缓冲液管中的缓冲液通过芯片分别进入富集液管和废液管中。通过控制板对电磁阀和夹管阀的开闭控制,实现样本的稀释,管路的排气润湿以及样本跑样过程。本发明中样本气体输出管、缓冲气体输出管、样本气体输入管、缓冲气体输入管、第一管路、第二管路、第三管路、第四管路均为微流控管,可以但不限于为1/16英寸的软管,或者硬管或者软硬结合管,其管口口径可以根据具体需求进行设置。本发明中芯片为微流控分离富集芯片,其入口数何出口数的增减均适用于本发明。本发明形成的自动化分离富集装置如附图2-4所示,在该装置的顶端和侧边还包括电源适配器接口401、电源开关402、开始按钮403、终止按钮404、按成按钮405、指示灯406、急停按钮407和细胞过滤器槽408,其中,细胞过滤槽用于对样本进行过滤,其他按钮用于辅助设备使用。请继续参阅附图1-4,一种采用上述的自动化分离富集装置对肿瘤细胞进行分离富集的方法,包括如下步骤:s01:将样本气体输入管g3和样本气体输出管g1通过钢针g5连接起来;将缓冲气体输入管g4和缓冲气体输出管g2通过钢针连接起来。控制板103用于控制压力电磁阀、样本电磁阀、缓冲电磁阀、样本夹管阀、缓冲夹管阀、富集夹管阀和废液夹管阀的开闭。在对样本进行补液:动力单元产生压力p2,富集夹管阀f4、废液夹管阀f3、样本电磁阀k2关闭,样本夹管阀f1、缓冲夹管阀f2和缓冲电磁阀k3打开;动力单元产生的压力p2由缓冲气体输入管g2进入到缓冲液管203中,缓冲液受到压力p2的作用,沿着第二管路210进入到芯片h中,经过芯片后再沿着第一管路209进入到样本管201中,维持时间s1,使得样本管中样本被稀释。s02:预润排气:动力装置产生压力p2保持不变,控制板103控制样本夹管阀f1和样本电磁阀k2关闭,同时控制缓冲电磁阀k3、缓冲夹管阀f2、富集夹管阀f4和废液夹管阀f3打开,动力单元产生的压力p2使得缓冲液管203中的缓冲液分别通过第三管路212和第四管路211排出至富集液管208和废液管206中,维持时间s2,使得管路中气体排出并达到预润管路的目的;s03:保压排气:控制板103控制富集夹管阀f4、废液夹管阀f3关闭,保留缓冲电磁阀k3和缓冲夹管阀f2打开,动力装置产生压力p2保持升为压力p3,维持时间s3,使得芯片中的气泡被完全去除;注意:压力p3是大于压力p2的,本发明采用的是先较低压预润及排气,再高压跑液的方法。s04:上样:动力装置产生压力p3保持不变,控制板103控制样本电磁阀k2、缓冲电磁阀k3、样本夹管阀f1、缓冲夹管阀f2、富集夹管阀f4和废液夹管阀f3打开;样本管201中的样本在压力p3作用下进入芯片h中进行分离富集,同时缓冲液管203中的缓冲液在压力p3作用下进入芯片h中,两种液体经过芯片之后,富集液进入富集液管208中,废液进入废液管206中;压力p3保持不变直至样本跑完。s05:样本跑完之后,对动力单元进行泄压;具体包括:s051:样本跑完之后,关闭样本夹管阀、缓冲夹管阀、富集夹管阀和废液夹管阀,维持时间s4;s052:控制板控制压力电磁阀打开,对动力单元进行泄压;同时打开样本夹管阀、缓冲夹管阀、富集夹管阀和废液夹管阀。以下通过具体实施例对本发明装置和方法进行进一步解释说明:实施例1一种用于循环肿瘤细胞富集的自动化微流控系统的操作方法,该方法采用本发明附图1-4中设备,具体操作如下:s01:分别取下装置中的样本管和缓冲液管,向缓冲液管中加入2.3ml十倍浓度的细胞保存液,然后,向缓冲液加入去离子水至设定刻度处,混合均匀;s02:将待测样本或采血管放入样本管中,向样本管中补混合后的细胞保存液至5ml;s03:将缓冲液管和样本管放入装置对应位置,在废液管架处放入50ml离心管作为废液管,然后在富集液管槽放入1.5ml或者2ml的富集液管;s04:按下开始键,等待样本上样,待样本管中的样本跑完后,按下完成键,结束上样,收起富集液管。本步骤中上样过程包括补液、预润排气、保压排气以及上样的全过程。经500次以上次实验反复验证,使用本项发明装置分选的5ml样本全流程在20分钟以内即可完成,一键式操作,简单方便,未受过训练的专业人员也可进行操作。由此说明本项发明相比于其他循环肿瘤细胞分离方法具有省时省力,操作简便的优势。实施例2采用本发明附图1-4中的设备对不同类型的细胞系进行分离,并针对分离后的细胞系进行回收并计算细胞系的回收效率,具体方法如下:1)取培养在t25中的非小细胞肺癌细胞系h1299,弃培养基,加入5mlpbs洗2次,加入1ml胰酶,使胰酶均匀覆盖细胞表面,弃多余的胰酶,37摄氏度孵育3分钟,加入含10%fbs的培养基终止消化反应,用1ml移液器将细胞混合均匀,在镜下确认所有细胞均被分散成单个细胞。并取100μl细胞,使用细胞计数仪进行计数。2)根据细胞计数仪计算出的浓度,使用细胞保存液对h1299进行稀释,稀释浓度为5ml稀释液中含有100个h1299细胞,将稀释后的细胞加入至附图1-3设备的样本管中,并采用该设备进行分离。3)待分离结束,分别对废液管和富集液管中的细胞进行计数。4)按照上述1)、2)、3)步同时进行3组实验;计算平均数:5)经过本发明设备分离得到的细胞,在显微镜下计数。废液中细胞平均数2个,富集液中细胞数112个。同时用细胞保存液冲洗管路,未发现细胞。由此得到h1299富集率为98.25%。按照以上步骤,同时分别对常见癌症类型的细胞系进行分离富集,例如对结直肠癌细胞系ht29、宫颈癌细胞系hela、胃癌细胞系ags、肝癌细胞系hepg2、乳腺癌细胞系mda-mb-231进行分离富集;得到结果见表细胞类型富集液细胞数总细胞数管路细胞数回收率h1299112114098.25%ht29136138098.55%hela9295096.84%ags165173095.38%hepg2113118095.76%mda-mb-2316869098.55%由此结果可以看出,经过本专利富集的细胞系回收率高,并且不分癌症类型,是一款多种癌症通用分离系统。实施例3采用本发明附图1-4中的设备对细胞进行分离,并检测分离细胞的活性,具体方法如下:1)取培养在t25中的肺癌细胞系a549,弃培养基,加入5mlpbs洗2次,加入1ml胰酶,使胰酶均匀覆盖细胞表面,弃多余的胰酶,37摄氏度孵育3分钟,加入含10%fbs的培养基终止消化反应,用1ml移液器将细胞混合均匀,在镜下确认所有细胞均被分散成单个细胞。并取100μl细胞,按照1:1加入台盼蓝,使用细胞计数仪进行计数并计算细胞活率;经测量细胞的初始活率为96.81%。2)调整细胞浓度至1×106个/ml,将稀释后的细胞加入至附图1-3设备的样本管中,并采用该设备进行分离。3)取下富集液管,200×g离心5分钟,弃上清,向细胞中加入1ml含10%fbs的rpmi1640,混合均匀。取100μl细胞按照1:1加入台盼蓝,使用细胞计数仪计算细胞活率。本发明采用相同的初始细胞液,经过三次分离并测量细胞活性,分离后的细胞的活率分别为94.82%、95.83%和96.44%,也就是说三次平均测量活性为95.70%。可以看出,本发明装置中的微流控系统分离细胞前后细胞活性变化没有明显区别。4)其余900μl细胞移至t25中,并补含10%fbs的rpmi1640至3ml,细胞每2-3天换一次液,每次稀释后保证细胞密度在30%左右,于饱和湿度、37℃的二氧化碳培养箱中培养2周;培养过程中具体照片以及生产曲线如如图5和附图6所示,可以看出,在进行两周的培养实验中,本发明分离装置和方法对于细胞的生长并没有影响。实施例4采用本发明附图1-4中的设备对全血进行分离,并检测分离后全血的效率,具体方法如下:1)使用edta采血管,分别采取5个健康人的外周血各5ml,500×g5分钟离心,移除上层血浆,向血细胞中补加细胞保存液至5ml。将采血管放入至样本管中,然后按照实施例1操作进行分离;2)待分离完毕,收起富集液管,200×g离心5分钟,向样本中加入终浓度为5μg/ml的dapi,室温孵育20分钟进行细胞核染色。200×g离心5分钟,弃上清,加入100μlpbs洗两遍,用100μlpbs重悬,在nikonti2荧光显微镜下对细胞富集管内的细胞进行计数;3)在明场下计算总细胞数,然后在荧光场中计算dapi阳性的细胞数,结果如下:a:5号样本离体后,室温放置超过12小时。b:1-分离后总细胞数/(平离前血常规白细胞数平均值+分离前血常规红细胞数平均值)。由以上结果分析可得,使用微流控系统分离后的白细胞去除率大于99.9%,红细胞去除率约等于100%。实施例5采用本发明附图1-4中的设备对肿瘤病人全血进行分离,并观察离心后的富集液,具体方法如下:1)使用edta抗凝血采取肿瘤病人5ml×2,500×g5分钟离心,分别移除上层血浆,向血细胞中补加细胞保存液至5ml。将采血管放入至样本管中,然后按照实施例1操作进行分离;2)分别向个2个富集液管中加入100μl4%的多聚甲醛,室温固定10分钟。400×g离心5分钟,弃上清。向富集液管中加入100μl的洗涤液,混合均匀,400×g离心5分钟,弃上清。向第一份富集液中加入100μl破膜液,室温破膜10分钟,600×g离心5分钟,弃上清。向第一份富集液中加入300μl洗涤液,600×g离心5分钟,弃上清。3)向第一份富集液中使用免疫荧光抗体cd45-alexafluor488、panck-alexafluor594、dapi,室温孵育1小时;600×g离心5分钟,弃上清。用300μl洗涤液洗2次,600×g离心5分钟,弃上清,加入100μl重悬液,荧光显微镜下观察。向第二份管中加入cd45-alexafluor488、vimentin-alexafluor594、dapi,室温孵育1小时;400×g离心5分钟,弃上清;向细胞沉淀中加入100μl重悬液,荧光显微镜下观察;观察图如附图7所示。从附图7可以看出,使用本发明分离富集装置分离循环肿瘤细胞,可以分离出远大于单个细胞的循环中细胞簇(ctm),和白细胞大小差不多的细胞核异质性肿瘤细胞(双核),同时也可以分离出小于白细胞的肿瘤细胞。对本领域的技术人员来说,可根据以上描述的技术方案以及构思,做出其它各种相应的改变以及形变,而所有的这些改变以及形变都应该属于本发明权利要求的保护范围之内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1