一种通过氧化还原-脱羧偶联反应合成杂芳甲胺类化合物的方法与流程
s.-z. lai, z. luo, z.-y. tang, org. lett.2019, 21, 2269
–
2272; j. yang, j. zhang, l. qi, c. hu, y. chen, chem. commun.2015, 51, 5275
–
5278; j. m. smith, t. qin, r. r. merchant, j. t. edwards, l. r. malins, z. liu, g. che, z. shen, s. a. shaw, m. d. eastgate, p. s. baran, angew. chem. int. ed.2017, 56, 11906
–
11910; w. xue, m. oestreich, angew. chem. int. ed.2017, 56, 11649
–
11652; c. li, j. wang, l. m. barton, s. yu, m. tian, d. s. peters, m. kumar, a. w. yu, k. a. johnson, a. k. chatterjee, m. yan, p. s. baran, science.2017, 356, 1045
–
1053.)。对n-(杂芳基甲基)-芳胺衍生物的活泼位点进行基团修饰具有重要生物学意义,含五元杂环的芳胺衍生物n的α位与nhp酯的氧化还原-脱羧偶联反应尚未报导。因此,为含五元杂环的芳胺衍生物n的α位与氧化还原活性酯(nhp酯)的脱羧偶联反应提供一种绿色、简便的方法尤为重要。
[0005]
杂芳甲胺类化合物的结构式如下:其中,r1为氢、烃基、烃氧基或卤素;r2为烃基、烃氧基或卤素;r3为烃基或卤代烃基。
技术实现要素:
[0006]
本发明的目的是提供一种反应条件温和、绿色环保、操作方便并且适用于工业化生产的通过氧化还原-脱羧偶联反应合成杂芳甲胺类化合物的方法。
[0007]
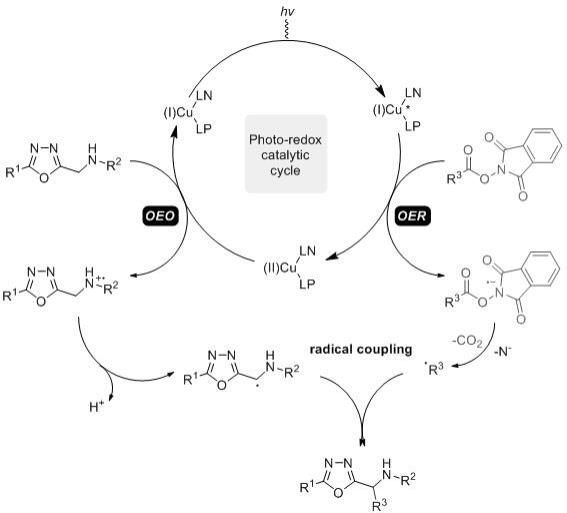
本发明通过氧化还原-脱羧偶联反应合成杂芳甲胺类化合物的方法,是在有机溶剂中,以n-(杂芳基甲基)-芳胺衍生物和nhp酯为原料,以铜盐的双配体络合物为催化剂,并加入碱类添加剂,在氩气保护下,于蓝光下室温反应12~24小时,待反应完全后减压蒸馏除去溶剂,柱层析分离,即得目标产物。
[0008]
所述n-(杂芳基甲基)-芳胺衍生物的结构式为:其中,r1为氢、烃基、烃氧基或卤素;r2为氢、烃基、烃氧基或卤素。
[0009]
所述nhp酯的结构式为:其中,r3为烃基或取代烃基。
[0010]
所述n-(杂芳基甲基)-芳胺衍生物和nhp酯的摩尔比为1:1.5~1:2。
[0011]
所述有机溶剂为乙腈、1,2-二氯乙烷,二氯甲烷、四氢呋喃、乙酸乙酯、n,n-二甲基
j = 8.5 hz, 2h), 4.53 (s, 1h), 4.18 (s, 1h), 2.18 (s, 3h), 2.05 (d, j = 12.7 hz, 1h), 2.01
ꢀ–ꢀ
1.94 (m, 1h), 1.81
ꢀ–ꢀ
1.61 (m, 4h), 1.28
ꢀ–ꢀ
1.22 (m, 2h), 1.21
ꢀ–ꢀ
1.14 (m, 3h).
13
c nmr (151 mhz, cdcl3) δ 167.1, 150.6, 144.6, 140.9, 129.8, 127.5, 124.7, 124.2, 119.9, 113.6, 110.6, 58.1, 42.7, 29.7, 29.6, 26.2, 26.0, 25.9, 20.3.实施例4:n-((1h-苯并[d]咪唑-2-基)(环己基)甲基)-4-甲基苯胺的合成在干燥的的10ml反应管中加入磁子,随后依次加入n-((1h-苯并[d]咪唑-2-基)甲基)-4-甲基苯胺(0.2mmol)和环己烷nhp酯(0.3mmol),乙酰丙酮铜 (10 mol%,0.02mmol),3,4,7,8-四甲基-1,10-菲咯啉(15 mol%,0.03mmol),(9,9-二甲基-9h-杂氧蒽-4,5-二基)双(二苯基膦)(15 mol%,0.03mmol)和三乙烯二胺 (0.4mmol ,2.0 equiv),然后抽出空气并用ar回充(3次)。加入乙腈(2ml),将反应管转移至蓝光反应器(6 w)并在其中照射12小时。减压蒸馏除去溶剂后进行柱层析分离(硅胶:200~300目,洗脱剂体积比为正己烷:乙酸乙酯=15:1)。减压蒸馏除去溶剂,得到白色固体产品,即为n-((1h-苯并[d]咪唑-2-基)(环己基)甲基)-4-甲基苯胺,产率为96%。
[0024]
该化合物的核磁数据如下:1h nmr (600 mhz, cdcl3) δ 7.86 (dd, j = 5.4, 3.1 hz, 1h), 7.75 (dd, j = 5.5, 3.0 hz, 1h), 7.54 (s, 1h), 7.23
ꢀ–ꢀ
7.19 (m, 2h), 6.91 (d, j = 8.4 hz, 2h), 6.51 (d, j = 8.4 hz, 2h), 4.51 (d, j = 4.8 hz, 1h), 4.11 (s, 1h), 2.18 (s, 3h), 2.12
ꢀ–ꢀ
2.06 (m, 1h), 1.74 (d, j = 11.7 hz, 4h), 1.65 (d, j = 12.9 hz, 1h), 1.30
ꢀ–ꢀ
1.23 (m, 3h), 1.18
ꢀ–ꢀ
1.08 (m, 2h).
13
c nmr (151 mhz, cdcl3) δ 156.2, 145.1, 134.2, 129.9, 128.0, 123.5, 122.3, 113.6, 59.7, 43.7, 29.9, 28.8, 26.1, 20.3.实施例5:n-(环己基(5-苯基恶唑-2-基)甲基)-4-甲基苯胺的合成在干燥的的10ml反应管中加入磁子,随后依次加入4-甲基-n-((5-苯基恶唑-2-基)甲基)苯胺 (0.2mmol) 和环己烷nhp酯(0.3mmol),乙酰丙酮铜 (10 mol%,0.02mmol),3,4,7,8-四甲基-1,10-菲咯啉(15 mol%,0.03mmol),(9,9-二甲基-9h-杂氧蒽-4,5-二基)双(二苯基膦)(15 mol%,0.03mmol)和三乙烯二胺 (0.4mmol ,2.0 equiv),然后抽出空气并用ar回充(3次)。加入乙腈(2ml),将反应管转移至蓝光反应器(6 w)并在其中照射12小时。减压蒸馏除去溶剂后进行柱层析分离(硅胶:200~300目,洗脱剂体积比为正己烷:乙酸乙酯=15:1)。减压蒸馏除去溶剂,得到白色固体产品,即为n-(环己基(5-苯基恶唑-2-基)甲基)-4-甲
基苯胺,产率为61%。
[0025]
该化合物的核磁数据如下:1h nmr (600 mhz, cdcl3) δ 7.58 (d, j = 7.2 hz, 2h), 7.39 (t, j = 7.7 hz, 2h), 7.30 (t, j = 7.4 hz, 1h), 7.22 (s, 1h), 6.95 (d, j = 8.0 hz, 2h), 6.62 (d, j = 8.5 hz, 2h), 4.44 (d, j = 7.0 hz, 1h), 2.19 (s, 3h), 2.02 (d, j = 13.0 hz, 1h), 1.96
ꢀ–ꢀ
1.89 (m, 1h), 1.82
ꢀ–ꢀ
1.72 (m, 2h), 1.66 (d, j = 12.8 hz, 1h), 1.56 (d, j = 12.8 hz, 1h), 1.30
ꢀ–ꢀ
1.22 (m, 2h), 1.20
ꢀ–ꢀ
1.13 (m, 3h).
13
c nmr (151 mhz, cdcl3) δ 164.6, 151.0, 144.8, 129.7, 128.8, 128.2, 128.1, 127.4, 124.1, 121.7, 113.7, 57.8, 42.7, 29.8, 29.5, 26.2, 26.0, 26.0, 20.4.实施例6:n-(环己基(5-苯基噻唑-2-基)甲基)-4-甲基苯胺的合成在干燥的的10ml反应管中加入磁子,随后依次加入n-((5-苯基噻唑-2-基)甲基)-4-甲基苯胺 (0.2mmol) 和环己烷nhp酯(0.3mmol),乙酰丙酮铜 (10 mol%,0.02mmol), 3,4,7,8-四甲基-1,10-菲咯啉(15 mol%,0.03mmol),(9,9-二甲基-9h-杂氧蒽-4,5-二基)双(二苯基膦)(15 mol%,0.03mmol)和三乙烯二胺 (0.4mmol ,2.0 equiv),然后抽出空气并用ar回充(3次)。加入乙腈(2ml),将反应管转移至蓝光反应器(6 w)并在其中照射12小时。减压蒸馏除去溶剂后进行柱层析分离(硅胶:200~300目,洗脱剂体积比为正己烷:乙酸乙酯=15:1)。减压蒸馏除去溶剂,得到白色固体产品,即为n-(环己基(5-苯基噻唑-2-基)甲基)-4-甲基苯胺,产率为56%。
[0026]
该化合物的核磁数据如下:1h nmr (600 mhz, cdcl3) δ 7.89 (s, 1h), 7.49 (d, j = 7.2 hz, 2h), 7.34 (t, j = 7.6 hz, 2h), 7.29
ꢀ–ꢀ
7.24 (m, 1h), 6.95 (d, j = 8.1 hz, 2h), 6.56 (d, j = 8.5 hz, 2h), 4.49 (d, j = 5.6 hz, 1h), 4.18 (s, 1h), 2.20 (s, 3h), 1.99
ꢀ–ꢀ
1.93 (m, 1h), 1.89 (d, j = 12.5 hz, 1h), 1.81
ꢀ–ꢀ
1.75 (m, 2h), 1.71
ꢀ–ꢀ
1.66 (m, 2h), 1.62 (s, 1h), 1.30
ꢀ–ꢀ
1.25 (m, 2h), 1.22
ꢀ–ꢀ
1.16 (m, 2h). 13
c nmr (151 mhz, cdcl3) δ 175.3, 144.9, 138.8, 137.9, 131.6, 129.7, 128.9, 127.9, 127.4, 126.5, 113.5, 62.2, 44.4, 30.0, 28.9, 26.3, 26.2, 26.16, 20.3.实施例7:n-(3,3-二甲基-1-(5-苯基-1,3,4-恶二唑-2-基)丁基)-4-甲基苯胺的合成在干燥的的10ml反应管中加入磁子,随后依次加入n-((5-苯基-1,3,4-恶二唑-2-基)甲基)-4-甲基苯胺 (0.2mmol) 和叔丁基甲基nhp酯(0.3mmol),乙酰丙酮铜 (10 mol%,0.02mmol), 3,4,7,8-四甲基-1,10-菲咯啉(15 mol%,0.03mmol),(9,9-二甲基-9h-杂氧
4,5-二基)双(二苯基膦)(15 mol%,0.03mmol)和三乙烯二胺(0.4mmol ,2.0 equiv),然后抽出空气并用ar回充(3次)。加入乙腈(2ml),将反应管转移至蓝光反应器(6 w)并在其中照射24小时。减压蒸馏除去溶剂后进行柱层析分离(硅胶:200~300目,洗脱剂体积比为正己烷:乙酸乙酯=15:1)。减压蒸馏除去溶剂,得到淡黄色固体产品,即为n-(5-溴-1-(5-苯基-1,3,4-恶二唑-2-基)戊基)-4-甲基苯胺,产率为30%。
[0029]
该化合物的核磁数据如下:1h nmr (600 mhz, cdcl3) δ 7.89 (d, j = 7.0 hz, 2h), 7.51
ꢀ–ꢀ
7.40 (m, 3h), 7.03 (d, j = 8.2 hz, 2h), 6.92 (d, j = 8.6 hz, 2h), 5.15 (t, j = 4.4 hz, 1h), 3.41
ꢀ–ꢀ
3.36 (m, 1h), 3.33
ꢀ–ꢀ
3.28 (m, 1h), 2.23 (s, 3h), 2.20
ꢀ–ꢀ
2.13 (m, 1h), 1.89
ꢀ–ꢀ
1.84 (m, 1h), 1.79
ꢀ–ꢀ
1.72 (m, 3h), 1.30
ꢀ–ꢀ
1.23 (m, 1h).
13
c nmr (151 mhz, cdcl3) δ 166.7, 164.4, 148.3, 131.5, 130.0, 129.6, 128.9, 126.8, 123.9, 117.9, 54.1, 46.8, 29.3, 25.4, 20.4, 20.3.实施例10:n-(1-(5-苯基-1,3,4-恶二唑-2-基)十六烷基)-4-甲基-苯胺的合成在干燥的的10ml反应管中加入磁子,随后依次加入n-((5-苯基-1,3,4-恶二唑-2-基)甲基)-4-甲基苯胺 (0.2mmol) 和十五烷基nhp酯(0.3mmol),乙酰丙酮铜 (10 mol%,0.02mmol),3,4,7,8-四甲基-1,10-菲咯啉(15 mol%,0.03mmol),(9,9-二甲基-9h-杂氧蒽-4,5-二基)双(二苯基膦)(15 mol%,0.03mmol)和三乙烯二胺 (0.4mmol ,2.0 equiv),然后抽出空气并用ar回充(3次)。加入乙腈(2ml),将反应管转移至蓝光反应器(6 w)并在其中照射20小时。减压蒸馏除去溶剂后进行柱层析分离(硅胶:200~300目,洗脱剂体积比为正己烷:乙酸乙酯=5:1)。减压蒸馏除去溶剂,得到白色固体产品,即为n-(1-(5-苯基-1,3,4-恶二唑-2-基)十六烷基)-4-甲基-苯胺,产率为55%。
[0030]
该化合物的核磁数据如下:1h nmr (600 mhz, cdcl3) δ 7.99 (d, j = 7.0 hz, 2h), 7.53
ꢀ–ꢀ
7.44 (m, 3h), 6.97 (d, j = 8.2 hz, 2h), 6.65 (d, j = 8.4 hz, 2h), 4.85
ꢀ–ꢀ
4.75 (m, 1h), 3.96 (d, j = 8.4 hz, 1h), 2.20 (s, 3h), 2.06
ꢀ–ꢀ
1.97 (m, 2h), 1.67
ꢀ–ꢀ
1.62 (m, 1h), 1.53
ꢀ–ꢀ
1.47 (m, 1h), 1.38
ꢀ–ꢀ
1.31 (m, 2h), 1.30
ꢀ–ꢀ
1.20 (m, 22h), 0.87 (t, j = 7.0 hz, 3h). 13
c nmr (151 mhz, cdcl3) δ 167.6, 164.8, 143.8, 131.6, 129.9, 128.9, 128.0, 126.9, 123.9, 113.8, 50.7, 34.5, 31.9, 29.7, 29.7, 29.6, 29.63, 29.61, 29.57, 29.5, 29.3, 29.2, 25.8, 22.7, 20.3, 14.1。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1