水稻SNP标记及其应用的制作方法
水稻snp标记及其应用
技术领域
1.本发明涉及snp标记及其应用。
背景技术:
2.稻花香2号是育种家田永太于2000年秋季从五优稻1号中选育而出。此品种成熟期晚,产量低,但经济效益高,2004年开始在五常市大面积种植,官方命名为“五优稻4号”,为五常大米的代表。稻花香2号不仅脱粒后香气袭人,而且稻子在田间生长时都能闻到叶片香和稻谷香。
3.五优稻4号品质好,营养丰富,蒸出来的米饭满堂飘香,饭粒晶莹如玉,素有“百年贡米”的美誉,在市场上深受广大消费者的青睐。但五优稻4号产量低,出米率低,价格较高。因此,市场上存在将粒型外观相近的其它稻米掺杂到五优稻4号稻米中进行销售的情形。因此,如何简单、准确而又快速地鉴定五优稻4号稻米纯度是大家一直关注的难题。
4.一般辨别五优稻4号水稻品种掺伪的检测方法是通过有经验的大米专家的肉眼外形观察与咀嚼品尝等经验判断,方法如下:首先,稻花香的外观很特殊,本身粒长,在出芽的一端的地方稍宽,100粒中至少有八成应该是这种形状;其次,从水稻来看,颜色不是很好看,有褐色斑点,不像其他水稻那么焦黄;三是,水稻表面皮质有些裂纹。但是这种方法主要依靠人的感官来判定,结果的准确度在很大程度上依赖于人员的知识水平和经验,容易出现误判。且通过外观和香味判断准确性较差,更难以实现五优稻4号掺伪的定量检测。再有粒型和成熟度有关,米的香味又受不同年份气候等外在环境因素影响,因此通过感官进行五优稻4号掺伪检测有一定的局限性。
5.对水稻品种的鉴定可以通过标准ny/t 1433-2014水稻品种鉴定技术规程ssr标记,或ny/t 2745-2015水稻品种鉴定snp标记法进行,但这两种鉴定方法不仅繁琐复杂,耗时长,而且也只能进行是否和原种一致的判断,无法进行掺伪的定量判断。
6.米业公司在收购五优稻4号稻谷时对品种鉴定有明确需求,希望能有简单容易操作、用时短的方法鉴定水稻品种,来确保收购的稻谷的确是高纯度的五优稻4号。本领域仍需定性、定量检测五优稻4号稻米掺伪的试剂和方法。
技术实现要素:
7.本发明提出了一种与五优稻4号品种相关、能够有效用于水稻品种检测的snp标记,利用该snp标记设计高效灵敏的五优稻4号水稻特异性引物和探针,对样本dna进行检测,从而实现对五优稻4号水稻品种纯度进行定量判断,有效地解决了五优稻4号水稻品种中掺入其它水稻品种的定量鉴别的难题。
8.具体而言,本发明提供一种分离的来自水稻细长杆基因(spindly gene)的核酸分子,其含有第一snp标记和任选的第二snp标记,其中第一snp标记位于水稻基因组第8号染色体第27996894位,为t或c,第二snp标记位于水稻基因组第8号染色体第27996914位,为a或g。
9.在一个或多个实施方案中,所述核酸分子是水稻细长杆基因的长度至少5bp的片段。在一个或多个实施方案中,所述核酸分子长度至少10bp、15bp、20bp、30bp、40bp、50bp、60bp、70bp、80bp、90bp、100bp、200bp、300bp、400bp、500bp、600bp、700bp、800bp、900bp、1kb。在一个或多个实施方案中,所述核酸分子长度为10bp-600bp、50-500bp,100-400bp,150-300bp或200-250bp。
10.在一个或多个实施方案中,所述核酸分子的核苷酸序列至少包括seq id no:1所示的核苷酸序列,或至少包括seq id no:8或10所示的核苷酸序列,或至少包括seq id no:9或11所示的核苷酸序列。
11.在一个或多个实施方案中,所述核酸分子的核苷酸序列包括seq id no:12。
12.在一个或多个实施方案中,所述第一snp标记为:以水稻基因组dna为模板,采用seq id no:4和3作为引物进行pcr扩增得到的扩增产物的自5’末端起第100位核苷酸,其为t或c,或以水稻基因组dna为模板,采用seq id no:2和3作为引物进行pcr扩增得到的扩增产物的自5’末端起第23位核苷酸,其为t或c;所述第二snp标记为:以水稻基因组dna为模板,采用seq id no:4和3作为引物进行pcr扩增得到的扩增产物的自5’末端起第120位核苷酸,其为a或g,或以水稻基因组dna为模板,采用seq id no:2和3作为引物进行pcr扩增得到的扩增产物的自5’末端起第43位核苷酸,其为a或g。
13.本发明还提供用于检测水稻基因组中的第一snp标记和任选的第二snp标记的引物,其中,第一snp标记位于水稻基因组第8号染色体第27996894位,其为t或c,第二snp标记位于水稻基因组第8号染色体第27996914位,其为a或g。
14.在一个或多个实施方案中,所述第一snp标记为:以水稻基因组dna为模板,采用seq id no:4和3作为引物进行pcr扩增得到的扩增产物的自5’末端起第100位核苷酸,其为t或c,或以水稻基因组dna为模板,采用seq id no:2和3作为引物进行pcr扩增得到的扩增产物的自5’末端起第23位核苷酸,其为t或c;所述第二snp标记为:以水稻基因组dna为模板,采用seq id no:4和3作为引物进行pcr扩增得到的扩增产物的自5’末端起第120位核苷酸,其为a或g,或以水稻基因组dna为模板,采用seq id no:2和3作为引物进行pcr扩增得到的扩增产物的自5’末端起第43位核苷酸,其为a或g。
15.在一个或多个实施方案中,所述引物选自:(1)seq id no:2和3所示的序列或在严谨条件下与seq id no:8或10杂交的序列或与其有至少90%相同性的序列;(2)seq id no:4和3所示的序列或在严谨条件下与seq id no:9或11杂交的序列或与其有至少90%相同性的序列;和(3)(1)和(2)所述序列的混合物。
16.本发明还提供用于检测水稻基因组第一snp标记和任选的第二snp标记的探针,其中,其中第一snp标记位于水稻基因组第8号染色体第27996894位,其为t或c,第二snp标记位于水稻基因组第8号染色体第27996914位,其为a或g。
17.在一个或多个实施方案中,所述第一snp标记为:以水稻基因组dna为模板,采用seq id no:4和3作为引物进行pcr扩增得到的扩增产物的自5’末端起第100位核苷酸,其为t或c,或以水稻基因组dna为模板,采用seq id no:2和3作为引物进行pcr扩增得到的扩增产物的自5’末端起第23位核苷酸,其为t或c;所述第二snp标记为:以水稻基因组dna为模板,采用seq id no:4和3作为引物进行pcr扩增得到的扩增产物的自5’末端起第120位核苷酸,其为a或g,或以水稻基因组dna为模板,采用seq id no:2和3作为引物进行pcr扩增得到
的扩增产物的自5’末端起第43位核苷酸,其为a或g。
18.在一个或多个实施方案中,探针包括(1)识别seq id no:8或9或其片段的五优稻4号探针,所述片段包含seq id no:8自5’端起第23位碱基,或包含seq id no:9自5’端起第100位碱基,和任选的(2)识别seq id no:8或9或其片段的五优稻4号探针,所述片段包含seq id no:8自5’端起第43位碱基,或包含seq id no:9自5’端起第130位碱基。
19.在一个或多个实施方案中,探针还包括(3)识别seq id no:10或11或其片段的非五优稻4号探针,所述片段包含seq id no:10自5’端起第23位碱基,或包含seq id no:11自5’端起第100位碱基,和任选的(4)识别seq id no:10或11或其片段的非五优稻4号探针,所述片段包含seq id no:10自5’端起第43位碱基,或包含seq id no:11自5’端起第120位碱基。
20.在一个或多个实施方案中,探针识别seq id no:9或11或其片段,所述片段包含seq id no:9或11自5’端起第100位碱基和任选的第120位碱基。示例性地,探针包括以下的一种或多种:(1)识别seq id no:9或其片段的探针,所述片段包含seq id no:9自5’端起第100位碱基,所述碱基是t,(2)识别seq id no:11或其片段的探针,所述片段包含seq id no:11自5’端起第100位碱基,所述碱基是c,(3)(1)或(2)的互补序列。任选地,探针还包括以下的一种或多种:(1)识别seq id no:9或其片段的探针,所述片段包含seq id no:9自5’端起第120位碱基,所述碱基是a,(2)识别seq id no:11或其的片段的探针,所述片段包含seq id no:11自5’端起第120位碱基,所述碱基是a或g,(3)(1)或(2)的互补序列。优选地,所述探针具有(1)seq id no:5或6所示的核苷酸序列或在高度严谨条件下与seq id no:8-11中任一杂交的序列或与之具有70%序列相同性的突变体,或(2)(1)的互补序列。
21.优选地,检测第二snp标记的探针增强hrm检测方法的分型特异性。
22.本发明还提供一种试剂盒,其含有用于检测水稻基因组中的第一snp标记的试剂,其中,第一snp标记位于水稻基因组第8号染色体第27996894位,其为t或c。
23.在一个或多个实施方案中,所述第一snp标记为:以水稻基因组dna为模板,采用seq id no:4和3作为引物进行pcr扩增得到的扩增产物的自5’末端起第100位核苷酸,其为t或c,或以水稻基因组dna为模板,采用seq id no:2和3作为引物进行pcr扩增得到的扩增产物的自5’末端起第23位核苷酸,其为t或c。
24.在一个或多个实施方案中,所述试剂盒包含检测第一snp标记的引物和任选的检测第一snp标记的探针和任选的具有第一snp标记的核酸分子。
25.在一个或多个实施方案中,所述试剂盒还含有检测水稻基因组中的第二snp标记的试剂,其中第二snp标记位于水稻基因组第8号染色体第27996914位,其为a或g。
26.在一个或多个实施方案中,所述第二snp标记为:以水稻基因组dna为模板,采用seq id no:4和3作为引物进行pcr扩增得到的扩增产物的自5’末端起第120位核苷酸,其为a或g,或以水稻基因组dna为模板,采用seq id no:2和3作为引物进行pcr扩增得到的扩增产物的自5’末端起第43位核苷酸,其为a或g。
27.在一个或多个实施方案中,所述试剂盒包含检测第二snp标记的引物和任选的检测第二snp标记的探针和任选的具有第二snp标记的核酸分子。
28.在一个或多个实施方案中,所述试剂盒包含:本文任一实施方案所述的引物,任选的本文任一实施方案所述的探针和任选的本文任一实施方案所述的核酸分子。
29.在一个或多个实施方案中,所述试剂盒包含:seq id no:2和3所示的序列或在严谨条件下与seq id no:8或10杂交的序列或与之具有至少90%相同性的序列或其互补序列,和任选的核酸分子,所述核酸分子的核苷酸序列至少包括seq id no:1所示的核苷酸序列或其互补序列,或至少包括seq id no:8或10所示的核苷酸序列或其互补序列,或至少包括seq id no:9或11所示的核苷酸序列或其互补序列。
30.在一个或多个实施方案中,所述试剂盒还包含:seq id no:4和3所示的序列或在严谨条件下与seq id no:9或11杂交的序列或与之有至少90%相同性的序列或其互补序列,和任选的seq id no:5或6所示的核苷酸序列或在严谨条件下与seq id no:8-11中任一杂交的序列或与之具有70%序列相同性的突变体或其互补序列。
31.本发明还提供鉴别水稻品种的方法,包括(1)检测水稻基因组中的第一snp标记和任选的第二snp标记,其中,第一snp标记和第二snp标记位于水稻基因组第8号染色体,其中第一snp标记位于第8号染色体第27996894位,第二snp标记位于第8号染色体第27996914位,(2)根据所述第一snp和任选的第二snp鉴定水稻品种,其中,第一snp为tt则鉴定为五优稻4号,否则鉴定为非五优稻4号,任选地,第二snp为aa则鉴定为非五优稻4号水稻组i、第二snp为gg则鉴定为非五优稻4号水稻组ii。。
32.在一个或多个实施方案中,所述第一snp标记为:以水稻基因组dna为模板,采用seq id no:2和3作为引物进行pcr扩增得到的扩增产物的自5’末端起第23位核苷酸,其为t或c,或以水稻基因组dna为模板,采用seq id no:4和3作为引物进行pcr扩增得到的扩增产物的自5’末端起第100位核苷酸,其为t或c;所述第二snp标记为:以水稻基因组dna为模板,采用seq id no:4和3作为引物进行pcr扩增得到的扩增产物的自5’末端起第120位核苷酸,其为a或g,或以水稻基因组dna为模板,采用seq id no:2和3作为引物进行pcr扩增得到的扩增产物的自5’末端起第43位核苷酸,其为a或g。
33.在一个或多个实施方案中,所述方法还包括根据检测到的第一snp鉴别水稻品种,其中,五优稻4号的第一snp为tt,非五优稻4号的第一snp为cc。
34.在一个或多个实施方案中,所述方法还包括根据检测到的第二snp鉴别水稻品种,其中非五优稻4号水稻组i的第二snp为aa、非五优稻4号水稻组ii的第二snp为gg。
35.在一个或多个实施方案中,所述方法还包括根据检测到的第一snp和第二snp鉴别水稻品种,其中五优稻4号的第一snp为tt,非五优稻4号的第一snp为cc,非五优稻4号水稻组i的第二snp为aa、非五优稻4号水稻组ii的第二snp为gg。
36.在一个或多个实施方案中,所述检测包含pcr,更优选地,所述检测是荧光定量pcr或hrm检测。
37.本发明还提供检测样品中五优稻4号含量或纯度的方法,所述方法包括扩增该水稻基因组中第一snp标记和任选的第二snp标记的序列的步骤,其中,第一snp标记和第二snp标记位于水稻基因组第8号染色体,其中第一snp标记位于第8号染色体第27996894位,其为t或c,第二snp标记位于第8号染色体第27996914位,其为a或g。
38.在一个或多个实施方案中,所述第一snp标记为:以水稻基因组dna为模板,采用seq id no:4和3作为引物进行pcr扩增得到的扩增产物的自5’末端起第100位核苷酸,其为t,或以水稻基因组dna为模板,采用seq id no:2和3作为引物进行pcr扩增得到的扩增产物的自5’末端起第23位核苷酸,其为t;所述第二snp标记为:以水稻基因组dna为模板,采用
seq id no:4和3作为引物进行pcr扩增得到的扩增产物的自5’末端起第120位核苷酸,其为a或g,或以水稻基因组dna为模板,采用seq id no:2和3作为引物进行pcr扩增得到的扩增产物的自5’末端起第43位核苷酸,其为a。
39.在一个或多个实施方案中,所述方法还包括根据第一snp标记和任选的第二snp标记的扩增结果确定五优稻4号含量或纯度。其中,第一snp为tt的扩增结果指示五优稻4号的含量或纯度;第一snp为cc的扩增结果指示非五优稻4号的含量或比例。任选地,五优稻4号的第二snp不包含g。任选地,第二snp为aa指示非五优稻4号水稻组i、gg指示非五优稻4号水稻组ii的含量或纯度。
40.在一个或多个实施方案中,所述扩增是荧光定量pcr,所述方法还包括根据扩增结果利用2-δδct
方法确定五优稻4号的含量或纯度。
41.更优选地,所述2-δδct
方法包括:比较样品中识别第一snp标记和任选第二snp标记的探针的ct值与内源参照探针的ct值,并将比较结果与对照的δct相比,利用得到的δδct确定五优稻4号的含量或纯度。
42.具体地,检测样品中五优稻4号含量或纯度的方法包括:荧光定量pcr检测识别第一snp标记和任选第二snp标记的探针的ct值和识别内源参照的探针的ct值,二者相减后得到样品δct,将样品δct与对照的δct相减得到δδct,所述对照是100%五优稻4号或100%非五优稻4号样品,和对δδct的负数进行2次方得到相对含量数值,用于样品中五优稻4号和非五优稻4号的定量判断。在一个或多个实施方案中,识别第一snp标记和任选第二snp标记的探针具有seq id no:5或6所示的核苷酸序列。在一个或多个实施方案中,识别内源参照的探针具有seq id no:7所示的核苷酸序列。
43.本发明还提供检测水稻基因组中的第一snp标记的试剂和任选的检测水稻基因组中的第二snp标记的试剂在鉴别水稻品种或检测水稻中五优稻4号含量或纯度中的用途,或在制备用于鉴别水稻品种或检测水稻中五优稻4号含量或纯度的试剂盒中的用途,其中,所述第一snp标记位于水稻基因组第8号染色体第27996894位,为t或c,所述第二snp标记位于水稻基因组第8号染色体第27996914位,为a或g。
44.在一个或多个实施方案中,所述水稻基因组第一snp标记为:以水稻基因组dna为模板,采用seq id no:4和3作为引物进行pcr扩增得到的扩增产物的自5’末端起第100位核苷酸,其为t或c,或以水稻基因组dna为模板,采用seq id no:2和3作为引物进行pcr扩增得到的扩增产物的自5’末端起第23位核苷酸,其为t或c,所述第二snp标记为:以水稻基因组dna为模板,采用seq id no:4和3作为引物进行pcr扩增得到的扩增产物的自5’末端起第120位核苷酸,其为a或g,或以水稻基因组dna为模板,采用seq id no:2和3作为引物进行pcr扩增得到的扩增产物的自5’末端起第43位核苷酸,其为a或g。
45.在一个或多个实施方案中,所述试剂包含本文任一实施方案所述的引物和任选的本文任一实施方案所述的探针和任选的本文任一实施方案所述的核酸分子。
46.在一个或多个实施方案中,根据检测到的第一snp鉴别水稻品种,其中,五优稻4号的第一snp为tt,非五优稻4号的第一snp为cc。
47.在一个或多个实施方案中,根据检测到的第二snp鉴别水稻品种,其中非五优稻4号水稻组i的第二snp为aa、非五优稻4号水稻组ii的第二snp为gg。
48.在一个或多个实施方案中,根据检测到的第一snp和第二snp鉴别水稻品种,其中
五优稻4号的第一snp为tt、第二snp为aa,非五优稻4号的第一snp为cc,非五优稻4号水稻组i的第二snp为aa、非五优稻4号水稻组ii的第二snp为gg。
附图说明
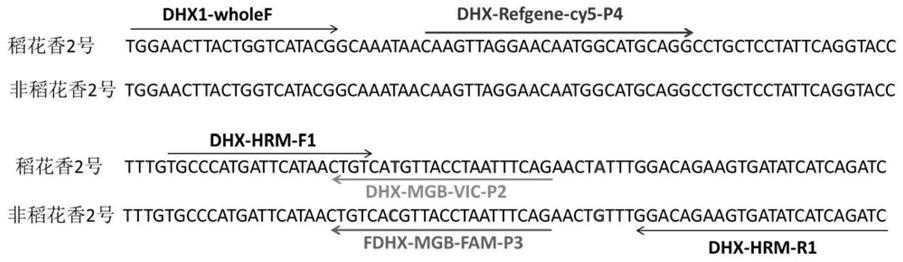
49.图1:五优稻4号和非五优稻4号hrm检测与荧光探针法检测引物探针位置图。
50.图2:五优稻4号和其它非五优稻4号水稻品种hrm分型图。
51.图3:五优稻4号和非五优稻4号不同含量标样定量数据图。a图从左到右依次为:0%非五优稻4号标样,5%非五优稻4号标样,10%非五优稻4号标样,20%非五优稻4号标样;50%非五优稻4号标样,80%非五优稻4号标样,90%非五优稻4号标样,95%非五优稻4号标样,100%非五优稻4号标样。b图从左到右依次为:100%五优稻4号标样,95%五优稻4号标样,90%五优稻4号标样,80%五优稻4号标样;50%五优稻4号标样,20%五优稻4号标样,10%五优稻4号标样,5%五优稻4号标样,0%五优稻4号标样。
52.图4:五优稻4号盲样纯度检测。从左到右依次为:0%非五优稻4号标样,5%非五优稻4号标样,50%非五优稻4号标样,95%非五优稻4号标样,100%非五优稻4号标样,米样1,米样2,米样3。
具体实施方式
53.发明人通过对五优稻4号水稻品种的ssr高通量测序,比对出五优稻4号区别与其它水稻品种的特异序列,通过五优稻4号与其它水稻品种特异位点核酸序列的特异性检测,来判断五优稻4号水稻中是否掺入其它水稻,并引入内源参照基因与参照样本进行五优稻4号稻米掺伪的定量分析。
54.具体地,本发明涉及与水稻品种相关的snp标记,用于检测所述snp标记的引物和试剂盒,所述snp标记、引物、试剂盒在水稻品种检测中的用途,以及检测水稻品种的方法。
55.发明人发现第8号染色体第27996894位的snp1和第27996914位的snp2与水稻品种相关。具体地,snp1是seq id no:1所示核苷酸序列自5’端起第23位碱基t或c;snp2是seq id no:1所示核苷酸序列自5’端起第43位碱基a或g。seq id no:1所示核苷酸序列如下:
56.tgcccatgattcataactgtcaygttacctaatttcagaactrtttggacagaagtgatatcatcagatc(seq id no:1)。
57.本文中,snp(single nucleotide polymorphism,snp,即单核苷酸多态性)是一类分子遗传标记,主要是指基因组水平上由单个核苷酸的变异所引起的dna序列多态性。snp表现出的多态性通常仅涉及到单个碱基的变异,例如转换、颠换、插入和缺失等。
58.本文中,水稻品种指经选育而具有不同性状的水稻品系。本文中,五优稻4号又名稻花香2号。发明人发现,五优稻4号的snp1为纯合tt,非五优稻4号的snp1为纯合cc;五优稻4号的snp2为纯合aa,非五优稻4号的snp2为纯合gg、aa。因此,通过检测样品中的上述snp1或snp1和snp2,能够有效地确定水稻品种是五优稻4号还是非五优稻4号。
59.本文所述“样品”是来自对象的任意类型的含多核苷酸的样品。优选地,本文所述样品来自或包含水稻植物器官、组织、细胞、核酸或包含水稻植物器官、组织、细胞、核酸的产品,包括但不限于水稻叶片、根、茎、花、果实、种子、细胞、dna、rna、大米、碎米、米糠、稻壳、加工或未加工的大米食物例如米粉、米线。dna可以是基因组dna。
60.术语“核酸”或“多核苷酸”指单链或双链形式的脱氧核糖核苷酸(dna)或核糖核苷酸聚合物(rna),及其互补物。核酸含有合成的、非天然的或改变的核苷酸碱基。核苷酸可以是核糖核苷酸、脱氧核糖核苷酸、或其修饰形式。本文考虑的多核苷酸的示例包括单链和双链dna,单链和双链rna,以及具有单链和双链dna和rna的混合物的杂合分子。dna可以是编码链或非编码链。在一个或多个实施方案中,所述样品包含经片段化的基因组dna。获取基因组dna并片段化的方法本领域周知。
61.dna基本组成单位是脱氧核糖核苷酸,经磷酸二酯键缩合而成长链状分子。每个脱氧核糖核苷酸由磷酸、脱氧核糖和碱基组成。dna的碱基(bp)主要有腺嘌呤(a)、鸟嘌呤(g)、胞嘧啶(c)和胸腺嘧啶(t)。在双链dna的双螺旋结构中,a与t经氢键配对,g与c经氢键配对。dna形式包括cdna、基因组dna、片段化dna或人工合成的dna。dna可以是单链的或是双链的。dna可以为任意长度,例如50-500bp,100-400bp,150-300bp或200-250bp。
62.本文所述“引物”是指在核苷酸聚合作用起始时,引导合成的一种具有特定核苷酸序列的核酸分子。引物组合物包含一种或多种引物。引物通常是人工合成的两段寡核苷酸序列,一个引物与靶区域一端的一条dna模板链互补,另一个引物与靶区域另一端的另一条dna模板链互补,其功能是作为核苷酸聚合作用的起始点。体外人工设计的引物被广泛用于聚合酶链反应(pcr)、qpcr、测序和探针合成等。引物可以为任意长度,例如5-200bp,10-100bp,20-800bp或25-50bp。
63.本发明引物用于检测snp。所述引物可以是识别seq id no:8-11中任一的核酸分子。在一些实施方式中,引物具有(1)seq id no:2-4中任一项所示的核苷酸序列或与之具有至少70%序列相同性的突变体,或(2)(1)的互补序列。在一个或多个实施方案中,引物是引物对,引物对分别具有seq id no:2和3所示序列或seq id no:3和4所示序列。在讨论引物时,本文所述“识别”指引物与模板序列在严谨或高度严谨条件下杂交,并且成对引物所扩增的片段涵盖seq id no:8或10自5’端起第23位碱基和/或第43位碱基,或涵盖seq id no:9或11自5’端起第100位碱基和/或第120位碱基。本文所述核酸杂交的严谨条件本领域技术人员已知。优选地,所述条件是使得序列彼此至少约65%、70%、75%、85%、90%、95%、98%或99%同源,通常保持彼此杂交。严谨杂交条件的非限制性实例是在含有6xssc、50mm tris-hcl(ph7.5)、1m medta、0.02%pvp、0.02%ficolll、0.02%bsa和500mg/ml变性鲑鱼精子dna的高盐缓冲剂中在65℃杂交,和任选的在0.2xssc、0.01%bsa中50℃洗涤一次或两次。
64.本发明也可采用探针来检测本发明所述的snp。本文所述“探针”是识别目的序列(与目的序列互补)的核酸序列(dna或rna)。探针通过分子杂交与目的基因结合,产生杂交信号,从而显示目的基因。探针可以包括整个目的序列,也可以是目的序列的片段。探针可以是dna,也可以是由之转录而来的rna。通常,探针带有检测标记,例如荧光标记。所述荧光标记包括但不限于fam、cy5和vic。本领域知晓适用于本文探针的荧光标记以及将其与探针连接的方法。
65.本文中,探针包括识别seq id no:8或9或其片段的五优稻4号探针,所述片段包含seq id no:8自5’端起第23位碱基,任选包含第43位碱基,或包含seq id no:9自5’端起第100位碱基,任选地包含第120位碱基。任选地,探针还可包括识别seq id no:10或11或其片段的非五优稻4号探针,所述片段包含seq id no:10自5’端起第23位碱基,任选包含第43位
碱基,或包含seq id no:11自5’端起第100位碱基,任选地包含第120位碱基。
66.在一个或多个实施方案中,探针包括(1)识别seq id no:8或9或其片段的五优稻4号探针,所述片段包含seq id no:8自5’端起第23位碱基,或包含seq id no:9自5’端起第100位碱基,和任选的(2)识别seq id no:8或9或其片段的五优稻4号探针,所述片段包含seq id no:8自5’端起第43位碱基,或包含seq id no:9自5’端起第130位碱基。探针还可包括(3)识别seq id no:10或11或其片段的非五优稻4号探针,所述片段包含seq id no:10自5’端起第23位碱基,或包含seq id no:11自5’端起第100位碱基,和任选的(4)识别seq id no:10或11或其片段的非五优稻4号探针,所述片段包含seq id no:10自5’端起第43位碱基,或包含seq id no:11自5’端起第120位碱基。
67.示例性地,探针包括选自以下的一种或多种:(1)识别seq id no:9或其片段的探针,所述片段包含seq id no:9自5’端起第100位碱基,所述碱基是t,(2)识别seq id no:11或其片段的探针,所述片段包含seq id no:11自5’端起第100位碱基,所述碱基是c,(3)(1)或(2)的互补序列。在另一实施方式中,探针还包括以下的一种或多种:(1)识别seq id no:9或其片段的探针,所述片段包含seq id no:9自5’端起第120位碱基,所述碱基是a,(2)识别seq id no:11或其的片段的探针,所述片段包含seq id no:11自5’端起第120位碱基,所述碱基是a或g,(3)(1)或(2)的互补序列。优选地,所述探针具有(1)seq id no:5或6所示的核苷酸序列或与之具有70%序列相同性的突变体,或(2)(1)的互补序列。在讨论探针时,本文所述“识别”指探针与模板序列在严谨或高度严谨条件下杂交,并且所述杂交涵盖seq id no:8或10自5’端起第23位碱基和/或第43位碱基,或涵盖seq id no:9或11自5’端起第100位碱基和/或第120位碱基。
68.本文术语“变体”或“突变体”是指与参照序列相比,通过一个或多个核苷酸的插入、缺失或取代使核酸序列发生变化同时保留其与其他核酸杂交能力的多核苷酸。本文任一实施方案所述的突变体包括与参照序列(如本文所述的seq id no:1-12)具有至少70%,优选至少80%,优选至少85%,优选至少90%,优选至少95%,优选至少97%的序列相同性并保留参照序列的生物学活性的核苷酸序列。可采用例如ncbi的blastn计算两条比对的序列之间的序列相同性。突变体还包括在参照序列的和核苷酸序列中具有一个或多个突变(插入、缺失或取代)、同时仍保留参照序列生物学活性的核苷酸序列。所述多个突变通常指1-10个以内,例如1-8个、1-5个或1-3个。取代可以是嘌呤核苷酸与嘧啶核苷酸之间的取代,也可以是嘌呤核苷酸之间或嘧啶核苷酸之间的取代。取代优选是保守性取代。例如,在本领域中,用性能相近或相似的核苷酸进行保守性取代时,通常不会改变多核苷酸的稳定性和功能。保守性取代例如嘌呤核苷酸之间的(a与g)的互换,嘧啶核苷酸之间的(t或u与c)的互换。因此,在本发明多核苷酸中用来自同一残基替换一个或几个位点,将不会在实质上影响其活性。当提及与本发明所述的引物(如seq id no:2-4)或探针(如seq id no:5-7)具有至少75%、至少80%、至少85%、至少90%、至少95%、至少97%序列相同性的突变体时,优选地,这些突变体在高严谨条件下可与包含seq id no:8、9、10或11的相对应的dna序列杂交。所述高严谨条件可为在0.1
×
sspe(或0.1
×
ssc),0.1%sds的溶液中,在65℃下杂交并洗膜。
69.本发明另一方面提供检测样品中水稻品种的方法,包括通过对待测样品进行本文所述的snp标记的检测,确定或定量水稻品种。所述方法进一步包括:(1)提取待测样品的
dna;(2)利用本文所述的引物和/或探针,确定或定量所述dna中的本文所述snp标记的基因型;和(3)基于(2)的结果,确定或定量水稻品种。其中,第一snp为tt的水稻品种为五优稻4号,用本领域检测snp的常规方法即可检测并鉴定五优稻4号,例如荧光定量探针法或hrm高分辨率溶解曲线法,这些方法的过程和所用试剂本领域周知。此外,因第二snp包含g的水稻品种不是五优稻4号,所以结合第二snp还可以更准确地分型非五优稻4号品种,例如使用hrm高分辨率溶解曲线法。在一个实施方式中,使用hrm高分辨率溶解曲线法检测第一snp和第二snp可以分型非五优稻4号水稻组i、非五优稻4号水稻组ii和五优稻,其中,非五优稻4号水稻组i的特征是第一snp为cc,第二snp为aa。非五优稻4号水稻组ii的特征是第一snp为cc,第二snp为gg。
70.在一个或多个实施方案中,非五优稻4号水稻组i包括:绥粳18,盐丰47,松粳22,北稻7,通院香518,富尔稻1号,龙庆稻3,南粳9108和俆稻9号。在一个或多个实施方案中,非五优稻4号水稻组ii包括:辽星1号,龙洋11,龙洋16,龙稻18,吉宏6号,柳优香,泰优390,美香占2号。
71.本文中,提取样品中dna的方法不受特别限制,本领域周知适用于本文的dna提取方法。
72.本领域周知适用于本文的snp标记检测方法,包括但不限于:测序、单链构象多态性聚合酶链式反应(pcr single strand conformation polymorphism,pcr-sscp)、实时荧光定量pcr与高分辨率熔解曲线分析(hrm)、荧光探针法定量pcr、限制性片段长度多态性聚合酶链式反应(pcr-restriction fragment length polymorphism,pcr-rflp)及飞行时间质谱等。本领域知晓snp标记检测方法中所需的除引物和/或探针以外的其他试剂。
73.根据本发明的一些具体示例,通过对待测样品进行本文所述的snp标记的检测来确定或定量水稻品种的方法,进一步包括:提取样品中的dna;利用引物seq id no:2和3,进行dna的荧光定量pcr,获得扩增产物;对所述扩增产物进行hrm分析,获得所述dna中的本文所述snp标记的基因型;以及基于所述snp标记的基因型,确定或定量水稻品种。
74.根据本发明的另一些具体示例,通过对待测样品进行本文所述的snp标记的检测来确定或定量水稻品种的方法,进一步包括:提取样品中的dna;利用引物seq id no:3和4,探针seq id no:5和6,以及参照探针seq id no:7,进行dna的荧光定量pcr;分析pcr结果,获得所述dna中的本文所述snp标记的基因型;以及基于所述snp标记的基因型,确定或定量水稻品种。
75.例如,检测样品中五优稻4号含量或纯度的方法包括:荧光定量pcr检测识别第一snp标记和任选第二snp标记的探针的ct值和识别内源参照的探针的ct值,二者相减后得到样品δct,将样品δct与对照的δct相减得到δδct,所述对照是100%五优稻4号或100%非五优稻4号样品,和对δδct的负数进行2次方得到相对含量数值,用于样品中五优稻4号和非五优稻4号的定量判断。在一个或多个实施方案中,识别第一snp标记和任选第二snp标记的探针具有seq id no:5或6所示的核苷酸序列。在一个或多个实施方案中,识别内源参照的探针具有seq id no:7所示的核苷酸序列。
76.本发明还提供一种试剂盒,其含有用于检测本发明所述的水稻基因组中的第一snp标记的试剂,其中,所述水稻基因组第一snp标记为:以水稻基因组dna为模板,采用seq id no:4和3作为引物进行pcr扩增得到的扩增产物的自5’末端起第100位核苷酸,其为t或
c,或以水稻基因组dna为模板,采用seq id no:2和3作为引物进行pcr扩增得到的扩增产物的自5’末端起第23位核苷酸,其为t或c。任选地,所述试剂盒还含有检测本发明所述的水稻基因组中的第二snp标记的试剂,所述第二snp标记为:以水稻基因组dna为模板,采用seq id no:4和3作为引物进行pcr扩增得到的扩增产物的自5’末端起第120位核苷酸,其为a或g,或以水稻基因组dna为模板,采用seq id no:2和3作为引物进行pcr扩增得到的扩增产物的自5’末端起第43位核苷酸,其为a或g。所述试剂可以是本文任一实施方案所述的引物和/或探针。任选地,该试剂盒还包括本发明所述的核酸分子(即扩增产物),该核酸分子可用作内标或阳性对照。优选地,所述引物选自:(1)seq id no:2和3所示的序列或与其有至少90%相同性的序列;(2)seq id no:4和3所示的序列或与其有至少90%相同性的序列;和(3)(1)和(2)所述序列的混合物。所述探针选自:(1)seq id no:5和6所示的序列或与其有至少90%相同性的序列;(2)(1)所述序列的互补序列;任选地,所述探针还包括seq id no:7所示的序列或与其有至少90%相同性的序列,和/或其互补序列。优选地,所述探针具有荧光标记,如分别被fam荧光、vic荧光和cy5荧光标记。试剂盒中还可含有实施pcr所需的各种试剂,如缓冲液、酶、dntp等。
77.在一优选的实施方案中,本发明的试剂盒含有:seq id no:2和3所示的引物序列。在另一优选的实施方案中,本发明的试剂盒含有:seq id no:4和3所示的引物序列;seq id no:5所示的探针,其由fam荧光标记;seq id no:6所示的探针,其由vic荧光标记;seq id no:7所示的探针,其由cy5荧光标记。
78.本发明snp标记及其应用的优点:
79.本发明可以定性或定量检测五优稻4号水稻品种中其它水稻品种的掺入量。本发明利用分子生物学方法定量检测五优稻4号稻米掺伪,适用水稻种子,大米和米粉等产品,从样本中快速提取dna,用开发的高效灵敏的五优稻4号特异荧光探针和引物进行荧光定量pcr扩增,通过设置内源参照基因与参照样本再对扩增数据进行定量分析,从而对五优稻4号纯度进行定量判断。结果直观客观,可避免人为判断,操作方便快捷,定量限达到5%,可大大减少错误判断的概率,且不受品种、地域、环境等带来的影响,检测更灵敏更高效。
80.下文将以具体实施例的方式阐述本发明。应理解,这些实施例仅仅是阐述性的,并不意图限制本发明的范围。实施例中未具体描述的材料、试剂和方法,均未本领域常规的材料、试剂和方法。
81.实施例
82.实施例1:材料和方法
83.1.材料
84.五优稻4号-水稻种子、其它水稻品种种子与市售大米样本均由丰益(上海)生物技术研发中心有限公司提供。
85.2.酶与试剂
86.酶购自康为世纪公司和bio-rad公司,试剂购自国药集团化学试剂有限公司,荧光定量pcr仪bio-rad cfx96;实验中用到的引物和探针均由上海生工生物工程公司合成。
87.3.实验方法
88.3.1水稻种子(米样)dna提取
89.使用研磨机把20克水稻种子(米样)磨碎,称取50mg粉末到2ml样品裂解管中,加入
500μl buffer 1,涡旋仪振荡混匀30s,52℃下孵育30min,转速1200rpm;加入500μl buffer 2,涡旋仪振荡混匀30s,将混合物离心5min(12000rpm),吸取500μl上清备用,提取所得dna溶液用灭菌纯水稀释10倍为模板dna,置于样品稀释管中备用,4℃短期存放,-20℃长期保存。或按五优稻4号水稻纯度定量检测试剂盒的操作说明书提取水稻种子或大米样本dna。
90.3.2五优稻4号水稻特异性引物与探针设计
91.针对五优稻4号水稻品种特异片段序列,primer5设计特异性引物。
92.hrm高分辨率熔解曲线法检测引物:
93.dhx-hrm-f1:5
’-
tgcccatgattcataactgt-3’(seq id no:2);
94.dhx-hrm-r1:5
’-
gatctgatgatatcacttctgtcc-3’(seq id no:3);
95.探针检测法引物:
96.dhx1-wholef:5
’-
tggaacttactggtcatacg-3’(seq id no:4);
97.dhx-hrm-r1:5
’-
gatctgatgatatcacttctgtcc-3’(seq id no:3);
98.设计探针:
99.fdhx-mgb-fam-p3:5
’-
fam
–
ctgaaattaggtaacgtgacag
–
mgb-3’(seq id no:5);
100.dhx-mgb-vic-p2:5
’-
vic
–
ctgaaattaggtaacatgacag
–
mgb-3’(seq id no:6)。
101.dhx-refgene-cy5-p4:5
’-
cy5
–
caagttaggaacaatggcatgcagg
–
bhq2-3’(seq id no:7)。
102.hrm高分辨率熔解曲线法检测引物扩增片段70bp:
103.五优稻4号核酸序列:
104.tgcccatgattcataactgtcatgttacctaatttcagaactatttggacagaagtgatatcatcagatc(seq id no:8,图1)
105.其它水稻核酸序列:
106.tgcccatgattcataactgtcacgttacctaatttcagaacta(g)tttggacagaagtgatatcatcagatc(seq id no:10,图1)
107.探针检测法引物扩增片段147bp:
108.五优稻4号核酸序列:
109.tggaacttactggtcatacggcaaataacaagttaggaacaatggcatgcaggcctgctcctattcaggtacctttgtgcccatgattcataactgtcatgttacctaatttcagaactatttggacagaagtgatatcatcagatc(seq id no:9,图1)
110.其它水稻核酸序列:
111.tggaacttactggtcatacggcaaataacaagttaggaacaatggcatgcaggcctgctcctattcaggtacctttgtgcccatgattcataactgtcacgttacctaatttcagaacta(g)tttggacagaagtgatatcatcagatc(seq id no:11,图1)
112.实施例2:hrm高分辨率熔解曲线法实时荧光定量pcr检测
113.以提取的dna为模板,采用hrm高分辨率熔解曲线法检测引物对dhx-hrm-f1和dhx-hrm-r1进行实时荧光定量pcr扩增。pcr反应体系为20μl,其中ssoadvancedtm green supermix 10μl,dhx-hrm-f1和dhx-hrm-r1引物(浓度为10μm)各0.5μl,模板dna(浓度为50-100ng/μl)2μl,无菌水补齐至20μl。空白对照以无菌水代替模板dna。每个反应做三个重复,pcr扩增程序采用两步法:95℃预变性3分钟;95℃变性15秒,60℃退火延伸1分钟,
共45个循环。
114.实时荧光pcr扩增完成后,将扩增产物直接应用bio-rad进行hrm高分辨率熔解曲线读取,hrm高分辨率熔解曲线熔解过程:95℃1min,70℃1min,然后以0.2℃/0.1s的速度从70℃升温至95℃,收集熔解曲线数据,用于precision melt analysis software分析软件进行hrm高分辨率熔解曲线分型。
115.以提取的不同水稻品种样品的dna为模板,使用hrm高分辨率熔解曲线法检测引物对dhx-hrm-f1和dhx-hrm-r1进行实时荧光定量pcr扩增,再进行hrm高分辨率熔解曲线读取,用precision melt analysis software分析软件进行hrm高分辨率熔解曲线分型,结果显示(图2),五优稻4号水稻品种有特异的hrm曲线,和其它水稻的hrm分型不同,非稻花香其它品种水稻组i包括的水稻有:绥粳18,盐丰47,松粳22,北稻7,通院香518,富尔稻1号,龙庆稻3,南粳9108和俆稻9号;其它品种水稻组ii包括的水稻有:辽星1号,龙洋11,龙洋16,龙稻18,吉宏6号,柳优香,泰优390,美香占2号。
116.实施例3:探针法实时荧光定量pcr检测
117.以提取的dna为模板,使用五优稻4号探针法检测引物探针检测法引物:dhx1-wholef和dhx-hrm-r1,五优稻4号特异探针dhx-mgb-vic-p2,和非五优稻4号特异探针fdhx-mgb-fam-p3,与内源参照基因dhx-refgene-cy5-p4探针进行实时荧光pcr检测。pcr反应体系为20μl,其中2
×
goldstar best mastermix 10μl,dhx1-wholef和dhx-hrm-r1引物(浓度为10μm)0.8μl,dhx-mgb-vic-p2探针(浓度为10μm)各0.25μl,fdhx-mgb-fam-p3探针(浓度为10μm)各0.125μl,dhx-refgene-cy5-p4探针(浓度为10μm)0.2μl,模板dna 2μl,无菌水补齐至20μl。空白对照以无菌水代替模板dna。每个反应做三个重复,pcr扩增程序采用两步法:95℃预变性10min;95℃变性15s;58℃退火延伸45s,共45个循环。
118.首先对探针法进行特异性分析,五优稻4号特异性探针dhx-mgb-vic-p2只在五优稻4号水稻品种中有扩增信号,其它水稻品种均没有扩增信号,非五优稻4号探针fdhx-mgb-fam-p3在非五优稻4号的水稻品种中有扩增信号,五优稻4号中没有扩增信号。对荧光定量pcr数据进行分析,可分别进行水稻样品中五优稻4号和非五优稻4号水稻品种含量的定量。基因表达数据处理采用2-δδct
方法进行,以水稻dhx-refgene-cy5-p4探针为内源参照基因,将样品中dhx-mgb-vic-p2和fdhx-mgb-fam-p3探针的ct值与dhx-refgene-cy5-p4探针的ct值相减后的值δct,再与100%五优稻4号或100%非五优稻4号含量的参照样本的δct相减,得到的δδct的负数进行2次方得到一个相对含量的数值,分别用于水稻样品中五优稻4号和非五优稻4号水稻品种含量的定量判断。
119.以提取的不同含量标准样品的dna为模板,使用引物dhx1-wholef和dhx-hrm-r1,五优稻4号特异探针dhx-mgb-vic-p2,和非五优稻4号特异探针fdhx-mgb-fam-p3,与内源参照基因dhx-refgene-cy5-p4探针进行实时荧光pcr检测,对荧光定量pcr数据进行分析,结果显示(图3),0%非五优稻4号标样,5%非五优稻4号标样,10%非五优稻4号标样,20%非五优稻4号标样;50%非五优稻4号标样,80%非五优稻4号标样,90%非五优稻4号标样,95%非五优稻4号标样,100%非五优稻4号标样,9个标样按非五优稻4号含量递增,相对基因表达量也呈现递增关系,可以用标样定量未知检测样品非五优稻4号的含量(图3,a)。100%五优稻4号标样,95%五优稻4号标样,90%五优稻4号标样,80%五优稻4号标样;50%五优稻4号标样,20%五优稻4号标样,10%五优稻4号标样,5%五优稻4号标样,0%五优稻4
号标样,9个标样按五优稻4号含量递减,相对基因表达量也呈现递减关系,可以用标样定量未知检测样品五优稻4号的含量(图3,b)。
120.实施例4:五优稻4号盲样纯度检测
121.对配置的3个五优稻4号大米产品的盲样样品进行检测,按五优稻4号水稻品种纯度检测试剂盒操作说明进行dna提取、荧光定量pcr扩增和数据分析,结果显示(图4),五优稻4号在盲样中的含量为:米样1为100%,米样2含11%,米样3含38%,三个盲样的检测结果和配比基本一致,配比的含量:米样1为100%五优稻4号,米样2含10%五优稻4号和米样3含40%五优稻4号。
122.结论:本发明是利用分子生物学方法定量检测五优稻4号稻米掺伪,从稻米样本中快速提取dna,用开发的高效灵敏的五优稻4号特异荧光探针和引物进行荧光定量pcr扩增,通过设置内源参照基因与参照样本再对扩增数据进行定量分析,从而对五优稻4号纯度进行定量判断,结果直观,操作方便快捷,且不受品种、地域、环境等带来的影响,检测更灵敏更高效。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1