一种小鼠来源的胃癌细胞系NCCG1、建立方法及其应用与流程
一种小鼠来源的胃癌细胞系nccg1、建立方法及其应用
技术领域
[0001]
本发明涉及细胞培养领域,具体涉及一种小鼠来源的胃癌细胞系(nccg1)、建立方法及其应用。
背景技术:
[0002]
胃癌是我国最常见的恶性肿瘤之一,在我国发病率居各类肿瘤的首位,全世界每年约有17万人死于胃癌。由于胃癌的具体发生机制尚未完全阐明,也缺乏有效的治疗手段,进展期胃癌5年生存率仅20%~30%。
[0003]
建立肿瘤细胞系是研究肿瘤致关重要的环节。细胞系广泛应用于生物学各个研究领域。它是指直接从生物体的组织中分离培养出细胞,为后续研究提供稳定细胞系的一种方法。细胞系是研究特定细胞的生长、代谢、调控特性,细胞与细胞间相互作用,细胞与基质的相互作用等有效的研究材料。人类的第一株连续细胞系是1951年由george otto gey实验室建立的子宫颈癌细胞系(hela),这株细胞系的建立是人体细胞体外培养的里程碑,hela细胞推进了细胞、基因、病毒、疫苗等许多研究领域的进程,也加深了人们对肿瘤的认识:发现肿瘤的各种特性、研究肿瘤发生发展的原因和过程、筛选抗癌药物等。除了研究细胞本身的特性和癌症的发生发展外,还应用于遗传、免疫、分化、发育的研究领域。此外,国内外不少企业还可以利用细胞进行生产各种因子、蛋白等。细胞的广泛应用推动了细胞生物学的蓬勃发展。
[0004]
肿瘤(细胞/动物)模型的建立加速了现代肿瘤学的研究进程,也使我们对肿瘤性疾病的演变过程有了更深入的了解。构建理想的肿瘤模型有助于探索胃癌的具体发病机制并为治疗提供理论依据。肿瘤细胞系及皮下荷瘤是目前最常用的肿瘤模型,将肿瘤细胞系移植到同种或异种动物的皮下形成肿瘤块,进而开展实验研究。因此在胃癌的研究中,使用不同类型的胃细胞系作为研究肿瘤异质性、多样性等具有重要意义。然而,目前胃癌细胞系相对较少,并且多数都是人肿瘤组织来源的细胞系,鼠源肿瘤细胞系具有成瘤率高、生长速度快、载瘤鼠种选择广泛等优点。但目前可用鼠源胃癌细胞系少见,常用的也仅有mfc小鼠胃癌细胞系,但mfc细胞系是1985年由钱书森教授构建,目前已经传代超过数百代,细胞本身可能已经发生突变或污染。本发明的细胞系,具有生长速度稳定、裸鼠成瘤率高等特点,可填补我国鼠源胃癌细胞系缺乏的现状,为胃癌的研究提供良好的肿瘤模型,可作为肿瘤病因与预防、检测试剂盒、新药研发等工具细胞,助力癌症预防与治疗。
技术实现要素:
[0005]
本发明的目的是克服现有技术存在的缺陷,提供一种胃癌细胞系,具体涉及胃癌细胞系nccg1及其建立方法。
[0006]
本发明建立了的胃癌细胞系可稳定传代,成瘤性好,能适用于建立动物模型。该细胞系可用于胃癌的发生发展及转移机制,耐药原理及新药筛选等的研究。
[0007]
根据本发明的一个方面,本发明提供了一种鼠源胃癌细胞系,其保藏在中国典型
培养物保藏中心,保藏编号为cctcc no:c2020165。
[0008]
根据本发明的另一个方面,本发明提供了前面所述的胃癌细胞系的子代细胞。
[0009]
根据本发明的又一个方面,本发明提供了胃癌细胞系的建立方法,其特征在于,所述建立方法包括如下步骤:
[0010]
1)致癌剂诱导小鼠成瘤;
[0011]
2)将步骤1)中形成的肿瘤组织接种到免疫缺陷小鼠身上成瘤;
[0012]
3)将步骤2)中形成的肿瘤细胞体外培养,形成稳定的胃癌细胞系。
[0013]
优选地,所述致癌剂包括4nqo、n-甲基-n'-硝基-亚硝基胍,化学酸(硝酸或盐酸),乙醇,幽门螺旋杆菌。上述致癌剂可单独应用也可联合应用。
[0014]
在本发明的一个具体实施方案中,所述致癌剂是4nqo。
[0015]
作为可选择的技术方案,步骤1)也可使用原位移植法,移植瘤法,免疫抑制法、转基因法诱导小鼠成瘤。
[0016]
可用于本发明的免疫缺陷小鼠包括scid小鼠、裸小鼠,重度免疫缺陷npi小鼠。
[0017]
在本发明的具体实施方案中,所述免疫缺陷小鼠是重度免疫缺陷npi小鼠。
[0018]
将肿瘤组织接种到免疫缺陷小鼠身上成瘤的方式为本领域常规使用的接种方式。所述接种方式包括皮下穿刺接种,原位接种或者肾囊膜内接种,优选地为皮下穿刺接种。所述接种的胃癌组织块大小较佳地为2
×
2mm。
[0019]
在本发明的具体实施方案中,采用套管植入法将步骤1)中形成的肿瘤组织植入免疫缺陷小鼠身上成瘤。
[0020]
进一步,肿瘤细胞体外培养采用如下细胞培养基:advanced dmem/f12(500ml培养基中含b27 10ml,n-2 5ml,glutamax 5ml,hepes 5ml,青-链霉素5ml)。
[0021]
根据本发明的又一个方面,本发明提供了前面所述的胃癌细胞系在制备使免疫缺陷小鼠产生胃癌的试剂中的应用。
[0022]
进一步,所述免疫小鼠包括scid小鼠、裸小鼠,重度免疫缺陷npi小鼠;更优选地,所述免疫缺陷小鼠是重度免疫缺陷npi小鼠。
[0023]
本发明所述的使免疫缺陷小鼠产生胃癌的试剂为本领域常规的试剂,该试剂的制备方法较佳地为将本发明所述的胃癌细胞系混悬于各种溶剂中即得。其中所述溶剂为本领域常规溶剂,较佳地为pbs缓冲液,所述pbs缓冲液的配方为:含有2%青霉素-链霉素混合液。
[0024]
根据本发明的又一个方面,本发明提供了前面所述的胃癌细胞系的应用,所述应用包括以下任一项所述的应用:
[0025]
1)在制备胃癌细胞模型中的应用;优选的,所述胃癌细胞模型包括胃癌发生、发展或转移的细胞模型;
[0026]
2)在制备胃癌动物模型中的应用;
[0027]
3)在建立胃癌发生发展,转移机制的研究平台中的应用;
[0028]
4)在筛选防治胃癌的药物中的应用;
[0029]
5)在建立耐药机理的研究平台中的应用。
[0030]
根据本发明的又一个方面,本发明提供了一种筛选用于治疗胃癌的候选药物的方法,所述方法包括如下步骤:将待测物施用于胃癌细胞模型中,施用后抑制细胞增殖或导致
细胞凋亡的待测物为用于治疗胃癌的候选物。所述胃癌细胞模型是前面所述的胃癌细胞系。
[0031]
根据本发明的又一个方面,本发明提供了一种筛选用于治疗胃癌的候选药物的方法,所述方法包括如下步骤:将待测物施用于胃癌动物模型中,观察和测量动物的体重和肿瘤生长情况;施用后导致胃癌动物模型胃癌症状改善或治愈的待检测物为用于治疗胃癌的候选物。所述胃癌动物模型是用前面所述的胃癌细胞系构建的。
[0032]
进一步,其中所述的待测化合物施用的方法为本领域常规的施用方法,较佳地包括:尾静脉注射、腹腔注射、灌胃、口服和肿瘤局部用药中的一种或几种方式施用于胃癌的荷瘤动物。
[0033]
本发明的优点和有益效果:
[0034]
本发明的胃癌细胞系具有稳定的细胞生物学特性,瘤细胞贴壁生长,代谢旺盛,生长快速,具有良好的体外培养扩增性;具有稳定的克隆形成能力和迁移、侵袭能力;细胞系在哺乳动物体内能够形成肿瘤,致瘤性强,可成功制备胃癌发生、发展的动物模型,该动物模型可用于研究胃癌发生发展分子机制、药物筛选及发现胃癌相关新生物标志等,是胃癌基础研究和临床前期应用的理想细胞系。
[0035]
生物材料样品的保藏信息:
[0036]
保藏单位:中国典型培养物保藏中心(cctcc);
[0037]
地址:中国武汉,武汉大学;
[0038]
保藏日期:2020年9月10日;
[0039]
保藏编号:cctcc no:c2020165;
[0040]
分类命名:小鼠胃癌细胞系nccg1。
附图说明
[0041]
图1显示小鼠肿瘤照片图;
[0042]
图2显示小鼠胃癌细胞形态图;
[0043]
图3显示克隆形成实验结果图;
[0044]
图4显示利用cck8实验检测细胞增殖能力的生长曲线图;
[0045]
图5显示利用cck8实验检测不同细胞系增殖能力的生长曲线图;
[0046]
图6显示小鼠胃癌组织he染色图。
具体实施方式
[0047]
下面通过实施例的方法进一步说明本发明,但并不因此将本发明限制在所述的实施例范围内。下列实施例中未做特殊说明,均为常规的方法或者条件。
[0048]
实施例1胃癌细胞系模型建立
[0049]
1、实验材料
[0050]
4nqo(4-nitroquinoline-n-oxide)购自sigma-aldrch,货号:n8141-5g;
[0051]
1,2丙二醇购自沪试,货号:30157018;
[0052]
pbs缓冲液(含有2%青霉素-链霉素混合液);
[0053]
青霉素-链霉素混合液(penicillin streptomycin)购自conrning公司;
[0054]
重度免疫缺陷npi鼠购自艾德摩生物,6-8周龄;
[0055]
rpmi-1640培养基购自conrning公司;
[0056]
胎牛血清购自北京细工商贸;
[0057]
glutamax购自gibco,货号:3505006;
[0058]
hepes购自gibco,货号:1563008;
[0059]
n-2购自gibco,货号:1750204;
[0060]
b27购自gibco,货号:17504-044;
[0061]
advanced dmem/f12购自gibco,货号:1263401。
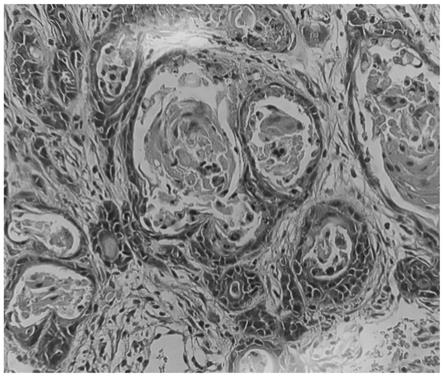
[0062]
2、实验步骤
[0063]
2.1致癌剂诱导胃癌形成
[0064]
将1g 4nqo和200ml 1,2丙二醇配成浓度0.5g/100ml的母液,震荡混匀,使用时1:50稀释,放入6-8周c57小鼠的饮水中投喂,连用16周后停药,继续养小鼠12周后解剖查看成瘤情况,形成的肿瘤照片见图1。
[0065]
2.2小鼠胃癌移植瘤模型构建
[0066]
1)解剖步骤2.1的成瘤小鼠,取出肿瘤,将肿瘤块用含有2%青霉素-链霉素混合液的pbs缓冲液冲洗3遍;
[0067]
2)将肿瘤剪成2*2mm大小组织块,放入4度预冷的含有10%胎牛血清的rpmi-1640培养基中;
[0068]
3)将小块肿瘤组织用套管针植入npi免疫缺陷鼠皮下,观察1周成瘤。
[0069]
2.3细胞系的培养
[0070]
1)将步骤2.2的小鼠二氧化碳处死后立即浸泡入70%的酒精消毒液中30秒;
[0071]
2)将小鼠的肿瘤解剖下来,转移到无菌细胞操作台,用2%青霉素-链霉素混合液的pbs缓冲液冲洗3遍,剔除肿块周边坏死、脂肪等异物,仅保留具有活性的肿瘤组织成分;
[0072]
3)将组织块放入5ml离心管中,用小剪刀剪30次;
[0073]
4)将离心管中加入3ml胰酶(trypsin 2.5%),上下颠倒10次,继续剪组织块30次,再次上下颠倒10次;
[0074]
5)静置10s,此时较大组织块已经沉降离心管底部,使用1ml枪头将上层悬浊液吸出放入1.5ml离心管中;
[0075]
6)1000转离心机离心5分钟,倒掉上清;
[0076]
7)使用advanced dmem/f12(500ml含b27 10ml,n-2 5ml,glutamax 5ml,hepes 5ml,青-链霉素5ml)配好的细胞培养基重悬下层细胞,并置于6孔板培养,48小时内不要触碰;
[0077]
8)48小时后细胞贴壁后换液,培养基中去除b27/n-2因子继续培养扩培;
[0078]
9)挑选单克隆,继续稳定培养细胞半年以上,使细胞表型稳定,获得的稳定胃癌细胞系命名为nccg1,细胞形态见图2。
[0079]
实施例2胃癌细胞系性质鉴定
[0080]
1、克隆形成实验
[0081]
1.1步骤
[0082]
将nccg1接种于含有完全培养基的六孔板培养皿中,37℃,5%co
2
孵育箱中培养两
周后,在倒置显微镜下观察并计算集落形成个数,每个集落不少于50个细胞。同时用姬姆萨染液染色并进行拍照备用。具体操作如下:
[0083]
1)胰酶消化,计数并接种细胞于六孔板培养皿中,每孔2000个细胞,co
2
培养箱,37℃培养;
[0084]
2)每3天进行细胞换液;
[0085]
3)待细胞克隆形成后即可停止培养(约10-14天);
[0086]
4)弃去培养液,pbs洗涤3次;
[0087]
5)加入5ml甲醇(浸没细胞即可),室温固定15min;
[0088]
6)姬姆萨染液染色30min;
[0089]
7)无菌水冲洗后,拍照,显微镜下计数。
[0090]
1.2结果
[0091]
克隆形成实验结果如图3所示,nccg1细胞具有较强的克隆形成能力,可作为研究肿瘤增殖的良好模型。
[0092]
2、nccg1细胞系基因敲降实验
[0093]
2.1步骤:
[0094]
针对rictor和对照的小干扰rnas(sirnas)由广州锐博生物技术有限公司设计并合成,rictor sirna序列为:5
’-
gcccuccauugcaacaaua-3
’
(seq id no.1),control sirna:5
’-
aguacagca aacgauacggtt-3
’
(seq id no.2)。利用lipofectaminetm 2000
将rictor sirna或control sirna转染细胞,转染48小时后收取细胞。
[0095]
具体操作如下:
[0096]
用于sirna干扰片段转染的所有器皿均经rnase-free处理。转染前一天,将细胞用胰酶消化,计数后铺制6孔板,细胞密度为每孔30万个,将细胞放入co
2
培养箱,37℃培养过夜。细胞培养液中不使用抗生素。在细胞生长密度约为50%-60%时,进行sirna转染;
[0097]
细胞先用pbs洗涤两次,加入新鲜的无血清培养基;
[0098]
用200μl无血清培养液稀释100pmol sirna(5μl),室温静置5min;
[0099]
用200μl无血清培养液稀释5μl的脂质体lipofectamine
tm 2000,室温静5min;
[0100]
将4和5混匀,室温孵育20min,然后慢慢加入经无血清培养基洗涤过的细胞中;
[0101]
37℃,5%co
2
条件下培养6小时后,更换为含有10%胎牛血清的完全培养基(不含抗生素)继续培养24-48h后可进行细胞增殖能力检测。
[0102]
2.2结果
[0103]
使用sirna技术敲降癌基因rictor,发现敲降该癌基因后,细胞的增殖能力显著减弱。证实该细胞系可作为基因敲降实验的良好细胞模型,助力肿瘤科学研究(图4)。
[0104]
3、nccg1细胞系与其他胃癌细胞系的增殖能力比较
[0105]
3.1步骤
[0106]
cck-8法是用于测定细胞增殖或细胞毒性试验中活细胞数目的一种高灵敏度,无放射性的比色检测法。我们使用cck-8(cell counting kit-8)试剂盒(东仁化学科技有限公司,上海)检测nccg1、hgc27两株细胞系活力,按照试剂盒提供的说明进行操作:
[0107]
将nccg1、hgc27两株细胞系用胰蛋白酶消化后计数,以每孔3,000个细胞的浓度接种于96孔板中,每孔设置12个重复;
[0108]
将培养板在培养箱孵育适当的时间(0、24、48、72、96小时)后,向培养板每孔中加入10μl cck-8溶液(注意不要在孔中生成气泡,它们会影响od值的读数);
[0109]
将培养板在培养箱内孵育1.5h。用酶标仪测定在450nm处的od值,绘制细胞增殖曲线。
[0110]
3.2结果
[0111]
用胃癌研究常用的细胞系hgc27作为对照,比较nccg1细胞系与hgc27细胞系的增殖能力。结果如图5显示,nccg1细胞系的增殖能力优于hgc27细胞系。证明本发明构建的nccg1细胞系可作为肿瘤研究的良好模型。
[0112]
4、nccg1细胞系移植成瘤实验
[0113]
4.1步骤
[0114]
4.1.1裸鼠成瘤实验
[0115]
1)将nccg1扩大培养后,胰酶消化收集细胞,悬浮于生理盐水中。
[0116]
2)通过细胞计数,调整细胞浓度至5
×
105/100μl。
[0117]
3)使用5只6周龄的雌性裸鼠(北京华阜康生物),每只皮下注射100-150μl细胞悬液接种于裸鼠背部,
[0118]
4)两个星期后观察成瘤率,发现5只裸鼠均成瘤,成瘤率100%。
[0119]
4.1.2he染色
[0120]
苏木精一伊红染色简称h&e染色法,是病理切片技术里最常用的染色法之一。其中苏木精为碱性染料,主要使胞质中的核糖体和细胞核中的染色质呈紫蓝色;而伊红为酸性染料,主要使细胞外基质和细胞质中的成分呈红色。其具体操作步骤如下:
[0121]
(1)烤片:将小鼠胃癌石蜡切片置于60度烤箱中烘烤90分钟。
[0122]
(2)脱蜡:从烤箱中迅速将切片置于二甲苯i中15分钟,再转至二甲苯ii中15分钟。此时肉眼可以观察到切片呈透明状。
[0123]
(3)依次将切片置于无水乙醇i、无水乙醇ii、95%乙醇、90%乙醇、80%,乙醇、70%乙醇和50%乙醇中各5分钟。
[0124]
(4)将切片置于去离子水中5分钟。
[0125]
(5)尽量去除切片上的水分,然后将切片置于苏木精中染色3-5分钟,去离子水冲洗。
[0126]
(6)将切片置于1%的盐酸乙醇中分色30秒,去离子水冲洗。
[0127]
(7)将切片置于自来水中返蓝,3分钟。
[0128]
(8)将切片置于0.5%的伊红溶液中染色3分钟。去离子水冲洗。
[0129]
(9)脱水:依次将切片置于50%乙醇、70%乙醇、80%乙醇、90%乙醇、95%乙醇、无水乙醇ii、无水乙醇i中各5分钟。
[0130]
(10)透明:将切片置于二甲苯ii和二甲苯i中各透明5分钟。
[0131]
(11)封片:向切片组织的部位滴加少量的中性树胶,轻轻盖上盖玻片。风干。
[0132]
(12)结果分析:将封好的切片送病理工作站,进行图像扫描、拍照。
[0133]
4.2结果
[0134]
小鼠胃癌组织he染色显示,肿瘤异型性明显,角化珠形成,证明nccg1是一株来源于胃高分化鳞癌的细胞系(图6)。
[0135]
以上已对本发明创造的较佳实施例进行了具体说明,但本发明创造并不限于所述实施例,熟悉本领域的技术人员在不违背本发明创造精神的前提下还可做出种种的等同的变型或替换,这些等同的变型或替换均包含在本申请权利要求所限定的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1