一种柳杉抗寒调控基因CfAPX及其应用的制作方法
本发明属于植物分子生物学和基因工程技术领域,具体涉及一种柳杉抗寒调控基因cfapx及其应用。
背景技术:
柳杉(cryptomeriafortunei)为杉科(taxodiaceae)柳杉属(cryptomeria)常绿高大乔木,又称为长叶孔雀松,喜山地气候及条件良好的酸性土壤,具有侧根发达、生长迅速、适应性强、树形优美且能净化空气、改善环境等特性,是中国南方优良的用材和园林树种。柳杉的生长和分布常受到干旱、寒冷等极端环境的制约,随着全球气候变化以及极端天气频繁发生,柳杉的生长发育受到了极大的影响。
抗坏血酸过氧化物酶(apx)是含有血红素的过氧化物酶家族,它以抗坏血酸作为特异性电子供体,催化h2o2生成水,通过清除活性氧维持细胞氧化还原稳态。生物或非生物胁迫(干旱、盐、高温、低温等)会使植物产生过多的活性氧物质,对细胞膜和细胞器造成不同程度的损伤。抗坏血酸过氧化物酶作为细胞抗氧化防御最重要的组成部分之一,当植物受到各种环境胁迫时,在调节活性氧(ros)水平方面发挥着至关重要的作用。
技术实现要素:
针对现有技术中存在的不足,本发明所要解决的技术问题是提供一种柳杉抗寒调控基因cfapx,其基因蛋白为抗坏血酸过氧化物酶,能高效的清除植物体内的过氧化氢,维持细胞稳态,当柳杉受到各种环境胁迫时,能够调节活性氧水平从而提高抗逆性。本发明所要解决的另一技术间题在于提供所述柳杉cfapx基因的应用。
为了解决上述技术问题,本发明所采用的技术方案如下:
一种柳杉抗寒调控基因cfapx,其核苷酸序列如seqidno.1所示。
所述的柳杉cfapx基因的编码蛋白,其氨基酸序列如seqidno.2所示。
含有所述的柳杉cfapx基因的载体和宿主细胞。
所述的载体为植物重组表达载体。
所述的植物重组表达载体为pbi121+cfapx。
所述的宿主细胞为农杆菌gv3101。
所述的柳杉抗寒调控基因cfapx在提高植物抗逆性中的应用。
所述的应用,基因cfapx在清除植物体内的过氧化氢,调节活性氧水平从而提高植物抗逆性。
所述的植株为柳杉或拟南芥。
有益效果:本申请通过实验发现cfapx基因在低温胁迫下柳杉叶片中的基因表达量在-16℃达到峰值。通过构建表达载体pbi121-cfapx对cfapx进行功能验证,发现,转基因植株cfapx基因的表达量上调,与野生型相比均达到了显著或极显著水平。因此,cfapx基因可以调节植物抗坏血酸过氧化物酶活性,从而提高细胞清除活性氧,维持稳态的能力,进一步提高植株的抗逆性。本申请提供的柳杉cfapx基因的表达蛋白是抗坏血酸过氧化物酶,其表达受到盐胁迫、干旱胁迫、低温胁迫等多种环境刺激的调节,在逆境条件下,apx的活性明显增强,参与将h2o2催化形成h2o的过程,通过清除活性氧维持细胞氧化还原稳态,提高植物的抗逆性,对植物的生长发育具有重要意义。
附图说明
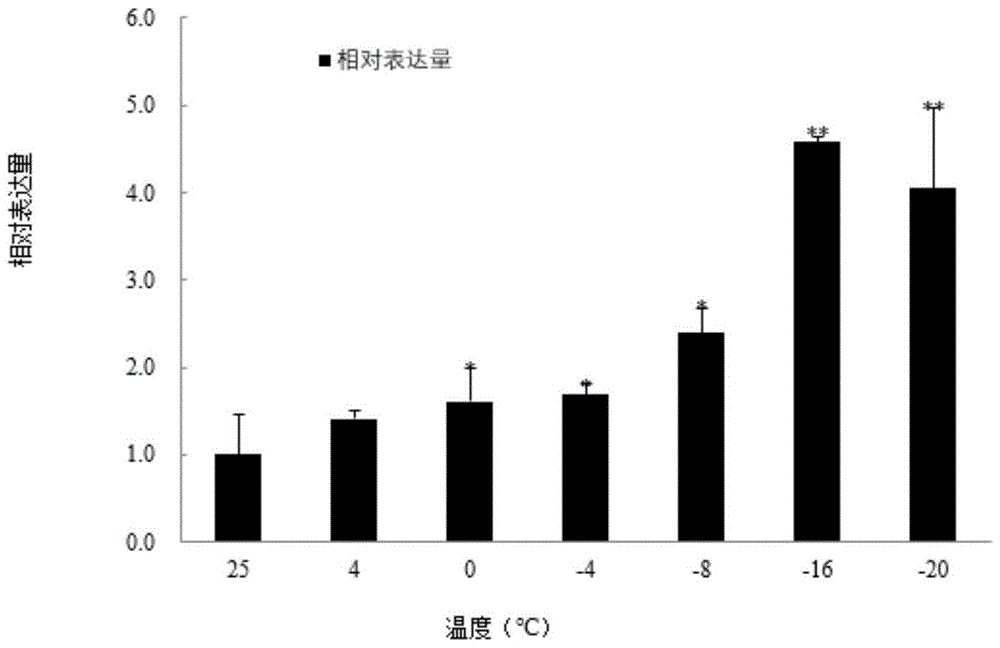
图1是cfapx基因在低温胁迫下柳杉叶片中的基因表达量柱状图;
图2是本发明的拟南芥转基因植株和野生型植株4℃处理后表型图;
图3是本发明的cfapx基因在拟南芥中不同时间的相对表达量柱状图;
图4是低温胁迫下转基因植株和野生型植株fv/fm的变化柱状图;
图5是低温胁迫下转基因植株和野生型植株y(ii)的变化柱状图;
图6是低温胁迫下转基因植株和野生型植株mda含量的变化柱状图;
图7是低温胁迫下转基因植株和野生型植株pod含量的变化柱状图。
具体实施方法
下面结合附图对本发明作进一步详细描述。下述实施案例中所使用的方法如无特别说明均为常规方法,本实施例所有引物合成及测序工作均由南京金斯瑞生物技术公司完成。
实施例1:柳杉cfapx基因的克隆和表达分析
1、柳杉cfapx基因的克隆
选取生长良好的柳杉扦插苗,放于培养箱中15℃预冷1d,4℃培养3d后,采取幼嫩叶片,提取总rna并反转录成cdna。在ncbi网站中根据柳杉高通量测序结果,建立柳杉本地blast数据库,最后以本地blast结果得分最高的序列作为apx同源序列设计引物cfapx-f和cfapx-r,以cdna为模板进行pcr扩增,pcr产物回收后连接载体pmd19-t。该特异性扩增引物cfapx-f和cfapx-r的序列为:
cfapx-f:5′-atcctgcggaattctatcgag-3′,
cfapx-r:5′-cttagaaatttaggtagcgact-3′。
以反转录合成的cdna为模板,利用引物cfapx-f和cfapx-r进行扩增。反应体系如下(50μl):2μlcdnatemplate,32.5μldh2o,8μldntpmixture,5μl10×lapcrbuffer(mg2++),1μlforwardprimer(10μm),1μlreverseprimer(10μm),0.5μllataq。扩增反应程序为:94℃4min,94℃30s,56℃1min,72℃2min,35个循环,72℃10min,4℃保持。
pcr产物经1.5%琼脂糖凝胶电泳检测后,对目的片段进行回收,并连接到载体pmd19-t上,然后转移到大肠杆菌感受态细胞,经阳性克隆检测后送至南京金斯瑞生物公司测序。
将测序得到的柳杉apx基因中间片段,3′、5′race片段用bioxm2.6软件拼接,得到cfapx基因全长,用ncbi网站blast在线工具进行比对,以确保序列的完整正确。结果表明:cfapx基因全长有1226bp,其核苷酸序列如下:
序列中:下划线为引物序列,加粗、斜体与下划线部分为起始、终止密码子,具体序列见seqidno.1所示,其中有750个碱基编码249个氨基酸(seqidno.2)。
2、柳杉cfapx基因实时荧光定量表达分析
柳杉选择gapdh为内参基因,实时定量引物如下:
rt-apx-f:5′-actacagatagcaaaagcatcg-3′
rt-apx-r:5′-ttcttgtattcctcgctcactt-3′
实时荧光定量pcr反应体系(20μl):10.0μl2×chamqsybrqpcrmastermix(lowroxpremixed),1μlprimer-f(10μm),1μlprimer-r(10μm),2μltemplatedna/cdna,6μlddh2o。扩增程序为:95℃20s,95℃10s,95℃10s,60℃34s,40个循环;95℃15s,60℃60s,95℃15s,4℃保持。
荧光定量结果(图1)显示:柳杉cfapx基因的表达量在低温胁迫下,随着温度的降低呈现先升高后下降的趋势。在-16℃达到峰值,-20℃相较于-16℃表现略有下降,即-16℃时柳杉cfapx基因表达量最高。
3、pbi121表达载体和宿主细胞的构建
根据已扩增得到的cfapx基因编码区利用oligo7设计引物,以柳杉cdna为模板,利用引物进行编码区扩增,同时将pbi121表达载体也用bamhi酶、xbai酶进行双酶切,再用t4连接酶将两个酶切产物连接、转化、挑取单克隆测序,将测序结果正确的菌液提取重组表达载体质粒。
将构建好的表达载体pbi121+cfapx转化到农杆菌gv3101感受态细胞中,挑取单克隆进行培养,使用pcr检测阳性菌落,获得宿主细胞。
实施例2:拟南芥的遗传转化、筛选和鉴定
将生长良好的哥伦比亚野生型拟南芥的顶生花序放入农杆菌gv3101浸染液中进行浸染,重复浸染直至花期结束,继续培养收获转基因t1代拟南芥种子。
将t1代拟南芥种子点播到含有卡那霉素的1/2ms培养基中,叶片绿色、生长健壮的幼苗为转基因拟南芥,未转基因的拟南芥会逐渐黄化死亡,继续培养收获拟南芥t2代种子,培养的植株为t2代转基因植株。
待拟南芥植株长到10片叶子左右时,收集转基因植株叶片,提取dna并进行pcr检测。
实施例3:转基因拟南芥的功能验证
1、拟南芥表型观察
将cfapx转基因拟南芥和野生型拟南芥幼苗分别放入4℃培养箱中培养两周(图2),观察发现转基因植株与对照植株相比,其叶片绿色变深,而野生型拟南芥叶片发黄变红,其叶绿素合成受到了破坏。
2、转基因拟南芥基因表达量分析
将cfapx转基因拟南芥放入4℃处理,分别于0、4、8、12h取叶片提取rna,保证反转录前每个处理rna的总量相同,进行实时荧光定量,拟南芥内参采用actin基因。引物设计如下:
rt-apx-f:5′-actacagatagcaaaagcatcg-3′
rt-apx-r:5′-ttcttgtattcctcgctcactt-3′
actin-f:5′-aattacccgatgggca-3′
acfin-r:5′-tcatactcggccttgga-3′
采用sybrgreeni荧光染料法进行qrt-pcr定量分析,所加试剂如下(20μl):10μl2×sybrpremixextaq,5.2μldh2o,0.4μlforwardprimer,0.4μlreverseprimer,4μlcdna。
cfapx转基因拟南芥基因表达量分析如图3所示,结果显示:cfapx基因的表达量在处理的0~8h内随着时间的增加而呈现出上调的状态,但当处理时间达到12h,相对基因表达量上升缓慢,但转基因植株cfapx基因的表达量上调,与野生型相比均达到了显著或极显著水平。
3、低温胁迫对转基因拟南芥和野生型拟南芥叶绿素荧光的影响
如图4、图5所示,低温处理后,野生型植株和转基因拟南芥植株叶绿素荧光参数fv/fm和y(ii)均显著降低。在4℃时随着处理时间的延长,fv/fm和y(ii)逐渐降低且转基因植株均低于野生型,在-6℃时转基因拟南芥植株fv/fm高于野生型,转基因植株和野生型植株在y(ii)参数上4℃时间延时(4h,12h,24h)及-6℃(8h)均表现出显著差异,说明cfapx基因在低温下发挥作用,抵御逆境胁迫,使拟南芥抗寒性增强。
4、低温胁迫对转基因拟南芥和野生型拟南芥丙二醛(mda)含量的影响
如图6所示,随着温度的降低,转基因植株和野生型植株丙二醛含量显著增加。4℃时两者mda含量逐渐增加,野生型植株变化均高于转基因植株,从4℃到-6℃,mda含量迅速积累,-6℃时转基因植株含量低于野生型,说明在低温胁迫下,野生型拟南芥体内mda含量的积累大于转基因拟南芥,野生型植株受伤害的程度更大,抗寒性较弱。
5、低温胁迫对转基因拟南芥和野生型拟南芥过氧化物酶(pod)含量的影响
图7显示在低温胁迫下,pod含量呈现逐渐增加的趋势。在-6℃处理时pod含量变化显著,转基因植株pod含量大于野生型,随着4℃处理时间的增加,转基因植株和野生型植株体内pod含量逐渐积累,总体来说在低温胁迫下转基因拟南芥pod含量大于野生型,酶活性较高,能有效的清除细胞内积累的活性氧,维持细胞稳态,提高抗逆性。
序列表
<110>南京林业大学
<120>一种柳杉抗寒调控基因cfapx及其应用
<130>100
<160>10
<170>siposequencelisting1.0
<210>1
<211>1309
<212>dna
<213>cryptomeriafortunei
<400>1
ctaatacgactcactatagggcaagcagtggtatcaacgcagagtacatggggactacag60
atagcaaaagcatcgttgatcctgcggaattctatcgaggcgaagtaaagagagcaatca120
tggtgaaggtatacccacaagtgagcgaggaatacaagaaggctattgacaaatgcagga180
ggaagctgcgagctctcattgctgagaaaaactgtgctcctattatggttcgtctcgcat240
ggcatgctgctgggacttatgatgtaaagagcaagactggagggccttttggaactatta300
gacatccttctgagttggctcatggggctaacagtggcttggatatcgccattaagttgc360
ttgagcctattaaggcacagttccccattgtcacttatgctgatctctatgagttggctg420
gagttgtggctgttgaggtcactggtggacctgatattccattccaccctggcagagaag480
acaagcctgagccaccagaagagggacggttgcccgatgccaccaaaggagctgatcatt540
tgagagatgtcttcggtcacatgggattgagtgaccaggacattgtggctttgtctggtg600
ctcacactttgggaagttgccacaaggagagatctggatttgaaggtccatggacgtcta660
acccgctcatctttgacaactcctatttcacagaacttgtcactggagagaaggaaggtc720
tgcttcaattgccttctgacaaggctttactaactgatcctaagtttgcaccccttgtac780
acaagtatgctcaggatgaagatgctttttttgctgactatgctgaggctcatttgaaac840
tttctgaacttgggtttgctgaagcatagatacttaatttgggaaggactctgtctctgt900
tcaccattccaagaaactactatcatatagtgaacagagaatgtcattttggttcaccgt960
ttcgatcagcagaatcgtatcatttcgatttttcgtaattgtctgttttgtggattgata1020
gttaatgtaaaacgtgtacatttttggagccttttatctatataagtgacttagtcgcta1080
cctaaatttctaagattgaaataaaatgtgggtcttgactttgtgaaagcacttagaagt1140
taaaacatttccattttttttaagaaatacctacccaagggttaagttttccacactttt1200
taatggaaatgcaaatcaaaactttgtaatggaatgttgaaaaaaaaaaaaaaaaaaaaa1260
aaaaaaaaagtactctgcgttgataccactgcttgccctatagtgagtc1309
<210>2
<211>249
<212>prt
<213>cryptomeriafortunei
<400>2
metvallysvaltyrproglnvalsergluglutyrlyslysalaile
151015
asplyscysargarglysleuargalaleuilealaglulysasncys
202530
alaproilemetvalargleualatrphisalaalaglythrtyrasp
354045
vallysserlysthrglyglypropheglythrilearghisproser
505560
gluleualahisglyalaasnserglyleuaspilealailelysleu
65707580
leugluproilelysalaglnpheproilevalthrtyralaaspleu
859095
tyrgluleualaglyvalvalalavalgluvalthrglyglyproasp
100105110
ileprophehisproglyarggluasplysprogluproprogluglu
115120125
glyargleuproaspalathrlysglyalaasphisleuargaspval
130135140
pheglyhismetglyleuseraspglnaspilevalalaleusergly
145150155160
alahisthrleuglysercyshislysgluargserglypheglugly
165170175
protrpthrserasnproleuilepheaspasnsertyrphethrglu
180185190
leuvalthrglyglulysgluglyleuleuglnleuproserasplys
195200205
alaleuleuthraspprolysphealaproleuvalhislystyrala
210215220
glnaspgluaspalaphephealaasptyralaglualahisleulys
225230235240
leusergluleuglyphealagluala
245
<210>3
<211>21
<212>dna
<213>cfapx-f引物序列(artificialsequence)
<400>3
atcctgcggaattctatcgag21
<210>4
<211>22
<212>dna
<213>cfapx-r引物序列(artificialsequence)
<400>4
cttagaaatttaggtagcgact22
<210>5
<211>22
<212>dna
<213>rt-apx-f引物序列(artificialsequence)
<400>5
actacagatagcaaaagcatcg22
<210>6
<211>22
<212>dna
<213>rt-apx-r引物序列(artificialsequence)
<400>6
ttcttgtattcctcgctcactt22
<210>7
<211>22
<212>dna
<213>rt-apx-f引物序列(artificialsequence)
<400>7
actacagatagcaaaagcatcg22
<210>8
<211>22
<212>dna
<213>rt-apx-r引物序列(artificialsequence)
<400>8
ttcttgtattcctcgctcactt22
<210>9
<211>16
<212>dna
<213>actin-f引物序列(artificialsequence)
<400>9
aattacccgatgggca16
<210>10
<211>17
<212>dna
<213>actin-r引物序列(artificialsequence)
<400>10
tcatactcggccttgga17
- 还没有人留言评论。精彩留言会获得点赞!