用于核酸检测的逆转录酶突变体的制作方法
1.本发明属于生物技术领域,具体地说,本发明涉及一种用于核酸检测的逆转录酶突变体。
背景技术:
2.鼠白血病逆转录酶(m-mlv)是一种以rna为模板的dna聚合酶,具有rnase h活性,不具有3
’-5’
外切酶活性,可用于逆转录合成cdna。由于rna具有较复杂的二级结构,对m-mlv酶的逆转录效率影响较大。打开rna二级结构最简单的方法是通过高温使二级结构的氢键打开,rna变为线性单链。但野生型的m-mlv酶最适反应温度为37℃,高温下稳定性下降并且活性降低。因此通过突变使m-mlv酶的热稳定性提高,使其适应高温下的反应是m-mlv酶的主要改造方向。
3.m-mlv酶的突变改造有以下的途径:
4.1、随机突变。对m-mlv全长序列或者某一结构域进行随机突变,然后进行筛选。此方法可筛选出高活性和高热稳定性的mmlv突变体,但技术过程繁复,随机突变产生的突变库容量可达到107,伴随大量的无活性突变,筛选难度极大。(参考文献:arezi b,hogrefe h.novel mutations in moloney murine leukemia virus reverse transcriptase increase thermostability through tighter binding to template-primer[j].nucleic acids research,2008,37(2):473-481.)
[0005]
2、对特定活性位点进行定点突变。此方法针对性较强,通过增加核酸结合位点、金属离子结合位点等关键活性位点氨基酸与底物的亲和力,提高酶活。但此方法缺乏对酶整体结构的分析,不能从整体上提高酶的稳定性。(参考文献:yasukawa k,mizuno m,konishi a,et al.increase in thermal stability of moloney murine leukaemia virus reverse transcriptase by site-directed mutagenesis[j].journal of biotechnology,2010,150(3):299-306.)
[0006]
总体而言,由于蛋白质结构的复杂性,不仅是位于活性位点的氨基酸甚至一些远离活性位点的氨基酸都可能对酶的整体结构及性能产生影响,因此酶的改造存在极大的不确定性。
技术实现要素:
[0007]
本发明的目的在于提供一种耐高温且具有高逆转录效率的逆转录酶突变体。
[0008]
在本发明的第一方面,提供了一种m-mlv酶突变体,所述m-mlv酶突变体在选自下组的至少两个(可以为两个、三个、四个、或五个)位点发生突变:第446位氨基酸残基、第313位氨基酸残基、第583位氨基酸残基、第607位氨基酸残基、第221位氨基酸残基,其中氨基酸残基编号采用seq id no.1所示的编号。
[0009]
对应的野生型鼠白血病逆转录酶(m-mlv)的氨基酸序列如seq id no.1所示。
[0010]
在另一优选例中,所述m-mlv酶突变体中,第446位的氨基酸残基位点突变为cys。
[0011]
在另一优选例中,所述m-mlv酶突变体中,第313位的氨基酸残基位点突变为his或gln。
[0012]
在另一优选例中,所述m-mlv酶突变体中,第583位的氨基酸残基位点突变为asn。
[0013]
在另一优选例中,所述m-mlv酶突变体中,第607位的氨基酸残基位点突变为lys。
[0014]
在另一优选例中,所述m-mlv酶突变体中,第221位的氨基酸残基位点突变为arg。
[0015]
在另一优选例中,所述m-mlv酶突变体的氨基选序列与seq id no.1相比具有至少约80%的同源性;更优选地,具有至少约90%的同源性;最优选地,具有至少约95%的同源性;如具有至少约96%、97%、98%、99%的同源性。
[0016]
在另一优选例中,所述m-mlv酶突变体在第583位氨基酸残基、和第313位氨基酸残基发生突变。
[0017]
在另一优选例中,所述m-mlv酶突变体在第313位氨基酸残基、和第221位氨基酸残基发生突变。
[0018]
在另一优选例中,所述m-mlv酶突变体在第583位氨基酸残基、和第446位氨基酸残基发生突变。
[0019]
在另一优选例中,所述m-mlv酶突变体在第583位氨基酸残基、和第221位氨基酸残基发生突变。
[0020]
在另一优选例中,所述m-mlv酶突变体在第313位氨基酸残基、和第446位氨基酸残基发生突变。
[0021]
在另一优选例中,所述m-mlv酶突变体在第313位氨基酸残基、和第607位氨基酸残基发生突变。
[0022]
在另一优选例中,所述m-mlv酶突变体在第313位氨基酸残基、第583位氨基酸残基、和第221位氨基酸残基发生突变。
[0023]
在另一优选例中,所述m-mlv酶突变体在第313位氨基酸残基、第583位氨基酸残基、和第607位氨基酸残基发生突变。
[0024]
在另一优选例中,所述m-mlv酶突变体在第313位氨基酸残基、第583位氨基酸残基、和第446位氨基酸残基发生突变。
[0025]
在另一优选例中,与野生型相比,所述m-mlv酶突变体在高温情况下(58℃)的逆转录效率提高10倍以上,优选地提高20倍以上,更优选地提高30倍以上。
[0026]
本发明的第二方面,提供了一种多核苷酸分子,所述多核苷酸分子编码本发明第一方面所述的m-mlv酶突变体。
[0027]
本发明的第三方面,提供了一种载体,所述载体含有本发明第二方面所述的核酸分子。
[0028]
本发明的第四方面,提供了一种宿主细胞,所述宿主细胞含有本发明第一方面所述的载体或染色体整合有本发明第二方面所述的核酸分子。
[0029]
在另一优选例中,所述宿主细胞为原核细胞、或真核细胞。
[0030]
在另一优选例中,所述原核细胞为大肠杆菌。
[0031]
在另一优选例中,所述真核细胞为酵母细胞。
[0032]
本发明的第五方面,提供了一种制备本发明第一方面所述的m-mlv酶突变体的方法,包括步骤:
[0033]
(i)在适合的条件下,培养本发明第四方面所述的宿主细胞,从而表达出所述的m-mlv酶突变体;和
[0034]
(ii)分离所述的m-mlv酶突变体。
[0035]
在另一优选例中,所述步骤(i)中培养所述宿主细胞的温度为20℃-40℃;优选为25℃-37℃,如35℃。
[0036]
本发明的第六方面,提供了一种试剂盒,所述试剂盒包含本发明第一方面所述的m-mlv酶突变体。
[0037]
在另一优选例中,所述试剂盒还包含选自下组的一种或多种组分:
[0038]
dntp、缓冲液、引物、探针、和纯水。
[0039]
本发明的第七方面,提供了本发明第一方面所述的m-mlv酶突变体在制备逆转录检测试剂或逆转录试剂盒中的用途。
[0040]
本发明的第八方面,提供了一种rna逆转录方法,所述方法包括步骤:
[0041]
(1)提供含有rna的样品;
[0042]
(2)逆转录反应
[0043]
使用本发明第一方面所述的逆转录酶突变体对步骤(1)提供的含有rna的样品进行逆转录反应。
[0044]
在另一优选例中,所述步骤(2)中,逆转录反应温度为55℃以上,优选地为58℃以上。
[0045]
应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
具体实施方式
[0046]
本发明人通过广泛而深入的研究,构建了逆转录酶(m-mlv)突变库,通过逐步筛选,最终筛选出了热稳定性提高且扩增效率较高的突变体。在此基础上,完成了本发明。
[0047]
在描述本发明之前,应当理解本发明不限于所述的具体方法和实验条件,因为这类方法和条件可以变动。还应当理解本文所用的术语其目的仅在于描述具体实施方案,并且不意图是限制性的,本发明的范围将仅由所附的权利要求书限制。
[0048]
除非另外定义,否则本文中所用的全部技术与科学术语均具有如本发明所属领域的普通技术人员通常理解的相同含义。如本文所用,在提到具体列举的数值中使用时,术语“约”意指该值可以从列举的值变动不多于1%。例如,如本文所用,表述“约100”包括99和101和之间的全部值(例如,99.1、99.2、99.3、99.4等)。
[0049]
虽然在本发明的实施或测试中可以使用与本发明中所述相似或等价的任何方法和材料,本文在此处例举优选的方法和材料。
[0050]
逆转录酶
[0051]
逆转录酶(reverse transcriptase)又称为依赖rna的dna聚合酶。该酶以rna为模板,以dntp为底物,trna(主要是色氨酸trna)为引物,在trna 3'-oh末端上,根据碱基配对的原则,按5'-3'方向合成一条与rna模板互补的dna单链,这条dna单链叫做互补dna(complementary dna,cdna)。
[0052]
逆转录酶可用于合成第一链cdna、制作cdna探针、rna转录、测序和rna的逆转录反应。本领域常用的逆转录酶包括鼠白血病病毒(m-mlv)逆转录酶和禽成髓细胞瘤病毒(amv)逆转录酶。
[0053]
在本发明的一个优选地实施方式中,本发明野生型m-mlv蛋白质序列如下:
[0054]
tlniedehrlhetskepdvslgstwlsdfpqawaetggmglavrqapliiplkatstpvsikqypmsqearlgikphiqrlldqgilvpcqspwntpllpvkkpgtndyrpvqdlrevnkrvedihptvpnpynllsglppshqwytvldlkdaffclrlhptsqplfafewrdpemgisgqltwtrlpqgfknsptlfdealhrdladfriqhpdlillqyvddlllaatseldcqqgtrallqtlgnlgyrasakkaqicqkqvkylgyllkegqrwltearketvmgqptpktprqlreflgtagfcrlwipgfaemaaplypltktgtlfnwgpdqqkayqeikqalltapalglpdltkpfelfvdekqgyakgvltqklgpwrrpvaylskkldpvaagwppclrmvaaiavltkdagkltmgqplvilaphavealvkqppdrwlsnarmthyqallldtdrvqfgpvvalnpatllplpeeglqhncldilaeahgtrpdltdqplpdadhtwytdgssllqegqrkagaavtteteviwakalpagtsaqraelialtqalkmaegkklnvytdsryafatahihgeiyrrrglltsegkeiknkdeilallkalflpkrlsiihcpghqkghsaeargnrmadqaarkaaitetpdtstll(seq id no.:1)
[0055]
在本发明的一个优选地实施方式中,经密码子优化的野生型m-mlv dna序列(wt)如下:
[0056]
acgctgaatatcgaggacgaacaccgtctgcacgaaaccagcaaggagccggacgttagtctgggtagcacgtggctgagcgattttccacaagcgtgggcggaaaccggtggtatgggtctcgccgttcgccaagccccactcattatcccactgaaagccacgagcacgccggtgagcatcaagcagtacccgatgagccaagaagcccgcctcggcattaaaccgcatattcagcgtctgctggaccaaggcattctggtgccgtgccagagtccgtggaatacgccactgctcccggttaagaagccgggcaccaacgattatcgcccggttcaagacctccgcgaagtgaacaagcgcgtggaagatatccatccgaccgtgccaaatccgtacaatctgctgagtggcctcccgccgagtcatcaatggtacaccgtgctggatctcaaggatgcgtttttctgcctccgtctgcatccaaccagccagccactctttgcgtttgagtggcgcgacccagaaatgggtatcagcggtcaactgacgtggacgcgtctgccgcaaggcttcaaaaacagcccgacgctgttcgatgaggccctccatcgcgatctggcggatttccgtatccagcatccagatctgattctgctgcagtacgttgacgatctgctcctcgcggccaccagtgaactggattgccagcaaggtacccgtgcgctgctgcagacgctgggcaatctgggctaccgtgccagcgcgaaaaaggcgcaaatctgccagaagcaagttaagtacctcggttatctgctgaaagagggtcaacgctggctgaccgaggcgcgtaaagagaccgttatgggtcagccaacgccaaagacgccacgccagctccgcgaatttctgggtaccgccggcttctgtcgtctgtggattccgggcttcgcggaaatggcggcgccactctacccgctgaccaaaaccggtaccctcttcaattggggcccagatcagcagaaggcctaccaagaaattaaacaagcgctgctcaccgcgccggccctcggtctcccagatctgaccaaaccgtttgagctgttcgtggacgagaagcaaggctacgccaaaggcgtgctgacccagaaactcggtccatggcgtcgtccggtggcctacctcagtaagaaactggatccagttgcggcgggttggccgccatgtctccgtatggtggcggcgattgccgttctgaccaaagacgccggcaaactcaccatgggtcagccgctggttattctcgccccacatgcggtggaagcgctggttaaacaaccgccagaccgctggctgagcaatgcccgcatgacccattatcaagcgctgctgctggacaccgaccgcgttcagttcggtccggtggttgcgctgaatccagcgacgctgctgccgctgccagaagaaggtctgcagcacaactgtctggacattctggccgaggcccatggcacccgtccagatctcaccgatcagccactgccagacgccgatcatacgtggtacaccgatggtagtagtctgctgcaagaaggtcaacgtaaagcgggtgccgcggtgacgacggaaaccgaggtgatctgggccaaagcgctgccagcgggtaccagcgcgcaacgtgcggaactgatcgcgctgacccaagcgctcaaaatggccgagggcaagaaactcaacgtg
tacaccgacagtcgctacgcgtttgcgaccgcgcacatccacggtgagatttatcgccgccgtggtctgctcacgagcgaaggtaaggagatcaagaataaggacgagatcctcgcgctgctgaaagccctctttctgccgaaacgtctgagcatcatccattgcccgggtcaccagaagggccacagtgcggaagcgcgcggtaatcgcatggccgatcaagccgcgcgcaaagcggcgattacggaaaccccggatacgagcacgctgctg(seq id no.:2)
[0057]
突变体的筛选和制备
[0058]
本发明计算单点突变后酶分子的吉布斯自由能变的变化值(ddg),以此衡量突变后分子稳定性的变化。ddg值(delta delta g)是分子的吉布斯自由能变的变化值,蛋白质分子从正常的折叠状态向无规则卷曲状态转变的过程需要消耗能量,此能量的值为δg值,δg值的高低可用于衡量蛋白质的稳定性,δg值越高,蛋白质变性所需要消耗的能量越多,使蛋白发生变性的温度越高,蛋白越稳定。
[0059]
蛋白质经过定点突变,各氨基酸相互作用发生变化,使δg值发生改变,野生型蛋白的δg值与突变体的δg值的差值即为ddg值。ddg值》0,说明突变后蛋白的δg值比野生型降低,蛋白更不稳定;ddg值《0,说明突变后蛋白δg值比野生型升高,蛋白更稳定。因此ddg值可用于预测蛋白质发生定点突变后结构的稳定性变化。从一系列的突变体中选出ddg值较高的突变,构建mmlv蛋白突变库,经过表达纯化,测定突变后mmlv的活性及热稳定性,筛选出具有高活性高热稳定性的单点突变体。但是由于蛋白结构地复杂性,不可能仅通过预测来获得符合实际应用需求的突变体,而且在大多数情况下模拟预测出的突变体均会导致酶活性的显著降低。
[0060]
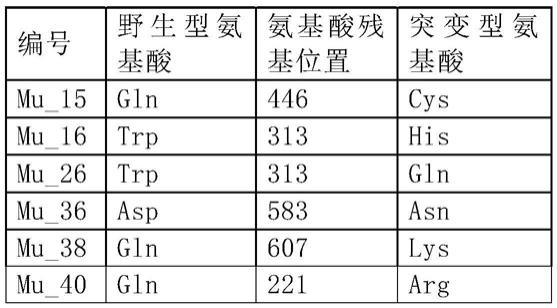
经过大量筛选,本发明筛选出了6个可使m-mlv酶获得耐高温和高活性的突变位点如下:
[0061][0062]
对以上6个突变位点进行组合,构建了10个mmlv突变体,得到了比以上6个单点突变性能更优的mmlv突变体。
[0063]
因此,在本发明的一个优选地实施方式中,本发明提供了一种m-mlv酶突变体,所述m-mlv酶突变体在选自下组的至少两个(可以为两个、三个、四个、或五个)位点发生突变:第446位氨基酸残基、第313位氨基酸残基、第583位氨基酸残基、第607位氨基酸残基、第221位氨基酸残基,其中氨基酸残基编号采用seq id no.1所示的编号。
[0064]
在一个优选地实施方式中,本发明的m-mlv酶突变体如下:
[0065][0066]
与野生型相比,所述m-mlv酶突变体在高温情况下(58℃)的逆转录效率提高10倍以上,优选地提高20倍以上,更优选地提高30倍以上。
[0067]
在一个优选地实施方式中,逆转录效率测试方法如下:
[0068]
从hela细胞中提取总rna为模板,按以下体系进行逆转录反应
[0069][0070][0071]
将野生型和突变体mmlv蛋白按以上体系进行反应,58℃15分钟,75℃5分钟灭活;然后取逆转录后产物,按以下体系进行荧光定量pcr检测
[0072][0073]
q-pcr程序:95℃3分钟,(95℃15秒,60℃15秒,72℃15秒读取荧光信号)x40个循环。
[0074]
以野生型逆转录酶效率为100%,与野生型逆转录酶的反应效率对比,突变型的逆转录效率计算公式如下:
[0075][0076]
其中,random 6随机引物序列如下:
[0077]
nnnnnn(n=a或t或g或c)
[0078]
gapdh-pf引物序列如下:
[0079]
gcctgcttcaccaccttctt(seq id no.:3)
[0080]
gapdh-pr引物序列如下:
[0081]
tgaacgggaagctcactggc(seq id no.:4)
[0082]
本领域的普通技术人员可以使用的常规方法获得本发明的m-mlv酶基因序列,例如全人工合成或pcr法合成。一种优选的合成法为不对称pcr法。不对称pcr法是用不等量的一对引物,pcr扩增后产生大量的单链dna(ssdna)。这对引物分别称为非限制引物与限制性引物,其比例一般为50-100∶1。在pcr反应的最初10-15个循环中,其扩增产物主要是双链dna,但当限制性引物(低浓度引物)消耗完后,非限制性引物(高浓度引物)引导的pcr就会产生大量的单链dna。用于pcr的引物可根据本文所公开的本发明的序列信息适当地选择,并可用常规方法合成。可用常规方法如通过凝胶电泳分离和纯化扩增的dna/rna片段。
[0083]
本发明的m-mlv酶突变体可以通过常规的重组dna技术进行表达或生产,包括步骤:
[0084]
(1)用编码本发明蛋白的多核苷酸,或用含有该多核苷酸的重组表达载体转化或转导合适的宿主细胞;
[0085]
(2)在合适的培养基中培养宿主细胞;
[0086]
(3)从培养基或细胞中分离、纯化目的蛋白质,从而获得m-mlv酶突变体。
[0087]
本领域的技术人员熟知的方法能用于构建含本发明m-mlv酶的编码dna序列和合适的转录/翻译控制信号的表达载体,优选市售的载体:pet28。这些方法包括体外重组dna技术、dna合成技术、体内重组技术等。所述的dna序列可有效连接到表达载体中的适当启动子上,以指导mrna合成。表达载体还包括翻译起始用的核糖体结合位点和转录终止子。此外,表达载体优选包含一个或多个选择性标记基因,以提供用于选择转化的宿主细胞的表型性状。
[0088]
所述重组载体在5'到3'方向上包括:启动子,目的基因和终止子。如果需要,所述重组载体还可以包括以下元件:蛋白纯化标签;3'多聚核苷酸化信号;非翻译核酸序列;转运和靶向核酸序列;选择标记(抗生素抗性基因、荧光蛋白等);增强子;或操作子。
[0089]
用于制备重组载体的方法是本领域普通技术人员所熟知的。表达载体可以是细菌
质粒、噬菌体、酵母质粒、植物细胞病毒、哺乳动物细胞病毒或其他载体。总之,只要其能够在宿主体内复制和稳定,任何质粒和载体都可以被采用。
[0090]
本领域普通技术人员可以采用熟知的方法构建含有本发明启动子和/或目的基因序列的载体。这些方法包括体外重组dna技术、dna合成技术、体内重组技术等。
[0091]
本发明的表达载体,可以用于转化适当的宿主细胞,以使宿主转录目的rna或表达目的蛋白质。宿主细胞可以是原核细胞,如大肠杆菌、谷氨酸棒杆菌、黄色短杆菌、链霉菌属、农杆菌:或是低等真核细胞,如酵母细胞;或是高等真核细胞,如植物细胞。本领域一般技术人员都清楚如何选择适当的载体和宿主细胞。用重组dna转化宿主细胞可用本领域技术人员熟知的常规技术进行。当宿主为原核生物(如大肠杆菌)时,可以用cacl2法处理,也可用电穿孔法进行。当宿主是真核生物,可选用如下的dna转染方法:磷酸钙共沉淀法,常规机械方法(如显微注射、电穿孔、脂质体包装等)。转化植物也可使用农杆菌转化或基因枪转化等方法,例如叶盘法、幼胚转化法、花芽浸泡法等。对于转化的植物细胞、组织或器官可以用常规方法再生成植株,从而获得转基因的植物。
[0092]
术语“可操作连接”是指将准备转录表达的目的基因以一种本领域的常规方式连接到它的控制序列以被表达。
[0093]
工程菌的培养和目的蛋白发酵生产
[0094]
在获得工程细胞后,便可在适合的条件下培养工程细胞,表达本发明的基因序列所编码的蛋白。根据宿主细胞的不同,培养中所用的培养基可选自各种常规培养基,在适于宿主细胞生长的条件下进行培养。当宿主细胞生长到适当的细胞密度后,用合适的方法(如温度转换或化学诱导)诱导选择的启动子,将细胞再培养一段时间。
[0095]
在本发明中,可采用常规的发酵条件。代表性的条件包括(但并不限于):
[0096]
(a)就温度而言,m-mlv酶的发酵及诱导温度保持在25-37℃;
[0097]
(b)就诱导期的ph值而言,诱导期ph控制在3-9;
[0098]
(c)就溶氧(do)而言,do控制在10-90%,溶氧的维持可以用氧气/空气混合气体的通入来解决;
[0099]
(d)就补料而言,补料种类宜包括甘油、甲醇、葡萄糖等碳源,可单独补料或混合补料;
[0100]
(e)就诱导期iptg浓度而言,常规诱导浓度都可用于本发明,通常iptg浓度控制在0.1-1.5mm;
[0101]
(f)就诱导时间而言,没有特别限制,通常为2-20小时,较佳地为5-15小时。
[0102]
本发明的目的蛋白m-mlv酶存在大肠杆菌细胞胞内,通过离心机收集宿主细胞,然后通过高压、机器力、酶解细胞被或其他细胞破碎方法破碎宿主细胞,释放重组蛋白,优选的是高压法。宿主细胞裂解液可通过絮凝、盐析、超滤等方法进行初步纯化后再进行层析、超滤等纯化,也可直接进行层析纯化。
[0103]
层析技术包括阳离子交换层析、阴离子交换层析、凝胶过滤层析、疏水层析、亲和层析等技术。常用的层析方法包括:
[0104]
1.阴离子交换层析:
[0105]
阴离子交换层析介质包括(但不限于):q-sepharose、deae-sepharose。如果发酵样品的盐浓度较高,影响与离子交换介质的结合,则在进行离子交换层析前需降低盐浓度。
样品可以用稀释、超滤、透析、凝胶过滤层析等手段进行平衡缓冲液的更换,直至与对应的离子交换柱平衡液系统相似,然后上样,进行盐浓度或ph的梯度洗脱。
[0106]
2.疏水层析:
[0107]
疏水层析介质包括(但不限于):phenyl-sepharose、butyl-sepharose、octyle-sepharose。样品通过添加nacl、(nh4)2so4等方式提高盐浓度,然后上样,通过降低盐浓度方法洗脱。通过疏水层析除去疏水性有较大差异的杂蛋白。
[0108]
3.凝胶过滤层析
[0109]
疏水层析介质包括(但不限于):sephacryl、superdex、sephadex类。通过凝胶过滤层析更换缓冲体系,或进一步精纯。
[0110]
4.亲和层析
[0111]
亲和层析介质包括(但不限于):hitrap
tm
heparinhpcolumns。
[0112]
5.膜过滤
[0113]
超滤介质包括:有机膜如聚砜膜、无机膜如陶瓷膜、金属膜类。通过膜过滤可以达到纯化和浓缩的目的。
[0114]
本发明的主要优点在于:
[0115]
(1)本发明提供了耐高温且具有高逆转录效率的逆转录酶突变体。
[0116]
(2)本发明的具有高逆转录效率的逆转录酶突变体在同等条件下扩增效率比野生型m-mlv酶有显著的提高,因此能够显著提高检测效率。
[0117]
(3)本发明从数十个突变体中进行多轮筛选,筛选出了6株单突变耐高温的逆转录酶突变体,在58℃的逆转录温度下仍然能够保持较高的逆转录效率。而且,其中3株耐高温的逆转录酶突变体在1分钟反应时间内即可达到反应平衡。因此,本发明筛选获得的各逆转录酶突变体具有出乎意料的优异技术效果。
[0118]
(4)对单突变位点进行组合获得含多突变位点的耐高温的逆转录酶突变体,与单突变逆转录酶突变体相比,本发明的含多突变位点的耐高温的逆转录酶突变体的逆转录效率进一步提高,优势突变位点的组合有助于提高m-mlv酶的综合性能。
[0119]
下面结合具体实施例,进一步详陈本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明详细条件的实验方法,通常按照常规条件如美国sambrook.j等著《分子克隆实验室指南》(黄培堂等译,北京:科学出版社,2002年)中所述的条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数按重量计算。以下实施例中所用的实验材料和试剂如无特别说明均可从市售渠道获得。
[0120]
实施例1各位点ddg值的计算及筛选
[0121]
将mmlv蛋白质序列输入rosetta算法软件cyrus bench(cyrus biotechnology),对0~100,101~200,201~300,301~400,401~500,501~600,601~671位氨基酸分段进行全位点全突变的ddg值计算,得到ddg值显著降低(ddg值《-2)的突变位点信息如下:
[0122]
表1
[0123]
[0124][0125]
实施例2构建mmlv突变库
[0126]
根据以上蛋白质序列,由苏州金唯智生物科技有限公司进行密码子优化,编译出dna序列(seq id no.:2)。
[0127]
由苏州金唯智生物科技有限公司根据以上dna序列进行基因合成,添加5'(nhei)及3'(xhoi)限制性酶切位点,将基因通过5'nhei and 3'xhoi克隆至载体pet28a,构建质粒wt-pet28a,制备重组质粒dna和含有该重组质粒的甘油菌,并根据实施例1所涉及的突变位点对质粒wt-pet28a进行定点突变,构建出突变库mu1-pet28a~mu40-pet28a。
[0128]
实施例3 mmlv突变体的表达及纯化
[0129]
将wt-pet28a,mu1~40-pet28a质粒转化至bl21(de3)感受态细胞,得到37个表达宿主菌,然后转接3ml lb培养基,37℃震荡培养5小时,然后加入0.1mm iptg 18℃诱导培养过夜。收集诱导后菌体,加入裂解液(50mm tris、50mm nacl、ph7.5),超声裂解,离心分离上清液。取上清液,经ni nta金属离子螯合填料纯化,得到野生型和40种突变mmlv蛋白
[0130]
实施例4突变体的筛选
[0131]
a:第一轮筛选(筛选保持活性的突变)
[0132]
从hela细胞中提取总rna为模板,按以下体系进行逆转录反应
[0133][0134]
将野生型和36个突变体mmlv蛋白按以上体系进行反应,42℃15分钟,75℃5分钟灭活。然后取逆转录后产物,按以下体系进行荧光定量pcr检测
[0135][0136]
q-pcr程序:95℃3分钟,(95℃15秒,60℃15秒,72℃15秒读取荧光信号)x40个循环。
[0137]
各突变体逆转录产物荧光定量pcr结果见下表:
[0138]
表2
[0139][0140]
下划线标记的14个突变体ct值低于野生型,即逆转录效率高于野生型。选择这些突变体进行第二轮筛选
[0141]
b:第二轮筛选(筛选耐高温突变)
[0142]
选第一轮筛选选出的突变体,按第一轮筛选的逆转录反应体系,提高逆转录反应温度至50、55、58℃,然后按第一轮筛选的荧光定量pcr体系进行逆转录效率检测,结果如下:
[0143]
表3
[0144]
[0145][0146]
备注:以野生型逆转录酶效率为100%,与野生型逆转录酶的反应效率对比,突变型的逆转录效率计算公式如下:
[0147][0148]
从第二轮筛选结果看,mu_15、16、26、36、38、40,6个突变体58℃下逆转录效率不低于50℃逆转录。选这6个突变体进行第三轮筛选。
[0149]
c:第三轮筛选(筛选高合成速率突变)
[0150]
选第二轮筛选选出的突变体,按第一轮筛选的逆转录反应体系,逆转录反应温度55℃,反应时间1分钟、2分钟、5分钟,然后按第一轮筛选的荧光定量pcr体系进行逆转录效率检测,结果如下:
[0151]
表4
[0152]
组别1min/ct mean2min/ct mean5min/ct meanwt24.8822.9921.851522.2420.2819.171620.0119.2519.472621.1720.7917.723617.6417.9217.933821.1520.7320.144018.9519.0018.34
[0153]
从第三轮筛选的结果看,mu_16、36、40逆转录反应1分钟与5分钟的差异不大,证明反应1分钟后反应即达到平衡。
[0154]
实施例5
[0155]
上述实施例中筛选出了6个可使m-mlv酶获得耐高温和高活性的突变位点如下:
[0156][0157]
[0158]
本实施例对以上6个突变位点进行组合,构建了10个mmlv突变体,期望得到比以上6个单点突变性能更优的mmlv突变体。
[0159]
按照下表的突变位点设计,在野生型mmlv蛋白质序列上进行突变。
[0160]
野生型mmlv蛋白质序列如seq id no.:1所示。
[0161][0162]
根据以上蛋白质序列,由苏州金唯智生物科技有限公司进行密码子优化,编译出dna序列,野生型mmlv dna序列(wt)如seq id no.:2所示。
[0163]
由苏州金唯智生物科技有限公司根据以上dna序列进行基因合成,添加5'(nhei)及3'(xhoi)限制性酶切位点,将基因通过5'nhei and 3'xhoi克隆至载体pet28a,构建质粒wt-pet28a,制备重组质粒dna和含有该重组质粒的甘油菌,并根据所涉及的突变位点对质粒wt-pet28a进行定点突变,构建出突变库mu41-pet28a至mu50-pet28a
[0164]
实施例6 mmlv突变体的表达及纯化
[0165]
将mu41至mu50-pet28a质粒转化至bl21(de3)感受态细胞,得到37个表达宿主菌,然后转接3ml lb培养基,37℃震荡培养5小时,然后加入0.1mm iptg18℃诱导培养过夜。收集诱导后菌体,加入裂解液(50mm tris、50mm nacl、ph7.5),超声裂解,离心分离上清液。取
上清液,经ni nta金属离子螯合填料纯化,得到10种突变mmlv蛋白
[0166]
实施例7 10种突变酶与单点突变mmlv的耐热性能对比
[0167]
取浓度为200u/ul的mu41至mu50 10种突变酶蛋白,及mu_15、16、26、36、38、和40共6种mmlv突变酶蛋白,放置于50℃恒温金属浴下处理60分钟,同时进行50℃、55℃、60℃、65℃及70℃的恒温金属浴上加热15分钟,然后与未经加热处理的酶样品一起进行逆转录反应。从hela细胞中提取总rna为模板,逆转录反应体系如下:
[0168][0169]
42℃15分钟,95℃5分钟灭活。然后取逆转录后产物,按以下体系进行荧光定量pcr检测
[0170][0171]
q-pcr程序:95℃3分钟,(95℃15秒,60℃15秒,72℃15秒读取荧光信号)x40个循环。
[0172]
荧光定量pcr结果(ct值)见下表:
[0173]
[0174][0175]
从以上结果可见,组合突变的mu_40至mu_50在55℃以上温度下比单点突变体稳定性高。在50℃下处理1小时,酶的逆转录性能基本没有改变。
[0176]
实施例8 10种突变酶与单点突变mmlv的反应速率对比
[0177]
按上述实施例7的逆转录反应体系进行逆转录反应,反应温度55℃,逆转录时间分别为30秒、1分钟、2分钟、3分钟,对逆转录产物进行荧光定量pcr检测,反应体系同实施例3。ct值结果如下:
[0178][0179]
从上述结果可见,mu_42、mu_45、mu_47、mu_48、mu_49在反应1分钟后ct值即与反应2、3分钟基本没有差异,因此判断其反应1分钟后即达到平衡。10个组合突变体在相同反应时间下的ct值均小于单点突变体,证明优势突变位点的组合有助于提高m-mlv酶的综合性能。
[0180]
实施例9在新冠病毒核酸检测中的应用
[0181]
本实施例提供了筛选出的组合突变体m-mlv酶在新型冠状病毒(2019-ncov)检测试剂上的应用。
[0182]
采用荧光定量pcr法检测2019-ncov病毒的orf1ab基因及n基因的序列,使用的引
物及探针序列信息如下:
[0183]
target 1(orf1ab):
[0184]
正向引物(f):ccctgtgggttttacacttaa(seq id no.:5)
[0185]
反向引物(r):acgattgtgcatcagctga(seq id no.:6)
[0186]
荧光探针(p):5'-fam-ccgtctgcggtatgtggaaaggttatgg-bhq1-3'(seq id no.:7)
[0187]
target 2(n):
[0188]
正向引物(f):ggggaacttctcctgctagaat(seq id no.:8)
[0189]
反向引物(r):cagacattttgctctcaagctg(seq id no.:9)
[0190]
荧光探针(p):5'-fam-ttgctgctgcttgacagatt-tamra-3'(seq id no.:10)
[0191]
配制反应体系如下:
[0192][0193]
配制好反应体系后,进行rt-pcr反应如下:55℃5分钟,95℃2分钟,(95℃30秒;68℃1分钟读取荧光)
×
40循环。结果如下:
[0194][0195]
对比5种组合突变酶与野生型m-mlv酶的ct差值(δct),计算与野生型m-mlv酶在orf1ab及n基因扩增效率的差异倍数如下:
[0196]
[0197]
从不同的组合突变体mmlv和野生型m-mlv酶对新冠参考品样品的扩增ct值看,突变体的扩增效率比野生型有明显提高。
[0198]
在本发明提及的所有文献都在本技术中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本技术所附权利要求书所限定的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1