调节性多核苷酸的制作方法
调节性多核苷酸
[0001]
本申请是申请号为201580073443.6,申请日为2015年11月13日,发明名称为“调节性多核苷酸”的中国专利申请的分案申请。
[0002]
相关申请的交叉引用
[0003]
本申请要求2014年11月14日提交的标题为modulatory polynucleotides的美国临时专利申请号62/079,590、2015年8月31日提交的标题为modulatory polynucleotides的美国临时专利申请号62/212,004、2015年9月29日提交的标题为modulatory polynucleotides的美国临时专利申请号62/234,477的权益;它们中的每一篇的内容通过引用整体并入本文。
[0004]
对序列表的参考
[0005]
本申请与电子形式的序列表一起提交。所述序列表作为2015年11月12日创建的标题为1014pctsl.txt的文件提供,其大小为235,330字节。电子形式的序列表中的信息通过引用整体并入本文。
技术领域
[0006]
本发明涉及用于设计、制备、生产和/或配制调节性多核苷酸的组合物、方法、工艺、试剂盒和装置。在某些实施方案中,这样的调节性多核苷酸可以由重组腺伴随病毒(aav)编码或者在重组腺伴随病毒(aav)内,且可以包含人工微rna(microrna)、人工前-微rna(pre-microrna)和/或人工初级-微rna(pri-microrna)。
背景技术:
[0007]
微rna(或mirna或mir)是小的、非编码的、单链核糖核酸分子(rna),其经常是19-25个核苷酸的长度。已经在哺乳动物基因组中鉴别出超过1000种微rna。成熟的微rna主要通过部分地或完全地与靶mrna的互补序列配对而结合靶信使rna(mrna)的3’非翻译区(3
’-
utr),从而在转录后水平促进靶mrna的降解,且在某些情况下,抑制翻译的起始。微rna在许多关键生物学过程(诸如细胞周期和生长的调节、细胞凋亡、细胞增殖和组织发育)中起关键作用。
[0008]
mirna基因通常被转录为mirna的长初级转录物(即初级-mirna(pri-mirna))。初级-mirna被切割成mirna的前体(即前-mirna(pre-mirna)),其被进一步加工以产生成熟的和功能性的mirna。
[0009]
尽管许多靶标表达策略采用基于核酸的模态(modality),仍然需要改进的具有更高特异性且具有更少脱靶效应的核酸模态。
[0010]
本发明提供了呈人工初级-、前-和成熟的微rna构建体的形式的这样的改进的模态以及它们的设计方法。这些新颖的构建体可以是合成的独立分子,或者在用于递送至细胞的质粒或表达载体中编码。这样的载体包括但不限于腺伴随病毒载体诸如任一种aav血清型的载体基因组,或其它病毒递送媒介物诸如慢病毒等。
技术实现要素:
[0011]
本文描述了用于设计、制备、生产和/或配制调节性多核苷酸的组合物、方法、工艺、试剂盒和装置。
[0012]
在某些实施方案中,这样的调节性多核苷酸可以由质粒或载体或重组腺伴随病毒(aav)编码或者被包含在质粒或载体或重组腺伴随病毒(aav)内,且可以包含人工微rna、人工前-微rna和/或人工初级-微rna。
[0013]
在下面的描述中阐述了本发明不同实施方案的细节。从描述和附图以及从权利要求书中会明白本发明的其它特征、目的和优点。
附图说明
[0014]
从附图所示的本发明的特定实施方案的以下描述会明白前述和其它目标、特征和优点,在附图中,在不同的视图中相同的附图标记表示相同的部件。附图不一定按比例,而是将重点放在解释本发明的各个实施方案的原理。
[0015]
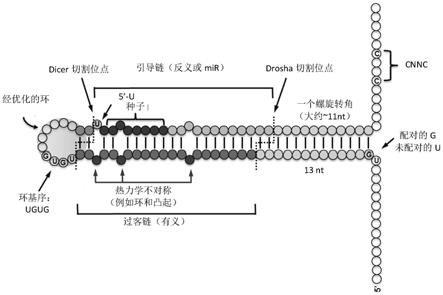
图1是根据本发明在aav载体中编码的人工初级-微rna的示意图。
[0016]
图2的直方图显示了在aav载体中编码的初级-mrna构建体的活性。
[0017]
图3的直方图显示了在aav载体中编码的调节性多核苷酸的引导链在hek293t细胞中的活性。
[0018]
图4的直方图显示了在aav载体中编码的调节性多核苷酸的过客链在hek293t细胞中的活性。
[0019]
图5的直方图显示了在aav载体中编码的调节性多核苷酸的引导链在hela细胞中的活性。
[0020]
图6的直方图显示了在aav载体中编码的调节性多核苷酸的过客链在hela细胞中的活性。
[0021]
图7是表达的细胞内aav dna的定量的直方图。
[0022]
图8的直方图显示了在aav载体中编码的构建体在人运动神经元中的活性。
[0023]
图9的图显示了u251mg细胞中的剂量依赖性的sod1沉默。
[0024]
图10的图显示了人星形胶质细胞中的剂量依赖性的sod1沉默。
[0025]
图11的图显示了在u251mg细胞中sod1沉默的时程。
[0026]
图12包含图12a、图12b和图12c,它们是显示构建体的剂量依赖性作用的图。图12a显示了相对sod1表达。图12b显示了引导链的百分比。图12c显示了过客链的百分比。
[0027]
图13的简图显示了调节性多核苷酸(mp)相对于itr、内含子(i)和聚腺苷酸(p)的位置。
具体实施方式
[0028]
本发明的组合物
[0029]
根据本发明,提供了作为人工微rna起作用的调节性多核苷酸。本文中使用的“调节性多核苷酸”是起作用以调节(增加或降低)靶基因的水平或量的任何核酸聚合物。调节性多核苷酸包括在调节之前在细胞内加工的前体分子。调节性多核苷酸或其加工形式可以在质粒、载体、基因组或用于递送至细胞的其它核酸表达载体中编码。
[0030]
在某些实施方案中,将调节性多核苷酸设计为初级微rna(初级-mir)或前体微rna(前-mir),它们在细胞内加工以产生高度特异性的人工微rna。
[0031]
基于经典的(canonical)或已知的微rna、初级-微rna或前-微rna的序列或结构支架,可以设计调节性多核苷酸,特别是本发明的人工微rna。这样的序列可以对应任何已知的微rna或它的前体,诸如在美国公开us2005/0261218和美国公开us2005/0059005(其内容通过引用整体并入本文)中教导的那些。
[0032]
微rna(或mirna或mir)是19-25个核苷酸长的非编码rna,其结合核酸分子的3
′
utr并下调基因表达(通过降低核酸分子稳定性或通过抑制翻译)。本发明的调节性多核苷酸可以包含一种或多种微rna序列、微rna种子或人工微rna,例如,作为微rna起作用的序列。
[0033]
微rna序列包含“种子”区域,即,在成熟的微rna的位置2-9的区域中的序列,所述序列与mirna靶序列具有完美的沃森-克里克互补性。微rna种子可以包含成熟的微rna的位置2-8或2-7或2-9。在某些实施方案中,微rna种子可以包含7个核苷酸(例如,成熟的微rna的核苷酸2-8),其中在对应的mirna靶标中的种子互补位点侧接与微rna位置1相对的腺嘌呤(a)。在某些实施方案中,微rna种子可以包含6个核苷酸(例如,成熟的微rna的核苷酸2-7),其中在对应的mirna靶标中的种子互补位点侧接与微rna位置1相对的腺嘌呤(a)。参见例如,grimson a,farh kk,johnston wk,garrett-engele p,lim lp,bartel dp;mol cell.2007年7月6日;27(1):91-105;它们中的每一篇通过引用整体并入本文。在天然存在的微rna中,微rna种子的碱基与靶序列具有完全互补性。
[0034]
如本文中教导的,已经鉴别出设计参数或规则并应用于设计具有优良靶基因调节性能和有限脱靶效应的调节性多核苷酸(例如,人工微rna)。
[0035]
在一个实施方案中,可以设计并优化本文描述的调节性多核苷酸的分子支架以建立具有期望的靶基因调节性能的调节性多核苷酸。作为一个非限制性实施例,所述调节性多核苷酸可以具有优良靶基因调节性能和有限脱靶效应。
[0036]
在一个实施方案中,本发明的调节性多核苷酸(诸如人工mir)包含根据一组规则组装的模块元件或序列基序,所述规则导致高度特异性的靶标识别和低引导/过客比率。这样的模块或序列基序包括但不限于双链区域、侧接区域、环、经优化的环、ugug环、gu结构域、间隔物(以控制近侧的和远侧的基序或模块间距,或引入诸如转角、环或凸起的结构元件)、cnnc基序和热力学不对称区域,它们可能包括环、凸起、错配、摆动和/或它们的组合。当构建人工mir时可以单独或联合应用的规则的非限制性例子包括在以下文献中教导的那些:seitz等人.silence 2011,2:4;gu,等人,cell 151,900-911,2012年11月9日;schwartz,等人,cell,第115卷,199-208,2003年10月17日;park,等人,nature,第475卷,101,2011年7月14日;ketley等人,2013,plos one 8(6);liu,等人,nucleic acids research,2008,第36卷,第9期2811-2824;dow,等人,2013,nat protoc.;7(2):374-393.doi:10.1038/nprot.2011.446;auyeung,等人,cell 152,844-858,2013年2月14日;gu等人,cell 2012年11月9日,151(4):900-11;fellmann等人.molecular cell 41,733-746,2011;han等人.cell 125,887-907,2006;betancur等人.frontiers in genetics,第3卷,art.127,2012年7月1-6日;schwarz等人.cell第115卷,199-208,2003;它们中的每一篇的内容通过引用整体并入本文。
[0037]
除了所述模块或序列基序以外,调节性多核苷酸还包含过客和引导链中的至少一
个或二者。所述过客和引导链可定位或位于所述调节性多核苷酸的茎环结构的5’臂或3’臂上。
[0038]
在一个实施方案中,所述调节性多核苷酸的3’茎臂可以具有在所述引导链的3’末端下游的11个核苷酸,它们与5’茎臂中的过客链的5’末端上游的13个核苷酸中的11个具有互补性。
[0039]
在一个实施方案中,所述调节性多核苷酸可以具有半胱氨酸,其是在所述调节性多核苷酸的3’茎臂的3’末端下游6个核苷酸。
[0040]
在一个实施方案中,所述调节性多核苷酸包含引导链的mirna种子匹配。在另一个实施方案中,所述调节性多核苷酸包含过客链的mirna种子匹配。在另一个实施方案中,所述调节性多核苷酸不包含引导链或过客链的种子匹配。
[0041]
在一个实施方案中,所述调节性多核苷酸可能几乎不具有引导链的显著全长脱靶。在另一个实施方案中,所述调节性多核苷酸可能几乎不具有过客链的显著全长脱靶。在另一个实施方案中,所述调节性多核苷酸可能几乎不具有引导链或过客链的显著全长脱靶。
[0042]
在一个实施方案中,所述调节性多核苷酸可能具有高体外活性。在另一个实施方案中,所述调节性多核苷酸可能具有低体外活性。在另一个实施方案中,所述调节性多核苷酸可能在体外具有高引导链活性和低过客链活性。
[0043]
在一个实施方案中,所述调节性多核苷酸在体外具有高引导链活性和低过客链活性。由引导链实现的靶标敲降(kd)可以是至少60%、65%、70%、75%、80%、85%、90%、95%、99%、99.5%或100%。由引导链实现的靶标敲降可以是60-65%、60-70%、60-75%、60-80%、60-85%、60-90%、60-95%、60-99%、60-99.5%、60-100%、65-70%、65-75%、65-80%、65-85%、65-90%、65-95%、65-99%、65-99.5%、65-100%、70-75%、70-80%、70-85%、70-90%、70-95%、70-99%、70-99.5%、70-100%、75-80%、75-85%、75-90%、75-95%、75-99%、75-99.5%、75-100%、80-85%、80-90%、80-95%、80-99%、80-99.5%、80-100%、85-90%、85-95%、85-99%、85-99.5%、85-100%、90-95%、90-99%、90-99.5%、90-100%、95-99%、95-99.5%、95-100%、99-99.5%、99-100%或99.5-100%。作为一个非限制性实施例,由引导链实现的靶标敲降(kd)是大于70%。
[0044]
在一个实施方案中,过客链关于最近脱靶的ic
50
大于引导链关于靶标的ic
50
的100倍。作为一个非限制性实施例,如果过客链关于最近脱靶的ic
50
大于引导链关于靶标的ic
50
的100倍,那么就说所述调节性多核苷酸在体外具有高引导链活性和低过客链活性。
[0045]
在一个实施方案中,所述引导链的5’加工具有在5’末端处的以下正确开始(correct start)(n):在体外或在体内的时间的至少75%、80%、85%、90%、95%、99%或100%。作为非限制性实施例,所述引导链的5’加工是精确的且具有在5’末端处的以下正确开始(n):在体外的时间的至少99%。作为非限制性实施例,所述引导链的5’加工是精确的且具有在5’末端处的以下正确开始(n):在体内的时间的至少99%。
[0046]
在一个实施方案中,引导链与过客链(g:p)比率是体外或体内1:99、5:95、10:90、15:85、20:80、25:75、30:70、35:65、40:60、45:55、50:50、55:45、60:40、65:35、70:30、75:25、80:20、85:15、90:10、95:5或99:1。作为非限制性实施例,所述引导链与过客链比率是体外80:20。作为非限制性实施例,所述引导链与过客链比率是体内80:20。
[0047]
在一个实施方案中,所述载体基因组的完整性是所述构建体的全长的至少60%、65%、70%、75%、80%、85%、90%、95%、99%或超过99%。
[0048]
调节性多核苷酸
[0049]
在一个实施方案中,任何已知的rnai构建体或rnai剂可以充当用于设计本发明的调节性多核苷酸或人工微rna的过客和/或引导链的开始构建体。这些包括经典sirna、小干扰rna(sirna)、双链rna(dsrna)、反向重复序列、短发夹rna(shrna)、小的暂时调节的rna(strna)、成簇的抑制性rna(crna)(包括放射状的成簇的抑制性rna、不对称的成簇的抑制性rna、直链的成簇的抑制性rna和复杂的或复合的成簇的抑制性rna)、dicer底物、dna-指导的rnai(ddrnai)、单链rnai(ssrnai)、微rna(mirna)拮抗剂、微rna模仿物(mimics)、微rna激动剂、blockmirs(又名xmirs)、微rna模拟物(mimetics)、微rna添加(addbacks)、supermir、在pct公开wo/2005/013901(其内容整体并入本文中)中公开的寡聚体构建体、诸如在美国公开20090131360(其内容整体并入本文中)中公开的那些的三联rnai构建体、在pct公开wo/2010/011346(其内容通过引用整体并入本文)中公开的单独-rxrna构建体;在pct公开wo/2010/033247(其内容通过引用整体并入本文)中公开的sd-rxrna构建体,降低rna水平并且也调节免疫应答的双效rnai构建体(公开在pct公开wo/2010/002851和wo/2009/141146中,其内容通过引用整体并入本文),和增加设计它们时所针对的靶标的表达的抗原rna(agrna)或小活化rna(sarna)(公开在pct公开wo/2006/130201、wo/2007/086990、wo/2009/046397、wo/2009/149182、wo/2009/086428中,其内容通过引用整体并入本文)。
[0050]
同样地,上面列出的微rna的任何初级-或前-微rna前体也可以充当本发明的调节性多核苷酸的分子支架。
[0051]
在一个实施方案中,所述开始构建体可以源自任何有关的物种,例如,不限于,小鼠、大鼠、狗、猴或人。
[0052]
在一个实施方案中,所述调节性多核苷酸可以位于启动子(例如,但不限于,cmv、u6、cba或具有sv40内含子的cba启动子)下游的表达载体中。另外,调节性多核苷酸还可以在表达载体中位于多腺苷酸化序列的上游。作为一个非限制性实施例,调节性多核苷酸可以在表达载体中位于启动子下游和/或多腺苷酸化序列上游1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30或超过30个核苷酸内。作为另一个非限制性实施例,调节性多核苷酸可以在表达载体中位于启动子下游和/或多腺苷酸化序列上游1-5、1-10、1-15、1-20、1-25、1-30、5-10、5-15、5-20、5-25、5-30、10-15、10-20、10-25、10-30、15-20、15-25、15-30、20-25、20-30或25-30个核苷酸内。作为一个非限制性实施例,调节性多核苷酸可以在表达载体中位于启动子下游和/或多腺苷酸化序列上游前1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、25%或超过25%的核苷酸内。作为另一个非限制性实施例,调节性多核苷酸可以在表达载体中位于启动子下游和/或多腺苷酸化序列上游前1-5%、1-10%、1-15%、1-20%、1-25%、5-10%、5-15%、5-20%、5-25%、10-15%、10-20%、10-25%、15-20%、15-25%或20-25%的核苷酸内。
[0053]
在一个实施方案中,所述调节性多核苷酸可以在表达载体中位于多腺苷酸化序列的上游。另外,调节性多核苷酸可以在表达载体中位于启动子(例如,但不限于,cmv、u6、cba或具有sv40内含子的cba启动子)的下游。作为一个非限制性实施例,调节性多核苷酸可以
在表达载体中位于启动子下游和/或多腺苷酸化序列上游1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30或超过30个核苷酸内。作为另一个非限制性实施例,调节性多核苷酸可以在表达载体中位于启动子下游和/或多腺苷酸化序列上游1-5、1-10、1-15、1-20、1-25、1-30、5-10、5-15、5-20、5-25、5-30、10-15、10-20、10-25、10-30、15-20、15-25、15-30、20-25、20-30或25-30个核苷酸内。作为一个非限制性实施例,调节性多核苷酸可以在表达载体中位于启动子下游和/或多腺苷酸化序列上游前1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、25%或超过25%的核苷酸内。作为另一个非限制性实施例,调节性多核苷酸可以在表达载体中位于启动子下游和/或多腺苷酸化序列上游前1-5%、1-10%、1-15%、1-20%、1-25%、5-10%、5-15%、5-20%、5-25%、10-15%、10-20%、10-25%、15-20%、15-25%或20-25%的核苷酸内。
[0054]
在一个实施方案中,所述调节性多核苷酸可以位于scaav中。
[0055]
在一个实施方案中,所述调节性多核苷酸可以位于ssaav中。
[0056]
在一个实施方案中,所述调节性多核苷酸可以在表达载体中位于flip itr的5’末端附近。在另一个实施方案中,所述调节性多核苷酸可以在表达载体中位于flip itr的3’末端附近。在另一个实施方案中,所述调节性多核苷酸可以在表达载体中位于flop itr的5’末端附近。在另一个实施方案中,所述调节性多核苷酸可以在表达载体中位于flop itr的3’末端附近。在一个实施方案中,所述调节性多核苷酸可以在表达载体中位于flip itr的5’末端和flop itr的3’末端之间。在一个实施方案中,所述调节性多核苷酸可以在表达载体中位于flip itr的3’末端和flip itr的5’末端之间(例如,flip itr的5’末端和flop itr的3’末端之间或者flop itr的3’末端和flip itr的5’末端之间的中途)。作为非限制性实施例,调节性多核苷酸可以在表达载体中位于itr(例如,flip或flop itr)的5’或3’末端下游1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30或超过30个核苷酸内。作为非限制性实施例,调节性多核苷酸可以在表达载体中位于itr(例如,flip或flop itr)的5’或3’末端上游1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30或超过30个核苷酸内。作为另外的非限制性实施例,调节性多核苷酸可以在表达载体中位于itr(例如,flip或flop itr)的5’或3’末端下游1-5、1-10、1-15、1-20、1-25、1-30、5-10、5-15、5-20、5-25、5-30、10-15、10-20、10-25、10-30、15-20、15-25、15-30、20-25、20-30或25-30个核苷酸内。作为另外的非限制性实施例,调节性多核苷酸可以在表达载体中位于itr(例如,flip或flop itr)的5’或3’末端上游1-5、1-10、1-15、1-20、1-25、1-30、5-10、5-15、5-20、5-25、5-30、10-15、10-20、10-25、10-30、15-20、15-25、15-30、20-25、20-30或25-30个核苷酸内。作为非限制性实施例,调节性多核苷酸可以在表达载体中位于itr(例如,flip或flop itr)的5’或3’末端上游前1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、25%或超过25%的核苷酸内。作为另外的非限制性实施例,调节性多核苷酸可以在表达载体中位于itr(例如,flip或flop itr)的5’或3’末端下游前1-5%、1-10%、1-15%、1-20%、1-25%、5-10%、5-15%、5-20%、5-25%、10-15%、10-20%、10-25%、15-20%、15-25%或20-25%的核苷酸内。
[0057]
分子支架
[0058]
在某些实施方案中,所述调节性多核苷酸的起始分子支架是已知的或野生型初级-或前-微rna。在其它实施方案中,从头开始设计所述调节性多核苷酸的分子支架(参见
cullen,gene therapy(2006)13,503-508,关于mir30;chung,等人,nucleic acids research,2006,第34卷,第7期,关于mir-155;其内容通过引用整体并入本文)。
[0059]
本文中使用的“分子支架”是形成用于设计或制备后续分子的序列或抗其的结构基础的框架或起始分子。
[0060]
转向图1。可以将本发明的调节性多核苷酸设计为所示的初级-mir。在图中,显示了初级-mir分子支架。包含净荷(例如,本文描述的sirna、mirna或其它rnai剂)的调节性多核苷酸包含先导5’侧翼序列,其可以是任意长度且可以完全地或部分地源自野生型微rna序列或是完全人工的。
[0061]
同样地,图中所示的3’侧翼序列可以在大小和起源上映射5’侧翼序列。任一个侧翼序列可以不存在。3’侧翼序列可以任选地含有一个或多个cnnc基序,其中“n”代表任何核苷酸。
[0062]
最少至少一个净荷序列形成所示的茎环结构的茎。在某些实施方案中,所述净荷序列包含至少一个与靶序列部分地互补且将杂交的核酸序列。在某些实施方案中,所述净荷是野生型微rna。在某些实施方案中,所述净荷是sirna分子或sirna分子的片段。在某些实施方案中,所述净荷是基本上双链的构建体,其可以包含一个或多个微rna、人工微rna或sirna。
[0063]
在某些实施方案中,所述茎环的5’臂包含过客链。该链也被称作有义链,因为它反映了与靶标的同一性。所述过客链可以是15-30个核苷酸的长度。它可以是15、16、17、18、19、20、21、22、23、24、25、26、27、28、29或30个核苷酸的长度。
[0064]
在某些实施方案中,所述茎环的3’臂包含引导链。该链也被称作反义链,因为它反映了与靶标的同源性。所述引导链可以是15-30个核苷酸的长度、21-25个核苷酸或22个核苷酸的长度。它可以是15、16、17、18、19、20、21、22、23、24、25、26、27、28、29或30个核苷酸的长度。在某些情况下,所述引导链包含在5’最末端处的“g”核苷酸。
[0065]
在某些实施方案中,其中所述引导链包含微rna或人工微rna,所述引导链可以包含一个或多个微rna种子序列。相对于引导链的第一个5’核苷酸或相对于dicer切割位点,所述种子序列可以位于引导链的位置2-7、2-8或2-9处。
[0066]
在其它实施方案中,所述过客链可以存在于3’臂上,而所述引导链存在于茎环结构的茎的5’臂上。
[0067]
所述过客和引导链可以在它们的长度的大部分上是完全互补的。在其它实施方案中,所述过客链和引导链可以独立地在所述链的长度的至少50%、60%、70%、80%、85%、90%、95%或99%上是至少70%、80%、90%、95%或99%互补的。
[0068]
过客链的同一性或引导链的同源性都不需要与靶标是100%互补的。
[0069]
环(也被称作环基序)分离茎环结构的过客和引导链。所述环可以是4-30个核苷酸、4-20个核苷酸、4-15个核苷酸、5-15个核苷酸、6-12个核苷酸、6个核苷酸、7个核苷酸、8个核苷酸、9个核苷酸、10个核苷酸、11个核苷酸和/或12个核苷酸的任意长度。
[0070]
在某些实施方案中,所述环包含至少一个ugug基序。在某些实施方案中,所述ugug基序位于所述环的5’末端处。
[0071]
间隔区域可以存在于调节性多核苷酸中以将一个或多个模块彼此分离。可以存在一个或多个这样的间隔区域。
[0072]
在一个实施方案中,8-20个(即,8、9、10、11、12、13、14、15、16、17、18、19或20个)核苷酸的间隔区域可以存在于过客链和侧翼序列之间。
[0073]
在一个实施方案中,所述间隔物是13个核苷酸,且位于过客链的5’末端和侧翼序列之间。在一个实施方案中,间隔物具有足够的长度以形成所述序列的大约一个螺旋转角。
[0074]
在一个实施方案中,8-20个(即,8、9、10、11、12、13、14、15、16、17、18、19或20个)核苷酸的间隔区域可以存在于引导链和侧翼序列之间。
[0075]
在一个实施方案中,所述间隔序列是10-13个(即,10、11、12或13个)核苷酸,且位于引导链的3’末端和侧翼序列之间。在一个实施方案中,间隔物具有足够的长度以形成所述序列的大约一个螺旋转角。
[0076]
在一个实施方案中,所述调节性多核苷酸包含在茎的基部处的至少一个ug基序,其中g核苷酸是配对的且u核苷酸是未配对的。在某些实施方案中,所述未配对的u核苷酸位于侧翼序列中。
[0077]
在一个实施方案中,所述调节性多核苷酸在5’至3’方向包含5’侧翼序列、5’臂、环基序、3’臂和3’侧翼序列。作为一个非限制性实施例,所述5’臂可以包含过客链,且所述3’臂包含引导链。在另一个非限制性实施例中,所述5’臂包含引导链,且所述3’臂包含过客链。
[0078]
在一个实施方案中,可以改变5’臂、净荷(例如,过客和/或引导链)、环基序和/或3’臂序列(例如,置换1个或更多个核苷酸,添加核苷酸和/或删除核苷酸)。所述改变可以造成构建体功能的有益变化(例如,增加靶序列的敲降,减少构建体的降解,减少脱靶效应,增加净荷的效率,和减少净荷的降解)。
[0079]
在一个实施方案中,可以改变过客链序列(例如,置换1个或更多个核苷酸、添加核苷酸和/或删除核苷酸)。作为一个非限制性实施例,所述过客链序列可以包含在所述序列的最后4个核苷酸内的1或2个置换(例如,c置换g)。作为另一个非限制性实施例,所述过客链序列可以包含在所述序列的5’末端的7-15个核苷酸内的1或2个置换(例如,u置换a,或c置换g)。
[0080]
在一个实施方案中,可以改变3’臂链序列(例如,置换1个或更多个核苷酸、添加核苷酸和/或删除核苷酸)。作为一个非限制性实施例,3’臂的序列可以包含在所述序列的前4个核苷酸内的1或2个置换(例如,a置换u)。
[0081]
在一个实施方案中,所述净荷构建体的分子支架可以包含5’侧接区域、环基序和3’侧接区域。在5’侧接区域和环基序之间可以是第一净荷区域,且在环基序和3’侧接区域之间可以是第二净荷区域。所述第一和第二净荷区域可以包含本文描述的sirna、mirna或其它rnai剂、片段或变体。所述第一和第二净荷区域还可以包含彼此相同、不同或互补的序列。作为一个非限制性实施例,所述第一净荷区域序列可以是sirna构建体的过客链,且所述第二净荷区域序列可以是sirna构建体的引导链。所述过客和引导序列可以是彼此基本上互补的。作为另一个非限制性实施例,所述第一净荷区域序列可以是sirna构建体的引导链,且所述第二净荷区域序列可以是sirna构建体的过客链。所述过客和引导序列可以是彼此基本上互补的。
[0082]
在一个实施方案中,本文描述的调节性多核苷酸的分子支架包含5’侧接区域、环区域和3’侧接区域。可以用在本文描述的分子支架中的5’侧接区域、环区域和3’侧接区域
的序列的非限制性例子显示在表1-3中。
[0083]
表1.分子支架的5’侧接区域
[0084][0085][0086]
表2.分子支架的环基序区域
[0087][0088]
表3.分子支架的3’侧接区域
[0089][0090][0091]
在表1-3中描述的任何区域可以用在本文描述的分子支架中。
[0092]
在一个实施方案中,所述分子支架可以包含一个在表1中列出的5’侧接区域。作为一个非限制性实施例,所述分子支架可以包含5’侧接区域5f1、5f2、5f3或5f4。
[0093]
在一个实施方案中,所述分子支架可以包含一个在表2中列出的环基序区域。作为一个非限制性实施例,所述分子支架可以包含环基序区域l1、l2、l3、l4或l5。
[0094]
在一个实施方案中,所述分子支架可以包含一个在表3中列出的3’侧接区域。作为一个非限制性实施例,所述分子支架可以包含3’侧接区域3f1、3f2、3f3、3f4、3f5或3f6。
[0095]
在一个实施方案中,所述分子支架可以包含在表1和2中描述的至少一个5’侧接区域和至少一个环基序区域。作为一个非限制性实施例,所述分子支架可以包含5f1和l1、5f1和l2、5f1和l3、5f1和l4、5f1和l5、5f2和l1、5f2和l2、5f2和l3、5f2和l4、5f2和l5、5f3和l1、5f3和l2、5f3和l3、5f3和l4、5f3和l5、5f4和l1、5f4和l2、5f4和l3、5f4和l4或5f4和l5。
[0096]
在一个实施方案中,所述分子支架可以包含在表2和3中描述的至少一个3’侧接区域和至少一个环基序区域。作为一个非限制性实施例,所述分子支架可以包含3f1和l1、3f1和l2、3f1和l3、3f1和l4、3f1和l5、3f2和l1、3f2和l2、3f2和l3、3f2和l4、3f2和l5、3f3和l1、3f3和l2、3f3和l3、3f3和l4、3f3和l5、3f4和l1、3f4和l2、3f4和l3、3f4和l4、3f4和l5、3f5和l1、3f5和l2、3f5和l3、3f5和l4、3f5和l5、3f6和l1、3f6和l2、3f6和l3、3f6和l4或3f6和l5。
[0097]
在一个实施方案中,所述分子支架可以包含在表1和3中描述的至少一个5’侧接区域和至少3’侧接区域。作为一个非限制性实施例,所述分子支架可以包含5f1和3f1、5f1和3f2、5f1和3f3、5f1和3f4、5f1和3f5、5f1和3f6、5f2和3f1、5f2和3f2、5f2和3f3、5f2和3f4、5f2和3f5、5f2和3f6、5f3和3f1、5f3和3f2、5f3和3f3、5f3和3f4、5f3和3f5、5f3和3f6、5f4和3f1、5f4和3f2、5f4和3f3、5f4和3f4、5f4和3f5、5f4和3f6。
[0098]
在一个实施方案中,所述分子支架可以包含至少一个5’侧接区域、至少一个环基序区域和至少一个3’侧接区域。作为一个非限制性实施例,所述分子支架可以包含5f1、l1和3f1;5f1、l1和3f2;5f1、l1和3f3;5f1、l1和3f4;5f1、l1和3f5;5f1、l1和3f6;5f2、l1和3f1;5f2、l1和3f2;5f2、l1和3f3;5f2、l1和3f4;5f2、l1和3f5;5f2、l1和3f6;5f3、l1和3f1;5f3、l1和3f2;5f3、l1和3f3;5f3、l1和3f4;5f3、l1和3f5;5f3、l1和3f6;5f4、l1和3f1;5f4、l1和3f2;5f4、l1和3f3;5f4、l1和3f4;5f4、l1和3f5;5f4、l1和3f6;5f1、l2和3f1;5f1、l2和3f2;5f1、l2和3f3;5f1、l2和3f4;5f1、l2和3f5;5f1、l2和3f6;5f2、l2和3f1;5f2、l2和3f2;5f2、l2和3f3;5f2、l2和3f4;5f2、l2和3f5;5f2、l2和3f6;5f3、l2和3f1;5f3、l2和3f2;5f3、l2和3f3;5f3、l2和3f4;5f3、l2和3f5;5f3、l2和3f6;5f4、l2和3f1;5f4、l2和3f2;5f4、l2和3f3;5f4、l2和3f4;5f4、l2和3f5;5f4、l2和3f6;5f1、l3和3f1;5f1、l3和3f2;5f1、l3和3f3;5f1、l3和3f4;5f1、l3和3f5;5f1、l3和3f6;5f2、l3和3f1;5f2、l3和3f2;5f2、l3和3f3;5f2、l3和3f4;5f2、l3和3f5;5f2、l3和3f6;5f3、l3和3f1;5f3、l3和3f2;5f3、l3和3f3;5f3、l3和3f4;5f3、l3和3f5;5f3、l3和3f6;5f4、l3和3f1;5f4、l3和3f2;5f4、l3和3f3;5f4、l3和3f4;5f4、l3和3f5;5f4、l3和3f6;5f1、l4和3f1;5f1、l4和3f2;5f1、l4和3f3;5f1、l4和3f4;5f1、l4和3f5;5f1、l4和3f6;5f2、l4和3f1;5f2、l4和3f2;5f2、l4和3f3;5f2、l4和3f4;5f2、l4和3f5;5f2、l4和3f6;5f3、l4和3f1;5f3、l4和3f2;5f3、l4和3f3;5f3、l4和3f4;5f3、l4和3f5;5f3、l4和3f6;5f4、l4和3f1;5f4、l4和3f2;5f4、l4和3f3;5f4、l4和3f4;5f4、l4和3f5;5f4、l4和3f6;5f1、l5和3f1;5f1、l5和3f2;5f1、l5和3f3;5f1、l5和3f4;5f1、l5和3f5;5f1、l5和3f6;5f2、l5和3f1;5f2、l5和3f2;5f2、l5和3f3;5f2、l5和3f4;5f2、l5和3f5;5f2、l5和3f6;5f3、l5和3f1;5f3、l5和3f2;5f3、l5和3f3;5f3、l5和3f4;5f3、l5和3f5;5f3、l5和3f6;5f4、l5和3f1;5f4、l5和3f2;5f4、l5和3f3;5f4、l5和3f4;5f4、l5和3f5;或5f4、l5和3f6。
[0099]
在一个实施方案中,所述分子支架可以包含一个或多个本领域已知的接头。所述接头可以分离所述区域或将一个分子支架与另一个分子支架分离。作为一个非限制性实施例,所述分子支架可以是多顺反子的。
[0100]
在一个实施方案中,使用以下性质中的至少一种来设计调节性多核苷酸:环变体、种子错配/凸起/摆动变体、茎错配、环变体和奴仆(vassal)茎错配变体、种子错配和基础茎错配变体、茎错配和基础茎错配变体、种子摆动和基础茎摆动变体或茎序列变体。
[0101]
在一个实施方案中,所述分子支架可以位于启动子(例如,但不限于,cmv、u6、cba或具有sv40内含子的cba启动子)的下游。另外,所述分子支架也可以位于多腺苷酸化序列
的上游。作为非限制性实施例,所述分子支架可以位于启动子下游和/或多腺苷酸化序列上游1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30或超过30个核苷酸内。作为另外的非限制性实施例,所述分子支架可以位于启动子下游和/或多腺苷酸化序列上游1-5、1-10、1-15、1-20、1-25、1-30、5-10、5-15、5-20、5-25、5-30、10-15、10-20、10-25、10-30、15-20、15-25、15-30、20-25、20-30或25-30个核苷酸内。作为非限制性实施例,所述分子支架可以位于启动子下游和/或多腺苷酸化序列上游前1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、25%或超过25%的核苷酸内。作为另外的非限制性实施例,所述分子支架可以位于启动子下游和/或多腺苷酸化序列上游前1-5%、1-10%、1-15%、1-20%、1-25%、5-10%、5-15%、5-20%、5-25%、10-15%、10-20%、10-25%、15-20%、15-25%或20-25%内。
[0102]
在一个实施方案中,所述分子支架可以位于多腺苷酸化序列的上游。另外,所述分子支架可以位于启动子(例如,但不限于,cmv、u6、cba或具有sv40内含子的cba启动子)的下游。作为非限制性实施例,所述分子支架可以位于启动子下游和/或多腺苷酸化序列上游1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30或超过30个核苷酸内。作为另外的非限制性实施例,所述分子支架可以位于启动子下游和/或多腺苷酸化序列上游1-5、1-10、1-15、1-20、1-25、1-30、5-10、5-15、5-20、5-25、5-30、10-15、10-20、10-25、10-30、15-20、15-25、15-30、20-25、20-30或25-30个核苷酸内。作为非限制性实施例,所述分子支架可以位于启动子下游和/或多腺苷酸化序列上游前1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、25%或超过25%的核苷酸内。作为另外的非限制性实施例,所述分子支架可以位于启动子下游和/或多腺苷酸化序列上游前1-5%、1-10%、1-15%、1-20%、1-25%、5-10%、5-15%、5-20%、5-25%、10-15%、10-20%、10-25%、15-20%、15-25%或20-25%内。
[0103]
在一个实施方案中,所述分子支架可以位于scaav中。
[0104]
在一个实施方案中,所述分子支架可以位于ssaav中。
[0105]
在一个实施方案中,所述分子支架可以位于flip itr的5’末端附近。在另一个实施方案中,所述分子支架可以位于flip itr的3’末端附近。在另一个实施方案中,所述分子支架可以位于flop itr的5’末端附近。在另一个实施方案中,所述分子支架可以位于flop itr的3’末端附近。在一个实施方案中,所述分子支架可以位于flip itr的5’末端和flop itr的3’末端之间。在一个实施方案中,所述分子支架可以位于flip itr的3’末端和flip itr的5’末端之间(例如,在flip itr的5’末端和flop itr的3’末端之间的中途,或在flop itr的3’末端和flip itr的5’末端之间的中途)。作为非限制性实施例,所述分子支架可以位于itr(例如,flip或flop itr)的5’或3’末端下游1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30或超过30个核苷酸内。作为非限制性实施例,所述分子支架可以位于itr(例如,flip或flop itr)的5’或3’末端上游1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30或超过30个核苷酸内。作为另外的非限制性实施例,所述分子支架可以位于itr(例如,flip或flop itr)的5’或3’末端下游1-5、1-10、1-15、1-20、1-25、1-30、5-10、5-15、5-20、5-25、5-30、10-15、10-20、10-25、10-30、15-20、15-25、15-30、20-25、20-30或25-30个核苷酸内。作为另外的非限制性实施例,所述分子支架可以位于itr(例如,flip或flop itr)的5’或3’末
端上游1-5、1-10、1-15、1-20、1-25、1-30、5-10、5-15、5-20、5-25、5-30、10-15、10-20、10-25、10-30、15-20、15-25、15-30、20-25、20-30或25-30个核苷酸内。作为非限制性实施例,所述分子支架可以位于itr(例如,flip或flop itr)的5’或3’末端上游前1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、25%或超过25%的核苷酸内。作为另外的非限制性实施例,所述分子支架可以位于itr(例如,flip或flop itr)的5’或3’末端下游前1-5%、1-10%、1-15%、1-20%、1-25%、5-10%、5-15%、5-20%、5-25%、10-15%、10-20%、10-25%、15-20%、15-25%或20-25%内。
[0106]
表达载体
[0107]
在一个实施方案中,表达载体(例如,aav载体)可以包含至少一种调节性多核苷酸,所述调节性多核苷酸包含至少一种本文描述的分子支架。
[0108]
在一个实施方案中,表达载体可以包含,从itr至itr(按5’至3’),itr、启动子、内含子、调节性多核苷酸、聚腺苷酸序列和itr。
[0109]
基因组大小
[0110]
在一个实施方案中,包含编码本文描述的调节性多核苷酸的核酸序列的载体基因组可以是单链的或双链的载体基因组。所述载体基因组的大小可以是小的、中等的、大的或最大的大小。另外,所述载体基因组可以包含启动子和聚腺苷酸尾巴。
[0111]
在一个实施方案中,包含编码本文描述的调节性多核苷酸的核酸序列的载体基因组可以是小单链载体基因组。小单链载体基因组可以是2.7-3.5kb大小,诸如约2.7、2.8、2.9、3.0、3.1、3.2、3.3、3.4和3.5kb大小。作为一个非限制性实施例,所述小单链载体基因组可以是3.2kb大小。另外,所述载体基因组可以包含启动子和聚腺苷酸尾巴。
[0112]
在一个实施方案中,包含编码本文描述的调节性多核苷酸的核酸序列的载体基因组可以是小双链载体基因组。小双链载体基因组可以是1.3-1.7kb大小,诸如约1.3、1.4、1.5、1.6和1.7kb大小。作为一个非限制性实施例,所述小双链载体基因组可以是1.6kb大小。另外,所述载体基因组可以包含启动子和聚腺苷酸尾巴。
[0113]
在一个实施方案中,包含编码本文描述的调节性多核苷酸的核酸序列的载体基因组可以是中等单链载体基因组。中等单链载体基因组可以是3.6-4.3kb大小,诸如约3.6、3.7、3.8、3.9、4.0、4.1、4.2和4.3kb大小。作为一个非限制性实施例,所述中等单链载体基因组可以是4.0kb大小。另外,所述载体基因组可以包含启动子和聚腺苷酸尾巴。
[0114]
在一个实施方案中,包含编码本文描述的调节性多核苷酸的核酸序列的载体基因组可以是中等双链载体基因组。中等双链载体基因组可以是1.8-2.1kb大小,诸如约1.8、1.9、2.0和2.1kb大小。作为一个非限制性实施例,所述中等双链载体基因组可以是2.0kb大小。另外,所述载体基因组可以包含启动子和聚腺苷酸尾巴。
[0115]
在一个实施方案中,包含编码本文描述的调节性多核苷酸的核酸序列的载体基因组可以是大单链载体基因组。大单链载体基因组可以是4.4-6.0kb大小,诸如约4.4、4.5、4.6、4.7、4.8、4.9、5.0、5.1、5.2、5.3、5.4、5.5、5.6、5.7、5.8、5.9和6.0kb大小。作为一个非限制性实施例,所述大单链载体基因组可以是4.7kb大小。作为另一个非限制性实施例,所述大单链载体基因组可以是4.8kb大小。作为另一个非限制性实施例,所述大单链载体基因组可以是6.0kb大小。另外,所述载体基因组可以包含启动子和聚腺苷酸尾巴。
[0116]
在一个实施方案中,包含编码本文描述的调节性多核苷酸的核酸序列的载体基因
组可以是大双链载体基因组。大双链载体基因组可以是2.2-3.0kb大小,诸如约2.2、2.3、2.4、2.5、2.6、2.7、2.8、2.9和3.0kb大小。作为一个非限制性实施例,所述大双链载体基因组可以是2.4kb大小。另外,所述载体基因组可以包含启动子和聚腺苷酸尾巴。
[0117]
启动子
[0118]
本领域技术人员可以认识到,靶细胞可能需要特异性的启动子,包括、但不限于物种特异性的、可诱导的、组织特异性的或细胞周期特异性的启动子(parr等人,nat.med.3:1145-9(1997);其内容通过引用整体并入本文)。
[0119]
在一个实施方案中,所述启动子是被认为对调节性多核苷酸中的净荷有效的启动子。
[0120]
在一个实施方案中,所述启动子是被认为对靶向的细胞有效的启动子。
[0121]
在一个实施方案中,所述启动子是提供净荷在靶向的组织(例如,但不限于,神经系统组织)中表达一段时间的弱启动子。表达可以持续1小时、2小时、3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时、11小时、12小时、13小时、14小时、15小时、16小时、17小时、18小时、19小时、20小时、21小时、22小时、23小时、1天、2天、3天、4天、5天、6天、1周、8天、9天、10天、11天、12天、13天、2周、15天、16天、17天、18天、19天、20天、3周、22天、23天、24天、25天、26天、27天、28天、29天、30天、31天、1个月、2个月、3个月、4个月、5个月、6个月、7个月、8个月、9个月、10个月、11个月、1年、13个月、14个月、15个月、16个月、17个月、18个月、19个月、20个月、21个月、22个月、23个月、2年、3年、4年、5年、6年、7年、8年、9年、10年或超过10年的时间段。表达可以持续1-5小时、1-12小时、1-2天、1-5天、1-2周、1-3周、1-4周、1-2个月、1-4个月、1-6个月、2-6个月、3-6个月、3-9个月、4-8个月、6-12个月、1-2年、1-5年、2-5年、3-6年、3-8年、4-8年或5-10年。作为一个非限制性实施例,所述启动子是用于在神经组织中持续表达净荷的弱启动子。
[0122]
在一个实施方案中,所述启动子可以是小于1kb的启动子。所述启动子可以具有200、210、220、230、240、250、260、270、280、290、300、310、320、330、340、350、360、370、380、390、400、410、420、430、440、450、460、470、480、490、500、510、520、530、540、550、560、570、580、590、600、610、620、630、640、650、660、670、680、690、700、710、720、730、740、750、760、770、780、790、800或超过800的长度。所述启动子可以具有200-300、200-400、200-500、200-600、200-700、200-800、300-400、300-500、300-600、300-700、300-800、400-500、400-600、400-700、400-800、500-600、500-700、500-800、600-700、600-800或700-800之间的长度。
[0123]
在一个实施方案中,所述启动子可以是两个或更多个组分(例如,但不限于,cmv和cba)的组合。每个组分可以具有200、210、220、230、240、250、260、270、280、290、300、310、320、330、340、350、360、370、380、381、382、383、384、385、386、387、388、389、390、400、410、420、430、440、450、460、470、480、490、500、510、520、530、540、550、560、570、580、590、600、610、620、630、640、650、660、670、680、690、700、710、720、730、740、750、760、770、780、790、800或超过800的长度。每个组分可以具有200-300、200-400、200-500、200-600、200-700、200-800、300-400、300-500、300-600、300-700、300-800、400-500、400-600、400-700、400-800、500-600、500-700、500-800、600-700、600-800或700-800之间的长度。作为一个非限制性实施例,所述启动子是382核苷酸的cmv-增强子序列和260核苷酸的cba-启动子序列的组合。
[0124]
在一个实施方案中,所述载体基因组包含至少一个元件以增强转基因靶标特异性和表达(参见例如,powell等人.viral expression cassette elements to enhance transgene target specificity and expression in gene therapy,2015;其内容通过引用整体并入本文)。用于增强转基因靶标特异性和表达的元件的非限制性例子包括启动子、内源性mirna、转录后调节元件(pre)、多腺苷酸化(polya)信号序列和上游增强子(use)、cmv增强子和内含子。
[0125]
在一个实施方案中,所述载体基因组包含至少一个元件以增强转基因靶标特异性和表达(参见例如,powell等人.viral expression cassette elements to enhance transgene target specificity and expression in gene therapy,2015;其内容通过引用整体并入本文),诸如启动子。在大多数组织中促进表达的启动子包括但不限于人延伸因子1α-亚基(ef1α)、立即早期巨细胞病毒(cmv)、鸡β-肌动蛋白(cba)和它的衍生物cag、β葡糖醛酸糖苷酶(gusb)或泛素c(ubc)。组织特异性的表达元件可以用于将表达限制至特定细胞类型,例如,但不限于,可以用于将表达限制至神经元、星形胶质细胞或少突神经胶质细胞的神经系统启动子。用于神经元的组织特异性的表达元件的非限制性例子包括神经元特异性的烯醇化酶(nse)、血小板衍生的生长因子(pdgf)、血小板衍生的生长因子b-链(pdgf-β)、突触蛋白(syn)、甲基-cpg结合蛋白2(mecp2)、camkii、mglur2、nfl、nfh、nβ2、ppe、enk和eaat2启动子。用于星形胶质细胞的组织特异性的表达元件的一个非限制性例子包括神经胶质原纤维酸性蛋白(gfap)和eaat2启动子。用于少突神经胶质细胞的组织特异性的表达元件的一个非限制性例子是髓磷脂碱蛋白(mbp)启动子。
[0126]
在一个实施方案中,所述载体基因组包含普遍存在的启动子。普遍存在的启动子的非限制性例子包括cmv、cba(包括衍生物cag、cbh等)、ef-1α、pgk、ubc、gusb(hgbp)和ucoe(hnrpa2b1-cbx3的启动子)。yu等人(molecular pain 2011,7:63;其内容通过引用整体并入本文)使用慢病毒载体在大鼠drg细胞和原代drg细胞中评价了在cag、efiα、pgk和ubc启动子下egfp的表达,并发现ubc表现出比其它3种启动子更弱的表达,并且对于所有启动子而言存在仅10-12%神经胶质表达。soderblom等人(e.neuro2015;其内容通过引用整体并入本文)评价了在注射进运动皮质中以后egfp在具有cmv和ubc启动子的aav8和具有cmv启动子的aav2中的表达。含有ubc或efiα启动子的质粒的鼻内施用表现出大于具有cmv启动子的表达的持久气道表达(参见例如,gill等人,gene therapy 2001,第8卷,1539-1546;其内容通过引用整体并入本文)。husain等人(gene therapy 2009;其内容通过引用整体并入本文)评价了具有hgusb启动子、hsv-1lat启动子和nse启动子的hβh构建体,并发现hβh构建体在小鼠脑中表现出比nse更弱的表达。passini和wolfe(j.virol.2001,12382-12392,其内容通过引用整体并入本文)评价了在新生小鼠心室内注射以后hβh载体的长期作用,并发现存在至少1年的持久表达。当使用nf-l和nf-h启动子与cmv-lacz、cmv-luc、ef、gfap、henk、nachr、ppe、ppe+wpre、nse(0.3kb)、nse(1.8kb)和nse(1.8kb+wpre)进行对比时,xu等人(gene therapy 2001,8,1323-1332;其内容通过引用整体并入本文)发现了在所有脑区域中的低表达。xu等人发现启动子活性按递减次序为nse(1.8kb)、ef、nse(0.3kb)、gfap、cmv、henk、ppe、nfl和nfh。nfl是一种650核苷酸启动子且nfh是一种920核苷酸启动子,它们二者都不存在于肝中,但是nfh在感觉本体感受神经元、脑和脊髓中是丰富的,且nfh存在于心脏中。scn8a是一种在drg、脊髓和脑中到处表达的470核苷酸启动子,在海马神经元和小脑浦
肯野细胞、皮质、丘脑和下丘脑中看到特别高的表达(参见例如,drews等人.2007和raymond等人.2004;它们中的每一篇的内容通过引用整体并入本文)。
[0127]
在一个实施方案中,所述载体基因组包含ubc启动子。所述ubc启动子可以具有300-350个核苷酸的大小。作为一个非限制性实施例,所述ubc启动子是332个核苷酸。
[0128]
在一个实施方案中,所述载体基因组包含gusb启动子。所述gusb启动子可以具有350-400个核苷酸的大小。作为一个非限制性实施例,所述gusb启动子是378个核苷酸。作为一个非限制性实施例,所述构建体可以是aav-启动子-cmv/珠蛋白内含子-hfxn-rbg,其中所述aav可以是自互补的,且所述aav可以是dj血清型。
[0129]
在一个实施方案中,所述载体基因组包含nfl启动子。所述nfl启动子可以具有600-700个核苷酸的大小。作为一个非限制性实施例,所述nfl启动子是650个核苷酸。作为一个非限制性实施例,所述构建体可以是aav-启动子-cmv/珠蛋白内含子-hfxn-rbg,其中所述aav可以是自互补的,且所述aav可以是dj血清型。
[0130]
在一个实施方案中,所述载体基因组包含nfh启动子。所述nfh启动子可以具有900-950个核苷酸的大小。作为一个非限制性实施例,所述nfh启动子是920个核苷酸。作为一个非限制性实施例,所述构建体可以是aav-启动子-cmv/珠蛋白内含子-hfxn-rbg,其中所述aav可以是自互补的,且所述aav可以是dj血清型。
[0131]
在一个实施方案中,所述载体基因组包含scn8a启动子。所述scn8a启动子可以具有450-500个核苷酸的大小。作为一个非限制性实施例,所述scn8a启动子是470个核苷酸。作为一个非限制性实施例,所述构建体可以是aav-启动子-cmv/珠蛋白内含子-hfxn-rbg,其中所述aav可以是自互补的,且所述aav可以是dj血清型。
[0132]
在一个实施方案中,所述载体基因组包含fxn启动子。
[0133]
在一个实施方案中,所述载体基因组包含pgk启动子。
[0134]
在一个实施方案中,所述载体基因组包含cba启动子。
[0135]
在一个实施方案中,所述载体基因组包含cmv启动子。
[0136]
在一个实施方案中,所述载体基因组包含肝或骨骼肌启动子。肝启动子的非限制性例子包括haat和tbg。骨骼肌启动子的非限制性例子包括结蛋白、mck和c5-12。
[0137]
在一个实施方案中,所述表达载体包含增强子元件、启动子和/或5’utr内含子。所述增强子可以是,但不限于,cmv增强子,所述启动子可以是,但不限于,cmv、cba、ubc、gusb、nse、突触蛋白(sunapsin)、mecp2和gfap启动子,且所述5’utr/内含子可以是,但不限于,sv40和cba-mvm。作为一个非限制性实施例,所述组合使用的增强子、启动子和/或内含子可以是:(1)cmv增强子、cmv启动子、sv40 5’utr内含子;(2)cmv增强子、cba启动子、sv 40 5’utr内含子;(3)cmv增强子、cba启动子、cba-mvm 5’utr内含子;(4)ubc启动子;(5)gusb启动子;(6)nse启动子;(7)突触蛋白启动子;(8)mecp2启动子和(9)gfap启动子。
[0138]
在一个实施方案中,所述表达载体具有经工程改造的启动子。
[0139]
内含子
[0140]
在一个实施方案中,所述载体基因组包含至少一个元件以增强转基因靶标特异性和表达(参见例如,powell等人.viral expression cassette elements to enhance transgene target specificity and expression in gene therapy,2015;其内容通过引用整体并入本文),诸如内含子。内含子的非限制性例子包括,mvm(67-97bp)、f.ix截短的内
含子1(300bp)、β-珠蛋白sd/免疫球蛋白重链剪接受体(250bp)、腺病毒剪接供体/免疫球蛋白剪接受体(500bp)、sv40晚剪接供体/剪接受体(19s/16s)(180bp)和杂合腺病毒剪接供体/igg剪接受体(230bp)。
[0141]
在一个实施方案中,所述内含子可以是100-500个核苷酸的长度。所述内含子可以具有80、90、100、110、120、130、140、150、160、170、171、172、173、174、175、176、177、178、179、180、190、200、210、220、230、240、250、260、270、280、290、300、310、320、330、340、350、360、370、380、390、400、410、420、430、440、450、460、470、480、490或500的长度。所述启动子可以具有80-100、80-120、80-140、80-160、80-180、80-200、80-250、80-300、80-350、80-400、80-450、80-500、200-300、200-400、200-500、300-400、300-500或400-500之间的长度。
[0142]
引入细胞中
[0143]
使用多种方案中的任一种,可以将本发明的调节性多核苷酸引入宿主细胞中。可以用包含所述调节性多核苷酸的病毒载体实现感染。合适的病毒载体的例子包括复制缺陷型逆转录病毒载体、腺病毒载体、腺相关的载体和慢病毒载体。
[0144]
根据本发明,用在治疗剂和/或诊断剂中的病毒载体包含已经简化或减少至目标核酸净荷或负荷的转导所必需的最小组分的病毒。
[0145]
以此方式,病毒载体被工程改造为用于特异性递送的媒介物,同时缺乏在野生型病毒中发现的有害复制和/或整合特征。
[0146]
本文中使用的“载体”是运输、转导异源分子(诸如本发明的多核苷酸)或者以其它方式充当异源分子(诸如本发明的调节性多核苷酸)的载体的任何分子或部分。“病毒载体”是包含一个或多个多核苷酸区域的载体,所述多核苷酸区域编码或包含目标净荷分子,例如,转基因、编码一个多肽或多个多肽的多核苷酸或调节性核酸。本发明的病毒载体可以重组地生产,且可以是基于腺伴随病毒(aav)亲本或参照序列。在本发明中可能有用的血清型包括从aav1、aav2、aav3、aav4、aav5、aav6、aav7、aav8、aav9、aav9.47、aav9(hu14)、aav10、aav11、aav12、aavrh8、aavrh10、aav-dj和aav-dj8产生的那些中的任一种。
[0147]
在一个实施方案中,在本发明中有用的血清型可以是aav-dj8。aav-dj8的氨基酸序列可以包含两个或更多个突变以便除去肝素结合结构域(hbd)。作为非限制性实施例,在美国专利号7,588,772(其内容通过引用整体并入本文)中被描述为seq id no:1的aav-dj序列可以包含两个突变:(1)r587q,其中在氨基酸587处的精氨酸(r;arg)被改变成谷氨酰胺(q;gln)和(2)r590t,其中在氨基酸590处的精氨酸(r;arg)被改变成苏氨酸(t;thr)。作为另一个非限制性实施例,可以包含三个突变:(1)k406r,其中在氨基酸406处的赖氨酸(k;lys)被改变成精氨酸(r;arg),(2)r587q,其中在氨基酸587处的精氨酸(r;arg)被改变成谷氨酰胺(q;gln),和(3)r590t,其中在氨基酸590处的精氨酸(r;arg)被改变成苏氨酸(t;thr)。
[0148]
aav载体还可以包含自互补的aav载体(scaav)。scaav载体含有两条dna链,它们对合在一起以形成双链dna。通过跳过第二条链合成,scaav允许在细胞中快速表达。
[0149]
在一个实施方案中,在本发明中使用的aav载体是scaav。
[0150]
在一个实施方案中,可以将所述调节性多核苷酸引入来自任何有关的物种(例如,但不限于,人、狗、小鼠、大鼠或猴)的细胞中。
[0151]
在一个实施方案中,可以将所述调节性多核苷酸引入与要治疗的疾病有关的细胞
中。作为一个非限制性实施例,所述疾病是als,且所述靶细胞是运动神经元和星形胶质细胞。
[0152]
在一个实施方案中,可以将所述调节性多核苷酸引入具有靶序列的高内源性表达水平的细胞中。
[0153]
在另一个实施方案中,可以将所述调节性多核苷酸引入具有靶序列的低内源性表达水平的细胞中。
[0154]
在一个实施方案中,所述细胞可以是具有高aav转导效率的那些。
[0155]
在一个实施方案中,可以用于调节性多核苷酸的体外分析的细胞包括但不限于hek293、hela、人原代星形胶质细胞、人星形胶质细胞细胞系(u251mg)、sh-sy5y-神经元和人ipsc衍生的运动神经元祖细胞。
[0156]
靶核酸
[0157]
本发明的调节性多核苷酸可以靶向任何基因或核酸构建体,包括编码和非编码基因。可以靶向编码人或灵长类动物蛋白的基因(dna或mrna)。另外,还可以靶向非编码基因,例如,长的非编码rna(lncrna)。
[0158]
在国际公开wo2012/018881a2(其内容通过引用整体并入本文)中教导了这样的lncrna分子和被设计成靶向这样的lncrna的rnai构建体的例子,其中任一种可以分别被所述调节性多核苷酸靶向或者由所述调节性多核苷酸编码。
[0159]
在一个实施方案中,本发明的调节性多核苷酸可以靶向本领域已知的任何基因。作为一个非限制性实施例,所述基因可以是sod1。
[0160]
在一个实施方案中,所述调节性多核苷酸可以靶向15-19个核苷酸长度的序列。作为一个非限制性实施例,所述靶标可以是在表1中所述的任意序列。作为另一个非限制性实施例,所述靶标可以是nm_000454.4的核苷酸406-424。作为另一个非限制性实施例,所述靶标可以是nm_000454.4的核苷酸645-661。
[0161]
在一个实施方案中,所述调节性多核苷酸可以靶向21个核苷酸长度的序列。在一个方面,所述靶标可以是nm_000454.4的任何21聚体序列或本领域已知的任何基因。作为一个非限制性实施例,所述靶标可以是nm_000454.4的核苷酸521-541。作为另一个非限制性实施例,所述靶标可以是nm_000454.4的核苷酸639-659。作为另一个非限制性实施例,所述靶标可以是nm_000454.4的核苷酸640-660。作为另一个非限制性实施例,所述靶标可以是nm_000454.4的核苷酸645-665。作为另一个非限制性实施例,所述靶标可以是nm_000454.4的核苷酸664-684。
[0162]
在一个实施方案中,可以将所述调节性多核苷酸设计成靶向人基因组中的任何基因或mrna,例如,与cns障碍(例如,但不限于,亨廷顿病、als等)有关的基因。
[0163]
药物组合物
[0164]
尽管本文中提供的药物组合物,例如包含要递送的净荷的那些调节性多核苷酸(包括编码质粒或表达载体,诸如病毒,例如,aav)的描述主要涉及适合用于施用给人类的药物组合物,技术人员会理解,这样的组合物通常适合用于施用给任意其它动物,例如,非人动物,例如非人哺乳动物。对适合施用给人类的药物组合物进行修改以便使所述组合物适合施用给各种动物是被充分理解的,并且具有普通技术的兽医药理学家仅用普通(如果有的话)实验就可以设计和/或执行这样的修改。预见到对其施用药物组合物的受试者包括
但不限于人类和/或其它灵长类动物;哺乳动物,包括商业上相关的哺乳动物诸如牛、猪、马、绵羊、猫、狗、小鼠和/或大鼠;和/或禽类,包括商业上相关的禽类诸如家禽、鸡、鸭、鹅和/或火鸡。
[0165]
在某些实施方案中,将组合物施用给人类、人患者或受试者。为了本公开内容的目的,短语“活性成分”通常是指携带净荷的病毒载体或用本文所述的病毒载体递送的调节性多核苷酸净荷分子。
[0166]
通过药理学领域中已知的或此后开发的任意方法,可以制备本文描述的药物组合物的制剂。一般而言,这样的制备方法包括以下步骤:使活性成分与赋形剂和/或一种或多种其它助剂结合,和然后,如果必要的话和/或合乎需要的话,将产品分包、成形和/或包装成期望的单次剂量或多次剂量单位。
[0167]
根据本发明的药物组合物中的活性成分、药学上可接受的赋形剂和/或任何额外成分的相对量将变化,这取决于所治疗的受试者的身份、大小和/或病症,并且进一步取决于要施用所述组合物的途径。
[0168]
制剂
[0169]
可以使用一种或多种赋形剂配制所述调节性多核苷酸或编码它们的病毒载体,以:(1)增加稳定性;(2)增加细胞转染或转导;(3)允许持久或延迟释放;或(4)改变生物分布(例如,将病毒载体靶向至特定组织或细胞类型)。
[0170]
本发明的制剂可以包括,但不限于,盐水、脂质样物、脂质体、脂质纳米颗粒、聚合物、脂复合物、芯-壳纳米颗粒、肽、蛋白、用病毒载体转染的细胞(例如,用于移植进受试者中)、纳米颗粒模仿物和它们的组合。此外,使用自装配的核酸纳米颗粒可以配制本发明的病毒载体。
[0171]
通过药理学领域中已知的或此后开发的任意方法,可以制备本文描述的药物组合物的制剂。一般而言,这样的制备方法包括以下步骤:使活性成分与赋形剂和/或一种或多种其它助剂结合。
[0172]
根据本公开内容的药物组合物可以散装、作为单一单位剂量和/或作为多个单一单位剂量制备、包装和/或销售。本文中使用的“单位剂量”表示包含预定量的活性成分的药物组合物的离散量。活性成分的量通常等于将要施用给受试者的活性成分的剂量,和/或这样的剂量的合宜分数,如这样的剂量的二分之一或三分之一。
[0173]
根据本公开内容的药物组合物中的活性成分、药学上可接受的赋形剂和/或任何额外成分的相对量可以变化,取决于正在治疗的受试者的特性、大小和/或状况,并且还取决于要施用所述组合物的途径。例如,所述组合物可以包含0.1%至99%(w/w)的活性成分。作为例子,所述组合物可以包含0.1%至100%、例如0.5至50%、1-30%、5-80%、至少80%(w/w)的活性成分。
[0174]
在某些实施方案中,本文描述的制剂可以含有至少一种净荷分子。作为非限制性实施例,所述制剂可以含有1、2、3、4或5种调节性多核苷酸净荷分子。在一个实施方案中,所述制剂可以含有调节性多核苷酸净荷构建体,其靶向蛋白,所述蛋白选自例如但不限于人蛋白、兽医蛋白、细菌蛋白、生物蛋白、抗体、免疫原性蛋白、治疗性肽和蛋白、分泌的蛋白、质膜蛋白、细胞质和细胞骨架蛋白、细胞内膜结合的蛋白、核蛋白、与人疾病有关的蛋白和/或与非人疾病有关的蛋白的类别。在一个实施方案中,所述制剂含有至少3种靶向蛋白的净
荷构建体。
[0175]
在某些实施方案中,药学上可接受的赋形剂可以是至少95%、至少96%、至少97%、至少98%、至少99%或100%纯的。在某些实施方案中,赋形剂被批准用于人类和用于兽医学应用。在某些实施方案中,赋形剂可以被美国食品和药品管理局批准。在某些实施方案中,赋形剂可以属于药用级。在某些实施方案中,赋形剂可以满足美国药典(usp)、欧洲药典(ep)、英国药典和/或国际药典的标准。
[0176]
本文中使用的赋形剂包括但不限于溶剂、分散介质、稀释剂或其它液体媒介物、分散或混悬助剂、表面活性剂、等渗剂、增稠剂或乳化剂、防腐剂等的任意种和所有,只有它们适合于所希望的特定剂型。用于配制药物组合物的各种赋形剂和用于制备组合物的技术是本领域已知的(参见remington:the science and practice of pharmacy,第21版,a.r.gennaro,lippincott,williams&wilkins,baltimore,md,2006;通过引用整体并入本文)。在本公开内容的范围内可以预见到常规赋形剂介质的应用,但是除了任何常规赋形剂介质可能与物质或它的衍生物不相容以外,诸如通过产生任何不希望的生物学效应或另外以有害方式与药物组合物的任意其它组分相互作用。
[0177]
示例性的稀释剂包括但不限于碳酸钙、碳酸钠、磷酸钙、磷酸二钙、硫酸钙、磷酸氢钙、磷酸钠、乳糖、蔗糖、纤维素、微晶纤维素、高岭土、甘露醇、山梨醇、肌醇、氯化钠、干燥的淀粉、玉米淀粉、糖粉等,和/或它们的组合。
[0178]
无活性成分
[0179]
在某些实施方案中,调节性多核苷酸制剂可以包含至少一种赋形剂,所述赋形剂是无活性成分。本文使用的术语“无活性成分”表示在制剂中包括的一种或多种无活性试剂。在某些实施方案中,在本发明的制剂中可以使用的全部、没有或一些无活性成分可以被美国食品和药品管理局(fda)批准。
[0180]
携带本文中公开的调节性多核苷酸的病毒载体的制剂可以包括阳离子或阴离子。在一个实施方案中,所述制剂包括金属阳离子,例如,但不限于,zn2+、ca2+、cu2+、mg+和它们的组合。作为一个非限制性实施例,制剂可以包括聚合物和与金属阳离子形成复合物的调节性多核苷酸(参见例如,美国专利号6,265,389和6,555,525,它们中的每一篇通过引用整体并入本文)。
[0181]
施用
[0182]
通过产生治疗上有效的结果的任意途径,可以施用包含本发明的调节性多核苷酸的病毒载体。这些包括但不限于肠内(进入肠)、胃肠内、硬膜外(进入硬脑膜物质)、口服(通过口腔)、透皮、硬膜外、大脑内(进入大脑)、脑室内(进入脑室)、皮内(应用在皮肤上)、真皮内(进入皮肤本身)、皮下(在皮肤下)、鼻施用(通过鼻)、静脉内(进入静脉)、静脉内推注、静脉内滴注、动脉内(进入动脉)、肌肉内(进入肌肉)、心内(进入心脏)、骨内输注(进入骨髓)、鞘内(进入椎管)、腹膜内(输注或注射进腹膜)、膀胱内输注、玻璃体内(通过眼)、海绵窦内注射(进入病理性腔体)、腔内(进入阴茎的基底)、阴道内施用、子宫内、羊膜外施用、透皮(穿过完整皮肤扩散用于全身分布)、透粘膜(穿过粘膜扩散)、经阴道、吹入法(嗅吸法)、舌下、唇下、灌肠剂、滴眼剂(在结膜上)、滴耳剂、耳(在耳朵中或通过耳朵)、含服(超向脸颊)、结膜、皮肤、牙(至一个或多个牙)、电渗透、宫颈内、endosinusial、气管内、体外、血液透析、渗入、间质、腹部内、羊膜内、关节内、胆内、支气管内、囊内、软骨内(在软骨内)、脊尾内(在
马尾内)、脑池内(在小脑延髓池内)、角膜内(在角膜内)、牙冠内(dental intracornal)、冠状动脉内(在冠状动脉内)、阴茎海绵体内(intracorporus cavernosum)(在阴茎海绵体的可扩张空间内)、椎间盘内(在椎间盘内)、导管内(在腺的导管内)、十二指肠内(在十二指肠内)、硬膜内(在硬膜内或下)、表皮内(至表皮)、食管内(至食管)、胃内(在胃内)、牙龈内(在牙龈内)、回肠内(在小肠的远侧部分内)、病灶内(在局部病灶内或直接引入局部病灶)、管腔内(在管腔内)、淋巴管内(在淋巴内)、骨髓内(在骨的骨髓腔内)、脑膜内(在脑膜内)、眼内(在眼内)、卵巢内(在卵巢内)、心包内(在心包内)、胸膜内(在胸膜内)、前列腺内(在前列腺内)、肺内(在肺或它的支气管内)、窦内(在鼻或眼窝窦内)、椎管内(在脊柱内)、滑膜内(在关节的滑液腔内)、腱内(在肌腱内)、睾丸内(在睾丸内)、鞘内(在脑脊髓轴的任何水平在脑脊液内)、胸腔内(在胸腔内)、小管内(在器官的管内)、肿瘤内(在肿瘤内)、鼓室内(在aurus介质内)、血管内(在一个或多个血管内)、心室内(在心室内)、离子透入法(借助于电流,其中可溶性盐的离子迁移进身体的组织中)、冲洗(浸泡或冲洗开放性创伤或体腔)、喉头(直接在喉上)、鼻胃(穿过鼻并进入胃)、封闭敷裹技术(局部途径施用,其然后被封闭该区域的敷料覆盖)、眼(至外眼)、口咽(直接至口和咽)、胃肠外、经皮、关节周、硬膜外、神经周、牙周、直肠、呼吸(在呼吸道内,为了局部或全身效应通过口或鼻吸入)、眼球后(脑桥后或眼球后)、软组织、蛛网膜下、结膜下、粘膜下、局部、经胎盘(通过或穿过胎盘)、经气管(穿过气管壁)、经鼓膜(穿过或通过鼓室)、输尿管(至输尿管)、尿道(至尿道)、阴道、骶管阻滞、诊断、神经传导阻滞、胆灌注、心脏灌注、体外光化学疗法或脊柱。在具体实施方案中,可以以允许它们穿过血脑屏障、血管屏障或其它上皮屏障的方式施用组合物。在一个实施方案中,用于施用途径的制剂可以包括至少一种无活性成分。
[0183]
定量给药
[0184]
本发明提供了包括给有此需要的受试者施用根据本发明的病毒载体和它们的调节性多核苷酸净荷或复合物的方法。通过使用有效地预防、治疗、诊断疾病、障碍和/或病症(例如,与工作记忆缺失有关的疾病、障碍和/或病症)或将其成像的任何量和任何施用途径,可以给受试者施用病毒载体药物组合物、其成像组合物、诊断组合物或预防组合物。所要求的确切量将在受试者之间变化,这取决于受试者的物种、年龄和总体状况、疾病的严重程度、具体组合物、它的施用模式、它的活性模式等。通常以易于施用和剂量均匀的单位剂型配制根据本发明的组合物。然而,应当理解,本发明的组合物的每日总用量可以由主治医师在合理的医学判断范围内决定。用于任何特定患者的具体的治疗上有效的、预防上有效的或适当的成像剂量水平将取决于多种因素,包括正在治疗的障碍和障碍的严重程度;使用的具体化合物的活性;所用的具体组合物;患者的年龄、体重、一般健康、性别和饮食;采用的具体调节性多核苷酸净荷的施用时间、施用途径和排泄速率;治疗的持续时间;与所用的具体化合物组合或同时使用的药物;和医学领域中众所周知的类似因素。
[0185]
在某些实施方案中,可以在足以每天递送约0.0001mg/kg至约100mg/kg、约0.001mg/kg至约0.05mg/kg、约0.005mg/kg至约0.05mg/kg、约0.001mg/kg至约0.005mg/kg、约0.05mg/kg至约0.5mg/kg、约0.01mg/kg至约50mg/kg、约0.1mg/kg至约40mg/kg、约0.5mg/kg至约30mg/kg、约0.01mg/kg至约10mg/kg、约0.1mg/kg至约10mg/kg或约1mg/kg至约25mg/kg受试者体重(每天1次或多次)的调节性多核苷酸剂量水平施用根据本发明的病毒载体药物组合物,以得到期望的治疗、诊断、预防或成像效应(参见例如,在国际公开号
wo2013078199中描述的单位剂量的范围,通过引用整体并入本文)。可以递送期望的调节性多核苷酸剂量超过一次(例如,在一天中超过一次施用)。在某些实施方案中,使用多次施用(例如,2、3、4、5、6、7、8、9、10、11、12、13、14次或更多次施用),可以递送期望的调节性多核苷酸剂量。当采用多次施用时,可以使用分次定量施用方案,诸如本文描述的那些。本文中使用的“分次剂量”是将单一单位剂量或总每日剂量分成2个或更多个剂量,例如,单一单位剂量的两次或更多次施用。本文中使用的“单一单位剂量”是在一个剂量/在一个时间/单个途径/单个接触点(即,单个施用事件)中施用的任何调节性多核苷酸治疗剂的剂量。本文中使用的“总每日剂量”是在24小时时间段中给出或开处方的量。它可以作为单一单位剂量施用。在一个实施方案中,将包含本发明的调节性多核苷酸的病毒载体在分次剂量中施用给受试者。可以在仅缓冲液中或在本文描述的制剂中配制它们。
[0186]
在一个实施方案中,根据本发明的组合物向细胞的递送包含由[vg/小时=ml/小时*vg/ml]限定的递送速度,其中vg是病毒基因组,vg/ml是组合物浓度,且ml/小时是延长的递送的速度。
[0187]
在一个实施方案中,根据本发明的组合物向细胞的递送可以包含约1x10
6 vg至约1x10
16 vg/受试者之间的总浓度。在某些实施方案中,递送可以包含约1x106、2x106、3x106、4x106、5x106、6x106、7x106、8x106、9x106、1x107、2x107、3x107、4x107、5x107、6x107、7x107、8x107、9x107、1x108、2x108、3x108、4x108、5x108、6x108、7x108、8x108、9x108、1x109、2x109、3x109、4x109、5x109、6x109、7x109、8x109、9x109、1x10
10
、2x10
10
、3x10
10
、4x10
10
、5x10
10
、6x10
10
、7x10
10
、8x10
10
、9x10
10
、1x10
11
、2x10
11
、2.1x10
11
、2.2x10
11
、2.3x10
11
、2.4x10
11
、2.5x10
11
、2.6x10
11
、2.7x10
11
、2.8x10
11
、2.9x10
11
、3x10
11
、4x10
11
、5x10
11
、6x10
11
、7x10
11
、7.1x10
11
、7.2x10
11
、7.3x10
11
、7.4x10
11
、7.5x10
11
、7.6x10
11
、7.7x10
11
、7.8x10
11
、7.9x10
11
、8x10
11
、9x10
11
、1x10
12
、1.1x10
12
、1.2x10
12
、1.3x10
12
、1.4x10
12
、1.5x10
12
、1.6x10
12
、1.7x10
12
、1.8x10
12
、1.9x10
12
、2x10
12
、3x10
12
、4x10
12
、4.1x10
12
、4.2x10
12
、4.3x10
12
、4.4x10
12
、4.5x10
12
、4.6x10
12
、4.7x10
12
、4.8x10
12
、4.9x10
12
、5x10
12
、6x10
12
、7x10
12
、8x10
12
、8.1x10
12
、8.2x10
12
、8.3x10
12
、8.4x10
12
、8.5x10
12
、8.6x10
12
、8.7x10
12
、8.8x10
12
、8.9x10
12
、9x10
12
、1x10
13
、2x10
13
、3x10
13
、4x10
13
、5x10
13
、6x10
13
、6.7x10
13
、7x10
13
、8x10
13
、9x10
13
、1x10
14
、2x10
14
、3x10
14
、4x10
14
、5x10
14
、6x10
14
、7x10
14
、8x10
14
、9x10
14
、1x10
15
、2x10
15
、3x10
15
、4x10
15
、5x10
15
、6x10
15
、7x10
15
、8x10
15
、9x10
15
或1x10
16 vg/受试者的组合物浓度。
[0188]
在一个实施方案中,根据本发明的组合物向细胞的递送可以包含每位受试者约1x106vg/kg至约1x10
16 vg/kg之间的总浓度。在某些实施方案中,递送可以包含约1x106、2x106、3x106、4x106、5x106、6x106、7x106、8x106、9x106、1x107、2x107、3x107、4x107、5x107、6x107、7x107、8x107、9x107、1x108、2x108、3x108、4x108、5x108、6x108、7x108、8x108、9x108、1x109、2x109、3x109、4x109、5x109、6x109、7x109、8x109、9x109、1x10
10
、2x10
10
、3x10
10
、4x10
10
、5x10
10
、6x10
10
、7x10
10
、8x10
10
、9x10
10
、1x10
11
、2x10
11
、2.1x10
11
、2.2x10
11
、2.3x10
11
、2.4x10
11
、2.5x10
11
、2.6x10
11
、2.7x10
11
、2.8x10
11
、2.9x10
11
、3x10
11
、4x10
11
、5x10
11
、6x10
11
、7x10
11
、7.1x10
11
、7.2x10
11
、7.3x10
11
、7.4x10
11
、7.5x10
11
、7.6x10
11
、7.7x10
11
、7.8x10
11
、7.9x10
11
、8x10
11
、9x10
11
、1x10
12
、1.1x10
12
、1.2x10
12
、1.3x10
12
、1.4x10
12
、1.5x10
12
、1.6x10
12
、1.7x10
12
、1.8x10
12
、1.9x10
12
、2x10
12
、3x10
12
、4x10
12
、4.1x10
12
、4.2x10
12
、4.3x10
12
、4.4x10
12
、4.5x10
12
、4.6x10
12
、4.7x10
12
、4.8x10
12
、4.9x10
12
、5x10
12
、6x10
12
、7x10
12
、8x10
12
、8.1x10
12
、
8.2x10
12
、8.3x10
12
、8.4x10
12
、8.5x10
12
、8.6x10
12
、8.7x10
12
、8.8x10
12
、8.9x10
12
、9x10
12
、1x10
13
、2x10
13
、3x10
13
、4x10
13
、5x10
13
、6x10
13
、6.7x10
13
、7x10
13
、8x10
13
、9x10
13
、1x10
14
、2x10
14
、3x10
14
、4x10
14
、5x10
14
、6x10
14
、7x10
14
、8x10
14
、9x10
14
、1x10
15
、2x10
15
、3x10
15
、4x10
15
、5x10
15
、6x10
15
、7x10
15
、8x10
15
、9x10
15
或1x10
16
vg/kg的组合物浓度。
[0189]
在一个实施方案中,每剂可以施用约10
5-106个病毒基因组(单位)。
[0190]
在一个实施方案中,根据本发明的组合物向细胞的递送可以包含约1x10
6 vg/ml至约1x10
16 vg/ml之间的总浓度。在某些实施方案中,递送可以包含约1x106、2x106、3x106、4x106、5x106、6x106、7x106、8x106、9x106、1x107、2x107、3x107、4x107、5x107、6x107、7x107、8x107、9x107、1x108、2x108、3x108、4x108、5x108、6x108、7x108、8x108、9x108、1x109、2x109、3x109、4x109、5x109、6x109、7x109、8x109、9x109、1x10
10
、2x10
10
、3x10
10
、4x10
10
、5x10
10
、6x10
10
、7x10
10
、8x10
10
、9x10
10
、1x10
11
、2x10
11
、3x10
11
、4x10
11
、5x10
11
、6x10
11
、7x10
11
、8x10
11
、9x10
11
、1x10
12
、1.1x10
12
、1.2x10
12
、1.3x10
12
、1.4x10
12
、1.5x10
12
、1.6x10
12
、1.7x10
12
、1.8x10
12
、1.9x10
12
、2x10
12
、2.1x10
12
、2.2x10
12
、2.3x10
12
、2.4x10
12
、2.5x10
12
、2.6x10
12
、2.7x10
12
、2.8x10
12
、2.9x10
12
、3x10
12
、3.1x10
12
、3.2x10
12
、3.3x10
12
、3.4x10
12
、3.5x10
12
、3.6x10
12
、3.7x10
12
、3.8x10
12
、3.9x10
12
、4x10
12
、4.1x10
12
、4.2x10
12
、4.3x10
12
、4.4x10
12
、4.5x10
12
、4.6x10
12
、4.7x10
12
、4.8x10
12
、4.9x10
12
、5x10
12
、6x10
12
、7x10
12
、8x10
12
、9x10
12
、1x10
13
、2x10
13
、3x10
13
、4x10
13
、5x10
13
、6x10
13
、6.7x10
13
、7x10
13
、8x10
13
、9x10
13
、1x10
14
、2x10
14
、3x10
14
、4x10
14
、5x10
14
、6x10
14
、7x10
14
、8x10
14
、9x10
14
、1x10
15
、2x10
15
、3x10
15
、4x10
15
、5x10
15
、6x10
15
、7x10
15
、8x10
15
、9x10
15
或1x10
16 vg/ml的组合物浓度。
[0191]
联合
[0192]
包含调节性多核苷酸的病毒载体可以与一种或多种其它治疗剂、预防剂、诊断剂或成像剂联合使用。“与
……
联合”不意图暗示所述药剂必须同时施用和/或为了一起递送而配制,尽管这些递送方法是在本公开内容的范围内。组合物可以与一种或多种其它的期望治疗剂或医学操作并行地、在其之前或之后施用。一般而言,每种试剂将以对该试剂确定的剂量和/或时间计划来施用。在某些实施方案中,本公开内容包括与药剂联合的药物组合物、预防组合物、诊断组合物或成像组合物的递送,所述药剂可以改善它们的生物利用率、降低和/或修改它们的代谢、抑制它们的排泄、和/或修改它们在体内的分布。
[0193]
递送
[0194]
在一个实施方案中,通过使用在欧洲专利申请号ep1857552(其内容通过引用整体并入本文)中描述的递送aav病毒粒子的方法,可以施用或递送包含调节性多核苷酸的病毒载体。
[0195]
在一个实施方案中,通过使用在欧洲专利申请号ep2678433(其内容通过引用整体并入本文)中描述的使用aav载体递送蛋白的方法,可以施用或递送包含调节性多核苷酸的病毒载体。
[0196]
在一个实施方案中,通过使用在美国专利号us 5858351(其内容通过引用整体并入本文)中描述的使用aav载体递送dna分子的方法,可以施用或递送包含调节性多核苷酸的病毒载体。
[0197]
在一个实施方案中,通过使用在美国专利号us 6211163(其内容通过引用整体并入本文)中描述的向血流递送dna的方法,可以施用或递送包含调节性多核苷酸的病毒载
体。
[0198]
在一个实施方案中,通过使用在美国专利号us 6325998(其内容通过引用整体并入本文)中描述的递送aav病毒粒子的方法,可以施用或递送包含调节性多核苷酸的病毒载体。
[0199]
在一个实施方案中,通过使用在美国专利号us 6335011(其内容通过引用整体并入本文)中描述的向肌细胞递送dna的方法,可以施用或递送包含调节性多核苷酸的病毒载体。
[0200]
在一个实施方案中,通过使用在美国专利号us 6610290(其内容通过引用整体并入本文)中描述的向肌细胞和组织递送dna的方法,可以施用或递送包含调节性多核苷酸的病毒载体。
[0201]
在一个实施方案中,通过使用在美国专利号us 7704492(其内容通过引用整体并入本文)中描述的向肌细胞递送dna的方法,可以施用或递送包含调节性多核苷酸的病毒载体。
[0202]
在一个实施方案中,通过使用在美国专利号us 7112321(其内容通过引用整体并入本文)中描述的向骨骼肌递送净荷的方法,可以施用或递送包含调节性多核苷酸的病毒载体。
[0203]
在一个实施方案中,通过使用在美国专利号us 7588757(其内容通过引用整体并入本文)中描述的向中枢神经系统递送净荷的方法,可以施用或递送病毒载体。
[0204]
在一个实施方案中,通过使用在美国专利号us 8283151(其内容通过引用整体并入本文)中描述的递送净荷的方法,可以施用或递送包含调节性多核苷酸的病毒载体。
[0205]
在一个实施方案中,通过使用在美国专利号us 8318687(其内容通过引用整体并入本文)中描述的用于治疗阿尔茨海默病而递送净荷的方法,可以施用或递送包含调节性多核苷酸的病毒载体。
[0206]
在一个实施方案中,通过使用在国际专利公开号wo2012144446(其内容通过引用整体并入本文)中描述的递送净荷的方法,可以施用或递送包含调节性多核苷酸的病毒载体。
[0207]
在一个实施方案中,通过使用在国际专利公开号wo2001089583(其内容通过引用整体并入本文)中描述的使用谷氨酸脱羧酶(gad)递送载体递送净荷的方法,可以施用或递送包含调节性多核苷酸的病毒载体。
[0208]
在一个实施方案中,通过使用在国际专利公开号wo2001096587(其内容通过引用整体并入本文)中描述的递送净荷的方法,可以施用或递送包含调节性多核苷酸的病毒载体。
[0209]
在一个实施方案中,通过使用在国际专利公开号wo2002014487(其内容通过引用整体并入本文)中描述的向肌肉组织递送净荷的方法,可以施用或递送包含调节性多核苷酸的病毒载体。
[0210]
在一个实施方案中,通过使用在国际专利公开号wo2012057363(其内容通过引用整体并入本文)中描述的向神经细胞递送净荷的方法,可以施用或递送包含调节性多核苷酸的病毒载体。
[0211]
通过生物利用度、治疗窗和/或分布体积中的一种或多种,可以表征本文描述的病
毒载体的药物组合物。
[0212]
在一个实施方案中,可以配制包含调节性多核苷酸的病毒载体。作为一个非限制性实施例,可以优化制剂的碱度和/或渗透压以确保在中枢神经系统或者中枢神经系统的区域或组分中的最佳药物分布。
[0213]
在一个实施方案中,通过单途径施用可以将包含调节性多核苷酸的病毒载体递送给受试者。
[0214]
在一个实施方案中,通过多位点施用途径可以将包含调节性多核苷酸的病毒载体递送给受试者。可以在2、3、4、5或超过5个部位给受试者施用包含调节性多核苷酸的病毒载体。
[0215]
在一个实施方案中,使用推注输注可以给受试者施用包含本文描述的调节性多核苷酸的病毒载体。
[0216]
在一个实施方案中,通过使用在数分钟、数小时或数天的时间段内的持久递送,可以给受试者施用包含本文描述的调节性多核苷酸的病毒载体。根据受试者、分布、制剂或另一种递送参数,可以改变输注速率。
[0217]
在一个实施方案中,对于多位点递送,导管可以位于脊柱中的超过一个位点处。可以以连续和/或推注输注来递送包含调节性多核苷酸的病毒载体。每个递送位点可以是不同的定量施用方案,或相同的定量施用方案可以用于每个递送位点。作为非限制性实施例,所述递送位点可以是在颈和腰区域中。作为另外的非限制性实施例,所述递送位点可以是在颈区域中。作为另外的非限制性实施例,所述递送位点可以是在腰区域中。
[0218]
在一个实施方案中,在递送包含本文描述的调节性多核苷酸的病毒载体之前,可以分析受试者的脊柱解剖学和病理学。作为非限制性实施例,与没有脊柱侧凸的受试者相比,具有脊柱侧凸的受试者可以具有不同的定量施用方案和/或导管位置。
[0219]
在一个实施方案中,在包含调节性多核苷酸的病毒载体的递送过程中,受试者的脊柱取向可以与地面垂直。
[0220]
在另一个实施方案中,在包含调节性多核苷酸的病毒载体的递送过程中,受试者的脊柱取向可以与地面平行。
[0221]
在一个实施方案中,在向受试者递送包含调节性多核苷酸的病毒载体的过程中,受试者的脊柱可以相对于地面成角。受试者的脊柱相对于地面的角度可以是至少10、20、30、40、50、60、70、80、90、100、110、120、130、140、150或180度。
[0222]
在一个实施方案中,选择递送方法和持续时间以提供在脊髓中的广泛转导。作为一个非限制性实施例,使用鞘内递送来提供沿着脊髓的嘴-尾长度的广泛转导。作为另一个非限制性实施例,多位点输注会提供沿着脊髓的嘴-尾长度的更均匀转导。作为另一个非限制性实施例,延长的输注会提供沿着脊髓的嘴-尾长度的更均匀转导。
[0223]
生物利用度
[0224]
当用如本文中所述的递送/配制试剂或媒介物(vehicles)配制成组合物时,包含本发明的调节性多核苷酸的病毒载体可以表现出与缺乏如本文中所述的递送剂的组合物相比增加的生物利用度。本文使用的术语“生物利用度”表示给受试者施用的给定量的特定试剂的全身可用性。通过在将化合物施用给哺乳动物以后测量所述化合物的未变化形式的曲线下面积(auc)或最大血清或血浆浓度(c
max
),可以评估生物利用度。auc是描绘沿着纵坐
标(y-轴)的化合物的血清或血浆浓度相对于沿着横坐标(x-轴)的时间的曲线下面积的确定。通常,使用本领域普通技术人员已知的方法可以计算特定化合物的auc,并如在g.s.banker,modern pharmaceutics,drugs and the pharmaceutical sciences,v.72,marcel dekker,new york,inc.,1996(其内容通过引用整体并入本文)中所述。
[0225]
c
max
值是给受试者施用化合物以后在受试者的血清或血浆中达到的化合物的最大浓度。使用本领域普通技术人员已知的方法可以测量特定化合物的c
max
值。本文中使用的短语“增加生物利用度”或“改善药代动力学”表示可以在受试者中增加本发明的病毒载体的全身可用性(如通过auc、c
max
或c
min
所测量的)的动作。在某些实施方案中,这样的动作可以包含与一种或多种如本文中所述的递送剂共同施用。在某些实施方案中,所述病毒载体的生物利用度可以增加至少约2%、至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约95%或约100%。
[0226]
治疗窗
[0227]
与没有一种或多种如本文中所述的递送剂存在下施用的病毒载体的治疗窗相比,当与一种或多种如本文中所述的递送剂一起配制时,包含本发明的调节性多核苷酸的病毒载体可以表现出化合物和/或组合物施用的治疗窗的增加。本文使用的术语“治疗窗”表示血浆浓度的范围,或在作用部位处的治疗活性物质水平范围,其具有引起治疗效果的高概率。在某些实施方案中,当在制剂中施用时,病毒载体的治疗窗可以增加至少约2%、至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约95%或约100%。
[0228]
分布体积
[0229]
与缺少一种或多种如本文中所述的递送剂的制剂相比,当与一种或多种如本文中所述的递送剂一起配制时,包含本发明的调节性多核苷酸的病毒载体可以表现出改善的分布体积(v
dist
),例如,减小的或靶向的。v
dist
将体内药剂的量与血液或血浆中的相同药剂的浓度相关联。本文使用的术语“分布体积”表示以与血液或血浆中相同的浓度在身体中含有药剂的总量所需的流体体积:v
dist
等于体内药剂的量/血液或血浆中的药剂的浓度。例如,对于10mg剂量的给定药剂和10mg/l的血浆浓度,分布体积将是1升。分布体积反映了药剂存在于血管外组织中的程度。大分布体积反映了药剂结合组织组分相对于血浆蛋白的趋势。在临床场合中,v
dist
可以用于确定达到稳态浓度的负荷剂量。在某些实施方案中,当与一种或多种如本文中所述的递送剂共同施用时,本发明的病毒载体组合物的分布体积可以减小至少约2%、至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%。
[0230]
试剂盒和装置
[0231]
本发明提供了多种用于方便地和/或有效地实现本发明的方法的试剂盒。通常,试剂盒将包含足够量和/或数目的组分以允许用户执行受试者的多次治疗和/或执行多个实验。
[0232]
本发明的载体、构建体、调节性多核苷酸、多核苷酸或多肽中的任意种可以包含在试剂盒中。在某些实施方案中,试剂盒还可以包括用于创制和/或合成本发明的化合物和/或组合物的试剂和/或说明书。在某些实施方案中,试剂盒还可以包括一种或多种缓冲液。在某些实施方案中,本发明的试剂盒可以包括用于制备蛋白或核酸阵列或文库的组分,且因而,可以包括例如固体支持物。
[0233]
在某些实施方案中,可以在水性介质中或以冻干形式包装试剂盒组分。试剂盒的容器装置通常包括至少一个小瓶、试管、烧瓶、瓶子、注射器或其它容器装置,其中可以放置组分,且优选地,适当地等分。在存在超过一种试剂盒组分(可以一起包装标记试剂和标签)的情况下,试剂盒通常还可以含有第二容器、第三容器或其它额外容器,其中可以单独地放置额外组分。在某些实施方案中,试剂盒还可以包含用于容纳无菌的、药学上可接受的缓冲液和/或其它稀释剂的第二容器装置。在某些实施方案中,可以在一个或多个小瓶中包含组分的不同组合。本发明的试剂盒通常还可以包括用于容纳本发明的化合物和/或组合物的装置,例如,严格限制商业销售的蛋白、核酸和任意其它试剂容器。这样的容器可以包括注射或吹模塑的塑料容器,在其中保留期望的管形瓶。
[0234]
在某些实施方案中,在一种和/或多种液体溶液中提供试剂盒组分。在某些实施方案中,液体溶液是水溶液,其中无菌水溶液是特别优选的。在某些实施方案中,可以将试剂盒组分提供为干燥的粉末。当将试剂和/或组分提供为干粉时,通过加入合适体积的溶剂可以重构这样的粉末。在某些实施方案中,预见到,还可以在另一个容器装置中提供溶剂。在某些实施方案中,将标记染料提供为干燥的粉末。在某些实施方案中,预见到,在本发明的试剂盒中提供10、20、30、40、50、60、70、80、90、100、120、120、130、140、150、160、170、180、190、200、300、400、500、600、700、800、900、1000微克或至少或至多那些量的干燥的染料。在这样的实施方案中,然后可以将染料再悬浮于任意合适的溶剂(诸如dmso)中。
[0235]
在某些实施方案中,试剂盒可以包括关于采用试剂盒组分以及在试剂盒中没有包括的任意其它试剂的应用的说明书。说明书可以包括可能实现的变化。
[0236]
装置
[0237]
在某些实施方案中,本发明的化合物和/或组合物可以与装置组合,涂布在装置上,或嵌入装置中。装置可以包括但不限于牙植入物、支架、骨替换物、人工关节、瓣膜、起搏器和/或其它可植入的治疗装置。
[0238]
本发明提供了装置,其可以包含编码一种或多种调节性多核苷酸净荷分子的病毒载体。这些装置含有在稳定的制剂中的病毒载体,所述病毒载体可以立即递送给有此需要的受试者,诸如人患者。
[0239]
根据本文中教导的单个、多个或分次定量施用方案,可以采用用于施用的装置来递送包含本发明的调节性多核苷酸的病毒载体。
[0240]
预见到将本领域已知用于向细胞、器官和组织多次施用的方法和装置与本文中作为本发明的实施方案公开的方法和组合物联合使用。这些包括例如具有多个针头的那些方法和装置,采用例如管腔或导管的杂合装置,以及利用热、电流或辐射驱动机制的装置。
[0241]
本发明的调节性多核苷酸可以用于治疗、预防或改善以异常的或不希望的靶标表达为特征的任何疾病或障碍。
[0242]
定义
[0243]
在本说明书中的不同地方,本公开内容的化合物的取代基以群组或以范围公开。本公开内容特别意在包括这样的群组和范围的成员的每个和每种单独子组合。
[0244]
约:本文使用的术语“约”是指所述值的
±
10%。
[0245]
联合施用:本文使用的术语“联合施用”或“联合的施用”是指,将两种或更多种药剂同时或在一段时间内施用给受试者,使得每种药剂对所述患者的作用可能存在重叠。在某些实施方案中,它们在彼此的约60、30、15、10、5或1分钟内施用。在某些实施方案中,药剂的施用足够紧密地安排,从而实现联合(例如,协同)效应。
[0246]
动物:本文使用的术语“动物”表示动物界的任何成员。在某些实施方案中,“动物”表示处于任何发育阶段的人。在某些实施方案中,“动物”表示处于任何发育阶段的非人动物。在某些实施方案中,所述非人动物是哺乳动物(例如,啮齿动物、小鼠、大鼠、兔、猴、狗、猫、羊、牛、灵长类动物或猪)。在某些实施方案中,动物包括、但不限于哺乳动物、禽类、爬行动物、两栖动物、鱼类和蠕虫类。在某些实施方案中,所述动物是转基因的动物、遗传工程改造的动物或克隆。
[0247]
大约:如本文使用的,应用于一个或多个目标值的术语“大约”或“约”表示与所述参考值类似的值。在某些实施方案中,术语“大约”或“约”表示在所述参考值的任一个方向(大于或更小)落在25%、20%、19%、18%、17%、16%、15%、14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4%、3%、2%、1%或更小的范围内的值的范围,除非另有说明或另外从上下文中显而易见(这样的数字会超过可能值的100%的情况除外)。
[0248]
与
……
结合:本文使用的术语“与
……
结合”、“缀合”、“连接”、“附着”和“系连”,当关于两个或更多个部分使用时,是指所述部分在物理上彼此结合或连接(直接地或通过一个或多个充当连接剂的额外部分)以形成这样的结构:所述结构是足够稳定的,使得所述部分在使用所述结构的条件(例如,生理条件)下保持物理结合。“结合”不需要严格地通过直接共价化学键合。它还可以暗示基于离子键合或氢键合或杂交的连接,所述连接是足够稳定的,使得“结合的”实体保持物理上是结合的。
[0249]
双功能的:本文使用的术语“双功能的”表示能够执行或维持至少两种功能的任何物质、分子或部分。所述功能可以影响相同的结果或不同的结果。产生功能的结构可以是相同或不同的。
[0250]
生物相容的:本文使用的术语“生物相容的”是指与活细胞、组织、器官或系统相容,产生小至无的损伤、毒性或免疫系统排斥的风险。
[0251]
可生物降解的:本文使用的术语“可生物降解的”是指能够通过生物的作用分解成无害产物。
[0252]
生物学上有活性的:本文中使用的短语“生物学上有活性的”表示在生物系统和/或生物体中具有活性的任何物质的特征。例如,当被施用给生物体时,对该生物体具有生物学效应的物质被认为是生物学上有活性的。在特定实施方案中,如果甚至多核苷酸的一部分是生物学上有活性的或模仿被认为生物学上相关的活性,则本发明的调节性多核苷酸可以被视为生物学上有活性的。
[0253]
诱导的多能干细胞:本文中使用的“诱导的多能干细胞”是可以被诱导以形成几种不同细胞类型中的任意种的细胞。
[0254]
化合物:本文使用的术语“化合物”意在包括所述结构的所有立体异构体、几何异
构体、互变异构体和同位素。
[0255]
本文所述化合物可以是不对称的(例如,具有一个或多个立构中心)。预见到所有立体异构体,诸如对映异构体和非对映异构体,除非另外指出。可以以光学活性的或外消旋的形式分离含有不对称取代的碳原子的本公开内容的化合物。如何从光学活性的起始原料制备光学活性形式的方法是本领域已知的,诸如通过拆分外消旋混合物或通过立体选择性的合成。烯烃、c=n双键等的许多几何异构体也可以存在于本文所述的化合物中,并且在本公开内容中预见到所有这样的稳定异构体。描述了本公开内容的化合物的顺式和反式几何异构体,并且它们可以作为异构体的混合物或作为分离的异构形式分离。
[0256]
本公开内容的化合物还包括互变异构形式。互变异构形式源自单键与邻近双键的对换和质子的伴随迁移。互变异构形式包括质子转移互变异构体,所述质子转移互变异构体是具有相同经验公式和总电荷的异构质子化状态。
[0257]
本公开内容的化合物还包括在中间体化合物或最终化合物中出现的原子的全部同位素。“同位素”表示这样的原子:其具有相同原子数,但是具有由原子核内的不同中子数引起的不同质量数。例如,氢的同位素包括氚和氘。
[0258]
本公开内容的化合物和盐可以通过常规方法与溶剂或水分子组合制备以形成溶剂合物和水合物。
[0259]
保守的:本文使用的术语“保守的”表示多核苷酸序列或多肽序列各自的核苷酸或氨基酸残基,所述残基是在对比的两个或更多个序列的相同位置中无改变地存在的那些。相对保守的核苷酸或氨基酸是在更相关的序列中与所述序列中在其它地方出现的核苷酸或氨基酸相比保守的那些。
[0260]
在某些实施方案中,如果两个或更多个序列是100%彼此相同的,则称它们是“完全保守的”。在某些实施方案中,如果两个或更多个序列彼此至少70%相同、至少80%相同、至少90%相同或至少95%相同,则称它们是“高度保守的”。在某些实施方案中,如果两个或更多个序列彼此约70%相同、约80%相同、约90%相同、约95%、约98%、或约99%相同,则称它们是“高度保守的”。在某些实施方案中,如果两个或更多个序列彼此至少30%相同、至少40%相同、至少50%相同、至少60%相同、至少70%相同、至少80%相同、至少90%相同或至少95%相同,则称它们是“保守的”。在某些实施方案中,如果两个或更多个序列彼此约30%相同、约40%相同、约50%相同、约60%相同、约70%相同、约80%相同、约90%相同、约95%相同、约98%相同或约99%相同,则称它们是“保守的”。序列的保守可以适用于多核苷酸或多肽的整个长度,或可以适用于其部分、区域或组件。
[0261]
控释:本文使用的术语“控释”表示符合特定释放模式以实现治疗结果的药物组合物或化合物释放特性。
[0262]
环状或环化的:本文使用的术语“环状”表示连续环的存在。环状分子不需要是圆形的,仅仅连接以形成亚基的连续链。
[0263]
细胞生长抑制性的:本文中使用的“细胞生长抑制性的”表示抑制、减少、遏制细胞(例如,哺乳动物细胞(例如,人细胞))、细菌、病毒、真菌、原生动物、寄生虫、朊病毒或它们的组合的生长、分裂或繁殖。
[0264]
细胞毒性的:本文中使用的“细胞毒性的”表示杀死细胞(例如,哺乳动物细胞(例如,人细胞))、细菌、病毒、真菌、原生动物、寄生虫、朊病毒或它们的组合或造成对它们的有
害、有毒或致死作用。
[0265]
递送:本文中使用的“递送”表示递送化合物、物质、实体、部分、负荷或净荷的动作或方式。
[0266]
递送剂:本文中使用的“递送剂”表示至少部分地促进调节性多核苷酸向靶向细胞的体内递送的任何物质。
[0267]
失稳的:本文使用的术语“可失稳的”、“失稳”或“失稳区域”是指与相同区域或分子的起始、野生型或天然形式相比更不稳定的区域或分子。
[0268]
可检测标记物:本文中使用的“可检测标记物”表示与另一个实体连接、掺入或结合的一个或多个标志物、信号或部分,其通过本领域已知的方法容易地检测到,所述方法包括放射摄影术、荧光、化学发光、酶活性、吸光度等。可检测标记物包括放射性同位素、荧光团、生色团、酶、染料、金属离子、诸如生物素、抗生物素蛋白、抗生蛋白链菌素和半抗原的配体、量子点等。可检测标记物可以位于本文中公开的肽或蛋白的任何位置处。它们可以是在氨基酸、肽或蛋白质内,或位于n-末端或c-末端处。
[0269]
非对映异构体:本文使用的术语“非对映异构体”是指彼此不为镜像且彼此不可重叠的立体异构体。
[0270]
消化:本文使用的术语“消化”是指分解成较小的碎片或组分。当表示多肽或蛋白时,消化导致肽的产生。
[0271]
远侧的:本文使用的术语“远侧的”是指位于远离中心或远离目标点或区域的地方。
[0272]
定量施用方案:本文中使用的“定量施用方案”是施用计划或医师确定的治疗、预防或姑息疗法的方案。
[0273]
对映异构体:本文使用的术语“对映异构体”是指本发明的化合物的每种单个光学活性形式,其具有至少80%(即,至少90%的一种对映异构体和至多10%的其它对映异构体)、优选地至少90%和更优选地至少98%的光学纯度或对映体过量(通过本领域的标准方法确定)。
[0274]
包封:本文使用的术语“包封”是指围绕、包围或包裹。
[0275]
经工程改造的:如本文中使用的,当本发明的实施方案被设计成具有与起始、野生型或天然分子不同的结构性或化学性特征或性质时,所述实施方案是“经工程改造的”。
[0276]
有效量:本文使用的术语药剂的“有效量”是这样的量:所述量足以实现有益的或期望的结果,例如,临床结果,且这样,“有效量”取决于它所应用的上下文。例如,在施用治疗癌症的药剂的上下文中,药剂的有效量是例如这样的量:与在不施用所述药剂的情况下得到的应答相比,所述量足以实现如本文中定义的癌症的治疗。
[0277]
外来体:本文中使用的“外来体”是由哺乳动物细胞分泌的囊泡或参与rna降解的复合物。
[0278]
表达:本文中使用的核酸序列的“表达”表示以下事件中的一个或多个:(1)从dna序列产生rna模板(例如,通过转录);(2)加工rna转录物(例如,通过剪接、编辑、5
′
帽形成和/或3’端加工);(3)rna翻译成多肽或蛋白;和(4)多肽或蛋白的翻译后修饰。
[0279]
特征:本文中使用的“特征”表示特性、性质或独特元件。
[0280]
制剂:本文中使用的“制剂”包括至少一种调节性多核苷酸和一种递送剂。
[0281]
片段:本文中使用的“片段”表示部分。例如,蛋白的片段可以包含通过消化从培养的细胞分离的全长蛋白而得到的多肽。
[0282]
功能性的:本文中使用的“功能性的”生物分子是处于特定形式的生物分子,在所述特定形式中,所述生物分子表现出用于表征它的性质和/或活性。
[0283]
同源性:本文使用的术语“同源性”表示聚合物分子之间例如核酸分子(例如dna分子和/或rna分子)之间和/或多肽分子之间的总体相关性。在某些实施方案中,如果聚合物分子的序列是至少25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或99%相同或相似的,则认为它们是彼此“同源的”。术语“同源的”必然地表示至少两个序列(多核苷酸或多肽序列)之间的对比。根据本发明,如果两个多核苷酸序列编码的多肽就至少一个至少约20个氨基酸的片段而言至少约50%、60%、70%、80%、90%、95%或甚至99%相同,则认为所述两个多核苷酸序列是同源的。在某些实施方案中,通过编码至少4
–
5个独特地指定的氨基酸的片段的能力来表征同源多核苷酸序列。对于长度小于60个核苷酸的多核苷酸序列,通过编码至少4
–
5个独特地指定的氨基酸的片段的能力来确定同源性。根据本发明,如果两种蛋白就至少一个至少约20个氨基酸的片段而言至少约50%、60%、70%、80%或90%相同,则认为这两个蛋白序列是同源的。
[0284]
同一性:本文使用的术语“同一性”表示聚合物分子之间,例如多核苷酸分子(例如dna分子和/或rna分子)之间和/或多肽分子之间,的总体相关性。例如,可以如下执行两个多核苷酸序列的同一性百分比的计算:为最佳比对目的将两个序列比对(例如,可以为最佳比对而在第一和第二核酸序列中的一个或二个中引入缺口,并且可以为对比目的而抛弃不相同的序列)。在某些实施方案中,为对比目的所比对的序列的长度是参照序列长度的至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%、至少95%或100%。然后对比在相应核苷酸位置处的核苷酸。当在第一序列中的位置被第二序列中在对应位置处的相同核苷酸占据时,则所述分子在该位置处是相同的。两个序列之间的同一性百分比是所述序列共有的相同位置的数目的函数,并考虑为两个序列的最佳比对需要引入的缺口的数目和每个缺口的长度。可以使用数学算法实现两个序列之间的序列对比和同一性百分比测定。例如,两个核苷酸序列之间的同一性百分比可以使用多种方法,如在以下文献中描述的那些方法,来确定:computational molecular biology,lesk,a.m.,编,oxford university press,new york,1988;biocomputing:informatics and genome projects,smith,d.w.,编,academic press,new york,1993;sequence analysis in molecular biology,von heinje,g.,academic press,1987;computer analysis of sequence data,part i,griffin,a.m.,和griffin,h.g.,编,humana press,new jersey,1994;和sequence analysis primer,gribskov,m.和devereux,j.,编,m stockton press,new york,1991;它们中的每一篇通过引用并入本文。例如,使用已经并入align程序(2.0版)中的meyers和miller(cabios,1989,4:11-17)的算法,使用pam120加权残基表、12的缺口长度罚分和4的缺口罚分,可以确定两个核苷酸序列之间的同一性百分比。可替换地,使用gcg软件包中的gap程序,使用nwsgapdna.cmp矩阵,可以确定两个核苷酸序列之间的同一性百分比。通常用来确定序列之间的同一性百分比的方法包括、但不限于在carillo,h.,和lipman,d.,siam j applied math.,48:1073(1988)中公开的那些;所述文献通过引用并入本文。另外,用于确定同一性的技术被编纂在公众可得到的计算机程序中。用于确定两个序列之间的同源性
的示例性计算机软件包括、但不限于gcg程序包(devereux,j.,等人,nucleic acids research,12(1),387(1984))、blastp、blastn和fasta(altschul,s.f.等人,j.molec.biol.,215,403(1990))。
[0285]
抑制基因的表达:本文中使用的短语“抑制基因的表达”是指造成基因的表达产物的量的减少。所述表达产物可以是从基因转录的rna(例如mrna)或从基因转录的rna所翻译成的多肽。通常,mrna水平的降低会导致从其翻译的多肽的水平的降低。使用用于测量mrna或蛋白的标准技术,可以确定表达的水平。
[0286]
异构体:本文使用的术语“异构体”是指本发明的任何化合物的任何互变异构体、立体异构体、对映异构体或非对映异构体。应当认识到,本发明的化合物可以具有一个或多个手性中心和/或双键,且因此,作为立体异构体存在,诸如双键异构体(即,几何e/z异构体)或非对映异构体(例如,对映异构体(即,(+)或(-))或顺/反异构体)。根据本发明,本文中描述的化学结构,和因此本发明的化合物,包括所有对应的立体异构体,也就是说,立体异构纯的形式(例如,几何纯的、对映异构纯的或非对映异构纯的)和对映异构的和立体异构的混合物,例如,外消旋体。通过众所周知的方法,诸如手性相气相色谱法、手性相高效液相色谱法、使化合物结晶为手性盐复合物或使化合物在手性溶剂中结晶,通常可以将本发明的化合物的对映异构的和立体异构的混合物拆分成它们的组分对映异构体或立体异构体。通过众所周知的不对称合成方法,也可以从立体异构地或对映异构纯的中间体、试剂和催化剂得到对映异构体和立体异构体。
[0287]
体外:本文使用的术语“体外”表示在人工环境中,例如在试管或反应容器中、在细胞培养物中、在培养皿等中发生的事件,而不是在生物(例如,动物、植物或微生物)内发生的事件。
[0288]
体内:本文使用的术语“体内”表示在生物(例如,动物、植物或微生物或其细胞或组织)内发生的事件。
[0289]
分离的:本文使用的术语“分离的”表示已经与至少一些伴随它的组分(无论在自然界中还是在实验场合中)分离的物质或实体。参考已经与它们结合的物质,分离的物质可以具有不同的纯度水平。分离的物质和/或实体可以与至少约10%、约20%、约30%、约40%、约50%、约60%、约70%、约80%、约90%或更多的最初与它们结合的其它组分分离。在某些实施方案中,所分离的药剂具有超过约80%、约85%、约90%、约91%、约92%、约93%、约94%、约95%、约96%、约97%、约98%、约99%或超过约99%的纯度。如本文中使用的,如果某物质基本上不含有其它组分,则它是“纯的”。
[0290]
基本上分离的:“基本上分离的”是指,所述化合物与在其中形成或检测它的环境基本上分离。部分分离可以包括例如富含本公开内容的化合物的组合物。基本上分离可以包括含有以重量计至少约50%、至少约60%、至少约70%、至少约80%、至少约90%、至少约95%、至少约97%或至少约99%的本公开内容的化合物或其盐的组合物。用于分离化合物及其盐的方法是本领域中常规的。
[0291]
接头:本文中使用的接头表示一组原子,例如,10-1,000个原子,且可以包含原子或基团,例如,但不限于,碳、氨基、烷基氨基、氧、硫、亚砜、磺酰基、羰基和亚胺。所述接头可以在第一末端处连接至核苷碱基或糖部分上的经修饰的核苷或核苷酸,和在第二末端处连接至净荷,例如,可检测的或治疗剂。所述接头可以具有足够的长度从而不会干扰向核酸序
列中的掺入。所述接头可以用于任何有用的目的,诸如如本文中所述的形成调节性多核苷酸多聚体(例如,通过连接两个或更多个调节性多核苷酸分子)或调节性多核苷酸缀合物,以及施用净荷。可以插入接头中的化学基团的例子包括但不限于烷基、烯基、炔基、酰氨基(amido)、氨基、醚、硫醚、酯、亚烷基、亚杂烷基、芳基或杂环基,它们中的每一个都可以任选地被取代,如本文中所述。接头的例子包括但不限于不饱和的烷烃、聚乙二醇(例如,乙二醇或丙二醇单体单元,例如,二乙二醇、双丙二醇、三甘醇、三丙二醇、四乙二醇或四乙二醇)和葡聚糖聚合物及其衍生物。其它例子包括但不限于在接头内的可切割的部分,例如,二硫键(-s-s-)或偶氮键(-n=n-),它们可以使用还原剂或光解进行切割。选择性地可切割的键的非限制性例子包括:可以例如通过使用三(2-羧基乙基)膦(tcep)或其它还原剂和/或光解切割的酰氨基键,以及可以例如通过酸性或碱性水解切割的酯键。
[0292]
微rna(mirna)结合位点:本文中使用的微rna(mirna)结合位点代表至少mirna的“种子”区域与其结合的核酸转录物的核苷酸位置或区域。
[0293]
修饰的:本文中使用的“修饰的”表示本发明的分子的被改变的状态或结构。可以以许多方式修饰分子,所述方式包括在化学上、在结构上和在功能上。
[0294]
天然存在的:本文中使用的“天然存在的”是指在没有人工辅助下在自然界中存在。
[0295]
中和抗体:本文中使用的“中和抗体”表示这样的抗体:其结合它的抗原并防御细胞免于抗原或感染介质影响(通过中和或消除它所具有的任何生物活性)。
[0296]
非人脊椎动物:本文中使用的“非人脊椎动物”包括除智人(homo sapiens)之外的所有脊椎动物,包括野生的和驯化的物种。非人脊椎动物的例子包括、但不限于哺乳动物,诸如羊驼、白臀野牛、野牛、骆驼、猫、牛、鹿、狗、驴、大额牛、山羊、豚鼠、马、骆马、骡、猪、兔、驯鹿、绵羊、水牛和牦牛。
[0297]
脱靶:本文中使用的“脱靶”表示对任意一种或多种靶标、基因或细胞转录物的任何非意图的效果。
[0298]
开放读码框:本文中使用的“开放读码框”或“orf”表示在给定的读码框中不含有终止密码子的序列。
[0299]
有效连接:本文中使用的短语“有效连接”表示两个或更多个分子、构建体、转录物、实体、部分等之间的功能性连接。
[0300]
任选地被取代:“任选地被取代的x”形式的短语(例如、任选地被取代的烷基)在本文中意图等同于“x,其中x任选地被取代”(例如,“烷基,其中所述烷基任选地被取代”)。它无意表示特征“x”(例如烷基)本身是任选的。
[0301]
肽:本文中使用的“肽”具有小于或等于50个氨基酸的长度,例如,约5、10、15、20、25、30、35、40、45或50个氨基酸长度。
[0302]
患者:本文中使用的“患者”表示可能寻求或需要治疗、要求治疗、正在接受治疗、将会接受治疗的受试者,或因为特定疾病或病症而在经过训练的专业人员照料下的受试者。
[0303]
药学上可接受的:短语“药学上可接受的”在本文中用于表示这样的化合物、物质、组合物和/或剂型:在合理的医学判断范围内,其适用于接触人类和动物的组织,而没有过度的毒性、刺激、变应性应答或其它问题或并发症,与合理的收益/风险比相称。
[0304]
药学上可接受的赋形剂:本文中使用的短语“药学上可接受的赋形剂”表示除了本文所述化合物以外的任何成分(例如,能够悬浮或溶解活性化合物的媒介物),且其具有在患者中基本上无毒的和非炎症性的性能。赋形剂可以包括,例如:抗粘剂、抗氧化剂、粘合剂、包衣剂、压缩助剂、崩解剂、染料(色料)、软化剂、乳化剂、填充剂(稀释剂)、成膜剂或包衣剂、矫味剂、香料、助流剂(流动增进剂)、润滑剂、防腐剂、印刷用油墨、吸附剂、助悬剂或分散剂、甜味剂和化合水。示例性的赋形剂包括、但不限于丁羟甲苯(bht)、碳酸钙、磷酸钙(磷酸氢钙)、硬脂酸钙、交联羧甲纤维素、交联聚乙烯吡咯烷酮、柠檬酸、交聚维酮、半胱氨酸、乙基纤维素、明胶、羟丙基纤维素、羟丙基甲基纤维素、乳糖、硬脂酸镁、麦芽糖醇、甘露醇、甲硫氨酸、甲基纤维素、对羟基苯甲酸甲酯、微晶纤维素、聚乙二醇、聚乙烯吡咯烷酮、聚维酮、预胶化淀粉、对羟基苯甲酸丙酯、棕榈酸视黄酯、紫胶、二氧化硅、羧甲基纤维素钠、柠檬酸钠、淀粉羟乙酸钠、山梨醇、淀粉(玉米)、硬脂酸、蔗糖、滑石粉、二氧化钛、维生素a、维生素e、维生素c和木糖醇。
[0305]
药学上可接受的盐:本公开内容也包括本文所述化合物的药学上可接受的盐。本文中使用的“药学上可接受的盐”表示公开的化合物的衍生物,其中通过将现有的酸或碱部分转化成其盐形式(例如,通过使游离碱基团与合适的有机酸反应)来修饰母体化合物。药学上可接受的盐的例子包括、但不限于碱性残基如胺的无机酸盐或有机酸盐;酸性残基如羧酸的碱盐或有机盐;等。代表性的酸加成盐包括乙酸盐、乙酸、己二酸盐、海藻酸盐、抗坏血酸盐、天冬氨酸盐、苯磺酸盐、苯磺酸、苯甲酸盐、硫酸氢盐、硼酸盐、丁酸盐、樟脑酸盐、樟脑磺酸盐、柠檬酸盐、环戊烷丙酸盐、二葡萄糖酸盐、十二烷基硫酸盐、乙磺酸盐、富马酸盐、葡庚糖酸盐、甘油磷酸盐、半硫酸盐、庚糖酸盐、己酸盐、氢溴酸盐、盐酸盐、氢碘酸盐、2-羟基-乙磺酸盐、乳糖酸盐、乳酸盐、月桂酸盐、月桂基硫酸盐、苹果酸盐、马来酸盐、丙二酸盐、甲磺酸盐、2-萘磺酸盐、烟酸盐、硝酸盐、油酸盐、草酸盐、棕榈酸盐、扑酸盐、果胶酸盐、过硫酸盐、3-苯基丙酸盐、磷酸盐、苦味酸盐、新戊酸盐、丙酸盐、硬脂酸盐、琥珀酸盐、硫酸盐、酒石酸盐、硫氰酸盐、甲苯磺酸盐、十一烷酸盐、戊酸盐等。代表性的碱金属或碱土金属盐包括钠、锂、钾、钙、镁等、以及无毒的铵、季铵和胺阳离子,包括、但不限于铵、四甲基铵、四乙基铵、甲胺、二甲胺、三甲胺、三乙胺、乙胺等。本公开内容的药学上可接受的盐包括形成的母体化合物的常规无毒盐,例如,从无毒的无机或有机酸形成。本公开内容的药学上可接受的盐可以通过常规化学方法从含有碱性或酸性部分的母体化合物合成。通常,通过使这些化合物的游离酸或碱形式与化学计量的量的适当的碱或酸在水或有机溶剂或这两者的混合物中反应,可以制备这样的盐;通常,非水性介质如醚、乙酸乙酯、乙醇、异丙醇或乙腈是优选的。合适的盐的列表可在以下文献中找到:remington’s pharmaceutical sciences,第17版,mack publishing company,easton,pa.,1985,第1418页,pharmaceutical salts:properties,selection,and use,p.h.stahl和c.g.wermuth(编),wiley-vch,2008,以及berge等人,journal of pharmaceutical science,66,1-19(1977),它们中的每一篇通过引用整体并入本文。
[0306]
药学上可接受的溶剂合物:本文中使用的术语“药学上可接受的溶剂合物”是指本发明的化合物,其中合适的溶剂的分子掺入晶格中。合适的溶剂在施用的剂量是生理学上可耐受的。例如,通过从包括有机溶剂、水或其混合物的溶液结晶、重结晶或沉淀,可以制备溶剂合物。合适的溶剂的例子是乙醇、水(例如,一水合物、二水合物和三水合物)、n-甲基吡
咯烷酮(nmp)、二甲亚砜(dmso)、n,n
’-
二甲基甲酰胺(dmf)、n,n
’-
二甲基乙酰胺(dmac)、1,3-二甲基-2-咪唑啉酮(dmeu)、1,3-二甲基-3,4,5,6-四氢-2-(1h)-嘧啶酮(dmpu)、乙腈(acn)、丙二醇、乙酸乙酯、苯甲醇、2-吡咯烷酮、苯甲酸苄酯等。当水是溶剂时,溶剂合物被称作“水合物”。
[0307]
药代动力学:本文中使用的“药代动力学”表示分子或化合物的任意一种或多种特性,当它涉及施用给活生物体的物质的结局的确定。药代动力学被分成几个领域,包括吸收的程度和速率、分布、代谢和排泄。这通常被称作adme,其中:(a)吸收是物质进入血液循环的过程;(d)分布是物质在身体的流体和组织中到处分散或散布;(m)代谢(或生物转化)是母体化合物不可逆地转化成子代谢物;和(e)排泄(或消除)表示物质从身体消除。在罕见的情况下,一些药物不可逆地积累在身体组织中。
[0308]
物理化学的:本文中使用的“物理化学的”是指或涉及物理的和/或化学的特性。
[0309]
预防:本文使用的术语“预防”表示部分地或完全地延迟感染、疾病、障碍和/或病症的发作;部分地或完全地延迟特定感染、疾病、障碍和/或病症的一种或多种症状、特征或临床表现的发作;部分地或完全地延迟特定感染、疾病、障碍和/或病症的一种或多种症状、特征或表现的发作;部分地或完全地延迟自感染、特定疾病、障碍和/或病症的进展;和/或降低发生与感染、疾病、障碍和/或病症相关的病状的风险。
[0310]
前药:本公开内容还包括本文所述化合物的前药。本文中使用的“前药”表示处于一定形式的任何物质、分子或实体,所述形式据预测该物质、分子或实体在化学或物理改变后作为治疗剂起作用。前药可以以某种方式共价地结合或掩蔽,并且其在施用给哺乳动物受试者之前、之时或之后释放或被转化成活性药物部分。通过以特定方式修饰存在于化合物中的官能团,可以制备前药,所述方式使得所述修饰在常规操作中或在体内被切割成母体化合物。前药包括这样的化合物:其中羟基、氨基、巯基或羧基键合至任意基团,当施用给哺乳动物受试者时所述基团会裂解以分别形成游离的羟基、氨基、巯基或羧基。在t.higuchi和v.stella,“pro-drugs as novel delivery systems,”a.c.s.symposium series的第14卷以及bioreversible carriers in drug design,edward b.roche编,american pharmaceutical association and pergamon press,1987中讨论了前药的制备和用途,它们二者特此通过引用整体并入。在某些实施方案中,本发明的初级-mir可以是前-mir的前药。同样,初级-mir或前-mir可以是从其加工的人工mir的前药。
[0311]
增殖:本文使用的术语“增殖”是指快速地生长、扩充或增加或造成生长、扩充或增加。“增殖的”是指具有增殖的能力。“抗增殖的”是指具有抵抗或抵消增殖特性的特性。
[0312]
预防性的:本文中使用的“预防性的”表示用于阻止疾病扩散的治疗剂或动作过程。
[0313]
预防:本文中使用的“预防”表示为维持健康和阻止疾病扩散而采取的措施。
[0314]
蛋白切割位点:本文中使用的“蛋白切割位点”表示这样的位点:在该处可以通过化学方式、酶方式或光化学方式完成氨基酸链的受控切割。
[0315]
蛋白切割信号:本文中使用的“蛋白切割信号”表示标记或标志要切割的多肽的至少一个氨基酸。
[0316]
目标蛋白:本文使用的术语“目标蛋白”或“期望的蛋白”包括本文中提供的那些及其片段、突变体、变体和改变。
[0317]
近侧的:本文使用的术语“近侧的”是指位于中心附近或目标点或区域附近。
[0318]
纯化:本文中使用的“纯化”、“纯化的”是指使得基本上纯的或不含不希望的组分、污染物质、混合物或杂质。
[0319]
样品:本文使用的术语“样品”或“生物样品”表示它的组织、细胞或组成部分(例如体液,包括但不限于血液、粘液、淋巴液、滑液、脑脊液、唾液、羊水、羊膜脐带血、尿、阴道液和精液)的子集。样品还可以包括从完整生物体或它的组织、细胞或组成部分的子集制备的匀浆物、裂解物或提取物,或其级分或部分,包括但不限于,例如,血浆,血清,脊髓液,淋巴液,皮肤、呼吸道、肠道和泌尿生殖道的外表部分,泪液,唾液,奶,血细胞,肿瘤,器官。样品还表示培养基,诸如营养物液体培养基或凝胶,其可以含有细胞组分,诸如蛋白或核酸分子。
[0320]
信号序列:本文中使用的短语“信号序列”表示可以指导蛋白的运输或定位的序列。
[0321]
单一单位剂量:本文中使用的“单一单位剂量”是在一个剂量/在一个时间/单个途径/单个接触点(即,单个施用事件)所施用的任何治疗剂的剂量。
[0322]
相似性:本文使用的术语“相似性”表示聚合物分子之间,例如多核苷酸分子(例如dna分子和/或rna分子)之间和/或多肽分子之间,的总体相关性。以与同一性百分比的计算相同的方式,可以计算聚合物分子彼此之间的相似性百分比,例外是,如本领域中所理解的,相似性百分比的计算考虑保守置换。
[0323]
分次剂量:本文中使用的“分次剂量”是将单一单位剂量或总每日剂量分成两个或更多个剂量。
[0324]
稳定的:本文中使用的“稳定的”表示足够稳健以耐受从反应混合物至有用纯度的分离并且优选地能够配制成有效治疗剂的化合物。
[0325]
稳定化的:本文使用的术语“稳定”、“稳定化”、“稳定化的区域”是指使得或变得稳定。
[0326]
立体异构体:本文使用的术语“立体异构体”表示化合物(例如,本文描述的任意式的化合物)可能具有的所有可能的不同的异构形式以及构象形式,尤其是基础分子结构的所有可能的立体化学地和构象地异构形式、所有非对映异构体、对映异构体和/或构象异构体。本发明的有些化合物可以以不同的互变异构形式存在,所述互变异构形式都被包括在本发明范围内。
[0327]
受试者:本文使用的术语“受试者”或“患者”表示可以给其施用根据本发明的组合物的任何生物,例如,为了实验、诊断、预防和/或治疗目的。典型受试者包括动物(例如,哺乳动物诸如小鼠、大鼠、兔、非人灵长类动物和人类)和/或植物。
[0328]
基本上:本文使用的术语“基本上”表示表现出目标特征或性质的总的或接近总的程度或度的定性条件。生物领域的普通技术人员会理解,生物学现象和化学现象很少(就算有的话)达到完成和/或推进到完全或者实现或避免绝对结果。术语“基本上”因此在本文中用于捕获在许多生物学现象和化学现象中固有的完整性的潜在缺乏。
[0329]
基本上等于:如本文中使用的,当涉及剂量之间的时间差异时,该术语是指加/减2%。
[0330]
基本上同时:如本文中使用的,当涉及多个剂量时,该术语是指在2秒内。
[0331]
遭受:正在“遭受”疾病、障碍和/或病症的个体已经被诊断出或表现出疾病、障碍和/或病症的一种或多种症状。
[0332]
易患:“易患”疾病、障碍和/或病症的个体尚未诊断出和/或可能没有表现出所述疾病、障碍和/或病症的症状,但是包含发生疾病或其症状的倾向性。在某些实施方案中,易患疾病、障碍和/或病症(例如,癌症)的个体可以由以下一项或多项来表征:(1)与所述疾病、障碍和/或病症的发展相关的基因突变;(2)与所述疾病、障碍和/或病症的发展相关的遗传多态性;(3)增加的和/或减少的与所述疾病、障碍和/或病症相关的蛋白和/或核酸的表达和/或活性;(4)与所述疾病、障碍和/或病症的发展相关的习惯和/或生活方式;(5)所述疾病、障碍和/或病症的家族史;和(6)暴露于与所述疾病、障碍和/或病症的发展相关的微生物和/或被其感染。在某些实施方案中,易患疾病、障碍和/或病症的个体将发生所述疾病、障碍和/或病症。在某些实施方案中,易患疾病、障碍和/或病症的个体将不发生所述疾病、障碍和/或病症。
[0333]
持续释放:本文使用的术语“持续释放”表示在特定时间段内符合释放速率的药物组合物或化合物释放概况。
[0334]
合成的:术语“合成的”是指通过人手生产、制备和/或制造。本发明的多核苷酸或多肽或其它分子的合成可以是化学或酶促的。
[0335]
靶向的细胞:本文中使用的“靶向的细胞”表示任意一种或多种目标细胞。所述细胞可以在体外、在体内、在原位存在或在生物的组织或器官中存在。所述生物可以是动物,优选地是哺乳动物,更优选地是人,并且最优选地是患者。
[0336]
治疗剂:术语“治疗剂”表示当施用给受试者时具有治疗、诊断和/或预防效果和/或引起期望的生物学和/或药理学作用的任何药剂。
[0337]
治疗有效量:本文使用的术语“治疗有效量”是指要递送的药剂(例如,核酸、药物、治疗剂、诊断剂、预防剂等)的量,当施用给遭受或易患感染、疾病、障碍和/或病症的受试者时,所述量足以治疗、诊断、预防所述感染、疾病、障碍和/或病症,改善其症状,和/或延迟其发作。
[0338]
治疗上有效的结果:本文使用的术语“治疗上有效的结果”是指这样的结果:其在遭受或易患感染、疾病、障碍和/或病症的受试者中足以治疗、诊断、预防所述感染、疾病、障碍和/或病症,改善其症状,和/或延迟其发作。
[0339]
总每日剂量:本文中使用的“总每日剂量”是在24小时时间段中给出或开处方的量。它可以作为单一单位剂量施用。
[0340]
转染:本文使用的术语“转染”表示将外源核酸引入细胞中的方法。转染的方法包括、但不限于化学方法、物理处理和阳离子脂质或混合物。
[0341]
治疗:本文使用的术语“治疗”表示部分地或完全地减轻、改善、改进、解除特定感染、疾病、障碍和/或病症的一种或多种症状或特征,延迟所述症状或特征的发作,抑制所述症状或特征的进展,降低所述症状或特征的严重程度,和/或降低所述症状或特征的发生率。例如,“治疗”癌症可以表示抑制肿瘤的存活、生长和/或扩散。可以将治疗施用给没有表现出疾病、障碍和/或病症的征象的受试者,和/或施用给仅表现出疾病、障碍和/或病症的早期征象的受试者,目的在于降低发生与所述疾病、障碍和/或病症相关的病状的风险。
[0342]
未修饰的:本文中使用的“未修饰的”表示在以任何方式改变之前的任何物质、化
合物或分子。未修饰可以、但不总是表示生物分子的野生型或天然形式。分子可以经历一系列修饰,因而每种经修饰的分子可以充当后续修饰的“未修饰的”起始分子。
[0343]
等同方案和范围
[0344]
本领域技术人员会认识到或使用不超过例行实验能够确定根据本文描述的发明的具体实施方案的许多等同方案。本发明的范围无意限于上面的描述,而是如所附权利要求所述。
[0345]
在权利要求中,诸如“一个”、“一种”和“所述”的冠词可以是指一个/种或超过一个/种,除非指示相反情形或以其它方式从上下文显而易见。如果群体成员中的一个、超过一个或所有成员存在于指定的产品或过程中、在指定的产品或过程中使用、或以其它方式与指定的产品或过程相关,则认为满足在一组的一个或多个成员之间包括“或”的权利要求或描述,除非指示相反情形或以其它方式从上下文显而易见。本发明包括这样的实施方案,其中所述组的刚好一个成员存在于给定产品或方法中、用于给定产品或方法中或者以其它方式与给定产品或方法相关。本发明包括这样的实施方案,其中所述组成员中的超过一个或全部都存在于给定产品或方法中、用于给定产品或方法中或者以其它方式与给定产品或方法相关。
[0346]
还应当指出,术语“包含”意图是开放式的,并且允许但不要求包括额外的要素或步骤。当在本文中使用术语“包含”时,因此还包括和公开术语”由
……
组成”。
[0347]
除非另有定义,否则本文使用的所有技术和科学术语具有本发明所属领域的普通技术人员所通常理解的相同含义。本文描述了用于本公开内容中的方法和材料;还可以使用本领域已知的其它合适的方法和材料。
[0348]
在给出范围的情况下,包括端点。此外,应当理解,除非另外指示或以其它方式从上下文和本领域普通技术人员的理解显而易见,以范围表述的数值在本发明的不同实施方案中可呈现处于所述范围内的任何具体数值或子范围,其精确至该范围的下限单位的十分之一,除非上下文另外清楚地指明。
[0349]
另外,应当理解,可以从任意一项或多项权利要求中明确地排除落在现有技术内的本发明的任何特定实施方案。因为这样的实施方案被视为本领域普通技术人员已知的,所以可以排除它们,即使所述排除并未在本文中明确地阐明。可以因为任何原因从任意一项或多项权利要求排除本发明的组合物的任何特定实施方案(例如,任何核酸或由其编码的蛋白;任何生产方法;任何使用方法等),无论是否与现有技术的存在相关。
[0350]
所有引用的来源,例如,在本文中引用的参考文献、出版物、数据库、数据库条目和论文,均通过引用并入本申请中,即便没有在引文中明确地说明。在引用的来源的描述与本申请发生冲突的情况下,在本申请中的描述应当占主导地位。
[0351]
章节和表的标题无意成为限制性的。
[0352]
实施例
[0353]
实施例1.调节性多核苷酸(人工初级-或前-微rna)的设计
[0354]
将人工初级-或前-微rna设计为编码人工mir(或人工sirna)的shrna或茎环结构,所述人工mir(或人工sirna)具有至少一条可以与靶核酸(例如,rna或dna)至少部分杂交的链和以下特征中的一种或多种:(a)在基础茎的基底处的ug基序,(b)在mirna环的5’末端处的ugug基序,(c)在引导链的5’末端处的尿苷,(d)从诸如mir-22的经典微rna衍生出的环结
构,(e)在3’侧翼序列处的cnnc,(f)来自诸如let-7b的经典微rna的侧接区域,和/或(g)如在过客和引导链之间的一个或多个凸起和错配。
[0355]
设计后,将所述序列工程改造或合成或插入质粒或载体中并施用给细胞或生物。合适的质粒或载体是转导或转染靶细胞的任一种。
[0356]
可以使用腺伴随病毒载体(aav)、病毒颗粒或整个病毒。
[0357]
施用导致调节性多核苷酸的加工,以产生改变靶核酸的表达水平的人工微rna。
[0358]
通过本领域的方法可以确定靶标的有效敲降,且将表现出微小的(如果有的话)脱靶效应。
[0359]
当测量加工时,调节性多核苷酸(例如,初级-或前-微rna)的有效过客-引导链双链体表现出大于95%的引导与过客链比率。
[0360]
实施例2.过客-引导链优化
[0361]
为了实现靶标表达的特异性的和有效的靶向敲降或调节,可以分别优化将形成本发明的初级-或前-微rna的茎-环结构的双链体茎的过客和引导链,例如作为sirna(小干扰rna)。
[0362]
将sirna针对选择的靶核酸设计为具有19碱基对中央双链体的经典的sirna,所述中央双链体具有在双链体的链的3’末端上的3’二核苷酸突出端,且其中反义链具有在19核苷酸区域上与靶核酸的完美互补性。
[0363]
可替换地,设计sirna,其中有义链(过客链)包含与靶核酸的小于19个核苷酸的同一性。
[0364]
做出对有义-反义(过客-引导)链双链体碱基配对的修饰以引入凸起或错配。可以在有义链的5’或3’末端处引入插入或缺失或错配,并且这些插入或缺失可以反映或不反映在引导链上。
[0365]
针对靶标敲降和其它有关的生理学和药代动力学性能,并针对脱靶效应的程度,通过本领域已知的标准方法测验得到的sirna。
[0366]
然后将表现出足够靶标敲降和微小脱靶效应的sirna(有或没有进一步修饰)工程改造为本发明的初级-或前-微rna的过客和引导链。
[0367]
实施例3.针对sod1的过客-引导链设计
[0368]
在工程改造本发明的初级-和/或前-微rna的最佳过客和引导链中,从超氧化物歧化酶1(sod1;genbank reference nm_000454.4)的序列中选择一系列19聚体有义链(过客链)序列。sod1 mrna的序列(显示为dna)是gtttggggccagagtgggcgaggcgcggaggtctggcctataaagtagtcgcggagacggggtgctggtttgcgtcgtagtctcctgcagcgtctggggtttccgttgcagtcctcggaaccaggacctcggcgtggcctagcgagttatggcgacgaaggccgtgtgcgtgctgaagggcgacggcccagtgcagggcatcatcaatttcgagcagaaggaaagtaatggaccagtgaaggtgtggggaagcattaaaggactgactgaaggcctgcatggattccatgttcatgagtttggagataatacagcaggctgtaccagtgcaggtcctcactttaatcctctatccagaaaacacggtgggccaaaggatgaagagaggcatgttggagacttgggcaatgtgactgctgacaaagatggtgtggccgatgtgtctattgaagattctgtgatctcactctcaggagaccattgcatcattggccgcacactggtggtccatgaaaaagcagatgacttgggcaaaggtggaaatgaagaaagtacaaagacaggaaacgctggaagtcgtttggcttgtggtgtaattgggatcgcccaataaacattcccttggatgtagtctgaggccccttaactcatctgttatcctgctagctgtagaaatgtatcctgataaacattaaacactgtaatcttaaaagtgtaattgtgt
gactttttcagagttgctttaaagtacctgtagtgagaaactgatttatgatcacttggaagatttgtatagttttataaaactcagttaaaatgtctgtttcaatgacctgtattttgccagacttaaatcacagatgggtattaaacttgtcagaatttctttgtcattcaagcctgtgaataaaaaccctgtatggcacttattatgaggctattaaaagaatccaaattcaaactaaaaaaaaaaaaaaaaaa(seq id no:15)。
[0369]
19聚体与有义链的最5’位置一起、与反义链(其为有义链的反向补体)一起显示在表4中。
[0370]
19聚体充当用于设计待测试的sirna的核心起始序列。
[0371]
表4.sod1 19聚体
[0372]
[0373]
[0374]
[0375]
[0376]
[0377]
[0378][0379]
然后将上面表4的核心开始有义-反义对工程改造为双链体sirna。在这样做的过程中,有义链的最3’的核苷酸在所有情况下改变为胞苷(c)核苷酸,然后仅剩下与靶标具有同一性的18个核苷酸。
[0380]
然后,添加在有义链和反义链各自的3’末端处的二核苷酸末端,从而产生表5的双链体。
[0381]
表5.针对sod1的sirna双链体
[0382]
[0383]
[0384]
[0385]
[0386]
[0387]
[0388]
[0389]
[0390]
[0391]
[0392]
[0393]
[0394][0395]
然后将sirna退火并针对sod1敲降进行试验。
[0396]
实施例4.靶向sod1的初级-和前-微rna
[0397]
将来自实施例3中的实验的发现有效的sod1 sirna的过客-引导链双链体工程改造成表达载体并转染进中枢神经系统或神经元细胞系的细胞中。即使在sirna敲降研究中使用的突出端是对于sirna而言经典的dtdt,所述合成的初级-mir或前-mir中的突出端也可以包含任何二核苷酸突出端。
[0398]
使用的细胞可以是原代细胞或源自诱导的多能干细胞(ips细胞)。
[0399]
然后测量sod1敲降,并执行深度测序以确定从在表达载体中施用的每种初级-或前-微rna加工成的确切过客和引导链。
[0400]
计算引导与过客链比率以确定敲降的效率,例如,rna诱导的沉默复合物(risc)加工的敲降的效率。
[0401]
将n-末端测序以确定切割位点和确定靶标的均匀切割百分比。如所预期的,切割高于90%。
[0402]
在一个平行研究中共转染hela细胞以分析sod1的体外敲降。使用萤光素酶构建体作为对照来确定脱靶效应。
[0403]
再次执行深度测序。
[0404]
实施例5.靶向sod1的初级-和前-微rna
[0405]
根据本发明,设计了初级-和前-微rna。这些给出在表6a、6b、7a和7b中。以5’至3’方向描述了序列,且茎-环结构的区域在表中以该次序打开。在表7a和7b中,序列的名称的“mir”组分不一定对应mirna基因的序列编号(例如,voymir-101是该序列的名称,且不一定意味着mir-101是该序列的部分)。
[0406]
表6a.前-mir序列(5
’-3’
)
[0407]
[0408]
[0409][0410]
表6b.前-mir序列(5
’-3’
)
[0411]
[0412][0413]
表7a.初级-mir序列(5
’-3’
)
[0414]
[0415]
[0416]
[0417]
[0418][0419]
表7b.初级-mir序列(5
’-3’
)
[0420][0421]
实施例6.靶向sod1的初级-和前-微rna;体内研究
[0422]
执行体内研究以测验实施例5的初级-或前-微rna构建体的功效。
[0423]
表8概述了要探究的实验设计变量。
[0424]
调节性核酸(初级-或前-微rna)的设计包括从mir30衍生出的环区域,茎区域源自let7以及在凸起、错配和不对称区域方面变化的过客链的不同组合。
[0425]
表8.实验设计
102.861、voymir-102.866、voymir-102.870、voymir-102.823、voymir-104.860、voymir-104.861、voymir-104.866、voymir-104.870、voymir-104.823、voymir-109.860、voymir-109.861、voymir-109.866、voymir-109.870、voymir-109.823、voymir-114.860、voymir-114.861、voymir-114.866、voymir-114.870、voymir-114.823、voymir-116.860、voymir-116.861、voymir-116.866、voymir-116.870、voymir-116.823、voymir-127.860、voymir-127.861、voymir-127.866、voymir-127.870、voymir-127.823)以及voymir-114和双链mcherry的对照转染进细胞中,以测验所述构建体的活性。
[0437]
a.过客和引导链在hek293中的活性
[0438]
将30种初级-mirna构建体和2种对照转染进hek293t细胞中。24小时以后,评价内源性mrna表达。大多数初级-mrna构建体表现出引导链的高活性(图3)和过客链的低至无的活性(图4)。
[0439]
b.过客和引导链在hela中的活性
[0440]
将30种初级-mirna构建体和2种对照转染进hela细胞中。48小时以后,评价内源性mrna表达。大多数初级-mrna构建体构建体表现出引导链的高活性(图5)和过客链的低至无的活性(图6)。
[0441]
c.hela和hek293相关性
[0442]
30种初级-mirna的敲降在hela和hek293细胞之间是类似的。30种初级-mirna构建体表现出构建体的引导链的敲降(参见图3和图5)。初级-mirna构建体的大多数引导链表现出70-90%敲降。
[0443]
d.衣壳选择
[0444]
将来自hela和hek293的前列(top)初级-mirna构建体包装进aav中并经历hela感染。为了确定最佳的aav以包装构建体,将包装在aav2或aav-dj8中的mcherry以10vg/细胞、1e2 vg/细胞、1e3 vg/细胞、1e4 vg/细胞或1e5 vg/细胞的moi感染进hela细胞中,并在40小时评价表达。选择aav2作为衣壳来包装前列初级-mir构建体。
[0445]
e.aav2生产
[0446]
将来自hela和hek293的前列初级-mirna构建体包装进aav2(1.6kb)中,且还包装了双链mcherry的对照(dsmcherry)。包装的构建体在分析之前经历idoixanol纯化。aav滴度显示在表9中。
[0447]
表9.aav滴度
[0448][0449][0450]
转导对hela细胞中的sod1敲降的作用显示在图7中。另外,在hela细胞中,较大的moi(1.0e+04相对于1.0e+05)没有表现出对于每种构建体而言增加的敲降。
[0451]
f.构建体在人运动神经元祖先(hmnp)中的活性
[0452]
将在实施例9e中描述的前18种初级-mirna构建体和mcherry的对照以10e5的moi感染进人运动神经元祖(hmnp)细胞中。48小时以后,评价内源性mrna表达。约一半的构建体给出hmnp中的sod1的大于50%沉默,且其中4种给出大于70%沉默(图8)。
[0453]
g.用于体内研究的构建体选择
[0454]
选择前12种初级-mirna包装的构建体,它们具有对靶序列的重大作用和对盒的微小作用。将包装在aav-rh10衣壳中的这些构建体配制成注射剂并施用在哺乳动物中以研究
所述构建体的体内作用。
[0455]
h.在不同细胞系中的活性
[0456]
在hela、sh-sy5y、u87mg和原代人星形胶质细胞细胞中测验了初级-mirna包装的构建体的活性。在hela细胞中的活性是在1-5pm范围内。在sh-sy5y细胞中的活性是在13-17pm范围内。在u87mg细胞中的活性是约1pm。在原代人星形胶质细胞中的活性是在49-123pm范围内。
[0457]
实施例10.初级-mirna的体外研究
[0458]
将包装在aav2中的在实施例9d中描述的18种初级-mirna和mcherry对照用于该研究。对于该研究,将在培养基(500ml dmem/f-12glutamax
tm
补充物(life technologies,目录号10565-018)、50ml fbs(life technologies,目录号16000-044,批号:1347556)、5ml mem非必需氨基酸溶液(100x)(目录号11140-050)和5ml hepes(1m)(life technologies,目录号15630-080))中的hek293t细胞(fisher scientific,目录号hcl4517)、在培养基(500ml dmem/f-12glutamax
tm
补充物(life technologies,目录号10565-018)、50ml fbs(life technologies,目录号16000-044,批号:1347556)、5ml mem非必需氨基酸溶液(100x)(目录号11140-050)和5ml hepes(1m)(life technologies,目录号15630-080))中的u251mg细胞(p18)(sigma,目录号09063001-1vl)或在培养基(补充了agm singlequot kit suppl.&growth factors(lonza,目录号cc-4123)的abm基础培养基500ml(lonza,目录号cc-3186))中的正常人星形胶质细胞(ha)(lonza,目录号cc-2565)用于测验构建体。接种hek293t细胞(5x10e4个细胞/孔,在96孔板中)、u251mg细胞(2x10e4个细胞/孔,在96孔板中)和ha细胞(2x10e4个细胞/孔,在96孔板中),且用于感染细胞的moi是1.0e+05。48小时以后,分析细胞,结果显示在表10中。
[0459]
表10.相对sod1 mrna水平
[0460]
[0461][0462]
对于大多数构建体,在hek293t细胞中看到大于80%敲降。超过一半的构建体在u251mg细胞中和在ha细胞中表现出大于80%敲降。
[0463]
实施例11.剂量依赖性的sod1降低
[0464]
将在实施例9e中描述的前18种初级-mirna构建体中的4种和mcherry的对照以1.0e+02、1.0e+03、1.0e+04、1.0e+05或1.0e+06的moi转染进人星形胶质细胞细胞系(u251mg)或原代人星形胶质细胞(ha)中。48小时以后,评价内源性mrna表达和剂量依赖性的沉默,并显示在图9(u251mg)和图10(ha)中。对于所有构建体,剂量的增加也与敲降的sod1 mrna的量的增加相关联。
[0465]
实施例12.sod1敲降的时程
[0466]
将两种初级-mirna构建体(voymir-120和voymir-122)、sod1 sirna的阴性对照和阳性对照转染进人星形胶质细胞细胞系(u251mg)中。确定相对sod1 mrna 60小时,如在图11中所示。在nucleofector转染以后,对于两种初级-mir构建体都看到70-75%的hsod1敲降,在12-24小时窗口中看到最大敲降。
[0467]
实施例13.sod1敲降和站立百分比
[0468]
将voymir-104以50pm、100pm和150pm的浓度转染进hela细胞中,并与未处理的(ut)细胞进行对比。在36、72、108和144小时确定相对sod1 mrna、引导链的百分比和过客链的百分比,如在图12a-12c中所示。最高浓度(150pm)表现出表达的最大减少,但是所有3种剂量表现出sod1表达的显著减少。
[0469]
实施例14.靶向sod1的初级-mirna
[0470]
为dog sod1设计初级-mirna,且所述构建体给出在表11中。在本发明所靶向的区域中,dog sod1是与人100%保守的。以5’至3’方向描述了序列,且茎-环结构的区域在表中
以该顺序打开。在表11中,序列的名称的“mir”组分不一定对应mirna基因的序列编号(例如,dvoymir-102是该序列的名称,且不一定意味着mir-102是该序列的部分)。
[0471]
表11.dog初级-mir序列(5
’-3’
)
[0472]
[0473][0474]
实施例15.调节性多核苷酸的位置的影响
[0475]
a.对病毒滴度的影响
[0476]
将调节性多核苷酸(voymir-114或voymir-126)在6个不同位置插入表达载体(基因组大小大约2400个核苷酸;scaav)中,如在图13中所示。在图13中,“itr”是反向末端重复,“i”代表内含子,“p”是聚腺苷酸且“mp”是调节性多核苷酸。对于6个位置和对于对照(没有调节性多核苷酸的构建体;scaav),使用taqman pcr评价病毒滴度,结果显示在表12中。
[0477]
表12.病毒滴度
[0478]
[0479][0480]
b.对基因组完整性的影响
[0481]
将调节性多核苷酸(voymir-114)在6个不同位置插入表达载体(基因组大小2400个核苷酸;scaav)和没有调节性多核苷酸的对照(scaav)中,如在图13中所示。在图13中,“itr”是反向末端重复,“i”代表内含子,“p”是聚腺苷酸且“mp”是调节性多核苷酸。从经纯化的aav制品提取病毒基因组并在中性琼脂糖凝胶上跑胶。在所有构建体中看到截短的基因组,且截短的基因组的近似百分比(总数的百分比)显示在表13中。
[0482]
表13.截短的基因组
[0483]
构建体总数的%位置150位置242位置349位置434位置533位置659对照9
[0484]
位置6具有最大数目的截短的基因组,而位置4和5具有最小量的截短的基因组。
[0485]
c.对敲降效率的影响
[0486]
将调节性多核苷酸(voymir-114)在6个不同位置插入表达载体(aav2)(基因组大小2400个核苷酸;scaav)中,如在图13中所示。在图13中,“itr”是反向末端重复,“i”代表内含子,“p”是聚腺苷酸且“mp”是调节性多核苷酸。在1x 104vg/细胞、1x 103vg/细胞和1x 102vg/细胞进行hela细胞的转导。在感染后72小时确定sod1 mrna表达(作为对照(egfp)的
百分比),结果显示在表14中。
[0487]
表14.sod1表达
[0488][0489]
位置3具有最高的sod1 mrna表达(作为对照的%),且位置4具有最低的sod1mrna表达(作为对照的%)。
[0490]
实施例16.基因组大小的影响
[0491]
a.对病毒滴度的影响
[0492]
将调节性多核苷酸(voymir-114)在位置1、2、5和6处插入表达载体(基因组大小2kb;scaav)中,如在图13中所示。在图13中,“itr”是反向末端重复,“i”代表内含子,“p”是聚腺苷酸且“mp”是调节性多核苷酸。将没有调节性多核苷酸的双链对照(基因组大小1.6kb;scaav对照)和双链表达载体(scaav mir114;itr(105核苷酸)-启动子(~900个核苷酸)-调节性多核苷酸(158个核苷酸)-聚腺苷酸序列(127个核苷酸)和itr)进行对比,以及不含调节性多核苷酸的对照(egfp;scaav)。使用taqman pcr评价病毒滴度,结果显示在表15中。
[0493]
表15.病毒滴度
[0494]
构建体大小病毒滴度(vg/15-cm盘)位置12kb9.5e+10位置22kb1.2e+11scaav mir1141.6kb1.1e+11位置52kb2.4e+10位置62kb1.1e+11对照2kb2.2e+11
[0495]
用位置5构建体看到最低病毒滴度,用位置2构建体看到最大值。
[0496]
b.对基因组完整性的影响
[0497]
将调节性多核苷酸(voymir-114)在位置1、2、5和6处插入表达载体(基因组大小2kb;scaav)中,如在图13中所示。在图13中,“itr”是反向末端重复,“i”代表内含子,“p”是聚腺苷酸且“mp”是调节性多核苷酸。将没有调节性多核苷酸的双链对照(基因组大小
1.6kb;scaav对照)和双链表达载体(scaav mir114;itr(105核苷酸)-启动子(~900个核苷酸)-调节性多核苷酸(158个核苷酸)-聚腺苷酸序列(127个核苷酸)和itr)进行对比,以及不含调节性多核苷酸的对照(egfp;scaav)。在所有构建体中看到截短的基因组,且截短的基因组的近似百分比(总数的百分比)显示在表16中。
[0498]
表16.截短的基因组
[0499]
构建体大小总数的%位置12kb34位置22kb30scaav mir1141.6kb20位置52kb21位置62kb46对照2kb5
[0500]
确定所有构建体都具有一些截短的基因组。
[0501]
进行另一项研究以确定不同的调节性多核苷酸的影响。将voymir-114和voymir-126插入单独的表达载体(基因组大小1.6kb;scaav)中,调节性多核苷酸靠近3’itr(正向取向)。对于voymir-114构建体,载体基因组(1526个核苷酸)的5’末端和调节性多核苷酸的中心(柔性环的中央)之间的距离是1115个核苷酸。对于voymir-126构建体,载体基因组(1626个核苷酸)的5’末端和调节性多核苷酸的中心(柔性环的中央)之间的距离是1164个核苷酸。
[0502]
对于voymir-114构建体,病毒滴度(vg/15-cm盘)是约1.1e+11。对于voymir-126构建体,内含子探针病毒滴度(vg/15-cm盘)是约1.2e+12。对照是约2.1e+11(vg/15-cm盘)。voymir-114具有约20%截短的基因组,voymir-126具有约15%截短的基因组,且对照具有约5%截短的基因组。
[0503]
实施例17.单链构建体的影响
[0504]
a.对病毒滴度的影响
[0505]
将调节性多核苷酸(voymir-114)在位置1、3和5处插入表达载体(基因组大小4.7kb;ssaav)中,如在图13中所示,并且也试验了不含调节性多核苷酸的对照(基因组大小2kb;ssaav)。在图13中,“itr”是反向末端重复,“i”代表内含子,“p”是聚腺苷酸且“mp”是调节性多核苷酸。使用taqman pcr评价病毒滴度,结果显示在表17中。
[0506]
表17.病毒滴度
[0507]
构建体病毒滴度(vg/15-cm盘)位置15.0e+11位置37.5e+11位置53.5e+11对照2.5e+11
[0508]
位置3显示出最大病毒滴度,其次是位置1,然后是位置5。
[0509]
b.对基因组完整性的影响
[0510]
将调节性多核苷酸(voymir-114)在位置1、3和5处插入表达载体(基因组大小4.7kb;ssaav)中,如在图13中所示,并且也试验了不含调节性多核苷酸的对照(基因组大小
2kb;ssaav)。在图13中,“itr”是反向末端重复,“i”代表内含子,“p”是聚腺苷酸且“mp”是调节性多核苷酸。从经纯化的aav制品提取病毒基因组并在中性琼脂糖凝胶上跑胶。在所有构建体中都看到截短的基因组,且截短的基因组的近似百分比(总数的百分比)显示在表18中。
[0511]
表18.截短的基因组
[0512]
构建体总数的%位置148位置330位置572对照0
[0513]
位置5具有最大数目的截短的基因组,而位置3具有最小量的截短的基因组。
[0514]
c.对敲降效率的影响
[0515]
将调节性多核苷酸(voymir-114)在位置1、3和5处插入表达载体(基因组大小4.7kb;ssaav)中,如在图13中所示,并且存在不含调节性多核苷酸的单链对照(基因组大小2kb;ssaav对照)、没有调节性多核苷酸的双链对照(基因组大小1.6kb;scaav对照)和双链表达载体(scaav mir114;itr(105核苷酸)-启动子(~900个核苷酸)-调节性多核苷酸(158个核苷酸)-聚腺苷酸序列(127个核苷酸)和itr)。在图13中,“itr”是反向末端重复,“i”代表内含子,“p”是聚腺苷酸且“mp”是调节性多核苷酸。在1x 104vg/细胞、1x 103vg/细胞和1x 102vg/细胞进行hela细胞的转导。在感染后72小时确定sod1 mrna表达(作为对照(egfp)的百分比),结果显示在表19中。
[0516]
表19.sod1表达
[0517][0518][0519]
位置3具有最高的sod1 mrna表达(作为对照的%),然后是位置1,具有最低sod1mrna表达(作为对照的%)的单链构建体是位置5。所述单链构建体都没有象具有调节性多核苷酸的双链对照一样低的敲降效率。
[0520]
实施例18.sod1体内敲降
[0521]
为了评价初级-mirna的体内生物活性,将自互补的初级-mirna(voymir-114.806、voymir127.806、voymir102.860、voymir109.860、voymir114.860、voymir116.860、
voymir127.860、voymir102.861、voymir104.861、voymir109.861、voymir114.861、voymir109.866、voymir116.866或voymir127.866)包装在具有cba启动子的aav-dj中。
[0522]
在小鼠中,通过10分钟纹状体内输注施用这些包装的初级-mirna或仅媒介物的对照(含有5%山梨醇和0.001%f-68的磷酸盐缓冲盐水)。表达人sod1且具有大约20-30g体重的雌性或雄性tg(sod1)3cje/j小鼠(jackson laboratory,bar harbor,me)接受5ul靶向纹状体的试验物的单侧注射(前后位+0.5mm,中侧位+2mm,相对于前囟点;背腹3.8mm,相对于头盖骨表面)。以0.5ul/min注射试验物(每种试验物5只动物)。使用具有33号针的、预填充的泵调节的hamilton微注射器(1701型,10μl)。在注射后1、2、3、4或6周,将动物处死,取出脑,将来自1mm冠板(coronal slab)的同侧纹状体(包括输注部位)以及来自邻近1mm冠板的纹状体组织切开并快速冷冻。将小鼠组织样品裂解,并定量人sod1蛋白水平以及sod1和小鼠gapdh(mgapdh)mrna水平。通过elisa(ebioscience(affymetrix,san diego,ca))定量sod1蛋白水平,并通过bca分析(thermofisher scientific,waltham,ma)定量总蛋白水平。对于每个组织样品,将归一化至总蛋白的sod1蛋白水平计算为2次测定的平均值。将这些归一化的sod1蛋白水平进一步归一化至媒介物组,然后平均化以得到组(治疗)平均值。通过qrt-pcr定量sod1和mgapdh mrna水平。对于每个组织样品,将sod1/mgapdh的比率(归一化的sod1mrna水平)计算为3次测定的平均值。然后将这些比率平均化以得到组(治疗)平均值。将这些组平均值进一步归一化至媒介物组。
[0523]
在非人灵长类动物中,通过鞘内腰椎推注施用试验物(1x 10
13-3x 10
13
vg的包装在具有cba启动子的aav-dj中的初级-mirna)或媒介物。具有大约2.5-8.5kg体重的雌性食蟹猴(成束猴,cr research model houston,houston,tx)接受植入的单个鞘内导管,所述导管的尖部位于腰椎处。以大约60分钟间隔施用试验物(每种试验物4只动物),包括3次1ml快速推注(1ml/分钟)。在施用后4-6周,将动物处死,并将选择的组织收获用于生物分析和组织学评价。针对用包装在具有cba启动子的aav-dj中的初级-mirna治疗以后的抑制,相对于媒介物组评估sod1蛋白和mrna水平。
[0524]
实施例19.使用voymir-114.806的体内sod1敲降
[0525]
在tg(sod1)3cje/j小鼠中,如在实施例18中所述,施用包装在具有cba启动子的aavdj中的voymir-114.806。通过单侧纹状体内施用,给小鼠施用3.7x 109vg的剂量。1或2周以后,不存在归一化的sod1蛋白水平的显著下降;归一化的sod1蛋白水平在1和2周以后分别是媒介物对照组的98
±
11%(标准差)和98
±
10%。截至第3周,voymir-114.806使归一化的sod1蛋白水平降低至媒介物对照组的84
±
9.0%,这是统计上显著的(p<0.05,具有dunnett氏事后分析的单因素方差分析)。截至第4和6周,voymir-114.806使归一化的sod1蛋白水平分别降低至媒介物对照组的73
±
7.9%(p<0.0001)和75
±
7.4%(p<0.0001)。这些结果证实,包装在具有cba启动子的aav-dj中的voymir-114.806在体内下调sod1蛋白水平中是有效的。另外,这些结果证实,低至3.7x 109vg的包装在具有cba启动子的aavdj中的voymir-114.806的总纹状体内剂量导致sod1蛋白水平的显著下调。
[0526]
尽管已经就几个描述的实施方案而言相当详尽地且相当特定地描述了本发明,但是无意将本发明限于任何这样的细节或实施方案或任何具体实施方案,而是应当参考所附权利要求来解释本发明,从而考虑到现有技术提供这类权利要求的最广泛的可能解释,并因此有效地包括本发明的预期范围。
[0527]
在本文中提及的所有出版物、专利申请、专利和其它参考文献通过引用整体并入。如果出现矛盾,以本说明书及其中的定义为准。另外,段落标题、材料、方法和实施例仅仅是示例性的,且无意成为限制性的。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1