一种绣球原生质体制备及瞬时转化的方法与流程
1.本发明涉及一种绣球原生质体制备及瞬时转化的方法,属于细胞生物学技术领域。
背景技术:
2.植物原生质体是去除细胞壁的裸露细胞,具有细胞全能性,有再分化为完整生物体的潜能。已被广泛用于植物细胞生物学研究领域,如基因瞬时表达、种质资源改良、目标基因亚细胞定位、蛋白互作等。原生质体在植物转基因、基因功能验证等方面具有广阔的应用前景。
3.绣球[hydrangea macrophylla(thunb.)ser.]又名绣球花、紫阳花、八仙花等,为虎耳草科绣球属观赏植物。具有适应性强、抗逆性强、病虫害少等优点,而且该属植物花型多样、花色丰富、花期较长,被广泛用于园林绿化、盆栽、切花等,具有较强的观赏和经济价值。近年来对绣球的研究多集中在栽培和育种领域,而绣球分子生物学特性相关研究主要在于分子标记的开发、铝转运相关基因功能分析等。由于绣球遗传转化体系尚不成熟,限制了利用转基因体系验证目的基因功能的研究。因此,开展绣球原生质体制备及瞬时转化研究具有重要意义。
[0004]
目前,已有研究利用绣球萼片进行原生质体分离的方法,但所用材料萼片只能在花期取样进行,原生质体的分离受时间限制,操作受限,如果可以直接取材于绣球叶片进行原生质体制备与转化,操作将不受时间限制。
技术实现要素:
[0005]
为了解决以上问题,本发明的目的在于提供一种绣球原生质体制备及瞬时转化的方法。
[0006]
为实现本发明的目的,本发明提供一种绣球原生质体的制备方法,包括:
[0007]
s1.选择绣球植株叶片,将所述叶片的叶缘切除,并垂直于所述叶片的主叶脉将所述叶片切成多个条状片体备用;优选的,所述叶片选自组培苗植株叶片、或任意植株幼嫩叶片;所述的幼嫩叶片为植株顶芽下面第3-6位叶片;所述叶片切条约1mm宽;
[0008]
s2.将步骤s1中的叶片迅速放入盛有酶解液的容器中,暗培养助于酶解;其中所述暗培养的条件优选为25~28℃暗培养12~15h;
[0009]
所述酶解液中包含mes、甘露醇、纤维素酶、离析酶、牛血清蛋白、kh2po4;
[0010]
所述纤维素酶为纤维素酶r-10,离析酶为离析酶r-10;
[0011]
所述酶解液中各成分含量分别为:ph值为5.7、浓度为5mm的mes,0.4~0.8m的甘露醇,1~1.5%(w/v)纤维素酶,0.5~0.8%(w/v)离析酶,0.1%牛血清蛋白,30~50mm的kh2po4。
[0012]
其中酶解液的制备方法为:将5mm mes(ph 5.7)、0.4~0.8m甘露醇、1~1.5%(w/v)纤维素酶r-10和0.5~0.8%(w/v)离析酶r-10混匀,55℃温浴10min,待冷却到室温后加
入30~50mm kh2po4和0.1%牛血清蛋白;最后过滤灭菌,得到酶解液,-20℃保存备用。
[0013]
s3.在步骤s2中容器中加入w5溶液,混匀终止消化,然后将消化好的原生质体过滤得到液体即得到绣球原生质体;
[0014]
其中加入的w5溶液与加入的酶解液的体积相同。
[0015]
所述w5溶液配方为:2mm mes(ph 5.7)、154mm nacl、125mm cacl2和5mm kcl,加入无菌水定容至100ml。
[0016]
本发明还提供一种绣球原生质体瞬时转化的方法,包括:
[0017]
s1.将上述得到的原生质体离心,弃上清,混匀原生质体;加入w5溶液,轻轻混匀后,低温(0~8℃)静置30min。
[0018]
其中所述离心条件为4℃条件下800~1000rpm
·
min-1
离心2min。所述w5溶液加入体积与原生质体制备过程中加入的酶解液体积相同。
[0019]
s2.弃上清,加入mmg溶液混匀将原生质体稀释,低温静置(0~8℃);
[0020]
其中mmg溶液配方为:4mm mes(ph 5.7)、0.4m甘露醇、15mm mgcl2,无菌水定容至100ml。
[0021]
s3.加入质粒和原生质体,轻柔混匀;然后加入peg溶液,轻柔混匀,室温静置10~20min。
[0022]
其中,所述质粒为带有目的基因片段的质粒或空载体,如p35s-gfp;
[0023]
所述质粒和原生质体的体积比为1:10;
[0024]
所述加入的peg溶液的体积与质粒和原生质体的总体积相同。
[0025]
所述peg溶液配方为:20~30%peg,0.2~0.4m甘露醇,50~100mm cacl2和20g
·
l-1
葡萄糖。
[0026]
s4.加入mmg溶液,轻柔混匀,离心,吸去上清。然后用w5溶液重悬原生质体,25℃光照培养12~15h,激光共聚焦显微镜观察基因表达情况。
[0027]
所述加入的mmg溶液与步骤s3最终得到溶液的体积比为2:1。
[0028]
所述光照培养设置为弱光照或在盛放原生质体的容器上盖一层白纸。
[0029]
本发明的有益效果:
[0030]
本发明所提供的一种绣球原生质体制备及瞬时转化的方法,具有以下优点和有益效果:
[0031]
(1)与现有技术相比,本发明所述的绣球原生质体制备及瞬时转化系统,利用叶片制备原生质体不受季节限制,操作简单并易于实现;
[0032]
(2)本发明所述的绣球原生质体制备方法,所用酶解液配方简单,获得的原生质体产量高、活性强;
[0033]
(3)本发明所述的绣球原生质体制备方法,所用酶解液中添加kh2po4,可显著增加原生质体质膜稳定性,有效保持原生质体活力;
[0034]
(4)本发明针对绣球叶片原生质体建立了相应的瞬时转化方法,操作简便、转化效率高;
[0035]
(5)本发明提供了一套高效获取绣球原生质体并进行瞬时转化的方法,为绣球基础和应用研究提供平了重要的技术支持,以促进绣球产业发展。
附图说明
[0036]
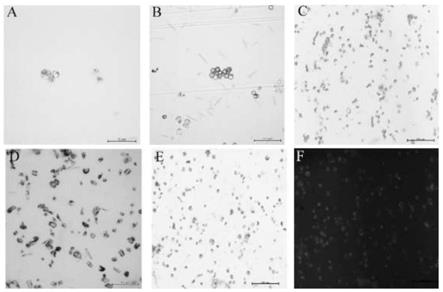
图1为不同酶解时间条件下绣球叶片原生质体分离的效果与活力检测;图中a为酶解6h得到的原生质体,bar=50μm;b为酶解9h得到的原生质体,bar=100μm;c为酶解12h得到的原生质体,bar=100μm;d为酶解15h得到的原生质体,bar=100μm;e为白光下原生质体,bar=100μm;f为fda染色后原生质体活力,bar=100μm。
[0037]
图2为放置于实施例2中处理组5的酶解液2d后绣球原生质体活力:a,白光下原生质体,bar=100μm;f,fda染色后原生质体活力,bar=100μm。
[0038]
图3为peg介导的绣球叶片原生质体瞬时表达;图中a为白光下绣球原生质体,bar=18μm;b为得到的原生质体转化p35s-gfp载体的绣球原生质体,bar=18μm。
具体实施方式
[0039]
为了更加清楚的理解本发明的目的、技术方案及有益效果,以下通过具体实施例对本发的技术方案进行进一步详细说明,但是本发明的保护范围不限于以下实施例。根据本领域普通技术知识和惯用手段做出的各种替换或变换,都应包含在本发明的保护范围中。
[0040]
本发明实施例中所用材料及试剂如下:
[0041]
1、植株选择
[0042]
选取江苏省农业科学院培养室中的虎耳草科绣球属大花绣球
‘
bailer’(endless summer
tm
,中文译名无尽夏)植株幼嫩叶片。
[0043]
2、试剂配制:
[0044]
w5溶液:于无菌瓶中分别加入2mm mes(ph 5.7)、154mm nacl、125mm cacl2和5mm kcl,然后加入无菌水定容至100ml。
[0045]
mmg溶液:于无菌瓶中分别加入4mm mes(ph 5.7)、0.4m甘露醇和15mm mgcl2,然后加入无菌水定容至100ml。
[0046]
实施例1:绣球叶片原生质体的制备
[0047]
本实施例中针对绣球叶片原生质体制备用酶解液组合(包括mes、甘露醇、纤维素酶r-10、离析酶r-10和kh2po4)进行试验,采用五因素四水平(l
16
(45))正交实验设计的方法,具体实施如下:
[0048]
s1.选择绣球组培苗叶片,用刀片将叶缘切除,并垂直于主叶脉将叶片切成细条备用(约1mm宽);
[0049]
s2.将步骤s1中的叶片迅速放入盛有酶解液的培养皿中,25~28℃暗培养12~15h。
[0050]
其中,所述的酶解液配制方法如下:
[0051]
于50ml离心管中加入5mm mes(ph 5.7)、0.8~1m甘露醇、1~1.5%(w/v)纤维素酶r-10和0.5~0.8%(w/v)离析酶r-10,55℃温浴10min,待冷却到室温后加入30~50mm kh2po4和0.1%牛血清蛋白;最后利用0.45μm滤膜过滤灭菌,得到酶解液,-20℃保存备用。
[0052]
s3.在消化好的酶解液中沿培养皿壁缓缓加入等体积的w5溶液,轻轻混匀终止消化,然后用细胞筛将消化好的原生质体过滤到离心管中即得到绣球原生质体,显微镜下观察。
[0053]
s4.镜检观察原生质体,产量测定采用血球计数板进行统计,活力检测采用fda(荧光素双醋酸酯)染色法。
[0054]
其中,所述的血球计数板测定原生质体产量操作如下:将血球计数板用擦镜纸擦净,在中央的计数室盖上专用的盖玻片;取10μl制备好的绣球原生质体滴加在血球计数板上,使其充满整个计数室,显微镜下观察统计;统计中间大格内的原生质体数,根据公式计算原生质体产量:原生质体产量(个
·
ml-1
)=原生质体数
×5×
1000
×
稀释倍数。
[0055]
其中,所述的fda染色法操作如下:在100μl原生质体悬液中加入5μl 0.01%fda,轻柔混匀,静置3~5min后,吸取15μl用于观察。
[0056]
结果如表1所示,组合3即5mm mes(ph 5.7)、0.8m甘露醇、1.5%纤维素酶r-10、0.8%离析酶r-10、50mm kh2po4和0.1%牛血清蛋白,可以得到质量好、产量高的原生质体,其次是组合2即5mm mes(ph 5.7)、0.4m甘露醇、1%纤维素酶r-10、0.5%离析酶r-10、30mm kh2po4和0.1%牛血清蛋白;fda染色观察荧光,发蓝色光原生质体最多,活性最高。
[0057]
表1不同酶解液组合对绣球原生质体产量和活力的影响
[0058][0059]
实施例2:绣球叶片原生质体的制备
[0060]
本实施例中针对绣球叶片原生质体制备酶解时间进行试验,设置0、6、9、12、15、16、17、18h,具体实施如下:
[0061]
s1.选择绣球植株顶芽下面第3-6位叶片,用刀片将叶缘切除,并垂直于主叶脉将叶片切成细条备用(约1mm宽);
[0062]
s2.将步骤s1中的叶片迅速放入盛有酶解液(5mm mes(ph 5.7)、0.8m甘露醇、1.5%(w/v)纤维素酶r-10、0.8%(w/v)离析酶r-10、50mm kh2po4和0.1%牛血清蛋白)的培养皿中,25~28℃暗培养12~15h。
[0063]
s3.在消化好的酶解液中沿培养皿壁缓缓加入等体积的w5溶液,轻轻混匀终止消化,然后用细胞筛将消化好的原生质体过滤到离心管中。
[0064]
s4.镜检观察原生质体。
[0065]
结果如表2和图1所示,将绣球叶片置于最佳酶液组合中,以酶解时间为0h作为对
照,酶解时间为6h时,原生质体有游离,但是产量很低;随着酶解时间的延长,原生质体的产量逐渐增加,12h后产量较高,当酶解15h时,原生质体出现破裂。因此,对于获得大量有活力的原生质体,12~15h为最佳酶解时间。
[0066]
表2不同处理时间对绣球原生质体状态的影响
[0067]
处理组酶解时间(h)原生质体状态10无26有游离,产量很低39有游离,产量低412有游离,产量较高515有游离,产量较高,部分开始破裂616破碎717破碎818破碎
[0068]
实施例3:绣球叶片原生质体制备
[0069]
本实施例中针对kh2po4浓度对绣球叶片原生质体活力的影响进行试验,设置0、20、30、40、50、60mm,具体实施如下:
[0070]
s1.选择绣球组培苗顶部幼嫩的叶片,用刀片将叶缘切除,并垂直于主叶脉将叶片切成细条备用(约1mm宽);
[0071]
s2.将步骤s1中的叶片迅速放入盛有酶解液(5mm mes(ph 5.7)、0.8m甘露醇、1.5%(w/v)纤维素酶r-10、0.8%(w/v)离析酶r-10、0~60mm kh2po4和0.1%牛血清蛋白)的培养皿中,25~28℃暗培养12~15h。
[0072]
s3.在消化好的酶解液中沿培养皿壁缓缓加入等体积的w5溶液,轻轻混匀终止消化,然后用细胞筛将消化好的原生质体过滤到离心管中。
[0073]
s4.镜检观察原生质体。
[0074]
结果如图2和表3所示,处理4(40mm kh2po4)和处理5(50mm kh2po4)在酶解之后放置2d镜检观察,原生质体活力仍然高达95%以上,其次,处理3(30mm kh2po4)原生质体活力也比较高。由此可见,kh2po4可显著增强原生质体稳定性,有效保持原生质体活力。
[0075]
表3.kh2po4浓度对绣球叶片原生质体活力的影响
[0076][0077]
实施例4:绣球原生质体瞬时转化
[0078]
本实施例中针对绣球叶片原生质体转化条件进行试验,peg转化液包括peg浓度、
甘露醇、cacl2和葡萄糖,采用四因素三水平(l9(34))正交实验设计的方法,具体实施如下:
[0079]
s1.选择绣球组培苗顶部幼嫩的叶片,用刀片将叶缘切除,并垂直于主叶脉将叶片切成细条备用(约1mm宽);
[0080]
s2.将步骤s1中的叶片迅速放入盛有酶解液(5mm mes(ph 5.7)、0.8m甘露醇、1.5%(w/v)纤维素酶r-10、0.8%(w/v)离析酶r-10、50mm kh2po4和0.1%牛血清蛋白)的培养皿中,25~28℃暗培养12~15h。
[0081]
s3.在步骤s2中消化好的酶解液中沿培养皿壁缓缓加入等体积的w5溶液,轻轻混匀终止消化,然后用细胞筛将消化好的原生质体过滤到预冷的50ml离心管中,4℃,800~1000rpm
·
min-1
离心2min,弃上清,轻柔混匀原生质体;沿管壁缓缓加入5ml w5溶液,轻轻混匀后,于冰上静置30min。
[0082]
s4.吸出上清,加入mmg溶液轻轻混匀将原生质体稀释,冰上放置。
[0083]
s5.在2ml离心管中加入质粒p35s-gfp(常规市售)和原生质体(体积比1:10),轻柔混匀;然后沿管壁轻轻加入等体积的新鲜配置的peg溶液,轻柔混匀,室温静置10~20min。
[0084]
s6.加入两倍体积的mmg溶液,轻柔混匀,1000rpm
·
min-1
离心2min,吸去上清。然后用w5溶液重悬原生质体,25℃光照培养箱培养12~15h(设置弱光照或在离心管上盖一层白纸),激光共聚焦显微镜观察基因表达情况。
[0085]
结果如表4和图3所示,葡萄糖对于绣球原生质体转化效率影响较小,处理2、3和5的原生质体较完整,碎片没有或较少,且转化效率较高,均高达50%以上。综上,利用peg介导的绣球原生质体进行转化,peg浓度为20~30%、甘露醇浓度为0.2~0.4m、cacl2浓度为50~100mm时,可以得到原生质体状态较好,且转化效率较高的结果。
[0086]
表4不同转化液对绣球原生质体转化效率的影响
[0087]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1