核苷类衍生物改性的核酸适体sgc8
development.2016,5,16014
16.[5]jayeeta banerjee.marit n hamilton.j mol med 2013.
[0017]
[6]sorah yoon,jhon j.rossi,el al.mol ther nucleic acids,2017,6,80-88.
[0018]
[7]sven kruspe,ulrich hahn,2014,9,1998-2011.
[0019]
[8]dihua shangguan,ying li,zhiwen tang,et.al.pnas,2006,103,11838-11843.
[0020]
[9]dihua shangguan,et.al.j proteome res,2008,2133-2139.
技术实现要素:
[0021]
本发明提供了一种核苷类衍生物改性的核酸适体,以改善核酸适体sgc8的稳定性、成药性,使其能够用于靶向性成像以及治疗等方面。
[0022]
本发明涉及了一种核苷类衍生物改性的核酸适体,包括如seq no:1所示的序列,所述核酸适体的至少一个核苷酸由核苷类衍生物替换,和/或末端经核苷类衍生物连接修饰。
[0023]
优选地,所述的核苷类衍生物为胸腺嘧啶核苷衍生物或胞嘧啶核苷衍生物。
[0024]
优选地,所述至少两个核苷酸由核苷类衍生物替换,优选地为两个核苷酸、四个核苷酸、六个核苷酸、八个核苷酸或十个核苷酸;优选地,所述替换发生在所述核酸适体的第9位-34位、和/或第1位-8位、和/或第35位-第41位;优选地,所述核酸适体的末端连接包括至少一个核苷类衍生物的核苷酸片段。
[0025]
本发明的一个实施例中,所述核苷类衍生物为5-fu或其衍生物,以替换所述核酸适体的目标位置的胸腺嘧啶核苷酸;所述5-fu或其衍生物替换所述核酸适体的第2位、第4位、第8位、第11位、第27位、第30位、第32位、第37位或第38位的一个、两个或多个;优选地,所述5-fu或其衍生物替换所述核酸适体的第11位、第27位、第30位和第32位。
[0026]
优选地,所述核酸适体的5’端连接包括至少一个5-fu或其衍生物的核苷酸片段,所述核苷酸片段的长度为至少5个核苷酸或其衍生物;优选地,所述核苷酸片段为5
’‑
fffff-。
[0027]
本发明的另外实施例中,所述核苷类衍生物为吉西他滨或其衍生物,其替换所述核酸适体的胞嘧啶核苷酸;所述吉西他滨或其衍生物替换所述核酸适体的第9位-34位、和/或第1位-8位的胞嘧啶核苷酸;更优选地,所述吉西他滨或其衍生物替换所述核酸适体的第10位、第13位、第15位、第16位、第18位、第19位、第29位、第34位的一个或多个胞嘧啶核苷酸;所述核酸适体5’段连接包括至少一个吉西他滨或其衍生物的核苷酸片段,所述核苷酸片段的长度为至少7个核苷酸或其衍生物;优选地,所述核苷酸片段为5
’‑
t(gem)t(gem)t(gem)-或5
’‑
t(gem)t(gem)t(gem)t-。
[0028]
核苷类衍生物改性的核酸适体,所述核酸适体的核苷酸同时分别被5-fu或其衍生物和吉西他滨或其衍生物替换,和/或末端经核苷类衍生物连接修;所述5-fu或其衍生物替换所述核酸适体的第2位、第4位、第8位、第11位、第27位、第30位、第32位、第37位或第38位的一个、两个或多个;所述吉西他滨或其衍生物替换所述核酸适体的第10位、第13位、第15位、第16位、第18位、第19位、第29位、第34位的一个或多个胞嘧啶核苷酸。
[0029]
本发明的具体实施例中,所述5-fu或其衍生物替换所述核酸适体的第11位、第27
位、第30位、第32位,所述吉西他滨或其衍生物替换所述核酸适体的第10位、第13位、第15位、第16位、第18位、第19位、第29位;或者,所述5-fu或其衍生物替换所述核酸适体的第11位、第27位、第30位、第32位,所述吉西他滨或其衍生物替换所述核酸适体的第3位、第7位、第10位、第13位、第15位、第16位、第18位、第19位、第29位、第34位;或者,所述5-fu或其衍生物替换所述核酸适体的第2位、第4位、第8位、第11位、第27位、第30位、第32位、第37位和第38位,所述吉西他滨或其衍生物替换所述核酸适体的第10位、第13位、第15位、第16位、第18位、第19位、第29位;或者,所述5-fu或其衍生物替换所述核酸适体的第2位、第4位、第8位、第11位、第27位、第30位、第32位、第37位和第38位,所述吉西他滨或其衍生物替换所述核酸适体的第3位、第7位、第10位、第13位、第15位、第16位、第18位、第19位、第29位。
[0030]
优选地,所述核酸适体的5’端和/或3’端修饰连接包括一个或多个核苷类衍生物的核苷酸片段。
[0031]
本发明另涉及的核苷酸类衍生物改性的核酸适体,如上所述的核苷类衍生物改性的核酸适体,其末端由c18修饰、peg修饰或倒t修饰(invert dt)。
[0032]
本发明涉及的核苷类衍生物改性的核酸适体,用于肿瘤靶向成像或光动力学治疗中用于成像的用途,和/或用于制备治疗细胞增殖性疾病药物的用途。
附图说明
[0033]
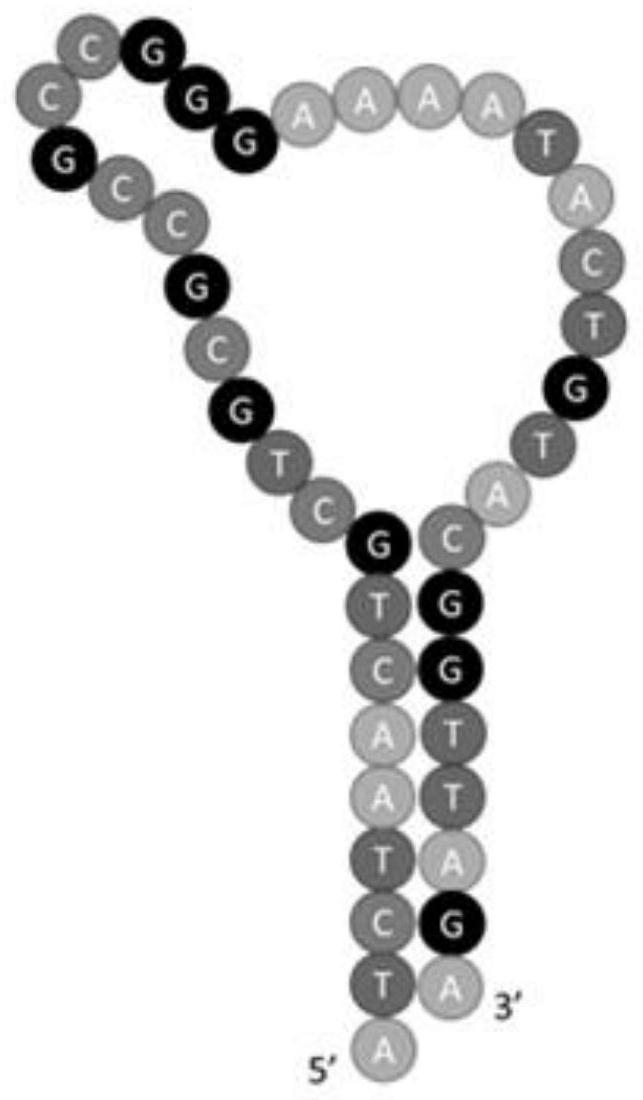
图1是未改性的序列sgc8;
[0034]
图2是环部进行了4个5-fu取代的序列;
[0035]
图3是全序列进行5-fu取代的序列;
[0036]
图4是末端进行5个5-fu修饰并且环部进行了4个5-fu取代的序列;
[0037]
图5是末端进行5个5-fu修饰的序列;
[0038]
图6是环部进行了7个吉西他滨修饰的序列;
[0039]
图7是序列进行全部吉西他滨取代胞嘧啶的序列;
[0040]
图8是末端连接了3个吉西他滨的序列;
[0041]
图9是全取代加末端修饰吉西他滨的序列;
[0042]
图10是环部进行吉西他滨取代胞嘧啶的序列;
[0043]
图11是吉西他滨全取代及环部5-fu取代的序列;
[0044]
图12是本发明的一个实施例中5-fu和吉西他滨(gem)改性的核酸适体。
[0045]
图13是本发明一个实施例中的5-fu和吉西他滨(gem)改性的核酸适体。
[0046]
图14是本发明实施例涉及的改性核酸适体与细胞表面结合能力变化,此变化通过结合细胞表面的核酸适体的荧光强度。
[0047]
图15是本发明实施例涉及的改性核酸适体的体外稳定性检测。
[0048]
图16是本发明实施例涉及的改性核酸适体的体内稳定性检测。
[0049]
图17是本发明实施例涉及的改性核酸适体用于体外药物活性检测的结果。
[0050]
图18是本发明实施例涉及的改性核酸适体用于体内药物活性检测的结果。
具体实施方式
[0051]
结合说明书附图和具体实施例对本发明做进一步描述,以便于更好地理解本发
fu或其衍生物替换所述核酸适体的第11位、第27位、第30位、第32位,所述吉西他滨或其衍生物替换所述核酸适体的第3位、第7位、第10位、第13位、第15位、第16位、第18位、第19位、第29位、第34位;在另外替换性实施例中,所述5-fu或其衍生物替换所述核酸适体的第2位、第4位、第8位、第11位、第27位、第30位、第32位、第37位和第38位,所述吉西他滨或其衍生物替换所述核酸适体的第10位、第13位、第15位、第16位、第18位、第19位、第29位;在另外替换性实施例中,所述5-fu或其衍生物替换所述核酸适体的第2位、第4位、第8位、第11位、第27位、第30位、第32位、第37位和第38位,所述吉西他滨或其衍生物替换所述核酸适体的第3位、第7位、第10位、第13位、第15位、第16位、第18位、第19位、第29位。
[0058]
本技术的某些特定的具体实施方式中,核酸适体或核苷类衍生物改性的核酸适体的末端可以经过修饰以进一步提高核酸适体sgc8的稳定性或成药性;例如,核酸适体的5’端连接包括至少一个5-fu或其衍生物的核苷酸片段,或者连接包括至少一个吉西他滨或其衍生物的核苷酸片段;所述核苷酸片段包括至少7个核苷酸或其衍生物,例如某些具体实施例中,核苷酸片段包括5个核苷酸或其衍生物;在另外的具体实施例中,核苷酸片段包括7个核苷酸或其衍生物。本技术的具体实施例中,此核苷酸片段可以为5
’‑
fffff-。在另外具体实施例中,此核苷酸片段为5
’‑
t(gem)t(gem)t(gem)-。在又另外具体实施例中,此核苷酸片段为5
’‑
t(gem)t(gem)t(gem)-t-。
[0059]
本技术另外的实施例中,为了能够提高本发明涉及的核酸适体的稳定性或使用性,利用稳定基团对核酸适体的末端进行修饰;例如核酸适体的末端由c18修饰、peg修饰或倒t修饰。
[0060]
下面结合具体的实施例对本技术做详细的说明。
[0061]
通过固相合成技术,根据核酸适体sgc8的序列,合成过程中分别利用5-fu和吉西他滨替换核酸适体的部分胸腺嘧啶核苷酸和胞嘧啶核苷酸,并且5’端连接核苷酸片段。
[0062]
实施例1
[0063]
本实施例得到的5-fu改性的核酸适体,其序列如下,结构如图2所示,称为1-sgc8,
[0064]5’‑
atctaactgc(5-fu)gcgccgccgggaaaa(5-fu)ac(5-fu)g(5-fu)acggttaga-3’。
[0065]
实施例2
[0066]
本实施例得到的5-fu改性的核酸适体,其序列如下,结构如图3所示,称为2-sgc8,
[0067]5’‑
a(5-fu)c(5-fu)aac(5-fu)gc(5-fu)gcgccgccgggaaaa(5-fu)ac(5-fu)g(5-fu)acgg(5-fu)(5-fu)aga-3’。
[0068]
实施例3
[0069]
本实施例得到的5-fu改性的核酸适体,其序列如下,结构如图4所示,称为3-sgc8,
[0070]5’‑
(5-fu)(5-fu)(5-fu)(5-fu)(5-fu)atctaactgc(5-fu)gcgccgccgggaaaa(5-fu)ac(5-fu)g(5-fu)acggttaga-3’。
[0071]
实施例4
[0072]
本实施例得到的5-fu改性的核酸适体,序列如下,其结构如图5所示,称为4-sgc8,
[0073]5’‑
(5-fu)(5-fu)(5-fu)(5-fu)(5-fu)atctaactgctgcgccgccgggaaaatactgtacggttaga-3’。
[0074]
实施例5
[0075]
本实施例得到的吉西他滨(gem)改性的核酸适体,序列如下,其结构如图6所示,称
为5-sgc8,
[0076]5’‑
atctaactg(gem)tg(gem)g(gem)(gem)g(gem)(gem)gggaaaata(gem)tgtacggttaga-3’。
[0077]
实施例6
[0078]
本实施例得到的吉西他滨(gem)改性的核酸适体,序列如下,其结构如图7所示,称为6-sgc8,
[0079]5’‑
at(gem)taa(gem)tg(gem)tg(gem)g(gem)(gem)g(gem)
[0080]
(gem)gggaaaata(gem)tgta(gem)ggttaga-3’。
[0081]
实施例7
[0082]
本实施例得到的吉西他滨(gem)改性的核酸适体,序列如下,其结构如下图8所示,称为7-sgc8,
[0083]5’‑
t(gem)t(gem)t(gem)atctaactgctgcgccgccgggaaaatactgtacggttaga-3’。
[0084]
实施例8
[0085]
本实施例得到的吉西他滨(gem)改性的核酸适体,序列如下,其结构如下图9所示,称为8-sgc8,
[0086]5’‑
t(gem)t(gem)t(gem)tatctaactg(gem)tg(gem)g(gem)(gem)g(gem)(gem)gggaaaata(gem)tgtacggttaga-3’。
[0087]
实施例9
[0088]
本实施例得到的5-fu和吉西他滨(gem)改性的核酸适体,序列如下,其结构如下图10所示,称为9-sgc8,
[0089]5’‑
atctaactg(gem)(5-fu)g(gem)g(gem)(gem)g(gem)(gem)gggaaaa(5-fu)a(gem)(5-fu)g(5-fu)acggttaga-3’。
[0090]
实施例10
[0091]
本实施例得到的5-fu和吉西他滨(gem)改性的核酸适体,序列如下,其结构如下图11所示,称为10-sgc8,
[0092]5’‑
at(gem)taa(gem)tg(gem)(5-fu)g(gem)g(gem)(gem)g(gem)(gem)gggaaaa(5-fu)a(gem)(5-fu)g(5-fu)acggttaga-3’。
[0093]
实施例11
[0094]
本实施例得到的5-fu和吉西他滨(gem)改性的核酸适体,序列如下,其结构如下图12所示,称为11-sgc8,
[0095]5’‑
a(5-fu)c(5-fu)aac(5-fu)g(gem)(5-fu)g(gem)g(gem)(gem)g(gem)(gem)gggaaaa(5-fu)a(gem)(5-fu)g(5-fu)acgg(5-fu)(5-fu)aga-3’。
[0096]
实施例12
[0097]
本实施例得到的5-fu和吉西他滨(gem)改性的核酸适体,序列如下,其结构如下图13所示,称为12-sgc8,
[0098]5’‑
a(5-fu)(gem)(5-fu)aa(gem)(5-fu)g(gem)(5-fu)g(gem)g(gem)(gem)g(gem)(gem)gggaaaa(5-fu)a(gem)(5-fu)g(5-fu)acgg(5-fu)(5-fu)aga-3’。
[0099]
实施例13靶向性
[0100]
将经改性的核酸适体250nm与结肠癌细胞hct116在200μl缓冲液体系中孵育30分
钟,清洗后检测细胞表面核酸适体的荧光强度,考察改性后的核酸适体与细胞结合能力的变化(图14),hct116为空白对照,改性后的sgc8,例如1-sgc8、2-sgc8、3-sgc8、4-sgc8、5-sgc8、6-sgc8、7-sgc8、8-sgc8,保持与原sgc8相同的结合能力,或者高于sgc8的结合能力(尤其是,5-sgc8、6-sgc8、7-sgc8、8-sgc8)。
[0101]
实施例14体外稳定性
[0102]
将核酸适体sgc8和经改性的核酸适体2-sgc8、3-sgc8、6-sgc8、8-sgc8、9-sgc8,与培养液孵育0-72小时等不同的时间(0.5h、1h、3h、6h、10h、24h、48h、72h),通过琼脂糖凝胶技术,检测所剩余的核酸的含量(图15),改性后的核酸适体的稳定性较sgc8具有明显提高,都能够提高到10小时以上。
[0103]
实施例15体内稳定性
[0104]
将上述改性的核酸适体4-sgc8 20μm/100μl,通过尾静脉注射入结肠癌细胞hct116的荷瘤小鼠体内,通过荧光成像仪对比单纯sgc8,观察小鼠肿瘤部位的荧光富集情况,及维持时间(0、0.5h、1h、2h、3h)。结果如图16所示,核酸适体4-sgc8具有不逊于单纯sgc8的稳定性。
[0105]
实施例16体外药物活性
[0106]
结肠癌细胞hct116接种96孔板,将上述改性的核酸适体sgc8、2-sgc8、3-sgc8、6-sgc8、8-sgc8配置成1nm,10nm,100nm,500nm,1000nm,10000nm等不同浓度,加入各孔中,孵育48小时后加入cck-8,检测细胞的存活情况,并统计细胞存活率,对比单纯sgc8及药物(5-fu和gem),评估改性后核酸适体的药效(图17a和图17b所示),改性后2-sgc8和3-sgc8以及6-sgc8和8-sgc8能够表现抑制细胞生长的活性,其效果与药物5-fu和gem相同和接近。
[0107]
实施例17体内药物活性
[0108]
构建结肠癌细胞hct116的皮下移植瘤模型,通过尾静脉注射药物100μl(5-fu 30mg/kg;2-sgc8、3-sgc8、4-sgc8:100mg/kg),每周两次给药,观察肿瘤的生长曲线及小鼠的存活情况。评估改性后的核酸适体的药效(图18所示),改性后的核酸适体sgc8相对于未改性的sgc8能更好地抑制肿瘤生长。
[0109]
本发明虽然已以较佳实施例公开如上,但其并不是用来限定本发明,任何本领域技术人员在不脱离本发明的精神和范围内,都可以利用上述揭示的方法和技术内容对本发明技术方案做出可能的变动和修改,因此,凡是未脱离本发明技术方案的内容,依据本发明的技术实质对以上实施例所作的任何简单修改、等同变化及修饰,均属于本发明技术方案的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1