一种γδT细胞的制备和扩增方法以及应用
一种
γδ
t细胞的制备和扩增方法以及应用
技术领域
1.本发明属于细胞生物学技术领域,涉及γδt细胞的分离,制备,扩增和应用。本发明还涉及外周血来源的γδt细胞的分离和扩增方法,γδt细胞体外基因修饰的方法,修饰后的γδt细胞在抗肿瘤领域的应用。
背景技术:
2.目前,用于癌症的t细胞免疫疗法不断发展并取得良好的临床疗效。但是仍然存在异体化治疗的障碍。γδt细胞发挥杀伤活性时不需要特异性抗原的刺激,无主要组织相容性复合体(major histocompatibility complex,mhc)限制性,具有较好的抗肿瘤活性和多种生物学功能,是肿瘤细胞免疫治疗强有力的工具。
3.根据t细胞受体(tcr)的不同,人体t淋巴细胞分为αβt细胞和γδt细胞。αβt细胞是体内主要的免疫t细胞,具有主要组织相容性复合体(mhc)介导的特异性识别抗原细胞毒功能。近年来具有非mhc限制性的γδt细胞开始逐渐受到了科研工作者的重视。正常情况下,γδt细胞约占外周血t细胞总数的5%以下,主要分布于皮肤、小肠、食管、肺、生殖器官等,为非特异性免疫细胞。γδt细胞作为重要的效应性t细胞,可分泌重要的杀伤肿瘤细胞的细胞因子,如干扰素γ(ifn-γ)和白细胞介素(il)一17a,从而具有较强的杀伤活性。
4.盐焗显示,当所述的γδt细胞被工程化以表达嵌合共刺激受体时,它们可以特异性地识别肿瘤细胞靶标,从而特异性杀伤靶细胞。并且,与基于单一抗体的car不能区分表达靶抗原的肿瘤和健康细胞相比,基因修饰后的γδt细胞不存在肿瘤脱靶(on-target/off-tumor)毒性的风险,其次,与受限于抗原非依赖性(强直)信号传导的car-t细胞相比,基因修饰后的γδt细胞具有更强的增殖能力,并不容易衰竭。
5.迄今为止,常用扩增方法如il-2,il-15,il-18等培养化合物成分扩增γδt细胞,该方法在14天内可使总γδt细胞增加100-1000倍;此后,扩增率降低,这与细胞死亡的增加相一致。因此,传统γδt扩增方案无法产生足够数量的细胞以符合商业上可行的同种异体产品。
技术实现要素:
6.本发明的目的是基于现有技术的现状,提供大量、快速的扩增人外周血来源的γδt细胞的方法。
7.本发明的另一个目的是制备具有靶向杀伤肿瘤细胞作用的γδt细胞。
8.本发明的再一个目的是提供上述γδt细胞的应用。
9.一方面,本发明提供了分离和扩增γδt细胞的方法,包括从人受试者的血液样本中分离γδt细胞,在存在唑来膦酸和细胞因子组合物的情况下扩增分离得到的γδt细胞,可扩增倍数达到1500倍。
10.本发明提供了一种体外扩增γδt细胞的方法,所述的方法包括:
11.获取或者分离γδt细胞;和/或
12.在含有唑来膦酸、人重组白细胞介素2和人重组白细胞介素7的培养介质中扩增所述的γδt细胞。
13.较好的,所述γδt细胞使用磁珠分离。
14.较好的,其中活扩增的培养介质(培养基)中存在唑来膦酸,浓度为0.5-2.0μm。
15.较好的,培养介质(培养基)中还白介素,其中存在的il-2的浓度为5ng/ml至10ng/ml。较好的,还可以包括il-7,il-7浓度为0.5-5ng/ml。
16.较好的,当细胞密度达到0.5-2.0x106个/ml时,1:1-1:4传代。本发明的研究表明,虽然控制细胞密度通常采用2-3天换液,或者根据培养基中指示剂的颜色判断是否更换培养基,但是测试结果表明,通常的方法可以保持细胞增长,但是完全达不到本发明的γδt细胞的扩增(培养)方法的扩增倍数。
17.另一方面,本技术涉及增强γδt细胞中病毒转导效率的方法,包括用重组病毒载体转导扩增后的γδt细胞。较好的,病毒载体是慢病毒载体。所述的方法还包括:
18.(1)使用嵌合型抗原受体的表达载体转染293t细胞获得慢病毒载体;
19.(2)使用步骤(1)获得的慢病毒载体转导γδt淋巴细胞;
20.所述的嵌合型抗原受体包括:靶向特定适应症抗原的单链抗体scfv、igg4铰链区、cd8跨膜区、4-1bb;
21.所述的scfv、igg4铰链区、cd8跨膜区、4-1bb的氨基酸序列分别如序列表所示。
22.较好的,所述的步骤(2)包括:
23.在γδt细胞的培养环境中加入重组有上述的嵌合型抗原受体的表达载体的慢病毒;
24.慢病毒感染过夜(24小时后)换液。
25.本发明还提供了一种γδt细胞,所述的γδt细胞使用上述方法制备,该方法包括:
26.获取或者分离γδt细胞;和/或在含有唑来膦酸、人重组白细胞介素2和人重组白细胞介素7的培养介质中扩增所述的γδt细胞。
27.该方法还可以包括:
28.(1)使用嵌合型抗原受体的表达载体转染293t细胞获得慢病毒载体;
29.(2)使用步骤(1)获得的慢病毒载体转导γδt淋巴细胞;
30.所述的嵌合型抗原受体包括:靶向特定适应症抗原的单链抗体scfv、igg4铰链区、cd8跨膜区、4-1bb;
31.所述的scfv、igg4铰链区、cd8跨膜区、4-1bb的氨基酸序列和核酸编码序列分别如seq id no.1、3、5、7所示。
32.本发明的γδt细胞中,所述的γδt细胞使用上述的嵌合型抗原受体进行基因修饰。
33.再一方面,本发明提供了一种嵌合型抗原受体,该嵌合型抗原受体包括:
34.靶向hiv-1gp120的单链抗体scfv、igg4铰链区、cd8跨膜区、4-1bb,其序列参见seq id no.1-8。
35.其中,靶向hiv-1gp120的单链抗体scfv是能够识别艾滋病病毒hiv-1病毒gp120蛋白并与之结合的scfv。所述单链抗体scfv能够识别hiv病毒感染细胞表面的gp120,是通过串联针对hiv病毒感染细胞表面的gp120的抗体轻链、重链可变区而得。单链抗体scfv作为
整个car分子的胞外结合结构域,其氨基酸序列来源于3bnc117-ptrpe质粒。
36.所述的嵌合型抗原受体可以用于制备基因修饰的γδ淋巴细胞,靶向hiv-1gp120。
37.igg4铰链区即igg4 hinge,是链接3bnc117 scfv与cd8跨膜区的铰链分子,其序列可参见seq id no.3-4。
38.cd8跨膜区是链接嵌合抗原受体胞外区结构和胞内区结构的跨膜分子,其序列可参见seq id no.5-6。
39.4-1bb是一种胞内信号共刺激域,其序列可参见seq id no.7-8。
40.3bnc117-igg4 hinge-cd8跨膜区-4-1bb-cd3ζ氨基酸序列为:mlllvtslllcelphpafllipqvqllqsgaavtkpgasvrvsceasgynirdyfihwwrqapgqglqwvgwinpktgqpnnprqfqgrvsltrhaswdfdtfsfymdlkalrsddtavyfcarqrsdywdfdvwgsgtqvtvssastkgpggggsggggsggggsdiqmtqspsslsasvgdtvtitcqangylnwyqqrrgkapklliydgsklergvpsrfsgrrwgqeynltinnlqpediatyfcqvyefvvpgtrldlkrtvaapeskygppcppcpapeflggpsvflfppkpkdtlmisrtpevtcvvvdvsqedpevqfnwyvdgvevhnaktkpreeqfnstyrvvsvltvlhqdwlngkeykckvsnkglpssiektiskakgqprepqvytlppsqeemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvfscsvmhealhnhytqkslslslgkdiyiwaplagtcgvlllslvitlyckrgrkkllyifkqpfmrpvqttqeedgcscrfpeeeeggcelrvkfsrsadapaykqgqnqlynelnlgrreeydvldkrrgrdpemggkprrknpqeglynelqkdkmaeayseigmkgerrrgkghdglyqglstatkdtydalhmqalppr*(seq id no.1)
41.相应的核苷酸序列为:
42.atgctgctgctggtgacaagcctgctgctgtgcgagctgccccaccctgcctttctgctgatcccccaggtgcagctgctgcagagcggagccgccgtgacaaagcctggcgcttctgtgcgggtgtcctgcgaggccagcggctacaacatccgggactacttcatccactggtggcggcaggccccaggccagggactgcagtgggtgggatggatcaaccccaagaccggccagcccaacaacccccggcagttccagggccgggtgtccctgacaagacacgccagctgggacttcgacaccttcagcttctacatggacctgaaggccctgcggagcgacgataccgccgtgtacttctgcgccagacagcggagcgactactgggatttcgacgtgtggggcagcggcacccaggtcacagtgtccagcgccagcacaaagggacctggcggcggaggatctggcggaggcggaagtggcggagggggcagcgatattcagatgacccagagccccagcagcctgagcgccagcgtgggcgacaccgtgaccatcacctgtcaggccaacggatacctgaactggtatcagcagcggagaggcaaggcccccaagctgctgatctacgacggcagcaagctggaacggggcgtgcccagccggttcagcggcagaagatggggccaagagtacaacctgaccatcaacaacctgcagcccgaggatattgccacatacttttgccaggtgtacgagttcgtggtgcccgggacccggctggatctgaagagaaccgtggccgctcccgagagcaaatacgggcccccctgccccccttgccctgcccccgagttcctgggcggacccagcgtgttcctgttcccccccaagcccaaggacaccctgatgatcagccggacccccgaggtgacctgtgtggtggtggacgtgtcccaggaggaccccgaggtccagttcaactggtacgtggacggcgtggaggtgcacaacgccaagaccaagccccgggaggagcagttcaatagcacctaccgggtggtgtccgtgctgaccgtgctgcaccaggactggctgaacggcaaggaatacaagtgtaaggtgtccaacaagggcctgcccagcagcatcgagaaaaccatcagcaaggccaagggccagcctcgggagccccaggtgtacaccctgccccctagccaagaggagatgaccaagaaccaggtgtccctgacctgcctggtgaagggcttctaccccagcgacatcgccgtggagtgggagagcaacggccagcccgagaacaactacaagaccaccccccctgtgctggacagcgacggcagcttcttcctgtacagccggctgaccgtggacaagagccggtggcaggagggcaacgtctttagctgctccgtgatgcacgaggccctgcacaaccactacacccagaagagcctgagcctgtccctgggcaaggatatctacatctgggcgcccttggccgggacttgtggggtccttctcctgtcactggttatcaccctttactgcaaacggggcagaa
25ng/ml和2ng/ml il-7,进一步扩增细胞直到满足回输的细胞数。
55.本发明进行了体外增殖及活性实验,结果显示,经所述方法分离扩增的γδt细胞具有更高的纯度以及更强的增殖能力。
56.本发明在构建的hiv-1体外细胞模型中发现,3b-γδt细胞显示出较好的增殖能力,细胞杀伤能力和细胞因子释放能力。
57.所述的肿瘤细胞源自肺癌、乳腺癌、胰腺癌、肝癌、胃癌、直结肠癌、白血病或者卵巢癌。
58.本发明提供一种新型的异体抗hivγδt细胞,使得hiv-1感染细胞可以被高效、持久、特异地清除,为长期控制病人体内hiv-1病毒载量的异体化治疗奠定了基础。
59.本发明还提供了上述基因修饰的γδt淋巴细胞在制备异体抗hiv感染的活细胞药物中的应用。
60.本发明将hiv car-t疗法与γδt进行了结合使用,提供了一种hiv car-γδt疗法可选的方法,为hiv-1功能性治愈探索提供了一种可行的思路。
61.本发明经过筛选、比较和优化,获得了能够快速大量扩增制备γδt细胞的方法,在14天内扩增倍数达到1500倍甚至更多。体外增殖及活性实验表明,本发明的方法分离扩增的γδt细胞具有更高的纯度以及更强的增殖能力。在此基础上,在构建的hiv-1体外细胞模型中发现,3b-γδt细胞显示出较好的增殖能力,对肿瘤细胞杀伤能力和细胞因子释放能力;本发明构建的基因修饰γδt细胞具有较强的杀伤肿瘤细胞的作用,有助于对hiv-1功能性治愈。
附图说明
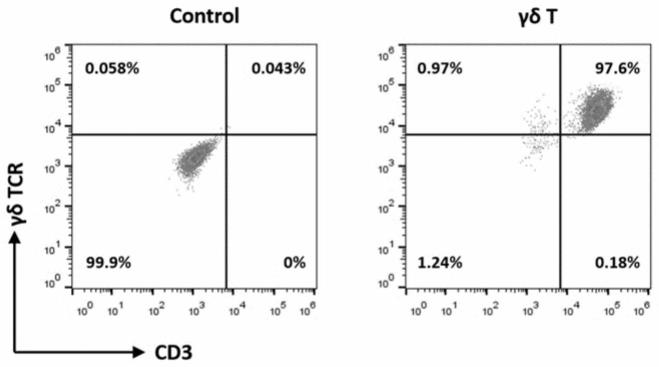
62.图1.γδt细胞分离后纯度图,
63.其中,横坐标代表cd3表达情况,纵坐标代表γδtcr表达情况。
64.图2.γδt细胞增殖情况检测结果,
65.其中,横坐标代表分离后扩增的时间,纵坐标代表γδt细胞的细胞数量,可见本发明所述方法扩增,γδt细胞可以明显扩增。
66.图3. 3b car重组载体示意图。
67.图4. 3b car-γδt细胞表型检测结果,
68.其中,utd是未经任何处理的γδt细胞作为对照,
69.纵坐标fs-a是前项散色光,横坐标car表示利用fitc-goat anti-human igg流式抗体染色后,检测到car阳性率比例;
70.结果显示,制备的3b car-γδt细胞car分子表达效率约在90%。
71.图5. 3b car-γδt细胞靶向杀伤hiv-1细胞活性的检测结果,其中,
72.纵坐标是杀伤百分比specific lysis,单位%,指靶细胞被杀伤的比例,计算公式为
[0073][0074]
横坐标ratio是指效应细胞数量与靶细胞数量比例;
[0075]
结果显示,在不同共孵育比例下,3b car-γδt细胞对lel6细胞均具有杀伤作用。
[0076]
图6. 3b car-γδt细胞细胞因子释放能力的检测结果,其中,
[0077]
纵坐标是三种细胞因子的浓度,结果显示,在与lel6细胞共孵育后,3b car-γδt组tnf-α、il-2、ifn-γ细胞因子释放量明显变多。***p《0.001。
具体实施方式
[0078]
实施例1γδt细胞的分离
[0079]
取抗凝外周血样品,配平后,以20℃,800
×
g,离心20分钟;将上层血浆转移至新的无菌离心管中。使用无菌磷酸盐缓冲液(pbs)100ml重悬并稀释细胞沉淀,将细胞悬液分次缓慢地贴壁加入人淋巴细胞分离液上(细胞悬液与人淋巴细胞分离液体积比为1:1);以20℃,800
×
g,离心20分钟(升1,降0)。使用10ml移液管轻插至中间层薄云状单个核细胞层上方0.5cm处,将该层细胞沿试管壁吸出,转移中间层细胞至新的50ml无菌离心管中,使用30ml无菌pbs在20℃,800
×
g,离心20分钟(升9,降9),洗涤2次。弃去上清液,使用4ml x-vivo 15培养基重悬细胞沉淀,收获pbmc,4℃保存,备用。
[0080]
分选缓冲液的配置:在ph 7.2的无菌pbs中加入0.5%小牛血清和2mm edta,并置于冰浴中预冷。
[0081]
磁珠标记:细胞计数后确定细胞数量,以300
×
g离心细胞悬浮液10分钟。以80ul的缓冲液重悬细胞颗粒每107个细胞。再往每107个细胞中加入20ul生物素标记的抗体混合物,混合均匀,冷藏10分钟(4-8℃)。每107个细胞加入1-2ml缓冲液洗涤细胞,300
×
g离心10分钟。然后107个细胞中加入80ul缓冲液,20ul抗生物素磁珠。混合均匀,冷藏15分钟(4-8℃)。每107细胞加入1-2ml缓冲液清洗细胞,300
×
g离心10分钟。用500ul缓冲液重悬细胞来进行磁选。
[0082]
磁性分离:根据细胞总数和tcrγ/δ+细胞的数量,选择合适的分选柱及相应分选器,将分选柱置于相应macs分选器的磁场中,用适量的缓冲液冲洗柱子准备。
[0083]
将重悬后的细胞悬液加入分选柱中,待液体流尽,再加入适量缓冲液洗脱分选柱3次。取下分选柱,脱离磁场,快速将分选柱上磁珠标记的γδt细胞收集至新的离心管中备用。
[0084]
实施例2γδt扩增
[0085]
使用配制好的γδt细胞培养液25ml,重悬经磁珠分选获取的γδt细胞,转移细胞悬液至75cm2培养瓶中,将培养瓶放置在饱和湿度、37℃、5.0%co2的培养箱内来培养。隔一天通过显微镜观察培养瓶内细胞生长情况。根据细胞生长状态,及时观察细胞密度,控制在0.5-2
×
106cells/ml,超出此密度范围时用γδt细胞培养液进行换液,并将细胞密度调整至该范围内。连续培养14-16天后,收获γδt细胞,整个细胞培养过程注意无菌操作。在细胞培养的0、3、7、14、16天分别取细胞培养上清液,按照上述方法在镜下计数、测定细胞存活率;并通过流式细胞仪检测培养后γδt细胞的比例,计算γδt细胞总数和扩增倍数、绘制生长曲线。
[0086]
γδt细胞培养基成分:x-vivo 15无血清培养基、10%血清、5ng/ml il-2、2ng/ml il-7、1.0μm唑来膦酸。
[0087]
实施例3体外构建靶向hiv-1 gp120的嵌合抗原受体表达载体
[0088]
以pcdh-cmv-mcs-ef1α-puro质粒为骨架,利用ecori和sali内切酶双酶切去除
mcs-ef1α-puro片段。随后以ptrpe-3bnc117-g4h-bbz质粒为模板,利用onestep-3bnc117-f,onestep-3bnc117-r引物pcr扩增出包含有hiv广泛中和性抗体可变区来源的scfv,igg4铰链,cd8分子跨膜区,4-1bb的3bnc117 car片段。最终将双酶切产物与pcr产物胶回收后进行onestep同源重组连接,连接产物在dh5α感受态中转化后涂在amp+的平板上筛选阳性克隆,阳性克隆扩大培养后抽提质粒并测序验证,得到阳性质粒pcdh-cmv-3bnc117 scfv-igg4-cd8tm-4-1bb并命名为3bnc117 car(缩写为3b car)。
[0089]
实施例4γδt细胞纯度及增殖能力检测
[0090]
收集培养6、8、11、14天的细胞用流式细胞仪检测并分析结果,同时以培养前的pbmc对照管。收集1
×
106个细胞/管于离心管中,配平后置于低温高速离心机中,在4℃下800rpm离心5min,弃去上清液,用500ul-1ml pbs重悬,800rpm离心5min,弃去上清液,然后用100ul pbs重悬细胞,向每管中各加入1ul抗γδtcr-fitc和cd3-pe,进免疫荧光双染色,在4℃下避光孵育30分钟后,加入pbs 1ml,轻轻吹打混匀后,4℃,3000rpm离心5分钟,洗涤3次。弃去上清液,再加入500μl pbs重悬细胞沉淀,然后使用流式细胞仪(fluorescence activating cell sorter,facs)检测γδt细胞的比例。
[0091]
根据细胞生长状态,每1-3天分别用γδt细胞培养液换液一次,并进行细胞计数。连续培养14-16天后,收获γδt细胞,整个细胞培养过程注意无菌操作。在细胞培养的0、3、7、14、16天分别取各组细胞培养上清液,按照上述方法进行台盼蓝染色并在镜下计数、测定细胞存活率;并通过流式细胞仪检测培养后γδt细胞的比例,计算γδt细胞总数和扩增倍数、绘制生长曲线。扩增倍数=(扩增后细胞总数
×
扩增后γδt细胞比例)/(扩增前细胞总数
×
扩增前γδt细胞比例)。
[0092]
结果显示,使用本实施例的方法在14天内,γδt细胞的扩增倍数达到1500倍,而使用目前常用的较好方法,例如在存在人重组白细胞介素2(il-2)和人重组白细胞介素15(il-15)的情况下扩增γδt细胞或选自il-21、基质细胞来源的因子(sdf)、il-1β、il-12、il-18和il-33组成的组的因子的情况时扩增倍数通常在100倍以上,不足1000倍。
[0093]
实施例5 3b car-γδt细胞的制备
[0094]
为了获得表达3b car的慢病毒颗粒,本发明将慢病毒骨架质粒,
△
8.91,vsvg三种质粒共转染进293t细胞,48h后收集病毒上清并过滤,超速离心浓缩后置于-80℃保存备用。
[0095]
利用携带有3b car元件的慢病毒感染健康人γδt淋巴细胞制备效应细胞。以moi=10静置感染的方式感染γδt细胞制备anti-hiv car-γδt效应细胞,并用未感染γδt细胞作为对照。
[0096]
6天后通过fluorescein(fitc)-conjugated affinipure f(ab')2fragment goat anti-human igg(h+l)标记,结果显示,与utd组相比3b car组car阳性率约为90%。
[0097]
实施例6 3b car-γδt细胞免疫功能检测
[0098]
本发明在体外初步验证了其对hiv-1 env
+
细胞模型lel6靶细胞的杀伤作用。我们分别将未修饰的γδt细胞,3b car-γδt细胞与lel6细胞进行了共孵育,并用jurkat细胞作为阴性对照,利用乳酸脱氢酶(lactate dehydrogenase,ldh)法检测了细胞杀伤效果。结果显示与utd组相比,在1:1,5:1,10:1三种不同的共孵育比例下,3b car组可以有效杀伤靶细胞,可以达到约90%的杀伤效果。而对于hiv-1 env-的jurkat细胞,效应细胞不会产生非特异性杀伤作用。specific lysis为杀伤百分比,计算公式为:
杀伤百分比越高,证实越多的靶细胞被杀灭。
[0099]
为了进一步检测anti-hiv car-γδt效应细胞的功能,将anti-hiv car-t效应细胞与lel6靶细胞按照10:1的比例进行了共孵育,并在24h后检测了il-2,tnf-α,ifn-γ3种细胞因子的释放,结果显示,与lel6靶细胞进行共孵育后,3b car组3种细胞因子的分泌量相比于utd组均有明显提升。
[0100]
以上所述,仅为本技术的具体实施方式,但本技术的保护范围并不局限于此,任何熟悉本领域技术的技术人员在本技术公开的技术范围内,可轻易想到的变化或替换,都应涵盖在本技术的保护范围之内。因此,本技术的保护范围应以所述权利要求的保护范围为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1