一种罗非鱼副产物抗菌肽及其筛选方法和应用与流程
1.本发明涉及抗菌肽制备领域,特别是涉及一种罗非鱼副产物抗菌肽及其筛选方法和应用。
背景技术:
2.罗非鱼(oreochromis niloticus)绝大多数生活在淡水域,也可在海水中生存。罗非鱼肉质爽口、肌间刺较少且富含蛋白质,同时由于其具有易于繁殖、独特的抗病性、快速生长和高适销性等优势已成为世界第二大常见养殖淡水鱼类。2016年产量超过540万吨,亚洲占有72%的产量(特别是在中国),非洲占有19%的产量,北美和南美占有9%的产量。尽管罗非鱼水产养殖发展迅速,但它也面临着链球菌(streptococcus spp.)、弧菌(vibrio spp.)和嗜水气单胞菌(aeromonas hydrophila)等引起的细菌感染挑战。目前,直接杀死或抑制病原细菌的抗生素仍然是控制细菌感染的主要药物,但在高生存压力下,细菌更可能发生突变以应对杀菌剂或抑菌剂,这可能导致抗生素效力下降和药物失效现象。滥用抗生素和出现耐药菌株的严峻形势迫切需要开发可用于代替抗生素的生态友好型新治疗剂,为预防罗非鱼细菌感染铺平道路。
3.罗非鱼加工导致约60%~70%的副产品,包括肌肉残留物、头部、内脏、皮肤、骨骼和鳞屑。副产物是用于水产饲料的有前景的原料,尤其是副产物水解产物。这些副产品废弃资源蛋白质含量丰富,通常加工成动物饲料,鱼类膳食和肥料等市值低的产品。目前用于回收营养和生理学重要肽的生物技术是鱼蛋白的酶促水解。酶水解物大多是含有2~20个氨基酸的小肽段,从而使水解产物成为人体各种生理功能的最可用的氨基酸来源。这些水解产物易于使用,具有良好的功能特性(抗菌、抗氧化或抗高血压等),是人类和动物皆可获得的蛋白质来源,通过将这些材料转化为鱼蛋白水解产物,可以正确利用富含蛋白质的鱼类加工废物和未充分利用的鱼类。
4.抗菌肽具有生态友好性、低残留风险、热稳定好、抗菌谱广以及不易产生耐药性等优势,可以提高养殖鱼类的抗病性或保持食品不受微生物污染,并可作为理想的抗生素药物替代品,在饲料、食品以及医药等行业具有广阔的应用前景。
5.因此采用罗非鱼副产物作为蛋白质丰富的原料,通过蛋白酶水解制备抗菌肽,针对提高罗非鱼副产物的利用率和附加值、为抗生素替代产品的研究提供新的参考。该专利技术可实现废弃资源利用和抗菌两方面作用,具有较大的经济价值。
技术实现要素:
6.本发明的目的是提供一种罗非鱼抗菌肽组合物及其筛选方法和应用,以解决上述现有技术存在的问题。
7.为实现上述目的,本发明提供了如下方案:
8.本发明提供了一种罗非鱼副产物抗菌肽组合物,述的罗非鱼副产物抗菌肽组合物包括氨基酸序列如seq od no.1
‑
seq id no.13所示的一个或多个多肽。
9.本发明还提供所述的罗非鱼副产物抗菌肽组合物的筛选方法,包括以下步骤:
10.1)利用酶解液将罗非鱼副产物进行酶解得到粗抗菌肽;
11.2)制得的粗抗菌肽进行分离纯化,并对纯化后的组分进行抑菌实验;
12.3)选择抑菌效果最佳的肽组分。
13.优选的,步骤1)中酶解液为酸性蛋白酶酶解液。
14.优选的,步骤1)中酶解的条件为:温度30℃~50℃,ph1.5~3.5,加酶量为罗非鱼副产物质量的0.5%~0.9%,酶解2h~6h后,取酶解液,离心抽滤后冷冻干燥得粗肽冻干粉。
15.优选的,步骤2)中分离纯化的方法为反相
‑
高效液相色谱分析和半制备液相色谱。
16.优选的,所述的反相
‑
高效液相色谱分析洗脱程序如下:0~10min,1%b;10~20min,80%b;20~30min,50%b;30~40min,30%b;40~50min,10%b;50~53min,1%b;所述的半制备液相色谱洗脱程序如下:0~6min,1%流动相b;6~12min,80%流动相b;12~18min,50%流动相b;18~24min,30%流动相b;24~30min,10%流动相b;30~33min,1%流动相b。
17.优选的,步骤2)中,采用牛津杯打孔法对纯化后的组分进行抑菌实验;采用二倍稀释法测定纯化后抗菌肽组分对各种致病菌的最小抑菌浓度和最小杀菌浓度。
18.优选的,步骤(2)中抑菌实验选择菌种为金黄色葡萄球菌、巨大芽孢杆菌、无乳链球菌、大肠杆菌及副溶血性弧菌中的一种或多种。
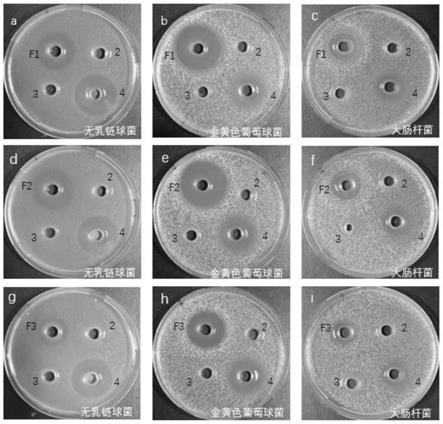
19.本发明还提供所述的罗非鱼副产物抗菌肽在抗菌中的应用。
20.本发明公开了以下技术效果:
21.(1)本发明采用的原料罗非鱼资源丰富、易于获得、蛋白质等营养物质含量高,且减少了资源浪费与环境污染。
22.(2)通过酸性蛋白酶酶解罗非鱼副产物,得到了能生产出抗菌肽的最优酶解条件,并且筛选出了能够被抑制的新型目标菌无乳链球菌。
23.(3)经分离纯化筛选出对水产品中常见致病菌有抑制作用的新型抗菌肽。
24.(4)通过lc
‑
ms/ms分析技术完成对抗菌肽氨基酸序列和肽结构的初探,鉴定得到13个肽段序列,并且其均为小分子多肽。
附图说明
25.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
26.图1(a)为罗非鱼副产物多肽rp
‑
hplc色谱图;(b)为罗非鱼副产物多肽的半制备
‑
rplc色谱图;
27.图2为罗非鱼副产物抗菌肽对革兰式阳性菌和阴性菌的抑菌效果。
具体实施方式
28.现详细说明本发明的多种示例性实施方式,该详细说明不应认为是对本发明的限
制,而应理解为是对本发明的某些方面、特性和实施方案的更详细的描述。
29.应理解本发明中所述的术语仅仅是为描述特别的实施方式,并非用于限制本发明。另外,对于本发明中的数值范围,应理解为还具体公开了该范围的上限和下限之间的每个中间值。在任何陈述值或陈述范围内的中间值以及任何其他陈述值或在所述范围内的中间值之间的每个较小的范围也包括在本发明内。这些较小范围的上限和下限可独立地包括或排除在范围内。
30.除非另有说明,否则本文使用的所有技术和科学术语具有本发明所述领域的常规技术人员通常理解的相同含义。虽然本发明仅描述了优选的方法和材料,但是在本发明的实施或测试中也可以使用与本文所述相似或等同的任何方法和材料。本说明书中提到的所有文献通过引用并入,用以公开和描述与所述文献相关的方法和/或材料。在与任何并入的文献冲突时,以本说明书的内容为准。
31.在不背离本发明的范围或精神的情况下,可对本发明说明书的具体实施方式做多种改进和变化,这对本领域技术人员而言是显而易见的。由本发明的说明书得到的其他实施方式对技术人员而言是显而易见得的。本申请说明书和实施例仅是示例性的。
32.关于本文中所使用的“包含”、“包括”、“具有”、“含有”等等,均为开放性的用语,即意指包含但不限于。
33.本发明所使用的材料、试剂等均可由商业途径获得。
34.实施例1
35.1、罗非鱼副产物最佳酶解条件的筛选和粗肽制备
36.对从市场上购买的罗非鱼,取罗非鱼副产物(鱼头、鱼骨、鱼皮和内脏等)绞碎,以料液比为1:1
‑
1∶5g/ml加入去离子水均质至混合物,调整ph为1.5
‑
3.5,选用酸性蛋白酶酶解罗非鱼副产物,酶解温度为30
‑
50℃,加酶量0.5
‑
0.9%,恒温水浴振荡2
‑
6h。再经15min沸水浴灭酶,冷却后于4℃、10000r/min离心20min,取上清液进行抽滤、冷冻干燥后即得罗非鱼副产物酶解粗肽粉末。以对无乳链球菌抑菌效果为指标,通过单因素实验(固定条件:时间5h、温度为40℃、ph为2.0、加酶量为0.6%、料液比1∶3g/ml,每次改变其中一个因素,其他因素不变进行酶解)及正交实验(以抑菌圈直径为响应值,选择对其影响较大的因素进行酶解条件的优化)获得最佳酶解工艺条件。最佳工艺条件为:罗非鱼副产物与去离子水料液比为1:5,ph为2.0,温度为40℃,时间5h,加酶量为0.7%。
37.2、罗非鱼副产物酶解粗肽分离纯化(反相
‑
高效液相色谱分析)
38.取制得的酶解粗肽粉末用超纯水配置2mg/ml肽溶液,经过0.22μm水相滤膜,使用zorbax sb c
‑
18(4.6
×
250mm,5μm)色谱柱在rp
‑
hplc上机分析,其中:上样量20μl,流动相a(超纯水),流动相b(甲醇),流速1ml/min,检测波长设置为268nm,洗脱程序如下:0~10min,1%b;10~20min,80%b;20~30min,50%b;30~40min,30%b;40~50min,10%b;50~53min,1%b,分析到响应值较高的3个组分,分别命名为a1、a2、a3,见图1(a)。
39.3、罗非鱼副产物酶解粗肽分离纯化(半制备液相色谱制备)
40.用超纯水将粗肽冻干粉配置成200mg/ml,过0.22μm滤膜后上机,使用zorbax sb c
‑
18(9.4
×
250mm,5μm)半制备色谱柱,上样量500μl,流动相a为超纯水,流动相b为甲醇,流速5ml/min,检测波长268nm,洗脱程序如下:0~6min,1%流动相b;6~12min,80%流动相b;12~18min,50%流动相b;18~24min,30%流动相b;24~30min,10%流动相b;30~33min;
1%流动相b。收集到响应值较高的3个峰,分别命名为f1、f2和f3,见图1(b)。旋转蒸发去除甲醇后冷冻干燥,多次制备至满足后续试验,于
‑
20℃下密封保藏。
41.4、纯化后罗非鱼副产物抗菌肽组分广谱抑菌活性测试
42.采用牛津杯打孔法测试f1~f3组分的广谱抑菌活性,取冻干肽粉末配置200μg/μl的肽溶液,添加无菌水作为空白对照,等ph的盐酸作为阴性对照,50μg/ml氯霉素溶液作为阳性对照,如图2所示。f1、f2和f3组分对革兰氏阳性菌和阴性菌都有较好的抑菌效果,其中f2对三种菌株的抑菌活性最强,其次是f1,最后是f3。并且f2组分对金黄色葡萄球菌有最大抑菌圈直径为33.39mm,抑菌效果达到极敏。三个组分对大肠杆菌的抑菌活性都相对较低,但其抑菌圈直径最低也大于15mm,显示为高敏的抑制效果。因此,罗非鱼副产物抗菌肽具有较好的广谱抑菌活性。
43.5、纯化后罗非鱼副产物抗菌肽f2组分的mic与mbc测试
44.采用二倍稀释法测定其对金黄色葡萄球菌、巨大芽孢杆菌、无乳链球菌、大肠杆菌及副溶血性弧菌的最小抑菌浓度和最小杀菌浓度。将mic所在列及其之前两列的培养液吸出,分别添加到各菌种固态培养基(金黄色葡萄球菌、大肠杆菌和巨大芽孢杆菌为lb培养基,无乳链球菌为bhi培养基和副溶血性弧菌为3%氯化钠蛋白胨大豆琼脂)的平板上,涂布均匀。随后将平板置于培养箱中,30℃培养24h。如表1所示,最佳抑菌f2组分对无乳链球菌的mic最低为3.13μg/μl,对金黄色葡萄球菌、巨大芽孢杆菌和副溶血性弧菌的mic为6.25μg/μl,对大肠杆菌的mic最高为12.5μg/μl。而对金黄色葡萄球菌和巨大芽孢杆菌的mbc为6.25μg/μl,低于无乳链球菌、大肠杆菌和副溶血性弧菌;
45.表1 抗菌肽f2组分对各细菌的mic与mbc测定
[0046][0047]
6、质谱检测(lc
‑
ms/ms)
[0048]
f2组分用样品溶解液(0.1%甲酸与2%乙腈)溶解,13200rpm,4℃离心20min,取上清,进行质谱鉴定。液相色谱柱信息如下:acclaim pepmap rslc c18(300um
×
5mm,5um,100a)(thermo,160454);acclaim pepmap c18(75um
×
150mm,3um,100a)(thermo,160321);流动相信息:流动相a为0.1%甲酸,流动相b为0.1%甲酸,80%乙腈,流速为300nl/min;分析时间:65min。梯度洗脱分离条件为:0~5min,保持b相5%不变;5~45min,b相体积分数由5%升高至50%;45~50min,b相由50%升高至90%;50~55min,保持b相90%不变;55~65min,b相由90%降至5%。液相分离后的肽段直接进入q exactive质谱仪进行在线检测,
具体质谱参数如表2和表3所示;
[0049]
表2 一级质谱参数
[0050][0051][0052]
表3 二级质谱参数
[0053][0054]
原始质谱文件通过mm file conversion软件转换处理后得到mgf格式文件,然后使用mascot检索uniprot数据库(mascot:http://www.matrixscience.com/)搜索质谱图,检索参数如表4所示;
[0055]
表4 检索参数
[0056][0057]
本实验检索比对数据库:oreochromis niloticus(nile tilapia)(tilapia nilotica):https://www.uniprot.org/taxonomy/8128
[0058]
如表5所示,在lc
‑
ms/ms分析和数据库检索的基础上,在f2组分中鉴定得到13个含有8
‑
33个氨基酸残基的肽段序列(seq id no.1
‑
seq id no.13),各肽段的分子质量均分布在484
‑
944da之间。
[0059]
表5 lc
‑
ms/ms鉴定的f2组分肽段的氨基酸序列
[0060][0061]
以上所述的实施例仅是对本发明的优选方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案做出的各种变形和改进,均应落入本发明权利要求书确定的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1